
-
-
Предмет:
Химия
-
Автор:
graysonpierce119
-
Создано:
3 года назад
Ответы
Знаешь ответ? Добавь его сюда!
-
-
Алгеьра 10 класс
-
Ребята помогите мне по математике
-
Задача на подобие треугольников. Помогите решить с нормальным объяснением
-
Информатика
11 минут назад
Помогите с информатикой пожалуйста
-
Математика
12 минут назад
Найти 3/6 от числа 72/17
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Вы не можете общаться в чате, вы забанены.
Чтобы общаться в чате подтвердите вашу почту
Отправить письмо повторно
Вопросы без ответа
-
Приведите примеры реакций ионного оьмена, при которых выделяются:
А) два осадка
Б) осадок и газ
В) осадок и вода
Помогите пожалуйстаааааа
-
Пожалуйста решите!!!
Отметьте каким образом в Спарте принимались решения и совершались выборы?????
Топ пользователей
-

Fedoseewa27
22808
-

Sofka
7419
-

zlatikaziatik
5659
-

vov4ik329
5111
-

DobriyChelovek
4625
-

olpopovich
3461
-
TheDenty
3258
-

dobriykaban
2540
-
Udachnick
1867
-

ViktoriaBell0
1740
Войти через Google
или
Запомнить меня
Забыли пароль?
У меня нет аккаунта, я хочу Зарегистрироваться
Выберите язык и регион
Русский
Россия
English
United States

How much to ban the user?
1 hour
1 day
Похожие вопросы:

Химия, 27.02.2019 04:30
.(Вычислить обьём углекислого газа ,которой можно полцучить при взаимодействии кислорода с 20 г. угля, содержащего10%примесей).
Ответов: 4

Химия, 27.02.2019 05:10
Закончите уравнения реакции, составьте схемы электронного и раставьте коэффициенты в уравнениях: р + о2 = li + n2 = zn + fe2(so4)3 =
Ответов: 3

Химия, 27.02.2019 06:50
Почему для получения оксида углерода ( iv) на мрамор действуют соляной кислотой, а не серной? ( )
Ответов: 4

Химия, 28.02.2019 14:10
№1. сколько орбиталей второго энергетического уровня атома не участвует в sp-гибридизации; в sp2-гибридизации; в sp3-гибрилизации? №2 чему равны углы между осями углеродного атома для: а) sp2-гибридных орбиталей б)sp-гибридныхорбиталей в) sp-гибридной и p-орбитали г)негибридых p-орбиталей д)sp3-гибридных орбиталей?
Ответов: 4
У тебя есть свой ответ?
Выпиши количество ошибок, допущенных при характеристике реакции: 2naoh+h2s=na2s+2h2o.&n…
Вопросы по другим предметам:

Математика, 31.03.2021 16:10

География, 31.03.2021 16:10

Окружающий мир, 31.03.2021 16:10

Математика, 31.03.2021 16:10

Биология, 31.03.2021 16:10

Информатика, 31.03.2021 16:10

Математика, 31.03.2021 16:11

Другие предметы, 31.03.2021 16:11

Биология, 31.03.2021 16:11

Алгебра, 31.03.2021 16:11

Математика, 31.03.2021 16:11

История, 31.03.2021 16:11

Русский язык, 31.03.2021 16:12


Обществознание, 31.03.2021 16:13

Математика, 31.03.2021 16:13

Русский язык, 31.03.2021 16:14

Математика, 31.03.2021 16:14

Математика, 31.03.2021 16:14

Обществознание, 31.03.2021 16:15
2NaOH + H2S → Na2S + 2H2O
⬇ Scroll down to see reaction info, how-to steps or balance another equation.
Word Equation
Sodium Hydroxide + Hydrogen Sulfide = Sodium Sulfide + Water
Two moles of aqueous
Sodium Hydroxide [NaOH]
and one mole of solid
Hydrogen Sulfide [H2S]
react to form one mole of aqueous
Sodium Sulfide [Na2S]
and two moles of liquid
Water [H2O]
Reaction Type
Double Displacement (Acid-Base)
- Exchange reaction
- List of Acids
- H2S
- List of Bases
- NaOH
Net Ionic Equation
2NaOH(aq) + H2S(s) = Na2S(aq) + 2H2O(l) might be an ionic equation. Calculate the net ionic equation for 2NaOH(aq) + H2S(s) = Na2S(aq) + 2H2O(l).
Redox (Oxidation-Reduction) Reaction
NaOH + H2S = Na2S + H2O might be a redox reaction.
Reaction Expressions
Kc or Q = ( [Na2S] [H2O]2 ) / ( [NaOH]2 [H2S] )
(assuming all reactants and products are aqueous. substitutue 1 for any solids/liquids, and Psubstance for gases.)
rate = -1/2 * (Δ[NaOH] / Δt) = -(Δ[H2S] / Δt) = (Δ[Na2S] / Δt) = 1/2 * (Δ[H2O] / Δt)
(assuming constant volume in a closed system and no accumulation of intermediates or side products)
Use the calculator below to balance chemical equations and determine the type of reaction (instructions).
Instructions
To balance a chemical equation, enter an equation of a chemical reaction and press the Balance button. The balanced equation will appear above.
- Use uppercase for the first character in the element and lowercase for the second character. Examples: Fe, Au, Co, Br, C, O, N, F.
- Ionic charges are not yet supported and will be ignored.
- Replace immutable groups in compounds to avoid ambiguity. For example, C6H5C2H5 + O2 = C6H5OH + CO2 + H2O will not be balanced, but XC2H5 + O2 = XOH + CO2 + H2O will.
- Compound states [like (s) (aq) or (g)] are not required.
- You can use parenthesis () or brackets [].
Examples
- Na2S + H2O + Cl2 = Na2O4S + HCl
- Na2S + H2O + Cl2 = Na2SO4 + HCl
- Na2S + H2O + HBrO4 = S + BrNa + NaOH
- Na2S + H2O + HBrO4 = S + NaBr + NaOH
- Na2S + H2O + Hg = HgS + NaOH + H20
- Na2S + H2O + I = Na2SO4 + HI
- Na2S + H2O + I2 = Na2SO4 + HI
- Na2S + H2O + NaBrO4 = S + NaBr + NaOH
- Ca(OH)2 + NaHCO3 + HCl = NaCl + CO2 + H2O + Ca(OH)2
- CaO + H3Po4 = Ca3(Po4)2 + H2O
- Mg(No3)2 + Na3Po4 = Mg3(Po4)2 + NaNo3
- C6H5ONa + HCl = C6H5OH + NaCl
- Recently Balanced Equations
How To Balance Equations
Read our article on how to balance chemical equations or ask for help in our chat.
You can also ask for help in our chat or forums.
Balance the equation NaOH + H2S = Na2S + H2O using the algebraic method.
-
Label Each Compound With a Variable
Label each compound (reactant or product) in the equation with a variable to represent the unknown coefficients.
aNaOH + bH2S = cNa2S + dH2O
-
Create a System of Equations
Create an equation for each element (Na, O, H, S) where each term represents the number of atoms of the element in each reactant or product.
Na: 1a + 0b = 2c + 0d O: 1a + 0b = 0c + 1d H: 1a + 2b = 0c + 2d S: 0a + 1b = 1c + 0d
-
Solve For All Variables
Use substitution, Gaussian elimination, or a calculator to solve for each variable.
- 1a — 2c = 0
- 1a — 1d = 0
- 1a + 2b — 2d = 0
- 1b — 1c = 0
Use your graphing calculator’s rref() function (or an online rref calculator) to convert the following matrix into reduced row-echelon-form:
[ 1 0 -2 0 0] [ 1 0 0 -1 0] [ 1 2 0 -2 0] [ 0 1 -1 0 0] [ 1 1 -1 -1 2]
The last column of the resulting matrix will contain solutions for each of the coefficients.
Simplify the result to get the lowest, whole integer values.
- a = 2 (NaOH)
- b = 1 (H2S)
- c = 1 (Na2S)
- d = 2 (H2O)
-
Substitute Coefficients and Verify Result
Count the number of atoms of each element on each side of the equation and verify that all elements and electrons (if there are charges/ions) are balanced.
2NaOH + H2S = Na2S + 2H2O
Reactants Products Na 2 2 ✔️ O 2 2 ✔️ H 4 4 ✔️ S 1 1 ✔️ Since there is an equal number of each element in the reactants and products of 2NaOH + H2S = Na2S + 2H2O, the equation is balanced.

Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Издательство: Просвещение
Тип: Учебник
§ 19. Сероводород. Сульфиды
Вопросы и задания
1. Составьте уравнения окислительно-восстановительных реакций полного и неполного сгорания сероводорода. Укажите окислитель и восстановитель.

2. Запишите уравнение химической реакции сероводорода с раствором нитрата свинца(II) в молекулярном, полном и сокращённом ионном виде. Отметьте признаки этой реакции.
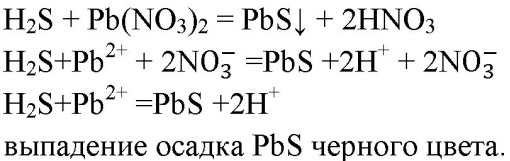
3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: CuS→H2S→SO2→SO3
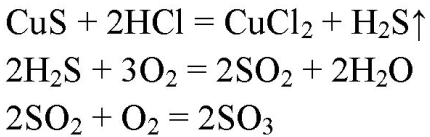
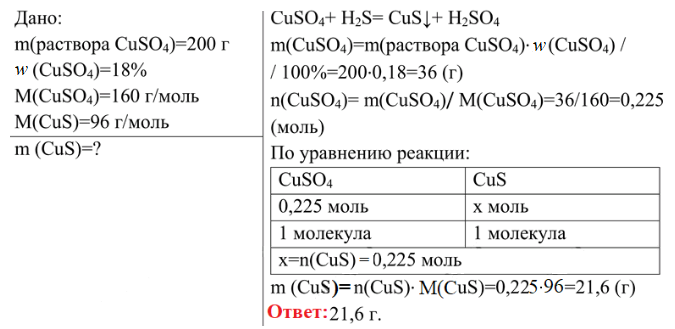
4. Сероводород пропустили через 200 г раствора сульфата меди(II) (массовая доля CuSO4 равна 18%). Вычислите массу осадка, выпавшего в результате этой реакции.
Тестовые задания
1. Летучие водородные соединения элементов VIA-группы имеют кристаллическую решётку
1) ионную
2) атомную
3) молекулярную
4) металлическую
3) молекулярную
2. Сероводород проявляет свойства восстановителя в химических реакциях
1) H2S + О2→S + H2O
2) H2S + NaOH→Na2S + Н2O
3) H2S + SO2→S + H2O
4) H2S + Pb(NO3)2→PbS + HNO3
5) H2S + O2→SO2 + H2O
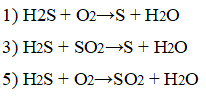
Выберите параграф
Сероводород
Строение молекулы и физические свойства
Сероводород H2S – это бинарное соединение водорода с серой, относится к летучим водородным соединениям. Следовательно, сероводород бесцветный ядовитый газ, с запахом тухлых яиц. Образуется при гниении. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы сероводорода похожа на структуру воды — уголковая молекула. Но валентный угол H-S-H меньше, чем угол H-O-H в воде и составляет 92,1о.

Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например, при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
S + H2 → H2S
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: хлорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
2CrCl3 + 3Na2S + 6H2O → 2Cr(OH)3 + 3H2S↑ + 6NaCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например, сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
2H2S + O2 → 2S + 2H2O
В избытке кислорода:
2H2S + 3O2 → 2SO2 + 2H2O
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Например, азотная кислота окисляет сероводород до молекулярной серы:
H2S + 2HNO3(конц.) → S + 2NO2 + 2H2O
При кипячении сера окисляется до серной кислоты:
H2S + 8HNO3(конц.) → H2SO4 + 8NO2 + 4H2O
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например, оксид серы (IV) окисляет сероводород:
2H2S + SO2 → 3S + 2H2O
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
3H2S + K2Cr2O7 + 4H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 7H2O
2H2S + 4Ag + O2 → 2Ag2S + 2H2O
Серная кислота окисляет сероводород либо до молекулярной серы:
H2S + H2SO4(конц.) → S + SO2 + 2H2O
Либо до оксида серы (IV):
H2S + 3H2SO4(конц.) → 4SO2 + 4H2O
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов: меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например, сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
H2S + Pb(NO3)2 → PbS + 2HNO3
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Содержание
При каких условиях H2S (сероводород) реагирует с NaOH (гидроксидом натрия)?
Для этого химического уравнения информации не найдено.
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта. Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции и образовываться H2O (вода) и Na2S (сульфид натрия)?
В полном предложении вы также можете сказать, что H2S (сероводород) реагирует с NaOH (гидроксидом натрия) и производит H2O (воду) и Na2S (сульфид натрия).
Явление после реакции H2S (сероводород) с NaOH (гидроксид натрия)
Это уравнение не содержит конкретной информации о явлении.
В этом случае вам просто нужно понаблюдать, чтобы убедиться, что вещество продукта
Na2S (сульфид натрия), появляющийся в конце реакции.
Или если любое из следующих реагирующих веществ
NaOH (гидроксид натрия), исчезающий
Какую еще важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнения
Дополнительные вопросы, связанные с химическими реакциями H2S + 2NaOH → 2H2O + Na2S
Вопросы, связанные с реагентом H2S (сероводород)
Каковы химические и физические характеристики H2S (сероводорода)?
В каких химических реакциях реагентом является H2S (сероводород)?
Вопросы, связанные с реагентом NaOH (гидроксид натрия)
Каковы химические и физические характеристики NaOH (гидроксида натрия)?
В каких химических реакциях используется NaOH (гидроксид натрия) в качестве реагента?
Вопросы, связанные с продуктом H2O (вода)
Каковы химические и физические характеристики H2O (гидроксида натрия)?
В каких химических реакциях образуется H2O (вода)?
Вопросы, связанные с продуктом Na2S (сульфид натрия)
Каковы химические и физические характеристики Na2S (гидроксид натрия)?
В каких химических реакциях образуется Na2S (сульфид натрия)?
Главная » Химия — 5 — 9 классы
вступили два сложных вещества, образовались два новых сложных вещества. Это реакция соединения.
Ответ: количество ошибок — .
Допишите:
эта реакция относится к реакциям .
Ответить!
Ответ №1
NaOH+H2S=NaS+H2O 2 помилки
Ответ №2
кількість помилок- 1! ця реакція відноситься до реакцій обміну!
Ответ дал: natalka2010
0
кількість помилок- 1! ця реакція відноситься до реакцій обміну!
Ответ дал: mlynarsolomija
0
NaOH+H2S=NaS+H2O 2 помилки
Ответ дал: natalka2010
0
S в цьому випадку 2 валентний,правильна формула Na2S

