Факторы, влияющие на результаты анализов
Влияние различных факторов на результаты лабораторных исследований
Лабораторные исследования зачастую служат более чувствительными показателями состояния человека, чем его самочувствие. Результаты анализов отражают физико-химические свойства исследуемой пробы и дают объективную диагностическую информацию в цифровом выражении. Важные решения о стратегии ведения пациента часто основаны на небольших изменениях лабораторных данных. Именно поэтому роль лабораторных тестов, а также спектр и количество проводимых исследований, необходимых в процессе диагностики и лечения заболеваний, постоянно возрастает. Однако из практики работы любой диагностической лаборатории известно, что получаемые ими результаты далеко не всегда являются правильными. Это связано с наличием большого количества непатологических факторов, способных оказывать влияние на конечные результаты лабораторных данных.
Как показывает наш опыт работы, основное количество получаемых неудовлетворительных результатов связано с ошибками, допущенными в ходе проведения анализа. Появление случайных и систематических ошибок на любой стадии анализа будет снижать достоверность лабораторных результатов и, как следствие, затруднит постановку правильного диагноза и проведение адекватного лечения.
ПРЕАНАЛИТИЧЕСКИЙ (ДОЛАБОРАТОРНЫЙ) ЭТАП включает в себя все стадии от назначения анализа клиницистом до поступления пробы в лабораторию на рабочее место, а именно: назначение анализа, взятие биологического материала, его обработку и доставку в лабораторию. Ошибки, возникающие на внелабораторном этапе анализа, составляют от 70% до 95% от общего их числа. Именно они могут оказаться непоправимыми и полностью обесценить весь ход проводимых исследований.
Поэтому правильная организация преаналитического этапа должна стать составной частью любой системы обеспечения качества лабораторного анализа.
При получении, обработке и доставке образцов в лабораторию следует иметь в виду следующие факторы, которые могут быть как устранимыми, так и неустранимыми. Результаты лабораторных исследований подвержены влиянию биологической и аналитической вариации. Если аналитическая вариация зависит от условий выполнения теста, то величина биологической вариации — от целого комплекса факторов. Общая биологическая вариация исследуемых показателей обусловлена внутрииндивидуальной вариацией, наблюдаемой у одного и того же человека в результате влияния биологических ритмов (разное время дня, года), и межиндивидуальной вариацией, вызванной как эндогенными, так и экзогенными факторами.
Факторы биологической вариации (физиологические факторы, факторы среды, условия взятия пробы, токсичные и терапевтические факторы) могут оказать влияние на результаты лабораторных исследований. Часть из них способна вызывать реальные отклонения лабораторных результатов от референтных значений вне связи с патологическим процессом. К таким факторам относят:
- Физиологические закономерности (влияние расы, пола, возраста, типа сложения, характера и объёма привычной активности, питания);
- Влияние окружающей среды (климат, геомагнитные факторы, время года и суток, состав воды и почвы в зоне обитания, социально-бытовая среда);
- Воздействие профессиональных и бытовых токсичных средств (алкоголь, никотин, наркотики) и ятрогенные влияния (диагностические и лечебные процедуры, лекарственные средства);
- Условия взятия пробы (приём пищи, физическая нагрузка, положение тела, стресс во время взятия пробы и др.);
- Методика взятия крови (способ взятия, средства и посуда, консерванты и т.д.);
- Неправильный (по времени) забор материала;
- Условия (температура, встряхивание, влияние света) и время транспортировки биоматериала на исследования в лабораторию.
Рассмотрим влияние наиболее важных факторов на результаты лабораторных анализов.
ПРИЕМ ПИЩИ
Режим питания, состав принимаемой пищи, перерывы в её приёме оказывают существенное влияние на ряд показателей лабораторных исследований. После приема пищи содержание отдельных продуктов обмена в крови может повышаться или подвергаться изменениям в результате постабсорбционных гормональных эффектов. Определение других аналитов может затрудняться вследствие мутности, вызванной хиломикронемией в послеобеденных пробах крови.
После 48 часов голодания может увеличиваться концентрация билирубина в крови. Голодание в течение 72 часов снижает концентрацию глюкозы в крови у здоровых людей до 2,5 ммоль/л, увеличивает концентрацию триглицеридов, свободных жирных кислот без значительных изменений концентрации холестерина. Длительное голодание (2 – 4 недели) также способно влиять на ряд лабораторных показателей. Концентрация общего белка, холестерина, триглицеридов, мочевины, липопротеинов в крови снижается; выведение креатинина и мочевой кислоты почками с мочой повышается. Длительное голодание тесно связано со снижением расхода энергии. Вследствие этого в крови снижается концентрация гормонов щитовидной железы – общего тироксина и еще в большей степени трийодтиронина. Голодание также приводит к увеличению содержания в пробах сыворотки крови кортизола и сульфата дегидроэпиандростерона.
Употребление жирной пищи может повысить концентрацию калия, триглицеридов и щелочной фосфатазы. Активность щелочной фосфатазы в таких случаях может особенно увеличиваться у людей с О- или В-группой крови.
Физиологические изменения после употребления жирной пище в виде гиперхиломикронемии могут увеличивать мутность сыворотки (плазмы) крови и тем самым влиять на результаты измерения оптической плотности. Повышение концентрации липидов в сыворотке крови может быть после употребления пациентом масла, крема или сыра, что приведёт к ложным результатам и потребует повторного анализа.
Определенные виды пищи и режимы питания могут влиять на ряд показателей сыворотки крови и мочи. Потребление большого количества мяса, то есть пищи с высоким содержанием белка, может увеличить концентрации мочевины и аммиака в сыворотке крови, количества уратов (солей кальция) в моче. Пища с высоким отношением ненасыщенных жирных кислот к насыщенным может вызвать снижение концентрации холестерина в сыворотке крови, а мясная пища вызывает увеличение концентрации уратов. Бананы, ананасы, томаты, авокадо богаты серотонином. При их употреблении за 3 дня до исследования мочи на 5-оксииндолуксусную кислоту даже у здорового человека её концентрация может быть повышенной. Напитки, богатые кофеином, увеличивают концентрацию свободных жирных кислот и вызывают выход катехоламинов из надпочечников и мозга (концентрация катехоламинов в сыворотке крови повышается). Кофеин способен повышать активность плазматического ренина. Приём алкоголя увеличивает в крови концентрацию лактата, мочевой кислоты и триглицеридов. Повышенное содержание общего холестерина, мочевой кислоты, гамма-глутамилтранспептидазы и увеличение среднего объема эритроцитов может быть связано с хроническим алкоголизмом.
Бессолевая диета может приводить к повышению уровня альдостерона в 3-5 раз. Концентрация билирубина после 48-часового голодания может повыситься в 2 раза, после еды – снижается на 20–25%; изменения уровня билирубина в течение суток могут достигать 15–30%.
ФИЗИЧЕСКИЕ УПРАЖНЕНИЯ
Состояние физической активности обследуемого оказывает большое влияние на результаты.
Физическая нагрузка может оказывать как преходящее, так и длительное влияние на различные параметры гомеостаза. Преходящие изменения включают в себя вначале снижение, а затем увеличение концентрации свободных жирных кислот в крови, повышение на 180% концентрации аммиака и на 300% — лактата, увеличение активности креатинкиназы, ACT, ЛДГ. Физические упражнения влияют на показатели гемостаза: активируют свертывание крови и функциональную активность тромбоцитов. Изменения указанных показателей связаны с активацией метаболизма и они обычно возвращаются к исходным (до физической нагрузки) значениям вскоре после прекращения физической деятельности. Тем не менее, активность некоторых ферментов (альдолаза, КК, ACT, ЛДГ) может оставаться повышенной в течение 24 ч после 1одночасовой интенсивной физической нагрузки. Длительная физическая нагрузка увеличивает концентрацию в крови половых гормонов, включая тестостерон, андростендион и лютеинизирующий гормон (ЛГ).
При длительном строгом постельном режиме и ограничении физической активности повышается экскреция с мочой норадреналина, кальция, хлора, фосфатов, аммиака, активность щелочной фосфатазы в сыворотке крови.
ЭМОЦИОНАЛЬНЫЙ СТРЕСС
Влияние психического стресса (страх перед взятием крови, перед операцией и т.д.) на результаты лабораторных тестов часто недооценивается. Между тем под его влиянием возможны преходящий лейкоцитоз; снижение концентрации железа; увеличение уровня катехоламинов, альдостерона, кортизола, пролактина, ангиотензина, ренина, соматотропного гормона, ТТГ и повышение концентрации альбумина, глюкозы, фибриногена, инсулина и холестерина. Сильное беспокойство, сопровождаемое гипервентиляцией, вызывает дисбаланс кислотно-основного состояния (КОС) с увеличением концентрации лактата и жирных кислот в крови.
ПОЛ ПАЦИЕНТА
Для целого ряда клинико-химических и гематологических показателей имеются статистически значимые различия между полами. В частности, это относится к уровням стероидных и гликопротеидных гормонов (прогестерон, эстрадиол, тестостерон, 17-ОН прогестерон, ЛГ, ФСГ, пролактин), транспортных белков (ССГ, ТСГ) и других биологически активных соединений (ТГ). В методической литературе имеется обширная информация по этому вопросу, кроме того, ее можно найти в большинстве инструкций по использованию диагностических наборов. Однако следует отметить, что приведенные в литературе референсные интервалы следует рассматривать лишь как ориентировочные. Это связано с наличием конструктивных особенностей наборов от различных фирм-производителей, а также с региональными и расовыми различиями в составе населения. Поэтому в каждой лаборатории рекомендуется установить собственные значения нормальных уровней исследуемых показателей с использованием тех видов наборов, которые регулярно применяются в рутинной практике.
ВОЗРАСТ ПАЦИЕНТА
Концентрация целого спектра аналитов зависит от возраста пациента и может значительно изменяться от момента рождения до старости. Наиболее ярко возрастные изменения выражены для некоторых биохимических показателей (гемоглобин, билирубин, активность щелочной фосфатазы, содержание липопротеинов низкой плотности и др.) а также для ряда аналитов, определяемых иммунохимическими методами. К ним относятся половые стероидные и гликопротеидные гормоны, тиреоиды, АКТГ, альдостерон, ренин, гормон роста (соматотропный), паратгормон, 17-оксипрогестерон, дегидроэпиандростерон, ПСА и др. Желательно, чтобы в каждой лаборатории имелись возрастные нормы для каждого из исследуемых показателей, что позволит более точно интерпретировать полученные результаты.
БЕРЕМЕННОСТЬ
Трактуя результаты лабораторных исследований у беременных, необходимо учитывать срок беременности в момент взятия пробы. При физиологической беременности средний объем плазмы возрастает примерно от 2600 до 3900 мл, причем в первые 10 недель прирост может быть незначительным, а затем происходит нарастающее увеличение объема к 35-й неделе, когда достигается указанный уровень. Объем мочи также может физиологически увеличиваться до 25% в 3-м триместре. В последнем триместре наблюдается 50% физиологическое повышение скорости клубочковой фильтрации.
Беременность является нормальным физиологическим процессом, который сопровождаются значительными изменениями в выработке стероидных, гликопротеидных и тиреоидных гормонов, транспортных белков (ССГ, ТСГ), АКТГ, ренина, а также в целом ряде биохимических и гематологических показателей. Поэтому для правильной интерпретации результатов важно точно указать срок беременности, когда была взята исследуемая проба крови.
При проведении скрининга врожденных пороков развития плода по лабораторным показателям следует иметь в виду, что диагностическая чувствительность и специфичность данного вида исследования в значительной степени будет определяться комбинацией выбранных иммунохимических маркеров. Она должна быть различной на разных стадиях развития плода. Например, для первого триместра беременности наиболее предпочтительным является определение АФП, свободной 6-субъединицы ХГЧ и ассоциированного с беременностью белка А (РАРРА), а для второго триместра — АФП, общего ХГЧ и свободного эстриола. Все указанные виды анализа должны проводиться в строго рекомендуемые сроки беременности, а каждая лаборатория, занимающаяся скрининговыми исследованиями, должна располагать собственной постоянно обновляемой и пополняемой базой медиан уровней исследуемых маркеров для каждой недели беременности.
МЕНСТРУАЛЬНЫЙ ЦИКЛ
Статистически значимые изменения концентрации могут быть вызваны колебаниями гормонального фона при менструации. Так, концентрация альдостерона в плазме определяется в два раза выше перед овуляцией, чем в фолликулярной фазе. Подобным образом ренин может проявить предовуляторное повышение.
Менструальный цикл является нормальным физиологическим процессом, который сопровождается значительными изменениями в выработке половых, тиреоидных гормонов, транспортных белков, АКТГ, ренина, а также в целом ряде биохимических и гематологических показателей. Для правильной интерпретации результатов важно точно указать день менструального цикла, когда была взята исследуемая проба крови.
БИОЛОГИЧЕСКИЕ РИТМЫ
Существуют линейные хронобиологические ритмы — например, возраст пациента, циклические ритмы — такие, как циркадные и сезонные, а также другие биологические циклы — например, менструальный цикл.
Циркадные ритмы аналита, т.е. изменения его концентрации в течение суток, наиболее ярко выражены у кортизола, АКТГ, альдостерона, пролактина, ренина, ТТГ, паратгормона, тестостерона и др. Отклонения концентраций от среднесуточных значений могут достигать 50%-400%, и этот фактор обязательно должен приниматься во внимание.
Суточные колебания содержания некоторых аналитов в сыворотке крови
|
Аналиты |
Максимальная концентрация (время суток) |
Минимальная концентрация (время суток) |
Амплитуда (% от средней за сутки) |
|
АКТГ |
6-10 |
0-4 |
150-200 |
|
Кортизол |
5-8 |
21-3 |
180-200 |
|
Тестостерон |
2-4 |
20-24 |
30-50 |
|
ТСГ |
20-2 |
7-13 |
5-15 |
|
Та |
8-12 |
23-3 |
10-20 |
|
ТТГ |
21-23 |
1-21 |
300-400 |
|
Пролактин |
5-7 |
10-12 |
80-100 |
|
Альдостерон |
2-4 |
12-14 |
60-80 |
|
Ренин |
0-6 |
10-12 |
120-140 |
|
Адреналин |
9-12 |
2-5 |
30-50 |
Например, циркадный ритм кортизола может являться причиной недостоверных результатов теста на толерантность к глюкозе, если он проводится во второй половине дня.
Для того чтобы не затруднять процесс интерпретации результатов, отбор проб для анализа нужно проводить строго в определенное время суток, обычно между 7:00 и 9:00 часами утра. Следует иметь в виду, что референсные интервалы большинства тестов, приведенных в справочной литературе, установлены именно для этого промежутка времени.
При проведении специальных исследований, например, при установлении индивидуального циркадного ритма секреции гормона, в течение суток берется несколько проб анализируемого материала. В документах, сопровождающих такие образцы, необходимо указать точное время взятия каждого из них.
На циркадный ритм могут накладываться индивидуальные ритмы сна, еды, физической активности, которые не следует путать с действительно суточными колебаниями. Для того, чтобы исключить индивидуальные ритмы при определении уровня аналитов, секретируемых порциями (ренин, вазопрессин, тестостерон, пролактин и др.), можно использовать смешанную пробу, полученную из трех образцов крови, взятых с интервалом в 2-3 часа. В некоторых случаях следует учитывать сезонные влияния. Например, содержание трийодтиронина на 20% ниже летом, чем зимой.
ПРИЕМ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Прием может отражаться на количественном содержании в организме целого ряда анализируемых показателей. Например, уровень ТТГ снижается при лечении допамином, концентрация общих и свободных фракций тиреоидных гормонов будет изменяться при введении фуросемида, даназола, амиодарона и салицилатов, а применение некоторых противоязвенных препаратов может повышать уровень пролактина у мужчин.
Присутствие лекарственных препаратов в биологическом материале – например, контрацептивов, салицилатов, андрогенов и др. — может специфическим (перекрестная реакция) или неспецифическим образом (интерференция) влиять на результаты лабораторных исследований при определении концентрации стероидных и тиреоидных гормонов, а также специфических связывающих белков крови. Прием аспиринсодержащих препаратов при определении длительности кровотечения по Дуке должен быть отменен за 7 – 10 дней до исследования. Если этого не сделать, можно получить патологический результат исследования. Поэтому проведение медикаментозной терапии, могущей искажать результаты анализа, следует назначать после взятия проб крови.
При проведении лекарственного мониторинга точное время взятия крови является очень важным параметром для правильной интерпретации результатов исследования.
Широкий спектр лекарственной интерференции в ходе лабораторных исследований рассмотрен во многих обзорах и книгах. Чтобы исключить возможность получения ложных результатов, обусловленных применением лекарственных препаратов, рекомендуется консультироваться с клиницистами, а также использовать соответствующие справочники.
При подготовке обследуемых к проведению биохимических исследований приняты следующие подходы: лекарства, мешающие определению компонентов, исключаются до взятия биоматериала, если они даются не по жизненным показаниям; утренний прием лекарств проводится только после взятия биоматериала; взятие крови с диагностической целью проводится перед инфузией лекарств и растворов. Загрязнение лабораторных проб инфузионными растворами является самой обычной и часто встречаемой формой преаналитической интерференции в больницах. Рекомендуется информировать лабораторию о том, когда и какое вливание было проведено пациенту, и когда была взята проба крови.
Пробу крови никогда не следует брать из сосуда, расположенного проксимально месту инфузии. Пробы следует брать из другой руки, из вены, в которую не проводится вливание.
Влияние ЛС на результаты лабораторных исследований может быть двух типов:
- Физиологическое влияние in vivo (в организме пациента) ЛС и их метаболитов;
- Влияние in vitro (на химическую реакцию, используемую для определения показатели) благодаря химическим и физическим свойствам ЛС (интерференция).
Физиологическое влияние ЛС и их метаболитов во многом известны практическим врачам. Рассмотрим значение интерференции, то есть вмешательства постороннего фактора в результаты анализа.
Интерференция может быть вызвана наличием в пробе биоматериала как эндогенного, так и экзогенного вещества. К основным эндогенным интерферирующим факторам относят следующие:
- Гемолиз, т.е. разрушение эритроцитов с выходом в жидкую часть крови ряда внутриклеточных компонентов (гемоглобин, ЛДГ, калия, магния и др.), что изменяет истинные результаты определения концентрации/активности таких компонентов крови, как билирубин, липаза, КК,ЛДГ, калий, магний и др;
- Липемия, извращающая результаты ряда колориметрических и нефелометрических методов исследования (особенно при исследовании фосфора, общего билирубина, мочевой кислоты, общего белка, электролитов);
- Парапротеинемия, вызывающая изменения результатов определения некоторыми методами фосфатов, мочевины, КК, ЛДГ, амилазы.
Наиболее частые экзогенные интерферирующие факторы — ЛС или их метаболиты. Так, при определении катехоламинов флуориметрическим методом в моче интенсивную флюоресценцию может вызывать принимаемый пациентом тетрациклин; метаболит пропранолола 4-гидррксипропранолол интерферирует при определении билирубина методами Йендрассика-Грофа и Эвелина-Меллоя.
Выявить интерференцию ЛС — одна из задач врача клинической лабораторной диагностики. Важный шаг для решения этой проблемы — контакт с клиницистом для выяснения характера принимаемых пациентом препаратов.
КУРЕНИЕ
У курильщиков может быть повышена концентрация карбоксигемоглобина, катехоламинов в плазме крови и кортизола в сыворотке крови. Изменения концентрации этих гормонов часто приводят к снижению количества эозинофилов, в то время как содержание нейтрофилов, моноцитов и свободных жирных кислот увеличивается. Курение приводит к увеличению концентрации гемоглобина, количества эритроцитов, среднего объёма эритроцита (MCV) и снижению количества лейкоцитов. Обнаружено повышение активности гаммаглутамилтрансферазы на 10% при потреблении 1 пачки сигарет в день; возможно удвоение активности по сравнению с референтными значениями при потреблении большего количества сигарет.
ДИАГНОСТИЧЕСКИЕ И ЛЕЧЕБНЫЕ МЕРОПРИЯТИЯ
На результаты лабораторных исследований могут оказывать влияние следующие диагностические и лечебные мероприятия:
- Оперативные вмешательства;
- Вливания и переливания;
- Пункции, инъекции, биопсии, пальпация, общий массаж;
- Эндоскопия;
- Диализ;
- Физическое напряжение (например, эргометрия, физические упражнения, ЭКГ);
- Функциональные тесты (например, пероральный тест на толерантность к глюкозе);
- Прием рентгеноконтрастных и лекарственных веществ;
- Ионизирующее излучение.
Например, уровень ПСА в течение нескольких дней может быть повышен после массажа простаты или катетеризации мочевого пузыря. Любые манипуляции с молочной железой или тепловые процедуры (например, сауна) приводят к значительному возрастанию уровня пролактина. Чтобы предотвратить такое влияние, взятие проб необходимо проводить до выполнения диагностических процедур, способных искажать результаты теста. Влагалищное кровотечение, произошедшее перед взятием пробы крови, может влиять на результат скрининга: кровотечение может увеличивать уровень АФП в крови матери. В этих условиях рекомендуется отложить анализ ~ на одну неделю после остановки кровотечения.
ПЕРИОДИЧНОСТЬ ВЗЯТИЯ ПРОБ
Повторные взятия проб крови широко используются в динамических исследованиях — при проведении стимуляционных тестов, для оценки эффективности проводимого лечения, при прогнозировании исхода заболевания, при лекарственном мониторинге, а также в целом ряде других случаев. Интервалы между взятием образцов, помимо конкретных задач исследования, должны определяться с учетом следующих факторов:
- Периода биологической полужизни определяемого аналита. Например, для оценки уровня ПСА в постоперационном периоде отбор крови для исследования должен проводиться не ранее, чем через 10-14 дней после хирургического вмешательства;
- Факмакокинетических свойств препаратов при проведении терапевтического лекарственного мониторинга. Например, забор крови для определения циклоспорина А должен производиться непосредственно перед приемом следующей его дозы, а для сердечных гликозидов — через 4 часа после введения препарата.
- Динамики изменения концентрации аналита в ходе нормальных или патологических процессов (мониторинг беременности, диагностика и мониторинг опухолевых и инфекционных заболеваний и др.). Обычно при этом индивидуальные колебания уровней исследуемых аналитов могут быть очень значительными (свободный эстриол, ХГЧ, АФП и др.). В этих случаях средние значения нормы или ее диапазоны не являются достаточно информативными для постановки диагноза. Вместо них используют значения медиан нормальных концентраций.
При мониторинге опухолевых заболеваний, а также для оценки эффективности проводимого лечения в качестве точки отсчета используются индивидуальные базовые уровни онкомаркеров до начала терапии. Последующие заборы крови проводятся через строго определенные клиницистами промежутки времени. Этот же принцип используется при диагностике и лечении инфекционных заболеваний — выявление специфических антител к возбудителю и динамика их уровней в ходе лечения.
При хранении образцов мочи при комнатной температуре может теряться до 40% глюкозы после 24-часового хранения.
ПОЛОЖЕНИЕ ТЕЛА ПАЦИЕНТА ПРИ ЗАБОРЕ КРОВИ
Положение тела пациента также влияет на ряд показателей. Переход из положения лёжа в положение сидя или стоя приводит к гидростатическому проникновению воды и фильтрующихся веществ из внутрисосудистого пространства в интерстициальное. Вещества, имеющие большую молекулярную массу (белки), и клетки крови со связанными с ними веществами не проходят в ткани, поэтому их концентрация в крови повышается (ферменты, общий белок, альбумин, железо, билирубин, ХС, ТГ, ЛС; связанные с белками, кальций). Могут увеличиваться концентрация гемоглобина, гематокрит, количество лейкоцитов. Отбор крови для определения ряда аналитов — таких, как альдостерон, эпинефрин, норэпинефрин, предсердный натрийуретический пептид, а также для оценки активности плазматического ренина — следует проводить в положении лежа и/или стоя при спокойном состоянии пациента. В направлении должна быть сделана специальная отметка о времени и условиях получения пробы.
МЕСТО И ТЕХНИКА ЗАБОРА КРОВИ
Место и техника забора крови также могут оказать существенное влияние на результаты лабораторных тестов (например, наложение жгута на период времени более 2 мин при заборе крови из вены может привести к гемоконцентрации и увеличению концентрации в крови белков, факторов коагуляции, содержания клеточных элементов). Лучшее место забора крови на анализы — локтевая вена. Следует также отметить, что венозная кровь — лучший материал не только для определения биохимических, гормональных, серологических, иммунологических показателей, но и для общеклинического исследования. Это обусловлено тем, что применяемые в настоящее время гематологические анализаторы, с помощью которых проводят общеклинические исследования крови (подсчёт клеток, определение гемоглобина, гематокрита и др.), предназначены для работы с венозной кровью, и в большинстве своём в странах, где их производят, они сертифицированы и стандартизированы для работы только с венозной кровью. Выпускаемые фирмами калибровочные и контрольные материалы также предназначены для калибровки гематологических анализаторов по венозной крови.
Помимо этого, при заборе крови из пальца возможен ряд методических особенностей, которые стандартизировать очень трудно (холодные, цианотичные, отёчные пальцы, необходимость в разведении исследуемой крови и др.), что приводит к значительным разбросам в получаемых результатах и как следствие — к необходимости повторных исследований для уточнения результата.
Для общеклинического исследования кровь из пальца рекомендуют забирать в следующих случаях:
- При ожогах, занимающих большую площадь поверхности тела пациента;
- При наличии у пациента очень мелких вен или их малой доступности;
- При выраженном ожирении пациента;
- При установленной склонности к венозному тромбозу;
- У новорождённых.
Пункцию артерии для забора крови используют редко (преимущественно для исследования газового состава артериальной крови).
ДРУГИЕ ФАКТОРЫ
Среди других факторов, влияющих на результаты исследований, имеют значение расовая принадлежность, географическое положение местности, высота над уровнем моря, температура окружающей среды.
Например; уровни АФП выше у женщин негроидной расы по сравнению с европеоидной расой. Активность ГГТ приблизительно в два раза выше у афро-американцев по сравнению с белым населением.
Как правильно подготовиться к исследованиям в клинико-диагностической лаборатории
АНАЛИЗ КРОВИ (КЛИНИЧЕСКИЙ, БИОХИМИЧЕСКИЙ, ИММУНОФЕРМЕНТНЫЙ)
- Исследование производится утром натощак – между последним приемом пищи и взятием крови должно пройти не менее 8 – 12 часов. Вечером предшествующего дня рекомендуется необильный ужин. Желательно за 1 – 2 дня до обследования исключить из рациона жирное, жареное и алкоголь. Если накануне состоялось застолье или было посещение бани или сауны – необходимо перенести лабораторное исследование на 1 – 2 дня;
- Накануне исследования лечь спать в обычное время и встать не позднее чем за 1 час до взятия крови;
- По возможности пробы следует брать между 7 и 9 часами утра;
- Период воздержания от приема алкоголя должен быть не менее 24 ч до сдачи анализа;
- За 1 час до взятия крови необходимо воздержаться от курения;
- Не следует сдавать кровь после рентгенологических исследований, физиотерапевтических и лечебных процедур, способных оказать влияние на результаты теста;
- Необходимо исключить факторы, влияющие на результаты исследований: физическое напряжение (бег, подъем по лестнице), эмоциональное возбуждение. Перед процедурой следует отдохнуть 10 – 15 минут и успокоиться. Для исключения влияния изменения положения тела обследуемый должен находиться в покое, сидеть или лежать не менее 5 мин. При динамическом наблюдении за пациентом взятие материала нужно проводить в идентичном положении тела;
- Необходимо помнить, что результат исследования может быть искажен действием принимаемых лекарственных препаратов. Поэтому перед сдачей анализа следует проконсультироваться у врача о возможности ограничения приема лекарственных препаратов для подготовки к исследованию. Рекомендуется отказаться от приема лекарственных препаратов перед сдачей крови на исследование, то есть забор крови производится до приема лекарственных препаратов;
- Учитывая суточные ритмы изменения показателей крови повторные исследования целесообразно проводить в одно и то же время;
- В разных лабораториях могут применяться разные методы исследования и единицы измерения. Чтобы оценка результатов обследования была корректной и была приемлемость результатов, желательно проводить исследования в одной и той же лаборатории, в одно и то же время.
ТЕСТ ТОЛЕРАНТНОСТИ К ГЛЮКОЗЕ (САХАРНАЯ КРИВАЯ)
Пероральный тест толерантности к глюкозе проводится, если клинические симптомы сахарного диабета отсутствуют, а содержание глюкозы в крови натощак ниже патологического уровня и находится в пределах физиологической нормы (предварительно необходимо провести исследование глюкозы в крови натощак).
Цель теста – определить эффективность работы инсулиновыделительного механизма поджелудочной железы и глюкозораспределительной системы организма. Необходимо подготовиться к этому тесту изменением диеты и приема лекарственных препаратов, по меньшей мере, за 3 дня до проведения теста. Очень важно точно следовать приведенной ниже инструкции, так как только в этом случае будут получены ценные результаты теста:
- Количество углеводов в пище должно быть не менее 125 граммов в день в течение 3 дней перед проведением теста;
- Нельзя ничего есть в течение 12 часов, предшествующих началу теста, но ни в коем случае голодание не должно быть более 16 часов;
- Не позволять себе физические нагрузки в течение 12 часов перед началом теста и во время проведения теста.
Методика проведения теста. Исследование производится дважды с интервалом в 2 часа. Утром, натощак, производится забор крови на глюкозу. Затем пациенту дают определенное количество глюкозы (в зависимости от массы тела), растворенной в теплой воде. Нагрузку следует принять медленно, не залпом, но не дольше, чем за 5 минут. За это время формируется адекватная физиологическая реакция на прием большого количества углеводов. После приема нагрузки производят повторный забор крови на глюкозу через 2 часа. Вместо глюкозы можно использовать пробный завтрак, содержащий не менее 120 граммов углеводов, 30 грамм из которых должны составлять легкоусвояемые (сахар, варенье, джем).
ОСОБЕННОСТИ ПОДГОТОВКИ К ОТДЕЛЬНЫМ ЛАБОРАТОРНЫМ ТЕСТАМ
Исследование холестерина и липидного спектра
Для определения холестерина и липидного спектра забор крови производится строго после 12 – 14 часового голодания. За 2 недели необходимо отменить препараты, понижающие уровень липидов в крови, если не ставиться цель определить гиполипидемический эффект терапии этими препаратами. Накануне взятия крови должен быть исключен прием алкоголя: присутствие алкоголя в крои является распространенной причиной выявления гипертриглицеридемии, даже у голодавших пациентов. Если исследование липидов проводится у больного, перенесшего инфаркт миокарда, то кровь следует брать либо в течение 24 часов после инфаркта, либо по истечении 3 месяцев, поскольку в период выздоровления метаболизм липидов нарушен.
Мочевая кислота
Необходимо в предшествующие исследованию дни соблюдать диету – отказаться от употребления богатой пуринами пищи: печени, почек, максимально ограничить в рационе мясо, рыбу, кофе, чай, алкоголь. Противопоказаны интенсивные физические нагрузки. Обязательна отмена таких лекарственных препаратов, как кофеин, теобромин, теофилин, салицилаты, аскорбиновая кислота, антибиотики, сульфаниламиды, производные тиазола.
Билирубин
Не рекомендуется накануне принимать аскорбиновую кислоту, лекарства или продукты, вызывающие искусственную окраску сыворотки.
Кортизол
Накануне исследования исключить прием таких препаратов как: глюкокортикоиды, эстрогены, пероральные контрацептивы. Также необходимо исключить прием алкоголя, физические упражнения, курение, стрессовые ситуации. Забор крови осуществляется не позднее 2-х часов после сна и до 10 часов утра.
Простатспецифический антиген (ПСА)
Забор крови должен быть произведен до пальпаторного исследования и массажа предстательной железы (ПЖ), лазерной терапии, рентгенографии, цистоскопии, колоноскопии. Эти лечебно – диагностические мероприятия могут вызвать более или менее выраженный и длительный подъем уровня ПСА в крови. Так как степень таких изменений непредсказуема, забор крови необходимо проводить или до или спустя неделю после проведенных манипуляций.
Диагностики инфекционных заболеваний (в том числе урогенитальные инфекции)
Забор крови для диагностики производится до начала приема антибактериальных и химиотерапевтических препаратов или не ранее чем через 10 – 14 дней после их отмены. При выполнении исследований на наличие инфекций следует учитывать, что в зависимости от периода инфицирования и состояния иммунной системы у любого пациента может быть ложноотрицательный результат. Но, тем не менее, отрицательный результат не исключает полностью наличие инфекции и в сомнительных случаях необходимо провести повторный анализ.
Иммунограмма
Анализ крови сдается строго натощак, после 12-часового голодания и обязательно до начала приема антибактериальных, противовоспалительных и гормональных препаратов или не ранее чем через 2 недели после их отмены. Если накануне исследования было повышение температуры, какое либо острое или обострение хронического заболевания, то лучше перенести срок сдачи анализа.
Аллергены
Для исключения ложноотрицательных результатов необходимо воздержаться от приема противоаллергенных препаратов за 3 – 5 дней до сдачи анализа крови.
Пролактин
Забор крови производится утром, не ранее, чем через 3 часа после пробуждения. Учитывая, что уровень пролактина может повышаться в результате физического или эмоционального стресса, после половых актов, после пребывания в сауне, приема алкоголя, необходимо перед исследованием исключить указанные факторы.
Исследование на тиреоидные гормоны
За 2 – 3 дня до проведения исследования исключается прием йодсодержащих препаратов, за 1 месяц – тиреоидных гормонов (чтобы получить истинные базальные уровни), если нет специальных указаний врача- эндокринолога. Однако, если целью исследования является контроль за дозой препаратов тиреоидных гормонов, забор крови производится на фоне приема обычной дозы.
Тиреоглобулин
Исследование целесообразно проводить спустя как минимум 6 недель после тиреоэктомии, либо проведенного лечения. Если назначены такие диагностические процедуры, как биопсия или сканирование ЩЖ, то исследование уровня ТГ в крови нужно строго проводить до процедур.
Соматотропный гормон
За 3 дня до взятия крови необходимо исключить спортивные тренировки, стрессовые ситуации. За 1 час до взятия крови — курение. Исследование проводится натощак (через 12 часов после последнего приема пищи). Пациент должен находиться в полном покое в течение 30 минут перед взятием крови. Не допускать стресса в процессе взятия крови.
ОБЩИЙ АНАЛИЗ МОЧИ
Для общего анализа мочи предпочтительно использовать «утреннюю» мочу, которая в течение ночи собирается в мочевом пузыре. Моча должна быть собрана после тщательного туалета наружных половых органов (несоблюдение этого правила может повлечь за собой выявление повышенного количества эритроцитов и лейкоцитов в моче, что затруднит постановку правильного диагноза) в сухую, чистую, хорошо отмытую от чистящих и дезинфицирующих средств посуду (для сбора мочи лучше использовать одноразовые пластиковые контейнеры). Для анализа можно собирать всю мочу, однако, в нее могут попасть элементы воспаления мочеиспускательного канала, наружных половых органов. Поэтому, как правило, первую порцию мочи не используют. Вторую, среднюю, порцию мочи собирают в чистую посуду, не касаясь склянкой тела. Посуда с мочой плотно закрывается крышкой. Моча, собранная для общего анализа, может храниться не более 1,5 – 2 часов (обязательно на холоду!). Длительное хранение мочи при комнатной температуре приводит к изменению физических свойств, разрушению клеток и размножению бактерий.
Накануне сдачи анализа следует исключить алкоголь, маринады, копчености, сахар, мед.
СБОР СУТОЧНОЙ МОЧИ ДЛЯ БИОХИМИЧЕСКОГО АНАЛИЗА
Суточная моча собирается в течение 24 часов на обычном питьевом режиме. Утром в 6 – 8 часов освобождается мочевой пузырь (эта порция мочи выливается), а затем в течение суток собирается вся моча в чистый широкогорлый сосуд с плотно закрывающейся крышкой, емкостью не менее 2 литров. При этом емкость с мочой необходимо сохранять в течение всего времени в прохладном месте (оптимально – в холодильнике на нижней полке – при 4 – 8 С), не допуская ее замерзания. Последняя порция берется точно в то же время, когда накануне был начат сбор (время начала и конца сбора отмечают). Если не вся моча доставляется в лабораторию, то количество суточной мочи измеряется мерным цилиндром, часть отливается в чистый сосуд, в котором ее доставляют в лабораторию, и обязательно указывается объем суточной мочи. Перед сдачей мочи на анализ нежелательно применение лекарственных веществ, так как некоторые из них (в частности, аскорбиновая кислота, входящая в состав комплексных витаминных препаратов) оказывают влияние на результаты биохимических исследований мочи.
Несоблюдение правил сбора, сроков и режима хранения проб, полученных для исследований, приводит к отрицательному результату!
Сдавайте анализы постоянно в одной и той же лаборатории – и вашему врачу будут примерно известны Ваши личные показатели нормы и любое отклонение от нормы будет сразу им замечено.

Благодарим за
обращение!
Спасибо, что помогаете нам стать лучше.
В ближайшее время наши менеджеры с Вами свяжутся.
Лабораторные исследования — более ранний и намного более чувствительный показатель состояния человека, чем его самочувствие. Результаты анализов отражают физико-химические свойства исследуемой пробы и дают объективную диагностическую информацию. Важные решения по тактике лечения врач зачастую принимает даже при небольших изменениях лабораторных показателей. Поэтому лабораторные исследования для диагностики и лечения заболеваний так важны. Однако результаты анализов далеко не всегда бывают правильными! Это связано с большим количеством факторов, способных оказать влияние на конечные результаты лабораторного тестирования.
Результаты лабораторных исследований подвержены влиянию биологической и аналитической вариации.
Биологическая вариация обусловлена внутрииндивидуальной вариацией, наблюдаемой у одного и того же человека, и межиндивидуальной вариацией, связанной с различиями между людьми.
К факторам, обуславливающим биологическую вариацию, относят:
-
Физиологические закономерности (влияние расы, пола, возраста, телосложения, характера физической активности и питания);
-
Влияние окружающей среды (климат, геомагнитные факторы, время года и суток, состав воздуха, воды и почвы в месте обитания, социально-бытовая среда);
-
Воздействие производственных и бытовых (алкоголь, никотин, наркотики) токсичных веществ, ятрогенных влияний (диагностические и лечебные процедуры, прием лекарственных средств);
-
Условия, предваряющие или сопровождающие взятие пробы (приём пищи и воды, физическая нагрузка, положение тела при взятии пробы, стрессорные и прочие факторы);
-
Время забора пробы, связанное с влиянием циркадных (суточных) ритмов и времени года;
-
Аналитическая вариация зависит от технологии анализа и используемого оборудования. Также к факторам, обуславливающим аналитическую вариацию, относят:
-
Методику взятия пробы (способ и погрешности процедуры, используемые средства, оборудование и консерванты);
-
Условия окружающей среды (температура, вибрации, тряска, интенсивность освещения) и продолжительность транспортировки биоматериала для исследования в лабораторию.
Недостоверные результаты могут быть вызваны ошибками, допущенными на разных этапах лабораторного исследования, затрудняя постановку диагноза и проведение адекватного лечения. Наиболее часто получение ошибочных результатов связано с внелабораторным (т.н. преаналитическим) этапом. Он включает в себя все стадии от назначения анализов врачом до поступления пробы в лабораторию. Именно с этим этапом связано 2/3 всех ошибочных результатов, которые могут обесценить проведенные исследования. Поэтому правильная организация преаналитического этапа – важнейший элемент обеспечения качества лабораторной диагностики.
Факторы, влияющие на правильность лабораторных исследований на преаналитическом этапе
Прием пищи
Режим питания, состав пищи, перерывы в её приёме оказывают существенное влияние на многие лабораторные показатели. После приема пищи содержание отдельных веществ в крови может повышаться или подвергаться изменениям в результате последующих гормональных эффектов. Наиболее значительно прием пищи повышает содержание в крови триглицеридов и глюкозы. Увеличивается также содержание лейкоцитов (т.н. постпрандиальный лейкоцитоз). Определение многих веществ может затрудняться мутностью, вызванной появлением в крови после приема пищи мельчайших жировых частиц (хиломикронов). Их концентрация достигает максимума через 2-2,5 часа после приема пищи, а, затем, постепенно снижается до незначительной в течение 8-10 часов. В это время целый ряд лабораторных исследований крови может быть невозможен. Голодание, тоже, может искажать результаты исследований. У здоровых людей после двух дней голодания увеличивается концентрация билирубина в крови, после еды его содержание в крови, наоборот, снижается. 3-х дневное голодание в 2-3 раза снижает концентрацию глюкозы в крови, увеличивает концентрацию триглицеридов. После 2-4-недельного голодания в крови снижается концентрация общего белка, холестерина, триглицеридов, мочевины и липопротеинов, повышается выведение почками креатинина и мочевой кислоты. На фоне длительного голодания организм переходит в режим экономии энергии, для чего снижает концентрацию в крови гормонов щитовидной железы – тироксина и трийодтиронина. Одновременно, голодание ведет к увеличению содержания в крови кортизола и дегидроэпиандростерона.
Некоторые продукты и режим питания могут влиять на результаты биохимического исследования крови и мочи. Употребление жирной пищи может повысить в крови концентрацию калия, триглицеридов и активность щелочной фосфатазы. Потребление большого количества мяса, то есть пищи с высоким содержанием белка, может увеличить концентрацию в крови мочевины, аммиака и солей кальция в моче. Пища с высоким содержанием ненасыщенных жирных кислот может вызвать снижение в крови концентрации холестерина. Бананы, ананасы, томаты, авокадо богаты серотонином. При их употреблении за 2-3 дня до исследования мочи на содержание 5-оксииндолуксусной кислоты даже у здорового человека её концентрация может стать повышенной. Диета с низким содержанием соли может приводить к повышению уровня альдостерона в 3-5 раз. Напитки, богатые кофеином, увеличивают концентрацию в крови свободных жирных кислот, стимулируют выброс надпочечниками катехоламинов и повышают активность ренина.
Прием алкоголя
Алкоголь снижает в крови концентрацию глюкозы, повышает концентрацию молочной кислоты, мочевой кислоты и триглицеридов. Прямое токсическое воздействие алкоголя на печень повышает активность в крови печеночных ферментов. Повышенное содержание в крови углевод-дефицитного трансферрина, холестерина, мочевой кислоты, активности гамма-глутамилтрансферазы (ГГТ) и увеличение среднего объема эритроцитов свидетельствует о хроническом алкоголизме.
Физическая нагрузка
Может оказывать как временное, так и продолжительное влияние. Преходящие изменения вначале проявляются снижением, а затем увеличением концентрации свободных жирных кислот в крови, двухкратным повышением концентрации аммиака и трехкратным — молочной кислоты. 1-2 часовые активные занятий в спортзале или 1-2 часовая игра в футбол приводит к временным изменениям активности креатинфосфокиназы (КФК), которые наблюдаются при обширных трансмуральных инфарктах. В меньшей степени повышается активность аспартатаминотрансферазы (АСТ) и лактатдегидрогеназы (ЛДГ). Эта ферментативная активность остается повышенной в течение суток. Физические упражнения влияют на показатели гемостаза: активируют свертывание крови и функциональную активность тромбоцитов. Длительная физическая нагрузка увеличивает концентрацию в крови половых гормонов, таких как тестостерон, андростендион и лютеинизирующий гормон (ЛГ).
При длительном постельном режиме, иммобилизации, малоподвижном образе жизни и ограничении физической активности повышается протромботический потенциал крови, возрастает риск спонтанного тромбообразования. Также, при длительной иммобилизации увеличивается выделение с мочой норадреналина, кальция, хлора, фосфатов, аммиака, в крови возрастает активность щелочной фосфатазы.
Курение
Никотин и другие содержащиеся в табачной продукции вещества (их более 2000) изменяют секрецию некоторых биологически активных веществ. Курение приводит к увеличению концентрации гемоглобина, количества и объёма эритроцитов, снижает количество лейкоцитов. У курильщиков повышается концентрация карбоксигемоглобина, катехоламинов и кортизола. Изменение концентрации этих гормонов приводит к снижению количества эозинофилов; содержание нейтрофилов, моноцитов и свободных жирных кислот увеличивается. Потребление большого количества сигарет сопровождается также повышением активности гамма-глутамилтрансферазы (ГГТ).
Эмоциональный стресс
Страх, испуг в момент взятия крови, боязнь операции, волнение перед визитом к врачу может влиять на результаты лабораторных исследований. Стрессорные воздействия сопровождаются временным лейкоцитозом; в крови снижается концентрация железа; увеличивается уровень катехоламинов, альдостерона, кортизола, инсулина, пролактина, ангиотензина, ренина, соматотропного гормона, тиреотропного гормона (ТТГ), повышается концентрация альбумина, глюкозы, холестерина, фибриногена. Сильное беспокойство, сопровождаемое глубоким и учащенным дыханием, вызывает дисбаланс кислотно-щелочного равновесия со снижением концентрации в крови молочной и жирных кислот.
Пол пациента
Практически для всех лабораторных показателей установлены достоверные половые различия. В большей степени это относится к содержанию в крови гормонов (прогестерона, эстрадиола, тестостерона, 17-ОН прогестерона, лютеинизирующего гормона, фолликулостимулирующего гормона, пролактина), транспортных белков и биологически активных соединений. В меньшей степени это относится к другим соединениям и форменным элементам крови, но и там различия могут быть существенны.
Возраст пациента
Содержание в крови большинства диагностически значимых веществ зависит от возраста и может значительно изменяться от рождения до старости. Наиболее ярко возрастные изменения проявляются в содержании гемоглобина, билирубина, активности щелочной фосфатазы, показателей липидного обмена, половых гормонов, адренокортикотропного гормона (АКТГ), альдостерона, ренина, гормон роста, паратгормона, дегидроэпиандростерона. С возрастом может меняться содержание маркеров онкологической настороженности, например простатаспецифического антигена (ПСА).
Расовая принадлежность
Для некоторых лабораторных показателей установлены различия нормальных значений между людьми отдельных рас. В сложных клинических ситуациях эти различия нужно учитывать при оценке результатов лабораторных исследований.
Индивидуальные уровни нормальных значений
Установленные нормальные (референтные) значения лабораторных показателей, дифференцированные в зависимости от пола, возраста и технологии анализа, характеризуют группу людей в целом. Однако, внутри любой возрастно-половой группы между отдельными здоровыми людьми наблюдаются также индивидуальные различия. Для некоторых лабораторных показателей эти различия между людьми одного пола и возраста могут быть многократными. С развитием лабораторных технологий, повышением точности исследований, накоплением медицинских знаний таким различиям придается все большее значение. Причина в том, что результаты исследований, присущие одному здоровому человеку, могут говорить о патологическом процессе в организме другого человека, особенно при рассмотрении их в динамике.
Беременность
Беременность является нормальным физиологическим процессом, который сопровождается перестройкой работы многих органов, значительными изменениями выработки половых и тиреоидных гормонов, транспортных белков, адренокортикотропного гормона (АКТГ), ренина, а также целого ряда биохимических и гематологических показателей. Для правильной интерпретации результатов нужно знать срок беременности, когда была взята исследуемая проба крови.
Менструальный цикл
Содержание женских половых гормонов изменяется в широком диапазоне в зависимости от фазы менструального цикла. Оценка результата таких исследований возможна только с привязкой к фазам цикла, для каждой из которых характерны свои диапазоны нормальных значений. Перед исследованием следует уточнить у врача оптимальные дни для взятия крови на анализ уровня фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), пролактина, прогестерона, эстрадиола, 17-ОН-прогестерона, андростендиона, ингибина и антимюллерова гормона (АМГ). Изменения гормонального фона могут также отражаться на результатах биохимических и гематологических лабораторных исследований. Для правильной интерпретации результатов важно точно указать день менструального цикла, когда была взята исследуемая проба крови.
Биологические ритмы
Все процессы в организме человека подвержены циклическим ритмам, таким, как циркадные и сезонные. Их влияние отражается на результатах лабораторных исследований. Циркадные (суточные) ритмы наиболее выражены для кортизола, адренокортикотропного гормона (АКТГ), альдостерона, пролактина, ренина, тиреотропного гормона (ТТГ), паратгормона и тестостерона. Отклонения их концентрации от среднесуточных значений могут достигать 400%, что обязательно должно приниматься во внимание. Например, циркадный ритм кортизола может быть причиной недостоверных результатов теста на толерантность к глюкозе, если он проводится во второй половине дня. Определяя индивидуальный циркадный ритм секреции гормона, когда в течение суток берется несколько проб анализируемого материала, в сопроводительных документах необходимо указывать точное время взятия каждой из них.
На циркадные ритмы, общие для всех людей, могут накладываться индивидуальные ритмы сна, еды и физической активности. В некоторых случаях следует учитывать сезонные влияния. Например, содержание гормона щитовидной железы трийодтиронина летом на 20% ниже, чем зимой. Содержание тестостерона, наоборот, несколько возрастает в теплое время года.
Прием лекарственных препаратов
Влияние лекарственных препаратов на результаты лабораторных тестов может быть двояким. Нужно различать действие препаратов:
а) Прием которых ожидаемо приводит к изменению результатов лабораторных исследований и действие которых контролируется по этим результатам. При проведении такого мониторинга точное время взятия крови является очень важным параметром для правильной интерпретации результатов.
б) Лабораторный контроль за действием которых не предусмотрен, но которые способны повлиять на правильность результатов лабораторных исследований. Эти препараты и их метаболиты могут привести к получению неправильных результатов лабораторных исследований, оказывая незапланированное влияние на физиологические процессы или негативно воздействовать на технологии лабораторного анализа. Например, уровень тиреотропного гормона (ТТГ) снижается при лечении допамином, концентрация тиреоидных гормонов тироксина и трийодтиронина изменяется при введении фуросемида, даназола, амиодарона и салицилатов, а применение некоторых антиантацидных препаратов может повышать уровень пролактина у мужчин. Присутствие в биологическом материале контрацептивов, салицилатов, андрогенов может специфически (перекрестные реакции) или не специфически (интерференция) влиять на результаты лабораторных исследований при определении стероидных и тиреоидных гормонов, а также связывающих белков крови. Это лишь краткая иллюстрация множества возможных воздействий. Проведение медикаментозной терапии, могущей искажать результаты анализа, следует обязательно учитывать при назначении лабораторных исследований.
По этим причинам лекарства, мешающие лабораторному анализу, если они назначены не по жизненным показаниям; принимают после взятия биоматериала. Это относится и к любым внутривенным инфузиям. Загрязнение лабораторных проб инфузионными растворами — обычная и часто встречающаяся причина получения неправильных результатов лабораторных исследований. Для исключения этого пробы следует брать из другой руки, из вены, в которую не проводится вливание. Рекомендуется информировать лабораторию о том, когда и какое вливание было проведено пациенту и когда была взята проба крови.
Диагностические и лечебные мероприятия
На результаты лабораторных исследований могут повлиять оперативные вмешательства, эндоскопия, диализ, внутривенные инфузии, пункции, инъекции, биопсии, пальпация, общий массаж, тепловые процедуры, эргометрия, функциональные тесты, введение рентгеноконтрастных веществ, лучевая и химиотерапия. Например, уровень простатаспецифического антигена (ПСА) может быть повышен в течение нескольких дней после массажа простаты, пальцевого исследования прямой кишки или катетеризации мочевого пузыря. Любые манипуляции с молочной железой или тепловые процедуры (например, сауна) приводят к увеличению уровня пролактина. Чтобы предотвратить такое влияние, пробы необходимо забирать до выполнения диагностических процедур, способных исказить результаты теста.
Прочие факторы
Среди прочих факторов, влияющих на результаты лабораторных исследований, имеют значение географическое положение местности, высота над уровнем моря и температура окружающей среды.
Положение тела при заборе крови
Положение тела пациента также влияет на ряд показателей. Переход из положения лёжа в положение сидя или стоя приводит к гидростатическому проникновению воды и фильтрующихся веществ из внутрисосудистого пространства в межклеточное (т.н. интерстициальное), составляющее 1/6 общего объема тела. Клетки крови, вещества, имеющие большую молекулярную массу и связанные с ними не могут проникнуть в ткани и остаются в сосудистом русле. Поэтому их концентрация в крови повышается, в среднем на 5-15%. С этим связана стандартизация положения пациента при взятии крови.
Способ и место забора крови
Участок тела пациента, используемый для взятия крови и техника забора также могут оказать существенное влияние на результаты лабораторных исследований. Лучшее место для забора крови на анализы — локтевая вена. Венозная кровь — лучший материал не только для определения биохимических, гормональных, серологических, иммунологических показателей, но и для общеклинического исследования. Это обусловлено тем, что применяемые в настоящее время гематологические анализаторы, с помощью которых проводят общеклинические исследования, предназначены для работы с венозной кровью. В странах, где их производят, они сертифицированы и стандартизированы для работы только с венозной кровью. Выпускаемые калибровочные и контрольные материалы также предназначены для работы гематологических анализаторов именно с венозной кровью. Помимо этого, при заборе крови из пальца есть методические особенности, которые стандартизировать очень трудно: попадание в образец значительных количеств тканевой (межклеточной) жидкости, нарушение периферического кровотока, необходимость в разведении образца и др., что приводит к ошибкам, низкой точности и воспроизводимости результатов.
Использование капиллярной крови для исследований свертывающей системы (системы гемостаза) не приемлемо в принципе. Это связано с неизбежным попаданием в образец значительных количеств тканевой (межклеточной) жидкости. Тканевая жидкость содержит тканевый тромбопластин, активирующий свертывающую систему, что приведет к получению совершенно неправильных результатов.
Важны также способ и продолжительность наложения жгута на руку при заборе крови. Наложение жгута на период более 2 мин при заборе крови из вены может привести к увеличению концентрации в пробе белков, факторов коагуляции и клеточных элементов.
Капиллярную кровь из пальца для лабораторных исследований допустимо использовать лишь в следующих случаях:
-
При ожогах, занимающих большую площадь поверхности тела пациента.
-
При наличии у пациента очень мелких вен или их плохой доступности.
-
При выраженном ожирении пациента с затрудненным доступом к венам.
-
При установленной склонности к венозному тромбозу.
-
У новорождённых.
Пункцию артерий для забора крови используют редко (преимущественно для исследования газового состава артериальной крови).
Хранение и транспортировка биологических материалов
Чувствительность компонентов биологических материалов, имеющих диагностическое значение и изучаемых в лабораториях, очень различна. Некоторые из этих компонентов способны выдерживать хранение и транспортировку при соблюдении определенных условий, другие – нет. По экономическим соображениям принято считать, что с использованием современных систем забора, методов консервации, соблюдении температурных режимов, хранение и транспортировка биологических материалов в течение ограниченного времени допустимы.
В ряде случаев это так. Тем не менее, известно, что многие важнейшие лабораторные показатели допускают очень ограниченную задержку между забором биологического материала и началом исследования. Ситуация еще больше осложняется тем, что одни компоненты лучше сохраняются при охлаждении, тогда как другие, наоборот, в таких условиях претерпевают ускоренную деградацию. Как очевидно, это значительно затрудняет хранение и транспортировку биологических материалов, учитывая, что компоненты с такими разными свойствами зачастую содержатся в одной пробирке. Нужно также учитывать различие между декларируемыми и реальными условиями сбора, хранения и доставки биологических материалов. При этом, стабильность многих компонентов крови и мочи в условиях лабораторной практики остается неизвестной.
Согласно ГОСТ Р 53079.4-2008 «Обеспечение качества клинических лабораторных исследований. Часть 4. Правила ведения преаналитического этапа», время доставки образцов в лабораторию не должно превышать 30-60 минут (для мочи – 90 минут), время от забора крови до ее центрифугирования (обязательный этап биохимических и коагулологических исследований) не должно превышать 1 часа. Также, согласно этому документу и другим авторитетным рекомендациям:
-
Не рекомендуется транспортировка образцов цельной крови, используемой, в частности, для проведения ее клинического анализа.
-
Определение скорости оседания эритроцитов (СОЭ) требует начала исследования не позднее 2-х часов с момента забора крови.
-
Моча, собранная для общего анализа крови, может храниться не более 2-х часов, причем применение консервантов нежелательно.
-
Для достоверного дифференциального подсчета лейкоцитарной формулы мазок крови должен быть приготовлен не позднее 3-х часов после ее забора.
Установлено, что в пробах крови, полученных от пациентов с выявленной патологией, могут усиливаться изменения, обычно наблюдаемые под влиянием времени и температуры. Это еще больше сокращает время допустимого хранения и транспортировки биологических материалов, поскольку стабильность компонентов может отличаться у разных пациентов.
Известно, что наименьшей стабильностью обладают показатели, характеризующие состояние свертывающей системы крови. Стандартным условием является проведение общих скрининговых исследований свертывающей системы в течение максимум 4-х часов с момента забора крови. Для т.н. интегральных исследований свертывающей системы крови (исследование тромбодинамики, тромбоэластография) временная задержка, связанная с транспортировкой образцов, недопустима в принципе – получение неправильных, дезориентирующих врача результатов происходит уже после 30-45-минутного промедления. Исследование тромбоцитарного звена свертывающей системы крови еще более уникально – это единственное из более чем 2500 лабораторных исследований, ведущееся на живых клетках. Последнее абсолютно исключает как транспортировку, так и любую задержку начала работы. Все сказанное тем более важно, что судить о состоянии свертывающей системы крови по концентрации или активности отдельных ее компонентов нельзя – значение имеет работа всей системы в целом.
Периодичность лабораторных исследований
Повторные исследования широко используются для оценки эффективности проводимого лечения и прогнозировании исхода заболевания, лекарственном мониторинге, постановке симуляционных тестов. Чтобы избежать получения ошибочных результатов, интервалы между исследованиями должны выбираться с учетом продолжительности «жизни» определяемого вещества в организме, динамики его накопления и выведения при нормальных и патологических процессах, фармакокинетических свойств лекарственных препаратов.
I. Внелабораторные ошибки.
1.
Канцелярские ошибки, ошибки, при взятии
пробы
2.
Ошибочный больной,
3.
Ошибочный образец, ошибочное заполнение
бланка
II. Внутрилабораторные ошибки (аналитические ошибки)
определяемые
или неопределяемые или случайные
систематические
требуют
статистического
(реактивы,
оборудование) анализа для
заключения
I. Внелабораторные ошибки
1.
Ошибочно назван больной.
Два
больного с одинаковой фамилией (записывают
инициалы, возраст). Неправильно выписан
бланк — направление на другого больного
(созвучная фамилия и т.д.)
2. Ошибочно идентифицирован образец.
-
лаборант
берет образец 25 и отливает сыворотку
в пробирку 26 и т.д. -
после
окончания работы лаборант находит 2
образца под одинаковым номером.
3. Ошибочно заполненные бланки
-
в
образце 198 содержание глюкозы 108 мг,
лаборант выписывает величину 198 мг. -
в
сыворотке исследуют кальций и фосфор,
лаборант результат исследования
записывает наоборот.
4. Ошибки при взятии пробы:
Очень
много факторов влияют на результаты
анализов. Поэтому забор материала,
условия транспортировки унифицированы.
На
результаты исследования влияют:
-
Время
забора материала. -
Положение
больного. -
Нервное
возбуждение, физическая нагрузка. -
Время
года, климат, диагностические и лечебные
процедуры, лекарственные вещества. -
Хранение
и доставка материала:
Спинномозговую
жидкость исследуют и доставляют сразу
же. — 1ч. При длительном хранении мочи
изменяются физико-химические свойства.
Мочу нужно хранить в холодильнике. Можно
использовать консерванты:
-
хлороформенная
вода (5-5,7 мл на 1л воды)-20-30 мл хлороформенной
воды на 1 л мочи. -
жидкость
Мюллера — 10,0 г сульфанила,25 г бихромата
калия,100 г воды. На 100 мл мочи 5 мл смеси. -
несколько
кристалликов тимола.
II.Аналитические ошибки Типы аналитических ошибок и частота их возникновения
Технические
ошибки: Частота
(%)
Калибровка 16
Расчеты 2
Приготовление
пробы 11
Техника
исследования 6
Интерпрекация 4
Систематические
ошибки:
Реактивы 9
Аппаратура 24
ГРУБЫЕ
ОШИБКИ:
одиночное значение исследуемого
компонента, выходящее за допустимые
пределы погрешности.
Причины:
недостаточная тщательность в работе
(неправильная дозировка, ошибки в
расчетах, небрежность в методике)
СЛУЧАЙНЫЕ
ОШИБКИ:
одиночное значение не выходящее за
допустимые пределы погрешности, но
стремящиеся к выходу за эти пределы.
Случайная ошибка происходит при всяком
измерении, поэтому при определении
вещества в пробе повторно, получают не
одинаковые, а различающиеся между собой
результаты.
Причины:
-
Неравномерное
перемешивание пробы. -
Нестабильность
приборов, инструментария -
Неточность
работы персонала (ошибки в пепитировании,
неправильное считывание результатов)
Случайные ошибки
невозможно исключить, но можно ограничить.
СИСТЕМАТИЧЕСКИЕ
ОШИБКИ:
погрешности, одинаковые по знаку,
происходящие от определенных причин,
влияющие на результаты, либо в сторону
увеличения, либо в сторону уменьшения.
Наиболее часто встречаются следующие
виды систематических ошибок.
Причины:
-
Методические
ошибки — зависят от особенностей
применяемого метода (наиболее серьезные
причины и устранить их трудно) -
Ошибки,
зависящие от приборов и реактивов. -
Ошибки
оперативные — неправильное или неточное
выполнение аналитических операций. -
Ошибки
индивидуальные.
Последние три
причины систематических ошибок можно
устранить и свести до минимума.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Доаналитические (внелабораторные) ошибки
Читайте также:
|
Классификация
Ошибки обычно разделяют на две основные группы:
1. Внелабораторные.
2. Лабораторные.
Доаналитические (внелабораторные) ошибки
Составляют около 20%всех ошибок. Их подразделяют на основные группы:
— канцелярские ошибки;
— ошибки, связанные с состоянием пациента и его подготовкой к
исследованию;
— ошибки взятия проб;
— хранения биологического материала;
— хранения и чистоты реактивов, инструментов и посуды,необходимых для взятия биологического материала. Канцелярские ошибки включают в себя ошибочных больных,ошибочныеоб разцы,перепутывание фамилий больных или их кодирующих номеров, бланков-заказов, ошибочные заявки и прочие.
При взятии крови частой причиной искажения лабораторных анализов является гемолиз крови. В гемолизированных сыворотках завышаются результаты определения железа,калия, билирубина, холестерина, активности ферментов(лактатдегидрогеназы, кислой и
щелочной фосфатаз, альдолазы и др.).
К лабораторным погрешностям может привести неправильно подобранный антикоагулянт. Так, цитрат и оксалат натрия ингибируют большинство ферментов, ЭДТА ингибирует активность щелочной и кислой фосфатаз,гепарин,активируетпостгепариновуюлипазу,расщепляющую,хиломикроны, и не может использоваться для получения плазмы на,исследование показателей липидного обмена, а также для исследования коагулограммы, являясь физиологическим антикоагулянтом.
При взятии крови на коагулограмму необходимо точное соотношение антикоагулянта и крови, иначе при увеличении количества цитрата натрия выявляется ложная гипокоагуляция, а при уменьшении происходит процесс свертывания крови и образование фибриновых сгустков.
При определении групп крови могут возникать как технические ошибки, связанные с нарушением инструкции (температурный режим, чистота посуды, нанесение сывороток на плоскость, соотношение крови
и стандартной сыворотки, время учета реакции и т.п.), так и ошибки, зависящие от качества стандартных реагентов.
Кроме того, бывают ошибки,связанные с особенностями исследуемой крови:
а) неправильное определение групп А и АВ;
б) неспецифическая агглютинация эритроцитов при онкологических заболеваниях, гиперфибриногенемиях, гипергаммаглобулинемиях, наличии аутоантител к эритроцитам и др.);
в) наличие в сыворотке крови лиц с группами А и АВ экстрааглютинина альфа-1.
Скорость оседания эритроцитов(СОЭ)у пациентов с разными, заболеваниями меняется в довольно значительных пределах (от 10-12 до50-60 мм/ч),имея существенное неспецифическое клиническое значение.На величину СОЭ оказывают выраженное влияние три группы факторов:
1. Состояние эритроцитов (количество клеток, их размеры -макро, микроциты, состояние мембраны эритроцитов, заряд мембраны).
2. Состав плазмы крови (повышенная концентрация белков острой фазы, гиперглобулинемия, гиперфибриногенемия).
3. Технические факторы (диаметр и длина капилляра, положение капилляра, вибрация, температура, световая и магнитная радиация,время седиментации, избыток антикоагулянта). Эти факторы необходимо учитывать при постановке и оценке СОЭ.
К ошибкам может привести неучет времени приема и качество пищи пациентов. Липемия искажает результаты не только показателей липидного обмена, но также и общего белка, билирубина, активности ферментов и др. В течение суток (суточные, циркадные ритмы) имеются колебания таких параметров как хлориды, фосфор, креатинин, азот мочевины, общие липиды, железо,общий белок,глюкокортикоиды
(табл.1).
Таблица 1 Колебания некоторых параметров в разное время суток
—T————-T—————-T—————T——————
¦Анализируемый¦ 7-10 час. ¦ 10-14 час. ¦ После 14 час.
№ ¦ компонент, ¦ _ _ ¦ _ _ ¦ _ _
п/п¦ ммоль/л ¦ Х+-хS ¦ Х+хS ¦ Х+хS
¦ ¦ V% ¦ V% ¦ V%
—+————-+—————-+—————+——————
1. Хлориды 101,54+-1,27 101,75+-1,49 102,28+-1,41
1,27 1,47 1,38
2. Фосфор 3,56+-0,30 3,71+-0,34 2,93+-0,21
8,30 9,28 7,41
3. Креатинин 0,88+-0,10 1,03+-0,07 1,12+-0,09
10,86 6,37 8,17
Изменяются биохимические показатели крови и в разные периоды года (сезонные ритмы, табл.2).
Таблица 2 Сезонные изменения уровня некоторых липидов крови у доноров
(Крыжановский В.Л., 1974)
——-T—————————T———————————
№ ¦ ¦ Время года
п/п ¦ Показатели +—————T——————
¦ ¦ осень ¦ зима
——-+—————————+—————+——————
1. Общий холестерин, ммоль/л 4,59+-0,313 7,085+-1,001
2. Холестерин в 2,69+-0,149 3,94+-0,147
бета-липопротеинах,
ммоль/л
3. Свободный холестерин, 1,895+-0,198 3,135+-0,153
ммоль/л
4. Свободные жирные кислоты, 0,493+-0,032 0,556+-0,047
г/л
5. Триацилглицерины, ммоль/л 2,087+-0,0935 1,614+-0,0913
6. Бета-липопротеины, г/л 4,21+-0,169 4,03+-0,228
———————————————————————
Необходимо унифицировать время забора биологического материала,исследовать кровь, взятую натощак во избежание возникновения источников погрешностей указанного рода.
Волнение и страх перед взятием крови могут повлиять на показатели гормонального статуса, глюкозы, калия и др. Физическая нагрузка приводит к сдвигам значений активности ферментов Курение прежде всего искажает результаты исследования показателей липидного обмена.
Проблема медикаментозных влияний на результаты становится все более актуальной. Лекарственные вещества
оказывают влияние на лабораторные показатели разными путями:
· — изменяют интенсивность болезненного процесса
· — оказывают побочное действие на деятельность различных органов и систем;
· — интерферируют с определенными веществами
В процессе лабораторного исследования.
Химическая и физическая интерференция является частой причиной ошибочных результатов при исследовании биологических проб.
Результаты лабораторных исследований нередко изменяют не сами лекарственные вещества, а их промежуточные или конечные продукты.
Обнаружены достоверные изменения таких показателей как билирубин, креатинин, калий, щелочная фосфатаза, аланинаминотрансфераза после
приема больших доз аскорбиновой кислоты. Поэтому собирать материал для исследования необходимо до начала приема лекарственных препаратов,а также до проведения диагностических и лечебных
процедур. Так, активность КК, ЛДГ, АсАТ увеличивается после катетеризации сердца, частых внутримышечных инъекций, КФ – после ректального исследования и массажа предстательной железы. Не рекомендуется брать кровь для гематологических исследований после физиопроцедур и рентгеновского облучения, после физических и умственных нагрузок. Не следует производить взятие крови на реакцию Вассермана у лихорадящих больных, после приема алкоголя, общего наркоза, обширных травм, хирургических вмешательств, приема наркотических препаратов и препаратов наперстянки. Следует также иметь в виду, что следы детергентов в стеклянных пробирках влияют на исследование активности ферментов, показателей липидного обмена(холестерина, фосфолипидов). Использование вместо стеклянных
пробирок одноразовых пластмассовых позволяет избегать указанных недостатков. Весьма существенной причиной возникновения погрешностей анализа является нарушение условий хранения проб. Длительное стояние
сыворотки над эритроцитами приводит к сдвигам концентрации ряда показателей (табл.3).
Таблица 3 Изменение некоторых биохимических компонентов сыворотки крови после продолжительного контакта ее со сгустком крови
——-T—————————T———————————
№ ¦ ¦ Время (часы)
п/п ¦ Компоненты +————-T——————-
¦ ¦ 24 ¦ 48
——-+—————————+————-+——————-
1. Глюкоза -30% -50%
2. Лактатдегидрогеназа +30% +40%
3. Калий +25% +52%
4. Железо +8% +17%
5. Трансаминазы -8%-9% -12%
6. Щелочная фосфатаза -2% -4%
———————————————————————
Некоторые вещества чувствительны к влиянию ультрафиолетовых лучей (например, билирубин), поэтому пробы нельзя держать на свету.
Время стояния сыворотки над сгустком крови или плазмы над эритроцитами должно строго ограничиваться (не более 1 ч после взятия крови). При необходимости сохранить сыворотку на 2-3 месяца ее следует заморозить при Т -20°С -70°С и хранить. Проведение бактериологических исследований часто сопровождается
ошибками, связанными с забором материала. Взятие материала может быть нестерильным или он взят из неинфицированного очага. Могут быть
нарушены условия доставки исследуемого материала (продолжительная транспортировка, большой промежуток времени от забора до посева), неправильная техника посева, нарушение технологии приготовления
питательных сред или некачественные среды. Иногда нарушаются условия культивирования в термостате, а также неправильная идентификация возбудителей микробов, связанная с постановкой метода или учетом результата. При целевом исследовании отрицательный ответ может быть обусловлен рядом приведенных причин. Для проведении КК бактериологических исследований используется специальный материал
(специальные культуры).
Иммунологические показатели у здоровых людей характеризуются индивидуальностью значений, возрастными изменениями и колебаниями
под влиянием биологических ритмов и нагрузочных факторов. Подобной изменчивостью характеризуются и иммунологические параметры больных.
Чтобы получить максимальную информацию от иммунограммы, необходимо знать индивидуальную иммунологическую норму пациента, проводить оценку всех показателей и их соотношений с учетом клинической картины заболевания и в динамике. В подавляющем большинстве случаев анализ иммунограммы дает возможность делать ориентировочные, а не безусловные выводы диагностического и прогностического характера.
При подготовке к исследованию общеклинического анализа мочи особых ограничений в рационе не требуется.
Важным является правильность сбора мочи. Необходимо воздержаться от большого количества моркови, свеклы, а также от приема мочегонных средств, амидопирина, настоев или отваров трав.
За сутки до исследования не следует менять питьевой режим. Мочу собирают в сухую, чистую
стеклянную посуду утром. Для определения количественного содержания глюкозы в суточной моче ее первая утренняя порция (после пробуждения) выливается. Затем пациент собирает в чистую трехлитровую банку все порции мочи в течение суток, включая и порцию мочи, выделенную утром следующего дня. Измерив общее количество и перемешав ее, пациент относит в лабораторию 100 мл мочи для исследования. При исследовании концентрационной функции почек по методу Зимницкого мочу в течение суток через каждые три часа собирают в отдельные, заранее подготовленные и подписанные банки (8 банок на 8 порций мочи). Мочегонные средства применять нельзя. Для исследования мочи по методу Нечипоренко с количественным подсчетом клеток собирается средняя порция утренней мочи (в середине мочеиспускания).
Исследование мочи по методу Аддис-Каковского требует ограничения суточного приема жидкости (чай, молоко, 1-е блюда,компот, вода) до 1 литра. Больной должен меньше пить днем и совсем не пить ночью. Собирают мочу, выделенную вечером и ночью за 12
часов. Больной вечером опорожняет мочевой пузырь и отмечает время. Через 12 часов он мочится в чистую стеклянную посуду. Если у него возникают позывы к мочеиспусканию ночью, то он собирает мочу в ту же
банку, отмечая время. Хранить мочу следует в прохладном месте. При длительном хранении изменяются физико-химические свойства мочи,разрушаются клеточные элементы осадка. В случае сбора суточного
количества мочи используют консерванты (кристаллы тимола, хлороформенную воду и др.).
Для цитологических исследований мокрота не должна стоять более 4 часов с момента получения, так как при более длительном хранении происходит аутолиз элементов. Спинномозговая жидкость доставляется в
лабораторию сразу же после пункции.
При невозможности непосредственного исследования кала, егосохраняют в стеклянной посуде в закрытом виде в холодильнике.Условия транспортировки биопроб могут оказать определенное влияние на точность получаемых результатов исследования. Во время
транспортировки следует оберегать пробы от сильного встряхивания и перегрева. Нередко источники погрешностей не поддаются качественному контролю. Необходимо помнить о важности регулярного инструктирования персонала клиник и амбулаторий о правилах и условиях забора, а также хранения биологического материала для различных клинико-диагностических исследований и подготовки пациента кисследованию.
Дата добавления: 2015-08-18; просмотров: 660 | Нарушение авторских прав
mybiblioteka.su — 2015-2023 год. (0.028 сек.)
5. Реагенты. Важный компонент системы «автоматизированный анализ крови» — реагенты. Часто лаборатории, купив анализатор, сталкиваются с необходимостью нести довольно ощутимые постоянные затраты на реагенты. Количество разных реагентов, используемых анализатором, существенно влияет на себестоимость и качество исследований.
Каждый конкретный тип гематологического анализатора рассчитан на свою собственную реагентную систему, однако между ними есть много общего.
Основными составляющими комплектов реагентов для гематологических анализаторов являются:
— изотонический разбавитель;
— лизирующий раствор;
— промывающий раствор (после каждой пробы);
— промывающий раствор (для качественной очистки системы);
— очищающий раствор (для экстренной очистки датчика и/или сервисных работ).
В зависимости от конкретной конструкции анализатора в базовый комплект может входить лишь часть указанных реагентов.
Изотонический разбавитель — это буферный раствор с фиксированными параметрами рН, электропроводности и осмолярности. Слово «изотонический» указывает только на одно и не самое важное свойство реагента — поддержание требуемого осмотического давления с целью обеспечения постоянства объема клеток крови. Дело в том, что эритроциты принимают тот объем, который им диктует осмолярность раствора. При увеличении осмолярности, в течение 3-5 с эритроциты сжимаются до некоторого равновесного объема. Если осмолярность раствора уменьшается, объем эритроцитов, соответственно, увеличивается. Таким образом, средний объем эритроцитов (MCV) увязывается с осмолярностью изотонического разбавителя. Использование изотонического разбавителя, не соответствующего марке анализатора, может привести к ложному завышению/занижению MCV.
Стабилизирующие добавки в изотоническом разбавителе должны обеспечивать сохранность форменных элементов крови в первом разведении в течение достаточно длительного времени. Присутствие в растворе антикоагулянта должно эффективно предотвращать образование фибриновых сгустков и агрегацию тромбоцитов.
Очень важными компонентами гематологических реагентов и, в частности, изотонических разбавителей являются антибактериальные добавки, которые препятствуют бактериальному заражению гидравлических магистралей анализаторов. Учитывая тот факт, что бактериостатики, как правило, негативно влияют на клеточные мембраны, их выбор довольно ограничен. Следует иметь в виду, что для всех гематологических анализаторов с дифференциацией лейкоцитов на три популяции основным режимом является работа с цельной кровью. В случае гематологических анализаторов, проводящих дифференциацию лейкоцитов на три популяции, изотонический разбавитель содержит специальные добавки, модифицирующие мембраны лейкоцитов. В этом случае изотонический разбавитель должен применяться в согласованной паре с соответствующим лизирующим раствором.
NB! Нельзя совмещать в пару «изотонический раствор — лизирующий реагент» компоненты от разных производителей!
Другим важнейшим реагентом является лизирующий раствор (гемолитик), который при добавлении в разведение крови вызывает лизис эритроцитов и в то же время сохраняет лейкоциты. Необходимо, чтобы гемолиз эритроцитов был качественный и полный, поскольку в гемолизате подсчитываются лейкоциты, которых первоначально примерно в 1000 раз меньше, чем эритроцитов. Для обеспечения этих свойств лизирующий раствор, как правило, содержит сложную композицию ионных поверхностно-активных соединений. Современные гемолитики обеспечивают быструю реакцию и высокую степень отделения лейкоцитов от стромы независимо от настройки дискриминатора конкретного прибора.
В анализаторах с дифференциацией лейкоцитов на три популяции лейкоциты под действием лизирующего раствора изменяют свои размеры так, что выделяются фракции лимфоцитов (первый пик лейкоцитарной гистограммы), гранулоциты (крайний правый пик лейкоцитарной гистограммы). В средней части гистограммы, в области так называемых средних клеток, расположены моноциты, базофилы и эозинофилы. Наряду с факторами пробоподготовки свойства реагентной системы оказывают существенное влияние на качество дифференциации лейкоцитов.
Промывающие растворы непосредственно не участвуют в процессе измерения, однако их свойства существенно влияют на стабильность аналитических характеристик анализаторов. Характерной особенностью гематологических анализаторов, использующих принцип Культера, является наличие счетных апертур малого диаметра. Кровь содержит в себе ряд веществ, которые имеют тенденцию осаждаться на апертуре и внутренней поверхности гидравлической системы. Это постепенно приводит к уменьшению диаметра, закупорке апертуры и ошибочным результатам. В некоторых случаях прибор просто останавливается и требует тщательной промывки. Таким образом, качество промывающих растворов влияет на долговременную стабильность работы прибора.
Промывающие растворы бывают в основном трех типов. Первый тип — растворы для мягкой промывки магистралей анализатора между пробами, они не содержат поверхностно-активных веществ (детергенты) в значительных концентрациях. К сожалению, детергентные промывающие растворы практически не удаляют белки. Поэтому для очистки от белковых осадков применяют растворы на основе гипохлорита натрия — второй тип промывающих растворов. Эти растворы являются очень сильными депротеинезаторами. Однако раствор гипохлорита натрия — очень едкое вещество, долгого контакта с ним не выдерживают детали из пластика (они трескаются), металла (подвергаются коррозии). Поэтому злоупотреблять такими растворами нельзя. Данные растворы в основном применяются в экстренных случаях, когда необходимо быстро очистить счетную апертуру, а также для сервисных работ.
Современное решение проблемы качественной промывки прибора — применение ферментативных промывающих растворов. Благодаря наличию ферментов, такие растворы эффективно удаляют адсорбированные на стенках гидравлической системы белки и другие вещества. При этом они совершенно нейтральны и не оказывают вредного действия на детали прибора. Трудность создания таких промывающих растворов заключается в известном свойстве ферментов быстро терять активность.
6. Калибровка и контроль качества. Система управления качеством любого исследования складывается из оценки адекватности каждого этапа. Общеклинический анализ крови — не исключение, этапы его выполнения во многом схожи с другими видами лабораторных исследований и отличаются только применяемыми антикоагулянтами и аналитическим оборудованием:
1. Основание для назначения анализа.
2. Подготовка пациента.
3. Взятие биологического материала.
4. Идентификация проб.
5. Обработка биологического материала с использованием антикоагулянтов.
6. Транспортировка проб.
7. Аналитическое исследование на гематологическом анализаторе.
8. Оформление бланка с результатами теста (может выполняться на самом анализаторе).
9. Оценка результата по интервалам норм.
10. Использование результатов в диагностическом процессе.
Первые 6 пунктов включаются в понятие преаналитического этапа. Анализ назначается врачом и, как правило, берется натощак. Раздел 8 руководства подробно описывает правила и условия взятия и обработки проб.
Аналитический этап
Качество результатов исследования крови на гематологических анализаторах определяется следующими факторами:
— качеством используемых реагентов;
— точностью дозирования цельной или разведенной крови;
— точностью дозирования изотонического раствора при разведении крови;
— точностью определения объема суспензии клеток, пропущенной через апертуру;
— точностью самого подсчета клеток;
— точностью определения размеров клеток;
— корректностью математических методов обработки первичных результатов измерения.
Для настройки приборов производители применяют специальные калибровочные микросферы, которые представляют собой стандартные частицы латекса, а также фиксированные эритроциты. Обычно стандарт, выпущенный одной фирмой, не совсем подходит для калибровки приборов других фирм.
Говоря о калибровке, хочется привести пример искажения результатов MCV, связанный с самим методом определения объема частицы. Если откалибровать анализатор взвесью эритроцитов, имеющих нормальную двояковогнутую форму, а затем измерить сферические клетки такого же объема, они будут восприняты как микроциты. И наоборот, если при калибровке применить сфероциты, то прибор будет регистрировать двояковогнутые нормоциты как макроциты. В коммерческих препаратах контрольной крови, применяемой для настройки приборов, эритроциты имеют сферическую форму, поэтому трудно говорить об адекватной калибровке MCV. До настоящего времени нет общепринятого стандарта для MCV.
Калибровка гематологических анализаторов представляет до сих пор не решенную до конца проблему. Если, например, для калибровки ручных методов определения гемоглобина существуют стандарты гемиглобинцианида, то признанных стандартов для калибровки счета клеток не существует. Те взвеси частиц и контрольная кровь, которые предлагают фирмы-производители для контроля своих приборов, калибраторами не являются и предназначены для проведения процедур контроля правильности положения дискриминаторов и счета импульсов. Все применяемые для «калибровки» и контроля работы приборов материалы имеют доверительные интервалы, в которые необходимо уложиться.
Если при калибровке гематологического анализатора показатели не укладываются в допустимые границы паспортных значений, необходимо исключить преаналитические ошибки: недостаточное перемешивание, отличие температуры контрольной крови, извлеченной из холодильника, от комнатной, нарушение режима хранения, приводящее к порче крови. Например, иногда приходилось наблюдать, как контрольную кровь замораживали. При замораживании наблюдается сильное занижение количества эритроцитов. Это бывает при хранении крови в старых моделях холодильников, встречающихся во многих лабораториях, рядом с морозильной камерой. Здесь температура может опускаться на несколько градусов ниже нуля, и этого достаточно для замораживания и последующего разрушения эритроцитов.
Необходимо также провести ряд мероприятий по обслуживанию прибора, по промывке и очистке апертур, затем вновь провести калибровку.
Клетки (частицы) контрольной крови должны удовлетворять следующим требованиям:
— отсутствие электропроводности;
— сопоставимость по размерам с контролируемыми клетками;
— сходная плотность;
— стабильность размеров во времени;
— химическая инертность.
Выпускаемая сегодня контрольная кровь представляет собой химеру, содержащую стабилизированные эритроциты, частицы латекса вместо лейкоцитов, тромбоциты животных и др. Поэтому стабилизированная кровь не является идеальным контрольным материалом, так как у содержащихся в ней клеток изменены размеры, форма поверхности, реологические свойства и специфическая электропроводность.
Следует заметить, что коммерческая контрольная кровь позволяет исследовать от 8-18 параметров и более. Для контроля приборов с дифференциацией лейкоцитов на 3 части используется кровь на 16-18 параметров. Однако необходимо понимать, что калиброванные латексные частицы, имитирующие лейкоциты, не реагируют на действие лизирующего раствора и при анализе не отражают правильность работы всей системы, а лишь правильность установки дискриминаторов. По сути, особого смысла в приобретении такой, более дорогой, крови нет, достаточно использовать контрольную кровь на 8-10 параметров.
Контрольная кровь применяется:
— для проверки правильности и воспроизводимости счета клеток;
— для проверки правильности разведения;
— для «калибровки» прибора.
Ежедневный контроль гематологических исследований включает исследование контрольной крови на анализаторе с каждой серией значений — в области нормы и в области низких и высоких значений. Все правила построения контрольных карт Леви-Дженнингса и оценка результатов по правилам Вестгарда применимы для работы с контрольной кровью, исследуемой на гематологических анализаторах. Поскольку коммерческая контрольная кровь до вскрытия флакона стабильна 4-6 мес, а после вскрытия — 20-30 дней, возможно и необходимо проводить ее анализ через каждые 20 проб пациентов и, конечно же, в каждой серии проб. Это позволяет:
1. Выявить отклонения в результатах исследований еще до того, как они станут клинически значимыми.
2. Получить необходимое количество результатов для более быстрого накопления статистики и построения карт, а также для оперативной оценки воспроизводимости работы прибора.
Многие современные гематологические анализаторы имеют встроенную программу оценки качества исследований, включающую построение контрольных карт.
Для повышения качества проводимых лабораторией исследований очень важно организовать не только внутрилабораторную, но и внешнюю межлабораторную систему управления качеством в форме локального, городского, федерального контроля. Внешний контроль качества позволяет справиться с наиболее трудной задачей — выявлением и устранением систематических ошибок измерений.
7. Обслуживание, консервация прибора. При эксплуатации гематологических анализаторов важную роль играет качество электрической сети и заземления. Внезапные отключения электропитания, перепады напряжения могут привести к выходу из строя микросхем и плат, сбоям в гидравлической системе, что неизбежно повлечет увеличение расходов на ремонт и обслуживание прибора. Приобретая гематологический анализатор, как и любое другое лабораторное оборудование, надо привыкнуть к необходимости затрат не только на расходные материалы, но и на такую важную «деталь», как источник бесперебойного питания с надежной стабилизацией напряжения.
Отключение электропитания на несколько часов в момент отбора и обработки пробы может привести к засорению трубок, апертур, клапанов. Это повлечет сбой дальнейшей работы, необходимость дополнительных процедур промывки и очистки прибора или даже незапланированное обслуживание прибора.
При получении прибора специалист, осуществляющий установку и обучение работе с анализатором, обязательно обратит ваше внимание на необходимость контроля фоновых значений, получаемых при счете в камерах без пробы. Многие приборы делают такой подсчет автоматически при запуске (процедура «start up»). Эта проверка фона дает уверенность в правильном определении параметров. В руководстве оператора к прибору обычно приводятся фоновые значения (табл. 1).

У большинства современных анализаторов есть процедура завершения работы («shut down»). Она позволяет удалить остатки биологического материала из системы, провести промывку прибора и подготовить его к отключению. Процедуры начала и окончания работы обязательны для выполнения.
Одно из действий прибора — заполнение счетных камер и микроотверстий моющим раствором, содержащим протеолитический фермент. Этот раствор находится в камерах несколько часов (ночь). Кровь, даже разведенная анализатором для подсчета, содержит достаточное количество белковых компонентов, постоянно оседающих на трубках, апертурном отверстии. К этим белкам прилипают микроскопические частицы, обломки клеток, бактерии. За несколько десятков циклов счета эта белково-детритная «пленка» может значительно увеличиться и привести к уменьшению диаметра отверстия. В результате — нарушение правильности подсчета (см. рис ).

Фермент, входящий в состав промывающего (моющего, очищающего) раствора, за несколько часов полностью растворяет белковую матрицу пленки и прибор вновь готов к работе.
Неукоснительное выполнение процедуры выключения является одним из факторов нормальной работы гематологического анализатора. Прибор, эксплуатируемый круглосуточно, не подвергается ферментативной очистке, что может привести к значительному изменению диаметра апертуры и нарушению счета. В таком отверстии могут застревать более мелкие частицы (ранее миновавшие апертуру беспрепятственно) и останавливать работу анализатора.
При закупоривании апертуры (сигнал «clog», «clogging») микросгустками, волокнами, частицами, прибор отмечает увеличение времени счета или разницу в количестве частиц, сосчитанных за несколько временны`х отрезков, в зависимости от конструкции прибора. При возникновении такой ситуации прибор обычно реализует запрограммированную процедуру автоматического устранения закупорки. Если самоочистка не приносит успеха, оператору необходимо вручную выполнить следующие действия:
— провести очистку концентрированным ферментативным раствором;
— провести очистку раствором специально приготовленного гипохлорита натрия;
— активизировать из меню прибора процедуру специальной очистки апертуры токами высокой частоты («прожиг» апертуры).
Неэффективность всех этих действий указывает на серьезную механическую закупорку микроотверстия и требует снятия и чистки апертуры в соответствии с инструкцией на прибор. В некоторых случаях может даже потребоваться вмешательство сервисной службы.
Важно помнить, что для обслуживания прибора необходимо всегда четко следовать инструкциям производителя.
Иногда, при эксплуатации гематологических анализаторов, большой проблемой становится высокий фон в канале счета тромбоцитов. Это часто наблюдается при загрязнении разбавителя штаммами бактерий, устойчивых к антибактериальным добавкам. Смена канистры с изотоническим раствором дает кратковременный успех — трубка, перенесенная из одной канистры в другую, заселяет микроорганизмами новую канистру. Через некоторое время бактерии размножаются и фон снова увеличивается. Эта ситуация требует полной дезинфекции гидравлических магистралей прибора, а иногда и замены состава реагентов и антибактериальных добавок в них.
Другой причиной увеличения фона и ложного цитоза может стать рост бактерий и попадание их в счетные камеры по трубкам слива от емкости отходов («waste»). Поверхности от камер до контейнера с отходами покрываются белково-липидной пленкой, на которой, как на питательной среде из агара, прорастают микроорганизмы. Несмотря на антибактериальные добавки, содержащиеся в дилюенте, бактерии быстро размножаются в банке с отходами и «дорастают» до камер счета. Для предотвращения этой проблемы необходимо:
1. Чаще опорожнять емкость с отходами.
2. Периодически проводить дезинфекцию емкости и сливных шлангов (о частоте и способе запросите инструкции у вашей сервисной службы).
3. НЕ ДОПУСКАТЬ соприкосновения конца сливного шланга с поверхностью отходов в канистре.
Консервация прибора
Гематологический анализатор, как и любой прибор, приобретается для того, чтобы работать непрерывно и избавлять лабораторию от трудоемких ручных операций. Приобретение анализатора является осознанной необходимостью. Ситуация с остановкой прибора из-за недостатка финансирования покупки расходных материалов — нонсенс, но встречается часто.
Если все же работу прибора приходится остановить, самое главное — это подготовить анализатор к длительному простою.
Большинство гематологических анализаторов можно остановить не более чем на одну неделю почти без последствий (летом, в жару, опаснее). Более долгий период простоя прибора с реагентами внутри системы приводит к размножению бактерий, высыханию солевых растворов, склеиванию трубок, прижатых клапанами, кристаллизации солей в апертурах, микротрубках. Привести прибор в рабочее состояние после такого безответственного отношения к нему требует множества сил и времени. Случаи оставления приборов с растворами не являются гарантийными, и пользователь вынужден будет оплачивать услуги сервисной службы в гарантийный срок, если не выполнит нескольких простых действий.
Эти действия чаще описаны в руководстве оператора или могут быть запрошены у сервис-инженеров. Процедура консервации в общих чертах выполняется с использованием соответствующих команд меню анализатора следующим образом:
1. Произвести очистку апертур, камер, трубок, гидравлической системы дезинфицирующим раствором (гипохлоритом).
2. Слить из жидкостной системы все реагенты (изотонический разбавитель, лизирующий и моющий растворы).
3. Промыть систему дистиллированной водой.
4. Осушить систему, прокачав воздух.
Теперь прибор готов к длительному ожиданию следующей поставки реагентов.
Совет: если есть небольшой запас изотонического разбавителя и поставка реагентов ожидается в ближайшее время, лучше прекратить выполнять анализы. Прибор необходимо включать и выключать 2-3 раза в неделю, выполняя процедуры начала и окончания рабочего дня («start up» и «shut down») с оставшимися растворами. Это будет поддерживать прибор в рабочем состоянии до поступления новой партии реактивов. Не следует проводить описанные процедуры с использованием дистиллированной воды, в ней нет антибактериальных добавок, прибор в этом случае может стать инкубатором для бактерий и грибков.
8. Преаналитика, ошибки и проблемы. Даже при наличии современного гематологического анализатора лаборатория иногда выдает результаты, не отражающие истинное состояние пациента, вводящие в заблуждение лечащих врачей. Денег в прибор вложено много, а результат не всегда удовлетворительный. В чем причина?
От 70 до 80% лабораторных ошибок связаны с нарушениями на преаналитическом этапе, ошибки аналитического этапа составляют 10-15%, постаналитического — 15-20%.
Ошибки внелабораторного этапа отличают случайность, бессистемность и трудноуловимость. Именно внелабораторные ошибки вносят самый весомый вклад в искажение результатов анализа, маскируются под проблемы, связанные с приборами и реагентами. В таких случаях несоответствие результатов клинической картине или результатам предыдущего обследования заставляет сотрудников лаборатории перепроверять аппаратуру или заменять реагенты. Это приводит к нерациональной трате рабочего времени и средств, а выявить истинную причину проблемы, как правило, не удается.
Взятие образца, его транспортировка, хранение требуют постоянного контроля со стороны лаборатории. Для получения качественных результатов необходимо учитывать присутствие в пробе интерферирующих веществ, индивидуальные особенности пациента, его подготовку к взятию пробы на анализ. Усилия по предотвращению ошибок на этом этапе окупятся ощутимым улучшением качества гематологических исследований, снижением необоснованных повторов, расходов рабочего времени и средств на обследование больного.
Только полностью стандартизуя все этапы гематологического, да и любого другого исследования от назначения до интерпретации результатов, можно ожидать получения адекватных данных.
Техника взятия крови, используемые иглы, скарификаторы, капилляры, пробирки для транспортировки и хранения проб, реагенты и аналитические системы — все должно быть «однородным» изо дня в день. Часть проблем устраняется с внедрением коммерческих систем взятия венозной и капиллярной крови (вакуумных и невакуумных пробирок с антикоагулянтами).
Взятие крови
Материал для анализа. Вена или палец?
Наилучшим материалом для выполнения анализа на гематологических анализаторах является венозная кровь. Несмотря на распространенное среди медицинских работников отечественных ЛПУ мнение, что «часто в вену лазить» плохо, во всем цивилизованном мире кровь на общий анализ у взрослых берется именно из вены. Важным подспорьем для взятия венозной крови на гемограмму стала разработка и широкое внедрение вакуумных пробирок, содержащих антикоагулянт. Принудительное всасывание крови под действием вакуума позволило использовать для венозной венепункции тонкие атравматичные иглы. Капиллярная кровь в других странах используется реже, в основном у маленьких детей, и связано это с техническими трудностями получения у них венозной крови. Очевидно, что для медицины развитых стран намного важнее получение достоверных результатов из более адекватного материала, чем лозунги об опасности венепункции. Тканевая жидкость, обрывки тканей и микросгустки в капиллярной крови — причина ошибок и сбоев анализатора.
В пробах капиллярной крови более активно происходит агрегация тромбоцитов, больше травмируются форменные элементы, Венозная же кровь, взятая в объеме 2-3 мл, может быть проанализирована повторно, из нее можно выполнить дополнительные исследования.
Взятие капиллярной крови рекомендовано:
— у новорожденных, детей младшего возраста;
— у лиц со склонностью к венозному тромбозу;
— при обширных ожогах и выраженном ожирении;
— при мелких и труднодоступных венах.
На преаналитическом этапе взятия биологического материала имеется более сотни (!) условий, регламентирующих получение адекватных результатов.
Взятие венозной крови как метод выбора имеет свои правила и ограничения, обсуждаемые в специальной литературе. Стоит напомнить, что для исключения общих факторов, влияющих на результаты гематологического исследования, необходимо соблюдение следующего:
— кровь берется после 15-минутного отдыха пациента;
— исключается прием алкоголя и курение непосредственно перед исследованием;
— кровь берется натощак, утром (7-9 ч), пациент во время процедуры сидит или лежит;
— наложение жгута на руку более чем на 1 мин приводит к сосудистому стазу и завышению уровня гемоглобина в венозной крови;
— для взятия венозной крови необходимо избегать мест травм, шрамов, гематом; вен, используемых для переливания растворов; ножных вен у больных диабетом, при нарушениях периферического кровотока, ангиопатиях.
Антикоагулянт
Стабилизация крови, анализируемой на автоматических счетчиках, проводится натриевыми или калиевыми солями этилендиаминтетрауксусной кислоты (ЭДТА — этилендиаминтетраацетат). Гепарин и цитрат натрия для этих целей не применяется. Кровь, стабилизированная цитратом натрия, используется при исследовании гемостаза и СОЭ.
Обычно указываемая в справочниках и инструкциях к приборам концентрация ЭДТА — 1-2 мг на 1 мл для венозной крови. В случае капиллярной крови концентрация антикоагулянта должна быть увеличена в 2-3 раза. Увеличение концентрации ЭДТА в 5 раз не опасно и приводит лишь к небольшому снижению MCV, но увлекаться не стоит.
Одно из важных условий получения качественного образца — тщательное перемешивание крови с антикоагулянтом. Имеет значение и форма нанесения антикоагулянта. Лучшие результаты дает применение пробирок с аэрозольным покрытием и мелкодисперсным порошковым напылением. Кристаллическая форма солей ЭДТА плохо растворима в крови. Применение кристаллических солей приводит к образованию фибриновых нитей в верхней части пробы крови.
Для предотвращения свертывания крови пробирку следует перевернуть, НЕ ВСТРЯХИВАЯ (!), около 10 раз.
Недостаток антикоагулянта в пробе (крови взято больше отмеченного на пробирке уровня) приводит к образованию микросгустков и нарушению работы прибора. Избыток антикоагулянта может повлиять на некоторые показатели только при очень большом превышении оптимальной концентрации.
Анализ СОЭ может быть выполнен из крови, стабилизированной ЭДТА.
Все, как обычно: 4 части крови смешать с 1 частью 3,8% раствора цитрата или физиологического раствора, выдержать 60 мин в капилляре, измерить.
Из стабилизированной ЭДТА можно приготовить мазки крови для подсчета лейкоформулы, но как можно быстрее от момента получения крови.
Авторы надеются, что в самое ближайшее время во всех отечественных лабораториях методы взятия венозной и капиллярной крови с использованием стандартизованных коммерческих систем, обработанных антикоагулянтом, станут нормой жизни. Медицинским сестрам, сопротивляющимся внедрению взятия крови на общий анализ из вены («мы не будем работать на лабораторию!»), необходимо помнить, что вся деятельность учреждений здравоохранения и персонала больниц и поликлиник направлена, в первую очередь, на благо пациента.
Безопасность
Взятие венозной крови с помощью вакуумных систем также называют бесконтактным методом. При работе с вакуумными пробирками, кроме всех прочих преимуществ, отсутствует контакт медицинского персонала с кровью (как при взятии через обычную иглу в пробирку) и, особенно, с аэрозолями крови, образующимися в большом количестве при взятии шприцем. Этот самый излюбленный метод, когда кровь струей устремляется в пробирку (травмирование клеток, гемолиз и пр.), одновременно является и самым опасным, самым «грязным» способом!
Кроме того, взятие крови шприцем с последующим разливанием аликвот по пробиркам вообще недопустимо из-за опасности образования микросгустков, травмирования иглой оператора, высокой вероятности попадания следов крови на руки медсестры, окружающие предметы!
Лозунги о недостатке средств на одноразовые изделия для взятия крови, исключающие преаналитические ошибки, меркнут перед статистикой заражения медицинского персонала вирусным гепатитом. Качество лабораторных исследований и безопасность работников здравоохранения должны чего-то стоить!
Кроме этих систем: стерильные одноразовые пособия: иглы, скарификаторы, перчатки, салфетки. Все, как всегда, плюс маски, дезрастворы, система утилизации.
Салфетки
Взятие крови для автоматического гематологического анализатора возможно только с использованием безворсовых материалов.
Никакой ваты для обработки кожи! Ворсинки ваты вместе с кровью попадают в гемоглобиновую и счетные камеры анализатора, нарушают точность и воспроизводимость анализа, это приводит к увеличению расхода реагентов (повторные промывки) и необходимости внепланового технического обслуживания прибора. Экономия на салфетках оборачивается увеличением затрат на ликвидацию последствий экономии.
Специальные салфетки, пропитанные дезинфицирующими составами и упакованные в индивидуальные пакеты в заводских условиях, — лучшая альтернатива ватным и марлевым шарикам.
Пробирки из пластика являются единственно возможными при взятии крови для последующей обработки на анализаторе.
Кровь, взятая в правильном соотношении с адекватным антикоагулянтом в пластиковую пробирку, сохраняется несколько часов (до 24 ч при 4 °С) без существенных изменений количества и морфологии клеток. Однако скорейшее выполнение анализа предпочтительно, так как патологические клетки менее устойчивы к хранению.
Контакт со стеклом, как и недостаточное количество антикоагулянта, неизбежно приводит к активации тромбоцитов и их агрегации. Результат агрегации — ложная «преаналитическая» тромбоцитопения 50-80·109/л, ошибка счета лейкоцитов может достигать 150% (ложный лейкоцитоз/лимфоцитоз), число эритроцитов может быть завышено почти на 0,5 Т/л, отсюда — неправильно рассчитанные эритроцитарные индексы. Это же может наблюдаться при появлении в кровотоке гигантских форм тромбоцитов, фрагментов мегакариоцитов, но уже относится к факторам физиологии пациента.
Кровь в пластиковых пробирках значительно меньше подвергается травмированию при транспортировке.
Как только цельная кровь взята в пробирку с антикоагулянтом и установлена в штатив, запускается процесс седиментации клеток (подобный СОЭ). Уже в первые минуты стояния образца эритроциты продолжают беспорядочно перемещаться и агрегируют с образованием «монетных столбиков». Спустя 4 мин эритроцитарные агрегаты состоят примерно из 10 эритроцитов, далее они постепенно становятся крупнее (до 50 и более эритроцитов) и разветвляются.
При хранении пробирок со стабилизированной кровью в вертикальном положении появляется лейкоцитарная пленка, состоящая из лейкоцитов и тромбоцитов. Они скапливаются на границе между эритроцитами и плазмой. Недостаточное перемешивание осевшей крови может стать одним из наиболее серьезных источников погрешности при анализе.
Пробирки типа «эппендорф»
В некоторых лабораториях кровь берут в эти «микроконические» пробирки. Цельная кровь имеет высокую вязкость, качественно перемешать ее в пробирке типа «эппендорф» очень трудно. После оседания клеток крови в этот маленький конус оператор может погрузить пробоотборник в более жидкую или более густую фракцию. Результатом будет неправильный счет. Поэтому специалисты не рекомендуют такие пробирки для гематологических исследований.
Нельзя трясти пробу крови! Ручное перемешивание даже в круглодонных микропробирках — процесс с большой долей человеческого фактора — источник ошибок.
Качественное перемешивание пробы возможно с использованием специальных гематологических миксеров. Эффект от приобретения дорогого анализатора часто сводится к нулю из-за экономии нескольких сотен рублей на покупке ротационного или качающего пробирки устройства (шейкера, гематологического миксера).
Продолжительность перемешивания до непосредственного анализа крови должна составлять не менее нескольких минут. Это время зависит от скорости перемешивания, конфигурации пробирок, вязкости крови и других факторов, но в среднем должно составлять не менее 2 мин.
Необходимо помнить, что длительное перемешивание может привести к травмированию и распаду патологических клеток.
Правильное решение проблемы — применение уже упоминавшихся вакуумных пробирок, гематологического миксера и приборов с автоматической системой отбора пробы (автосамплера).
Для преаналитического и аналитического этапов гематологического анализа оптимально:
— применение одноразовых безворсовых салфеток, обработанных дезинфицирующим составом;
— применение одноразовых стерильных вакуумных систем для венозной и микропробирок для капиллярной крови;
— применение перемешивающих устройств для гомогенизации крови или приставки-автосамплера к прибору.
Одноразовые системы для взятия крови не только обеспечивают качество исследований, но и помогают соблюдать санитарно-эпидемиологические требования.
Использование вакуумных систем позволяет:
— снизить опасность возможного инфицирования персонала при работе с кровью (так как кровь сразу же из вены поступает в герметично закрытую пробирку), конструкция систем полностью исключает контакт крови пациента с окружающей средой;
— повысить достоверность результата анализа за счет исключения ошибок преаналитического этапа, связанных с транспортировкой и центрифугированием пробирок;
— обеспечить сохранность проб, исключить разбивание пробирок при транспортировке и центрифугировании и уменьшить риск соприкосновения с кровью при порезе колотым краем стеклянной пробирки; отсутствует необходимость уравновешивания пробирок при центрифугировании;
— исключить ошибки идентификации пациента, пробирки снабжены этикеткой для маркировки;
— соблюсти правильное соотношение кровь-антикоагулянт, важное для точности результатов анализа;
— набрать кровь в одну, две пробирки и более за очень короткий промежуток времени и без повторного введения иглы в вену;
— манипуляция
Согласно данным ВОЗ, удельный вес лабораторных анализов составляет 75–80 % от общего числа диагностических исследований, выполняемых в медорганизациях.
Служба значительно эволюционировала: если раньше лаборатория была придатком в поиске факторов риска, постановке диагноза, назначении лечения, то сегодня она является объединяющим механизмом на всех этапах взаимодействия врача и пациента. Централизация лабораторных исследований — мировая тенденция реформирования клинической лабдиагностики. Особое значение имеет преаналитический этап клинических лабораторных исследований.
Лабораторная диагностика
Важная составляющая
Основной целью централизации лабораторных исследований является повышение эффективности лечебно-диагностического процесса за счет расширения объема лабораторной, диагностически значимой информации, которая поступает лечащим врачам из централизованной лаборатории.
Согласно постановлению коллегии Минздрава от 25.07.2018 № 14.4 «О совершенствовании работы службы лабораторной диагностики», централизация лабораторий, направленная на увеличение доступности лабораторных исследований, определена основным стратегическим моментом развития службы клинической лабораторной диагностики страны.
Важнейшей составляющей централизации является процесс взаимодействия с внешним заказчиком (медучреждением) на преаналитическом этапе оказания лабораторных услуг. Преаналитический этап включает прием пациента врачом, назначение лабораторных исследований, заполнение бланка направления, получение пациентом инструкций об особенностях подготовки к сдаче анализов или сбору биологического материала, взятие проб, доставку материала в лабораторию.
При централизации для лаборатории существенно увеличивается число пунктов сбора проб биологического материала, значительно расширяется спектр заказываемых тестов, изменяется структура проб биологического материала, ритм и временной период их поступления в лабораторию.
Взаимодействие централизованной лаборатории с заказчиком на преаналитическом этапе предполагает обучение врачей, медсестер, курьеров, обеспечение их инструкциями по подготовке пациентов к лабораторным исследованиям, правилам взятия, сбора и подготовки проб к транспортировке, организацию логистики доставки. Порядок организации взятия проб биологического материала и доставки его в централизованную лабораторию является одним из важнейших моментов обеспечения правильного взаимодействия лаборатории и учреждения здравоохранения.
Централизация лабораторных исследований предусматривает особые требования к организации преаналитического этапа, строгое выполнение которых позволит обеспечить получение качественных результатов. Любые неточности на этапе назначения лабораторных исследований будут существенным образом снижать эффективность лечебно-диагностического процесса.
Большинство ошибок в процессе лабораторного анализа — от назначения теста до интерпретации результатов — происходит до того, как образец попал в лабораторию, т. е. вне прямого контроля лаборатории. По данным различных исследований, на преаналитический этап приходится от 46 % до 68 % всех лабораторных ошибок.
Наиболее частые ошибки преаналитического этапа:
- отсутствие образца или перечня назначенных исследований;
- ошибки идентификации образца (этикетка,сопроводительный документ);
- гемолиз in vitro (в пробирке);
- сгустки в образце крови/плазмы;
- неправильная пробирка/контейнер;
- недостаточное количество образца (объем пробы);
- неправильное соотношение кровь/антикоагулянт;
- недостаточное перемешивание образца после взятия;
- неадекватные условия хранения и транспортировки;
- неправильный режим центрифугирования (время/скорость).
Рекомендации
При определении приемлемости выявленных ошибок рекомендуется использовать целевые уровни индикаторов качества преаналитического этапа, установленные Международной федерацией клинической химии и лабораторной медицины (IFCC). Ошибки преаналитического этапа могут существенно исказить состав или свойства биологического материала и таким образом существенно снизить диагностическую ценность результата лабораторного исследования. Частота таких ошибок зависит от уровня технологической дисциплины в направляющей организации здравоохранения, качества администрирования этого этапа.
Основные причины большого количества ошибок:
- отсутствие стандартов качества выполнения процедур преаналитического этапа;
- неиспользование для взятия и сбора биоматериала одноразовых безопасных приспособлений по причине существующего ложного представления об их высокой стоимости;
- недостаточные знания и качество обучения среднего медперсонала правилам и технике выполнения процедур преаналитического этапа.
Прогресс лабораторных технологий, оснащение медицинской лаборатории современными автоматическими анализаторами позволили получать существенно более точные результаты анализов. Новые автоматические анализаторы весьма чувствительны к качеству исследуемого биоматериала, что предъявляет более высокие требования к условиям взятия, хранения и срокам доставки проб.
Согласно приказу Минздрава от 18.04.2019 № 466 «О совершенствовании деятельности службы лабораторной диагностики Республики Беларусь», обеспечение качества преаналитического этапа лабораторных исследований является зоной ответственности клинических специалистов. В стандарте СТБ ISO 15189-2015 «Медицинские лаборатории. Требования к качеству и компетенции» требуется установление индикаторов качества с целью мониторинга и оценки работы по всем критическим аспектам преаналитического этапа. Их внедрение в лабораторную практику и систематический сбор данных позволят обеспечить надежность результатов лабораторного тестирования.
Внутренний стандарт
Клинико-диагностическая лаборатория (КДЛ) РНПЦ РМиЭЧ является многопрофильной, с 2016 года выполняет централизованные исследования для взрослых и детей Новобелицкого и Советского районов Гомеля. Заказчиками являются 10 поликлиник. Исследования включают широкий спектр биохимических (специфических белков и метаболитов), иммунохимических (гормоны, онкомаркеры, витамины и др.), коагулологических (коагулограмма, агрегатограмма, факторы свертывания и антикоагулянты, D-димеры и др.) лабораторных тестов.
Разработан внутренний стандарт, который был включен в текст совместного приказа РНПЦ РМиЭЧ и ГУЗО Гомельского облисполкома (№ 117 и № 167 от 05.02.2019) «О централизации лабораторных исследований». Определена схема проведения централизованных лабораторных исследований.
Для обеспечения доступности для врачей-клиницистов информации о полном спектре выполняемых тестов сотрудниками лаборатории разработаны бланки направлений.
Для обеспечения контроля качества выполнения централизованных исследований лаборатория постоянно анализирует результаты применения основных индикаторов качества преаналитического этапа:
- ошибки идентификации и транскрипции тестов;
- несоответствие направления установленной форме;
- неверный тип, недостаточный объем образца;
- повреждение образца/направления в ходе транспортировки;
- образец, направление для образца не получены;
- сгусток в образце.
По результатам анализа, проведенного КДЛ РНПЦ РМиЭЧ, несоответствия в целом выявляются для 1,3 % доставленных образцов сыворотки/плазмы. Среди индикаторов с наибольшей частотой встречаются ошибки транскрипции тестов, составляющие 1 %:
- отсутствие отметок о необходимых тестах;
- нечеткий запрос на исследование;
- незаполненные/не полностью заполненные паспортные данные пациента (не обозначен пол, возраст, не указан диагноз, отсутствует печать врача).
Реже определяются ошибки идентификации пробы — нарушение маркировки, в т. ч. расхождения между нумерацией направления и пробы. В 0,34 % случаев пробы не доставлялись в лабораторию, в 0,3 % — для проб отсутствовали направления на исследования. Несмотря на то что выбраковка по причине гемолиза определена на этапе взятия крови и первичной пробоподготовки, в лабораторию в 0,31 % случаев доставляются гемолизированные образцы. В 0,5–1 % случаев в пробах сыворотки встречаются нити фибрина, сгустки, осадок эритроцитов. Регистрируются случаи доставки количества сыворотки, недостаточного для выполнения назначенных тестов. Такие несоответствия являлись результатом неполного соблюдения поликлиниками правил пробоподготовки: выдержки необходимого времени сворачивания крови, соблюдения режима центрифугирования крови и пипетирования сыворотки.
Для образцов сыворотки с выявленными ошибками транскрипции тестов лаборатория выясняет необходимую информацию по телефону, после чего образцы, как правило, принимаются в работу. Указанные действия позволили минимизировать потери образцов по причине нарушений правил преаналитики. Выбраковка с оформлением акта отказа в приеме биологического материала с объяснением причин проводится для гемолизированных образцов либо для случаев, когда доставляется только проба сыворотки без направления и наоборот. Пробы сыворотки со сгустками, эритроцитами подвергаются повторному центрифугированию, после чего выполняются исследования.
Лабораторные исследования — более ранний и намного более чувствительный показатель состояния человека, чем его самочувствие. Результаты анализов отражают физико-химические свойства исследуемой пробы и дают объективную диагностическую информацию. Важные решения по тактике лечения врач зачастую принимает даже при небольших изменениях лабораторных показателей. Поэтому лабораторные исследования для диагностики и лечения заболеваний так важны. Однако результаты анализов далеко не всегда бывают правильными! Это связано с большим количеством факторов, способных оказать влияние на конечные результаты лабораторного тестирования.
Результаты лабораторных исследований подвержены влиянию биологической и аналитической вариации.
Биологическая вариация обусловлена внутрииндивидуальной вариацией, наблюдаемой у одного и того же человека, и межиндивидуальной вариацией, связанной с различиями между людьми.
К факторам, обуславливающим биологическую вариацию, относят:
-
Физиологические закономерности (влияние расы, пола, возраста, телосложения, характера физической активности и питания);
-
Влияние окружающей среды (климат, геомагнитные факторы, время года и суток, состав воздуха, воды и почвы в месте обитания, социально-бытовая среда);
-
Воздействие производственных и бытовых (алкоголь, никотин, наркотики) токсичных веществ, ятрогенных влияний (диагностические и лечебные процедуры, прием лекарственных средств);
-
Условия, предваряющие или сопровождающие взятие пробы (приём пищи и воды, физическая нагрузка, положение тела при взятии пробы, стрессорные и прочие факторы);
-
Время забора пробы, связанное с влиянием циркадных (суточных) ритмов и времени года;
-
Аналитическая вариация зависит от технологии анализа и используемого оборудования. Также к факторам, обуславливающим аналитическую вариацию, относят:
-
Методику взятия пробы (способ и погрешности процедуры, используемые средства, оборудование и консерванты);
-
Условия окружающей среды (температура, вибрации, тряска, интенсивность освещения) и продолжительность транспортировки биоматериала для исследования в лабораторию.
Недостоверные результаты могут быть вызваны ошибками, допущенными на разных этапах лабораторного исследования, затрудняя постановку диагноза и проведение адекватного лечения. Наиболее часто получение ошибочных результатов связано с внелабораторным (т.н. преаналитическим) этапом. Он включает в себя все стадии от назначения анализов врачом до поступления пробы в лабораторию. Именно с этим этапом связано 2/3 всех ошибочных результатов, которые могут обесценить проведенные исследования. Поэтому правильная организация преаналитического этапа – важнейший элемент обеспечения качества лабораторной диагностики.
Факторы, влияющие на правильность лабораторных исследований на преаналитическом этапе
Прием пищи
Режим питания, состав пищи, перерывы в её приёме оказывают существенное влияние на многие лабораторные показатели. После приема пищи содержание отдельных веществ в крови может повышаться или подвергаться изменениям в результате последующих гормональных эффектов. Наиболее значительно прием пищи повышает содержание в крови триглицеридов и глюкозы. Увеличивается также содержание лейкоцитов (т.н. постпрандиальный лейкоцитоз). Определение многих веществ может затрудняться мутностью, вызванной появлением в крови после приема пищи мельчайших жировых частиц (хиломикронов). Их концентрация достигает максимума через 2-2,5 часа после приема пищи, а, затем, постепенно снижается до незначительной в течение 8-10 часов. В это время целый ряд лабораторных исследований крови может быть невозможен. Голодание, тоже, может искажать результаты исследований. У здоровых людей после двух дней голодания увеличивается концентрация билирубина в крови, после еды его содержание в крови, наоборот, снижается. 3-х дневное голодание в 2-3 раза снижает концентрацию глюкозы в крови, увеличивает концентрацию триглицеридов. После 2-4-недельного голодания в крови снижается концентрация общего белка, холестерина, триглицеридов, мочевины и липопротеинов, повышается выведение почками креатинина и мочевой кислоты. На фоне длительного голодания организм переходит в режим экономии энергии, для чего снижает концентрацию в крови гормонов щитовидной железы – тироксина и трийодтиронина. Одновременно, голодание ведет к увеличению содержания в крови кортизола и дегидроэпиандростерона.
Некоторые продукты и режим питания могут влиять на результаты биохимического исследования крови и мочи. Употребление жирной пищи может повысить в крови концентрацию калия, триглицеридов и активность щелочной фосфатазы. Потребление большого количества мяса, то есть пищи с высоким содержанием белка, может увеличить концентрацию в крови мочевины, аммиака и солей кальция в моче. Пища с высоким содержанием ненасыщенных жирных кислот может вызвать снижение в крови концентрации холестерина. Бананы, ананасы, томаты, авокадо богаты серотонином. При их употреблении за 2-3 дня до исследования мочи на содержание 5-оксииндолуксусной кислоты даже у здорового человека её концентрация может стать повышенной. Диета с низким содержанием соли может приводить к повышению уровня альдостерона в 3-5 раз. Напитки, богатые кофеином, увеличивают концентрацию в крови свободных жирных кислот, стимулируют выброс надпочечниками катехоламинов и повышают активность ренина.
Прием алкоголя
Алкоголь снижает в крови концентрацию глюкозы, повышает концентрацию молочной кислоты, мочевой кислоты и триглицеридов. Прямое токсическое воздействие алкоголя на печень повышает активность в крови печеночных ферментов. Повышенное содержание в крови углевод-дефицитного трансферрина, холестерина, мочевой кислоты, активности гамма-глутамилтрансферазы (ГГТ) и увеличение среднего объема эритроцитов свидетельствует о хроническом алкоголизме.
Физическая нагрузка
Может оказывать как временное, так и продолжительное влияние. Преходящие изменения вначале проявляются снижением, а затем увеличением концентрации свободных жирных кислот в крови, двухкратным повышением концентрации аммиака и трехкратным — молочной кислоты. 1-2 часовые активные занятий в спортзале или 1-2 часовая игра в футбол приводит к временным изменениям активности креатинфосфокиназы (КФК), которые наблюдаются при обширных трансмуральных инфарктах. В меньшей степени повышается активность аспартатаминотрансферазы (АСТ) и лактатдегидрогеназы (ЛДГ). Эта ферментативная активность остается повышенной в течение суток. Физические упражнения влияют на показатели гемостаза: активируют свертывание крови и функциональную активность тромбоцитов. Длительная физическая нагрузка увеличивает концентрацию в крови половых гормонов, таких как тестостерон, андростендион и лютеинизирующий гормон (ЛГ).
При длительном постельном режиме, иммобилизации, малоподвижном образе жизни и ограничении физической активности повышается протромботический потенциал крови, возрастает риск спонтанного тромбообразования. Также, при длительной иммобилизации увеличивается выделение с мочой норадреналина, кальция, хлора, фосфатов, аммиака, в крови возрастает активность щелочной фосфатазы.
Курение
Никотин и другие содержащиеся в табачной продукции вещества (их более 2000) изменяют секрецию некоторых биологически активных веществ. Курение приводит к увеличению концентрации гемоглобина, количества и объёма эритроцитов, снижает количество лейкоцитов. У курильщиков повышается концентрация карбоксигемоглобина, катехоламинов и кортизола. Изменение концентрации этих гормонов приводит к снижению количества эозинофилов; содержание нейтрофилов, моноцитов и свободных жирных кислот увеличивается. Потребление большого количества сигарет сопровождается также повышением активности гамма-глутамилтрансферазы (ГГТ).
Эмоциональный стресс
Страх, испуг в момент взятия крови, боязнь операции, волнение перед визитом к врачу может влиять на результаты лабораторных исследований. Стрессорные воздействия сопровождаются временным лейкоцитозом; в крови снижается концентрация железа; увеличивается уровень катехоламинов, альдостерона, кортизола, инсулина, пролактина, ангиотензина, ренина, соматотропного гормона, тиреотропного гормона (ТТГ), повышается концентрация альбумина, глюкозы, холестерина, фибриногена. Сильное беспокойство, сопровождаемое глубоким и учащенным дыханием, вызывает дисбаланс кислотно-щелочного равновесия со снижением концентрации в крови молочной и жирных кислот.
Пол пациента
Практически для всех лабораторных показателей установлены достоверные половые различия. В большей степени это относится к содержанию в крови гормонов (прогестерона, эстрадиола, тестостерона, 17-ОН прогестерона, лютеинизирующего гормона, фолликулостимулирующего гормона, пролактина), транспортных белков и биологически активных соединений. В меньшей степени это относится к другим соединениям и форменным элементам крови, но и там различия могут быть существенны.
Возраст пациента
Содержание в крови большинства диагностически значимых веществ зависит от возраста и может значительно изменяться от рождения до старости. Наиболее ярко возрастные изменения проявляются в содержании гемоглобина, билирубина, активности щелочной фосфатазы, показателей липидного обмена, половых гормонов, адренокортикотропного гормона (АКТГ), альдостерона, ренина, гормон роста, паратгормона, дегидроэпиандростерона. С возрастом может меняться содержание маркеров онкологической настороженности, например простатаспецифического антигена (ПСА).
Расовая принадлежность
Для некоторых лабораторных показателей установлены различия нормальных значений между людьми отдельных рас. В сложных клинических ситуациях эти различия нужно учитывать при оценке результатов лабораторных исследований.
Индивидуальные уровни нормальных значений
Установленные нормальные (референтные) значения лабораторных показателей, дифференцированные в зависимости от пола, возраста и технологии анализа, характеризуют группу людей в целом. Однако, внутри любой возрастно-половой группы между отдельными здоровыми людьми наблюдаются также индивидуальные различия. Для некоторых лабораторных показателей эти различия между людьми одного пола и возраста могут быть многократными. С развитием лабораторных технологий, повышением точности исследований, накоплением медицинских знаний таким различиям придается все большее значение. Причина в том, что результаты исследований, присущие одному здоровому человеку, могут говорить о патологическом процессе в организме другого человека, особенно при рассмотрении их в динамике.
Беременность
Беременность является нормальным физиологическим процессом, который сопровождается перестройкой работы многих органов, значительными изменениями выработки половых и тиреоидных гормонов, транспортных белков, адренокортикотропного гормона (АКТГ), ренина, а также целого ряда биохимических и гематологических показателей. Для правильной интерпретации результатов нужно знать срок беременности, когда была взята исследуемая проба крови.
Менструальный цикл
Содержание женских половых гормонов изменяется в широком диапазоне в зависимости от фазы менструального цикла. Оценка результата таких исследований возможна только с привязкой к фазам цикла, для каждой из которых характерны свои диапазоны нормальных значений. Перед исследованием следует уточнить у врача оптимальные дни для взятия крови на анализ уровня фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), пролактина, прогестерона, эстрадиола, 17-ОН-прогестерона, андростендиона, ингибина и антимюллерова гормона (АМГ). Изменения гормонального фона могут также отражаться на результатах биохимических и гематологических лабораторных исследований. Для правильной интерпретации результатов важно точно указать день менструального цикла, когда была взята исследуемая проба крови.
Биологические ритмы
Все процессы в организме человека подвержены циклическим ритмам, таким, как циркадные и сезонные. Их влияние отражается на результатах лабораторных исследований. Циркадные (суточные) ритмы наиболее выражены для кортизола, адренокортикотропного гормона (АКТГ), альдостерона, пролактина, ренина, тиреотропного гормона (ТТГ), паратгормона и тестостерона. Отклонения их концентрации от среднесуточных значений могут достигать 400%, что обязательно должно приниматься во внимание. Например, циркадный ритм кортизола может быть причиной недостоверных результатов теста на толерантность к глюкозе, если он проводится во второй половине дня. Определяя индивидуальный циркадный ритм секреции гормона, когда в течение суток берется несколько проб анализируемого материала, в сопроводительных документах необходимо указывать точное время взятия каждой из них.
На циркадные ритмы, общие для всех людей, могут накладываться индивидуальные ритмы сна, еды и физической активности. В некоторых случаях следует учитывать сезонные влияния. Например, содержание гормона щитовидной железы трийодтиронина летом на 20% ниже, чем зимой. Содержание тестостерона, наоборот, несколько возрастает в теплое время года.
Прием лекарственных препаратов
Влияние лекарственных препаратов на результаты лабораторных тестов может быть двояким. Нужно различать действие препаратов:
а) Прием которых ожидаемо приводит к изменению результатов лабораторных исследований и действие которых контролируется по этим результатам. При проведении такого мониторинга точное время взятия крови является очень важным параметром для правильной интерпретации результатов.
б) Лабораторный контроль за действием которых не предусмотрен, но которые способны повлиять на правильность результатов лабораторных исследований. Эти препараты и их метаболиты могут привести к получению неправильных результатов лабораторных исследований, оказывая незапланированное влияние на физиологические процессы или негативно воздействовать на технологии лабораторного анализа. Например, уровень тиреотропного гормона (ТТГ) снижается при лечении допамином, концентрация тиреоидных гормонов тироксина и трийодтиронина изменяется при введении фуросемида, даназола, амиодарона и салицилатов, а применение некоторых антиантацидных препаратов может повышать уровень пролактина у мужчин. Присутствие в биологическом материале контрацептивов, салицилатов, андрогенов может специфически (перекрестные реакции) или не специфически (интерференция) влиять на результаты лабораторных исследований при определении стероидных и тиреоидных гормонов, а также связывающих белков крови. Это лишь краткая иллюстрация множества возможных воздействий. Проведение медикаментозной терапии, могущей искажать результаты анализа, следует обязательно учитывать при назначении лабораторных исследований.
По этим причинам лекарства, мешающие лабораторному анализу, если они назначены не по жизненным показаниям; принимают после взятия биоматериала. Это относится и к любым внутривенным инфузиям. Загрязнение лабораторных проб инфузионными растворами — обычная и часто встречающаяся причина получения неправильных результатов лабораторных исследований. Для исключения этого пробы следует брать из другой руки, из вены, в которую не проводится вливание. Рекомендуется информировать лабораторию о том, когда и какое вливание было проведено пациенту и когда была взята проба крови.
Диагностические и лечебные мероприятия
На результаты лабораторных исследований могут повлиять оперативные вмешательства, эндоскопия, диализ, внутривенные инфузии, пункции, инъекции, биопсии, пальпация, общий массаж, тепловые процедуры, эргометрия, функциональные тесты, введение рентгеноконтрастных веществ, лучевая и химиотерапия. Например, уровень простатаспецифического антигена (ПСА) может быть повышен в течение нескольких дней после массажа простаты, пальцевого исследования прямой кишки или катетеризации мочевого пузыря. Любые манипуляции с молочной железой или тепловые процедуры (например, сауна) приводят к увеличению уровня пролактина. Чтобы предотвратить такое влияние, пробы необходимо забирать до выполнения диагностических процедур, способных исказить результаты теста.
Прочие факторы
Среди прочих факторов, влияющих на результаты лабораторных исследований, имеют значение географическое положение местности, высота над уровнем моря и температура окружающей среды.
Положение тела при заборе крови
Положение тела пациента также влияет на ряд показателей. Переход из положения лёжа в положение сидя или стоя приводит к гидростатическому проникновению воды и фильтрующихся веществ из внутрисосудистого пространства в межклеточное (т.н. интерстициальное), составляющее 1/6 общего объема тела. Клетки крови, вещества, имеющие большую молекулярную массу и связанные с ними не могут проникнуть в ткани и остаются в сосудистом русле. Поэтому их концентрация в крови повышается, в среднем на 5-15%. С этим связана стандартизация положения пациента при взятии крови.
Способ и место забора крови
Участок тела пациента, используемый для взятия крови и техника забора также могут оказать существенное влияние на результаты лабораторных исследований. Лучшее место для забора крови на анализы — локтевая вена. Венозная кровь — лучший материал не только для определения биохимических, гормональных, серологических, иммунологических показателей, но и для общеклинического исследования. Это обусловлено тем, что применяемые в настоящее время гематологические анализаторы, с помощью которых проводят общеклинические исследования, предназначены для работы с венозной кровью. В странах, где их производят, они сертифицированы и стандартизированы для работы только с венозной кровью. Выпускаемые калибровочные и контрольные материалы также предназначены для работы гематологических анализаторов именно с венозной кровью. Помимо этого, при заборе крови из пальца есть методические особенности, которые стандартизировать очень трудно: попадание в образец значительных количеств тканевой (межклеточной) жидкости, нарушение периферического кровотока, необходимость в разведении образца и др., что приводит к ошибкам, низкой точности и воспроизводимости результатов.
Использование капиллярной крови для исследований свертывающей системы (системы гемостаза) не приемлемо в принципе. Это связано с неизбежным попаданием в образец значительных количеств тканевой (межклеточной) жидкости. Тканевая жидкость содержит тканевый тромбопластин, активирующий свертывающую систему, что приведет к получению совершенно неправильных результатов.
Важны также способ и продолжительность наложения жгута на руку при заборе крови. Наложение жгута на период более 2 мин при заборе крови из вены может привести к увеличению концентрации в пробе белков, факторов коагуляции и клеточных элементов.
Капиллярную кровь из пальца для лабораторных исследований допустимо использовать лишь в следующих случаях:
-
При ожогах, занимающих большую площадь поверхности тела пациента.
-
При наличии у пациента очень мелких вен или их плохой доступности.
-
При выраженном ожирении пациента с затрудненным доступом к венам.
-
При установленной склонности к венозному тромбозу.
-
У новорождённых.
Пункцию артерий для забора крови используют редко (преимущественно для исследования газового состава артериальной крови).
Хранение и транспортировка биологических материалов
Чувствительность компонентов биологических материалов, имеющих диагностическое значение и изучаемых в лабораториях, очень различна. Некоторые из этих компонентов способны выдерживать хранение и транспортировку при соблюдении определенных условий, другие – нет. По экономическим соображениям принято считать, что с использованием современных систем забора, методов консервации, соблюдении температурных режимов, хранение и транспортировка биологических материалов в течение ограниченного времени допустимы.
В ряде случаев это так. Тем не менее, известно, что многие важнейшие лабораторные показатели допускают очень ограниченную задержку между забором биологического материала и началом исследования. Ситуация еще больше осложняется тем, что одни компоненты лучше сохраняются при охлаждении, тогда как другие, наоборот, в таких условиях претерпевают ускоренную деградацию. Как очевидно, это значительно затрудняет хранение и транспортировку биологических материалов, учитывая, что компоненты с такими разными свойствами зачастую содержатся в одной пробирке. Нужно также учитывать различие между декларируемыми и реальными условиями сбора, хранения и доставки биологических материалов. При этом, стабильность многих компонентов крови и мочи в условиях лабораторной практики остается неизвестной.
Согласно ГОСТ Р 53079.4-2008 «Обеспечение качества клинических лабораторных исследований. Часть 4. Правила ведения преаналитического этапа», время доставки образцов в лабораторию не должно превышать 30-60 минут (для мочи – 90 минут), время от забора крови до ее центрифугирования (обязательный этап биохимических и коагулологических исследований) не должно превышать 1 часа. Также, согласно этому документу и другим авторитетным рекомендациям:
-
Не рекомендуется транспортировка образцов цельной крови, используемой, в частности, для проведения ее клинического анализа.
-
Определение скорости оседания эритроцитов (СОЭ) требует начала исследования не позднее 2-х часов с момента забора крови.
-
Моча, собранная для общего анализа крови, может храниться не более 2-х часов, причем применение консервантов нежелательно.
-
Для достоверного дифференциального подсчета лейкоцитарной формулы мазок крови должен быть приготовлен не позднее 3-х часов после ее забора.
Установлено, что в пробах крови, полученных от пациентов с выявленной патологией, могут усиливаться изменения, обычно наблюдаемые под влиянием времени и температуры. Это еще больше сокращает время допустимого хранения и транспортировки биологических материалов, поскольку стабильность компонентов может отличаться у разных пациентов.
Известно, что наименьшей стабильностью обладают показатели, характеризующие состояние свертывающей системы крови. Стандартным условием является проведение общих скрининговых исследований свертывающей системы в течение максимум 4-х часов с момента забора крови. Для т.н. интегральных исследований свертывающей системы крови (исследование тромбодинамики, тромбоэластография) временная задержка, связанная с транспортировкой образцов, недопустима в принципе – получение неправильных, дезориентирующих врача результатов происходит уже после 30-45-минутного промедления. Исследование тромбоцитарного звена свертывающей системы крови еще более уникально – это единственное из более чем 2500 лабораторных исследований, ведущееся на живых клетках. Последнее абсолютно исключает как транспортировку, так и любую задержку начала работы. Все сказанное тем более важно, что судить о состоянии свертывающей системы крови по концентрации или активности отдельных ее компонентов нельзя – значение имеет работа всей системы в целом.
Периодичность лабораторных исследований
Повторные исследования широко используются для оценки эффективности проводимого лечения и прогнозировании исхода заболевания, лекарственном мониторинге, постановке симуляционных тестов. Чтобы избежать получения ошибочных результатов, интервалы между исследованиями должны выбираться с учетом продолжительности «жизни» определяемого вещества в организме, динамики его накопления и выведения при нормальных и патологических процессах, фармакокинетических свойств лекарственных препаратов.
ММА имени И.М. Сеченова
Железодефицитная анемия (ЖДА) – клинико–гематологический синдром, характеризующийся нарушением синтеза гемоглобина в результате дефицита железа, развивающегося на фоне различных патологических (физиологических) процессов, и проявляющийся признаками анемии и сидеропении.
Важность проведения рациональной и эффективной терапии ЖДА обусловлена медико–социальным значением и высокой распространенностью данного состояния среди населения, особенно женщин детородного возраста, т.к:
- женщины детородного возраста составляют основную группу риска развития ЖДА
- запасы железа в организме женщин в 3 раза меньше, чем у мужчин
- потребление железа у девушек и фертильных женщин в развитых странах (США) составляет 55–60% от должного
- ЖДА составляет 75–95% всех анемий беременных
- в России около 12% женщин детородного возраста страдают ЖДА
- латентный дефицит железа в некоторых регионах России достигает 50%.
Диагностика железодефицитной анемии
Этапы диагностического поиска:
1 – диагностика гипохромной анемии
1 – диагностика гипохромной анемии
2 – диагностика железодефицитного характера анемии
3 – диагностика причины ЖДА.
1. Диагностика гипохромной анемии. Все ЖДА являются гипохромными. Поэтому гипохромный характер анемии является ключевым признаком, позволяющим заподозрить в первую очередь ЖДА и определить дальнейшее направление диагностического поиска.
Врач–клиницист при трактовке результатов анализа крови должен обязательно обращать внимание не только на цветовой показатель (может быть рассчитан неправильно при ошибке в подсчете лаборантом количества эритроцитов), но и на морфологическую картину эритроцитов, которая описывается врачом–лаборантом при просмотре мазка (например, гипохромия, микроцитоз и т.д.).
2. Диагностика железодефицитного характера анемии (дифференциальный диагноз гипохромной анемии). Не все гипохромные анемии являются железодефицитными. С учетом этого наличие гипохромной анемии не исключает гипохромные анемии другого происхождения В связи с этим на данном этапе диагностического поиска необходимо проведение дифференциальной диагностики между ЖДА и так называемыми сидероахрестическими (ахрезия – неиспользование) анемиями. При сидероахрестических анемиях (групповое понятие), обозначаемых также, как железонасыщенные анемии, содержание железа в организме находится в пределах нормы или даже имеется его избыток, однако в силу различных причин железо не используется для построения гема в молекуле гемоглобина, что в итоге ведет к образованию гипохромных эритроцитов с низким содержанием гемоглобина. Неиспользованное железо поступает в запасы, откладывается в органах и тканях (печень, поджелудочная железа, кожа, макрофагальная система и др.), приводя к развитию гемосидероза.
Правильно распознавать ЖДА и отличить ее от сидероахрестических анемий чрезвычайно важно, так как ошибочный диагноз ЖДА у больных железонасыщенными анемиями может повлечь за собой неоправданное назначение таким больным препаратов железа, что в данной ситуации приведет к еще большей «перегрузке» органов и тканей железом. При этом лечебный эффект от препаратов железа будет отсутствовать.
Основными гипохромными анемиями, с которыми следует проводить дифференциальный диагноз ЖДА, являются следующие:
- анемии, связанные с нарушением синтеза гема, возникающие в результате угнетения активности некоторых ферментов (гемсинтетаза), обеспечивающих включение железа в молекулу гема. Этот ферментный дефект может иметь наследственную природу (наследственные сидероахрестические анемии) или возникать в результате воздействия некоторых медикаментов (изониазид, ПАСК и др.), хронической алкогольной интоксикации, контакта со свинцом и др.;
- талассемия, относится к группе наследственных гемолитических анемий, связанных с нарушением синтеза глобина – белковой части гемоглобина. Заболевание имеет несколько вариантов и характеризуется признаками гемолиза (ретикулоцитоз, повышение уровня непрямого билирубина, увеличение селезенки), высоким содержанием железа в сыворотке и в депо, гипохромной анемией. Фактически при талассемии речь также идет о сидероахрезии, т.е. о неиспользовании железа, но не в результате дефектов ферментов, участвующих в синтезе гема, а вследствие нарушения процесса построения молекулы гемоглобина в целом из–за патологии глобиновой его части;
- анемии, связанные с хроническими заболеваниями. Этим термином принято обозначать группу анемий, возникающих у больных на фоне различных заболеваний, чаще всего воспалительного характера (инфекционных и неинфекционных). Примером могут служить анемии при нагноительных заболеваниях различной локализации (легкие, брюшная полость, остеомиелит), сепсисе, туберкулезе, инфекционном эндокардите, ревматоидном артрите, злокачественных опухолях при отсутствии хронических кровопотерь. При всем многообразии патогенетических механизмов анемии в данных ситуациях одним из основных считается перераспределение железа в клетки макрофагальной системы, активирующейся при воспалительных и опухолевых процессах. Поскольку истинного дефицита железа при этих анемиях не наблюдается, более оправданно говорить не о ЖДА, а о железоперераспределительных анемиях. Последние носят, как правило, умеренно гипохромный характер, содержание железа в сыворотке может быть незначительно снижено, ОЖСС обычно в пределах нормы или умеренно снижена, что отличает этот вариант анемий от ЖДА. Характерно повышение уровня ферритина в крови. Понимание и правильная трактовка патогенетических механизмов развития анемий при вышеуказанных заболеваниях позволяют врачу воздерживаться от назначения этим больным препаратов железа, которые обычно малоэффективны.
Таким образом, о наличии ЖДА можно говорить в случаях гипохромной анемии, сопровождающейся снижением содержания сывороточного железа, повышением ОЖСС, снижением концентрации ферритина. Во избежание ошибок при трактовке результатов определения содержания железа в сыворотке необходимо учитывать следующие правила и рекомендации:
- исследование должно проводиться до начала лечения препаратами железа. В противном случае, даже при приеме препаратов в течение короткого промежутка времени, полученные показатели не отражают истинного содержания железа в сыворотке. Если препараты железа были назначены, то исследование может проводиться не ранее чем через 7 дней после их отмены;
- трансфузии эритроцитов, нередко проводимые до уточнения природы анемии (выраженное снижение уровня гемоглобина, признаки сердечной недостаточности и т. д.), также искажают оценку истинного содержания железа в сыворотке;
- для исследования сыворотки на содержание железа должны использоваться специальные пробирки, дважды промытые дистиллированной водой, так как использование для мытья водопроводной воды, содержащей незначительные количества железа, влияет на результаты исследования. Для высушивания пробирок не следует использовать сушильные шкафы, так как с их стенок при нагревании в посуду попадает незначительное количество железа;
- в настоящее время для исследования железа принято использовать в качестве реактива батофенантралин, образующий с ионами железа цветной комплекс со стойкой окраской и высоким молярным коэффициентом экстинкции; точность метода довольно высока;
- кровь для анализа следует брать в утренние часы, так как имеют место суточные колебания концентрации железа в сыворотке (в утренние часы уровень железа выше);
- на показатели содержания железа в сыворотке оказывают влияние фаза менструального цикла (непосредственно перед менструацией и во время нее уровень сывороточного железа выше), беременность (повышение содержания железа в первые недели беременности), прием оральных контрацептивов (повышение), острые гепатиты и циррозы печени (повышение). Могут наблюдаться случайные вариации исследуемых показателей.
3. Выявление причины ЖДА. После подтверждения железодефицитного характера анемии, т. е. верификации синдрома ЖДА, не менее важной задачей является установление причины данного анемического синдрома. Распознавание причины развития ЖДА в каждом конкретном случае является конечным этапом диагностического поиска. Ориентация на нозологическую диагностику очень важна, так как в большинстве случаев при лечении анемии можно воздействовать на основной патологический процесс.

Алгоритм диагностики железодефицитных анемий
В основе развития ЖДА лежат разнообразные причины, среди которых основное значение имеют следующие:
– хронические кровопотери различной локализации (желудочно–кишечные, маточные, носовые, почечные) вследствие различных заболеваний;
– нарушение всасывания поступающего с пищей железа в кишечнике (энтериты, резекция тонкого кишечника, синдром недостаточного всасывания, синдром «слепой петли»);
– повышенная потребность в железе (беременность, лактация, интенсивный рост и др.);
– алиментарная недостаточность железа (недостаточное питание, анорексии различного происхождения, вегетарианство и др.).

Причины железодефицитных анемий
Лечение ЖДА
При выявлении причины развития ЖДА основное лечение должно быть направлено на ее устранение (оперативное лечение опухоли желудка, кишечника, лечение энтерита, коррекция алиментарной недостаточности и др.). Однако в целом ряде случаев радикальное устранение причины ЖДА не представляется возможным (например, при продолжающихся меноррагиях, наследственных геморрагических диатезах, проявляющихся носовыми кровотечениями, у беременных, а также при некоторых других ситуациях). В таких случаях основное значение приобретает патогенетическая терапия железосодержащими лекарственными препаратами.
При выявлении причины развития ЖДА основное лечение должно быть направлено на ее устранение (оперативное лечение опухоли желудка, кишечника, лечение энтерита, коррекция алиментарной недостаточности и др.). Однако в целом ряде случаев радикальное устранение причины ЖДА не представляется возможным (например, при продолжающихся меноррагиях, наследственных геморрагических диатезах, проявляющихся носовыми кровотечениями, у беременных, а также при некоторых других ситуациях). В таких случаях основное значение приобретает патогенетическая терапия железосодержащими лекарственными препаратами.
Лекарственные препараты железа (ПЖ) являются средством выбора для коррекции дефицита железа и уровня гемоглобина у больных ЖДА. ПЖ следует предпочитать пищевым продуктам, содержащим железо.

Лекарственные препараты железа для лечения железодефицитных анемий
В настоящее время в распоряжении врача имеется большой арсенал лекарственных ПЖ, характеризующихся различным составом и свойствами, количеством содержащегося в них железа, наличием дополнительных компонентов, влияющих на фармакокинетику препарата, лекарственной формой.
В клинической практике лекарственные ПЖ применяются внутрь или парентерально. Путь введения препарата у больных ЖДА определяется конкретной клинической ситуацией. Кроме того, все железосодержащие препараты могут быть разделены на две группы – препараты солей железа и препараты в виде железосодержащих комплексов, имеющие некоторые отличительные свойства (состав, фармакокинетика, переносимость и т.д.), см. табл. 1.

Принятие решения о назначении препаратов железа
1. Путь введения препаратов железа
1. Путь введения препаратов железа
Клиническая ситуация
В подавляющем большинстве случаев препараты железа следует назначать внутрь.
Парентерально препараты железа могут применяться при следующих клинических ситуациях:
– нарушение всасывания при патологии кишечника (энтериты, синдром недостаточности всасывания, резекция тонкого кишечника, резекция желудка по Бильрот II с включением двенадцатиперстной кишки);
– обострение язвенной болезни желудка или двенадцатиперстной кишки;
– непереносимость ПЖ для приема внутрь, не позволяющая продолжать лечение;
– необходимость более быстрого насыщения организма железом, например, у больных ЖДА, которым предстоят оперативные вмешательства (миома матки, геморрой и др.).
2. Выбор железосодержащего препарата для приема внутрь
- Количество двухвалентного железа
- Наличие в препарате веществ, улучшающих всасывание железа
- Переносимость препарата
При выборе конкретного препарата и оптимального режима дозирования необходимо иметь в виду, что адекватный прирост показателей гемоглобина при наличии ЖДА может быть обеспечен поступлением в организм от 30 до 100 мг двухвалентного железа. Учитывая, что при развитии ЖДА всасывание железа увеличивается по сравнению с нормой и составляет 25–30% (при нормальных запасах железа – всего 3–7%), необходимо назначать от 100 до 300 мг двухвалентного железа в сутки. Применение более высоких доз не имеет смысла, поскольку всасывание железа при этом не увеличивается. Таким образом, минимальная эффективная доза составляет 100 мг, максимальная – 300 мг двухвалентного железа в сутки. Индивидуальные колебания в количестве необходимого железа обусловлены степенью дефицита железа в организме, истощения запасов, скоростью эритропоэза, всасываемостью, переносимостью и некоторыми другими факторами. С учетом этого при выборе лекарственного ПЖ следует ориентироваться не только на содержание в нем общего количества, но главным образом на количество двухвалентного железа, которое всасывается только в кишечнике.
ПЖ следует принимать во время еды. В то же время всасывание железа лучше при приеме лекарственных препаратов перед едой.
Предпочтительнее препараты, содержащие аскорбиновую кислоту (Сорбифер Дурулес). Не рекомендуется запивать препараты железа чаем, так как танин образует с железом плохо растворимые комплексы. Не следует одновременно с препаратами железа принимать препараты кальция, тетрациклиновые и фторхинолоновые антибиотики.
3. Оценка эффективности назначенного препарата
- Количество ретикулоцитов через 7–10 дней после назначения препарата
- Величина и темпы прироста гемоглобина каждую неделю

Вещества, влияющие на всасывание препаратов железа
При назначении ПЖ в достаточной дозе на 7–10–й день от начала лечения наблюдается повышение количества ретикулоцитов. Нормализация уровня гемоглобина отмечается в большинстве случаев через 3–4 недели лечения, но иногда сроки нормализации показателей гемоглобина затягиваются до 6–8 недель и может наблюдать резкое скачкообразное повышение гемоглобина. Эти индивидуальные проявления и особенности могут быть обусловлены выраженностью ЖДА, степенью истощения запасов железа, а также не полностью устраненной причиной (хронические кровопотери и др.).
4. Оценка переносимости препарата при назначении внутрь
- Наблюдение за больными, контроль за лечением
Среди побочных проявлений на фоне применения ПЖ внутрь наиболее часто возникают тошнота, анорексия, металлический вкус во рту, запоры, реже – поносы. Развитие запоров обусловлено, по всей вероятности, связыванием в кишечнике сероводорода, являющегося одним из стимулов кишечной перистальтики. В большинстве случаев современные ПЖ вызывают незначительные побочные явления, требующие их отмены и перехода на парентеральный путь введения.

Оценка переносимости перорального введения препарата железа
Диспептические расстройства могут уменьшаться при приеме препаратов после еды или снижении дозы.
По современным технологиям в настоящее время выпускаются ПЖ с замедленным высвобождением из них железа (Сорбифер Дурулес) благодаря наличию инертных субстанций, из которых через мелкие поры постепенно поступает железо. Это обеспечивает пролонгированный эффект всасывания и сокращает частоту нарушений со стороны желудочно–кишечного тракта.
5. Длительность насыщающей терапии
- Темпы прироста уровня гемоглобина
- Сроки нормализации уровня гемоглобина
- Клиническая ситуация
Продолжительность так называемой насыщающей терапии препаратами железа определяется темпами прироста гемоглобина, а следовательно и сроками нормализации уровня гемоглобина. Это, в свою очередь, может зависеть от активности препарата железа, от степени истощения запасов железа в организме. По нашим данным, высокий темп прироста гемоглобина наблюдается на фоне лечения препаратом сорбифер–дурулес. Средняя величина прироста гемоглобина в сутки составляет при этом около 2 г/л, что позволяет завершить курс насыщающей терапии за 2–3 недели.
6. Необходимость поддерживающей терапии
- Клиническая ситуация (беременность, неустранимые меноррагии и носовые кровотечения и др.)
Лечение оральными препаратами железа
В большинстве случаев для коррекции дефицита железа при отсутствии специальных показаний ПЖ следует назначать внутрь.
В настоящее время на российском фармацевтическом рынке имеется большое количество препаратов железа для приема внутрь – в виде различных солей железа либо в виде железосодержащих комплексов. Препараты различаются количеством содержащихся в них солей железа, в том числе двухвалентного железа, наличием дополнительных компонентов (аскорбиновая и янтарная кислоты, витамины, фруктоза и др.), лекарственными формами (таблетки, драже, сиропы, растворы) и стоимостью.
Основные железосодержащие препараты представлены в виде сульфата железа, глюконата, хлорида, фумарата железа, глицинсульфата, причем наибольшей степенью абсорбции обладают препараты сульфата железа, а наименьшей – глицинсульфата.
В таблице 2 представлены основные зарегистрированные в России лекарственные ПЖ в виде солей и железосодержащих комплексов для приема внутрь. Причины неэффективности терапии препаратами железа внутрь и способы коррекции приведены в таблице 3.
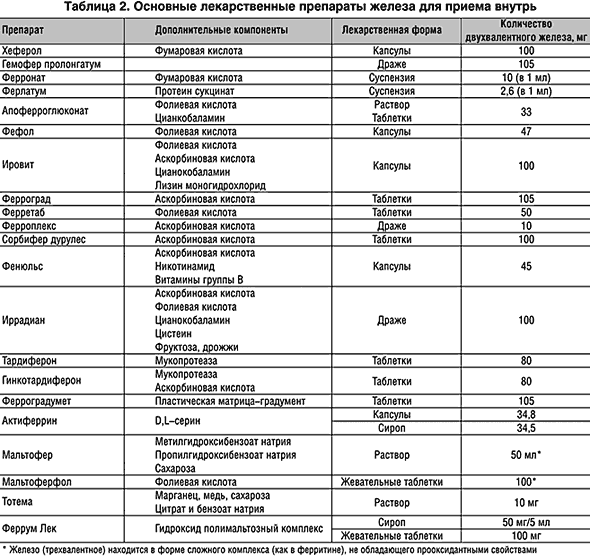

Лечение препаратами железа для парентерального введения
В отличие от ПЖ для приема внутрь в инъекционных препаратах железо всегда находится в трехвалентной форме.
В отличие от ПЖ для приема внутрь в инъекционных препаратах железо всегда находится в трехвалентной форме.
На фоне парентерального лечения ПЖ, особенно при внутривенном применении, нередко возникают аллергические реакции в виде крапивницы, лихорадки, анафилактического шока. Кроме того, при внутримышечном введении ПЖ может возникать потемнение кожи в местах инъекций, инфильтраты, абсцессы. При внутривенном введении возможно развитие флебитов. Если ПЖ для парентерального введения назначают больным гипохромной анемией, не связанной с дефицитом железа, имеется повышенный риск возникновения тяжелых нарушений из–за «перегрузки» железом различных органов и тканей (печень, поджелудочная железа и др.) с развитием гемосидероза. В то же время при ошибочном назначении ПЖ внутрь никогда не наблюдается возникновение гемосидероза.
В таблице 4 представлены ПЖ, использующиеся для парентерального введения.

Тактика лечения ЖДА при различных клинических ситуациях
Лечение больных ЖДА имеет свои особенности в зависимости от конкретной клинической ситуации с учетом многих факторов, в том числе характера основного заболевания и сопутствующей патологии, возраста больных (дети, старики), выраженности анемического синдрома, дефицита железа, переносимости ПЖ и др. Далее приводятся наиболее часто встречающиеся в клинической практике ситуации и некоторые особенности лечения больных ЖДА.
Лечение больных ЖДА имеет свои особенности в зависимости от конкретной клинической ситуации с учетом многих факторов, в том числе характера основного заболевания и сопутствующей патологии, возраста больных (дети, старики), выраженности анемического синдрома, дефицита железа, переносимости ПЖ и др. Далее приводятся наиболее часто встречающиеся в клинической практике ситуации и некоторые особенности лечения больных ЖДА.
ЖДА у новорожденных и детей. Основной причиной ЖДА у новорожденных считается наличие ЖДА или скрытого дефицита железа у матери во время беременности. У детей раннего возраста наиболее частой причиной ЖДА является алиментарный фактор, в частности, вскармливание исключительно молоком, поскольку содержащееся в женском молоке железо всасывается в незначительных количествах. Среди ПЖ, которые показаны новорожденным и детям наряду с соответствующей коррекцией питания (витамины, минеральные соли, животный белок), следует назначать препараты для приема внутрь, содержащие малые и средние дозы двухвалентного железа (10–45 мг). Предпочтительнее назначение ПЖ в каплях или в виде сиропа. У детей раннего возраста удобно применение полимальтозного комплекса железа в виде жевательных таблеток (мальтоферфол).
ЖДА у девушек–подростков является чаще всего следствием недостаточных запасов железа в результате дефицита железа у матери во время беременности. При этом имеющийся у них относительный дефицит железа в период интенсивного роста и с появлением менструальных кровопотерь может приводить к развитию клинико–гематологических признаков ЖДА. Таким больным показана терапия ПЖ для приема внутрь. Целесообразно использование препаратов сульфата железа, содержащих различные витамины, так как в период интенсивного роста повышается потребность в витаминах группы А, В, С. После восстановления показателей гемоглобина до нормальных значений следует рекомендовать повторные курсы лечения, особенно если устанавливаются обильные месячные или имеются другие незначительные кровопотери (носовые, десневые).
ЖДА у беременных является самым частым патогенетическим вариантом анемий, возникающих во время беременности. Чаще всего ЖДА диагностируется во II–III триместре и требует коррекции лекарственными ПЖ. Целесообразно назначать препараты сульфата железа, содержащие аскорбиновую кислоту. Содержание аскорбиновой кислоты должно превышать в 2–5 раз количество железа в препарате. Суточные дозы двухвалентного железа у беременных с нетяжелыми формами ЖДА могут не превышать 100 мг, так как при более высоких дозах вероятно возникновение различных диспептических расстройств, к которым и без того склонны беременные. Комбинации ПЖ с витамином В12 и фолиевой кислотой, а также ПЖ, содержащими фолиевую кислоту, не оправдан, так как фолиеводефицитная анемия у беременных возникает редко и имеет специфические клинико–лабораторные признаки.
Парентеральный путь введения ПЖ у большинства беременных без специальных показаний следует считать нецелесообразным. Лечение ПЖ при верификации ЖДА у беременных должно проводиться до конца беременности. Это имеет принципиально важное значение не только для коррекции анемии у беременной, но главным образом для профилактики дефицита железа у плода.
По рекомендации ВОЗ все беременные на протяжении II–III триместров беременности и в первые 6 мес лактации должны получать ПЖ.
ЖДА у женщин, страдающих меноррагиями. Независимо от причины меноррагий (миома, эндометриоз, дисфункция яичников, тромбоцитопатии и др.) и необходимости воздействия на соответствующий фактор, необходима длительная терапия ПЖ для приема внутрь. Доза, режим дозирования и конкретный ПЖ подбираются индивидуально с учетом содержания железа в препарате, его переносимости и т.д. При выраженной анемии с клиническими признаками гипосидероза целесообразно назначение препаратов с высоким содержанием двухвалентного железа (100 мг), что позволяет, с одной стороны, осуществлять адекватную компенсацию дефицита железа, а с другой – облегчает и делает более удобным прием железосодержащих препаратов (1–2 раза в сутки). После нормализации уровня гемоглобина необходимо проводить поддерживающую терапию ПЖ в течение 5–7 дней после окончания менструации. При удовлетворительном состоянии и стабильных показателях гемоглобина возможны перерывы в лечении, которые, однако, не должны быть длительными, так как продолжающиеся у женщин меноррагии быстро истощают запасы железа с риском рецидива ЖДА.
ЖДА у больных с нарушением всасывания (энтериты, резекция тонкого кишечника, синдром «слепой петли») требует назначения ПЖ для парентерального введения наряду с лечением основного заболевания. Назначают ПЖ в виде железо–полимальтозного комплекса для внутримышечного или для внутривенного введения. Не следует применять более 100 мг железа в сутки (содержание 1 ампулы препарата). Следует помнить о возможности развития побочных явлений при парентеральном введении ПЖ (флебиты, инфильтраты, потемнение кожи в местах инъекций, аллергические реакции).
ЖДА у лиц пожилого и старческого возраста может иметь полиэтиологический характер. Так, например, причинами развития ЖДА у данного возрастного контингента могут быть хронические кровопотери на фоне опухолевого процесса в желудке, толстом кишечнике (трудно выявляемая локализация опухоли у стариков), нарушение всасывания, алиментарная недостаточность железа и белка. Возможны случаи сочетания ЖДА и В12–дефицитной анемии. Кроме того, признаки ЖДА могут появляться у больных В12–дефицитной анемией (наиболее частый анемический синдром в позднем возрасте) на фоне лечения витамином В12. Возникающая при этом активация нормобластического кроветворения требует повышенного расхода железа, запасы которого у стариков по различным причинам могут быть ограничены.
Если по объективным причинам не представляется возможным верифицировать ЖДА у стариков (тяжесть состояния, декомпенсация сопутствующей патологии, отказ от обследования и т.д.), то правомочно назначение пробного лечения ПЖ в виде солей железа (сульфат железа, фумарат железа) или в виде железо–полимальтозного комплекса внутрь (при отсутствии признаков нарушения всасывания) с высоким содержанием железа. Ориентиром для правильности выбранной тактики и дальнейшего продолжения лечения ПЖ может быть повышение количества ретикулоцитов по сравнению с исходным через 7–10 дней после начала лечения. Тактика лечения ЖДА у различных групп больных представлена в таблице 5.

a:2:{s:4:»TEXT»;s:65535:»a:2:{s:4:»TEXT»;s:65535:»a:2:{s:4:»TEXT»;s:65535:»a:2:{s:4:»TEXT»;s:76136:»
5. Реагенты. Важный компонент системы «автоматизированный анализ крови» — реагенты. Часто лаборатории, купив анализатор, сталкиваются с необходимостью нести довольно ощутимые постоянные затраты на реагенты. Количество разных реагентов, используемых анализатором, существенно влияет на себестоимость и качество исследований.
Каждый конкретный тип гематологического анализатора рассчитан на свою собственную реагентную систему, однако между ними есть много общего.
Основными составляющими комплектов реагентов для гематологических анализаторов являются:
— изотонический разбавитель;
— лизирующий раствор;
— промывающий раствор (после каждой пробы);
— промывающий раствор (для качественной очистки системы);
— очищающий раствор (для экстренной очистки датчика и/или сервисных работ).
В зависимости от конкретной конструкции анализатора в базовый комплект может входить лишь часть указанных реагентов.
Изотонический разбавитель — это буферный раствор с фиксированными параметрами рН, электропроводности и осмолярности. Слово «изотонический» указывает только на одно и не самое важное свойство реагента — поддержание требуемого осмотического давления с целью обеспечения постоянства объема клеток крови. Дело в том, что эритроциты принимают тот объем, который им диктует осмолярность раствора. При увеличении осмолярности, в течение 3-5 с эритроциты сжимаются до некоторого равновесного объема. Если осмолярность раствора уменьшается, объем эритроцитов, соответственно, увеличивается. Таким образом, средний объем эритроцитов (MCV) увязывается с осмолярностью изотонического разбавителя. Использование изотонического разбавителя, не соответствующего марке анализатора, может привести к ложному завышению/занижению MCV.
Стабилизирующие добавки в изотоническом разбавителе должны обеспечивать сохранность форменных элементов крови в первом разведении в течение достаточно длительного времени. Присутствие в растворе антикоагулянта должно эффективно предотвращать образование фибриновых сгустков и агрегацию тромбоцитов.
Очень важными компонентами гематологических реагентов и, в частности, изотонических разбавителей являются антибактериальные добавки, которые препятствуют бактериальному заражению гидравлических магистралей анализаторов. Учитывая тот факт, что бактериостатики, как правило, негативно влияют на клеточные мембраны, их выбор довольно ограничен. Следует иметь в виду, что для всех гематологических анализаторов с дифференциацией лейкоцитов на три популяции основным режимом является работа с цельной кровью. В случае гематологических анализаторов, проводящих дифференциацию лейкоцитов на три популяции, изотонический разбавитель содержит специальные добавки, модифицирующие мембраны лейкоцитов. В этом случае изотонический разбавитель должен применяться в согласованной паре с соответствующим лизирующим раствором.
NB! Нельзя совмещать в пару «изотонический раствор — лизирующий реагент» компоненты от разных производителей!
Другим важнейшим реагентом является лизирующий раствор (гемолитик), который при добавлении в разведение крови вызывает лизис эритроцитов и в то же время сохраняет лейкоциты. Необходимо, чтобы гемолиз эритроцитов был качественный и полный, поскольку в гемолизате подсчитываются лейкоциты, которых первоначально примерно в 1000 раз меньше, чем эритроцитов. Для обеспечения этих свойств лизирующий раствор, как правило, содержит сложную композицию ионных поверхностно-активных соединений. Современные гемолитики обеспечивают быструю реакцию и высокую степень отделения лейкоцитов от стромы независимо от настройки дискриминатора конкретного прибора.
В анализаторах с дифференциацией лейкоцитов на три популяции лейкоциты под действием лизирующего раствора изменяют свои размеры так, что выделяются фракции лимфоцитов (первый пик лейкоцитарной гистограммы), гранулоциты (крайний правый пик лейкоцитарной гистограммы). В средней части гистограммы, в области так называемых средних клеток, расположены моноциты, базофилы и эозинофилы. Наряду с факторами пробоподготовки свойства реагентной системы оказывают существенное влияние на качество дифференциации лейкоцитов.
Промывающие растворы непосредственно не участвуют в процессе измерения, однако их свойства существенно влияют на стабильность аналитических характеристик анализаторов. Характерной особенностью гематологических анализаторов, использующих принцип Культера, является наличие счетных апертур малого диаметра. Кровь содержит в себе ряд веществ, которые имеют тенденцию осаждаться на апертуре и внутренней поверхности гидравлической системы. Это постепенно приводит к уменьшению диаметра, закупорке апертуры и ошибочным результатам. В некоторых случаях прибор просто останавливается и требует тщательной промывки. Таким образом, качество промывающих растворов влияет на долговременную стабильность работы прибора.
Промывающие растворы бывают в основном трех типов. Первый тип — растворы для мягкой промывки магистралей анализатора между пробами, они не содержат поверхностно-активных веществ (детергенты) в значительных концентрациях. К сожалению, детергентные промывающие растворы практически не удаляют белки. Поэтому для очистки от белковых осадков применяют растворы на основе гипохлорита натрия — второй тип промывающих растворов. Эти растворы являются очень сильными депротеинезаторами. Однако раствор гипохлорита натрия — очень едкое вещество, долгого контакта с ним не выдерживают детали из пластика (они трескаются), металла (подвергаются коррозии). Поэтому злоупотреблять такими растворами нельзя. Данные растворы в основном применяются в экстренных случаях, когда необходимо быстро очистить счетную апертуру, а также для сервисных работ.
Современное решение проблемы качественной промывки прибора — применение ферментативных промывающих растворов. Благодаря наличию ферментов, такие растворы эффективно удаляют адсорбированные на стенках гидравлической системы белки и другие вещества. При этом они совершенно нейтральны и не оказывают вредного действия на детали прибора. Трудность создания таких промывающих растворов заключается в известном свойстве ферментов быстро терять активность.
6. Калибровка и контроль качества. Система управления качеством любого исследования складывается из оценки адекватности каждого этапа. Общеклинический анализ крови — не исключение, этапы его выполнения во многом схожи с другими видами лабораторных исследований и отличаются только применяемыми антикоагулянтами и аналитическим оборудованием:
1. Основание для назначения анализа.
2. Подготовка пациента.
3. Взятие биологического материала.
4. Идентификация проб.
5. Обработка биологического материала с использованием антикоагулянтов.
6. Транспортировка проб.
7. Аналитическое исследование на гематологическом анализаторе.
8. Оформление бланка с результатами теста (может выполняться на самом анализаторе).
9. Оценка результата по интервалам норм.
10. Использование результатов в диагностическом процессе.
Первые 6 пунктов включаются в понятие преаналитического этапа. Анализ назначается врачом и, как правило, берется натощак. Раздел 8 руководства подробно описывает правила и условия взятия и обработки проб.
Аналитический этап
Качество результатов исследования крови на гематологических анализаторах определяется следующими факторами:
— качеством используемых реагентов;
— точностью дозирования цельной или разведенной крови;
— точностью дозирования изотонического раствора при разведении крови;
— точностью определения объема суспензии клеток, пропущенной через апертуру;
— точностью самого подсчета клеток;
— точностью определения размеров клеток;
— корректностью математических методов обработки первичных результатов измерения.
Для настройки приборов производители применяют специальные калибровочные микросферы, которые представляют собой стандартные частицы латекса, а также фиксированные эритроциты. Обычно стандарт, выпущенный одной фирмой, не совсем подходит для калибровки приборов других фирм.
Говоря о калибровке, хочется привести пример искажения результатов MCV, связанный с самим методом определения объема частицы. Если откалибровать анализатор взвесью эритроцитов, имеющих нормальную двояковогнутую форму, а затем измерить сферические клетки такого же объема, они будут восприняты как микроциты. И наоборот, если при калибровке применить сфероциты, то прибор будет регистрировать двояковогнутые нормоциты как макроциты. В коммерческих препаратах контрольной крови, применяемой для настройки приборов, эритроциты имеют сферическую форму, поэтому трудно говорить об адекватной калибровке MCV. До настоящего времени нет общепринятого стандарта для MCV.
Калибровка гематологических анализаторов представляет до сих пор не решенную до конца проблему. Если, например, для калибровки ручных методов определения гемоглобина существуют стандарты гемиглобинцианида, то признанных стандартов для калибровки счета клеток не существует. Те взвеси частиц и контрольная кровь, которые предлагают фирмы-производители для контроля своих приборов, калибраторами не являются и предназначены для проведения процедур контроля правильности положения дискриминаторов и счета импульсов. Все применяемые для «калибровки» и контроля работы приборов материалы имеют доверительные интервалы, в которые необходимо уложиться.
Если при калибровке гематологического анализатора показатели не укладываются в допустимые границы паспортных значений, необходимо исключить преаналитические ошибки: недостаточное перемешивание, отличие температуры контрольной крови, извлеченной из холодильника, от комнатной, нарушение режима хранения, приводящее к порче крови. Например, иногда приходилось наблюдать, как контрольную кровь замораживали. При замораживании наблюдается сильное занижение количества эритроцитов. Это бывает при хранении крови в старых моделях холодильников, встречающихся во многих лабораториях, рядом с морозильной камерой. Здесь температура может опускаться на несколько градусов ниже нуля, и этого достаточно для замораживания и последующего разрушения эритроцитов.
Необходимо также провести ряд мероприятий по обслуживанию прибора, по промывке и очистке апертур, затем вновь провести калибровку.
Клетки (частицы) контрольной крови должны удовлетворять следующим требованиям:
— отсутствие электропроводности;
— сопоставимость по размерам с контролируемыми клетками;
— сходная плотность;
— стабильность размеров во времени;
— химическая инертность.
Выпускаемая сегодня контрольная кровь представляет собой химеру, содержащую стабилизированные эритроциты, частицы латекса вместо лейкоцитов, тромбоциты животных и др. Поэтому стабилизированная кровь не является идеальным контрольным материалом, так как у содержащихся в ней клеток изменены размеры, форма поверхности, реологические свойства и специфическая электропроводность.
Следует заметить, что коммерческая контрольная кровь позволяет исследовать от 8-18 параметров и более. Для контроля приборов с дифференциацией лейкоцитов на 3 части используется кровь на 16-18 параметров. Однако необходимо понимать, что калиброванные латексные частицы, имитирующие лейкоциты, не реагируют на действие лизирующего раствора и при анализе не отражают правильность работы всей системы, а лишь правильность установки дискриминаторов. По сути, особого смысла в приобретении такой, более дорогой, крови нет, достаточно использовать контрольную кровь на 8-10 параметров.
Контрольная кровь применяется:
— для проверки правильности и воспроизводимости счета клеток;
— для проверки правильности разведения;
— для «калибровки» прибора.
Ежедневный контроль гематологических исследований включает исследование контрольной крови на анализаторе с каждой серией значений — в области нормы и в области низких и высоких значений. Все правила построения контрольных карт Леви-Дженнингса и оценка результатов по правилам Вестгарда применимы для работы с контрольной кровью, исследуемой на гематологических анализаторах. Поскольку коммерческая контрольная кровь до вскрытия флакона стабильна 4-6 мес, а после вскрытия — 20-30 дней, возможно и необходимо проводить ее анализ через каждые 20 проб пациентов и, конечно же, в каждой серии проб. Это позволяет:
1. Выявить отклонения в результатах исследований еще до того, как они станут клинически значимыми.
2. Получить необходимое количество результатов для более быстрого накопления статистики и построения карт, а также для оперативной оценки воспроизводимости работы прибора.
Многие современные гематологические анализаторы имеют встроенную программу оценки качества исследований, включающую построение контрольных карт.
Для повышения качества проводимых лабораторией исследований очень важно организовать не только внутрилабораторную, но и внешнюю межлабораторную систему управления качеством в форме локального, городского, федерального контроля. Внешний контроль качества позволяет справиться с наиболее трудной задачей — выявлением и устранением систематических ошибок измерений.
7. Обслуживание, консервация прибора. При эксплуатации гематологических анализаторов важную роль играет качество электрической сети и заземления. Внезапные отключения электропитания, перепады напряжения могут привести к выходу из строя микросхем и плат, сбоям в гидравлической системе, что неизбежно повлечет увеличение расходов на ремонт и обслуживание прибора. Приобретая гематологический анализатор, как и любое другое лабораторное оборудование, надо привыкнуть к необходимости затрат не только на расходные материалы, но и на такую важную «деталь», как источник бесперебойного питания с надежной стабилизацией напряжения.
Отключение электропитания на несколько часов в момент отбора и обработки пробы может привести к засорению трубок, апертур, клапанов. Это повлечет сбой дальнейшей работы, необходимость дополнительных процедур промывки и очистки прибора или даже незапланированное обслуживание прибора.
При получении прибора специалист, осуществляющий установку и обучение работе с анализатором, обязательно обратит ваше внимание на необходимость контроля фоновых значений, получаемых при счете в камерах без пробы. Многие приборы делают такой подсчет автоматически при запуске (процедура «start up»). Эта проверка фона дает уверенность в правильном определении параметров. В руководстве оператора к прибору обычно приводятся фоновые значения (табл. 1).

У большинства современных анализаторов есть процедура завершения работы («shut down»). Она позволяет удалить остатки биологического материала из системы, провести промывку прибора и подготовить его к отключению. Процедуры начала и окончания работы обязательны для выполнения.
Одно из действий прибора — заполнение счетных камер и микроотверстий моющим раствором, содержащим протеолитический фермент. Этот раствор находится в камерах несколько часов (ночь). Кровь, даже разведенная анализатором для подсчета, содержит достаточное количество белковых компонентов, постоянно оседающих на трубках, апертурном отверстии. К этим белкам прилипают микроскопические частицы, обломки клеток, бактерии. За несколько десятков циклов счета эта белково-детритная «пленка» может значительно увеличиться и привести к уменьшению диаметра отверстия. В результате — нарушение правильности подсчета (см. рис ).

Фермент, входящий в состав промывающего (моющего, очищающего) раствора, за несколько часов полностью растворяет белковую матрицу пленки и прибор вновь готов к работе.
Неукоснительное выполнение процедуры выключения является одним из факторов нормальной работы гематологического анализатора. Прибор, эксплуатируемый круглосуточно, не подвергается ферментативной очистке, что может привести к значительному изменению диаметра апертуры и нарушению счета. В таком отверстии могут застревать более мелкие частицы (ранее миновавшие апертуру беспрепятственно) и останавливать работу анализатора.
При закупоривании апертуры (сигнал «clog», «clogging») микросгустками, волокнами, частицами, прибор отмечает увеличение времени счета или разницу в количестве частиц, сосчитанных за несколько временны`х отрезков, в зависимости от конструкции прибора. При возникновении такой ситуации прибор обычно реализует запрограммированную процедуру автоматического устранения закупорки. Если самоочистка не приносит успеха, оператору необходимо вручную выполнить следующие действия:
— провести очистку концентрированным ферментативным раствором;
— провести очистку раствором специально приготовленного гипохлорита натрия;
— активизировать из меню прибора процедуру специальной очистки апертуры токами высокой частоты («прожиг» апертуры).
Неэффективность всех этих действий указывает на серьезную механическую закупорку микроотверстия и требует снятия и чистки апертуры в соответствии с инструкцией на прибор. В некоторых случаях может даже потребоваться вмешательство сервисной службы.
Важно помнить, что для обслуживания прибора необходимо всегда четко следовать инструкциям производителя.
Иногда, при эксплуатации гематологических анализаторов, большой проблемой становится высокий фон в канале счета тромбоцитов. Это часто наблюдается при загрязнении разбавителя штаммами бактерий, устойчивых к антибактериальным добавкам. Смена канистры с изотоническим раствором дает кратковременный успех — трубка, перенесенная из одной канистры в другую, заселяет микроорганизмами новую канистру. Через некоторое время бактерии размножаются и фон снова увеличивается. Эта ситуация требует полной дезинфекции гидравлических магистралей прибора, а иногда и замены состава реагентов и антибактериальных добавок в них.
Другой причиной увеличения фона и ложного цитоза может стать рост бактерий и попадание их в счетные камеры по трубкам слива от емкости отходов («waste»). Поверхности от камер до контейнера с отходами покрываются белково-липидной пленкой, на которой, как на питательной среде из агара, прорастают микроорганизмы. Несмотря на антибактериальные добавки, содержащиеся в дилюенте, бактерии быстро размножаются в банке с отходами и «дорастают» до камер счета. Для предотвращения этой проблемы необходимо:
1. Чаще опорожнять емкость с отходами.
2. Периодически проводить дезинфекцию емкости и сливных шлангов (о частоте и способе запросите инструкции у вашей сервисной службы).
3. НЕ ДОПУСКАТЬ соприкосновения конца сливного шланга с поверхностью отходов в канистре.
Консервация прибора
Гематологический анализатор, как и любой прибор, приобретается для того, чтобы работать непрерывно и избавлять лабораторию от трудоемких ручных операций. Приобретение анализатора является осознанной необходимостью. Ситуация с остановкой прибора из-за недостатка финансирования покупки расходных материалов — нонсенс, но встречается часто.
Если все же работу прибора приходится остановить, самое главное — это подготовить анализатор к длительному простою.
Большинство гематологических анализаторов можно остановить не более чем на одну неделю почти без последствий (летом, в жару, опаснее). Более долгий период простоя прибора с реагентами внутри системы приводит к размножению бактерий, высыханию солевых растворов, склеиванию трубок, прижатых клапанами, кристаллизации солей в апертурах, микротрубках. Привести прибор в рабочее состояние после такого безответственного отношения к нему требует множества сил и времени. Случаи оставления приборов с растворами не являются гарантийными, и пользователь вынужден будет оплачивать услуги сервисной службы в гарантийный срок, если не выполнит нескольких простых действий.
Эти действия чаще описаны в руководстве оператора или могут быть запрошены у сервис-инженеров. Процедура консервации в общих чертах выполняется с использованием соответствующих команд меню анализатора следующим образом:
1. Произвести очистку апертур, камер, трубок, гидравлической системы дезинфицирующим раствором (гипохлоритом).
2. Слить из жидкостной системы все реагенты (изотонический разбавитель, лизирующий и моющий растворы).
3. Промыть систему дистиллированной водой.
4. Осушить систему, прокачав воздух.
Теперь прибор готов к длительному ожиданию следующей поставки реагентов.
Совет: если есть небольшой запас изотонического разбавителя и поставка реагентов ожидается в ближайшее время, лучше прекратить выполнять анализы. Прибор необходимо включать и выключать 2-3 раза в неделю, выполняя процедуры начала и окончания рабочего дня («start up» и «shut down») с оставшимися растворами. Это будет поддерживать прибор в рабочем состоянии до поступления новой партии реактивов. Не следует проводить описанные процедуры с использованием дистиллированной воды, в ней нет антибактериальных добавок, прибор в этом случае может стать инкубатором для бактерий и грибков.
8. Преаналитика, ошибки и проблемы. Даже при наличии современного гематологического анализатора лаборатория иногда выдает результаты, не отражающие истинное состояние пациента, вводящие в заблуждение лечащих врачей. Денег в прибор вложено много, а результат не всегда удовлетворительный. В чем причина?
От 70 до 80% лабораторных ошибок связаны с нарушениями на преаналитическом этапе, ошибки аналитического этапа составляют 10-15%, постаналитического — 15-20%.
Ошибки внелабораторного этапа отличают случайность, бессистемность и трудноуловимость. Именно внелабораторные ошибки вносят самый весомый вклад в искажение результатов анализа, маскируются под проблемы, связанные с приборами и реагентами. В таких случаях несоответствие результатов клинической картине или результатам предыдущего обследования заставляет сотрудников лаборатории перепроверять аппаратуру или заменять реагенты. Это приводит к нерациональной трате рабочего времени и средств, а выявить истинную причину проблемы, как правило, не удается.
Взятие образца, его транспортировка, хранение требуют постоянного контроля со стороны лаборатории. Для получения качественных результатов необходимо учитывать присутствие в пробе интерферирующих веществ, индивидуальные особенности пациента, его подготовку к взятию пробы на анализ. Усилия по предотвращению ошибок на этом этапе окупятся ощутимым улучшением качества гематологических исследований, снижением необоснованных повторов, расходов рабочего времени и средств на обследование больного.
Только полностью стандартизуя все этапы гематологического, да и любого другого исследования от назначения до интерпретации результатов, можно ожидать получения адекватных данных.
Техника взятия крови, используемые иглы, скарификаторы, капилляры, пробирки для транспортировки и хранения проб, реагенты и аналитические системы — все должно быть «однородным» изо дня в день. Часть проблем устраняется с внедрением коммерческих систем взятия венозной и капиллярной крови (вакуумных и невакуумных пробирок с антикоагулянтами).
Взятие крови
Материал для анализа. Вена или палец?
Наилучшим материалом для выполнения анализа на гематологических анализаторах является венозная кровь. Несмотря на распространенное среди медицинских работников отечественных ЛПУ мнение, что «часто в вену лазить» плохо, во всем цивилизованном мире кровь на общий анализ у взрослых берется именно из вены. Важным подспорьем для взятия венозной крови на гемограмму стала разработка и широкое внедрение вакуумных пробирок, содержащих антикоагулянт. Принудительное всасывание крови под действием вакуума позволило использовать для венозной венепункции тонкие атравматичные иглы. Капиллярная кровь в других странах используется реже, в основном у маленьких детей, и связано это с техническими трудностями получения у них венозной крови. Очевидно, что для медицины развитых стран намного важнее получение достоверных результатов из более адекватного материала, чем лозунги об опасности венепункции. Тканевая жидкость, обрывки тканей и микросгустки в капиллярной крови — причина ошибок и сбоев анализатора.
В пробах капиллярной крови более активно происходит агрегация тромбоцитов, больше травмируются форменные элементы, Венозная же кровь, взятая в объеме 2-3 мл, может быть проанализирована повторно, из нее можно выполнить дополнительные исследования.
Взятие капиллярной крови рекомендовано:
— у новорожденных, детей младшего возраста;
— у лиц со склонностью к венозному тромбозу;
— при обширных ожогах и выраженном ожирении;
— при мелких и труднодоступных венах.
На преаналитическом этапе взятия биологического материала имеется более сотни (!) условий, регламентирующих получение адекватных результатов.
Взятие венозной крови как метод выбора имеет свои правила и ограничения, обсуждаемые в специальной литературе. Стоит напомнить, что для исключения общих факторов, влияющих на результаты гематологического исследования, необходимо соблюдение следующего:
— кровь берется после 15-минутного отдыха пациента;
— исключается прием алкоголя и курение непосредственно перед исследованием;
— кровь берется натощак, утром (7-9 ч), пациент во время процедуры сидит или лежит;
— наложение жгута на руку более чем на 1 мин приводит к сосудистому стазу и завышению уровня гемоглобина в венозной крови;
— для взятия венозной крови необходимо избегать мест травм, шрамов, гематом; вен, используемых для переливания растворов; ножных вен у больных диабетом, при нарушениях периферического кровотока, ангиопатиях.
Антикоагулянт
Стабилизация крови, анализируемой на автоматических счетчиках, проводится натриевыми или калиевыми солями этилендиаминтетрауксусной кислоты (ЭДТА — этилендиаминтетраацетат). Гепарин и цитрат натрия для этих целей не применяется. Кровь, стабилизированная цитратом натрия, используется при исследовании гемостаза и СОЭ.
Обычно указываемая в справочниках и инструкциях к приборам концентрация ЭДТА — 1-2 мг на 1 мл для венозной крови. В случае капиллярной крови концентрация антикоагулянта должна быть увеличена в 2-3 раза. Увеличение концентрации ЭДТА в 5 раз не опасно и приводит лишь к небольшому снижению MCV, но увлекаться не стоит.
Одно из важных условий получения качественного образца — тщательное перемешивание крови с антикоагулянтом. Имеет значение и форма нанесения антикоагулянта. Лучшие результаты дает применение пробирок с аэрозольным покрытием и мелкодисперсным порошковым напылением. Кристаллическая форма солей ЭДТА плохо растворима в крови. Применение кристаллических солей приводит к образованию фибриновых нитей в верхней части пробы крови.
Для предотвращения свертывания крови пробирку следует перевернуть, НЕ ВСТРЯХИВАЯ (!), около 10 раз.
Недостаток антикоагулянта в пробе (крови взято больше отмеченного на пробирке уровня) приводит к образованию микросгустков и нарушению работы прибора. Избыток антикоагулянта может повлиять на некоторые показатели только при очень большом превышении оптимальной концентрации.
Анализ СОЭ может быть выполнен из крови, стабилизированной ЭДТА.
Все, как обычно: 4 части крови смешать с 1 частью 3,8% раствора цитрата или физиологического раствора, выдержать 60 мин в капилляре, измерить.
Из стабилизированной ЭДТА можно приготовить мазки крови для подсчета лейкоформулы, но как можно быстрее от момента получения крови.
Авторы надеются, что в самое ближайшее время во всех отечественных лабораториях методы взятия венозной и капиллярной крови с использованием стандартизованных коммерческих систем, обработанных антикоагулянтом, станут нормой жизни. Медицинским сестрам, сопротивляющимся внедрению взятия крови на общий анализ из вены («мы не будем работать на лабораторию!»), необходимо помнить, что вся деятельность учреждений здравоохранения и персонала больниц и поликлиник направлена, в первую очередь, на благо пациента.
Безопасность
Взятие венозной крови с помощью вакуумных систем также называют бесконтактным методом. При работе с вакуумными пробирками, кроме всех прочих преимуществ, отсутствует контакт медицинского персонала с кровью (как при взятии через обычную иглу в пробирку) и, особенно, с аэрозолями крови, образующимися в большом количестве при взятии шприцем. Этот самый излюбленный метод, когда кровь струей устремляется в пробирку (травмирование клеток, гемолиз и пр.), одновременно является и самым опасным, самым «грязным» способом!
Кроме того, взятие крови шприцем с последующим разливанием аликвот по пробиркам вообще недопустимо из-за опасности образования микросгустков, травмирования иглой оператора, высокой вероятности попадания следов крови на руки медсестры, окружающие предметы!
Лозунги о недостатке средств на одноразовые изделия для взятия крови, исключающие преаналитические ошибки, меркнут перед статистикой заражения медицинского персонала вирусным гепатитом. Качество лабораторных исследований и безопасность работников здравоохранения должны чего-то стоить!
Кроме этих систем: стерильные одноразовые пособия: иглы, скарификаторы, перчатки, салфетки. Все, как всегда, плюс маски, дезрастворы, система утилизации.
Салфетки
Взятие крови для автоматического гематологического анализатора возможно только с использованием безворсовых материалов.
Никакой ваты для обработки кожи! Ворсинки ваты вместе с кровью попадают в гемоглобиновую и счетные камеры анализатора, нарушают точность и воспроизводимость анализа, это приводит к увеличению расхода реагентов (повторные промывки) и необходимости внепланового технического обслуживания прибора. Экономия на салфетках оборачивается увеличением затрат на ликвидацию последствий экономии.
Специальные салфетки, пропитанные дезинфицирующими составами и упакованные в индивидуальные пакеты в заводских условиях, — лучшая альтернатива ватным и марлевым шарикам.
Пробирки из пластика являются единственно возможными при взятии крови для последующей обработки на анализаторе.
Кровь, взятая в правильном соотношении с адекватным антикоагулянтом в пластиковую пробирку, сохраняется несколько часов (до 24 ч при 4 °С) без существенных изменений количества и морфологии клеток. Однако скорейшее выполнение анализа предпочтительно, так как патологические клетки менее устойчивы к хранению.
Контакт со стеклом, как и недостаточное количество антикоагулянта, неизбежно приводит к активации тромбоцитов и их агрегации. Результат агрегации — ложная «преаналитическая» тромбоцитопения 50-80·109/л, ошибка счета лейкоцитов может достигать 150% (ложный лейкоцитоз/лимфоцитоз), число эритроцитов может быть завышено почти на 0,5 Т/л, отсюда — неправильно рассчитанные эритроцитарные индексы. Это же может наблюдаться при появлении в кровотоке гигантских форм тромбоцитов, фрагментов мегакариоцитов, но уже относится к факторам физиологии пациента.
Кровь в пластиковых пробирках значительно меньше подвергается травмированию при транспортировке.
Как только цельная кровь взята в пробирку с антикоагулянтом и установлена в штатив, запускается процесс седиментации клеток (подобный СОЭ). Уже в первые минуты стояния образца эритроциты продолжают беспорядочно перемещаться и агрегируют с образованием «монетных столбиков». Спустя 4 мин эритроцитарные агрегаты состоят примерно из 10 эритроцитов, далее они постепенно становятся крупнее (до 50 и более эритроцитов) и разветвляются.
При хранении пробирок со стабилизированной кровью в вертикальном положении появляется лейкоцитарная пленка, состоящая из лейкоцитов и тромбоцитов. Они скапливаются на границе между эритроцитами и плазмой. Недостаточное перемешивание осевшей крови может стать одним из наиболее серьезных источников погрешности при анализе.
Пробирки типа «эппендорф»
В некоторых лабораториях кровь берут в эти «микроконические» пробирки. Цельная кровь имеет высокую вязкость, качественно перемешать ее в пробирке типа «эппендорф» очень трудно. После оседания клеток крови в этот маленький конус оператор может погрузить пробоотборник в более жидкую или более густую фракцию. Результатом будет неправильный счет. Поэтому специалисты не рекомендуют такие пробирки для гематологических исследований.
Нельзя трясти пробу крови! Ручное перемешивание даже в круглодонных микропробирках — процесс с большой долей человеческого фактора — источник ошибок.
Качественное перемешивание пробы возможно с использованием специальных гематологических миксеров. Эффект от приобретения дорогого анализатора часто сводится к нулю из-за экономии нескольких сотен рублей на покупке ротационного или качающего пробирки устройства (шейкера, гематологического миксера).
Продолжительность перемешивания до непосредственного анализа крови должна составлять не менее нескольких минут. Это время зависит от скорости перемешивания, конфигурации пробирок, вязкости крови и других факторов, но в среднем должно составлять не менее 2 мин.
Необходимо помнить, что длительное перемешивание может привести к травмированию и распаду патологических клеток.
Правильное решение проблемы — применение уже упоминавшихся вакуумных пробирок, гематологического миксера и приборов с автоматической системой отбора пробы (автосамплера).
Для преаналитического и аналитического этапов гематологического анализа оптимально:
— применение одноразовых безворсовых салфеток, обработанных дезинфицирующим составом;
— применение одноразовых стерильных вакуумных систем для венозной и микропробирок для капиллярной крови;
— применение перемешивающих устройств для гомогенизации крови или приставки-автосамплера к прибору.
Одноразовые системы для взятия крови не только обеспечивают качество исследований, но и помогают соблюдать санитарно-эпидемиологические требования.
Использование вакуумных систем позволяет:
— снизить опасность возможного инфицирования персонала при работе с кровью (так как кровь сразу же из вены поступает в герметично закрытую пробирку), конструкция систем полностью исключает контакт крови пациента с окружающей средой;
— повысить достоверность результата анализа за счет исключения ошибок преаналитического этапа, связанных с транспортировкой и центрифугированием пробирок;
— обеспечить сохранность проб, исключить разбивание пробирок при транспортировке и центрифугировании и уменьшить риск соприкосновения с кровью при порезе колотым краем стеклянной пробирки; отсутствует необходимость уравновешивания пробирок при центрифугировании;
— исключить ошибки идентификации пациента, пробирки снабжены этикеткой для маркировки;
— соблюсти правильное соотношение кровь-антикоагулянт, важное для точности результатов анализа;
— набрать кровь в одну, две пробирки и более за очень короткий промежуток времени и без повторного

