УДК 618.2, ББК 57.16, С60
С60 Гемостаз: ошибки и неточности. Лабораторная оценка системы гемостаза в акушерстве и гинекологии : Информационный бюллетень / А.В. Соловьёва, С.А. Дьяконов, О.А. Быкова; под ред. В.Е. Радзинского — М. : Редакция журнала StatusPraesens, 2020. — 16 с.
ISBN 978-5-907218-32-1
Тесты лабораторной диагностики, отражающие физиологические и патологические сдвиги в системе гемостаза до и во время беременности, весьма многочисленны. Тем не менее использование этих новых инструментов привело к парадоксальной ситуации — гипер- и гиподиагностике многочисленных нарушений. В частности, изолированное повышение D-димера часто влечёт за собой «лечение анализов» без конкретного диагноза.
Специалисты выделяют необходимый минимум доступных диагностических методик, позволяющих своевременно и адекватно оценить состояние гемостазиологического баланса как на прегравидарном этапе, так и у беременных. Тем не менее без чёткого понимания врачом всех особенностей функционирования свёртывающей системы крови в различные периоды жизни женщины интерпретация результатов коагулограммы вряд ли будет точной и информативной.
Издание предназначено для акушеров-гинекологов и руководителей женских консультаций, родильных домов и перинатальных центров, гинекологических отделений многопрофильных стационаров, сотрудников и руководителей кафедр акушерства и гинекологии, слушателей всех форм непрерывного медицинского образования, аспирантов, клинических ординаторов и студентов медицинских вузов.
УДК 618.2, ББК 57.16, ISBN 978-5-907218-32-1
© Соловьёва А.В.
© ООО «Медиабюро Статус презенс»
Обязательный минимум
Тесты лабораторной диагностики, отражающие физиологические и патологические сдвиги в системе гемостаза до и во время беременности, весьма многочисленны1. Специалисты выделяют необходимый минимум доступных диагностических методик, позволяющих своевременно и адекватно оценить состояние гемостазиологического баланса с целью выполнения профилактических и/или лечебных мероприятий2.
Согласно действующим российским клиническим рекомендациям «Нормальная беременность» (2020), необходимо назначать беременной коагулограмму при первом визите и перед родами. Это исследование включает определение четырёх параметров3.
- Активированное частичное тромбопластиновое время (АЧТВ).
- Протромбиновое время (ПВ).
- Фибриноген.
- Количество тромбоцитов.
Строго говоря, последний из указанных параметров диагностики гемостатических нарушений — определение количества тромбоцитов — входит в рамки общего (клинического) анализа крови и служит основой оценки сосудисто-тромбоцитарного звена гемостаза4. Важно понимать, что на протяжении физиологической беременности медиана количества «кровяных пластинок» смещается незначительно. Тем не менее тромбоцитопении развиваются у 7–11% беременных, при этом в подавляющем большинстве случаев подобные эпизоды патогенетически связаны с самой гестацией5. Количество тромбоцитов, как правило, составляет не менее 100×109/л. Гестационную тромбоцитопению необходимо дифференцировать с неспецифичными для беременности причинами этого нарушения (идиопатическая тромбоцитопеническая пурпура, синдром Бернара–Сулье, системная красная волчанка, антифосфолипидный синдром [АФС] и др). Акушер-гинеколог должен наблюдать таких пациенток в тесном сотрудничестве с гематологом и (при необходимости) с ревматологом6.
Показаний для обязательного скринингового исследования агрегационной способности тромбоцитов с добавлением различных реагентов, чаще всего аденозиндифосфата, при физиологическом течении гестации у пациенток с отсутствием геморрагических проявлений в анамнезе нет. В противном случае рекомендовано выполнять оценку активации тромбоцитов при первой явке беременной (7–8 нед).
Рассмотрим подробнее другие обязательные параметры оценки гемостаза беременной. В течение физиологической беременности и в послеродовом периоде важнейшие скрининговые показатели коагуляционного гемостаза — АЧТВ и ПВ — обычно не претерпевают значимых изменений, хотя возможна и тенденция к их укорочению7.
- АЧТВ чутко реагирует на изменения уровней веществ, обеспечивающих работу каскада реакций внешней и общей систем свёртывания, — факторов II, V, VIII, IX, X, XI, XII и фибриногена. Этот показатель определяют в целях скрининга врождённых или приобретённых коагулопатий. В числе первых наиболее известны гемофилия A и B, а также болезнь Виллебранда; вторые включают нарушения функции печени и введение противосвёртывающих препаратов. Именно поэтому АЧТВ используют для мониторинга гепаринотерапии — между этим параметром и дозой нефракционированного гепарина существует линейная зависимость.
- ПВ — ещё один необходимый инструмент оценки показателей внешней и общей систем свёртывания. ПВ высокочувствительно к изменениям витамин-К-зависимых факторов (II, VII, X), поэтому его используют в мониторинге антитромботической терапии антагонистом этого соединения варфарином, а также для оценки течения заболеваний печени.
Несложное в лабораторной практике определение ПВ основано на добавлении к плазме крови тканевого фактора. Оно было внедрено американским врачом Армандом Квиком (ArmandJ. Quick) ещё в 1935 году, но до сих пор служит классическим анализом коагулирующей активности8. Тем не менее в 1980-х годах оценка ПВ была усовершенствована с помощью нового показателя — международного нормализованного отношения (МНО), позволяющего минимизировать зависимость результата от вариабельности реагента. МНО — это отношение ПВ пациента к нормальному ПВ, возведённое в значение международного индекса чувствительности, указанное производителем тканевого фактора на упаковке.
Фибриноген— один из важнейших белков гемостаза, и его определение незаменимо для выявления таких редких наследственных заболеваний, как а- или дисфибриногенемия. Его обязательно оценивают при тяжёлых травмах, синдроме диссеминированного внутрисосудистого свёртывания (ДВС) и заболеваниях печени. Сгусток фибриногена/фибрина стабилизирован фактором XIII, а его распад с образованием продуктов деградации характерен для таких тромботических состояний, как тромбоз глубоких вен или тромбоэмболия лёгочной артерии.

Перегрузка
Четыре вышеперечисленных показателя — основа лабораторного анализа гемостаза, но палитра оценки свёртывающей функции крови ими не исчерпывается9.
Так, упомянутые выше продукты деградации кровяного сгустка стали предметом самостоятельного углублённого исследования, при этом в последние десятилетия оценку растворимых комплексов мономеров фибрина потеснил D -димер. Его изолированное определение стало «бичом» российского акушерства и гинекологии.
Определение D-димера необходимо прежде всего для исключения венозных тромбоэмболических осложнений (ВТЭО) и оценки тяжести ДВС-синдрома (в последнем случае — обязательно в сочетании с иными параметрами гемостаза!). На «вторых ролях» сегодня — прогнозирование тромботических рисков, течения инфекционных и онкологических заболеваний.
Тенденция к неоправданному расширению «сферы ответственности» этого продукта фибринолиза — общемировое явление. Изолированное повышение D-димера часто влечёт за собой «лечение анализов» без конкретного диагноза, при этом зарубежные специалисты указывают на проблемы со стандартизацией, чувствительностью и специфичностью существующих диагностических тестов.
Тем не менее на «плечи» этого «атланта» нередко возлагают диагностику угрозы прерывания беременности на ранних сроках и даже бесплодия неясного генеза. Нужно отметить, что принятые в 2019 году российские клинические рекомендации «Вспомогательные репродуктивные технологии и искусственная инсеминация»10 и «Женское бесплодие (современные подходы к диагностике и лечению)»11 регламентируют лишь назначение коагулограммы при подготовке к программам ВРТ. Аналогичные указания содержит и обновлённый (вступает в силу с 1 января 2021 года) порядок использования ВРТ12. К сожалению, конкретный объём ориентировочного исследования системы гемостаза в этих документах не указан.
Таким образом, оценка гемостаза у бесплодных пациенток сейчас направлена на скринингперед назначением стимуляции овуляции, ассоциированной с повышением риска ВТЭО13. Ассоциация гиперкоагуляции с привычным невынашиванием неясного генеза наряду с применением антикоагулянтов в качестве эмпирической профилактики потери беременности служит предметом горячих научных дискуссий14 15.
В худшем случае при оценке результатов определения D-димера не принимают во внимание его «запрограммированный» рост в течение гестации, отражающий состояние физиологической гиперкоагуляции. Так, по данным испанских исследователей (2018), в III триместре его показатели превышают верхнюю границу для небеременных (500 мкг/л) у 99% пациенток16. Окончательная валидация параметров динамики этого продукта распада кровяного сгустка у беременных — задача на ближайшее будущее.
Знака равенства нет
Недооценка физиологических изменений системы гемостаза — распространённая ошибка медиков. Если такие скрининговые показатели, как АЧТВ, ПВ и количество тромбоцитов, обычно не претерпевают выраженных изменений, это не будет верным для остальных параметров при углублённом исследовании. В частности, для физиологического течения беременности характерны рост уровня фибриногена и снижение антикоагулянтной активности крови. Отмечают увеличение факторов свёртывания VII, VIII и IX и угнетение активности протеина S при незначительном снижении свободной фракции последнего (и стабильной концентрации общего белка)21.
С целью стратификации пациенток в группы риска по возможным геморрагическим, тромботическим и гестационным осложнениям необходимо акцентировать внимание на своевременном исследовании показателей системы гемостаза (на этапе планирования гестации или при первом обращении беременной в медицинскую организацию). Последующее обследование при физиологическом течении беременности должно быть обосновано22 23.
У пациенток группы низкого риска гестационных и тромбоэмболических осложнений при физиологическом течении беременности объём обследования должен быть минимизирован, что позволяет исключить в эти сроки необоснованное инвазивное вмешательство и снизить затраты.
В эту группу включают женщин при отсутствии:
- экстрагенитальных заболеваний;
- необходимости в лечебных мероприятиях по коррекции экстрагенитальных заболеваний;
- специфических осложнений гестационного процесса при данной беременности (отёки, протеинурия и гипертензивные расстройства, преждевременные роды, задержка роста плода [ЗРП]);
- анте-, интра- и ранней неонатальной гибели ребёнка в анамнезе женщины;
- осложнений при предыдущих родах, таких, как гипотоническое кровотечение.
С другой стороны, пациенткам групп риска гестационных и тромбоэмболических осложнений необходимо расширить объём исследования с целью своевременной профилактики возможного клинического неблагополучия.
Для физиологического течения беременности характерны перечисленные ниже изменения параметров гемостаза, определяемых при углублённом исследовании.
- Повышение уровня фактора Виллебранда.
- Снижение активности фермента ADAMTS13*.
- Снижение активности фактора XIII (фибринстабилизирующего) ко времени родов.
- Увеличение способности к образованию тромбина (по показателям теста генерации тромбина).
- Изменения показателей тромбоэластографии и тромбодинамики с тенденцией к усилению фибринообразования.
- Увеличение уровня тканевого фактора.
- Нарастание D-димера.
- Снижение антикоагулянтной активности крови за счёт изменений в системе протеина С при стабильной активности антитромбина III.
- Снижение уровня гомоцистеина на фоне приёма фолатов.
Отклонения от этих тенденций — повод для повышенного внимания к состоянию беременной, часто служащий основанием для назначения консультации гематолога.
Венозные тромбоэмболии: ищем мутации
Прокоагуляционные изменения при нормальной беременности повышают риск тромботических осложнений24 25. Однако это — не причина рассматривать гестацию как самостоятельный повод к углублённому исследованию гемостаза. Тем не менее в группу риска ВТЭО включают пациенток с широким спектром состояний.
- Предшествующие ВТЭО: рецидивирующие, неспровоцированные, спровоцированные, связанные с приёмом эстрогенсодержащих препаратов.
- Семейный тромботический анамнез (ВТЭО у родственников первой линии родства в возрасте до 50 лет).
- Искусственные клапаны сердца, кава-фильтр.
- Тяжёлая форма преэклампсии, внутриутробная гибель плода во время данной беременности.
- Носительство тромбофилических генотипов (подробнее о них — ниже): гомозиготное носительство фактора V Лейден FVL (G1691A), сочетание гетерозиготных полиморфизмов FVL и протромбина F2 (G20210A), гомозиготное носительство последнего, дефицит антитромбина III, протеина S и C.
- Экстрагенитальные заболевания (злокачественные опухоли, сахарный диабет 1-го типа, нефротический синдром, системная красная волчанка, серповидно-клеточная анемия).
У этих пациенток исследование гемостаза при беременности дополняют определением агрегации тромбоцитов с аденозиндифосфатом, D-димера, антитромбина III, а также скринингом нарушений в системе протеина С и оценкой резистентности фактора V к активированному протеину C. На прегравидарном этапе рекомендовано определение гомоцистеина, но его мониторинг в течение гестации не показан.
Рутинный скрининг для определения тромбофилических нарушений в рамках прегравидарной подготовки не назначают ввиду недоказанной целесообразности такого мероприятия. Определение концентрации гомоцистеина в крови также не обязательно. Генетическое обследование для выявления наследственных тромбофилий (полиморфизмов генов гемостаза) рекомендуют женщинам, имеющим родственников первой степени родства с тромбофилией высокого риска, а также при наличии в анамнезе нижеследующих состояний31.
- Идиопатический артериальный тромбоз (в молодом возрасте).
- Идиопатические ВТЭО необычной локализации (тромбозы вен ЖКТ, почек, головного мозга, венозного синуса).
- Эпизод ВТЭО, ассоциированный с воздействием факторов умеренного риска (операции небольшого объёма, непродолжительная иммобилизация или путешествия на незначительные расстояния, приём эстрогенсодержащих контрацептивов).
- Идиопатическая ВТЭО в сочетании с отнесением пациентки к группе риска по кровотечению или с наличием противопоказаний для антикоагулянтной терапии.
- Необъяснимые осложнения беременности (более трёх потерь на сроках до 10 нед или одна и более после 10 нед, преэклампсия, ЗРП, преждевременная отслойка нормально расположенной плаценты).
Тромбориски: не только беременность
Большую долю работы акушера-гинеколога занимает ведение пациенток вне беременности, а если говорить точнее, женщин, которым необходимо репродуктивное планирование. Несмотря на достаточно широкий выбор контрацептивов, их использование в нашей стране, как и во всём мире, до сих пор явно недостаточно. И одна из причин — гормонофобия. Множество публикаций StatusPraesens за 11 лет истории журнала было посвящено методичному и аргументированному считать риск тромбообразования, повышающийся на фоне приёма гормональных препаратов.
Действительно, вероятность ВТЭО у пользовательниц КОК в среднем в 3,5 раза выше в сравнении с теми, кто гормональные средства не применяет32 33. Однако указанная опасность, например, почти в 3 раза меньше, чем при гестации. Врач может использовать валидированный опросник для оценки риска ВТЭО, ответы на который могут стать достаточным основанием для расширения диагностического поиска и принятия верного решения
Ещё один документ, на который следует опираться в вопросах выбора средств и методов предотвращения нежеланной беременности, — Медицинские критерии приемлемости32, в которых чётко прописано, что наличие факторов риска ВТЭО — противопоказание для назначения любого КОК. В качестве важной ремарки эксперты ВОЗ отмечают, что все КОК в той или иной степени несут в себе тромбориски, однако для тех препаратов, в состав которых включены ЛНГ, норэтистерон и норгестимат, эти риски всё жеменее выражены32 34. Так, при использовании КОК с ЛНГ вероятность тромботических осложнений составляет 5–10 случаев на 10 тыс. женщино-лет[^35–37], практически столь же безопасным можно признать норэтистерон35, а норгестимат может увеличить вероятность ВТЭО на 14%36. Близким к эталонному трио сегодня можно считать КОК на основе гестагена хлормадинона ацетата 2,4 на 10 тыс. женщино-лет38.
В частности, крупная постмаркетинговая наблюдательная работа включила около 20 тыс. женщин, получавших КОК с 2 мг ХМА и 0,03 мг в течение 6 циклов. В ней был отмечен один эпизод тромбоза вен нижней конечности и один случай тромбоэмболии лёгочной артерии. Согласно оценкам авторов, частота ВТЭО составила 2,1 на 10 000 женщино-лет39.
Хорошие параметры безопасности КОК с ХМА подтвердило и исследование III фазы длительного применения препарата «Белара». В нём участвовала 781 женщина (23 033 цикла с КОК, до 45 у одной пациентки). В нём был описан единственный эпизод тромбоза глубоких вен нижней конечности у курильщицы старше 30 лет после обусловленной вывихом голеностопного сустава иммобилизации40.
Помимо эффективной контрацепции, использование средств на основе ХМА обеспечивает хороший контроль менструального цикла, уменьшение объёма кровопотери, снижение выраженности дисменореи, акне, себореи, гирсутизма.
Практикующему врачу также важно помнить, что в оценке тромботических рисков использования гормональной контрацепции необходимо учитывать фактор времени: абсолютно любой КОК на старте применения усиливает процессы коагуляции и фибринолиза (и это найдёт отражение в лабораторных анализах), однако уже через полгода показатели гемостаза выравниваются.
К тромбофилиям высокого риска относят гомозиготные полиморфизмы генов фактора V G1691A (лейденская мутация) и фактора II G20210A либо их сочетание, а также дефицит антитромбина. Тромбофилиями низкого риска признаны дефицит антитромбина, протеинов C и S, гипергомоцистеинемия, гетерозиготные мутации G1691A и G20210A41.
Объём рекомендуемого генетического обследования включает поиск мутаций в следующих генах:
- F5 G1691A;
- F2 G20210A;
- SERPINC1 (ген сериновой протеазы);
- PROC и PROS1 (гены протеинов С и S соответственно).
При обнаружении тромбофилии необходимо организовать консультацию пациентки у гематолога.
Антитромботическую терапию женщинам с наследственными тромбофилиями назначают только в рамках клинических исследований или в целях профилактики тромбоэмболических осложнений42. Медицинская общественность с большим интересом ожидает результаты крупного международного рандомизированного контролируемого исследования Anticoagulants for LIving FEtuses2 (ALIFE2), посвящённого оценке эффективности терапии препаратом низкомолекулярного гепарина у женщин с носительством тромбофилических мутаций и привычным невынашиванием беременности в анамнезе43.
Коагулопатические кровотечения: кто в группе риска?
О высоком риске коагулопатических кровотечений следует задуматься при появлении в поле зрения акушера-гинеколога пациентки с врождённым геморрагическим диатезом (болезнь Виллебранда, тромбоцитопатии). Для этого заболевания характерно появление с детского возраста кровоточивости микроциркуляторного типа (носовые, десневые кровотечения, повышенная склонность к образованию синяков, обильные менструальные кровотечения, продолжающееся кровотечение после малых хирургических вмешательств — экстракции зуба, тонзилэктомии).
При наступлении беременности таким пациенткам рекомендовано наблюдение и обследование на III этапе оказания специализированной медицинской помощи. У них дополнительно определяют агрегацию тромбоцитов с аденозиндифосфатом, уровень фактора Виллебранда (только до срока гестации 8 нед) и фактора XIII (фибринстабилизирующего). Назначение ТЭГ на прегравидарном этапе и во время гестации не рекомендовано (за исключением поздних сроков).
Рекомендуют консультацию гематолога при снижении:
- количества или функции тромбоцитов;
- уровня фактора Виллебранда;
- активности фактора XIII.
Система гемостаза тесно вовлечена в патогенетические изменения при преэклампсии44 45.
Группа риска преэклампсии включает беременных с такими состояниями, как:
- ранняя преэклампсия и преждевременные роды в сроке до 34 нед в анамнезе;
- преэклампсия больше чем в одной предшествующей беременности;
- хронические заболевания почек;
- аутоиммунные заболевания, и в первую очередь системная красная волчанка, и АФС;
- наследственная тромбофилия (мутации F5L G1691A; F2 G20210А; глубокий дефицит антитромбина III, протеина С или протеина S);
- сахарный диабет (1-го или 2-го типа);
- хроническая артериальная гипертензия;
- индекс массы тела 35 кг/м2 и более при первом посещении.
Необходимо отметить, что в настоящее время коагулограмма не служит скрининговым анализом для этого нарушения, хотя фибриноген предложен в качестве возможного маркёра преэклампсии, особенно тяжёлой, в III триместре беременности46. У таких пациенток желательно определять гомоцистеин, при этом такие методы, как исследование функции тромбоцитов, измерение уровня D-димера или выполнение ТЭГ, не предоставляют дополнительной диагностической информации.
Антифосфолипидный синдром
АФС — аутоиммунное заболевание, которому присуще сочетание неблагоприятных исходов беременности или тромбозов (венозных или артериальных) с повышением титра антифосфолипидных антител (волчаночного антикоагулянта, антител к кардиолипину и β2-гликопротеину-1). Многие исследователи считают АФС одной из наиболее важных корригируемых причин привычного невынашивания беременности.
Согласно международному консенсусному заявлению 2006 года, известному, как «Сиднейские диагностические критерии АФС», о наличии этого заболевания можно говорить только в случае комбинации по меньшей мере одного из клинических и одного из лабораторных критериев синдрома47.
К клиническим критериям АФС относят следующие.
- Сосудистый тромбоз. Один или более клинических эпизодов тромбоза артерий, вен или мелких сосудов в любых тканях или органах. Тромбоз должен быть объективно подтверждён бесспорными результатами визуализирующих методов исследования (или гистологически, в последнем случае в отсутствие выраженного воспаления сосудистой стенки).
- Потери беременности:
- один или более случаев внутриутробной гибели морфологически нормального плода на сроке 10 нед гестации и позднее (нормальное морфологическое строение документировано при УЗИ или непосредственном исследовании абортуса); или
- один или более случаев преждевременных родов морфологически нормальным плодом на сроке до 34 нед гестации вследствие тяжёлой преэклампсии, или эклампсии, или выраженной плацентарной недостаточности; или
- три или более последовательных случаев самопроизвольной потери беременности на сроке до 10 нед гестации после исключения анатомических дефектов матки, гормональных нарушений, материнских или отцовских хромосомных нарушений.
Лабораторные критерии АФС следующие.
- Волчаночный антикоагулянт, выявленный в плазме крови при двух исследованиях или более с промежутком не менее 12 нед, согласно рекомендациям ISTH.
- Антитела к кардиолипину изотипов IgG и/или IgM, выявленные в сыворотке или плазме крови в средних или высоких титрах при двух исследованиях или более с промежутком не менее 12 нед с помощью стандартизованного иммуноферментного метода.
- Антитела к β2-гликопротеину-1 изотипов IgG и/или IgM, выявленные в сыворотке или плазме крови в высоких титрах при двух исследованиях или более с промежутком не менее 12 нед с помощью стандартизованного иммуноферментного метода.
Между эпизодами, отвечающими условиям клинических и лабораторных критериев АФС, не должно пройти более 12 нед (но меньше 5 лет). Изолированного выявления антифосфолипидных антител для вынесения диагноза АФС недостаточно.
Квалифицированную медицинскую помощь при АФС оказывают совместно ревматолог, гематолог и акушер-гинеколог. При обнаружении антифосфолипидных антител пациентке с тремя эпизодами невынашивания и более на прегравидарном этапе назначают профилактические дозы ацетилсалициловой кислоты. После положительного теста на беременность дополнительно используют профилактические дозы нефракционированного или низкомолекулярного гепарина48. Глюкокортикоиды не улучшают исходы беременности при АФС и повышают вероятность артериальной гипертензии и гестационного сахарного диабета.
Опасно для жизни
К ведущим критическим состояниям, определяющим современную структуру материнской смертности во всём мире, относят ДВС-синдром и различные клинические формы тромботической микроангиопатии (ТМА). В основе этих патологических состояний лежит повреждение эндотелия сосудов микроциркуляторного русла, влекущее за собой диссеминированное тромбообразование[^49–51].
На фоне гестации спектр клинических вариантов ТМА включает ряд заболеваний: атипичный гемолитико-уремический синдром (аГУС), тромботическую тромбоцитопеническую пурпуру (ТТП), преэклампсию и эклампсию, HELLP-синдром и катастрофический АФС (КАФС)[^52–54].
В группу риска ДВС-синдрома следует включать пациенток со следующими состояниями:
- острой массивной кровопотерей;
- эмболией околоплодными водами;
- преждевременной отслойкой плаценты;
- антенатальной гибелью плода;
- хорионамнионитом.
В пользу развития ТМА будут свидетельствовать:
- органная дисфункция различной локализации;
- тромбоцитопения в сочетании с гемолитической анемией;
- шизоцитоз;
- повышение активности печёночных трансаминаз;
- повышение уровня лактатдегидрогеназы.
В клинической практике объём исследования системы гемостаза при жизнеугрожающих состояниях должен включать оценку следующих параметров:
- количество тромбоцитов;
- металлопротеиназа ADAMTS13;
- протромбиновое время;
- фибриноген;
- ТЭГ;
- D-димер;
- антитромбин III;
- волчаночный антикоагулянт.
В то же время назначение таких весьма распространённых диагностических процедур, как исследование времени свёртывания и времени кровотечения, оценка агрегации тромбоцитов, растворимых фибрин-мономерных комплексов (методом паракоагуляции), не помогает надёжной верификации диагноза жизнеугрожающих состояний. Именно поэтому их рутинное применение не показано. А вот консультация гематолога при возникновении любого из указанных выше нарушений на фоне гестации — мера исключительно важная.
Для определения тактики ведения больных в качестве первоочередной задачи следует провести дифференциальную диагностику между ДВС-синдромом, вторичными ТМА (преэклампсия, HELLP-синдром и КАФС) и её первичными формами, аГУС и ТТП55 56. Так, одним из определяющих критериев дифференциальной диагностики ТМА признана активность металлопротеиназы ADAMTS1355. Для наследственной формы ТТП характерен дефицит ADAMTS13 (активность менее 10%)57. В то же время для верификации аГУС следует учитывать не только снижение активности ADAMTS13, но и обнаружение антител к обсуждаемой металлопротеиназе.

«…Гемостаз — эволюционно сложившаяся защитная реакция организма, выражающаяся в остановке кровотечения при повреждении стенки сосуда». Такое определение можно найти в медицинских энциклопедиях и учебниках, однако оно не отражает всей сложности и значимости процесса. В акушерско-гинекологической практике эта проблема особенно актуальна, причём охватывает пациенток как в период гестации, так и вне её. Современная лабораторная диагностика предлагает достаточно широкий спектр исследований свёртывающей и противосвёртывающей систем крови, но без чёткого понимания врачом всех особенностей гемостаза в различные периоды жизни женщины, интерпретация результатов вряд ли окажется точной и информативной. 
Научно-практическое издание
Соловьёва Алина Викторовна, Дьяконов Сергей Александрович, Быкова Ольга Александровна
ГЕМОСТАЗ: ОШИБКИ И НЕТОЧНОСТИ
Лабораторная оценка системы гемостаза в акушерстве и гинекологии
Информационный бюллетень
Под редакцией В.Е. Радзинского
Генеральный директор: Светлана Александровна Маклецова
Креативный директор: Виталий Кристал
Директор по развитию: Александр Васильевич Иванов
Заместители редакционного директора: Ольга Анатольевна Раевская, Хильда Юрьевна Симоновская
Аппарат ответственного секретаря редакции: Мария Кириченко, Надежда Васильева
Ответственные редакторы: Ольга Быкова, Сергей Дьяконов
Препресс-директор: Анастасия Пушкарь
Выпускающие редакторы:Нелли Демкова, Елена Давыдова
Вёрстка: Галина Калинина
Корректор: Елена Соседова
Художник: Юлия Крестьянинова
Подписано в печать 11.11.2020. Бумага мелованная. Печать офсетная.
Формат 60×90/16. Усл. печ. л. 1. Тираж 15 500 экз.
Ответственность за содержание рекламы и публикаций «На правах рекламы» несут рекламодатели.
ООО «Медиабюро Статус презенс».
105082, Москва, Спартаковский пер., д. 2, стр. 1. Бизнес-центр «Платформа», подъезд 9, этаж 3. Тел.: +7 (499) 346 3902.
E-mail: info@praesens.ru. Сайт: praesens.ru.
Группа ВКонтакте: vk.com/praesens.
Группа в Фейсбуке: facebook.com/stpraesens.
Профиль в Инстаграме: instagram.com/statuspraesens.
Отпечатано в типографии ООО «МИНИН». 603104, г. Нижний Новгород, ул. Краснозвёздная, д. 7А, оф. 3.
Самое слабое звено в диагностике патологии системы гемостаза — преаналитический этап, который включает как подготовку пациента к выполнению исследования, так и саму процедуру забора и транспортировки образца крови в лабораторию. 80–85 % диагностических ошибок вызваны погрешностями на этом этапе, что объясняется высокой лабильностью и многофакторностью системы гемостаза.
 Основная цель преаналитического этапа лабораторной диагностики — обеспечить стабильность компонентов биоматериала и свести к минимуму воздействие различных факторов, влияющих на результат. Стандартизация всех условий и процедур на этом этапе является требованием внутрилабораторного контроля качества исследований.
Основная цель преаналитического этапа лабораторной диагностики — обеспечить стабильность компонентов биоматериала и свести к минимуму воздействие различных факторов, влияющих на результат. Стандартизация всех условий и процедур на этом этапе является требованием внутрилабораторного контроля качества исследований.
Обычная скрининговая коагулограмма для одного пациента обходится более 10 рублей, расширенная — порядка 40 рублей в государственных клиниках, в частных дороже. Каждый дополнительный показатель (D-димер, активность факторов свертывания и пр.) увеличивает стоимость исследования как минимум на 20 рублей.
Ошибки на преаналитическом этапе и доставка некачественных образцов в лабораторию приводят к недостоверным результатам и делают все затраты бесполезными.
Подготовка пациента
На результаты могут повлиять экзогенные «варьирующие» факторы.
Физическая активность: спустя несколько минут физической активности в 2–3 раза увеличивается концентрация FVIII и фактора Виллебранда (vWF); может сохраняться на протяжении 12 часов. Происходит активация тромбоцитов и фибринолиза, увеличивается уровень D-димеров.
Длительный психологический стресс ведет к снижению активности FV, FVIII, FIX (сохраняется на протяжении нескольких дней). Стрессовые условия во время взятия крови приводят к гиперагрегации тромбоцитов.
Физиологические гормональные изменения влияют на активность всей системы свертывания и фибринолиз. Классическим примером является беременность. При физиологическом течении беременности наблюдается постепенный рост FVII и FX. Уровень FVIII и vWF увеличивается в 2–3 раза и сохраняется даже после родов. Формируется резистентность к протеину С (РС), активность протеина S (РS) снижается на 30 %.
Увеличивается уровень маркеров активации свертывания крови и растворимого фибрина. Изменения в системе фибринолиза связаны с ростом ингибиторов РАI-1, РАI-2 (плацентарного), постепенным ростом D-димеров.
При исследовании системы гемостаза у женщин приходится учитывать фазы месячного цикла и влияние гормональных препаратов. Уровни FVIII и vWF наименьшие в фолликулярной и наибольшие в лютеиновой фазе цикла. В период менопаузы наблюдается постепенный рост фибриногена и FVIII. Применение гормонозаместительной терапии (ГЗТ) вызывает АРС-резистентность и снижение PS. Употребление жирной пищи и курение в день исследования приводят к росту фибринолитической активности, активации свертывания крови и активации тромбоцитов.
Употребление жирной пищи и курение в день исследования приводят к росту фибринолитической активности, активации свертывания крови и активации тромбоцитов.
Недостаточная стандартизация так называемых варьирующих долабораторных факторов приводит к диагностическим ошибкам и в итоге увеличивает продолжительность и стоимость диагностики и лечения пациента.
Памятка для пациента
- Кровь следует сдавать утром натощак, не менее чем через 8 ч после последнего приема пищи в условиях, которые не вызывают стресса.
- На протяжении 24 ч перед обследованием необходимо избегать физических нагрузок, употребления жирной пищи и приема алкоголя.
- В день обследования запрещается курить.
- Перед сдачей крови необходимо посидеть в течение 20–30 мин.
- При приеме варфарина рекомендуется с 17:00 до 19:00 принять всю дозу препарата с интервалом не менее 2 ч до или после приема пищи, с последующей сдачей анализа на МНО с 8:00 до 10:00.
Кстати, терминалы электронной очереди позволяют снизить влияние стрессового фактора на пациента, ожидающего взятия крови.
Что должен знать врач, направляющий пациента на обследование гемостаза
1. При назначении даты исследования врачу необходимо учитывать влияние лекарственных препаратов, принимаемых пациентом, на агрегацию тромбоцитов или параметры коагуляции (антикоагулянтов, тромболитиков, ингибиторов фибринолиза, антиагрегантов, оральных контрацептивов, НПВС, венотоников и др.). Эта информация вместе с диагнозом пациента должна быть отражена в бланке направления на исследование.
2. При высоком значении гематокрита стандартное количество цитрата в вакуумных пробирках оказывается избыточным для уменьшенного объема плазмы, что приводит к «ложной» гипокоагуляции. При значении гематокрита ниже 35 % возникает дефицит антикоагулянта в пробе, что может привести к «ложной» гиперкоагуляции в результатах и кровь может свернуться в пробирке еще до исследования. Для стабилизации образцов крови при нормальном значении гематокрита (35–50 %) рекомендуемое соотношение кровь/антикоагулянт 9:1. При отклонениях гематокрита от указанных величин следует изменить это соотношение в соответствии с формулой Ingram: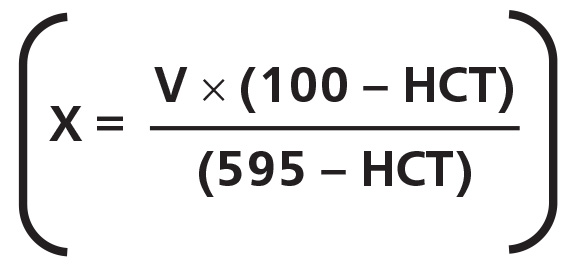
X — добавляемый объем 3,2 % цитрата, мл; V — конечный объем пробирки для крови, мл; HCT — показатель гематокрита у пациента, %.
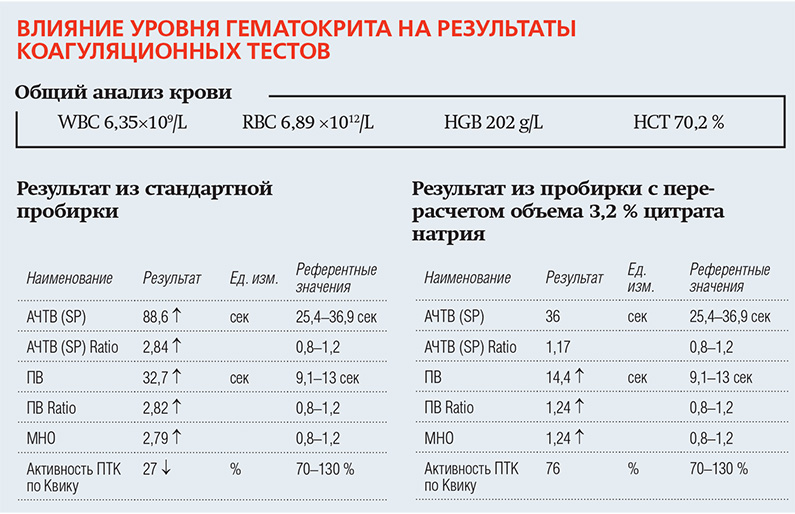 Перед обследованием врач должен направить пациента с патологическим уровнем гематокрита в лабораторию для расчета количества цитрата натрия и подготовки индивидуальной пробирки для взятия крови на гемостаз.
Перед обследованием врач должен направить пациента с патологическим уровнем гематокрита в лабораторию для расчета количества цитрата натрия и подготовки индивидуальной пробирки для взятия крови на гемостаз.
3. Особенности подготовки к исследованиям системы гемостаза у женщин:
- С целью диагностики болезни Виллебранда у женщин детородного возраста следует брать кровь на исследование в 1–4-й дни месячного цикла (в дни максимальной кровопотери).
- С целью диагностики снижения РS и АРС-резистентности следует отменить прием оральных контрацептивов за 2 месяца перед обследованием.
- С целью диагностики врожденных нарушений свертывания крови у беременных (особенно болезни Виллебранда и недостатка РS) кровь необходимо брать не ранее, чем через 2 месяца после родов.
4. Диагностику волчаночного антикоагулянта (ВА) в остром периоде заболевания (до 3 месяцев) при приеме НОАК, прямых ингибиторов фактора Ха и тромбина проводить не рекомендуется во избежание получения ложноположительных результатов. Если по истечении 3 месяцев пациенту необходимо проведение диагностики АФС, но он еще нуждается в приеме антикоагулянтной терапии (АКТ), рекомендуется:
Если по истечении 3 месяцев пациенту необходимо проведение диагностики АФС, но он еще нуждается в приеме антикоагулянтной терапии (АКТ), рекомендуется:
- при применении варфарина проводить исследование после того, как МНО опустится ниже 1,5, или через 1–2 недели после прекращения приема препарата; в случае необходимости продолжения АКТ препаратом выбора, который может быть назначен перед лабораторным исследованием на ВА, являются НМГ;
- последнее введение дозы НМГ должно проводиться за 12 и более часов до анализа крови на ВА. В случае применения НФГ следует отменить препарат за 2 дня до исследования ВА;
- при применении ривароксабана и дабигатрана проводить исследование через 3 дня после отмены препаратов или при переводе пациента на НМГ.
5. Мониторинг АКТ предполагает подбор дозы антикоагулянта, основанный на результатах лабораторных тестов. Крайне важно добиться от пациента правильного приема АК и следования графику.
Прием варфарина с 17:00 до 19:00 всей дозы одновременно с интервалом не менее 2 ч до или после приема пищи, с последующей сдачей анализа на МНО с 8:00 до 10:00.
Рекомендуемые уровни гипокоагуляции:
- высокий уровень МНО — от 3 до 4,5;
- средний уровень МНО — от 2 до 3;
- низкий уровень МНО — от 1,8 до 2,3.
Введение НМГ (далтепарина натрия, надропарина кальция, эноксапарина натрия) с 6:00 до 7:00 утра, сдача крови для исследования анти-Ха активности (НМГ) + антитромбина III (АТ) через 3–4 часа после введения с 10:00 до 11:00.
Целевой диапазон анти-Ха активности:
- для профилактических доз НМГ (п/к) 0,2–0,5 анти-Ха МЕ/мл;
- для лечебных (п/к) 0,5–1,5 анти-Ха МЕ/мл.
Прием ривароксабана (ксарелто) утром натощак с последующей сдачей крови для ис- следования анти-Ха активности (ривароксабан) + АТ через 1,5–2 ч после приема до 11:00.
Лабораторный контроль терапии НМГ и прямыми ингибиторами Ха-фактора рекомендован с учетом клинической ситуации в следующих случаях:
- при геморрагических проявлениях на фоне терапии;
- ОПН, ХПН;
- массе тела менее 50 и более 100 кг;
- длительной терапии (более 10 дней);
- риске кровотечений из-за сопутствующих заболеваний;
- терапии у беременных.
 6. Контроль за лечением антиагрегантами (ингибиторами циклооксигеназы, ингибиторами связывания АДФ с рецепторами тромбоцитов, антагонистами гликопротеина GpIIb/IIIa). Оценку чувствительности к антиагрегантам и достаточности дозировки рекомендуется проводить не ранее, чем через 14 дней после начала приема препаратов. Рекомендуется достижение целевого диапазона.
6. Контроль за лечением антиагрегантами (ингибиторами циклооксигеназы, ингибиторами связывания АДФ с рецепторами тромбоцитов, антагонистами гликопротеина GpIIb/IIIa). Оценку чувствительности к антиагрегантам и достаточности дозировки рекомендуется проводить не ранее, чем через 14 дней после начала приема препаратов. Рекомендуется достижение целевого диапазона.
7. С целью диагностики наследственных и приобретенных тромбоцитопатий рекомендуется проводить исследование индуцированной агрегации тромбоцитов дважды:
- на момент обращения с геморрагическими проявлениями;
- повторно не ранее, чем через 14 дней после отмены приема всех препаратов, влияющих на агрегацию тромбоцитов, в т. ч. витаминов и БАДов.
Основные требования, обеспечивающие правильность тестирования показателей гемостаза:
- атравматическая флеботомия;
- полное заполнение пробирки кровью в соответствии с объемом антикоагулянта (9:1);
- использование 3,2 % (0,109 М) трехзамещенного двухводного цитрата натрия;
- полное и осторожное смешивание крови и антикоагулянта;
- транспортировка и хранение проб крови при комнатной температуре (18–25 °С);
- получение бестромбоцитарной плазмы центрифугированием крови в течение 1 ч после взятия;
- быстрое тестирование плазмы после центрифугирования.
Кровь следует брать утром натощак из локтевой вены иглой с широким просветом (0,8 мм). Преимущество имеют вакуумные пробирки, предназначенные для получения венозной крови, стабилизированной цитратом натрия в соотношении 9:1. Использование шприца не рекомендуется из-за активации тромбоцитов и факторов свертывания турбулентным движением крови и ее смешивания с воздухом во время заполнения.
Наложение манжеты при пункции локтевой вены оптимально в течение 1 минуты.
В ходе эксперимента при 3-минутном стазе, вызванном манжетой, ПВ укорачивалось на 3,1 %, содержание фибриногена повышалось на 10,1 %, D-димеров — на 13,4 %, активность FVII и FVIII увеличивалась на 10,6 % и 10,2 % соответственно.
Недостаточное перемешивание венозной крови и антикоагулянта может вызвать образование частичных сгустков небольшого размера, которые не видны в первичных пробирках. Проба запускается в работу, на исследования расходуются дорогостоящие реагенты и только по результатам исследования врач КДЛ может заподозрить наличие в пробе сгустков. В таких случаях выбраковка проводится на постаналитическом этапе лабораторного исследования.
 На основании анализа вызываемых погрешностей из-за недобора крови и нарушения соотношения кровь/антикоагулянт Институт клинических лабораторных стандартов (CLSI) рекомендует не тестировать пробы при заполнении менее чем на 90 % требуемого объема.
На основании анализа вызываемых погрешностей из-за недобора крови и нарушения соотношения кровь/антикоагулянт Институт клинических лабораторных стандартов (CLSI) рекомендует не тестировать пробы при заполнении менее чем на 90 % требуемого объема.
Чем быстрее кровь доставлена в лабораторию, тем достовернее будет результат. Не нужно ждать 30 минут, как при получении сыворотки, чтобы сформировался сгусток. Работа ведется с плазмой, в которой, в отличие от сыворотки, есть фибриноген. Благодаря добавленному в пробирку антикоагулянту кровь не сворачивается.
По рекомендации CLSI, для тестирования плазменного звена гемостаза предпочтительным является 3,2 % (0,109 М) цитрат натрия. Применение именно этой концентрации дает меньшую частоту преаналитических ошибок, т. к. вызывает большую устойчивость лабильных факторов свертывания крови.
Для тестирования агрегационной способности тромбоцитов рекомендуется применение прямых ингибиторов тромбина и НФГ. Они оказывают наименьшее интерферирующее действие на агрегацию тромбоцитов. Очень важно сократить до минимума время между взятием крови и центрифугированием. До центрифугирования кровь необходимо хранить в закрытых пробирках только при комнатной температуре. Нарушение температурного режима может привести к гемолизу эритроцитов и активации тромбоцитов. Первичный скрининг включает в себя исследования, отражающие состояние целых звеньев системы гемостаза, которые позволяют исключить значительные отклонения и сориентировать клиницистов в направленности патологии: количество тромбоцитов, АЧТВ, ПВ, ТВ, концентрация фибриногена, РФМК, D-димеры. На втором этапе назначаются специфические исследования, позволяющие уточнить диагноз: агрегация тромбоцитов с различными индукторами, активность и антиген vWF, активность плазменных факторов свертывания, физиологических антикоагулянтов, фибринолитической системы, лабораторная диагностика АФС, уровень гомоцистеина, ПЦР-диагностика наследственных тромбофилий и др. Выбор уточняющих тестов зависит от клинической ситуации и результатов скрининговых исследований.
Первичный скрининг включает в себя исследования, отражающие состояние целых звеньев системы гемостаза, которые позволяют исключить значительные отклонения и сориентировать клиницистов в направленности патологии: количество тромбоцитов, АЧТВ, ПВ, ТВ, концентрация фибриногена, РФМК, D-димеры. На втором этапе назначаются специфические исследования, позволяющие уточнить диагноз: агрегация тромбоцитов с различными индукторами, активность и антиген vWF, активность плазменных факторов свертывания, физиологических антикоагулянтов, фибринолитической системы, лабораторная диагностика АФС, уровень гомоцистеина, ПЦР-диагностика наследственных тромбофилий и др. Выбор уточняющих тестов зависит от клинической ситуации и результатов скрининговых исследований.
Врачи, направляющие пациентов на контроль эффективности антикоагулянтной терапии, должны помнить о необходимости соблюдения пациентами графика приема АК и мониторинга с помощью лабораторных исследований. Ведь последствиями пренебрежения правилами подготовки пациента могут быть такие угрозы, как ятрогенные (лекарственные) тромбозы и кровотечения, ложные суждения о наличии коагулопатии и в целом увеличение расходов на повторные исследования.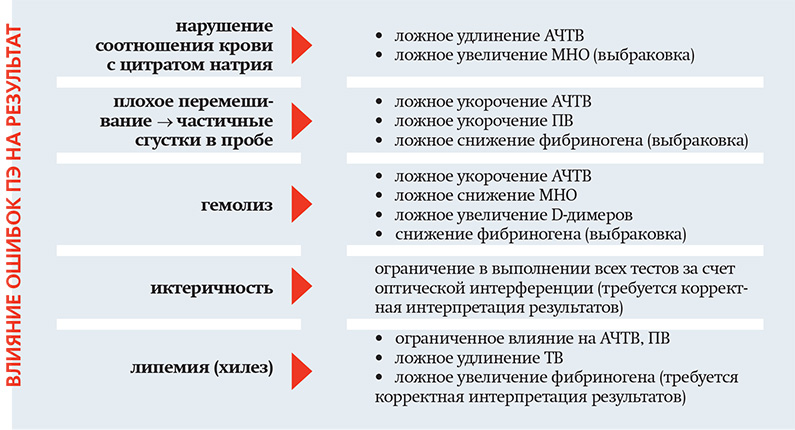 Фото Татьяны Столяровой, «МВ».
Фото Татьяны Столяровой, «МВ».
Лабораторные исследования — более ранний и намного более чувствительный показатель состояния человека, чем его самочувствие. Результаты анализов отражают физико-химические свойства исследуемой пробы и дают объективную диагностическую информацию. Важные решения по тактике лечения врач зачастую принимает даже при небольших изменениях лабораторных показателей. Поэтому лабораторные исследования для диагностики и лечения заболеваний так важны. Однако результаты анализов далеко не всегда бывают правильными! Это связано с большим количеством факторов, способных оказать влияние на конечные результаты лабораторного тестирования.
Результаты лабораторных исследований подвержены влиянию биологической и аналитической вариации.
Биологическая вариация обусловлена внутрииндивидуальной вариацией, наблюдаемой у одного и того же человека, и межиндивидуальной вариацией, связанной с различиями между людьми.
К факторам, обуславливающим биологическую вариацию, относят:
-
Физиологические закономерности (влияние расы, пола, возраста, телосложения, характера физической активности и питания);
-
Влияние окружающей среды (климат, геомагнитные факторы, время года и суток, состав воздуха, воды и почвы в месте обитания, социально-бытовая среда);
-
Воздействие производственных и бытовых (алкоголь, никотин, наркотики) токсичных веществ, ятрогенных влияний (диагностические и лечебные процедуры, прием лекарственных средств);
-
Условия, предваряющие или сопровождающие взятие пробы (приём пищи и воды, физическая нагрузка, положение тела при взятии пробы, стрессорные и прочие факторы);
-
Время забора пробы, связанное с влиянием циркадных (суточных) ритмов и времени года;
-
Аналитическая вариация зависит от технологии анализа и используемого оборудования. Также к факторам, обуславливающим аналитическую вариацию, относят:
-
Методику взятия пробы (способ и погрешности процедуры, используемые средства, оборудование и консерванты);
-
Условия окружающей среды (температура, вибрации, тряска, интенсивность освещения) и продолжительность транспортировки биоматериала для исследования в лабораторию.
Недостоверные результаты могут быть вызваны ошибками, допущенными на разных этапах лабораторного исследования, затрудняя постановку диагноза и проведение адекватного лечения. Наиболее часто получение ошибочных результатов связано с внелабораторным (т.н. преаналитическим) этапом. Он включает в себя все стадии от назначения анализов врачом до поступления пробы в лабораторию. Именно с этим этапом связано 2/3 всех ошибочных результатов, которые могут обесценить проведенные исследования. Поэтому правильная организация преаналитического этапа – важнейший элемент обеспечения качества лабораторной диагностики.
Факторы, влияющие на правильность лабораторных исследований на преаналитическом этапе
Прием пищи
Режим питания, состав пищи, перерывы в её приёме оказывают существенное влияние на многие лабораторные показатели. После приема пищи содержание отдельных веществ в крови может повышаться или подвергаться изменениям в результате последующих гормональных эффектов. Наиболее значительно прием пищи повышает содержание в крови триглицеридов и глюкозы. Увеличивается также содержание лейкоцитов (т.н. постпрандиальный лейкоцитоз). Определение многих веществ может затрудняться мутностью, вызванной появлением в крови после приема пищи мельчайших жировых частиц (хиломикронов). Их концентрация достигает максимума через 2-2,5 часа после приема пищи, а, затем, постепенно снижается до незначительной в течение 8-10 часов. В это время целый ряд лабораторных исследований крови может быть невозможен. Голодание, тоже, может искажать результаты исследований. У здоровых людей после двух дней голодания увеличивается концентрация билирубина в крови, после еды его содержание в крови, наоборот, снижается. 3-х дневное голодание в 2-3 раза снижает концентрацию глюкозы в крови, увеличивает концентрацию триглицеридов. После 2-4-недельного голодания в крови снижается концентрация общего белка, холестерина, триглицеридов, мочевины и липопротеинов, повышается выведение почками креатинина и мочевой кислоты. На фоне длительного голодания организм переходит в режим экономии энергии, для чего снижает концентрацию в крови гормонов щитовидной железы – тироксина и трийодтиронина. Одновременно, голодание ведет к увеличению содержания в крови кортизола и дегидроэпиандростерона.
Некоторые продукты и режим питания могут влиять на результаты биохимического исследования крови и мочи. Употребление жирной пищи может повысить в крови концентрацию калия, триглицеридов и активность щелочной фосфатазы. Потребление большого количества мяса, то есть пищи с высоким содержанием белка, может увеличить концентрацию в крови мочевины, аммиака и солей кальция в моче. Пища с высоким содержанием ненасыщенных жирных кислот может вызвать снижение в крови концентрации холестерина. Бананы, ананасы, томаты, авокадо богаты серотонином. При их употреблении за 2-3 дня до исследования мочи на содержание 5-оксииндолуксусной кислоты даже у здорового человека её концентрация может стать повышенной. Диета с низким содержанием соли может приводить к повышению уровня альдостерона в 3-5 раз. Напитки, богатые кофеином, увеличивают концентрацию в крови свободных жирных кислот, стимулируют выброс надпочечниками катехоламинов и повышают активность ренина.
Прием алкоголя
Алкоголь снижает в крови концентрацию глюкозы, повышает концентрацию молочной кислоты, мочевой кислоты и триглицеридов. Прямое токсическое воздействие алкоголя на печень повышает активность в крови печеночных ферментов. Повышенное содержание в крови углевод-дефицитного трансферрина, холестерина, мочевой кислоты, активности гамма-глутамилтрансферазы (ГГТ) и увеличение среднего объема эритроцитов свидетельствует о хроническом алкоголизме.
Физическая нагрузка
Может оказывать как временное, так и продолжительное влияние. Преходящие изменения вначале проявляются снижением, а затем увеличением концентрации свободных жирных кислот в крови, двухкратным повышением концентрации аммиака и трехкратным — молочной кислоты. 1-2 часовые активные занятий в спортзале или 1-2 часовая игра в футбол приводит к временным изменениям активности креатинфосфокиназы (КФК), которые наблюдаются при обширных трансмуральных инфарктах. В меньшей степени повышается активность аспартатаминотрансферазы (АСТ) и лактатдегидрогеназы (ЛДГ). Эта ферментативная активность остается повышенной в течение суток. Физические упражнения влияют на показатели гемостаза: активируют свертывание крови и функциональную активность тромбоцитов. Длительная физическая нагрузка увеличивает концентрацию в крови половых гормонов, таких как тестостерон, андростендион и лютеинизирующий гормон (ЛГ).
При длительном постельном режиме, иммобилизации, малоподвижном образе жизни и ограничении физической активности повышается протромботический потенциал крови, возрастает риск спонтанного тромбообразования. Также, при длительной иммобилизации увеличивается выделение с мочой норадреналина, кальция, хлора, фосфатов, аммиака, в крови возрастает активность щелочной фосфатазы.
Курение
Никотин и другие содержащиеся в табачной продукции вещества (их более 2000) изменяют секрецию некоторых биологически активных веществ. Курение приводит к увеличению концентрации гемоглобина, количества и объёма эритроцитов, снижает количество лейкоцитов. У курильщиков повышается концентрация карбоксигемоглобина, катехоламинов и кортизола. Изменение концентрации этих гормонов приводит к снижению количества эозинофилов; содержание нейтрофилов, моноцитов и свободных жирных кислот увеличивается. Потребление большого количества сигарет сопровождается также повышением активности гамма-глутамилтрансферазы (ГГТ).
Эмоциональный стресс
Страх, испуг в момент взятия крови, боязнь операции, волнение перед визитом к врачу может влиять на результаты лабораторных исследований. Стрессорные воздействия сопровождаются временным лейкоцитозом; в крови снижается концентрация железа; увеличивается уровень катехоламинов, альдостерона, кортизола, инсулина, пролактина, ангиотензина, ренина, соматотропного гормона, тиреотропного гормона (ТТГ), повышается концентрация альбумина, глюкозы, холестерина, фибриногена. Сильное беспокойство, сопровождаемое глубоким и учащенным дыханием, вызывает дисбаланс кислотно-щелочного равновесия со снижением концентрации в крови молочной и жирных кислот.
Пол пациента
Практически для всех лабораторных показателей установлены достоверные половые различия. В большей степени это относится к содержанию в крови гормонов (прогестерона, эстрадиола, тестостерона, 17-ОН прогестерона, лютеинизирующего гормона, фолликулостимулирующего гормона, пролактина), транспортных белков и биологически активных соединений. В меньшей степени это относится к другим соединениям и форменным элементам крови, но и там различия могут быть существенны.
Возраст пациента
Содержание в крови большинства диагностически значимых веществ зависит от возраста и может значительно изменяться от рождения до старости. Наиболее ярко возрастные изменения проявляются в содержании гемоглобина, билирубина, активности щелочной фосфатазы, показателей липидного обмена, половых гормонов, адренокортикотропного гормона (АКТГ), альдостерона, ренина, гормон роста, паратгормона, дегидроэпиандростерона. С возрастом может меняться содержание маркеров онкологической настороженности, например простатаспецифического антигена (ПСА).
Расовая принадлежность
Для некоторых лабораторных показателей установлены различия нормальных значений между людьми отдельных рас. В сложных клинических ситуациях эти различия нужно учитывать при оценке результатов лабораторных исследований.
Индивидуальные уровни нормальных значений
Установленные нормальные (референтные) значения лабораторных показателей, дифференцированные в зависимости от пола, возраста и технологии анализа, характеризуют группу людей в целом. Однако, внутри любой возрастно-половой группы между отдельными здоровыми людьми наблюдаются также индивидуальные различия. Для некоторых лабораторных показателей эти различия между людьми одного пола и возраста могут быть многократными. С развитием лабораторных технологий, повышением точности исследований, накоплением медицинских знаний таким различиям придается все большее значение. Причина в том, что результаты исследований, присущие одному здоровому человеку, могут говорить о патологическом процессе в организме другого человека, особенно при рассмотрении их в динамике.
Беременность
Беременность является нормальным физиологическим процессом, который сопровождается перестройкой работы многих органов, значительными изменениями выработки половых и тиреоидных гормонов, транспортных белков, адренокортикотропного гормона (АКТГ), ренина, а также целого ряда биохимических и гематологических показателей. Для правильной интерпретации результатов нужно знать срок беременности, когда была взята исследуемая проба крови.
Менструальный цикл
Содержание женских половых гормонов изменяется в широком диапазоне в зависимости от фазы менструального цикла. Оценка результата таких исследований возможна только с привязкой к фазам цикла, для каждой из которых характерны свои диапазоны нормальных значений. Перед исследованием следует уточнить у врача оптимальные дни для взятия крови на анализ уровня фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), пролактина, прогестерона, эстрадиола, 17-ОН-прогестерона, андростендиона, ингибина и антимюллерова гормона (АМГ). Изменения гормонального фона могут также отражаться на результатах биохимических и гематологических лабораторных исследований. Для правильной интерпретации результатов важно точно указать день менструального цикла, когда была взята исследуемая проба крови.
Биологические ритмы
Все процессы в организме человека подвержены циклическим ритмам, таким, как циркадные и сезонные. Их влияние отражается на результатах лабораторных исследований. Циркадные (суточные) ритмы наиболее выражены для кортизола, адренокортикотропного гормона (АКТГ), альдостерона, пролактина, ренина, тиреотропного гормона (ТТГ), паратгормона и тестостерона. Отклонения их концентрации от среднесуточных значений могут достигать 400%, что обязательно должно приниматься во внимание. Например, циркадный ритм кортизола может быть причиной недостоверных результатов теста на толерантность к глюкозе, если он проводится во второй половине дня. Определяя индивидуальный циркадный ритм секреции гормона, когда в течение суток берется несколько проб анализируемого материала, в сопроводительных документах необходимо указывать точное время взятия каждой из них.
На циркадные ритмы, общие для всех людей, могут накладываться индивидуальные ритмы сна, еды и физической активности. В некоторых случаях следует учитывать сезонные влияния. Например, содержание гормона щитовидной железы трийодтиронина летом на 20% ниже, чем зимой. Содержание тестостерона, наоборот, несколько возрастает в теплое время года.
Прием лекарственных препаратов
Влияние лекарственных препаратов на результаты лабораторных тестов может быть двояким. Нужно различать действие препаратов:
а) Прием которых ожидаемо приводит к изменению результатов лабораторных исследований и действие которых контролируется по этим результатам. При проведении такого мониторинга точное время взятия крови является очень важным параметром для правильной интерпретации результатов.
б) Лабораторный контроль за действием которых не предусмотрен, но которые способны повлиять на правильность результатов лабораторных исследований. Эти препараты и их метаболиты могут привести к получению неправильных результатов лабораторных исследований, оказывая незапланированное влияние на физиологические процессы или негативно воздействовать на технологии лабораторного анализа. Например, уровень тиреотропного гормона (ТТГ) снижается при лечении допамином, концентрация тиреоидных гормонов тироксина и трийодтиронина изменяется при введении фуросемида, даназола, амиодарона и салицилатов, а применение некоторых антиантацидных препаратов может повышать уровень пролактина у мужчин. Присутствие в биологическом материале контрацептивов, салицилатов, андрогенов может специфически (перекрестные реакции) или не специфически (интерференция) влиять на результаты лабораторных исследований при определении стероидных и тиреоидных гормонов, а также связывающих белков крови. Это лишь краткая иллюстрация множества возможных воздействий. Проведение медикаментозной терапии, могущей искажать результаты анализа, следует обязательно учитывать при назначении лабораторных исследований.
По этим причинам лекарства, мешающие лабораторному анализу, если они назначены не по жизненным показаниям; принимают после взятия биоматериала. Это относится и к любым внутривенным инфузиям. Загрязнение лабораторных проб инфузионными растворами — обычная и часто встречающаяся причина получения неправильных результатов лабораторных исследований. Для исключения этого пробы следует брать из другой руки, из вены, в которую не проводится вливание. Рекомендуется информировать лабораторию о том, когда и какое вливание было проведено пациенту и когда была взята проба крови.
Диагностические и лечебные мероприятия
На результаты лабораторных исследований могут повлиять оперативные вмешательства, эндоскопия, диализ, внутривенные инфузии, пункции, инъекции, биопсии, пальпация, общий массаж, тепловые процедуры, эргометрия, функциональные тесты, введение рентгеноконтрастных веществ, лучевая и химиотерапия. Например, уровень простатаспецифического антигена (ПСА) может быть повышен в течение нескольких дней после массажа простаты, пальцевого исследования прямой кишки или катетеризации мочевого пузыря. Любые манипуляции с молочной железой или тепловые процедуры (например, сауна) приводят к увеличению уровня пролактина. Чтобы предотвратить такое влияние, пробы необходимо забирать до выполнения диагностических процедур, способных исказить результаты теста.
Прочие факторы
Среди прочих факторов, влияющих на результаты лабораторных исследований, имеют значение географическое положение местности, высота над уровнем моря и температура окружающей среды.
Положение тела при заборе крови
Положение тела пациента также влияет на ряд показателей. Переход из положения лёжа в положение сидя или стоя приводит к гидростатическому проникновению воды и фильтрующихся веществ из внутрисосудистого пространства в межклеточное (т.н. интерстициальное), составляющее 1/6 общего объема тела. Клетки крови, вещества, имеющие большую молекулярную массу и связанные с ними не могут проникнуть в ткани и остаются в сосудистом русле. Поэтому их концентрация в крови повышается, в среднем на 5-15%. С этим связана стандартизация положения пациента при взятии крови.
Способ и место забора крови
Участок тела пациента, используемый для взятия крови и техника забора также могут оказать существенное влияние на результаты лабораторных исследований. Лучшее место для забора крови на анализы — локтевая вена. Венозная кровь — лучший материал не только для определения биохимических, гормональных, серологических, иммунологических показателей, но и для общеклинического исследования. Это обусловлено тем, что применяемые в настоящее время гематологические анализаторы, с помощью которых проводят общеклинические исследования, предназначены для работы с венозной кровью. В странах, где их производят, они сертифицированы и стандартизированы для работы только с венозной кровью. Выпускаемые калибровочные и контрольные материалы также предназначены для работы гематологических анализаторов именно с венозной кровью. Помимо этого, при заборе крови из пальца есть методические особенности, которые стандартизировать очень трудно: попадание в образец значительных количеств тканевой (межклеточной) жидкости, нарушение периферического кровотока, необходимость в разведении образца и др., что приводит к ошибкам, низкой точности и воспроизводимости результатов.
Использование капиллярной крови для исследований свертывающей системы (системы гемостаза) не приемлемо в принципе. Это связано с неизбежным попаданием в образец значительных количеств тканевой (межклеточной) жидкости. Тканевая жидкость содержит тканевый тромбопластин, активирующий свертывающую систему, что приведет к получению совершенно неправильных результатов.
Важны также способ и продолжительность наложения жгута на руку при заборе крови. Наложение жгута на период более 2 мин при заборе крови из вены может привести к увеличению концентрации в пробе белков, факторов коагуляции и клеточных элементов.
Капиллярную кровь из пальца для лабораторных исследований допустимо использовать лишь в следующих случаях:
-
При ожогах, занимающих большую площадь поверхности тела пациента.
-
При наличии у пациента очень мелких вен или их плохой доступности.
-
При выраженном ожирении пациента с затрудненным доступом к венам.
-
При установленной склонности к венозному тромбозу.
-
У новорождённых.
Пункцию артерий для забора крови используют редко (преимущественно для исследования газового состава артериальной крови).
Хранение и транспортировка биологических материалов
Чувствительность компонентов биологических материалов, имеющих диагностическое значение и изучаемых в лабораториях, очень различна. Некоторые из этих компонентов способны выдерживать хранение и транспортировку при соблюдении определенных условий, другие – нет. По экономическим соображениям принято считать, что с использованием современных систем забора, методов консервации, соблюдении температурных режимов, хранение и транспортировка биологических материалов в течение ограниченного времени допустимы.
В ряде случаев это так. Тем не менее, известно, что многие важнейшие лабораторные показатели допускают очень ограниченную задержку между забором биологического материала и началом исследования. Ситуация еще больше осложняется тем, что одни компоненты лучше сохраняются при охлаждении, тогда как другие, наоборот, в таких условиях претерпевают ускоренную деградацию. Как очевидно, это значительно затрудняет хранение и транспортировку биологических материалов, учитывая, что компоненты с такими разными свойствами зачастую содержатся в одной пробирке. Нужно также учитывать различие между декларируемыми и реальными условиями сбора, хранения и доставки биологических материалов. При этом, стабильность многих компонентов крови и мочи в условиях лабораторной практики остается неизвестной.
Согласно ГОСТ Р 53079.4-2008 «Обеспечение качества клинических лабораторных исследований. Часть 4. Правила ведения преаналитического этапа», время доставки образцов в лабораторию не должно превышать 30-60 минут (для мочи – 90 минут), время от забора крови до ее центрифугирования (обязательный этап биохимических и коагулологических исследований) не должно превышать 1 часа. Также, согласно этому документу и другим авторитетным рекомендациям:
-
Не рекомендуется транспортировка образцов цельной крови, используемой, в частности, для проведения ее клинического анализа.
-
Определение скорости оседания эритроцитов (СОЭ) требует начала исследования не позднее 2-х часов с момента забора крови.
-
Моча, собранная для общего анализа крови, может храниться не более 2-х часов, причем применение консервантов нежелательно.
-
Для достоверного дифференциального подсчета лейкоцитарной формулы мазок крови должен быть приготовлен не позднее 3-х часов после ее забора.
Установлено, что в пробах крови, полученных от пациентов с выявленной патологией, могут усиливаться изменения, обычно наблюдаемые под влиянием времени и температуры. Это еще больше сокращает время допустимого хранения и транспортировки биологических материалов, поскольку стабильность компонентов может отличаться у разных пациентов.
Известно, что наименьшей стабильностью обладают показатели, характеризующие состояние свертывающей системы крови. Стандартным условием является проведение общих скрининговых исследований свертывающей системы в течение максимум 4-х часов с момента забора крови. Для т.н. интегральных исследований свертывающей системы крови (исследование тромбодинамики, тромбоэластография) временная задержка, связанная с транспортировкой образцов, недопустима в принципе – получение неправильных, дезориентирующих врача результатов происходит уже после 30-45-минутного промедления. Исследование тромбоцитарного звена свертывающей системы крови еще более уникально – это единственное из более чем 2500 лабораторных исследований, ведущееся на живых клетках. Последнее абсолютно исключает как транспортировку, так и любую задержку начала работы. Все сказанное тем более важно, что судить о состоянии свертывающей системы крови по концентрации или активности отдельных ее компонентов нельзя – значение имеет работа всей системы в целом.
Периодичность лабораторных исследований
Повторные исследования широко используются для оценки эффективности проводимого лечения и прогнозировании исхода заболевания, лекарственном мониторинге, постановке симуляционных тестов. Чтобы избежать получения ошибочных результатов, интервалы между исследованиями должны выбираться с учетом продолжительности «жизни» определяемого вещества в организме, динамики его накопления и выведения при нормальных и патологических процессах, фармакокинетических свойств лекарственных препаратов.
НП «Центр внешнего контроля качества клинических лабораторных исследований»;
ФГБУ «Государственный научно-исследовательский центр профилактической медицины» Минздравсоцразвития России, Москва

Внешняя оценка качества коагулологических исследований в рамках ФСВОК: источники аналитических погрешностей
Как цитировать:
Заикин Е.В. Внешняя оценка качества коагулологических исследований в рамках ФСВОК: источники аналитических погрешностей. Лабораторная служба.
2015;4(2):27‑37.
Zaikin EV. External quality assessment in coagulation testing according to Russian Federal External Quality Assessment Scheme: Sources of Analytical Errors. Laboratory Service. 2015;4(2):27‑37. (In Russ.)
https://doi.org/10.17116/labs20154227-37

Введение
Определение показателей системы гемостаза является одним из важнейших направлений клинической лабораторной диагностики. В силу ряда технологических особенностей этот вид анализа подвержен влиянию многих факторов и требует регулярного выполнения внутрилабораторного контроля и внешней оценки качества. Внешняя оценка качества коагулологических исследований в нашей стране осуществляется в пяти разделах Федеральной системы внешней оценки качества клинических лабораторных исследований (ФСВОК), посвященных оценке качества определения процента протромбина по Квику, международного нормализованного отношения (МНО), активированного частичного тромбопластинового времени (АЧТВ), тромбинового времени, фибриногена, антитромбина, факторов VIII, IX, Виллебранда, протеинов C и S, плазминогена, волчаночного антикоагулянта и D-димера.
В настоящей работе представлены алгоритмы оценки качества наиболее широко применяемых в клинической практике коагулологических исследований, выполняемой в разделе ФСВОК «Коагулология», а также результаты многофакторного дисперсионного анализа результатов исследования контрольных образцов участниками данного раздела и изучения зависимости доли неудовлетворительных результатов от уровня определяемых показателей.
Материал и методы
В рамках раздела «Коагулология» ФСВОК внешней оценке качества подлежат определения 6 показателей системы гемостаза: процента протромбина по Квику, МНО, АЧТВ, тромбинового времени, фибриногена и антитромбина. Определение протромбинового времени (ПВ) в секундах было признано экспертами ФСВОК нестандартизованным показателем. По этой причине оно не подлежит оценке как самостоятельный показатель, для которого требуется обеспечить единство измерений в разных лабораториях, в отличие от его производных. Тем не менее, результаты определения ПВ запрашиваются наряду с международным индексом чувствительности (МИЧ) тромбопластина и средним нормальным протромбиновым временем (СНПВ) стандартной плазмы с целью контроля правильности вычисления МНО по формуле:

Участники данного раздела получают 3 раза в год наборы контрольных образцов лиофилизированной плазмы крови человека с различными уровнями определяемых показателей. Каждый набор содержит по 2 образца, обозначаемых буквенными индексами «K» и «L». Образцы должны быть исследованы в разные дни (в разных аналитических сериях), по 2 измерения каждого из показателей, определяемых в данной лаборатории (рис. 1

Схема с двумя различными образцами
В случае, если «K» и «L» — различные образцы, результаты их анализа оцениваются отдельно. По результатам двух параллельных измерений каждого образца рассчитывают среднее значение (Х) и относительный размах (R) между ними:

где Х1 и Х2 — соответственно результаты 1-го и 2-го измерений определяемого показателя. Величина Х используется для оценки правильности полученных результатов (степени близости среднего к целевому значению; характеризуется величиной относительного смещения), а величина R — для оценки их повторяемости (степени близости результатов измерений между собой).
Величину относительного смещения (B) рассчитывают по формуле:

где ЦЗ — целевое значение, рассчитывается как среднее арифметическое величин Х в группе лабораторий, использовавших одну и ту же методику анализа (или по всем лабораториям, проанализировавшим данный контрольный образец, если код метода/набора реагентов не был указан, отнесен к «прочим» или размер группы оказался менее 5 лабораторий). Если распределение величин Х имеет положительную асимметрию и может быть нормализовано логарифмированием, в качестве целевого значения используется среднее геометрическое. Под методикой, образующей группу, обычно понимают наборы реагентов одного производителя, но в некоторых случаях могут быть исключения, если наборы от одного производителя дают существенно различные результаты, для которых производителем установлены различные референтные интервалы.
Образец результатов внешней оценки качества для конкретного участника при схеме с двумя различными образцами представляется в виде таблицы и четырех графиков (рис. 2
 ). В качестве критериев оценки допустимости величин B и R экспертами ФСВОК установлены фиксированные пределы в процентах (табл. 1
). В качестве критериев оценки допустимости величин B и R экспертами ФСВОК установлены фиксированные пределы в процентах (табл. 1
Схема с двумя одинаковыми образцами
В случае, если образцы «K» и «L» в наборе представлены одним и тем же пулом плазмы, величина Х рассчитывается по всем четырем результатам измерений:

где XK1 — 1-е измерение образца «K», XK2 — 2-е измерение образца «K», XL1 — 1-е измерение образца «L», XL2 — 2-е измерение образца «L». Целевое значение и смещение среднего (B) рассчитываются так же, как и в предыдущем случае.
Поскольку образцы «K» и «L» исследуются в разные дни, это позволяет рассчитать междневной относительный размах между средними значениями в двух образцах (Q), который используется для оценки воспроизводимости (степени близости результатов измерений образцов «K» и «L», выполненных в разные дни):

где XK и XL — средние значения определяемого показателя в образцах «K» и «L» соответственно, вычисляются по формулам:

Оценкой повторяемости служит средний относительный внутридневной размах (R):

где RK и RL — значения относительных размахов между двумя параллельными измерениями образцов «K» и «L» соответственно, выполненными в один день, вычисляются по формулам:

Образец результатов внешней оценки качества для конкретного участника при схеме с двумя одинаковыми образцами представляется в виде таблицы и трех графиков (рис. 3
 ). Для величин B, Q и R установлены фиксированные допуски в процентах (табл. 2
). Для величин B, Q и R установлены фиксированные допуски в процентах (табл. 2
Рекомендации участникам ФСВОК
По итогам каждого контрольного цикла участники ФСВОК получают общие рекомендации по выявлению источников погрешностей их методик на основании результатов оценки правильности, воспроизводимости и повторяемости.
Неудовлетворительная оценка по правильности (помечена звездочкой величина относительного смещения) означает наличие недопустимо большой систематической погрешности результатов лаборатории. В этом случае рекомендуется проверить прежде всего качество используемых в лаборатории калибровочных образцов, правильность выполнения процедуры калибровки аналитической системы (если методика калибруется по стандартным образцам), стабильность работы измерительных и дозирующих устройств (отсутствие дрейфа), качество реактивов.
Неудовлетворительная оценка по воспроизводимости свидетельствует о нестабильной работе аналитической системы изо дня в день. В основе такого вида нестабильности лежат факторы, которые остаются постоянными в течение дня, но могут случайно меняться день ото дня: калибровка, набор реагентов, температура в помещении и т.п. Кроме того, в междневной размах, определенный по результатам, полученным в разных контрольных образцах, исследованных в разные дни, вносит вклад неточность дозировки воды при растворении лиофилизатов и, возможно, разное ее качество.
Неудовлетворительная оценка по повторяемости означает наличие недопустимо больших различий результатов повторных измерений одного и того же образца, выполненных в одной и той же аналитической серии. В этом случае рекомендуется в первую очередь обратить внимание на показатели, которые могут меняться в течение одной аналитической серии (одного дня) — дозируемый объем образца (нестабильность работы дозирующего устройства), температура реакционной смеси, стабильность показаний прибора, чистота реакционных пробирок и т.п. В случае использования автоматических анализаторов следует обратить внимание на то, сколько времени проба находится в штативе анализатора при 37 °С в ожидании анализа.
Дисперсионный анализ совокупности результатов
При индивидуальной внешней оценке результатов конкретной лаборатории их смещение рассматривается как лабораторная составляющая систематической погрешности методики. Погрешность, связанная с использованием наборов реагентов конкретного производителя, выносится за скобки, поскольку находится вне зоны ответственности лаборатории. Целевые значения для оценки правильности устанавливаются отдельно по каждому набору реагентов или совокупности наборов от одного производителя. Однако, как видно из рис. 2
 и 3
и 3 , распределение результатов анализа конкретного пула плазмы всеми участниками имеет вид, подобный распределению Гаусса (в линейной или логарифмической шкале), как в целом, так и в группе лабораторий, использовавших один и тот же набор реагентов. Это означает, что каждое смещение лаборатории, будучи систематической погрешностью по отдельности, является вместе с тем случайной величиной и может быть представлена статистическими параметрами: средним и дисперсией (коэффициентом вариации).
, распределение результатов анализа конкретного пула плазмы всеми участниками имеет вид, подобный распределению Гаусса (в линейной или логарифмической шкале), как в целом, так и в группе лабораторий, использовавших один и тот же набор реагентов. Это означает, что каждое смещение лаборатории, будучи систематической погрешностью по отдельности, является вместе с тем случайной величиной и может быть представлена статистическими параметрами: средним и дисперсией (коэффициентом вариации).
Схема межлабораторного эксперимента с двумя одинаковыми контрольными образцами может быть описана линейной моделью дисперсионного анализа [1] как сумма погрешностей различного происхождения. Поскольку каждая лаборатория в рамках одного контрольного цикла может использовать только один метод/набор реагентов, а контрольный образец является расходуемым и не может быть проанализирован в разных лабораториях и даже в одной лаборатории в разных аналитических сериях, такая модель дисперсионного анализа называется группированным планом:

где Xijkl — результат l-го измерения в k-й аналитической серии в j-й лаборатории i-м методом/набором реагентов; μ — математическое ожидание измеряемой физической величины (принятое опорное значение); γi — погрешность i-го метода/набора реагентов (i = 1, …, I), характеризуется коэффициентом межнаборной вариации CVнабор, оценка суммы μ и γi используется в качестве целевого значения: ЦЗ = μ+γi; δij — погрешность j-й лаборатории
(j = 1, …, Ji), характеризуется коэффициентом межлабораторной вариации CVлаб.; εijk — погрешность k-й аналитической серии (k = 1, …, Kij), характеризуется коэффициентом междневной вариации CVмеждн;
ζijkl — погрешность l-го измерения (l = 1, …, Lijk), характеризуется коэффициентом внутридневной вариации CVвнутр.
Дисперсионный анализ позволяет стратифицировать различные компоненты дисперсии таким образом, что дисперсия выборки равна сумме дисперсий от всех включенных в модель источников погрешностей. В модели с пропорциональными ошибками вместо стандартных отклонений используют коэффициенты вариации, а доля того или иного источника в общей погрешности равна доле в процентах соответствующего CV2 в квадратичной сумме:

При проведении дисперсионного анализа из расчета были исключены группы результатов, сформированные по признаку набора реагентов, в которых было менее 20 лабораторий, а также результаты, в которых код набора реагентов не был указан или отнесен к «прочим». Тем не менее, репрезентативные группы, вошедшие в расчет, представляют более 90% результатов, как видно на примере МНО (рис. 4

Результаты и обсуждение
В данной работе представлены результаты, полученные в рамках ФСВОК в 2011 и 2014 г. В 2014 г. в разделе «Коагулология» приняли участие 2094 лаборатории из 7478 участников ФСВОК, а в 2011 г. — 1842 лаборатории из 7381. В 2014 г. были использованы обе схемы оценки качества: с различными и одинаковыми образцами, и мы имеем возможность сравнить доли результатов, не удовлетворяющих установленным критериям, для различных показателей на разных контрольных материалах. В 2011 г. во всех трех циклах применялась схема с двумя одинаковыми образцами, что позволяет провести дисперсионный анализ результатов в рамках единой линейной модели и сравнить вклад различных источников аналитической погрешности в зависимости от уровня определяемых показателей в контрольных образцах.
Оценка по схеме с двумя различными образцами
В первых двух циклах 2014 г. в контролируемые лаборатории были разосланы наборы контрольных материалов по схеме с двумя различными образцами (табл. 3


Хотя МНО считается наиболее стандартизованным показателем, тем не менее и на его примере было показано, что суммарный коэффициент межлабораторной вариации увеличивается по мере изменения значений МНО в контрольных образцах от нормальных к патологическим (рис. 6

Оценка по схеме с двумя одинаковыми образцами
В цикле 3-14 в контролируемые лаборатории были направлены наборы контрольных материалов по схеме с двумя одинаковыми контрольными образцами, в которых уровни определяемых показателей находились в районе границы между нормой и патологией. Доля неудовлетворительных результатов при оценке правильности, воспроизводимости и повторяемости относительно допусков, установленных экспертами ФСВОК, в большинстве случаев лежала в пределах 5-10% (табл. 4

Поскольку величина диапазонов допустимых значений в определенной степени связана с достигнутым уровнем качества методов исследования, доля неудовлетворительных результатов позволяет сравнивать соответствие им различных методик на разных контрольных образцах только в пределах одной аналитической характеристики. Если доля неудовлетворительных результатов при оценке повторяемости, например, превышает таковую при оценке правильности, это не означает, что смещение оказывает меньшее влияние на общую погрешность результата, чем случайная ошибка методики. Для сравнения влияния факторов внутридневной, междневной, межлабораторной и межнаборной вариации на дисперсию конечного результата необходимо иметь план межлабораторного эксперимента, соответствующий вышеописанной линейной модели дисперсионного анализа.
В 2011 г. во всех трех циклах раздела «Коагулология» была использована схема с двумя одинаковыми контрольными образцами, причем уровни определяемых показателей варьировались в разных циклах от нормальных к патологическим. Образцы цикла 2-11 были условно «нормальными», цикла 1-11 — «пограничными», а цикла 3-11 — «патологическими». Антитромбин в 2011 г. не был включен в раздел «Коагулология». Методом дисперсионного анализа были получены оценки коэффициентов вариации, характеризующих 4 фактора в иерархической модели, и их процентные доли в общей неопределенности результата (табл. 5

В случае определения протромбинового времени в секундах в нормальном образце 2/3 всей погрешности измерения приходится на различия между наборами реагентов от разных производителей. После преобразования к МНО или проценту протромбина по Квику доля фактора различий между наборами реагентов не превышает 25% от общей погрешности результата. На первый план выходит межлабораторная вариация, вклад которой в общую погрешность составляет 60-75%. Вклад междневной вариабельности при определении МНО составляет от 9 до 18%, а внутридневной (случайная ошибка прибора) — от 2 до 4%. Таким образом, наиболее важным источником аналитических погрешностей является калибровка прибора в лаборатории и/или однородность партии реагентов/калибраторов от одного производителя, в том числе вследствие различий в условиях их доставки и хранения.
При определении АЧТВ наблюдается увеличение коэффициентов вариации, характеризующих все виды источников погрешностей, по мере перехода от нормальных образцов к патологическим, а также увеличение доли фактора метода/набора реагентов в общей погрешности, которая достигает 50% на патологическом образце. Разброс средних значений, полученных на разных наборах реагентов, невелик в цикле 2-11 на нормальном контрольном образце, но становится весьма значительным в цикле 3-11 на патологическом образце, где крайние значения отличаются более чем в 2 раза (табл. 6

При определении тромбинового времени результат измерения в основном зависит от используемого набора реагентов — вклад этого фактора в квадратичную сумму превышает 50% на всех
образцах. Это объясняется тем, что различные наборы реагентов содержат тромбин в различных концентрациях: обычно 3, 6 или 9 ед/мл. И чем выше концентрация тромбина, тем меньше тромбиновое время, измеренное с помощью этого набора (табл. 7

Наборы реагентов от разных производителей для определения фибриногена хорошо стандартизованы между собой: коэффициент межнаборной вариации не превышает 10% и дает примерно такой же вклад в общую погрешность, как и междневная вариация. Основной вклад (порядка 75% и более) в дисперсию результатов вносит межлабораторная составляющая.
Выводы
1. Основным источником аналитических погрешностей при определении показателей системы гемостаза является межлабораторная составляющая, которая заведомо превосходит внутридневную и междневную погрешности методик — ошибки, связанные с нестабильностью аналитической системы в рамках одного прибора.
2. Межлабораторная вариабельность на патологических образцах выше, чем на нормальных.
3. Для АЧТВ и тромбинового времени первостепенное значение приобретает различие между наборами реагентов разных производителей вследствие отсутствия их стандартизации.
Статья подготовлена при финансовой поддержке АСНП «ЦВКК».
Самое слабое звено в диагностике патологии системы гемостаза — преаналитический этап, который включает как подготовку пациента к выполнению исследования, так и саму процедуру забора и транспортировки образца крови в лабораторию. 80–85 % диагностических ошибок вызваны погрешностями на этом этапе, что объясняется высокой лабильностью и многофакторностью системы гемостаза.
 Основная цель преаналитического этапа лабораторной диагностики — обеспечить стабильность компонентов биоматериала и свести к минимуму воздействие различных факторов, влияющих на результат. Стандартизация всех условий и процедур на этом этапе является требованием внутрилабораторного контроля качества исследований.
Основная цель преаналитического этапа лабораторной диагностики — обеспечить стабильность компонентов биоматериала и свести к минимуму воздействие различных факторов, влияющих на результат. Стандартизация всех условий и процедур на этом этапе является требованием внутрилабораторного контроля качества исследований.
Обычная скрининговая коагулограмма для одного пациента обходится более 10 рублей, расширенная — порядка 40 рублей в государственных клиниках, в частных дороже. Каждый дополнительный показатель (D-димер, активность факторов свертывания и пр.) увеличивает стоимость исследования как минимум на 20 рублей.
Ошибки на преаналитическом этапе и доставка некачественных образцов в лабораторию приводят к недостоверным результатам и делают все затраты бесполезными.
Подготовка пациента
На результаты могут повлиять экзогенные «варьирующие» факторы.
Физическая активность: спустя несколько минут физической активности в 2–3 раза увеличивается концентрация FVIII и фактора Виллебранда (vWF); может сохраняться на протяжении 12 часов. Происходит активация тромбоцитов и фибринолиза, увеличивается уровень D-димеров.
Длительный психологический стресс ведет к снижению активности FV, FVIII, FIX (сохраняется на протяжении нескольких дней). Стрессовые условия во время взятия крови приводят к гиперагрегации тромбоцитов.
Физиологические гормональные изменения влияют на активность всей системы свертывания и фибринолиз. Классическим примером является беременность. При физиологическом течении беременности наблюдается постепенный рост FVII и FX. Уровень FVIII и vWF увеличивается в 2–3 раза и сохраняется даже после родов. Формируется резистентность к протеину С (РС), активность протеина S (РS) снижается на 30 %.
Увеличивается уровень маркеров активации свертывания крови и растворимого фибрина. Изменения в системе фибринолиза связаны с ростом ингибиторов РАI-1, РАI-2 (плацентарного), постепенным ростом D-димеров.
При исследовании системы гемостаза у женщин приходится учитывать фазы месячного цикла и влияние гормональных препаратов. Уровни FVIII и vWF наименьшие в фолликулярной и наибольшие в лютеиновой фазе цикла. В период менопаузы наблюдается постепенный рост фибриногена и FVIII. Применение гормонозаместительной терапии (ГЗТ) вызывает АРС-резистентность и снижение PS. Употребление жирной пищи и курение в день исследования приводят к росту фибринолитической активности, активации свертывания крови и активации тромбоцитов.
Употребление жирной пищи и курение в день исследования приводят к росту фибринолитической активности, активации свертывания крови и активации тромбоцитов.
Недостаточная стандартизация так называемых варьирующих долабораторных факторов приводит к диагностическим ошибкам и в итоге увеличивает продолжительность и стоимость диагностики и лечения пациента.
Памятка для пациента
- Кровь следует сдавать утром натощак, не менее чем через 8 ч после последнего приема пищи в условиях, которые не вызывают стресса.
- На протяжении 24 ч перед обследованием необходимо избегать физических нагрузок, употребления жирной пищи и приема алкоголя.
- В день обследования запрещается курить.
- Перед сдачей крови необходимо посидеть в течение 20–30 мин.
- При приеме варфарина рекомендуется с 17:00 до 19:00 принять всю дозу препарата с интервалом не менее 2 ч до или после приема пищи, с последующей сдачей анализа на МНО с 8:00 до 10:00.
Кстати, терминалы электронной очереди позволяют снизить влияние стрессового фактора на пациента, ожидающего взятия крови.
Что должен знать врач, направляющий пациента на обследование гемостаза
1. При назначении даты исследования врачу необходимо учитывать влияние лекарственных препаратов, принимаемых пациентом, на агрегацию тромбоцитов или параметры коагуляции (антикоагулянтов, тромболитиков, ингибиторов фибринолиза, антиагрегантов, оральных контрацептивов, НПВС, венотоников и др.). Эта информация вместе с диагнозом пациента должна быть отражена в бланке направления на исследование.
2. При высоком значении гематокрита стандартное количество цитрата в вакуумных пробирках оказывается избыточным для уменьшенного объема плазмы, что приводит к «ложной» гипокоагуляции. При значении гематокрита ниже 35 % возникает дефицит антикоагулянта в пробе, что может привести к «ложной» гиперкоагуляции в результатах и кровь может свернуться в пробирке еще до исследования. Для стабилизации образцов крови при нормальном значении гематокрита (35–50 %) рекомендуемое соотношение кровь/антикоагулянт 9:1. При отклонениях гематокрита от указанных величин следует изменить это соотношение в соответствии с формулой Ingram: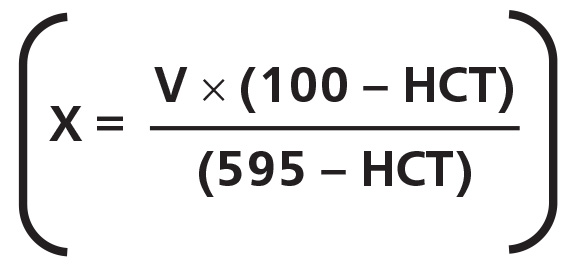
X — добавляемый объем 3,2 % цитрата, мл; V — конечный объем пробирки для крови, мл; HCT — показатель гематокрита у пациента, %.
 Перед обследованием врач должен направить пациента с патологическим уровнем гематокрита в лабораторию для расчета количества цитрата натрия и подготовки индивидуальной пробирки для взятия крови на гемостаз.
Перед обследованием врач должен направить пациента с патологическим уровнем гематокрита в лабораторию для расчета количества цитрата натрия и подготовки индивидуальной пробирки для взятия крови на гемостаз.
3. Особенности подготовки к исследованиям системы гемостаза у женщин:
- С целью диагностики болезни Виллебранда у женщин детородного возраста следует брать кровь на исследование в 1–4-й дни месячного цикла (в дни максимальной кровопотери).
- С целью диагностики снижения РS и АРС-резистентности следует отменить прием оральных контрацептивов за 2 месяца перед обследованием.
- С целью диагностики врожденных нарушений свертывания крови у беременных (особенно болезни Виллебранда и недостатка РS) кровь необходимо брать не ранее, чем через 2 месяца после родов.
4. Диагностику волчаночного антикоагулянта (ВА) в остром периоде заболевания (до 3 месяцев) при приеме НОАК, прямых ингибиторов фактора Ха и тромбина проводить не рекомендуется во избежание получения ложноположительных результатов. Если по истечении 3 месяцев пациенту необходимо проведение диагностики АФС, но он еще нуждается в приеме антикоагулянтной терапии (АКТ), рекомендуется:
Если по истечении 3 месяцев пациенту необходимо проведение диагностики АФС, но он еще нуждается в приеме антикоагулянтной терапии (АКТ), рекомендуется:
- при применении варфарина проводить исследование после того, как МНО опустится ниже 1,5, или через 1–2 недели после прекращения приема препарата; в случае необходимости продолжения АКТ препаратом выбора, который может быть назначен перед лабораторным исследованием на ВА, являются НМГ;
- последнее введение дозы НМГ должно проводиться за 12 и более часов до анализа крови на ВА. В случае применения НФГ следует отменить препарат за 2 дня до исследования ВА;
- при применении ривароксабана и дабигатрана проводить исследование через 3 дня после отмены препаратов или при переводе пациента на НМГ.
5. Мониторинг АКТ предполагает подбор дозы антикоагулянта, основанный на результатах лабораторных тестов. Крайне важно добиться от пациента правильного приема АК и следования графику.
Прием варфарина с 17:00 до 19:00 всей дозы одновременно с интервалом не менее 2 ч до или после приема пищи, с последующей сдачей анализа на МНО с 8:00 до 10:00.
Рекомендуемые уровни гипокоагуляции:
- высокий уровень МНО — от 3 до 4,5;
- средний уровень МНО — от 2 до 3;
- низкий уровень МНО — от 1,8 до 2,3.
Введение НМГ (далтепарина натрия, надропарина кальция, эноксапарина натрия) с 6:00 до 7:00 утра, сдача крови для исследования анти-Ха активности (НМГ) + антитромбина III (АТ) через 3–4 часа после введения с 10:00 до 11:00.
Целевой диапазон анти-Ха активности:
- для профилактических доз НМГ (п/к) 0,2–0,5 анти-Ха МЕ/мл;
- для лечебных (п/к) 0,5–1,5 анти-Ха МЕ/мл.
Прием ривароксабана (ксарелто) утром натощак с последующей сдачей крови для ис- следования анти-Ха активности (ривароксабан) + АТ через 1,5–2 ч после приема до 11:00.
Лабораторный контроль терапии НМГ и прямыми ингибиторами Ха-фактора рекомендован с учетом клинической ситуации в следующих случаях:
- при геморрагических проявлениях на фоне терапии;
- ОПН, ХПН;
- массе тела менее 50 и более 100 кг;
- длительной терапии (более 10 дней);
- риске кровотечений из-за сопутствующих заболеваний;
- терапии у беременных.
 6. Контроль за лечением антиагрегантами (ингибиторами циклооксигеназы, ингибиторами связывания АДФ с рецепторами тромбоцитов, антагонистами гликопротеина GpIIb/IIIa). Оценку чувствительности к антиагрегантам и достаточности дозировки рекомендуется проводить не ранее, чем через 14 дней после начала приема препаратов. Рекомендуется достижение целевого диапазона.
6. Контроль за лечением антиагрегантами (ингибиторами циклооксигеназы, ингибиторами связывания АДФ с рецепторами тромбоцитов, антагонистами гликопротеина GpIIb/IIIa). Оценку чувствительности к антиагрегантам и достаточности дозировки рекомендуется проводить не ранее, чем через 14 дней после начала приема препаратов. Рекомендуется достижение целевого диапазона.
7. С целью диагностики наследственных и приобретенных тромбоцитопатий рекомендуется проводить исследование индуцированной агрегации тромбоцитов дважды:
- на момент обращения с геморрагическими проявлениями;
- повторно не ранее, чем через 14 дней после отмены приема всех препаратов, влияющих на агрегацию тромбоцитов, в т. ч. витаминов и БАДов.
Основные требования, обеспечивающие правильность тестирования показателей гемостаза:
- атравматическая флеботомия;
- полное заполнение пробирки кровью в соответствии с объемом антикоагулянта (9:1);
- использование 3,2 % (0,109 М) трехзамещенного двухводного цитрата натрия;
- полное и осторожное смешивание крови и антикоагулянта;
- транспортировка и хранение проб крови при комнатной температуре (18–25 °С);
- получение бестромбоцитарной плазмы центрифугированием крови в течение 1 ч после взятия;
- быстрое тестирование плазмы после центрифугирования.
Кровь следует брать утром натощак из локтевой вены иглой с широким просветом (0,8 мм). Преимущество имеют вакуумные пробирки, предназначенные для получения венозной крови, стабилизированной цитратом натрия в соотношении 9:1. Использование шприца не рекомендуется из-за активации тромбоцитов и факторов свертывания турбулентным движением крови и ее смешивания с воздухом во время заполнения.
Наложение манжеты при пункции локтевой вены оптимально в течение 1 минуты.
В ходе эксперимента при 3-минутном стазе, вызванном манжетой, ПВ укорачивалось на 3,1 %, содержание фибриногена повышалось на 10,1 %, D-димеров — на 13,4 %, активность FVII и FVIII увеличивалась на 10,6 % и 10,2 % соответственно.
Недостаточное перемешивание венозной крови и антикоагулянта может вызвать образование частичных сгустков небольшого размера, которые не видны в первичных пробирках. Проба запускается в работу, на исследования расходуются дорогостоящие реагенты и только по результатам исследования врач КДЛ может заподозрить наличие в пробе сгустков. В таких случаях выбраковка проводится на постаналитическом этапе лабораторного исследования.
 На основании анализа вызываемых погрешностей из-за недобора крови и нарушения соотношения кровь/антикоагулянт Институт клинических лабораторных стандартов (CLSI) рекомендует не тестировать пробы при заполнении менее чем на 90 % требуемого объема.
На основании анализа вызываемых погрешностей из-за недобора крови и нарушения соотношения кровь/антикоагулянт Институт клинических лабораторных стандартов (CLSI) рекомендует не тестировать пробы при заполнении менее чем на 90 % требуемого объема.
Чем быстрее кровь доставлена в лабораторию, тем достовернее будет результат. Не нужно ждать 30 минут, как при получении сыворотки, чтобы сформировался сгусток. Работа ведется с плазмой, в которой, в отличие от сыворотки, есть фибриноген. Благодаря добавленному в пробирку антикоагулянту кровь не сворачивается.
По рекомендации CLSI, для тестирования плазменного звена гемостаза предпочтительным является 3,2 % (0,109 М) цитрат натрия. Применение именно этой концентрации дает меньшую частоту преаналитических ошибок, т. к. вызывает большую устойчивость лабильных факторов свертывания крови.
Для тестирования агрегационной способности тромбоцитов рекомендуется применение прямых ингибиторов тромбина и НФГ. Они оказывают наименьшее интерферирующее действие на агрегацию тромбоцитов. Очень важно сократить до минимума время между взятием крови и центрифугированием. До центрифугирования кровь необходимо хранить в закрытых пробирках только при комнатной температуре. Нарушение температурного режима может привести к гемолизу эритроцитов и активации тромбоцитов. Первичный скрининг включает в себя исследования, отражающие состояние целых звеньев системы гемостаза, которые позволяют исключить значительные отклонения и сориентировать клиницистов в направленности патологии: количество тромбоцитов, АЧТВ, ПВ, ТВ, концентрация фибриногена, РФМК, D-димеры. На втором этапе назначаются специфические исследования, позволяющие уточнить диагноз: агрегация тромбоцитов с различными индукторами, активность и антиген vWF, активность плазменных факторов свертывания, физиологических антикоагулянтов, фибринолитической системы, лабораторная диагностика АФС, уровень гомоцистеина, ПЦР-диагностика наследственных тромбофилий и др. Выбор уточняющих тестов зависит от клинической ситуации и результатов скрининговых исследований.
Первичный скрининг включает в себя исследования, отражающие состояние целых звеньев системы гемостаза, которые позволяют исключить значительные отклонения и сориентировать клиницистов в направленности патологии: количество тромбоцитов, АЧТВ, ПВ, ТВ, концентрация фибриногена, РФМК, D-димеры. На втором этапе назначаются специфические исследования, позволяющие уточнить диагноз: агрегация тромбоцитов с различными индукторами, активность и антиген vWF, активность плазменных факторов свертывания, физиологических антикоагулянтов, фибринолитической системы, лабораторная диагностика АФС, уровень гомоцистеина, ПЦР-диагностика наследственных тромбофилий и др. Выбор уточняющих тестов зависит от клинической ситуации и результатов скрининговых исследований.
Врачи, направляющие пациентов на контроль эффективности антикоагулянтной терапии, должны помнить о необходимости соблюдения пациентами графика приема АК и мониторинга с помощью лабораторных исследований. Ведь последствиями пренебрежения правилами подготовки пациента могут быть такие угрозы, как ятрогенные (лекарственные) тромбозы и кровотечения, ложные суждения о наличии коагулопатии и в целом увеличение расходов на повторные исследования. Фото Татьяны Столяровой, «МВ».
Фото Татьяны Столяровой, «МВ».
Лабораторные методы оценки системы гемостаза
Взятие
крови
Кровь из вены
следует брать иглой с широким просветом
желательно без шприца. Если кровь
вытекает медленно (у больных с гипотонией,
в терминальном состоянии, при взятии
тонкой иглой у детей), забор крови можно
осуществлять с использованием шприца.
Игла должна быть сухой и силиконированой,
шприц и пробирки также должны быть
сухими и силиконироваными (или
пластиковыми), чтобы максимально снизить
контактную активацию факторов свертывания.
После наложения жгута и прокола вены
первые 0,5 — 1,0 мл вытекающей крови не
используют для коагулологических
исследований, т.к. в нее попадают тканевая
жидкость и фрагменты тканей и клеточных
элементов, которые значительно искажают
результаты коагулограммы. Эту кровь
можно использовать для других исследований
(определение группы крови, биохимические
тесты и т.д.). Чтобы избежать венозного
застоя и тканевой гипоксии (они активируют
процессы и свертывания крови, и
фибринолиза), после взятия первой порции
необходимо слегка расслабить жгут на
2-3 сек и вновь затянуть его. В результате
застоявшаяся в венах предплечья кровь
сразу же заменяется новой (без тканевых
примесей). Время взятия крови не должно
превышать одной минуты, так как в медленно
вытекаюшей крови изменяется соотношение
между коагуляционными и фибринолитическими
компонентами.
В качестве
антикоагулянта используют забуференный
раствор 3,8%-го цитрата натрия в соотношении
1:9. Это соотношение изменяется в
зависимости от показателя гематокрита.
Уменьшение количества антикоагулянта
может спровоцировать ускорение
свертывание крови, увеличение его
количества, соответственно, увеличение
ПТВ, АЧТВ и т.д.
Исследование
должно быть выполнено тотчас после
центрифугирования, плазму можно хранить
не более 2-х часов при температуре +40С.
Если при исследовании гемостаза
используют иммуннологичекие или
колориметрические ( с применением
хромогенных субстратов) методы, плазму
можно хранить в замороженном состоянии
при -20 0С
до 14-ти суток.
Комплекс
лабораторных тестов, характеризующих
вторичный гемостаз называется
коагулограммой.
Комплекс лабораторных тестов,
характеризующих и первичный, и вторичный
гемостаз называется гемостазиограмма.
Она кроме показателей свертывания
крови, включает лабораторные тесты,
отражающие состояние сосудистой стенки,
количество и качество тромбоцитов.
1 Исследование начальных этапов коагуляционного гемостаза Время свертывания по Ли-Уайту
Принцип:
определяют время свертывания цельной
нестабилизированной венозной крови
при 37 оС
с поправкой на то, что перемешивание
крови в пробирке искусственно ускоряет
гемостаз.
Hормальные величины:
5-7 мин.
Активированное
частичное тромбопластиновое время
(АЧТВ)
Hорма: 35-45 сек.
Принцип:
определяют
время свертывания бедной тромбоцитами
цитратной плазмы при добавлении
оптимального количества кальция коалина
и кефалина.
Протромбиновое
время (протромбиновый
индекс – ПИ)
ПТВ
– это показатель внешней системы
активации протромбиназы. Оно зависит
от содержания в плазме факторов VII,
V,
Х, а также протромбина и фибриногена.
Принцип:
определяют время свертывания плазмы
бедной тромбоцитами при добавлении
избытка тромбопластина и хлорида
кальция. Согласно международным
требованиям, тромбопластин должен быть
стандартизован фирмой-изготовителем
и иметь следующие характеристики:
1. В нормальной
контрольной плазме протромбиновое
время должно быть в пределах 11-15 сек (в
среднем около 12 сек).
2.
Препарат тромбопластина должен быть
хорошо растворимым, он готовится простым
разведение дистиллированной водой или
раствором хлорида кальция (0,277%).
3.На
маркировке тромбопластин должен иметь
международный индекс чувствительности
– МИЧ (Internacional
Sensitivy
Index,
ISI).
МИЧ характеризует степень чувствительности
тромбопластина к дефициту факторов
протромбинового комплекса.
Способы выражения
ПТВ
1. Протромбиновый индекс (ПТИ)
протромбиновое
время референтное
ПТИ
= ————————————————— х
100% (Норма= 80-120%)
протромбиновое
время пациента
протромбиновое
время пациента
R
= ———————————————— (Норма =
0,8-1,2)
протромбиновое
время референтное
4.
Международный нормализационный индекс
(МНО) или Internacional
Normalised
Index
(INR)
INR
учитывает качество используемого
тромбопластина. Активность применяемого
тромбопластина характеризует международный
индекс чувствительности (Internacional
Sensitivy
Index,
ISI).
Референтный препарат человеческого
мозгового тромбопластина имеет ISI=1,0.
INR
= (Ratio)N
, где N
= ISI
(Норма = 1,0-1,4)
Соотношение
показателей следующее:
ПТВ
увеличено, R
увеличен ,INR
увеличен,
ПТИ
снижен.
Соседние файлы в предмете Лабораторная диагностика
- #
- #
- #
- #
- #
- #
- #
- #
- #
НП «Центр внешнего контроля качества клинических лабораторных исследований»;
ФГБУ «Государственный научно-исследовательский центр профилактической медицины» Минздравсоцразвития России, Москва

Внешняя оценка качества коагулологических исследований в рамках ФСВОК: источники аналитических погрешностей
Журнал:
Лабораторная служба. 2015;4(2): 27‑37
Как цитировать:
Заикин Е.В.
Внешняя оценка качества коагулологических исследований в рамках ФСВОК: источники аналитических погрешностей. Лабораторная служба.
2015;4(2):27‑37.
Zaikin EV. External quality assessment in coagulation testing according to Russian Federal External Quality Assessment Scheme: Sources of Analytical Errors. Laboratory Service. 2015;4(2):27‑37. (In Russ.).
https://doi.org/10.17116/labs20154227-37

?>
Введение
Определение показателей системы гемостаза является одним из важнейших направлений клинической лабораторной диагностики. В силу ряда технологических особенностей этот вид анализа подвержен влиянию многих факторов и требует регулярного выполнения внутрилабораторного контроля и внешней оценки качества. Внешняя оценка качества коагулологических исследований в нашей стране осуществляется в пяти разделах Федеральной системы внешней оценки качества клинических лабораторных исследований (ФСВОК), посвященных оценке качества определения процента протромбина по Квику, международного нормализованного отношения (МНО), активированного частичного тромбопластинового времени (АЧТВ), тромбинового времени, фибриногена, антитромбина, факторов VIII, IX, Виллебранда, протеинов C и S, плазминогена, волчаночного антикоагулянта и D-димера.
В настоящей работе представлены алгоритмы оценки качества наиболее широко применяемых в клинической практике коагулологических исследований, выполняемой в разделе ФСВОК «Коагулология», а также результаты многофакторного дисперсионного анализа результатов исследования контрольных образцов участниками данного раздела и изучения зависимости доли неудовлетворительных результатов от уровня определяемых показателей.
Материал и методы
В рамках раздела «Коагулология» ФСВОК внешней оценке качества подлежат определения 6 показателей системы гемостаза: процента протромбина по Квику, МНО, АЧТВ, тромбинового времени, фибриногена и антитромбина. Определение протромбинового времени (ПВ) в секундах было признано экспертами ФСВОК нестандартизованным показателем. По этой причине оно не подлежит оценке как самостоятельный показатель, для которого требуется обеспечить единство измерений в разных лабораториях, в отличие от его производных. Тем не менее, результаты определения ПВ запрашиваются наряду с международным индексом чувствительности (МИЧ) тромбопластина и средним нормальным протромбиновым временем (СНПВ) стандартной плазмы с целью контроля правильности вычисления МНО по формуле:

Участники данного раздела получают 3 раза в год наборы контрольных образцов лиофилизированной плазмы крови человека с различными уровнями определяемых показателей. Каждый набор содержит по 2 образца, обозначаемых буквенными индексами «K» и «L». Образцы должны быть исследованы в разные дни (в разных аналитических сериях), по 2 измерения каждого из показателей, определяемых в данной лаборатории (рис. 1

Схема с двумя различными образцами
В случае, если «K» и «L» — различные образцы, результаты их анализа оцениваются отдельно. По результатам двух параллельных измерений каждого образца рассчитывают среднее значение (Х) и относительный размах (R) между ними:

где Х1 и Х2 — соответственно результаты 1-го и 2-го измерений определяемого показателя. Величина Х используется для оценки правильности полученных результатов (степени близости среднего к целевому значению; характеризуется величиной относительного смещения), а величина R — для оценки их повторяемости (степени близости результатов измерений между собой).
Величину относительного смещения (B) рассчитывают по формуле:

где ЦЗ — целевое значение, рассчитывается как среднее арифметическое величин Х в группе лабораторий, использовавших одну и ту же методику анализа (или по всем лабораториям, проанализировавшим данный контрольный образец, если код метода/набора реагентов не был указан, отнесен к «прочим» или размер группы оказался менее 5 лабораторий). Если распределение величин Х имеет положительную асимметрию и может быть нормализовано логарифмированием, в качестве целевого значения используется среднее геометрическое. Под методикой, образующей группу, обычно понимают наборы реагентов одного производителя, но в некоторых случаях могут быть исключения, если наборы от одного производителя дают существенно различные результаты, для которых производителем установлены различные референтные интервалы.
Образец результатов внешней оценки качества для конкретного участника при схеме с двумя различными образцами представляется в виде таблицы и четырех графиков (рис. 2
 ). В качестве критериев оценки допустимости величин B и R экспертами ФСВОК установлены фиксированные пределы в процентах (табл. 1
). В качестве критериев оценки допустимости величин B и R экспертами ФСВОК установлены фиксированные пределы в процентах (табл. 1
Схема с двумя одинаковыми образцами
В случае, если образцы «K» и «L» в наборе представлены одним и тем же пулом плазмы, величина Х рассчитывается по всем четырем результатам измерений:

где XK1 — 1-е измерение образца «K», XK2 — 2-е измерение образца «K», XL1 — 1-е измерение образца «L», XL2 — 2-е измерение образца «L». Целевое значение и смещение среднего (B) рассчитываются так же, как и в предыдущем случае.
Поскольку образцы «K» и «L» исследуются в разные дни, это позволяет рассчитать междневной относительный размах между средними значениями в двух образцах (Q), который используется для оценки воспроизводимости (степени близости результатов измерений образцов «K» и «L», выполненных в разные дни):

где XK и XL — средние значения определяемого показателя в образцах «K» и «L» соответственно, вычисляются по формулам:

Оценкой повторяемости служит средний относительный внутридневной размах (R):

где RK и RL — значения относительных размахов между двумя параллельными измерениями образцов «K» и «L» соответственно, выполненными в один день, вычисляются по формулам:

Образец результатов внешней оценки качества для конкретного участника при схеме с двумя одинаковыми образцами представляется в виде таблицы и трех графиков (рис. 3
 ). Для величин B, Q и R установлены фиксированные допуски в процентах (табл. 2
). Для величин B, Q и R установлены фиксированные допуски в процентах (табл. 2
Рекомендации участникам ФСВОК
По итогам каждого контрольного цикла участники ФСВОК получают общие рекомендации по выявлению источников погрешностей их методик на основании результатов оценки правильности, воспроизводимости и повторяемости.
Неудовлетворительная оценка по правильности (помечена звездочкой величина относительного смещения) означает наличие недопустимо большой систематической погрешности результатов лаборатории. В этом случае рекомендуется проверить прежде всего качество используемых в лаборатории калибровочных образцов, правильность выполнения процедуры калибровки аналитической системы (если методика калибруется по стандартным образцам), стабильность работы измерительных и дозирующих устройств (отсутствие дрейфа), качество реактивов.
Неудовлетворительная оценка по воспроизводимости свидетельствует о нестабильной работе аналитической системы изо дня в день. В основе такого вида нестабильности лежат факторы, которые остаются постоянными в течение дня, но могут случайно меняться день ото дня: калибровка, набор реагентов, температура в помещении и т.п. Кроме того, в междневной размах, определенный по результатам, полученным в разных контрольных образцах, исследованных в разные дни, вносит вклад неточность дозировки воды при растворении лиофилизатов и, возможно, разное ее качество.
Неудовлетворительная оценка по повторяемости означает наличие недопустимо больших различий результатов повторных измерений одного и того же образца, выполненных в одной и той же аналитической серии. В этом случае рекомендуется в первую очередь обратить внимание на показатели, которые могут меняться в течение одной аналитической серии (одного дня) — дозируемый объем образца (нестабильность работы дозирующего устройства), температура реакционной смеси, стабильность показаний прибора, чистота реакционных пробирок и т.п. В случае использования автоматических анализаторов следует обратить внимание на то, сколько времени проба находится в штативе анализатора при 37 °С в ожидании анализа.
Дисперсионный анализ совокупности результатов
При индивидуальной внешней оценке результатов конкретной лаборатории их смещение рассматривается как лабораторная составляющая систематической погрешности методики. Погрешность, связанная с использованием наборов реагентов конкретного производителя, выносится за скобки, поскольку находится вне зоны ответственности лаборатории. Целевые значения для оценки правильности устанавливаются отдельно по каждому набору реагентов или совокупности наборов от одного производителя. Однако, как видно из рис. 2
 и 3
и 3 , распределение результатов анализа конкретного пула плазмы всеми участниками имеет вид, подобный распределению Гаусса (в линейной или логарифмической шкале), как в целом, так и в группе лабораторий, использовавших один и тот же набор реагентов. Это означает, что каждое смещение лаборатории, будучи систематической погрешностью по отдельности, является вместе с тем случайной величиной и может быть представлена статистическими параметрами: средним и дисперсией (коэффициентом вариации).
, распределение результатов анализа конкретного пула плазмы всеми участниками имеет вид, подобный распределению Гаусса (в линейной или логарифмической шкале), как в целом, так и в группе лабораторий, использовавших один и тот же набор реагентов. Это означает, что каждое смещение лаборатории, будучи систематической погрешностью по отдельности, является вместе с тем случайной величиной и может быть представлена статистическими параметрами: средним и дисперсией (коэффициентом вариации).
Схема межлабораторного эксперимента с двумя одинаковыми контрольными образцами может быть описана линейной моделью дисперсионного анализа [1] как сумма погрешностей различного происхождения. Поскольку каждая лаборатория в рамках одного контрольного цикла может использовать только один метод/набор реагентов, а контрольный образец является расходуемым и не может быть проанализирован в разных лабораториях и даже в одной лаборатории в разных аналитических сериях, такая модель дисперсионного анализа называется группированным планом:

где Xijkl — результат l-го измерения в k-й аналитической серии в j-й лаборатории i-м методом/набором реагентов; μ — математическое ожидание измеряемой физической величины (принятое опорное значение); γi — погрешность i-го метода/набора реагентов (i = 1, …, I), характеризуется коэффициентом межнаборной вариации CVнабор, оценка суммы μ и γi используется в качестве целевого значения: ЦЗ = μ+γi; δij — погрешность j-й лаборатории
(j = 1, …, Ji), характеризуется коэффициентом межлабораторной вариации CVлаб.; εijk — погрешность k-й аналитической серии (k = 1, …, Kij), характеризуется коэффициентом междневной вариации CVмеждн;
ζijkl — погрешность l-го измерения (l = 1, …, Lijk), характеризуется коэффициентом внутридневной вариации CVвнутр.
Дисперсионный анализ позволяет стратифицировать различные компоненты дисперсии таким образом, что дисперсия выборки равна сумме дисперсий от всех включенных в модель источников погрешностей. В модели с пропорциональными ошибками вместо стандартных отклонений используют коэффициенты вариации, а доля того или иного источника в общей погрешности равна доле в процентах соответствующего CV2 в квадратичной сумме:

При проведении дисперсионного анализа из расчета были исключены группы результатов, сформированные по признаку набора реагентов, в которых было менее 20 лабораторий, а также результаты, в которых код набора реагентов не был указан или отнесен к «прочим». Тем не менее, репрезентативные группы, вошедшие в расчет, представляют более 90% результатов, как видно на примере МНО (рис. 4

Результаты и обсуждение
В данной работе представлены результаты, полученные в рамках ФСВОК в 2011 и 2014 г. В 2014 г. в разделе «Коагулология» приняли участие 2094 лаборатории из 7478 участников ФСВОК, а в 2011 г. — 1842 лаборатории из 7381. В 2014 г. были использованы обе схемы оценки качества: с различными и одинаковыми образцами, и мы имеем возможность сравнить доли результатов, не удовлетворяющих установленным критериям, для различных показателей на разных контрольных материалах. В 2011 г. во всех трех циклах применялась схема с двумя одинаковыми образцами, что позволяет провести дисперсионный анализ результатов в рамках единой линейной модели и сравнить вклад различных источников аналитической погрешности в зависимости от уровня определяемых показателей в контрольных образцах.
Оценка по схеме с двумя различными образцами
В первых двух циклах 2014 г. в контролируемые лаборатории были разосланы наборы контрольных материалов по схеме с двумя различными образцами (табл. 3


Хотя МНО считается наиболее стандартизованным показателем, тем не менее и на его примере было показано, что суммарный коэффициент межлабораторной вариации увеличивается по мере изменения значений МНО в контрольных образцах от нормальных к патологическим (рис. 6

Оценка по схеме с двумя одинаковыми образцами
В цикле 3-14 в контролируемые лаборатории были направлены наборы контрольных материалов по схеме с двумя одинаковыми контрольными образцами, в которых уровни определяемых показателей находились в районе границы между нормой и патологией. Доля неудовлетворительных результатов при оценке правильности, воспроизводимости и повторяемости относительно допусков, установленных экспертами ФСВОК, в большинстве случаев лежала в пределах 5-10% (табл. 4

Поскольку величина диапазонов допустимых значений в определенной степени связана с достигнутым уровнем качества методов исследования, доля неудовлетворительных результатов позволяет сравнивать соответствие им различных методик на разных контрольных образцах только в пределах одной аналитической характеристики. Если доля неудовлетворительных результатов при оценке повторяемости, например, превышает таковую при оценке правильности, это не означает, что смещение оказывает меньшее влияние на общую погрешность результата, чем случайная ошибка методики. Для сравнения влияния факторов внутридневной, междневной, межлабораторной и межнаборной вариации на дисперсию конечного результата необходимо иметь план межлабораторного эксперимента, соответствующий вышеописанной линейной модели дисперсионного анализа.
В 2011 г. во всех трех циклах раздела «Коагулология» была использована схема с двумя одинаковыми контрольными образцами, причем уровни определяемых показателей варьировались в разных циклах от нормальных к патологическим. Образцы цикла 2-11 были условно «нормальными», цикла 1-11 — «пограничными», а цикла 3-11 — «патологическими». Антитромбин в 2011 г. не был включен в раздел «Коагулология». Методом дисперсионного анализа были получены оценки коэффициентов вариации, характеризующих 4 фактора в иерархической модели, и их процентные доли в общей неопределенности результата (табл. 5

В случае определения протромбинового времени в секундах в нормальном образце 2/3 всей погрешности измерения приходится на различия между наборами реагентов от разных производителей. После преобразования к МНО или проценту протромбина по Квику доля фактора различий между наборами реагентов не превышает 25% от общей погрешности результата. На первый план выходит межлабораторная вариация, вклад которой в общую погрешность составляет 60-75%. Вклад междневной вариабельности при определении МНО составляет от 9 до 18%, а внутридневной (случайная ошибка прибора) — от 2 до 4%. Таким образом, наиболее важным источником аналитических погрешностей является калибровка прибора в лаборатории и/или однородность партии реагентов/калибраторов от одного производителя, в том числе вследствие различий в условиях их доставки и хранения.
При определении АЧТВ наблюдается увеличение коэффициентов вариации, характеризующих все виды источников погрешностей, по мере перехода от нормальных образцов к патологическим, а также увеличение доли фактора метода/набора реагентов в общей погрешности, которая достигает 50% на патологическом образце. Разброс средних значений, полученных на разных наборах реагентов, невелик в цикле 2-11 на нормальном контрольном образце, но становится весьма значительным в цикле 3-11 на патологическом образце, где крайние значения отличаются более чем в 2 раза (табл. 6

При определении тромбинового времени результат измерения в основном зависит от используемого набора реагентов — вклад этого фактора в квадратичную сумму превышает 50% на всех
образцах. Это объясняется тем, что различные наборы реагентов содержат тромбин в различных концентрациях: обычно 3, 6 или 9 ед/мл. И чем выше концентрация тромбина, тем меньше тромбиновое время, измеренное с помощью этого набора (табл. 7

Наборы реагентов от разных производителей для определения фибриногена хорошо стандартизованы между собой: коэффициент межнаборной вариации не превышает 10% и дает примерно такой же вклад в общую погрешность, как и междневная вариация. Основной вклад (порядка 75% и более) в дисперсию результатов вносит межлабораторная составляющая.
Выводы
1. Основным источником аналитических погрешностей при определении показателей системы гемостаза является межлабораторная составляющая, которая заведомо превосходит внутридневную и междневную погрешности методик — ошибки, связанные с нестабильностью аналитической системы в рамках одного прибора.
2. Межлабораторная вариабельность на патологических образцах выше, чем на нормальных.
3. Для АЧТВ и тромбинового времени первостепенное значение приобретает различие между наборами реагентов разных производителей вследствие отсутствия их стандартизации.
Статья подготовлена при финансовой поддержке АСНП «ЦВКК».
Лабораторные исследования — более ранний и намного более чувствительный показатель состояния человека, чем его самочувствие. Результаты анализов отражают физико-химические свойства исследуемой пробы и дают объективную диагностическую информацию. Важные решения по тактике лечения врач зачастую принимает даже при небольших изменениях лабораторных показателей. Поэтому лабораторные исследования для диагностики и лечения заболеваний так важны. Однако результаты анализов далеко не всегда бывают правильными! Это связано с большим количеством факторов, способных оказать влияние на конечные результаты лабораторного тестирования.
Результаты лабораторных исследований подвержены влиянию биологической и аналитической вариации.
Биологическая вариация обусловлена внутрииндивидуальной вариацией, наблюдаемой у одного и того же человека, и межиндивидуальной вариацией, связанной с различиями между людьми.
К факторам, обуславливающим биологическую вариацию, относят:
-
Физиологические закономерности (влияние расы, пола, возраста, телосложения, характера физической активности и питания);
-
Влияние окружающей среды (климат, геомагнитные факторы, время года и суток, состав воздуха, воды и почвы в месте обитания, социально-бытовая среда);
-
Воздействие производственных и бытовых (алкоголь, никотин, наркотики) токсичных веществ, ятрогенных влияний (диагностические и лечебные процедуры, прием лекарственных средств);
-
Условия, предваряющие или сопровождающие взятие пробы (приём пищи и воды, физическая нагрузка, положение тела при взятии пробы, стрессорные и прочие факторы);
-
Время забора пробы, связанное с влиянием циркадных (суточных) ритмов и времени года;
-
Аналитическая вариация зависит от технологии анализа и используемого оборудования. Также к факторам, обуславливающим аналитическую вариацию, относят:
-
Методику взятия пробы (способ и погрешности процедуры, используемые средства, оборудование и консерванты);
-
Условия окружающей среды (температура, вибрации, тряска, интенсивность освещения) и продолжительность транспортировки биоматериала для исследования в лабораторию.
Недостоверные результаты могут быть вызваны ошибками, допущенными на разных этапах лабораторного исследования, затрудняя постановку диагноза и проведение адекватного лечения. Наиболее часто получение ошибочных результатов связано с внелабораторным (т.н. преаналитическим) этапом. Он включает в себя все стадии от назначения анализов врачом до поступления пробы в лабораторию. Именно с этим этапом связано 2/3 всех ошибочных результатов, которые могут обесценить проведенные исследования. Поэтому правильная организация преаналитического этапа – важнейший элемент обеспечения качества лабораторной диагностики.
Факторы, влияющие на правильность лабораторных исследований на преаналитическом этапе
Прием пищи
Режим питания, состав пищи, перерывы в её приёме оказывают существенное влияние на многие лабораторные показатели. После приема пищи содержание отдельных веществ в крови может повышаться или подвергаться изменениям в результате последующих гормональных эффектов. Наиболее значительно прием пищи повышает содержание в крови триглицеридов и глюкозы. Увеличивается также содержание лейкоцитов (т.н. постпрандиальный лейкоцитоз). Определение многих веществ может затрудняться мутностью, вызванной появлением в крови после приема пищи мельчайших жировых частиц (хиломикронов). Их концентрация достигает максимума через 2-2,5 часа после приема пищи, а, затем, постепенно снижается до незначительной в течение 8-10 часов. В это время целый ряд лабораторных исследований крови может быть невозможен. Голодание, тоже, может искажать результаты исследований. У здоровых людей после двух дней голодания увеличивается концентрация билирубина в крови, после еды его содержание в крови, наоборот, снижается. 3-х дневное голодание в 2-3 раза снижает концентрацию глюкозы в крови, увеличивает концентрацию триглицеридов. После 2-4-недельного голодания в крови снижается концентрация общего белка, холестерина, триглицеридов, мочевины и липопротеинов, повышается выведение почками креатинина и мочевой кислоты. На фоне длительного голодания организм переходит в режим экономии энергии, для чего снижает концентрацию в крови гормонов щитовидной железы – тироксина и трийодтиронина. Одновременно, голодание ведет к увеличению содержания в крови кортизола и дегидроэпиандростерона.
Некоторые продукты и режим питания могут влиять на результаты биохимического исследования крови и мочи. Употребление жирной пищи может повысить в крови концентрацию калия, триглицеридов и активность щелочной фосфатазы. Потребление большого количества мяса, то есть пищи с высоким содержанием белка, может увеличить концентрацию в крови мочевины, аммиака и солей кальция в моче. Пища с высоким содержанием ненасыщенных жирных кислот может вызвать снижение в крови концентрации холестерина. Бананы, ананасы, томаты, авокадо богаты серотонином. При их употреблении за 2-3 дня до исследования мочи на содержание 5-оксииндолуксусной кислоты даже у здорового человека её концентрация может стать повышенной. Диета с низким содержанием соли может приводить к повышению уровня альдостерона в 3-5 раз. Напитки, богатые кофеином, увеличивают концентрацию в крови свободных жирных кислот, стимулируют выброс надпочечниками катехоламинов и повышают активность ренина.
Прием алкоголя
Алкоголь снижает в крови концентрацию глюкозы, повышает концентрацию молочной кислоты, мочевой кислоты и триглицеридов. Прямое токсическое воздействие алкоголя на печень повышает активность в крови печеночных ферментов. Повышенное содержание в крови углевод-дефицитного трансферрина, холестерина, мочевой кислоты, активности гамма-глутамилтрансферазы (ГГТ) и увеличение среднего объема эритроцитов свидетельствует о хроническом алкоголизме.
Физическая нагрузка
Может оказывать как временное, так и продолжительное влияние. Преходящие изменения вначале проявляются снижением, а затем увеличением концентрации свободных жирных кислот в крови, двухкратным повышением концентрации аммиака и трехкратным — молочной кислоты. 1-2 часовые активные занятий в спортзале или 1-2 часовая игра в футбол приводит к временным изменениям активности креатинфосфокиназы (КФК), которые наблюдаются при обширных трансмуральных инфарктах. В меньшей степени повышается активность аспартатаминотрансферазы (АСТ) и лактатдегидрогеназы (ЛДГ). Эта ферментативная активность остается повышенной в течение суток. Физические упражнения влияют на показатели гемостаза: активируют свертывание крови и функциональную активность тромбоцитов. Длительная физическая нагрузка увеличивает концентрацию в крови половых гормонов, таких как тестостерон, андростендион и лютеинизирующий гормон (ЛГ).
При длительном постельном режиме, иммобилизации, малоподвижном образе жизни и ограничении физической активности повышается протромботический потенциал крови, возрастает риск спонтанного тромбообразования. Также, при длительной иммобилизации увеличивается выделение с мочой норадреналина, кальция, хлора, фосфатов, аммиака, в крови возрастает активность щелочной фосфатазы.
Курение
Никотин и другие содержащиеся в табачной продукции вещества (их более 2000) изменяют секрецию некоторых биологически активных веществ. Курение приводит к увеличению концентрации гемоглобина, количества и объёма эритроцитов, снижает количество лейкоцитов. У курильщиков повышается концентрация карбоксигемоглобина, катехоламинов и кортизола. Изменение концентрации этих гормонов приводит к снижению количества эозинофилов; содержание нейтрофилов, моноцитов и свободных жирных кислот увеличивается. Потребление большого количества сигарет сопровождается также повышением активности гамма-глутамилтрансферазы (ГГТ).
Эмоциональный стресс
Страх, испуг в момент взятия крови, боязнь операции, волнение перед визитом к врачу может влиять на результаты лабораторных исследований. Стрессорные воздействия сопровождаются временным лейкоцитозом; в крови снижается концентрация железа; увеличивается уровень катехоламинов, альдостерона, кортизола, инсулина, пролактина, ангиотензина, ренина, соматотропного гормона, тиреотропного гормона (ТТГ), повышается концентрация альбумина, глюкозы, холестерина, фибриногена. Сильное беспокойство, сопровождаемое глубоким и учащенным дыханием, вызывает дисбаланс кислотно-щелочного равновесия со снижением концентрации в крови молочной и жирных кислот.
Пол пациента
Практически для всех лабораторных показателей установлены достоверные половые различия. В большей степени это относится к содержанию в крови гормонов (прогестерона, эстрадиола, тестостерона, 17-ОН прогестерона, лютеинизирующего гормона, фолликулостимулирующего гормона, пролактина), транспортных белков и биологически активных соединений. В меньшей степени это относится к другим соединениям и форменным элементам крови, но и там различия могут быть существенны.
Возраст пациента
Содержание в крови большинства диагностически значимых веществ зависит от возраста и может значительно изменяться от рождения до старости. Наиболее ярко возрастные изменения проявляются в содержании гемоглобина, билирубина, активности щелочной фосфатазы, показателей липидного обмена, половых гормонов, адренокортикотропного гормона (АКТГ), альдостерона, ренина, гормон роста, паратгормона, дегидроэпиандростерона. С возрастом может меняться содержание маркеров онкологической настороженности, например простатаспецифического антигена (ПСА).
Расовая принадлежность
Для некоторых лабораторных показателей установлены различия нормальных значений между людьми отдельных рас. В сложных клинических ситуациях эти различия нужно учитывать при оценке результатов лабораторных исследований.
Индивидуальные уровни нормальных значений
Установленные нормальные (референтные) значения лабораторных показателей, дифференцированные в зависимости от пола, возраста и технологии анализа, характеризуют группу людей в целом. Однако, внутри любой возрастно-половой группы между отдельными здоровыми людьми наблюдаются также индивидуальные различия. Для некоторых лабораторных показателей эти различия между людьми одного пола и возраста могут быть многократными. С развитием лабораторных технологий, повышением точности исследований, накоплением медицинских знаний таким различиям придается все большее значение. Причина в том, что результаты исследований, присущие одному здоровому человеку, могут говорить о патологическом процессе в организме другого человека, особенно при рассмотрении их в динамике.
Беременность
Беременность является нормальным физиологическим процессом, который сопровождается перестройкой работы многих органов, значительными изменениями выработки половых и тиреоидных гормонов, транспортных белков, адренокортикотропного гормона (АКТГ), ренина, а также целого ряда биохимических и гематологических показателей. Для правильной интерпретации результатов нужно знать срок беременности, когда была взята исследуемая проба крови.
Менструальный цикл
Содержание женских половых гормонов изменяется в широком диапазоне в зависимости от фазы менструального цикла. Оценка результата таких исследований возможна только с привязкой к фазам цикла, для каждой из которых характерны свои диапазоны нормальных значений. Перед исследованием следует уточнить у врача оптимальные дни для взятия крови на анализ уровня фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), пролактина, прогестерона, эстрадиола, 17-ОН-прогестерона, андростендиона, ингибина и антимюллерова гормона (АМГ). Изменения гормонального фона могут также отражаться на результатах биохимических и гематологических лабораторных исследований. Для правильной интерпретации результатов важно точно указать день менструального цикла, когда была взята исследуемая проба крови.
Биологические ритмы
Все процессы в организме человека подвержены циклическим ритмам, таким, как циркадные и сезонные. Их влияние отражается на результатах лабораторных исследований. Циркадные (суточные) ритмы наиболее выражены для кортизола, адренокортикотропного гормона (АКТГ), альдостерона, пролактина, ренина, тиреотропного гормона (ТТГ), паратгормона и тестостерона. Отклонения их концентрации от среднесуточных значений могут достигать 400%, что обязательно должно приниматься во внимание. Например, циркадный ритм кортизола может быть причиной недостоверных результатов теста на толерантность к глюкозе, если он проводится во второй половине дня. Определяя индивидуальный циркадный ритм секреции гормона, когда в течение суток берется несколько проб анализируемого материала, в сопроводительных документах необходимо указывать точное время взятия каждой из них.
На циркадные ритмы, общие для всех людей, могут накладываться индивидуальные ритмы сна, еды и физической активности. В некоторых случаях следует учитывать сезонные влияния. Например, содержание гормона щитовидной железы трийодтиронина летом на 20% ниже, чем зимой. Содержание тестостерона, наоборот, несколько возрастает в теплое время года.
Прием лекарственных препаратов
Влияние лекарственных препаратов на результаты лабораторных тестов может быть двояким. Нужно различать действие препаратов:
а) Прием которых ожидаемо приводит к изменению результатов лабораторных исследований и действие которых контролируется по этим результатам. При проведении такого мониторинга точное время взятия крови является очень важным параметром для правильной интерпретации результатов.
б) Лабораторный контроль за действием которых не предусмотрен, но которые способны повлиять на правильность результатов лабораторных исследований. Эти препараты и их метаболиты могут привести к получению неправильных результатов лабораторных исследований, оказывая незапланированное влияние на физиологические процессы или негативно воздействовать на технологии лабораторного анализа. Например, уровень тиреотропного гормона (ТТГ) снижается при лечении допамином, концентрация тиреоидных гормонов тироксина и трийодтиронина изменяется при введении фуросемида, даназола, амиодарона и салицилатов, а применение некоторых антиантацидных препаратов может повышать уровень пролактина у мужчин. Присутствие в биологическом материале контрацептивов, салицилатов, андрогенов может специфически (перекрестные реакции) или не специфически (интерференция) влиять на результаты лабораторных исследований при определении стероидных и тиреоидных гормонов, а также связывающих белков крови. Это лишь краткая иллюстрация множества возможных воздействий. Проведение медикаментозной терапии, могущей искажать результаты анализа, следует обязательно учитывать при назначении лабораторных исследований.
По этим причинам лекарства, мешающие лабораторному анализу, если они назначены не по жизненным показаниям; принимают после взятия биоматериала. Это относится и к любым внутривенным инфузиям. Загрязнение лабораторных проб инфузионными растворами — обычная и часто встречающаяся причина получения неправильных результатов лабораторных исследований. Для исключения этого пробы следует брать из другой руки, из вены, в которую не проводится вливание. Рекомендуется информировать лабораторию о том, когда и какое вливание было проведено пациенту и когда была взята проба крови.
Диагностические и лечебные мероприятия
На результаты лабораторных исследований могут повлиять оперативные вмешательства, эндоскопия, диализ, внутривенные инфузии, пункции, инъекции, биопсии, пальпация, общий массаж, тепловые процедуры, эргометрия, функциональные тесты, введение рентгеноконтрастных веществ, лучевая и химиотерапия. Например, уровень простатаспецифического антигена (ПСА) может быть повышен в течение нескольких дней после массажа простаты, пальцевого исследования прямой кишки или катетеризации мочевого пузыря. Любые манипуляции с молочной железой или тепловые процедуры (например, сауна) приводят к увеличению уровня пролактина. Чтобы предотвратить такое влияние, пробы необходимо забирать до выполнения диагностических процедур, способных исказить результаты теста.
Прочие факторы
Среди прочих факторов, влияющих на результаты лабораторных исследований, имеют значение географическое положение местности, высота над уровнем моря и температура окружающей среды.
Положение тела при заборе крови
Положение тела пациента также влияет на ряд показателей. Переход из положения лёжа в положение сидя или стоя приводит к гидростатическому проникновению воды и фильтрующихся веществ из внутрисосудистого пространства в межклеточное (т.н. интерстициальное), составляющее 1/6 общего объема тела. Клетки крови, вещества, имеющие большую молекулярную массу и связанные с ними не могут проникнуть в ткани и остаются в сосудистом русле. Поэтому их концентрация в крови повышается, в среднем на 5-15%. С этим связана стандартизация положения пациента при взятии крови.
Способ и место забора крови
Участок тела пациента, используемый для взятия крови и техника забора также могут оказать существенное влияние на результаты лабораторных исследований. Лучшее место для забора крови на анализы — локтевая вена. Венозная кровь — лучший материал не только для определения биохимических, гормональных, серологических, иммунологических показателей, но и для общеклинического исследования. Это обусловлено тем, что применяемые в настоящее время гематологические анализаторы, с помощью которых проводят общеклинические исследования, предназначены для работы с венозной кровью. В странах, где их производят, они сертифицированы и стандартизированы для работы только с венозной кровью. Выпускаемые калибровочные и контрольные материалы также предназначены для работы гематологических анализаторов именно с венозной кровью. Помимо этого, при заборе крови из пальца есть методические особенности, которые стандартизировать очень трудно: попадание в образец значительных количеств тканевой (межклеточной) жидкости, нарушение периферического кровотока, необходимость в разведении образца и др., что приводит к ошибкам, низкой точности и воспроизводимости результатов.
Использование капиллярной крови для исследований свертывающей системы (системы гемостаза) не приемлемо в принципе. Это связано с неизбежным попаданием в образец значительных количеств тканевой (межклеточной) жидкости. Тканевая жидкость содержит тканевый тромбопластин, активирующий свертывающую систему, что приведет к получению совершенно неправильных результатов.
Важны также способ и продолжительность наложения жгута на руку при заборе крови. Наложение жгута на период более 2 мин при заборе крови из вены может привести к увеличению концентрации в пробе белков, факторов коагуляции и клеточных элементов.
Капиллярную кровь из пальца для лабораторных исследований допустимо использовать лишь в следующих случаях:
-
При ожогах, занимающих большую площадь поверхности тела пациента.
-
При наличии у пациента очень мелких вен или их плохой доступности.
-
При выраженном ожирении пациента с затрудненным доступом к венам.
-
При установленной склонности к венозному тромбозу.
-
У новорождённых.
Пункцию артерий для забора крови используют редко (преимущественно для исследования газового состава артериальной крови).
Хранение и транспортировка биологических материалов
Чувствительность компонентов биологических материалов, имеющих диагностическое значение и изучаемых в лабораториях, очень различна. Некоторые из этих компонентов способны выдерживать хранение и транспортировку при соблюдении определенных условий, другие – нет. По экономическим соображениям принято считать, что с использованием современных систем забора, методов консервации, соблюдении температурных режимов, хранение и транспортировка биологических материалов в течение ограниченного времени допустимы.
В ряде случаев это так. Тем не менее, известно, что многие важнейшие лабораторные показатели допускают очень ограниченную задержку между забором биологического материала и началом исследования. Ситуация еще больше осложняется тем, что одни компоненты лучше сохраняются при охлаждении, тогда как другие, наоборот, в таких условиях претерпевают ускоренную деградацию. Как очевидно, это значительно затрудняет хранение и транспортировку биологических материалов, учитывая, что компоненты с такими разными свойствами зачастую содержатся в одной пробирке. Нужно также учитывать различие между декларируемыми и реальными условиями сбора, хранения и доставки биологических материалов. При этом, стабильность многих компонентов крови и мочи в условиях лабораторной практики остается неизвестной.
Согласно ГОСТ Р 53079.4-2008 «Обеспечение качества клинических лабораторных исследований. Часть 4. Правила ведения преаналитического этапа», время доставки образцов в лабораторию не должно превышать 30-60 минут (для мочи – 90 минут), время от забора крови до ее центрифугирования (обязательный этап биохимических и коагулологических исследований) не должно превышать 1 часа. Также, согласно этому документу и другим авторитетным рекомендациям:
-
Не рекомендуется транспортировка образцов цельной крови, используемой, в частности, для проведения ее клинического анализа.
-
Определение скорости оседания эритроцитов (СОЭ) требует начала исследования не позднее 2-х часов с момента забора крови.
-
Моча, собранная для общего анализа крови, может храниться не более 2-х часов, причем применение консервантов нежелательно.
-
Для достоверного дифференциального подсчета лейкоцитарной формулы мазок крови должен быть приготовлен не позднее 3-х часов после ее забора.
Установлено, что в пробах крови, полученных от пациентов с выявленной патологией, могут усиливаться изменения, обычно наблюдаемые под влиянием времени и температуры. Это еще больше сокращает время допустимого хранения и транспортировки биологических материалов, поскольку стабильность компонентов может отличаться у разных пациентов.
Известно, что наименьшей стабильностью обладают показатели, характеризующие состояние свертывающей системы крови. Стандартным условием является проведение общих скрининговых исследований свертывающей системы в течение максимум 4-х часов с момента забора крови. Для т.н. интегральных исследований свертывающей системы крови (исследование тромбодинамики, тромбоэластография) временная задержка, связанная с транспортировкой образцов, недопустима в принципе – получение неправильных, дезориентирующих врача результатов происходит уже после 30-45-минутного промедления. Исследование тромбоцитарного звена свертывающей системы крови еще более уникально – это единственное из более чем 2500 лабораторных исследований, ведущееся на живых клетках. Последнее абсолютно исключает как транспортировку, так и любую задержку начала работы. Все сказанное тем более важно, что судить о состоянии свертывающей системы крови по концентрации или активности отдельных ее компонентов нельзя – значение имеет работа всей системы в целом.
Периодичность лабораторных исследований
Повторные исследования широко используются для оценки эффективности проводимого лечения и прогнозировании исхода заболевания, лекарственном мониторинге, постановке симуляционных тестов. Чтобы избежать получения ошибочных результатов, интервалы между исследованиями должны выбираться с учетом продолжительности «жизни» определяемого вещества в организме, динамики его накопления и выведения при нормальных и патологических процессах, фармакокинетических свойств лекарственных препаратов.
Гемостазиограмма, или расширенная коагулограмма, – это анализ крови, направленный на определение ее свертывающей способности. Его назначают, если нужно определить основные показатели системы свертываемости крови, проконтролировать процесс лечения с применением препаратов, которые угнетают свертывающую способность, а также предотвратить серьезные осложнения при некоторых заболеваниях.

- Суть анализа
- Показания к проведению
- Нормы и отклонения
- Гемостазиограмма при беременности
- Подготовка к анализу
Суть анализа
Гемостазиограмма – специальное исследование, с помощью которого можно узнать о нарушениях в системе свертываемости крови. На основе полученных данных разрабатывают комплекс мероприятий по коррекции таких отклонений.
Коагулограмма включает исследование таких показателей:
- количество тромбоцитов и эритроцитов;
- показатели гемоглобина и гематокрита;
- фибриноген;
- протромбин;
- МНО (международное нормализованное отношение, одно из исследований на протромбин);
- антитромбин III;
- протромбиновое время;
- протромбиновый индекс;
- тромбиновое время;
- АЧТВ (активированное частичное тромбопластиновое время);
- РФМК (растворимые фибрин-мономерные комплексы).
Перечисленные данные позволяют определить скорость образования сгустка крови, а также выявить избыток и недостаток компонентов, которые отвечают за сворачивание крови.
Показания к проведению
Анализ на определение свертывающей способности крови назначают при:
- Бесплодии.
- Подготовке к применению вспомогательных репродуктивных технологий (ИКСИ, ЭКО, внутриматочная инсеминация).
- Планировании беременности и ее наступлении.
- Частом появлении гематом на местах ушибов.
- Подготовке к оперативному вмешательству.
- Повторяющихся выкидышах.
- Наличии заболеваний кровеносных сосудов (варикоз, тромбозы).
- Появлении следов крови в кале и моче.
- Хронической анемии.
- Ишемии и мерцательной аритмии.
- Заболеваниях печени и селезенки.
Также это исследование назначают пациентам, которые проходят лечение с применением антикоагулянтов.
Пациентам пожилого возраста назначают коагулограмму для своевременного обнаружения проблем со свертываемостью и предупреждения таких тяжелых патологий, как инфаркт миокарда и кровоизлияние в головной мозг.
Нормы и отклонения
После получения результатов гемостазиограммы их расшифровывают. Для каждого из показателей есть свои нормы и отклонения.
Фибриноген
Это белок, который присутствует в плазме крови в растворенном виде. Обычно он не влияет на процесс кровообращения, но, при активизации свертывающей системы, превращается в фибрин. Его нити составляют основу кровяного сгустка. Чем выше показатель данного белка, тем более высок тромбогенный потенциал крови.
Нормальный показатель фибриногена — от 2 до 4 г/л. У беременных женщин на поздних сроках он может повышаться до 6–7 г/л.
АЧТВ
Это период времени, в течение которого, при условии добавления веществ-активаторов, образуется кровяной сгусток. Нормальные показатели находятся в диапазоне 28–40 секунд. Если значения более низкие, это указывает на замедление образования сгустка, более высокие – наоборот, на ускоренное образование.
МНО
Этот показатель позволяет контролировать свертывание крови у пациентов, которые по медицинским показаниям принимают антикоагулянты. Обычно диапазон нормы для них — 2–3, при этом в периоды, когда пациент не принимает такие препараты, этот показатель ниже.
Тромбоциты
В норме у мужчин и женщин число кровяных пластинок не должно превышать 500 000 Ед/мкл. Если этот показатель повышен, это указывает на риски тромбозов.
Эритроциты
Это красные клетки крови, которые содержат гемоглобин, а также принимают участие в транспортировке кислорода и углекислого газа по кровеносным сосудам. Норма эритроцитов зависит от пола и возраста.
- У мужчин от 18 до 45 лет норма находится в пределах 4,3-5,7 × 1012/л, у женщин – от 3,8 до 5,1 × 1012/л.
- У мужчин от 45 до 64 лет норма эритроцитов составляет 4,2-5,6 × 1012/л, у женщин – 3,8-5,3 × 1012/л.
- У мужчин старше 65 лет нормальный показатель этих клеток крови находится в пределах 3,8-5,8 × 1012/л, у женщин – 3,8-5,2 × 1012/л.
Протромбин
Это белок, принимающий участие в процессе свертывания крови. Он синтезируется печенью. В лабораторных условиях рассчитывают протромбин по Квику. Этот метод позволяет вычислить процентное выражение. Нормой являются показатели в пределах 78–142%.
Антитромбин III
Это физиологический антикоагулянт, который поддерживает жидкое состояние крови. Анализ проводят путем определения концентрации раствора по степени окрашиваемости. Результат выводят в процентах. Нормой для взрослых являются пределы от 66 до 124%.
Гемоглобин
Это железосодержащий белок эритроцитов, который удерживает кислород для его дальнейшей доставки в ткани организма. У мужчин норма находится в пределах 1300150160 г/л, у женщин — 120–140 г/л.
Протромбиновое время
В норме этот показатель должен составлять 10–13 секунд. Это период, за который происходит образование сгустка крови после добавления в плазму тканевого фактора.
Тромбиновое время
Это качественный тест, позволяющий определить показатели перехода фибриногена в фибрин. Показатели нормы — от 14 до 21 секунды.
Протромбиновый индекс
Это показатель, позволяющий определить отклонение во времени свертываемости образца крови, полученного от пациента, по сравнению с показателями здорового человека. В норме погрешность не должна превышать 7%.
РФМК
Тест определяет частицы тромбов в кровяном русле. Чем выше их концентрация, тем более вероятен тромбоз. Нормальные значения – от 3,0 до 4,0 мг/100 мл.
Гемостазиограмма при беременности
У беременных женщин показатели нормы гемостазиограммы отличаются от общепринятых. Некоторые из них занижены, а некоторые, наоборот, завышены.
- АЧТВ — от 17 до 20 секунд.
- Тромбиновое время — от 16 до 25 секунд.
- Фибриноген — до 6,5 г/л.
- Антитромбин — от 70 до 120%.
- Протромбин — от 78 до 142%.

Подготовка к анализу
Для получения максимально достоверных результатов необходимо правильно подготовиться к сдаче крови из вены. Эта процедура выполняется натощак.
Рекомендации по подготовке к забору крови для коагулограммы:
- За сутки отказаться от повышенных физических нагрузок.
- Последний прием пищи вечером перед предстоящей процедурой должен быть не позднее 20:00. Накануне процедуры не стоит употреблять острое и жирное, а также копчености.
- За сутки до анализа необходимо исключить употребление алкоголя.
- Утром перед сдачей крови нельзя курить, пить кофе, чай и любые другие напитки. От завтрака также нужно отказаться: кровь берут натощак.
Женщинам нужно сдать кровь на исследование свертываемости в межменструальный период.
Если пациент принимает антикоагулянты, за несколько дней до назначенного анализа прием нужно прекратить. Это обсуждается с лечащим врачом.

