Травма уретры — это частичное или полное нарушение целостности мочеиспускательного канала под действием разрушающих механических факторов. Проявляется уретроррагией, дизурией, задержкой мочи, болью, гематомой, припухлостью в зоне повреждения. Диагностируется с помощью общего анализа мочи, УЗИ уретры, ретроградной уретрографии. При ушибах возможна консервативная противовоспалительная, обезболивающая, кровоостанавливающая терапия. Для устранения разрывов выполняют катетеризацию мочевого пузыря, эпицистостомию, первичную, отсроченную, позднюю пластику уретры.
Общие сведения
Травмы уретры — распространенный вид повреждений, который в мирное время выявляется у 15% мужчин с травмами мочеполовых органов, в период войны — у 30% пострадавших пациентов. У женщин данная патология встречается редко из-за небольших размеров уретрального канала и его расположения в тазу. До 96% уретральных травм мирного времени являются закрытыми, во время военных действий резко возрастает количество отрытых огнестрельных ранений уретры. Актуальность своевременной диагностики и правильного лечения таких повреждений обусловлена быстрым развитием тяжелых инвалидизирующих осложнений и ростом летальности при задержке с оказанием специализированной помощи.
Травма уретры
Причины
Значимость отдельных этиологических факторов, вызывающих травматические повреждения мочеиспускательного канала, зависит от пола пострадавшего, времени и обстоятельств получения увечья (мирный период, боевые действия), наличия предпосылок (состояние алкогольного опьянения, виктимогенное поведение, урологические, гинекологические заболевания). Специалисты в сфере урологии и травматологии выделяют следующие группы причин уретральных травм:
- Производственный и бытовой травматизм. В мирных условиях у мужчин мочеиспускательный канал чаще всего травмируется вследствие ДТП, падения с высоты с ударом промежностью о твердый предмет, при несчастных случаях в быту, на производстве, при занятиях спортом. Задний отдел мужской и женской уретры повреждается при сочетанных травмах с переломом тазового кольца.
- Насильственные действия. Закрытые травмы переднего отдела уретрального канала становятся результатом драк или нападения злоумышленников с нанесением ударов в промежность. Наиболее распространенными причинами открытых травм у мужчин во время войны являются огнестрельные ранения, в мирный период — ножевые удары, укусы домашних и бродячих животных.
- Сексуальные эксперименты. И у мужчин, и у женщин уретральная стенка может повреждаться из-за введения в просвет твердых или острых инородных предметов во время мастурбации. В ряде случаев такие действия обусловлены психическими расстройствами (умственной отсталостью, бредом и императивными слуховыми галлюцинациями при шизофрении, психозах различного генеза).
- Акушерские травмы. Патологические роды являются ведущими в возникновении уретральных травм у женщин. Мочеиспускательный канал разрушается при ишемии и некрозе вследствие сдавливания головкой крупного плода, при разрывах влагалища, грубом выполнении акушерских операций (наложении щипцов, использовании вакуум-экстрактора, извлечении плода за тазовый конец).
- Ятрогенные воздействия. При нарушении техники проведения процедур часть диагностических и лечебных медицинских манипуляций осложняется уретральными травмами. Целостность слизистой оболочки, а иногда и более глубоких слоев стенки уретры может нарушаться при проведении катетеризации мочевого пузыря, цистоскопии, бужировании мочеиспускательного канала из-за наличия сужений.
Патогенез
Механизм повреждения уретры определяется особенностями фактора, послужившего причиной травмы. В 40-60% случаев уретральный канал повреждается при переломах со смещением тазового кольца из-за растяжения между точками крепления связочного аппарата к костям. У некоторых пациентов с политравмой возможно разрушение органа острыми костными отломками. Ведущим звеном в патогенезе большинства тупых закрытых травм уретры является нарушение кровообращения и трофики стенки вследствие образования гематомы, реже при резких сильных ударах наступает частичный разрыв оболочек органа.
Ишемия и размозжение тканей, приводящие к некрозу, также отмечаются при длительном сдавливании уретры в родах. Большинство открытых травм провоцируются разрезом или разрывом тканей инородными предметами. При неосторожном введении в уретру медицинских инструментов обычно травмируется эпителиальный слой, реже — другие оболочки. Вне зависимости от типа воздействия в зоне деструкции возникает травматическое воспаление с нарушением гемодинамики, отеком тканей, раздражением болевых рецепторов, нарушением естественного пассажа мочи, при разрушении сосудов наблюдается кровотечение различной интенсивности.
Классификация
При систематизации травм уретры учитывают их локализацию, степень нарушения целостности оболочек, наличие других увечий. У мужчин различают повреждения переднего (губчатого) и задних (перепончатого, предстательного) отделов мочеиспускательного канала. В первом случае травмируется часть органа, проходящая в пенисе, во втором — промежностные и тазовые участки уретры. Если просвет органа не сообщается с окружающими тканями, ранение считается непроникающим (ушиб, растяжение, надрыв слизистой оболочки, касательные травмы), при разрушении всех слоев уретральной стенки — проникающим (частичный, полный разрыв). Закрытые травмы не имеют сообщения с окружающей средой, при открытых нарушена целостность кожи. При отсутствии повреждений смежных органов травму называют изолированной, при наличии других ранений и переломов — сочетанной. Большое значение при выборе тактики ведения пациента играет степень травматических повреждений:
- Ушиб уретры. Наиболее частый вариант непроникающих закрытых травм, при котором вследствие удара возникает отек, в стенке органа или окружающих тканях нарушается гемодинамика, зачастую формируется гематома. Допускается выжидательная консервативная тактика с мониторингом состояния.
- Растяжение уретры. Целостность стенок сохранена, однако мочеиспускательный канал удлиняется под действием растягивающих механических нагрузок. Основную опасность представляют возможные нарушения кровообращения в тканях уретры. Пациентам обеспечивают динамическое наблюдение.
- Частичный разрыв уретры. Травма может быть ограниченной в глубину (непроникающие надрывы) или по протяженности (нециркулярные проникающие повреждения). Для восстановления целостности обычно используют катетеризацию, реже требуется проведение реконструктивной пластики.
- Полный разрыв уретры по окружности. С учетом тяжести полученных повреждений различают травмы с расстоянием между разошедшимися концами до 2 см и более 2 см. Восстановление мочеиспускательного канала невозможно без выполнения реконструктивно-пластической операции.
В качестве отдельной категории травм рассматривают размозжения уретры. Их основными особенностями считаются массивность деструкции как стенок органа, так и окружающих тканей. Размозженные повреждения, как правило, являются открытыми. Пострадавшим с подобными травмами окончательная реконструкция уретрального канала часто производится в отдаленном периоде.
Симптомы травмы уретры
Закрытое травматическое повреждение без полного разрыва органа проявляется болезненностью, резью, затруднениями при мочеиспускании, кровянистым окрашиванием первой порции мочи, выделениями крови из мочеиспускательного отверстия между мочеиспусканиями. Обычно определяется гематома в области промежности, мошонки, припухлость на участке повреждения передней части уретры. О полном разрыве уретрального канала свидетельствует прекращение мочеотделения, тяжесть, боль в нижней части живота, императивные нерезультативные позывы к мочеиспусканию, вызванные переполнением мочевого пузыря. У женщин при сочетанном разрыве передней влагалищной стенки возможно отхождение мочи через вагину. При открытых травмах выявляется прокол или зияющая рана в области полового члена, промежности.
Осложнения
Тяжелые и сочетанные травмы уретры у 45-98% пострадавших осложняются травматическим шоком, который в 7-10% случаев становится причиной летального исхода. Массивное повреждение задних отделов зачастую сопровождается значительными кровоизлияниями в полость малого таза и вторичной острой анемией. При проникающих ранениях происходит мочевая инфильтрация тканей, образуются урогематомы, которые при присоединении инфекции могут нагнаиваться. Постренальный застой мочи способствует восходящему инфицированию с развитием цистита, пиелонефрита, в тяжелых случаях — почечной недостаточности, уросепсиса. Отдаленными последствиями уретральных травм являются частые уретриты, стриктуры мочеиспускательного канала, эректильная дисфункция, недержание мочи, наружные (накожные), уретро-ректальные, уретро-влагалищные свищи, мочекаменная болезнь.
Диагностика
Достаточными основаниями для подозрения на травму уретры служат характерная клиническая картина и наличие анамнестических сведений о механическом воздействии на область промежности, половых органов. Для подтверждения травматического повреждения, определения его степени и характера обычно назначают такие инструментальные методы обследования, как:
- УЗИ. Применяется для экспресс-диагностики уретральных травм. Преимуществом ультразвукового исследования уретры является его неинвазивность. Эхографическая визуализация мочеиспускательного канала позволяет оценить его форму, просвет, состояние стенок. Методика применима только у мужчин. В сочетании с УЗИ почек, мочеточников, мочевого пузыря обеспечивает быстрое выявление сочетанного травматического повреждения тазовых органов.
- Ретроградная уретрография. Считается наиболее точным методом диагностики. При наличии проникающих травм контрастное вещество, введенное в наружное мочеиспускательное отверстие, распространяется в окружающие ткани. Уретрография обязательно проводится перед катетеризацией мочеиспускательного канала для оценки протяженности разрывов. Для большей информативности метод дополняют проведением экскреторной урографии в двух проекциях.
Вспомогательными диагностическими методами является общий анализ мочи, в котором определяются неизмененные эритроциты, и ректальное исследование, выявляющее высокое стояние предстательной железы при полных циркулярных разрывах уретры. Для определения состояния смежных органов рекомендована обзорная рентгенография таза. Эндоскопические методы обычно не применяют, чтобы не усугубить повреждение тканей. В общем анализе крови может снижаться уровень эритроцитов, гемоглобина, умеренно повышаться содержание лейкоцитов, ускоряться СОЭ. Дифференциальная диагностика проводится между различными видами травм уретрального канала, с травматическими повреждениями мочевого пузыря, ушибом, переломом полового члена без нарушения целостности уретры. По решению врача-уролога пострадавших консультирует травматолог, хирург, терапевт, анестезиолог-реаниматолог, мужчин осматривает андролог, женщин — акушер-гинеколог.
Лечение травмы уретры
Консервативное ведение допускается при наличии непроникающих ушибов, растяжений и оказании специализированной помощи не позже, чем через 6-12 часов после получения травматического повреждения. Оптимальным решением в таких случаях является обеспечение покоя, прикладывание холода, назначение НПВС, которые оказывают противовоспалительное и анальгезирующее действие, кровоостанавливающих препаратов, седативных и транквилизирующих средств. Для профилактики возможных инфекционных осложнений травмы проводится превентивная антибиотикотерапия. При нарушении мочевыделения на срок до 7 суток устанавливается резиновый катетер. В остальных случаях рекомендовано хирургическое лечение.
При выборе операции учитывают тяжесть состояния пациента и особенности травматического повреждения (локализацию, степень тяжести, вид, сочетание с другими травмами). Основными задачами хирургического вмешательства считаются обеспечение беспрепятственного оттока мочи, создание условий для заживления поврежденных тканей или реконструктивное восстановление уретры. Основными видами операций при травматической деструкции уретры являются:
- Надлобковая эпицистостомия. При частичных разрывах отвод мочи через цистостому позволяет снизить нагрузку на стенки уретры, при полных — ликвидировать острую задержку мочи. В зависимости от степени повреждения эпицистостомию дополняют катетеризацией мочевого пузыря или реконструктивной пластикой уретры, соответствующей типу повреждений.
- Первичный уретроуретроанастомоз. Сопоставление разрыва возможно при незначительном расхождении его концов, отсутствии массивных урогематом, удовлетворительном состоянии пострадавшего. Преимуществом первичного шва уретры является низкая вероятность возникновения эректильной дисфункции. Вмешательство чаще проводится при травмах губчатой части органа.
- Отсроченная пластика уретры на катетере. Мочеиспускательный канал на 2-3 недели катетеризируют трубкой из биологически инертного материала, которую устанавливают через высокое сечение мочевого пузыря. Дефект стенки ушивают после стабилизации состояния пострадавшего. Отсроченные вмешательства рекомендованы при травмах задних отделов.
Пациентам с открытыми повреждениями проводится первичная хирургическая обработка раны. При наличии мочевых затеков, урогематом обеспечивается их вскрытие и дренирование. Осложненное течение травматического процесса зачастую требует проведения поздних реконструктивно-пластических операций, позволяющих устранить стриктуры, свищи и другие отдаленные последствия.
Прогноз и профилактика
Исход уретральных травм зависит от тяжести повреждения и протяженности анатомического дефекта. Прогноз наиболее благоприятен при изолированных непроникающих ранениях. Более чем у половины пациентов с небольшими частичными разрывами происходит самостоятельная реканализация уретры. При полном циркулярном перерыве органа со значительным диастазом концов обычно требуется длительное лечение и проведение восстановительных операций. Профилактика травм уретры предполагает соблюдение норм безопасности на производстве, в быту, повышенную осторожность при спортивных тренировках, занятиях травмоопасными хобби, ограничение употребления алкогольных напитков. Важную роль в предупреждении ятрогенных повреждений играет своевременное выявление и адекватное лечение заболеваний простаты, выбор оптимальной акушерской тактики при риске осложнений в родах.
Оперативное лечение последствий повреждений костей таза и нижних мочевыводящих путей – одна из сложных и наименее разработанных проблем современной хирургии, травматологии и урологии. Большое количество неудовлетворительных результатов лечения больных с данной патологией является следствием неоправданного применения консервативного лечения и неудачных оперативных вмешательств. Количество пациентов с данным видом травмы из года в год постоянно увеличивается, что связано в первую очередь с ростом транспортного травматизма.
Ситуация усугубляется отсутствием четко разработанной схемы обследования и оказания совместной квалифицированной медицинской помощи урологами и травматологами этой группе пациентов. При этом одной из главных проблем при оперативном лечении в этом случае данной группы пациентов является правильный и научно обоснованный выбор травматологами и урологами не только того или иного оперативного пособия, но и последовательности выполнения урологического и/ или травматологического этапов.
Несомненная социальная значимость и актуальность этой проблемы побудила нас создать совместную группу, состоящую из травматологов и урологов ведущих учреждений России – ЦИТО им. Н.Н. Приорова и НИИ урологии Минздравсоцразвития РФ. Основной задачей созданной группы была разработка алгоритма обследования пациентов с сочетанными застарелыми травмами таза и уретры и выработка наиболее адекватной лечебной тактики, включая этапность оперативного лечения.
Абсолютное большинство повреждений таза в результате переломов костей, разрывов фиброзно-хрящевых структур сочленений характеризуется нарушением непрерывности и стабильности тазового кольца и относится к категории дезинтегрирующих повреждений. В большинстве случаев отмечается множественный характер повреждений таза – возникновение нескольких травматических очагов в одном или разных анатомических отделах (переднее полукольцо, заднее полукольцо, вертлужная впадина). По данным ЦИТО повреждения органов мочевыделительной системы при таких травмах составляют 45 % всех сочетанных повреждений, причем в половине случаев они характеризуются нарушением анатомической целостности органов – разрывом почек (8,3%), мочевого пузыря (25%), уретры и мочевого пузыря (4,2% всех повреждений органов мочевыделительной системы) [1].
Преобладающей причиной образования стриктуры уретры в настоящее время является последствия травмы мочеиспускательного канала. Закрытые повреждения мочеиспускательного канала в мирное время, как правило, бывают следствием транспортного и промышленного травматизма, реже – бытового, в военное время – результатом насыщенности современной армии техникой и применения оружия, обладающего большой разрушительной силой [2-5]. При травматическом повреждении уретры полный ее разрыв наблюдается в 65% наблюдений, частичный – в 35% [6].
В 68-84% причиной повреждения заднего отдела уретры является автомобильная травма, в 25-60% – падение на промежность [4, 5, 7]. По данным Palmer J.K. et al. переломы костей таза сочетаются с повреждением уретры в 10% наблюдений [8]. В свою очередь, практически все повреждения мембранозного отдела уретры, вызванные тупой травмой, сочетаются с повреждением костей таза. Кроме того, по данным Carlin B.I. et al. повреждение уретры сочетается с травмой мочевого пузыря в 10-20% [9]. Повреждения тазовых органов чаще всего встречаются у лиц в возрасте до 30 лет [10]. По данным Perry M.O. и Husmann D.A. повреждения уретры при травме таза у женщин встречается в 1-6% наблюдений, они обусловлены воздействием костных отломком и часто сочетаются с повреждениями прямой кишки (30%) и влагалища (75%) [11, 12].
Повреждения переднего отдела уретры у мужчин встречаются в три раза реже, чем повреждения заднего ее отдела, что связано с анатомическими особенностями отдела уретры, в частности высокой подвижностью висячего отдела уретры [13]. Травмы переднего отдела уретры составляют лишь 10% из всех повреждений нижних мочевыводящих путей [14]. Основной причиной повреждений переднего отдела уретры является тупая травма или проникающее ранение. При тупой травме промежности в 85% случаев повреждается бульбозный отдел уретры [15]. Причиной этого является анатомическая фиксация данного отдела уретры к лобковым костям и ее сдавление между ними и травмирующим предметом. В отличие от повреждений заднего отдела уретры, которые очень часто сочетаются с повреждениями других органов, травма переднего отдела уретры чаще бывает изолированной. Более того, травма переднего отдела уретры часто остается незамеченной пациентами, и они обращаются за медицинской помощью через несколько месяцев с жалобами на затруднение мочеиспускания из-за развития стриктуры [16].
 |
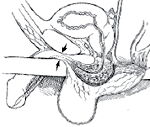
| Рисунок 1. Механизм повреждения передней уретры при тупой травме. |
| А – Повреждение уретры вследствие сдавления между предметом и лобковым симфизом. В – Мочевые затеки вследствие повреждения передней уретры |
Механизм и локализация травмы передней уретры и пути распространения мочевых затеков при ее повреждении представлены на рисунке 1.
Анатомо-физиологической особенностью тазового кольца является его жесткость, что позволяет удерживать тело в вертикальном состоянии. Кости тазового кольца отличаются малой подвижностью и большой прочностью, способны выдерживать давление массой от 200 до 1115 кг. Жесткость тазового кольца обеспечивается за счет сухожильного и связочного аппаратов. Менее прочно лонно-седалищное сочленение, составляющее переднее полукольцо. Более прочными характеристиками обладают крестцово-повздошные сочленения (заднее полукольцо).
Особенностью связочного аппарата костей таза является то, что при травме со смещением костей по плоскости более 2-3 мм происходят различные необратимые повреждения связочного аппарата переднего и/или заднего полукольца. Поэтому при различных переломах костей таза почти всегда повреждается и связочный аппарат переднего и/или заднего полукольца.
Внутри тазового кольца равномерно и индивидуально «растянут», в зависимости от конфигурации таза, мембранозный отдел уретры, состоящий из мышечно-фасциальных образований. Тазовый отдел диафрагмы анатомически располагается внутри малого таза, спереди прикрепляется к внутренним поверхностям лонно-седалищных костей, а сзади – к крестцу. За счет этого тазовые органы удерживаются от выпадения. Через тазовый отдел диафрагмы проходит уретральный канал, который располагается в непосредственной близости от переднего полукольца таза (рисунок 2).

Рисунок 2. Тазовое кольцо мочеполовой диафрагмы у мужчин
Протяженность мембранозного отдела уретры составляет 1-1,5 см, толщина стенки уретры – 0,15 мм. Этот отдел является наружным сфинктером уретры, отвечающим за удержание мочи. Именно тесное анатомо-топографическое расположение мембранозного отдела уретры внутри тазового кольца при травмах таза с повреждением переднего его полукольца приводит часто к различным повреждениям в области этого отдела уретры. У мужчин с обеих сторон от нижних поверхностей седалищных костей располагаются кавернозные тела и поэтому, как правило, при травмах переднего полукольца таза повреждается не только уретральный канал, но и кавернозные тела, что приводит к различным формам нарушений эректильной функции [8, 10].
При травме таза нарушается конфигурация тазового кольца, меняется степень натяжения тазового отдела диафрагмы, особенно это выражено на стороне повреждения. Внешний удар в область костей таза может быть причиной деформаций тазового отдела диафрагмы. Травма и возникновение болевого синдрома приводят к резкому сокращению тазового отдела диафрагмы в противоположную сторону от нанесенного внешнего воздействия, что приводит к различным нарушениям мочеиспускательного канала. Степень и характер повреждения мембранозного отдела уретры (от надрыва до разрыва) зависят от силы, скорости сокращения тазового отдела диафрагмы и степени повреждения и смещения костей таза. Протяженность и локализация различных повреждений тазового отдела диафрагмы зависят от механизма и места повреждения. При различных переломах костей таза, и особенно переднего полукольца, наиболее часто повреждаются мембранозный и/или бульбозный отдел уретры. На рисунке 3 представлен механизм нарушения целостности костных структур таза и повреждения тазовой диафрагмы фиксированной к этим структурам.

Рисунок 3. Механизм повреждения мочеполовой диафрагмы при травме костей таза (переднего полукольца) в прямой и задней проекции
Застарелые переломы костей таза, сочетающиеся с повреждениями уретры, относятся к наиболее сложным в оперативном смысле вмешательствам. Это, в первую очередь, связано с тем, что выполнение различных уретропластик с целью восстановления самостоятельного мочеиспускания в некоторых случаях бывает невозможно из-за выраженных различных посттравматических деформаций костей таза.
Сочетанная или комбинированная политравма относится к разряду наиболее тяжелых и, как правило, сопровождается не только с повреждениями костей таза и уретры, но и поражением жизненно важных органов – головного мозга, позвоночника, органов брюшной полости и т. д. Поэтому в остром периоде при поступлении пациентов в стационар в состоянии шока и кровотечения, угрожающих жизни, медицинская помощь направлена на спасение пострадавшего. Оценке степени выраженности травматологических и урологических повреждений на этом этапе уделяется минимальное внимание, если нет повреждений тазовых органов, требующих ушивания и дренирования. При поступлении в стационар пациентов с травмами таза и нарушением самостоятельного мочеиспускания или различной степени уретроррагии урологи ограничиваются установкой эпицистостомы с целью дренирования мочевого пузыря. При поступлении таких пациентов в травматологические отделения травматологи ограничиваются консервативным лечением – постельный режим и вынужденное положение на спине на 1,5-3 месяца. На этом этапе мало кто из специалистов обращает необходимое внимание на характер и степень повреждений костей таза и органов мочеполовой системы [2, 4, 17, 18].
Именно это в большинстве наблюдений становится основной причиной неудач различных видов уретропластики и возникающих после нее осложнений. К осложнениям уретропластики в этих ситуациях относится формирование рецидивных стриктур и облитераций, образование свищей различных локализаций. При восстановлении проходимости мочеиспускательного канала после уретропластики могут возникнуть такие осложнения, как различные формы недержания мочи, связанные с повреждением мембранозного отдела уретры, а также развитие ретроградной эякуляции при повреждении шейки мочевого пузыря.
Эти осложнения могут быть связаны как с выраженными посттравматическими деформациями костей таза, так и с отсутствием проведения необходимого обследования на предоперационном этапе для получения полноценной информации о состоянии больного, как травматологами, так и урологами.
Различные застарелые травматические деформации тазового кольца, как правило, сочетаются с переломами переднего полукольца со смещением и/или наличием отломков в проекции мочеиспускательного канала и/или передней стенки мочевого пузыря. Как правило, повреждение уретры при травме таза возникает в области бульбо-мембранозного отдела. Один из факторов повреждения уретры связан со смещением костных фрагментов таза в проекцию мочеиспускательного канала, что может приводить к частичному или полному сдавливанию или/и повреждению уретры с формированием в дальнейшем ее стриктуры или/и облитерации или свища. На рисунке 4 представлена совмещенная антеградная фиброцистоуретрография с ретроградной уретрографией в прямой проекции с неправильно сросшимся переломом седалищной кости слева, посттравматической облитерацией уретры и цистостомой. На снимке определяются множественные остеофиты, механическое сдавление уретры, а в проксимальной части бульбозного отдела уретры определяется облитерация уретры. Убедительно судить о наличии костных фрагментов в проекции облитерации уретры не представляется возможным. При выполнении компьютерной томографии костей таза с уретроцистографией, у этого пациента определяется механическое сдавление уретры фрагментом седалищной кости (рисунок 5).
У мужчин повреждение переднего полукольца таза и седалищных костей, особенно со смещением, часто приводит к эректильной дисфункции. Причинами этого могут быть повреждения кавернозных тел у мест прикрепления к костям таза, нарушение иннервации и повреждение сосудов полового члена.
Таким образом, осложнения после травмы таза у мужчин и женщин клинически проявляются не только различными нарушениями опорнодвигательного аппарата, но различными расстройствами мочеиспускания от острой его задержки до тотального недержания мочи. Неэффективность неоднократных попыток уретропластики в дальнейшем может привести к необходимости пожизненного дренирования мочевого пузыря цистостомой. При возникновении недержания мочи она может быть устранена установкой искусственного сфинктера мочевого пузыря или слинговой операцией, как у мужчин, так и у женщин. Серьезными осложнениями травмы таза у мужчин является нарушение потенции (эректильная дисфункция) и/или возникновение ретроградной эякуляции, что приводит к бесплодию. В связи с увеличением количества сочетанных травм костей таза и мочевыводящих путей последние годы резко увеличилось число инвалидов и количество разводов в этой группе пациентов.
Таким образом, серьезные осложнения со стороны нижних мочевых путей в результате травмы таза вызывают необходимость разработки и внедрения в практику травматологов и урологов алгоритма диагностики и лечения этих тяжелых осложнений не только для их лечения, но и для социальной адаптации пострадавшего.
Ключевые слова: травма костей таза, травма уретры, стриктура уретры, механизм повреждения уретры при травме.
Keywords: pelvic trauma, urethra trauma, urethral stricture, mechanism of urethral injury in pelvic trauma.
ЛИТЕРАТУРА
- Травматология. Национальное руководство / Под ред. Котельников Г.П., Миронов С.П. М. ГЭОТАР-Медиа. 2008.
- Pokorny M., Pontes J.E., Pierce J.M. Jr. Urological injuries associated with pelvic trauma // J Urol. 1976. Vol. 121. P. 455-457.
- Flaherty J.J., Kelley R., Burnett B., Bucy J., Surian M., Schildkraut D., Clarke B.G. Relationship of pelvic bone fracture patterns to injuries of urethra and bladder // J Urol. 1968. Vol. 99. P. 297-300.
- Fallon B., Wendt J.C., Hawtrey C.E. Urological injury and assessment in patients with fractured pelvis // J Urol. 1984. Vol. 131. P. 712-714.
- Шевцов И.П., Глухарев А.Г. Повреждения органов мочеполовой системы. Л. 1972. С. 101-159.
- Webster G.D. Perineal repair of membranous urethral stricture // Urol Clin North Am. 1989. Vol. 16. P. 303-312.
- Koraitim M.M. Pelvic fracture urethral injuries: evaluation of various methods of management // J Urol. 1996. Vol. 156. № 4. P. 1288-1291.
- Palmer J.K., Benson G.S., Corriere J.N. Jr. Diagnosis and initial management of urological injuries associated with 200 consecutive pelvic fractures // J Urol. 1983. Vol. 130. P. 712-714.
- Carlin B.I., Resnick M.I. Indications and techniques for urologic evaluation of the trauma patient with suspected urologic injury // Semin Urol. 1995. Vol. 13. № 1. P. 9-24.
- Mundy A.R. Pelvic fracture injuries of the posterior urethra // World J Urol. 1999. Vol. 17. № 2. P. 90-95.
- Perry M.O., Husmann D.A. Urethral injuries in female subjects following pelvic fractures // J Urol. 1992. Vol. 147. № 1. P. 139-143.
- Venn S.N., Greenwell T.J., Mundy A.R. Pelvic fracture injuries of the female urethra // BJU Int. 1999. Vol. 83. № 6. P. 626-630.
- Chapple C.R. Urethral injury // BJU Int. 2000. Vol. 86. № 3. P. 318-326.
- Morey A.F., McAninch J.W. Reconstruction of traumatic posterior urethral strictures // Tech Urol. 1997. Vol. 3. № 2. P. 103-107.
- Armenakas N.A., McAninch J.W. Acute anterior urethral injuries: diagnosis and initial management / In: McAninch J.W., editor. Traumatic and reconstructive urology. Philadelphia: W.B. Saunders; 1996. p. 54.
- Hernandez J., Morey A.F. Anterior urethral injury // World J Urol. 1999. Vol. 17. № 2. P. 96-100.
- Morey A.F., Hernandez J., McAninch J.W. Reconstructive surgery for trauma of the lower urinary tract // Urol Clin North Am. 1999. Vol. 26. № 1. P. 49-46.
- Christopher M. Dixon, M.D. Diagnosis and Acute Management of Posterior Urethral Disruptions / In: McAninch J.W., editor. Traumatic and reconstructive urology. Philadelphia: W.B. Saunders; 1996. Р. 347-357.
| Прикрепленный файл | Размер |
|---|---|
| Скачать статью | 944.16 кб |
# КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
УДК 616.62 — 616-001
клинические рекомендации по оказанию скорой медицинской помощи при травмах мочевого пузыря
© С. Х. Аль-Шукри, С. Ю. Боровец, В. Я. Дубинский
Кафедра урологии Первого Санкт-Петербургского государственного медицинского университета им. акад. И. П. Павлова
® Приведены клинические рекомендации оказания скорой неотложной медицинской помощи на догоспитальном этапе и в условиях отделения скорой медицинской помощи при травмах мочевого пузыря. Учтены современные представления клиницистов и рекомендации Европейской Ассоциации урологов. Указана сила рекомендаций с учетом уровня доказательности.
<©> Ключевые слова: травма мочевого пузыря, скорая медицинская помощь.
определение
Повреждения мочевого пузыря — нарушение целостности стенки мочевого пузыря под воздействием повреждающего фактора [1].
классификация
По виду повреждения мочевого пузыря разделяют на закрытые и открытые.
Среди открытых повреждений в зависимости от вида ранящего снаряда выделяют ножевые, пулевые, осколочные и др; в зависимости от характера ранения — колотые и резаные.
Закрытые повреждения разделяют на внутри-брюшинные, внебрюшинные, смешанные.
Классификация повреждений мочевого пузыря по типу травмы представлена в таблице 1
В зависимости от наличия или отсутствия повреждений других, наряду с мочевым пузырем, ор-
Классификация повреждений мочевого пузыря по типу тр
ганов выделяют сочетанные и изолированные повреждения.
По наличию осложнений выделяют неосложнен-ные и осложненные травмы. К наиболее значимым осложнениям травмы мочевого пузыря относят шок, кровопотерю, перитонит, мочевую инфильтрацию, уросепсис [2].
этиология и патогенез
Причиной закрытого повреждения мочевого пузыря в большинстве случаев является транспортная травма, реже — сдавление или падение пострадавшего, удар в надлобковую область и др. Описаны случаи ятрогенного повреждения мочевого пузыря при смене эпицистостомического дренажа, цистолитотрипсии, ТУР и др., а также открытые травмы мочевого пузыря при выполнении хирургических операций (грыжесечение,
Таблица 1
змы [3]
Вид повреждения Механизм повреждения Ассоциированные Повреждения
Тупая травма Внебрюшинная • Тупая травма таза с ранением костными отломками. • Разрушение мест прикрепления связок • Разрывы тазового кольца. • Переломы других длинных костей
Внутрибрюшинная • Высокоскоростная тупая травма нижнего этажа живота. • Резкое повышение внутрипузыр-ного давления с разрывом в области верхушки • Высокая частота сочетания с повреждениями внутрибрюшных органов. • Высокая смертность
Проникающая травма Направленное ранение пузырной стенки Обычно сочетание с ранениями других органов
гинекологические операции, экстирпация прямой кишки) [2, 4, 5].
клиническая картина
Симптомами повреждения мочевого пузыря являются: задержка мочи, частые болезненные позывы на мочеиспускание, так называемое мочеиспускание «в себя» (при внутрибрюшинном разрыве), выделение небольшого количества мочи, окрашенной кровью, явления перитонита или перитонизма. Могут возникать явления шока и кровопотери [4, 5]. При огнестрельных, колотых и резаных повреждениях большое диагностическое значение имеет выделение мочи по раневому каналу.
советы позвонившему за медицинской помощью
Рекомендуется принять имеющийся препарат из группы ненаркотических анальгетиков. Назначение наркотических препаратов маскирует клинические проявления повреждений соседних органов.
Оказание скорой медицинской помощи на догоспитальном этапе
Диагностика. Основывается на изучении причины травмы и выявлении симптомов повреждения мочевого пузыря, ведущими из которых являются частые болезненные позывы на мочеиспускание, выделение небольшого количества мочи, окрашенной кровью [6, 7]. Дифференциальная диагностика внутри- и внебрюшинных разрывов мочевого пузыря на догоспитальном этапе затруднена.
Лечение. Проводятся мероприятия по остановке кровотечения и поддержанию жизненно важных функций.
Госпитализация: Во всех случаях требуется срочная госпитализация в отделение скорой медицинской помощи или в урологический стационар.
Оказание скорой медицинской помощи на стационарном этапе
Диагностика. Экскреторная урография с нисходящей цистографией, проведение восходящей цистографии — наиболее достоверные методы диагностики разрывов мочевого пузыря. Катетеризацию мочевого пузыря выполняют на рентгеновском столе, чтобы после оценки ее результатов сразу перейти к ретроградной цистографии. Перед ее началом производится обзорная рентгенография тазовой области, что позволяет определить характер и степень костных повреждений.
Признаками проникающего внебрюшинного разрыва мочевого пузыря являются деформация его стенок и затеки рентгеноконтрастного вещества за его пределы. При внутрибрюшинных разрывах бесформенные затеки контрастного вещества определяются в брюшной полости, а при внебрюшинных разрывах — в полость малого таза. Достоверную информацию можно получить с помощью компьютерной томографии, особенно при ретроградном контрастировании мочевого пузыря [4, 6, 7].
Лечение. Лечение разрывов мочевого пузыря только оперативное, направленное на восстановление его целостности, дренирование мочевого пузыря постоянным катетером и дренирование урогемато-мы. При внебрюшинных разрывах — дренирование полости малого таза по Мак-Уортеру-Буяльскому (через запирательные отверстия) [4, 7].
наиболее часто встречающиеся ошибки
Перед выполнением ретроградной цистографии следует убедиться в отсутствии повреждения уретры, так как при этом катетеризация уретры противопоказана.
список литературы
1. Dreitlein D. A., Suner S., Basler J. Genitourinary trauma // Emerg Med Clin North Am. 2001. Vol.19, N 3. P. 569-590.
2. Руководство по урологии. Под ред. Н. А. Лопаткина (в 3-х томах). М.: Медицина. 1998. 672 с.
3. Lynch T. H., Martinez-Pineiro L., Plas E, Serafetinides E, Turk-eri L., Santucci R. A., HohenfellnerM. European Association of Urology. EAU guidelines on urological trauma // Eur. Urol. 2005. Vol.47, N 1. P.1-15.
4. Руководство по скорой медицинской помощи. Под ред. С. Ф. Багненко и др. М.: ГЭОТАР-Медиа. 2007. 816 с.
5. Урология. Национальное руководство. Под ред. Н. А. Лопаткина. М.: ГЭОТАР-Медиа, 2009. 1024 с.
6. Урология. Под ред. С. Х. Аль-Шукри и В. Н. Ткачука. М.: ГЭОТАР-Медиа, 2012. 480 с.
7. Елисеев О. М. Справочник по оказанию скорой и неотложной помощи. СПб.: Лейла. 1996. 672 с.
clinical recommendation for first medical emergency treatment for patients with bladder trauma
Al-Shukri S. H., Borovets S. Yu., Dubinskiy V. Ya.
G Summary. Clinical recommendations concerning pre-hospital emergency health care delivery as well as emergency health care delivery in the clinical department of emergency for the patients with bladder
trauma are described. Clinical recommendations were composed based on the modern recommendations of European Association of Urologist. The statistical significance of recommendations is indicated.
G Key words: bladder trauma; emergency health care.
Сведения об авторах:
Аль-Шукри Сальман Хасунович — д. м. н., профессор, заведующий кафедрой урологии. первый санкт-петербургский государственный медицинский университет им. акад. и. п. павлова. 197022, санкт-петербург, ул. льва толстого, д. 17. E-mail: alshukri@mail.ru.
Боровец Сергей Юрьевич — д. м. н., старший научный сотрудник кафедры урологии. первый санкт-петербургский государственный медицинский университет им. акад. и. п. павлова. 197022, санкт-петербург, ул. льва толстого, д. 17. E-mail: sborovets@mail.ru.
Дубинский Владислав яковлевич — к. м. н., доцент кафедры урологии. первый санкт-петербургский государственный медицинский университет им. акад. и. п. павлова. 197022, санкт-петербург, ул. льва толстого, д. 17.
Al-shukri salman Hasunovich — doctor of medical science, professor, head of the department. Department of Urology. First St. Petersburg State I. P. Pavlov Medical University. Lev Tolstoy St., 17, Saint Petersburg, 197022, Russia. E-mail: al-shukri@mail.ru.
Boronets sergey Yurievich — doctor of medical science, senior researcher, Urology Department. First St. Petersburg State I. P. Pavlov Medical University. Lev Tolstoy St., 17, Saint Petersburg, 197022, Russia. E-mail: sborovets@mail.ru.
Dubinskiy Vladislav yakovlevich — candidate of medical science, associate professor of the Urology Department. First St. Petersburg State I. P. Pavlov Medical University. Lev Tolstoy St., 17, Saint Petersburg, 197022, Russia.
Корниенко С.И. дисс.докт. М. 2012г.
Обзор литературы
«Осложнения трансуретральных вмешательств на уретре»
1.1. Основные виды эндоскопических операций на уретре и наиболее часто встречающиеся осложнения.
В настоящее время основные рентгеноэндоскопические операции, выполняемые на уретре из трансуретрального доступа, включают в себя внутреннюю уретротомию, трансуретральную резекцию уретры, эндоскопическую реканализацию уретры, трансуретральную имплантацию уретрального стента. В редких случаях при наличии камня уретры выполняется уретроскопия с удалением камня непосредственно из уретры при невозможности смещения камня в мочевой пузырь и последующей цистолитотрипсии. Таким образом, подавляющее большинство данных операций выполняются по поводу стриктур и облитераций уретры, что определяет огромную медико-социальную значимость данной проблемы.
Развитие и последующее внедрение рентгеноэндоскопических операций привело к значительному увеличению их числа и расширению показаний к их применению. В последнее время большинство урологов стали все чаще применять комбинированные оперативные вмешательства, направленные на одномоментную коррекцию нескольких заболеваний, например, стриктура уретры, доброкачественная гиперплазия простаты и камни мочевого пузыря [8], что приводит к увеличению времени операции и повышает вероятность развития осложнений.
Малоинвазивность и высокая эффективность рентгеноэндоскопических трансуретральных операций делает их привлекательными не только для пациентов, но и для урологов [26]. Осложнения, возникающие на интраоперационном и послеоперационном этапе при эндоскопической коррекции стриктур уретры крайне редко представляют собой опасность для жизни пациента, но, как правило, приводят к значительному снижнению качества жизни больного, удлиняя сроки лечения и социальной реабилитации пациента [5].
По мнению большинства авторов, своевременная профилактика, диагностика и своевременное и адекватное лечение осложнений позволяет минимизировать влияние осложнений оперативных вмешательств на течение болезни в целом и повысить эффективность лечения данной категории больных [2, 24, 25, 27, 34].
В 1876 году Otis впервые применил способ рассечения стриктур уретры с помощью уретротома без эндоскопической визуализации стриктуры [101]. Уретротом Otis проводится по передней уретре, настраивается до желаемого размера уретры с последующим извлечением ножа. Далее инструмент извлекается и по уретре устанавливался катетер для шинирования рассеченной области. Метод достаточно эффективен при лечении стриктур пенильного отдела уретры и в настоящее время нередко применяется для самостоятельного лечения стриктур и перед выполнением трансуретральной резекции простаты при наличии узкого переднего отдела уретры.
В 1971 году Sachse [101] сообщил о выполнении уретротомии «холодным» ножом под эндоскопическим контролем уретротома с прямой оптикой. Оптическая внутренняя уретротомия представляет собой рассечение рубцовых тканей уретры под контролем зрения до создания адекватного просвета уретры, позволяющего провести эндоскоп, катетер Foley для последующего шинирования уретры, проведения противорецидивной терапии. Автор описал возможные осложнения внутренней оптической уретротомии, которые могут включать в себя – уросепсис, уретроррагию, перфорацию уретры с формированием ложных ходов и затеком ирригационной жидкости, рецидив стриктуры уретры и, в редких случаях, эректильную дисфункцию.
Основным принципом операции является увеличение просвета уретры путем рассечения суженного участка и последующего заживления рассеченного участка на фоне шины вторичным натяжением. Ряд авторов [111,118] предпочитают использовать детские уретротомы для выполнения операции при стриктурах пенильного отдела уретры, так как эндоскоп меньшего калибра обладает большими манипуляционными возможностями и позволяет легче провести инструмент через суженный участок.
Многочисленные исследования прогностических критериев эффективности внутренней уретротомии показали, что наиболее значимыми являются локализация, длина, этиология, количество стриктур и степень сужения просвета уретры [7,8,13,25,29,36]. При наличии стриктуры бульбозного отдела уретры, протяженностью до 1,0см, без выраженного спонгиофиброза, внутренняя уретротомия является высокоэффективной операцией. Barry [36] сообщил о выполнении внутренней оптической уретротомии у 82 больных и отметил, что внутреняя уретротомия малоэффективна при протяженных (более 2см) стриктурах и облитерациях уретры. Также автор отмечает, что данная процедура не показана и опасна при наличии смещения фрагментов уретры по плоскости и интерпозиции костными отломками. При оценке частоты развития осложнений автор отмечает, что их частота составила менее 10%. Автор считает, что большинство осложнений может быть предупреждено при тщательном и правильном отборе больных перед операцией, всестороннем изучении анамнеза заболевания и комплексном предоперационном обследовании.
Рецидив стриктуры: рецидив стриктуры является наиболее частым осложнением внутренней уретротомии [7]. Объективная оценка частоты рецидивов после выполнения данной операции крайне затруднена в связи с различными определениями критериев эффективности операции, сроками наблюдения в отдаленные сроки после операции, критериями рецидива заболевания и разнородностью групп оперированных больных. Некоторые авторы считают, что в большинстве случаев внутреняя уретротомия с последующим бужированием является высокоэффективным методом лечения у большинства пациентов[2, 24, 27]. Другие авторы [93, 94] считают, что такая тактика является эффективной в 60-90% при наблюдении в короткие сроки после операции, а при оценке отдаленных результатов положительные результаты были отмечены лишь у 20% больных. В исследовании Pansadoro и Emiliozzi [99] сообщили о наличии удовлетворительных результатов у 32% пациентов после выполнении повторных уретротомий.
Значительное количество работ посвящено срокам шинирования уретры катетером после операции. Некоторые авторы [115] считают необходимым оставлять катетер на срок до 6 недель, хотя в других исследованиях указано, что долговременная катетеризация не имеет дополнительных преимуществ перед сроками шинирования уретры в сроки от 3 до 7 дней [47]. Ряд авторов считает более эффективной методику еженедельной катетеризации мочевого пузыря после удаления уретрального катетера, хотя в исследованиях не было доказано статистической достоверности в отношении снижения частоты рецидива в данной группе больных [2].
Кровотечение: уретроррагия является следствием рассечения рубцов до здоровых тканей спонгиозного тела, то есть при любой технически правильно выполненной операции отмечается уретроррагия. Выраженность уретроррагии может быть различной, в то время как моча по уретральному катетеру обычно светлая, так как источник кровотечения располагается дистальнее наружного сфинктера. Albers и соавторы [34] сообщили о том, что у 4% пациентов после уретротомии отмечена уретроррагия, которая требовала интенсивной консервативной терапии с наложением давящей повязки. Ни в одном случае не понадобилось выполнения открытой ревизии уретры, спонгиозного тела, окончательной остановки кровотечения.
Уретроррагия после выполнения уретротомии обычно незначительная и для ее ликвидации достаточно компрессии уретры уретральным катетером. Кровотечение более контролируемо при локализации стриктуры в области пенильного отдела уретры, компрессия достигается наложением давящей повязки в проекции места рассечения. При наличии стриктуры бульбозного отдела накладывается давящая повязка на промежность, иногда авторы отмечают лучший эффект при создании дополнительной компрессии в этой зоне с помощью специальной подкладки в виде шарика или цилиндра. Ряд авторов [7, 41] считают целесообразным производить натяжение уретрального катетера для предотвращения ретроградного поступления крови в мочевой пузырь.
Эректильная дисфункция: в области бульбозного отдела уретры спонгиозное тело имеет толщину 3-4 мм и широко соприкасается с кавернозными телами. При выполнении внутренней уретротомии в данном отделе рассечение выполняется на 12 часах условного циферблата и в ряде случаев в результате уретротомии формируется шунт между спонгиозным телом и кавернозными телами, что приводит к развитию эректильной дисфункции [42]. При развитии эректильной дисфункции после уретротомии целесообразно исключить формирование фистулы. При подтверждении диагноза необходимо выполнение хирургического вмешательства, направленного на ревизию полового члена, ликвидацию сообщения между спонгиозным и кавернозным телом путем ушивания дефекта tunica albuginea и спонгиозного тела [42].
Еще одним из механизмов формирования эректильной дисфункции после внутренней уретротомии является развитие парауретрального фиброза, формирование спонгиофиброза и хорды с развитием эректильной деформации полового члена [40]. Turner-Warwick [112] предлагает выполнять разрезы на 4 и 8 часах условного циферблата с целью снижения риска развития данного осложнения, в особенности при выполнении повторных операций.
Недержание мочи: При выполнении внутренней уретротомии в области мембранозного отдела уретры одним из осложнений операции является недержание мочи. Перед выполнением данных операций больной должен быть полностью информирован о развитии данного осложнения, о методах его лечения. Наиболее часто стриктуры данной локализации возникают после выполнения операций на предстательной железе (радикальная простатэктомия, чреспузырная аденомэктомия и трансуретральная резекция простаты). После выполнения операций у больных отсутствует внутренний сфинктер и выполнение операции в зоне наружного сфинктера нередко приводит к развитию стрессового недержания мочи. Лечение данного осложнения является достаточно трудоемким и нередко малоэффективным. В ранние сроки после операции большинству больных проводится консервативная терапия, направленная на ослабление тонуса детрузора и повышение сократительной активности наружного сфинктера, симтоматическое лечение. В настоящее время, в литературе отсутствуют четкие данные об эффективности данного лечения в связи с уникальностью данной категории больных, различными сроками наблюдения в отделенные сроки после операции и отсутствию единых критериев успеха лечения [43]. В случае неэффективности консервативного лечения больным выполняются операции, направленные на хирургическую коррекцию недержания мочи (операция TVT, инъекция коллагена в зону наружного сфинктера, имплантация искусственного сфинктера), однако результаты подобных операций изучены недостаточно и требуются дополнительные исследования в данной области [13].
Перфорация уретры и затек ирригационной жидкости: при выполнении внутренней уретротомии целесообразно использовать в качестве ирригационной жидкости физиологический раствор, 5% раствор глюкозы или сорбитол для предотвращения потенциальных проблем, связанных с возможным поступлением ирригационной жидкости за пределы уретры (т.н. «ТУР-синдром»). Данное осложнение более вероятно при перфорации уретры и контакте с кавернозными телами. Экстравазация промывной жидкости обычно более часто развивается при выполнении внутренней уретротомии по поводу послеоперационных стриктур (после уретропластики). В зоне рецидивного сужения кровообращение и иннервация тканей в значительной степени нарушены, что приводит к формированию затека ирригационной жидкости в окружающие ткани. Данное осложнение легко распознается при осмотре, когда половой член и мошонка резко увеличиваются в размерах. В случае отсутствия значительной перфорации уретры данное осложнение купируется консервативными мероприятиями. При использовании в качестве ирригационной жидкости гипо- или гиперосмолярных растворов данное осложнение может приводить к развитию так называемого «ТУР-синдрома». Однако в течение последних лет данные растворы при выполнении эндоскопических операций не используются [6, 13, 37, 109].
Перфорация уретры при выполнении внутренней оптической уретротомии отмечена у 5-9 % пациентов [7, 13, 27, 34, 49]. Авторы отмечают, что данное осложнение нередко встречается при наличии небольшого опыта выполнения данных операций у уролога, нарушении техники выполнения операции (рассечение должно выполняться только после проведения струны-проводника или мочеточникового катетера до мочевого пузыря) или наличии очень сложной (узкая и протяженная) стриктуры уретры, не позволяющей провести через нее струну-проводник или мочеточниковый катетер. По мнению большинства авторов, при возникновении данного осложнения необходимо попытаться восстановить просвет уретры и провести инструмент до мочевого пузыря с последующим шинированием поврежденной зоны уретральным катетером. При неэффективности данных попыток операция должна быть закончена установкой пункционного цистостомического дренажа. Данное осложнение является достаточно грозным в связи с развитием в последующем более грубого фиброзного процесса в парауретральных тканях и формированием более сложной стриктуры или облитерации уретры, что крайне неблагоприятно для последующего лечения пациента.
Инфекционно-воспалительные осложнения: частота развития послеоперационных инфекционно-воспалительных осложнений значительно варьирует в различных публикациях и составляет от 4 до 27% [84, 97, 100, 113]. Инфекционно-воспалительные осложнения внутренней уретротомии включают в себя уретрит, простатит, орхоэпидидимит, острый пиелонефрит и бактериотоксический шок, являющийся наиболее грозным и жизнеопасным осложнением.
Большинство авторов считает, что основными причинами развития данных осложнений является наличие инфекция мочевых путей до операции, наличие цистостомического дренажа, а с другой стороны частота развития послеоперационных инфекционно-воспалительных осложнений является показателем внутрибольничной инфекции и эффективности мер асептики и антисептики [82].
Среди адекватных мер по профилактике развития данной группы осложнений является проведение антибиотикотерапии в соответствии с данными посева мочи до операции, назначение антибиотиков широкого спектра действия интраоперационно и проведение рациональной антибиотикотерапии в послеоперационном периоде.
Небольшая продолжительность и техническая простота операции являются факторами, позволяющими избежать значительного числа осложнений. Однако, при развитии интраоперационных осложнений, таких как кровотечение и перфорация уретры с экстравазацией ирригационной жидкости вероятность развития инфекционно-воспалительных осложнений значительно повышается.
Длительность шинирования уретры после внутренней уретротомии является одним из факторов, способствующим развитию инфекционно-воспалительных осложнений. Большое количество работ посвящено снижению частоты инфекционно-воспалительных осложнений после уретротомии с помощью применения катетеров с серебряным покрытием [13, 86], антибактериальным покрытием с пролонгированным периодом рассасывания препарата [90].
Уретрит является наиболее частым из данной группы осложнений и встречается по данным различных авторов в 9 – 27% случаев [7, 83]. Данное осложнение эффективно лечится с помощью консервативной терапии. Тем не менее, развитие уретрита приводит к развитию выраженного воспаления в зоне операции, что приводит к формированию значительного фиброза и рецидиву стриктуры. С другой стороны, послеоперационный уретрит, приводящий к выраженной гипертермии и интоксикации, требует раннего удаления уретрального катетера, что также может служить причиной неэффективности операции. Многочисленными исследованиями [6, 13, 14, 22] отмечено, что частота развития уретрита прямо пропорционально зависит от калибра уретрального катетера. Считается, что использование уретрального катетера у взрослого мужчины калибром не более 16 F не вызывает значительных нарушений трофики уретры и не приводит к развитию уретрита, в то время как использование уретрального катетера размерами 20-24F приводит к растяжению стенок уретры, нарушению кровообращения в стенке мочеиспускательного канала и развитию уретрита, исходом которого является формирование значительного парауретрального фиброза.
Частота развития орхоэпидидимита и простатита после операции «Внутренняя уретротомия», составляет от 4 до 8% и зависит от наличия инфекции в моче до операции [34]. При возникновении данных осложнений проводится консервативная терапия. Оперативное лечение по поводу острого гнойно-деструктивного эпидидимоорхита проводится у 0,5% пациентов и, по всей видимости, не зависит от локализации и протяженности стриктуры, продолжительности операции, а зависит, по мнению большинства авторов, от патогенности микроорганизма, степени снижения гуморального и клеточного иммунитета, наличия факторов, поддерживающих течение воспалительного процесса (затек, уретроррагия и т.д.).
Инфекционно-воспалительные осложнения со стороны верхних мочевых путей после выполнения уретротомии встречаются редко. Большинство авторов отмечают два механизма развития острого пиелонефрита после данной операции: наиболее часто инфекция попадает в почки гематогенным путем. Изменения верхних мочевых путей, являющиеся результатом инфравезикальной обструкции по типу уретерогидронефроза и наличием пузырно-мочеточникового рефлюкса, способствуют развитию обострения хронического пиелонефрита после операции.
Бактериотоксический шок или так называемая «уретральная лихорадка» [34] является крайне редким осложнением внутренней уретротомии и развивается в результате массивного поступления в кровь грамотрицательных микроорганизмов. Частота развития данного осложнения не превышает 0,1% [22]. Лечение данного осложнения проводится в соответствие с общепринятой тактикой лечения в условиях отделения интенсивной терапии. Тактика ведения больного урологами состоит в отведении мочи из уретры методом цистостомии и удалении уретрального катетера.
Внутреняя уретротомия является стандартной и широко распространенной урологической операцией. В большинстве клиник накоплен значительный опыт лечения данной категории больных. Многочисленными исследованиями определены показания и противопоказания к операции, изучены ее критерии эффективности. При выявлении облитерации уретры выбор метода лечения гораздо более сложен и может различаться в различных клиниках.
Облитерация уретры является, как правило, следствием повреждения или полного разрыва уретры в результате производственной или бытовой травмы, а также радикальных оперативных вмешательств на уретре и по поводу онкологических заболеваний предстательной железы [29]. При переломе костей таза полный разрыв уретры встречается в 5-10% случаев [58]. Наиболее часто, в 85-90%, облитерация встречается в мембранозном и простатическом отделах уретры, причем облитерация мембранозного отдела является в основном следствием травмы, тогда как причина облитерации простатического отдела в большинстве случаев связана с оперативными вмешательствами по поводу заболеваний предстательной железы и мочевого пузыря [25]. Реже облитерация встречается в бульбозном отделе (8-10% случаев), и в висячем отделе (2-6% случаев) [59]. Нередко облитерация распространяется на несколько отделов.
Лечение облитерации уретры было неразрешимой проблемой вплоть до конца XIX века. При задержках мочи, вызванных полной окклюзией мочеиспускательного канала, для облегчения страданий больного применялись различные способы отведения мочи из мочевого пузыря. Так, Абу Ибн Сина производил чреспромежностную пункцию мочевого пузыря. Дионис для этой же цели применял надлобковую пункцию, а Я. Виллие пунктировал мочевой пузырь через прямую кишку. Постепенно однократные способы отведения мочи стали заменяться более постоянными. Colot и Tolet в конце XVII в. впервые наложили стому выше места сужения. В прошлом столетии для отведения мочи при разрывах уретры стали рекомендовать наложение надлобкового мочепузырного свища.
В нынешнем столетии методами восстановления проходимости уретры при ее облитерации являются: канализация уретры, туннелизация уретры, операции Хольцова-Мариона, Соловова и их различные модификации, различные виды пластики мочеиспускательного канала путем замещения недостающего участка аутотрансплантатами, либо искусственными материалами. Принципиально методы лечения облитерации уретры можно разделить на открытые оперативные и эндоскопические.
Эндоскопическое лечение облитерации уретры стало возможным в конце 70-х – начале 80-х годов и напрямую связано с развитием высоких технологий в области эндоскопического инструментария и методов получения изображения [25].
Эндоскопическое лечение облитерации уретры преследует перед собой две цели: создание проходимости уретры и создание адекватного просвета уретры [68]. При достижении первой цели основная проблема – предотвращение ложных проходов между дистальным и проксимальным концами облитерированной уретры.
В 1978г. H. Sachse впервые применил эндоскопический подход в восстановлении проходимости задней уретры при облитерации [101]. Реканализация уретры была достигнута при введении металлического зонда через надлобковый свищ и осуществлении ретроградной оптической уретротомии “холодным” ножом по направлению к зонду. Метод в последующем получил название “core through”. Клинический опыт был далее развит Lieberman S.F. и Barri J.M. в 1982г. [77]. Barri J.M. позднее опубликовал данные о результатах наблюдения (от 1,5мес до 7 лет) за 12 больными, перенесшими эндоскопическую реканализацию уретры. Удержание мочи отмечено в 75% случаев и не отмечено случаев импотенции, вызванной эндоскопическим вмешательством [36].
Использование второго ригидного цистоскопа, введенного через надлобковый свищ, было описано Glass R.E. et al. (1979) [54]. Blandy J.P. (1980) предложил использовать надлобковый цистоскоп для освещения рубца, который являлся ориентиром для трансуретральной инцизии, при этом уретротом используется с погашенным источником света [37]. Этот метод был в последующем усовершенствован Gonzalez R. et al. (1983) и получил название “cut-to-the-light” [55].
Последующие публикации по данной проблеме включали сообщения о множестве модификаций вышеперечисленных методик. Yasuda K. et al. (1991) использовали свет антеградно введенного цистоскопа в качестве “мишени” для ретроградной пункции рубцовых тканей тонким троакаром [115]. Некоторые авторы используют гибкий или ригидный нефроскоп, как альтернативу ригидному цистоскопу, для улучшения эндоскопической видимости и возможности проведения тонкого троакара через рубцовую ткань [25]. McVary К.Т. et al. [90] и М.Ф. Трапезникова [29] используют трансректальный ультразвуковой контроль для более точного проведения эндоскопической иглы через прерванную уретру в мочевой пузырь. Gupta N.P.[59] выполняет антеградную уретротомию (уретротомом, проведенным через надлобковый свищ), как завершающий этап реканализации уретры. Большое количество методик, позволяющих выполнить восстановление просвета уретры, свидетельствует об отсутствии идеального метода и наличии недостатков у существующих методов.
Применение методик “cut-to-the-light” и “core through” наиболее эффективно при короткой облитерации задней уретры. В случаях, когда дефект уретры превышает 2-3см, при использовании подобных вмешательств увеличивается риск кровотечения, повреждения сфинктера и перфорации прямой кишки [25]. Во избежание этих осложнений некоторые авторы предпочитают использовать рентгенотелевизионный контроль при эндоскопической реканализации уретры [7, 25] или трансректальное ультразвуковое сканирование [29]. Предварительное проведение пункционных игл и струн-проводников через рубцовую ткань создает благоприятные условия для выбора направления рассечения облитерированного участка уретры под эндоскопическим контролем [29].
После того, как достигнуто сообщение между дистальным и проксимальным концами облитерированной уретры, необходимо создать адекватный просвет мочеиспускательного канала. Чаще всего многие авторы используют визуальную уретротомию на 12 часах условного циферблата [7, 26], и, если просвет уретры недостаточен, выполняется электрорезекция рубцовых тканей при помощи стандартного или детского резектоскопов [72]. Chiou R.K. заканчивает уретротомию дилатацией уретры при помощи направляющих нитевидных зондов-катетеров [40]. Leonard M.P. et al. предпочитают выполнять последовательную дилатацию уретры до 28 Fr специальными бужами по проволочному направителю [75]; Marshall F.F. et al. используют для этой цели баллон-катетер высокого давления [81]. Для создания адекватного канала к проксимальной уретре de Vries C.R. использует Bugbee электрод с низким режущим потоком [47], а Niesel T et al. – лазерную уретротомию [97].
Таким образом, эндоскопическая реканализация уретры методами “Cut-to-the-light” и “Core-through” стала применяться в лечении больных с облитерацией уретры как альтернатива традиционным открытым операциям. Несмотря на сравнительно небольшой накопленный клинический опыт, данные более чем 10 клинических центров мира показывают, что большинство пациентов имеют хорошие результаты лечения (табл. №1).
Таблица №1. Результаты и осложнения эндоскопического лечения больных с облитерацией уретры.
Авторы |
Кол-вопац-тов, (n) |
Продол. Наблюд., (мес.) |
Импо- тенция, (%) |
Недерж. мочи, (%, (тип) |
Результаты, повторные операции |
“Cut-to-the-light” |
|||||
|
Gupta & Gill [59] |
10 |
6-24 |
0 |
20 (2стресс) |
5- уретротомия |
|
Marshall [81] |
4 |
12 |
25 |
0 |
2- ТУР уретры 2- уретротомия |
|
McCoy et al. [87] |
12 |
6-35 |
58* |
8 (1тотал) |
6- уретротомия |
|
Chiou et al. [40] |
8 |
6-24 |
25* |
25 (1стресс, 1 тотал) |
7- уретротомия |
|
Leonard et al. [75] |
6 |
17 |
0 |
3- уретротомия |
|
|
Cohen et al. [43] |
5 |
60 |
40 |
2- пластика |
|
|
Саидов И.Р. [25] |
18 |
6-24 |
0 |
0 |
5-уретротомия |
“Core-through” |
|||||
|
Lieberman & Barry, [77] |
4 |
2-9 |
50* |
25 (1стресс) |
1- уретротомия |
|
Gonzales et al. [56] |
3 |
11-28 |
0 |
0 |
3- уретротомия |
|
Towler & Eisen [111] |
5 |
8-46 |
0 |
0 |
3- уретротомия |
|
Barry [36] |
12 |
1,5-85 |
42* |
25 |
6- уретротомия |
|
Yasuda et al.[115] |
17 |
12-96 |
41* |
12 (2стресс) |
6- уретротомия |
|
El-Abd, [49] |
79 |
6-12 |
5 стресс |
33- уретротомия |
|
|
Jepson et al. [68] |
8 |
35-85 |
37 |
12 |
4- уретротомия |
|
Саидов И.Р. [25] |
8 |
6-24 |
0 |
0 |
3-уретротомия |
* — импотенция до операции.
Как видно из таблицы, применяемые методики лечения в большинстве случаев способствуют сохранению потенции и удержанию мочи. Однако обращает на себя внимание различный процент послеоперационной стриктуры уретры, указанный в литературе. Рецидив стриктуры уретры составляет от 25 до 100% больных. Все эти больные нуждались во вторичной эндоскопической операции. Разные авторы используют различные способы устранения рецидивной стриктуры уретры. Это могут быть баллонная дилатация, внутренняя оптическая уретротомия, трансуретральная резекция рубцовых тканей [36, 56, 111].
Для предотвращения рецидива стриктуры уретры многие авторы рекомендуют больным после удаления уретрального катетера хроническое бужирование уретры [2,49]. Нередко больным рекомендуется выполнять эту процедуру самостоятельно (самобужирование) от 1 раза в неделю, до 1 раза в месяц [49]. Другие авторы отдают предпочтение баллонной дилатации уретры, считая этот метод менее травматичным по сравнению с традиционным бужированием [72]. Согласно Guille F. et al. (1994), дилатацию и самобужирование необходимо выполнять в первый год после операции, особенно если протяженность облитерации была более 2,5 см. [58]. Choiu R.K. с целью улучшения эпителизации и сохранения адекватного просвета уретры, рекомендует использовать эндоскопическую уретропластику кожным лоскутом в раннем послеоперационном периоде [41]. По данным Naude J., у шестерых из его восьми пациентов, наблюдавшихся в течение двух лет после эндоскопической уретропластики, сохранялся хороший “калибр” уретры, 9% больных потребовалось выполнение вторичной уретропластики [94]. Для этой же цели некоторые авторы предлагают после реканализации устанавливать внутренний уретральный стент (спираль) [93]. К побочным эффектам уретрального стента относят перинеальный дискомфорт, гематурию, инкрустацию стента солями. Известны также случаи формирования стриктуры в проксимальной и дистальной частях стента и закупорки просвета стента гипертрофированным уротелием [98].
В зависимости от результатов лечения по-разному обосновываются показания к эндоскопическим вмешательствам. Одни авторы, полагая, что на эффективность лечения в значительной степени влияет протяженность облитерации, рекомендуют применять эндоскопическое лечение при коротких (1-2см) облитерациях уретры [25]. Другие авторы считают, что операция может быть выполнена, если максимальная протяженность облитерированного участка уретры не превышает 3 см. [42]. Многие авторы считают, что эндоскопическая операция более эффективна при облитерациях простатического отдела уретры и шейки мочевого пузыря [25, 29, 118]. Lesley K.C. et al. (1996); Zinman L.N. (1998) считают, что эндоскопическое лечение эффективно при коротких дефектах уретры у пациентов после простатэктомии [76, 118]. Некоторые авторы высказывают мнение, что эндоскопическое лечение возможно только при первичных послеоперационных облитерациях уретры и противопоказано при посттравматических и рецидивных облитерациях независимо от локализации и протяженности [85].
Остается спорным вопрос о сроках выполнения этих операций после травматического или ятрогенного повреждения мочеиспускательного канала. Guille F. et al. считают, что эндоскопическое лечение в ранние сроки (после стабилизации общего состояния больного от 1 до 3 недель), более атравматично, позволяет восстановить проходимость мочеиспускательного канала, сопоставить концы разорванной уретры при смещении их в плоскости, а также исключает длительное дренирование мочевого пузыря цистостомическим дренажем [58]. Такого же мнения придерживаются и другие авторы, полагая, что первичное эндоскопическое лечение создает хорошие условия для эпителизации уретры, тем самым уменьшая риск образования рецидивной стриктуры и степень парауретрального фиброза [85]. Однако McRoberts J.W. и Ragde H., проведя экспериментальные исследования на животных, доказали, что рубцовый фиброз встречается после раннего эндоскопического лечения как в зоне операции, так и вокруг участка разрыва [89]. Другие авторы утверждают, что раннее лечение возможно только при незначительных сопутствующих повреждениях, позволяющих минимизировать анестезиологический риск и не препятствующих размещению больного в положении камнесечения [86]. McAninch J.W. [84] сообщает, что более 50% больных после первичного лечения требуют повторного оперативного лечения по поводу рецидива стриктуры. В дополнение к большому проценту рецидивов стриктуры к недостаткам данной методики относят риск создания ложных ходов и опасность интраоперационного кровотечения. В связи с этим многие авторы предпочитают выполнять эндоскопическое лечение в более поздние сроки (от 2 до 6 месяцев), после формирования грубого рубца в месте прерванной уретры [99]. Rehman J. et al. указывают, что раннее и отсроченное лечение имеют аналогичные результаты [100]. Из шести больных, (при оценке совокупных данных) наблюдавшихся в течение трех лет, у 9% отмечалось недержание мочи, у 54 % – рецидив стриктуры [100].
Анализируя суммарные результаты применения эндоскопического вида лечения (более 250 больных с облитерацией проксимальной уретры), 10 исследовательских групп в Европе и Америке пришли к мнению о том, что эндоскопический метод имеет ряд потенциальных преимуществ перед открытыми операциями – меньшую травматизацию и кровопотерю, сокращение койко-дня, уменьшение сроков реабилитации, значительно меньшее количество таких традиционных для открытой уретропластики осложнений, как недержание мочи, импотенция, рецидив заболевания [102]. Вместе с тем, в литературе имеются указания на интра- и послеоперационные осложнения реканализации уретры: имбибиция пеноскротальной области ирригационной жидкостью и уретроррагия, повреждение наружного сфинктера мочевого пузыря, простаты и прямой кишки, описан также случай повреждения уретры наряду с поломкой и потерей лезвия уретротома [83]. В раннем послеоперационном периоде могут иметь место приапизм и осложнения воспалительного характера (уретрит, кавернит и др.). Среди поздних осложнений отмечаются частичное или полное недержание мочи (3-8,6% больных), а также различные виды половых расстройств (0,5-10,6% больных) [85].
При эндоскопической реканализации уретры вновь созданный “канал” уретры лишен слизистой оболочки. Время и степень регенерации уротелия в области облитерации зависят от многих факторов (степень воспалительной инфильтрации, выраженность рубцового процесса, локализация и др.), в том числе от протяженности облитерации: чем она длиннее, тем вероятнее возникновение в последующем стриктуры в этой части уретры [2]. По данным М.Ф. Трапезниковой и соавт. (1997), задний отрезок уретры обладает более выраженной способностью к регенерации за счет того, что в отличие от передней уретры со всех сторон окружен железисто-мышечной тканью простаты, создающей благоприятные условия для кровоснабжения [29]. Таким образом, можно предположить, что частота возникновения послеоперационной стриктуры уретры будет выше при локализации дефекта в передней уретре. Стриктура уретры в зоне эндоскопической реканализации, требующая выполнения внутренней уретротомии или длительного бужирования уретры, встречается, по данным разных авторов, в 45,6 — 58,2% случаев [2, 118].
Следует отметить, что эндоскопическая реканализация уретры является гораздо более опасной операцией и при отсутствии точных ориентиров в отличие от операции внутренней уретротомии может не привести к желаемому результату (восстановление проходимости уретры). Данное осложнение возможно при наличии облитерации большой протяженности, расхождению участков уретры по плоскости и наличию костных отломков между концами уретры. Необходимо отметить, что большинство авторов считают, что данных осложнений можно избежать при правильном отборе больных для операции на основании всестороннего предоперационного обследования [7, 25, 40].
Операции по восстановлению просвета уретры в бульбозномембранозном и простатическом отделах уретры могут приводить к развитию жизнеопасного кровотечения из вен малого таза, которое нередко приводит к летальному исходу. Единичные публикации о летальных исходах отмечены в различных исследованиях [6, 13, 34]. Еще одним из осложнений эндоскопической реканализации уретры является перфорация простаты и прямой кишки. Данное осложнение является достаточно редким, однако его частота выше, чем частота перфорации уретры при внутренней уретротомии, что является отражением сложности операции.
Еще одним из видов трансуретральных эндоскопических операций на уретре является имплантация постоянных и рассасывающихся уретральных стентов. Установка спирали в стенозированный участок позволяет длительное время поддерживать стенозированный участок в достаточно раскрытом состоянии, позволяющим избавить пациента от инфравезикальной обструкции.
Уретральные стенты делятся на временные и постоянные. К временным спиралям относятся Urethrospiral, спирали UroCoil и Memokath. К постоянным – Urolume Wallstent, Memotherm и Ultraflex . Отдельным видом являются рассасывающиеся спирали. Механизм действия постоянных и временных спиралей отличается. Постоянные стенты являются каркасом уретры и со временем эпителизируются и постоянно поддерживают просвет уретры. Временные стенты являются шиной, которая, находясь длительное время в зоне операции, позволяет предотвратить развитие рестеноза. После удаления временного стента новый просвет уретры остается достаточно широким, таким образом, предотвращается развитие рестеноза [96].
В случае наличия протяженных стриктур уретры многие авторы отмечают необходимость имплантации двух и более спиралей [93, 110].
Стентирование уретры – легко и быстровыполнимая процедура с меньшей, что немало важно, по сравнению с хирургическим лечением стоимостью и хорошо изученными осложнениями. К последним относятся: миграция стента, инкрустация, его обструкция, прорастание гиперплазированной тканью, ирритативная симптоматика со стороны нижних мочевых путей, инфекционно-воспалительные осложнения, уретроррагия.
По данным различных авторов временные стенты обычно легко поддаются быстрому и атравматичному удалению. В противоположность этому постоянные стенты вызывают эпителизацию, завершающуюся в 70 % случаев после 6-12 месяцев, что обычно осложняет их удаление. Однако, отсутствие эпителизации временных стентов означает, что по сравнению с постоянными стентами они имеют более выраженную тенденцию к миграции и инкрустации.. Таким образом, вид осложнений при использовании уретральных эндопротезов зависит от того, какой тип стента был применен, материала, из которого он изготовлен, его конструкции, метода его установки, правильного подбора размеров стента, квалифицированности и правильности его установки, сроков дренирования мочевого пузыря, а также индивидуальных особенностей организма, включающих в себя сопутствующие заболевания. По данным Djavan и соавторов[45] частота миграции в 5.6 % случаев стентов “Trestle” после термотерапии. Harrison и De Souza[61], а также Nielsen и соавт.[96] сообщили о частоте миграции стента в 4.5 и 9.7 % соответственно при использовании стентов «Prostakat». Thomas и соавторы [110] изучили применение аналогичных стентов и наблюдали в виде осложнений: кровотечение в 5 %, смещение стента в 15 %, рецидивирующие инфекции мочевых путей в 10 % и инкрустацию стента в 4 % случаев. При исследовании результатов применения стентов Braf и соавт. [38] отмечали среди осложнений формирование стриктуры уретры, а также смерть одного больного от уросепсиса. Milroy и соавторы [93] обобщили результаты применения эндопротеза «Urolum» у 140 больных и отметили удаление стентов из-за неправильного их расположения у 11 пациентов и из-за выраженного дискомфорта, связанного с эндопротезом у 3 пациентов. В своей работе авторы отмечают умеренную инкрустацию стентов с образованием гликопротеиновой пленки при нахождении в просвете уретры в течение 1-6 месяцев и присоединение кристаллов мочевой кислоты после 9 месяцев. Инкрустация стента не вызывала функциональных изменений со стороны стента. Все стенты продолжали функционировать адекватно. Так же необходимо отметить, что отсутствие стент-ассоциированной инфекции мочевых путей помогает в определенной степени ограничить феномен инкрустации. Sassine и Schulman [102] отметили 1 случай инкрустации после 14 месяцев стояния полиуретановых стентов; в их группе пациентов мочевая инфекция отмечалась в 12 % случаев. Chiu и соавторы [41] сообщили об инкрустации стентов «Prostakat» на 8 месяце после имплантации у 2 пациентов с инфекцией мочевыводящих путей, обусловленных уреазопродуцирующими штаммами. Инфракрасная спектрофотометрия выявила наличие оксалата кальция и струита в инкрустате. Nordling и соавторы [98] отметили инкрустацию в 30 % случаев, при этом клинически значимой она была в 10 % случаев. Наличие инфекции мочевыводящих путей, обусловленной уреазопродуцирующими бактериями, и длительное стентирование представляют собой, по мнению абсолютного большинства авторов [41,93,102] два основных фактора, предрасполагающих к инкрустации стента. При использовании современных стентов из силикона и нитинола частота осложнений значительно ниже и все в большей степени зависит не от характерологических особенностей применяемого уретрального эндопротеза, а от человеческого фактора.
Подводя итог вышеизложенному, можно сделать вывод, что до настоящего времени представляются недостаточно изученными и противоречивыми многие вопросы, касающиеся осложнений трансуретральных эндоскопических способов в лечении стриктур, облитераций и камней мочеиспускательного канала. Практически по всем основным разделам критериев отбора больных для операции, диагностики и лечения различных осложнений у авторов отсутствует единое мнение [30]. Особенно сложным представляется определение показаний к эндоскопическим операциям в целом, а также к различным методам их выполнения, что определяет различия в результатах лечения больных, частоте развития различных осложнений. Различными авторами неоднозначно оценивается зависимость осложнений трансуретральных методов лечения от прогностических критериев эффективности операции [7, 99]. Общим является мнение, что эндоскопические методы лечения заболеваний уретры отличаются, по сравнению с открытыми оперативными вмешательствами, меньшей травматичностью, меньшим количеством послеоперационных осложнений, сокращением сроков послеоперационной реабилитации больного, а также не являются противопоказанием к открытой уретропластике и не ухудшают условия для ее выполнения в случае, если эндоскопическое лечение терпит неудачу [5,6,13,25,118].
При проведении предоперационного обследования больных в целом используются однотипные диагностические приемы, однако обращает на себя внимание то, что разные авторы по-разному оценивают роль каждого способа диагностики [85]. Кроме того, отсутствует критическая оценка различных диагностических способов, позволяющих определить распространенность склеротической ткани в области стриктуры и облитерации уретры с последующей оценкой вероятности развития осложнений операции [2,7,25,84,112].
Нерешенность вышеуказанных основных вопросов вызывает необходимость дальнейшего изучения осложнений трансуретральных эндоурологических вмешательств в лечении заболеваний мочеиспускательного канала.
«Осложнения трансуретральных электрохирургических вмешательств на предстательной железе»
2.1. Основные виды эндоскопических операций на предстательной железе и наиболее часто встречающиеся осложнения.
Высокая распространенность доброкачественной гиперплазии предстательной железы (ДГП) у мужчин пожилого и старческого возраста определяет актуальность вопросов лечения этого заболевания [5,6]. При аутопсии гистологические признаки ДГП определяются у 50% мужчин в возрасте 55 лет и приблизительно в 80% случаев к 75 годам [15]. Клинические симптомы, обусловленные ДГП, обнаруживаются в 10% случаев в возрастной группе до 40 лет [12], у 40-61% мужчин к 70 годам [5], а потребность в лечении возникает в 10-20% случаев [6], причем абсолютные показания к хирургическому лечению имеют только 5-10% пациентов[15]. При выборе тактики лечения нельзя не учитывать возрастные особенности данной категории пациентов[6]. Больные пожилого и старческого возраста нередко страдают тяжелыми сопутствующими заболеваниями, значительно повышающими риск оперативного вмешательства[5]. Наиболее часто встречающимися интеркурентными заболеваниями у этой группы больных, по данным Гориловского Л.М., являются ИБС, постинфарктный кардиосклероз, артериальная гипертензия, заболевания органов дыхания, хронический пиелонефрит, сахарный диабет [6]. Возможные, у таких пациентов, нарушения свертывающей системы крови увеличивают риск кровотечения, как во время операции, так и в послеоперационном периоде[66].
В течение десятилетий стандартом хирургического лечения ДГП остается трансуретральная резекция простаты [15]. Сочетая в себе достаточный радикализм и эффективность, характерные для открытого оперативного вмешательства, метод обладает рядом безусловных преимуществ, среди которых меньшая инвазивность, возможность повторения без повышения риска для больного, расширение показаний к оперативному лечению у лиц пожилого и старческого возраста с выраженными интеркурентными заболеваниями, в том числе нарушениями свертывающей системы крови, меньшее количество осложнений, более короткий период реабилитации и другие [26]. По данным сводного анализа 29 рандомизированных исследований, проведенных за период с 1986 по 1998 год, симптоматическое улучшение, определяемое по снижению суммарного количества баллов с использованием шкал IPSS, AUA-7, Boyarski, DAN-PSS после ТУР составляет в среднем 70.6% и в более чем половине исследований превышает этот показатель [79]. При объективной оценке качества мочеиспускания на основе изменения показателей максимальной объемной скорости мочеиспускания (Q max) и количества остаточной мочи после операции среднее увеличение Q max составляет 125 % или 9.7 мл/сек в абсолютных величинах [45]. Данные по количеству остаточной мочи полностью согласуются с результатами урофлоуметрии, отмечается снижение ее объема в среднем на 60.5 %[45].
Необходимость выполнения повторного оперативного вмешательства дает возможность оценить эффективность ТУР при изучении отдаленных результатов первичной операции [104]. По данным Jensen и соавт. уровень повторных ТУР составляет 1.8 % в год после первичной операции [67]. Результаты большого мультицентрового исследования свидетельствуют о необходимости выполнения повторного ТУР у 2.3 % — 4.3 % пациентов в течение первого года после операции, к пятому году доля таких пациентов возрастает до 8.9 % — 9.7 %, а на восьмой год составляет уже 12.0 % — 15.5 % от первоначального количества [79].
Обладая высокой клинической эффективностью ТУР простаты имеет определенные осложнения, уровень которых остается достаточно стабильным, несмотря на улучшение инструментария, накопления определенного хирургического опыта выполнения данных операций. Смертность после выполнения этого оперативного вмешательства за последние 30 лет значительно снизилась и на сегодняшний день не превышает 0.25% [16, 91].
Наиболее серьезным интаоперационным осложнением ТУР простаты остается массивное кровотечение, требующее проведения гемотрансфузии [91]. По данным Mebust и соавт. подобная необходимость возникает у 2.5 % пациентов [91], а Horinger и соавт. отмечают частоту гемотрансфузий для восполнения интраоперационной кровопотери после ТУР простаты до 4.2 % [66]. По данным сводной статистики потребность в подобной терапии остается достаточно высокой и сохраняется на уровне 7.2 %, что, безусловно, говорит об актуальности и значимости проблемы [79]. По данным Мануэль Бардо Тоскано с соавт. (1990), располагающими 5 летним опытом ТУР, ранние и поздние кровотечения отмечены в 4,2% случаев [28].
Тем не менее, остаются не изученными целый ряд вопросов, связанными с разработкой эффективной профилактики развития интраоперационной кровопотери, а именно особенности отбора больных для операции, особенности хирургической техники при развитии массивного кровотечения, особенности ведения подобных больных в послеоперационном периоде.
В настоящее время использование современных ирригационных растворов, совершенствование техники оперативного вмешательства и применяемого для его выполнения оборудования позволили значительно снизить частоту возникновения «ТУР-синдрома»[3, 109]. По данным Мартова А.Г., «синдром водной интоксикации организма» возникает у 0.1-1 % больных после ТУР простаты [16]. В серии наблюдений Mebust и соавт. это грозное осложнение развивалось у 2 % оперированных пациентов[91], а по данным других авторов его частота достигает 3.4 % — 6.7 % [92]. При анализе причин столь высокий процент осложнений объясняется продолжительностью оперативного вмешательства (в среднем 59 мин) при достаточно небольших размерах резецируемой простаты (средний вес удаленной ткани 15.6 грамм)[103].
Причиной развития «ТУР-синдрома» является значительное всасывание ирригационной жидкости в кровеносное русло. Вероятность проникновения большого количества ирригационной жидкости в сосудистое русло возрастает с увеличением времени операции. Указание на необходимость ограничения времени операции можно обнаружить во многих работах. Одни авторы считают, что ТУР не должна продолжаться более 45 мин, другие — более 1 часа, третьи — не более 1,5 часа [51]. Согласно мнению J.Blandy [37], «если у хирурга лучше получается операция, произведенная несколько дольше чем за 1час, то так и нужно оперировать, но вместе с тем недопустимо неоправданное промедление». F.Tauzin, L. Sanz [109] считают, что операция не должна продолжаться дольше 1,5 – 2 часов.
Объем абсорбции не всегда соответствует времени резекции и объему резецированной ткани. Описан «ТУР-синдром», возникший через 15 минут после операции и тяжелейший «ТУР-синдром» при резекции ДГП небольших размеров [3]. Согласно мнению большинства авторов, такие случаи обусловлены нарушением техники операции: вскрытием венозных синусов простатической капсулы, а также попаданием раствора в паравезикальное пространство. При этом, раствор под давлением (60 см. водного столба и выше), превышающим давление в венозных синусах (40 см. водного столба) поступает в венозные синусы, вызывая водную интоксикацию организма. Для выяснения механизма возникновения абсорбции ряд исследователей в качестве ирригационного раствора использовали 25% раствор гиппурана и установили, что в тех случаях, когда во время ТУР вскрывались венозные синусы простатической капсулы и промывная жидкость поступала в мочевой пузырь под давлением, превышающим венозное, через 12-15 минут после операции получались отчетливые экскреторные урограммы. Если ТУР не сопровождалась кровотечением и сосудистые образования простатической капсулы не вскрывались, экскреторных урограмм не получали. В исследованиях с помощью радиоизотопов также отмечена возможность абсорбции жидкости через паравезикальное пространство, в которое раствор попадает при перфорациях капсулы простаты, даже весьма незначительных [18]. Исходя из того, что абсорбция жидкости зависит от давления промывной жидкости, значительное число работ посвящено поддержанию адекватного давления ирригационного раствора [15].
Ряд работ посвящены воздействию электрического тока на промывную жидкость и форменные элементы крови, в которых доказывается возникновение гемоглобинемии, дисэлектролитемии, увеличение концентрации катионных белков и общей протеолитической активности жидкости. Так М.А. Гончар и М.И. Ухаль считают, что свободный гемоглобин появляется в результате разрушения эритроцитов при электрокоагуляции, он абсорбируется через рану и попадает в кровь [3]. Другим действием электрического тока считается образование токсичных тканевых продуктов (т.н. нефротоксическая субстанция), которые повреждают почки — катионные белки, серотонин, гистамин, всасывающиеся продукты некроза тканей [109]. По другой концепции считается, что благодаря действию электрического тока с промывной жидкостью теряется значительное количество натрия и организм мобилизует все резервы натрия в организме [15]
С патогенетических позиций и исторически принято различать «ТУР- синдром» при использовании гипер- и гипотонических растворов (в настоящее время данный вариант встречается редко в связи с повсеместным использованием изотонических (негемолизирующих) растворов: 2,5-5% раствор глюкозы, 1,1% раствор глицина, cytal, 1,1% раствор гликокола, 0,9% раствор мочевины и др.) и «ТУР-синдром» при использовании изотонических растворов. В обоих случаях «ТУР-синдром» — результат гипергидратации («водная интоксикация»), в результате которой в плазме развивается гипонатриемия и гипокальциемия; в случае применения гипер-и гипотонических растворов к основным патогенетическим звеньям прибавляется гемолиз.
При попадании воды в сосудистое русло снижается осмолярность плазмы, что приводит к разрушению эритроцитов и появлению в плазме свободного гемоглобина (розовая плазма, гемолитическая желтуха к концу первых суток, анемия, не соответствующая по тяжести операционной кровопотере). У ряда больных в результате резкого повышения концентрации свободного гемоглобина возникает олигурия, затем анурия, острая почечная недостаточность (ОПН), а также картина диссеминированного внутрисосудистого свертывания крови («ДВС-синдрома») вследствии высвобождения при гемолизе значительного количества прокоагулянтов. ОПН, развившаяся в результате гемолиза, является причиной летального исхода у 20% больных, умерших после ТУР [109]. Вместе с тем существуют и иные факторы поражения почек после ТУР: нарушение кровотока в почках и воздействие на почки так называемой «гуморальной нефротоксической субстанции» [3]. Таким образом, генез ОПН в клинической картине «ТУР-синдрома» сложен и до конца не изучен.
По современным представлениям [15] существует 3 возможных механизма повреждения почек:
* механическая блокада почечных канальцев отложением пигмента. Экспериментально показано, что отложение пигмента происходит в дистальных извитых канальцах и дистальных участках петли Генле. Пигмент выпадает в канальцах, предварительно поврежденных в результате применения лекарств, либо в результате ишемии. Однако, по мнению ряда исследователей, механическая блокада канальцев не может изолированно приводить к ОПН.
* появление нефротоксической гуморальной субстанции, образующейся при действии электрического тока, которая может повреждать почки. Основным эффектом воздействия токсинов является повреждение эпителия проксимальных канальцев, что приводит к увеличению поступления натрия в область macula densa, повышенной выработке ренина и спазму приносящих артериол. Все это ведет к нарушению кровообращения в почке. В настоящее время считается, что возможными «кандидатами» на роль нефротоксической субстанции являются «средние молекулы», катионные белки, а также липополисахариды, образующиеся в результате теплового действия электрического тока на ткань предстательной железы, подобные тем, что оказывают гепатонефротоксическое действие в период острой ожоговой токсемии при ожоговой болезни.
* нарушение кровообращения в почках, возникающее при наличии в крови свободного гемоглобина, воздействии нефротоксинов, а также в результате послеоперационной гипотензии. При этом происходит открытие артериовенозных шунтов и уменьшение кровотока в почечных клубочках, что приводит к значительному снижению клубочковой фильтрации, вызывая тем самым наряду с воздействием других факторов, олигурию, а затем и анурию в послеоперационном периоде.
При применении негемолизирующих растворов клинические проявления «ТУР-синдрома», согласно результатам ряда исследований, возникают при снижении натрия в плазме до 115 — 120 ммоль/л.[109]. Радиоизотопные исследования показали, что натрий теряется с промывным раствором. При этом при всасывании ирригационных растворов осмолярность плазмы поддерживается вследствие изотоничности растворов, но потери натрия не возмещаются.
Согласно W. Mebust и соавт. [91] в среднем по окончании ТУР объем циркулирующей крови (ОЦК) снижается на 12% от исходного. При этом на фоне гипонатриемии и гипоосмолярности возникает увеличение накопления жидкости в интерстиции тканей, приводя к гипергидратации тканей при снижении ОЦК. Таким образом, гипергидратация является одним из основных патогенетических факторов возникновения «ТУР-синдрома» [15].
Определенный интерес представляют также работы, посвященные возможному влиянию качества ирригационных растворов на некоторые клинические проявления «ТУР-синдрома» [15]. При применении в качестве промывного раствора 1,1% раствора гликокола рядом авторов отмечены его токсические эффекты [109]. Это позволило им предположить, что часть симптомов «ТУР-синдрома» может быть обусловлена токсическим воздействием раствора на организм. Согласно другим исследованиям при использовании глицина, последний, в результате окислительного дезаминирования образует глиоксиловую кислоту и аммоний. При абсорбции в результате метаболизма глицина в организме возникает значительная гипераммонийемия, которая и вызывает часть проявлений «ТУР – синдрома» и т.д.
Следует отметить, что несмотря на кажущуюся ясность основной роли гипонатриемии в возникновении «ТУР-синдрома», остается невыясненным вопрос — почему не всякая гипонатриемия приводит к развитию этого осложнения? Исследование содержания электролитов в плазме крови более чем у 1000 больных показало, что только у 6% концентрация натрия не изменялась, у 90% больных она снижалась не более чем на 8-15 ммоль/л; а у 4% больных — более чем на 21 ммоль/л [109]. При этом «ТУР-синдром» отмечался лишь у 1% больных. F. Tauzin и соавт. [109] утверждают, что для развития «ТУР-синдрома» необходимо снижение концентрации натрия в плазме крови ниже 115-120 ммоль/л. Другие авторы указывают, что при наличии у пациентов гиперхолестеринемии и гиперлипопротеидемии концентрация натрия в плазме крови может быть понижена, но это не сопровождается никакими физиологическими эффектами, т.к. при пересчете концентрации натрия на свободную воду (которой в данных условиях меньше) имеется так называемая псевдогипонатриемия. В пожилом возрасте указанные выше изменения встречаются достаточно часто, что ведет к подобным несоответствиям, на которые и ссылаются исследователи [15]. В заключение, большинство авторов отмечают, что до конца эффективной методики профилактики развития «ТУР-синдрома» не разработано.
Ряд интраоперационных осложнений (массивная кровопотеря, экстравазация, повреждение “наружного сфинктера” мочевого пузыря, электроожоги и др.) обычно проявляются в послеоперационном периоде[16].
Наиболее распространенными осложнениями в раннем послеоперационном периоде (первые 4-6 недель) являются послеоперационное кровотечение с возможностью развития тампонады мочевого пузыря сгустками крови, продолжительная задержка мочеиспускания после удаления уретрального катетера и инфекция мочевыводящих путей[15,16,18].
Раннее послеоперационное кровотечение, возникающее в первые дни после ТУР простаты, обычно является следствием некачественного гемостаза во время операции или повторного открытия артериальных стволов[91]. При этом у 5.5 — 8 % пациентов по результатам сравнительного анализа ряда рандомизированных исследований кровотечение носит клинически значимый характер, приводя к развитию тампонады мочевого пузыря сгустками, и требует неотложных мероприятий [53].
Задержка мочеиспускания в послеоперационном периоде обусловлена, прежде всего, изменениями в детрузоре, приводящими к его функциональной декомпенсации и не может быть объяснена только недостаточным удалением ткани во время операции [8]. В ряде работ отмечена корреляция между максимальной скоростью мочеиспускания (Q max), объемом предстательной железы, количеством остаточной мочи с одной стороны и наличием доказанной посредством комплексного уродинамического исследования инфравезикальной обструкции с другой, причем снижение Q max не обязательно означало присутствие инфравезикальной обструкции [104]. B. Djavan и соавторы [45] обнаружили, что пациенты, имевшие проблемы с восстановлением адекватного самостоятельного мочеиспускания после ТУР, были старше (средний возраст 83.5 лет против 70.1 года в группе с восстановившимся адекватным мочеиспусканием), имели больший объем остаточной мочи перед операцией и значительно меньшее максимальное давление детрузора (24.4 против 73.5 см водного столба). Авторы пришли к заключению, что адекватный подбор пациентов позволит добиться значительного снижения частоты подобных осложнений после ТУР простаты, так как исключит ненужную операцию у категории больных с неблагоприятным прогнозом относительно ее клинической эффективности [45] .
Инфекционно-воспалительные осложнения возникают обычно в течение нескольких дней — недель после ТУР простаты и могут проявляться в виде острого пиелонефрита (1.7-10%), уретрита и простатита (2.1%), эпидидимита (1.2-3.1%), эпидидимоорхита (1.2-3.1%), цистита, парауретральных абсцессов и др. (суммарно до 5-22 % пациентов)[16, 22].
Ретроградная эякуляция — одно из самых частых осложнений трансуретральной резекции доброкачественной гиперплазии простаты. Данное осложнение по результатам сводной статистики возникает в среднем в 65.2 % случаев, а в некоторых исследованиях до 100 % наблюдений [15,37]. Основной причиной его возникновения считается резекция тканей шейки мочевого пузыря и частота его возникновения зависит от степени ее сохранности [15].
Имеются довольно противоречивые сообщения о возникновении импотенции (по данным Мартова А.Г. 0-12% пациентов[16]), в патогенезе развития которой придается значение психоэмоциональным и гормональным изменениям, нейроваскуляторным дисфункциям, механическим и термальным повреждениям, возникающим после эндоскопической электрорезекции ДГП [16]. Наиболее исчерпывающее исследование в этой области было проведено VA Cooperative Study Group [60]. По результатам сравнения получены практически идентичные показатели ухудшения сексуальной функции как в группе пациентов после ТУР простаты по поводу ДГП, так и в контрольной группе с тем же заболеванием без каких либо вмешательств, а именно, 19 % и 21 % соответственно за период наблюдения около 3 лет [10]. Улучшение сексуальной функции отметили 3 % пациентов в каждой группе. Частота возникновения эректильной дисфункции после ТУР при анализе 29 рандомизированных клинических исследований в среднем составляет 6.5 % [79].
К наиболее частым осложнениям отдаленного периода (более 4-6 недель) после операции относятся стриктура уретры и склероз шейки мочевого пузыря, возникающие в среднем в 3.8 % и 4.7 % (максимально до 11.6 %) соответственно [16]. Подобные осложнения (наряду с недостаточным удалением ткани, оставленными долями ДГП и очень редко — истинным рецидивом заболевания) определяют тот процент повторных операций, который проводится после первичных электрорезекций гиперплазированной простаты [15]. Основными причинами данных осложнений являются механическая травма (в том числе недостаточная обработка инструмента гелем, использование инструментов большого диаметра и др.), электротравма и воспалительный процесс [18].
Таким образом, ТУР предстательной железы сопровождается развитием различных по степени выраженности осложнений у 1-18 % больных [104]. Наиболее серьезные из них, прежде всего, интра- и послеоперационное кровотечение, требующее гемотрансфузии и синдром водной интоксикации, инициировали поиск альтернативных методик, направленных на снижение риска развития послеоперационных осложнений, угрожающих жизни больного при сохранении сравнимых с трансуретральной резекцией результатов лечения [103]. Отражением подобной тенденции является значительное снижение числа трансуретральных резекций простаты с 253 000 в 1987 году до 145 000 в 1994 году в рамках программы MediCare (США)[103]. Аналогичные изменения отмечаются и в станах Европы [79].
При операциях на предстательной железе малого размера (до 30 см3) рассечение мышечных волокон шейки мочевого пузыря до капсулы (инцизия простаты) эффективно избавляет пациентов от инфравезикальной обструкции [15]. Преимуществом данной методики является относительно небольшой процент послеоперационных осложнений в виде кровотечения, требующего переливания крови (0.4%) или приводящего к тампонаде мочевого пузыря. Кроме того, частота ретроградной эякуляции (18.2%) значительно меньше по сравнению со стандартной ТУР простаты (65.4%), что позволяет рекомендовать выполнение инцизии простаты более молодым, сексуально активным пациентам с небольшим объемом простаты [79].
Развитие эндоскопической техники и лазерных технологий, использование ультразвукового сканирования, создание различных лазерных световодов привели к появлению таких методов лечения ДГП, как трансуретральная лазерная «простатэктомия» под ультразвуковым контролем, бесконтактная лазерная «простатэктомия» с помощью средств бокового прижигания, контактная лазерная «простатэктомия», интерстициальная лазерная коагуляция простаты [51]. Суть эндоскопической лазерной хирургии ДГП заключается в уменьшении объема «аденомы» (редко в удалении «аденомы») за счет термического воздействия на гиперплазированную ткань. Фотоны лазерного излучения, доставляемые к простате по передающим системам (световодам) и обладающие определенной энергией, сталкиваясь с атомами ткани, высвобождают тепло. Быстрота и способность достижения того или иного уровня температуры зависят от длины волны лазера (природы лазерного излучения), плотности ткани-мишени, времени экспозиции, скорости сканирования и других факторов [51]. В результате возможно возникновение двух различных эффектов: коагуляции и вапоризации гиперплазированной ткани простаты. Повышение внутритканевой температуры до 100 С приводит к денатурации белка и развитию коагуляционного некроза. Некротизированные ткани с течением времени отторгаются, вследствии чего объем простаты и вызываемая им обструкция уменьшаются. При быстром прогревании ткани до 300 С происходит выпаривание жидкости как внутри, так и вне клеток с одновременной карбонизацией органического матрикса. Вапоризация сопровождается немедленным образованием дефекта ткани в месте приложения энергии[23].
В числе первых методик, использующих лазерное излучение для хирургического лечения ДГП, в конце 80-х годов появилась так называемая трансуретральная лазериндуцированная простатэктомия (TULIP) [51]. Сущность ее заключалась в бесконтактном облучении ткани простаты посредством введенного через уретру зонда, содержащего световод и сканирующий на частоте 7,5 МГц ультразвуковой датчик для контроля рабочей зоны. Световод обеспечивал боковое 90о отклонение луча, проводимого от Nd:YAG лазерного генератора. Однако, такие серьезные недостатки, как высокая стоимость лечения, длительность и сложность обучения, отсутствие непосредственного визуального контроля привели к тому, что в настоящее время метод практически не применяется [23].
Воздействие лазерного луча на ткань простаты со стороны простатического отдела уретры под контролем зрения составляет сущность визуальной лазерной аблации [51]. Для ее выполнения используются светопроводящие волокна с боковым прижиганием, а в качестве источника лазерного луча чаще всего применяется Nd:YAG генератор. Возможно как бесконтактное, так и контактное воздействие [23]. При низких мощностях излучения и отсутствии непосредственного контакта световода с поверхностью простаты преимущественно развивается коагуляция тканей с последующим их отторжением. Для выполнения вапоризации простаты необходимо увеличение энергии, доставляемой к единице площади поверхности, что осуществляется путем контактной лазерной аблации. При этом используются волокна, как с боковым, так и оконечным прижиганием, а наконечники из сапфира обеспечивают наибольшую мощность передаваемого в ткани излучения [51]. Основным недостатком лазерной вапоризации является низкая скорость удаления тканей, что ограничивает применение метода при объеме простаты более 40 см3 [79].
Дополнительные возможности открывает применение Ho:YAG лазера, обеспечивающего рассечение ткани простаты за счет вапоризации и адекватный гемостаз в месте инцизии [51]. Использование Ho:YAG лазера возможно, как в качестве дополнения к Nd:YAG визуальной лазерной аблации с целью создания продольных каналов в зоне коагуляции, обеспечивающих сокращение сроков дренирования уретральным катетером в послеоперационном периоде, так и в моноварианте – аблации ткани простаты путем вапоризации. Наиболее перспективным направлением на сегодняшний день является резекция простаты с применением Ho:YAG лазера [92]. При этом аденоматозная ткань иссекается до капсулы. Возможно выполнение резекции аденомы достаточно большого объема с минимальной интраоперационной кровопотерей. Преимуществом данной технологии является ее относительная безопасность в плане развития кровотечения в раннем послеоперационном периоде (частота гемотрансфузий составляет не более 0.2%) и возможность получения гистологического материала для исследования [91]. Однако, необходимость в длительном обучении и сложность освоения метода ограничивают его широкое применение [79].
Непосредственное воздействие на ткань простаты путем введения в нее световода используется в методе интерстициальной лазерной аблации[23]. При этом лазерный луч вызывает коагуляционный некроз с последующей атрофией в глубине ткани, не приводя к отторжению поверхностно расположенного уротелия[51]. В качестве источника применяются Nd:YAG генераторы и генераторы на основе полупроводниковых диодов. Возможность применения практически при любых размерах и архитектонике долей, сохранения уротелия, а как следствие, меньшая выраженность ирритативной симптоматики и частота развития инфекционных осложнений в послеоперационном периоде определяют неоспоримые достоинства метода[79].
Идея использования термического разрушения ткани простаты для ликвидации инфравезикальной обструкции заложена и в других малоинвазивных методах, таких как термотерапия, микроволновая трансуретральная аблация, аблация высокоинтенсивным сфокусированным ультразвуком, трансуретральная игольчатая аблация [79].
Лазерная «простатэктомия», как и остальные малоинвазивные методы, успешно выполняет задачу снижения жизненно опасных осложнений хирургического вмешательства на предстательной железе при ее доброкачественной гиперплазии [51]. Риск развития кровотечения, требующего переливания крови минимален. Так же нет сообщений и о развитии такого грозного осложнения, как «синдром водной интоксикации»[3]. Однако, теоретическая возможность его возникновения появляется с возрастанием «инвазивности» вмешательства, например, при выполнении гольмиевой резекции простаты в случае открытия большого венозного синуса или перфорации капсулы[92].
Многие малоинвазивные методики, в том числе и лазерная «простатэктомия», не приводят к немедленному удалению ткани во время вмешательства, а уменьшение обструкции базируется на последующем отторжении некротизированных участков. Результатом является послеоперационная задержка мочеиспускания, требующая длительного дренирования уретральным катетером [79]. Так, после выполнения визуальной лазерной аблации, по данным ряда авторов, средняя продолжительность дренирования катетером составляет 4.7 – 14.7 дней[51], достигая в некоторых исследованиях 19 дней[91]. После удаления катетера сложности с восстановлением самостоятельного мочеиспускания испытывают 30.4 % больных, перенесших визуальную лазерную аблацию[79].
Большое число авторов подчеркивают тот факт, что сама технология этих вмешательств, основанная на необходимости отторжения очагов коагуляционного некроза с течением времени не способствует улучшению качества жизни пациентов в ближайшем послеоперационном периоде [20,23,104]. По данным проспективного нерандомизированного исследования, проведенного Schaltz и соавторов в 1997 г [103], при сравнении ближайших результатов оперативного лечения ДГП с использованием ТУР простаты, аблации высокоинтенсивным сфокусированным ультразвуком, трансуретральной игольчатой аблации и визуальной лазерной аблации получен практически идентичный для всех групп (кроме ТУР) уровень осложнений, требующих проведения дополнительного лечения [23]. Отмечена сходная частота микций и эпизодов неудержания мочи в течении первых 6 недель после перечисленных выше операций при значительно большей выраженности дизурии у пациентов, перенесших визуальную лазерную аблацию [104]. Ночная поллакиурия в этой группе больных составила в среднем до 4 раз, тогда как в других группах удалось достигнуть значительного ее снижения за первые 6 недель послеоперационного периода [104]. Изучение качества жизни показало, что наибольший дискомфорт испытывают пациенты после трансуретральной игольчатой аблации и визуальной лазерной аблации в сравнении с трансуретральной резекцией простаты [53]. Интерстициальная лазерная коагуляция обеспечивает аналогичные визуальной лазерной аблации результаты лечения, позволяя избежать выраженной ирритативной симптоматики в послеоперационном периоде[51].
S. Madersbacher и соавторы, анализируя многочисленные рандомизированные исследования, посвященные малоинвазивным методам лечения ДГПЖ, отмечают, что при всей скудности данных, касательно позднего послеоперационного периода, уровень их осложнений несколько меньше, чем после ТУР простаты [79]. Так, стриктура уретры развивается в среднем у 1.4 % больных. Исключение составляет частота повторных вмешательств, обусловленных сохранением или рецидивированием симптомов инфравезикальной обструкции, которая достигает 12.9 – 15 % в течении первого года после первичной операции. Авторы приходят к заключению о большем, чем предполагалось ранее, проценте осложнений после малоинвазивных вмешательств. При этом подчеркивается превалирование осложнений раннего послеоперационного периода над интраоперационными[79].
Как контактные, так и бесконтактные методы лазерной простатэктомии обладают сходной клинической эффективностью [51]. Симптоматическое улучшение по сравнению с предоперационными показателями после визуальной лазерной аблации в среднем составляет 61 % и несколько меньше (57%) после интестициальной лазерной коагуляции [79]. Наилучшие показатели объемной скорости мочеиспускания и сокращения количества остаточной мочи достигнуты при гольмиевой резекции простаты, превосходя (различия статистически не достоверны), по данным одного из исследований, аналогичный параметр после ТУР простаты [15]. В среднем, после лазерной простатэктомии прирост Q max составляет 83 %, а объем остаточной мочи снижается на 52% [51]. Другие малоинвазивные вмешательства, описываемые выше, имеют более скромные показатели клинической эффективности [92].
Таким образом, ТУР простаты в сравнении с рассматриваемыми вмешательствами занимает лидирующие позиции в плане клинической эффективности и стабильности положительных результатов в отдаленном периоде после операции, сохраняя достойную роль «золотого стандарта» в хирургическом лечении ДГПЖ. Преодоление таких недостатков лазерных методик, как высокая экономическая стоимость, позднее наступление дизобструкции, значительная дизурия в послеоперационном периоде, длительное послеоперационное отведение мочи, продолжительность самой операции, относительная нерадикальность лечения позволит занять лазерной хирургии достойное место в спектре методов лечения ДГПЖ[15, 79].
С целью снижения осложнений, связанных с использованием монополярных инструментов, прежде всего таких как ожоги уретры и ягодичной области, кровотечение в интра- и послеоперационном периоде, а также ТУР-синдрома, на сегодняшний день активно внедряется в практику новое направление в эндоскопии – биполярная электрохирургия, получившая свое развитие в создании новой технологии – плазмакинетическая резекция и вапоризация [79]. Однако, опыт применения данной методики еще очень ограничен, не накоплены отдаленные результаты выполнения биполярной электрорезекции простаты, требуется проведение рандомизированных исследований, направленных на изучение сравнительной оценки эффективности и частоты развития осложнений после данных операций для суждения об их эффективности.
Трансуретральные электрохирургические методы лечения доброкачественной гиперплазии предстательной железы на сегодняшний день занимают лидирующие позиции по частоте их применений в клинической практике [20].
Совершенствование электрохирургических методов открывает перспективы улучшения результатов лечения доброкачественной гиперплазии простаты и снижения риска развития жизненоопасных осложнений в сравнении со стандартной трансуретральной резекцией [91].
При выполнении вапоризации простаты уролог должен четко осознавать электрохирургические принципы, лежащие в основе процесса и возможное влияние различных факторов на его исход [23, 60, 92].
Основные эффекты, происходящие в ткани при воздействии тока обусловлены превращением электрической энергии в термическую [23]. Однако, дополнительное значение имеют и другие факторы:
а) механическая энергия пара, образующегося как в клетках, так и в интерстиции;
б) давление акустических волн, возникающих за счет ионизации и плазменного разряда;
в) электропорация мембран (возникновение пор в липидном матриксе мембран под действием электрического поля, приводящих при определенной величине к разрыву клетки);
г) фарадические эффекты и емкостное сопротивление.
Достаточно высокой частоты ток обладает способностью генерировать заряд в расположенных рядом проводниках благодаря мощному электромагнитному полю. Результатом такого влияния могут явиться ожоги в месте контакта монополярного инструмента с телом пациента [15]. Подобного недостатка лишены современные инструменты для выполнения биполярной резекции.
Использование высоких энергий и определенный процент осложнений в виде послеоперационного недержания мочи и импотенции породили предположение о возможности термического повреждения наружного сфинктера мочевого пузыря и эректильных нервов в процессе вапоризации простаты [23]. В ряде исследований была проведена оптическая термометрия перипростатических структур, а так же, для определения температуры применялись термосенсоры в указанной области [60]. Ни одно из исследований не выявило значимого термического влияния на наружный сфинктер мочевого пузыря и нервно-мышечный пучок. Повышение температуры в 10 мм от вапортрода не превышало 1.9 С [23], на расстоянии 1-2 мм достигало 40 С, а в 3-5 мм составляло только 2-5 С. Наибольшее повышение температуры соответствовало использованию режима коагуляции и объяснялось в два раза большим пиковым напряжением по сравнению с резекцией, что сопровождалось более глубоким проникновением термической энергии в ткани [60]. Авторы подчеркивают, что обширное использование электровапоризации в «сфинктерной» зоне увеличивает риск недержания мочи в послеоперационном периоде [60]. Такие факторы, как постоянное охлаждение промывной жидкостью (в меньшей степени отведение тепла с током крови), отказ от применения коагуляционного тока в апикальных отделах, снижение выходной мощности в генераторах без микропроцессорного контроля при возрастании импеданса способствуют, по результатам исследований, предотвращению излишнего повышения температуры в перипростатических структурах [23].
Клинические исследования показали достаточную эффективность электровапоризации простаты в избавлении от инфравезикальной обструкции при сохранении невысокого уровня послеоперационных осложнений [23]. Результаты мета-анализа пяти крупных проспективных рандомизированных исследований [20]. Shokier и соавт., используя генератор Valleylab SSE4 (Valleylab Inc., Colorado, USA) выполняли вапоризацию с использованием только режущего режима мощностью 200-300 Вт больным с объемом простаты до 60 см3[104]. Средняя продолжительность оперативного вмешательства при электровапоризации была значительно больше, чем при ТУР простаты (52 мин против 39.7 мин, Р< 0.001). Однако, уретральный катетер удалялся у 86 % пациентов в течении уже первых суток после вапоризации, тогда как такая возможность представлялась только у 26 % больных, перенесших ТУР простаты. Среднее время пребывания в стационаре после вапоризации составило 1.5 дней и 2.5 дня после ТУР. Клиническая эффективность обоих методов оставалась практически одинаковой в течении одного года после операции.
Hammadeh и соавторы наблюдали группы больных после ТУР и вапоризации простаты (генератор Valleylab Force 2, мощность 240 Вт) на протяжении 3 лет[60]. Авторы так же отметили значительно меньшую продолжительность катетеризации и нахождения в стационаре (Р< 0.001) в послеоперационном периоде для вапоризации простаты при большей средней длительности операции (Р< 0.01) в сравнении с ТУР простаты. Послеоперационное кровотечение с тампонадой мочевого пузыря встречалось значительно чаще после ТУР (Р < 0.05 ), в то время как задержка мочеиспускания в большем проценте случаев осложняла послеоперационный период электровапоризации (Р < 0.04 ). В группе больных, которым была выполнена вапоризация простаты, гемотрансфузия не проводилась, не было отмечено недержания мочи и новых случаев эректильной дисфункции. Ирритативная симптоматика была более выражена у больных после ТУР простаты, при обследовании на 6 неделе послеоперационного периода (35% против 25% в группе электровапоризации).
De Sautel и соавторы сообщили о результатах комплексного уродинамического обследования 29 больных, после вапоризации простаты [46]. В полном соответствии с субъективным и объективным улучшением после проведенного оперативного лечения максимальное давление детрузора снижалось в среднем с 95 до 44.5 см водного столба. Эти данные свидетельствуют об одинаковой эффективности ТУР и электровапоризации в избавлении от инфравезикальной обструкции [23]. Gallucci и соавторы сообщили о 84 % уменьшении объема простаты через один месяц после электровапоризации и констатировали значимое улучшение уродинамических параметров [53].
Таким образом, вапоризации простаты обеспечивает высокую клиническую эффективность избавления от инфравезикальной обструкции при меньшей по сравнению со стандартной ТУР частотой жизненно опасных осложнений, более коротким периодом дренирования уретральным катетером и временем нахождения в стационаре в послеоперационном периоде. Существенным недостатком метода является низкая скорость аблации ткани простаты; процесс выпаривания ткани более продолжителен по времени, образующийся карбонизированный слой его замедляет и для возобновления эффекта выпаривания необходима регидратация ткани [23]. Все это заставляет применять электровапоризацию в виде монотерапии при объемах ДГП, не превышающих 40 см3[23, 79].
Таблица № 17. Данные мета-анализа пяти проспективных рандомизированных исследований, посвященных сравнению стандартной ТУР и электровапоризации простаты [20]
|
Параметр |
ТУР |
Вапоризация |
Кол-во исследо-ваний |
|
Число пациентов |
270 |
262 |
5 |
|
Исходный IPSS* |
22.4(18-27) |
23.2(19-27) |
5 |
|
Исходный Qмах(мл/сек)* |
8.9(6.9-11.4) |
8.4(7.3-10.3) |
5 |
|
Продолжительность операции(мин)* |
40.7(21.6-53) |
46(26.9-60) |
4 |
|
Дренирования катетером (часов)* |
52.5(46.6-52) |
32.7(20.9-47) |
5 |
|
Гемотрансфузия** |
6.4(2-11.6) |
0 |
3 |
|
Макрогематурия с тампонадой мочевого пузыря** |
13.6(8.8-20) |
4.2(3-5.7) |
3 |
|
Задержка мочи** |
7.9(3.8-12) |
15(6-23) |
3 |
|
Инфекция мочевыводящих путей** |
5.2(0-11.6) |
8(0-18) |
3 |
|
Эпидидимит** |
2.5(0-5) |
0.7(0-1.4) |
2 |
|
Ретроградная эякуляция** |
85(81-89) |
74(72-76) |
2 |
|
Импотенция** |
9(7-11) |
14(11-17) |
2 |
|
Сохранение ирритативной симптоматики в отдаленном периоде** |
22.5(10-35) |
20(15-25) |
2 |
|
Недержание мочи** |
1.3(0-3.8) |
7.2(3-18.6) |
3 |
|
Повторные операции в течение 1 года** |
5.5(4-7) |
5.5(4-7) |
3 |
|
Склероз шейки мочевого пузыря** |
4(3-5) |
1.4(0-4.2) |
3 |
|
Стриктура уретры** |
2(0-4) |
2(0-4) |
2 |
* — среднее значение показателя, ** — частота пациентов в %.
Работа идеального электрохирургического прибора должна сочетать в себе эффективное удаление ткани (сравнимое со стандартной ТУР) с хорошим интраоперационым гемостазом, препятствующим возникновению кровотечения во время аблации [53]. Результаты исследований и клинический опыт со стандартной ТУР и электровапоризацией простаты заложили основу создания симбиоза этих двух методик в виде вапоризирующей резекции [15, 79]. Ткань простаты резецируется петлей, режущий край которой имеет ту же толщину, что и стандартная петля (0.3 мм), но ширина его в четыре раза больше. Вчетверо возрастает и количество энергии, доставляемое за то же время к тканям в латеральном по отношению к петле направлении. Результатом является более совершенный гемостаз[16, 18]. Исследования свидетельствуют, что за 2.5 сек вапоризирующая петля доставляет в ткани 270 Вт, тогда как стандартная петля только 195 Вт. Увеличившаяся масса и толщина петли предоставляет возможность работы в более мощных режимах [23].
До настоящего времени еще не завершено проведение крупных проспективных рандомизированных исследований, напрямую сопоставляющих вапоризирующую резекцию со стандартной ТУР простаты [53]. Faul и соавт. сообщили о результатах выполнения вапоризирующей резекции 182 пациентам с ДГПЖ [50]. Авторы констатируют высокую клиническую эффективность, полностью сопоставимую со стандартной ТУР простаты. В среднем 27 (10.5-103) грамм ткани простаты резецировалось за 26 (7-75) минут. В послеоперационном периоде отмечалось лишь умеренное снижение уровня гемоглобина крови (в среднем с 155 г/л до 142 г/л в ближайшие 24 часа) и не возникало необходимости в гемотрансфузии. Частота возникновения стриктур уретры соответствовала таковой после стандартной ТУР простаты[50]. Однако, вапоризирующая резекция, не уступая по эффективности и скорости выполнения стандартной ТУР, является такой же трудной в освоении, так как гемостатический эффект «вапоризирующей» петли не такой выраженный, как «роликового вапортрода», а техника выполнения срезов и удаления ДГП требует значительного опыта и тренинга[50].
В целях преодоления обсуждаемых выше недостатков роликовой вапоризации и вапоризирующей резекции, а так же дальнейшего развития малоинвазивных способов удаления тканей в 1995 году была разработана новая методика трансуретрального эндоскопического лечения ДГПЖ – роторезекция, выполняемая с помощью оборудования ROTORESECT (Karl Storz, Германия) [20]. Сущность метода заключается в сочетании вапоризации, коагуляции и одновременного механического удаления ткани простаты. Инструмент представляет собой резектоскоп с оптической системой и пассивным рабочим элементом, в котором происходит передача вращающего момента с прикрепляемого микромотора на вапоризирующий (коагулирующий) и одновременно вращающийся электрод[20]. Высокочастотный ток (250-400 Кгц, 220-300 Вт) подается от генератора (радиотома) на тот же электрод при нажатии ножной педали радиотома, при этом, с помощью специального электронного сенсора возможно как сопряжение вапоризации и вращения электрода, так и отключение вращения с работой только в режиме вапоризации (коагуляции). Так же возможно изменение параметров вращения электрода [20].
Рядом авторов проведено сравнение клинической эффективности трансуретральной роторезекции и трансуретральной резекции простаты [20, 92]. Michel и соавторы выполнили трансуретральную роторезекцию группе больных с ДГПЖ [92]. Исходный объем простаты по результатам трансректального УЗИ в среднем составлял 44 ± 15.4 см3, а время оперативного вмешательства 64±18 минут. В послеоперационном периоде не отмечалось значимого снижения уровня гемоглобина крови и не требовалось гемотрансфузии. Дренирование уретральным катетером проводилось в течение 1.5±1 дней. По результатам обследования через 6 месяцев после операции Q мах в среднем возросла с исходных 9 до 22 мл/сек, объем остаточной мочи в среднем снизился с 170 до 30 мл, IPSS изменился с 22 до 5 пунктов. Авторы приходят к заключению, что трансуретральная роторезекция обеспечивает практически бескровное удаления ткани простаты, сравнимое по эффективности со стандартной ТУР петлевым электродом [92].
Меринов Д.С. [20] сравнил результаты 60 трансуретральных резекций простаты и 60 роторезекций, автором проведена оценка эффективности обеих методик, изучены показания и противопоказания к обеим методикам. При выполнении роторезекции автором не было отмечено геморрагических осложнений, однако отмечено, что при выраженной средней долей более предпочтительным является выполнение трансуретральной резекции простаты.
Анализ литературы свидетельствует о высокой актуальности дальнейшего развития минимально-инвазивных методов ликвидации инфравезикальной обструкции у пациентов с ДГП, снижающих риск развития жизненно опасных осложнений при сохранении сравнимых с трансуретральной резекцией результатов лечения. Появляющиеся новые методы заслуживают детального изучения и сопоставления с «золотым стандартом» для определения их роли в арсенале средств лечения этой категории больных.
Однако, несмотря на совершенствование инструментов и техники выполнения трансуретральных вмешательств, на сегодняшний день не отмечено значимой тенденции к снижению осложнений после выполнения стандартной монополярной резекции предстательной железы, что в свою очередь обусловливает поиск новых высокотехнологичных активно применяемых на сегодняшний день методов лечения ДГПЖ.
Поэтому детальное изучение причин развития интраоперационных и послеоперационных осложнений, разработка комплекса профилактических мер, способов ранней диагностики и своевременного лечения данной категории пациентов являются одним из главных факторов по улучшению результатов лечения больных.
Недостаточное количество информации по этим и многим другим вопросам диктует настоятельную необходимость глубокого и всестороннего изучения данной проблемы.
«Осложнения трансуретральных вмешательств на мочевом пузыре»
3.1. Основные виды эндоскопических операций на мочевом пузыре и наиболее часто встречающиеся осложнения.
Трансуретральные эндоскопические операции, выполняемые на мочевом пузыре, в настоящее время включает в себя:
· Трансуретральная электрорезекция, электровапоризация мочевого пузыря (опухоли, дисплазия, воспаление и др.)
· Трансуретральная лазерная аблация мочевого пузыря
· Цистоскопия, биопсия мочевого пузыря
· Цистолитотрипсия, цистолитоэкстракция
· Инцизия шейки дивертикула мочевого пузыря
Исходя из анатомо-функциональных позиций и клинических особенностей осложнения трансуретральных операций, выполняемых на устье мочеточника и интрамуральном отделе мочеточника (рассечение уретероцеле, трансуретральная резекция устья мочеточника, катетеризация и установка стента) будут рассмотрены в соответствующей главе.
В настоящее время с активным развитием и внедрением в клиническую практику достижений научно-технического прогресса, большое распространение получили эндоурологические методики, которые являются не только органосохраняющими, но и функциональнощадящими. Большинство урологов Европы и Америки признает приоритет трансуретральных эндоскопических методов в лечении неинвазивных форм РМП [1, 11, 19, 62, 74]. Учитывая локализацию поверхностных новообразований в пределах lamina propria, правильно выполненное эндоскопическое пособие на этих стадиях позволяет произвести полное удаление опухоли в пределах здоровых тканей, что соответствует принципам радикального хирургического лечения. Авторы убедительно показывают преимущества эндоскопических методик: малая травматичность, сохранение емкости мочевого пузыря, сокращение времени операции, быстрая послеоперационная реабилитация, отсутствие снижения качества жизни (сохранение самостоятельного мочеиспускания, копулятивной и фертильной функций и др.), в случае рецидива, возможность повторных и многократных эндоскопических трансуретральных операций, переносимых больными значительно легче открытых пособий. Необходимо сразу же отметить, что электрокоагуляция опухолей мочевого пузыря, независимо от их размера, локализации и степени злокачественности — метод паллиативный, и в настоящее время применяться не должен. [8, 19, 26, 88].
Трансуретральная резекция (ТУР) — электрохирургический метод, наиболее часто применяющийся для хирургического удаления поверхностных опухолей мочевого пузыря [106]. Показанием к операции является наличие опухоли Тa, Tis, T1 при No(Nx)Mo. Операционная техника подробно освещена в ряде монографий и руководств по оперативной урологии [8, 12, 26] и в своей основе заключается в осторожной парциальной электрорезекции новообразования, проводимой от верхушки к основанию до глубокого мышечного слоя, с тщательной коагуляцией кровоточащих сосудов. Неотъемлемой частью операции является полифокальная биопсия отдаленных участков уротелия, а также дна пострезекционной площадки. Конечной целью ТУР, по мнению Н.А. Лопаткина и соавторов [11], является не только радикальное удаление опухоли, но и что очень важно, получение полной информации о патоморфологической стадии новообразования. Радикальность операции подтверждается отсутствием подслизистой и мышечной опухолевой инвазии при гистологическом исследовании.
При локализации опухоли в зоне мочеточникового устья, вне зависимости от выраженности нарушений уродинамики верхних мочевых путей, резекцию проводят после предварительного заведения мочеточникового катетера, что улучшает интраоперационную ориентацию и препятствует развитию обструктивных осложнений. При показаниях выполняется поверхностная резекция устья. Осложнения, вызванные повреждением терминального отдела мочеточника, встречаются редко [31].
Мультифокальный рост поверхностного РМП не является противопоказанием к ТУР. В таких случаях В.Я. Симонов [26] обращает внимание на важность первостепенного удаления наиболее мелких опухолей, так как резекция больших новообразований связана с возможным кровотечением, что может в дальнейшем затруднить поиск мелких опухолей из-за потери прозрачности ирригационной среды.
Наличие больших экзофитных опухолей (диаметром более 5 см) также не служит противопоказанием к ТУР [].
Учитывая возрастно-половые особенности заболевания [5,19], следует остановиться на сопутствующей РМП доброкачественной гиперплазии простаты (ДГП). В таких случаях возможна сочетанная ТУР мочевого пузыря и простаты [8, 15, 26]. Важно строгое соблюдение последовательности операции – сначала резекция мочевого пузыря, затем ТУР простаты. Такая тактика необходима для обеспечения прозрачности ирригационной среды, а так же для снижения риска имплантационного метастазирования во время ТУР в раневую поверхность простаты [1].
Необходимо отметить не только лечебные, но и диагностические возможности ТУР – т.к. окончательный диагноз выставляется только по результатам гистологического исследования удаленного материала, что собственно и является критерием достоверности стадии опухоли [11, 114]. При патоморфологическом выявлении инвазивных форм РМП пособие не радикально и должно являться начальным этапом дальнейшего комплексного лечения. В этих случаях ТУР носит диагностический характер, а также может быть паллиативным лечебным пособием при невозможности по тем или иным причинам (старческий возраст, выраженные интеркуррентные заболевания и др.) проведения радикального лечения. [80]
Касаясь вопросов диагностики следует отметить трансуретральное ультразвуковое исследование (УЗИ) и фотодинамическую диагностику (ФДД) мочевого пузыря. Трансуретральное УЗИ дает возможность более детального изображения опухоли и стенки мочевого пузыря [19], что позволяет стадировать опухоль с точностью до 94%, что подтверждается данными гистологического исследования. ФДД в урологическую практику внедрена в 1996г. [4, 9, 73] Метод ФДД, основан на введении в мочевой пузырь фотосенсибилизатора – 5-аминолевулиновой кислоты (5-ALA). В течение 2 часов концентрация протопорфина IX в малигнизированных клетках в 17 раз превышает его концентрацию в здоровых тканях, что прекрасно видно при последующем облучении мочевого пузыря фиолетовым светом. По выявляемым участкам флюоресценции возможна ранняя диагностика изменений уротелия (дисплазия, carcinoma in situ), не определяемых обычным эндоскопическим контролем [73]. Так, Н.А.Лопаткин и соавторы [9] из 11 пациентов подвергнутых ФДД, у 3 выявили опухоли мочевого пузыря, невидимые при стандартной цистоскопии в белом свете. Главная ценность методов – возможное их использование интраоперационно в качестве контроля резекции, что по мнению ряда авторов повышает радикализм ТУР и ведет к снижению рецидивов рака мочевого пузыря.
Результаты ТУР мочевого пузыря в лечении поверхностного рака мочевого пузыря дискутабельны. Частота рецидивов только после ТУР, по данным разных авторов, в среднем составляет от 50 до 90% [11, 19, 65].
Б.П. Матвеев с соавторами [19] публикуют данные о 48 — 90% рецидивов поверхностного рака мочевого пузыря после чисто хирургического лечения путем ТУР, причем в течение года рецидив выявлен в 50% случаев, а у 20% диагностирован инвазивный рост и увеличение степени злокачественности.
Данные зарубежных исследователей о частоте рецидивирования поверхностного РМП только после ТУР также неутешительны [33, 74]. Частота рецидивов поверхностного рака по данным различных авторов частота рецидивов поверхностного рака варьирует от 39 до 77% [33, 74].
К интраоперационным осложнениям ТУР мочевого пузыря, особенно часто встречающимся при работе с крупными (более 10 г) и мультицентричными опухолями, исследователи [1, 8, 11, 44, 70] относят:
1. Риск кровотечения
2. «ТУР – синдром»
3. Неконтролируемую перфорацию мочевого пузыря (из-за стимуляции запирательного нерва)
4. Возможность неполного удаления опухоли
5. Плохую операционную видимость при массивном кровотечении
6. Высокую частоту рецидивирования.
В таблице № 23 приведены данные о частоте кровотечений после выполнения трансуретральных резекций мочевого пузыря по поводу опухоли.
Таким образом, можно отметить, что улучшение оборудования и наполенный урологами опыт операций позволили несколько снизить частоту геморрагических осложнений, однако уровень последних по-прежнему остается достаточно большим.
Таблица № 23. Частота кровотечений после выполнения ТУР мочевого пузыря по поводу РМП.
|
Авторы |
кол-во операций |
частота кровотечений |
|
Dich A. [48] |
373 |
13% |
|
Kardos R. [71] |
116 (лазер) |
0% |
|
Чепуров А.К. [30] |
824 |
4,6% |
|
Collado A. [44] |
2821 |
2,8% |
Внутри- и внебрюшинная перфорация мочевого пузыря, помимо кровотечения, являются наиболее серьезными интраоперационными осложнениями любой эндоскопической манипуляции, выполняемой на мочевом пузыре. При монополярной трансуретральной резекции мочевого пузыря риск развития данного осложнения повышен при наличии широкого основания опухоли и при локализации последней на боковых стенках вследствие электростимуляции запирательного нерва. Возникновение перфорации мочевого пузыря часто сочетается с повышенным риском развития кровотечения, удлинения времени операции и повышенным риском развития «ТУР-синдрома». Частота перфорации мочевого пузыря значительно варьирует от 0,4% до 13% [30, 44, 48, 71]. По данным авторов 80-90-х годов частота данного осложнения была не менее 8-13% [8, 26]. С накоплением опыта эндоскопической электрохирургии и анестезиологического пособия, усовершенствованием оборудования частота данного осложнения значительно снизилась и по данным современных публикаций не превышает 4%[44]. Данного осложнения удается избежать при использовании электровапоризации вследствие большей поверхности вапортрода, лазерной аблации и биполярной электрорезекции опухолей мочевого пузыря. Одной из важных проблем при развитии перфорации мочевого пузыря является возможность отсева опухолевых клеток за пределы мочевого пузыря. Анализ литературы, посвященной данному вопросу установил, что согласно мнению большинства исследователей риск отсева существует, но он минимален, описано несколько случаев, когда после трансутрельной резекции мочевого пузыря, сопровождавшейся перфорацией мочевого пузыря было отмечено экстраорганное распространение опухоли [62]. Риск развития данного осложнения выше при низкой степени дифференцировки опухолевых клеток и мультифокальном опухолевом росте.
«ТУР-синдром» при выполнении трансуретральной резекции мочевого пузыря является крайне редким осложнением. Частота развития данного осложнения составляла 0,5-2% в 80-90-х годах [3, 109]. При появлении инструментов, поддерживающих низкое давление промывной жидкости, риск развития данного осложнения значительно снизился и в литературе встречаются лишь единичные его описания.
Большое количество рецидивов и недостатки ТУР не могут удовлетворять урологов, что в свою очередь, ведет к непрекращающейся генерации новых лечебных методик, направленных на повышение перспектив лечения поверхностных форм РМП, одной из которых является удаление (аблация, деструкция, аппликация) новообразований с использованием лазерных технологий. Хороший режущий и гемостатический эффекты, бактерицидные и абластические свойства высокоэнергетических лазерных излучений легли в основу их использования для лечения поверхностного РМП с конца 70-х годов [71].
В хирургии, чаще всего, используются следующие лазерные источники: аргоновый (Ar, длина волны 4550 – 5150 нм), углекислый (СО2, 10600 нм), неодимовый на кристаллах иттрий – аллюминиевого граната (Nd: YAG, 1064 нм), гольмиевый (Ho: YAG, 2100 нм) и полупроводниковый диодный (830 нм). Определяющими моментами в термодинамическом процессе лазер-ткань являются длина волны лазера и плотность ткани. С уменьшением длины волны и плотности ткани возрастает глубина проникновения лазера [51].
Наибольшей проникающей способностью обладает Nd: YAG – лазер. По ряду данных [71] глубина его проникновения составляет 9 – 10 мм. Излучение этого лазера лишь незначительно поглощается ирригационной водной средой, что имеет важное значение при эндохирургических операциях. Кроме того, Nd: YAG – лазер обладает хорошим коагулирующим эффектом. Такие характеристики привели к наиболее частому использованию энергии Nd: YAG – лазера в лечении заболеваний мочевого пузыря [71].
Для лечения поверхностного РМП в основном используют эффекты коагуляции и вапоризации.
Удаление новообразований мочевого пузыря с помощью лазера может осуществляться бесконтактным и контактным методами. Для проведения операции используют соответствующий лазерный генератор, уретроцистоскоп с инструментальным каналом и подъемником Альбаррана, а так же специальные фиброоптические светопроводящие волокна, передающие лазерное излучение [51]. Различают волокна переднего и бокового прижигания. Первые используются при контактной вапоризации, вторые – при бесконтактной коагуляции или вапоризации. Волокна бокового излучения оснащены специальными наконечниками, передающими лазерный луч в сторону под углом к продольной оси волокна. Производятся модели с различными углами отклонения, а также другими физико – техническими характеристиками, влияющими на плотность мощности, потерю энергии и тепловой эффект лазерного воздействия. В настоящее время наибольшее распространение получили бесконтактные методики [51].
Техника аблации заключается в «обработке» лазером (коагуляция, вапоризация) опухолевой ткани, ее основания и здоровой слизистой мочевого пузыря не менее 1 см от края новообразования [71]. Высоко-термическое лазерное воздействие на окружающие опухоль ткани вызывает развитие лимфостаза, что, по мнению ряда авторов [51], способствует предотвращению распространения опухолевых клеток.
Опухоли передней стенки и шейки мочевого пузыря удобно удалять используя специальный цистоскоп с ретроградным подъемным устройством и оптикой с углом зрения 1100 [15]. В случаях, когда новообразование располагается на тонкой ножке, предпочтительно контактное отсечение опухоли на уровне основания с последующей аппликацией ложа бесконтактным способом [71].
Развитие методов фиброскопии дает возможность производить лазерную деструкцию опухолей с применением фиброуретроцистоскопа. Гибкость дистального конца эндоскопа позволяет осмотреть всю поверхность мочевого пузыря, включая малодоступные для ригидной цистоскопии зоны, а с помощью светопроводящего волокна, помещенного в инструментальном канале, можно выполнить лазерную деструкцию опухоли [71].
При бесконтактной коагуляционной методике Nd:YAG – лазером отмечается отсутствие эффекта удаления ткани. Опухоль белеет и сморщивается, оставляя на своем месте некротизированную массу – струп, который в дальнейшем самостоятельно отторгается, в ряде случаев вызывая отсроченное кровотечение [71]. Обычно рана заживает без выраженных воспалительных реакций вторичным натяжением в течение 4 – 6 недель [51].
В связи с возможным загрязнением дистального конца наконечника с последующим его термическим повреждением, а так же для улучшения эндоскопической видимости, операция выполняется с использованием тубуса постоянной водной ирригации или осуществляется в газовом режиме (за счет инсуфляции азота, гелия или углекислого газа) [71].
Лазерное излучение может подаваться в постоянном или импульсно – периодическом режиме. Мощность лазера обычно составляет 30 – 60 Вт. Суммарные затраты энергии около 20 – 60 кДж. Среднее время, затрачиваемое на удаление опухоли размером более 1 – 2 см в диаметре, составляет 40 – 50 мин. [51].
В отечественной и зарубежной литературе тема лазерного удаления поверхностного РМП представлена меньшим количеством публикаций и не так полно и подробно как методика ТУР [4, 9, 71].
В последнее время для лечения поверхностного РМП стал использоваться и Ho: YAG — лазер, обладающий небольшой проникающей способностью. В основе лечения лежит эффект вапоризации. А.К. Чепуров [31] применял Ho: YAG – лазер в группе из 19 пациентов с РМП в стадии Та – Т2NoMo. Рецидив заболевания в течение года выявлен у 5 (26,3%) человек.
Удаление новообразований с использованием лазера, по мнению В.Я. Симонова [26], предпочтительно при малых размерах опухоли, а при новообразованиях превышающих 1-2см в диаметре, авторы предлагают сочетанное использование ТУР и лазерных методов. Операция начинается с выполнения стандартной ТУР и завершается проведением лазерной аппликации дна удаленной опухоли. Такая комбинация методик снижает операционное время за счет быстрого удаления новообразования путем ТУР, и повышает абластичность операции лазерным воздействием.
В целом, по данным ряда авторов[11, 51, 71], можно выделить основные преимущества лазерных методов:
1. Достаточная простота операционной техники
2. Хороший интраоперационный гемостаз
3. Абластичность воздействия
4. Отсутствие «ТУР – синдрома»
5. Отсутствие стимуляции запирательного нерва
6. Сокращение послеоперационного периода
7. Возможность использования лазерного излучения в гибких эндоскопах.
К недостаткам методов [11, 51, 71] относят:
1. Ограничение глубины проникновения в ткани (из-за возможного поверхностного обугливания при высокой плотности мощности лазера)
2. Значительное увеличения длительности операции (особенно при опухолях более 1,0 – 2,0 см в диаметре и при мультифокальном росте)
3. Отсутствие гистологического материала
4. Отсроченные кровотечения (в связи с отхождением раневого струпа)
5. Необходимость использования специального оборудования и инструментария, превышающих по стоимости электрохирургические методики в 20 – 100 раз.
К разновидности лазерного удаления опухолей мочевого пузыря относят фотодинамическую терапию (ФДТ), впервые использованную в 1976г [73]. Метод заключается во внутривенном введении фотосенсибилизирующего вещества, чаще Photofrin II – производного гематопорфирина, задерживаемого опухолевой тканью с последующим, через 2 – 3 дня, облучением мочевого пузыря жидким аргоновым лазером c настройкой цвета (красный – 630 нм; зеленый – 514 нм). В результате воздействия лазерного света на Photofrin II высвобождается атомарный кислород и образуются свободные радикалы, приводящие к цитотоксическому действию [73].
M. Kriegmair и соавторы [73], проводя ФДТ у 21 пациента с Ta, Tis и Т1, полную регрессию зафиксировали у 12 больных в средние сроки наблюдения 18 месяцев, у 3 была частичная регрессия.
Метод сложен в практическом применении, недостаточно эффективен и имеет большое количество осложнений в виде цистита, пузырно-мочеточникового рефлюкса и ожогов из-за нарушения светочувствительности [73].
Электровапоризация – электрохирургический метод, заключающийся в быстром испарении ткани с мгновенной коагуляцией больших участков поверхности. Публикации по данной теме ограничены одной зарубежной [88] и рядом статей в отечественной литературе [10, 11,23].
J.M. McKiernan с соавторами [88] сообщают о 8 пациентах, которым производилась трансуретральная электровапоризация поверхностных опухолей больших размеров (средний размер новообразований около 4,3 см в диаметре). Авторы делают выводы о безопасности и эффективности метода сопоставимого со стандартной петлевой трансуретральной резекцией, а так же о некоторых преимуществах над последним. Трансуретральная электровапоризация опухоли мочевого пузыря сокращает время операции, позволяет быстро контролировать кровотечение, уменьшает необходимость повторных резекций, снижает время госпитализации. Отмечен относительный недостаток новой техники – отсутствие гистологического материала, в связи с чем предложена интраоперационная биопсия как обязательный компонент операции. Среди осложнений отмечен случай падения гематокрита на 2,7 г% у пациента с исходно низкими цифрами, потребовавший гемотрансфузии, а так же один случай острого обструктивного пиелонефрита, возникший при вапоризации большой опухоли на боковой стенке. Сроки наблюдения составили 23 месяца. У 3 больных выявлен рецидив опухоли через 3 месяца. Всем произведена повторная электровапоризация. У других пациентов рецидивов не выявлено.
Лопаткин Н.А., Мартов А.Г. и соавторы [10] сообщают о 32 пациентах в стадии Ta – T1 No(Nx)Mo, которым была выполнена электровапоризация. Отмечена хорошая интраоперационная эндоскопическая видимость, эффективный гемостаз, отсутствие необходимости частого удаления рабочего элемента для очищения электрода (что характерно для ТУР мочевого пузыря), так как ткань опухоли, содержащая значительное количество вне- и внутриклеточной жидкости, быстро выпаривается и не остается на варпортроде, сокращение сроков дренирования мочевого пузыря. При сокращении запирательного нерва (4 случая) не было непредвиденного повреждения стенки мочевого пузыря, что, по-видимому, связано с большой площадью контактной поверхности варпортрода. Не отмечено интра- или послеоперационного кровотечения, неконтролируемой перфорации, «ТУР-синдрома».
К недостаткам метода отнесены необходимость сочетанной биопсии (в виде ТУР) и повышенное газообразование, затрудняющее осуществление вмешательства на передней стенке мочевого пузыря. Отмечена нецелесообразность применения методики при локализации опухоли в проекции устья и интрамурального отдела мочеточника во-избежании повреждения его терминальной части. При локализации опухоли в проекции внутрибрюшной части стенки мочевого пузыря рекомендуется проводить операцию с большой осторожностью при сниженной мощности воздействия до 220 – 240 Вт, в связи с возможным термическим повреждением прилежащих петель кишечника.
Из осложнений выявлено развитие уретрита у 2 пациентов и острого пиелонефрита без нарушения уродинамики у 1 пациента.
В сроки наблюдения за оперированными больными в течение 6 – 24 месяцев, получены результаты у 23 (71,9%) пациентов. В качестве комплексного лечения проводилась иммунотерапия. Рецидив выявлен у 3 (13%) больных.
Полученные предварительные данные применения электровапоризации в комплексном лечении рака мочевого пузыря позволяют авторам считать метод клинически эффективным. Однако для подтверждения данного положения требуются дальнейший контроль и получение результатов отдаленных наблюдений.
Проблема рецидивирования и прогрессирования поверхностного рака мочевого пузыря в ранние сроки после оперативного лечения является одной из самых серьезных и актуальных среди спорных вопросов, касающихся осложнений трансуретральных операций на мочевом пузыре [64].
Развитие рецидива опухоли мочевого пузыря является наиболее грозным из поздних послеоперационных осложнений трансуретральной резекции мочевого пузыря, так как с одной стороны, требует выполнения повторного оперативного лечения, а с другой стороны, рецидивная опухоль может отличаться от первичной более агрессивными биологическими свойствами и обуславливать худший прогноз. Вопрос о том, являются ли рецидивные опухоли мочевого пузыря, выявленные в срок до 3-х месяцев после первичной операции истинно рецидивными или не выявленными во время первичной операции, остается открытым и весьма актуальным [1, 19, 63, 64].
Развитие поверхностного рака мочевого пузыря трудно предугадать из-за гетерогенности опухолей, представляющих данное заболевание. Две основные особенности определяют судьбу пациента с поверхностным раком мочевого пузыря. Это рецидивирование и прогрессирование опухоли [19, 62].
Несмотря на то, что трансуретральная резекция признана “золотым стандартом” в лечении поверхностного рака мочевого пузыря, имеет место достаточно большое количество рецидивов, выявляемых в ранние сроки после первой операции. По данным различных зарубежных авторов, высокий процент рецидивов (60-90%) поверхностного рака выявляется уже в ранние сроки после трансуретральной резекции мочевого пузыря [63]. Так Heney N. с соавт. (1983) отмечают развитие рецидивов рака мочевого пузыря при стадии Та в 39% случаев, при стадии Т1 в 61% в течение полугодового наблюдения после трансуретральной резекции [62]. Holmang S. (1999) выявил рецидивы у 40,9% больных через 3 месяца после трансуретральной резекции [64]. Kurth K. (1997) сообщает о развитии рецидивов у 50% больных с одиночными опухолями и у 70% больных с множественными опухолями в течение 3 месяцев после трансуретральной резекции [74]. Witjes c cоавторами, проводя статистический анализ 22 рандомизированных исследований, обобщающих результаты трансуретральной резекции при Та и Т1, обнаружили рецидивы в 54% случаев [114].
Данные отечественных авторов о частоте рецидивов поверхностного рака мочевого пузыря после трансуретральной резекции, также остаются неутешительными и в среднем составляют от 40 до 90% [1, 4, 10, 11, 19]. При высоком показателе общей 5-летней выживаемости (более 70%) развитие рецидивов отмечается более чем у 50% больных (по данным НИИ урологии в ходе наблюдения за более чем 600 больными с поверхностным раком мочевого пузыря) [11]. Матвеев Б.П. и соавторы отметили рецидивы в послеоперационном периоде у 75% больных [19].
При возникновении рецидива может снижаться степень дифференцировки опухоли и возрастать глубина инвазии, что значительно ухудшает прогноз, происходит так называемое прогрессирование рака мочевого пузыря [114]. Под прогрессированием поверхностного рака мочевого пузыря понимают увеличение стадии заболевания, то есть развитие инвазивной опухоли (критерий Т), увеличение степени клеточной анаплазии (критерий G) или наличие метастатического процесса (критерий М) [19, 62]. Различные авторы приводят данные о прогрессировании поверхностного рака мочевого пузыря до 40% случаев после трансуретральной резекции при проведении первой контрольной цистоскопии [63]. Так, Heney N. (1999) почти в 30% рецидивов отмечает повышение стадии заболевания и/или степени злокачественности, т.е. поверхностный рак мочевого пузыря прогрессирует в инвазивную форму, особенно если первичная опухоль достигла собственной пластинки слизистой оболочки мочевого пузыря [62]. Матвеев Б.П. с соавт. (2002) публикуют данные о рецидивах поверхностного рака мочевого пузыря после хирургического лечения, у которых в 20% диагностирован инвазивный рост и увеличение степени злокачественности [19]. У 82% больных в стадии Tis заболевание рецидивирует и у 60% прогрессирует в инвазивные формы рака [80]. Так, по данным Holmang S. и Johansson S., (2002), в 32% случаев поверхностного рака инвазия в мышечный слой мочевого пузыря обнаруживается уже при первой контрольной цистоскопии [65]. Несмотря на адекватную начальную терапию путём трансуретральных электрорезекций или Neodym-YAG-лазерную коагуляцию, Горелов C.Н. (2002) с соавт. обнаружили у 50-70% больных с поверхностными стадиями опухоли образование местного рецидива, причём в 10-20% случаев выявлено прогрессирование заболевания (инфильтративный рост) [4]. Таким образом, данные как зарубежных, так и отечественных исследователей в отношении частоты рецидивирования поверхностного рака мочевого пузыря после трансуретральной резекции неутешительны. Частота рецидивов рака мочевого пузыря после трансуретральной резекции крайне высока 50-90% (в среднем 60%) [19, 31]. Помимо высокой частоты рецидивов отмечается риск возможного прогрессирования заболевания в виде увеличения стадии роста первичной опухоли (Т) или увеличения степени ее злокачественности (G), что является неблагоприятным прогностическим фактором развития рака мочевого пузыря. В целом, прогрессирование поверхностного рака мочевого пузыря в течение 3-5 лет после различных видов лечения для стадии Та составляет 2-4 %, для Т1 — 29-30 %, для Тis — около 54 % [62,63]. Сводные данные о возникновении рецидива и прогрессии после выполнения трансуретральной резекции в качестве монотерапии представлены в таблице № 24.
Следующим оперативным вмешательством, выполняемым на мочевом пузыре из трансуретрального доступа является цистолитотрипсия или литоэкстракция.
Таблица № 24. «Рецидивирование и прогрессирование поверхностного рака мочевого пузыря через три месяца и 5 лет после трансуретральной резекции».
|
Источники |
Коли-чество пациентов |
Рецидив % |
Прогрессия общая % |
Прогрессия при Т1G3 % |
Прогрессия в течение 5 лет %. |
|
Heney N., [62] |
63 |
79 |
30 |
48 |
3 |
|
Jewitt H., [70] |
77 |
80 |
18 |
33 |
5 |
|
Markus A., [80] |
20 |
48 |
30 |
35 |
2 |
|
Abel P., [33] |
27 |
79 |
33 |
46 |
3 |
|
Smith J., [106] |
43 |
Нет данных |
— |
51 |
10 |
|
Holmang S., [64] |
99 |
Нет данных |
40 |
45 |
20 |
|
Holmang S., [65] |
65T1a, 48T1b |
68,75 |
— |
65 |
> 5 |
Herr H., 1999 [63] |
23 |
Нет данных |
— |
65 |
15 |
Ни то, ни другое вмешательство редко являются самостоятельными, и как правило, комбинируются с операциями на уретре (внутренняя уретротомия), предстательной железе и шейке мочевого пузыря (трансуретральная резекция простаты и шейки мочевого пузыря). Цистолитоэкстракция применяется при небольших (до 1см) камнях или их фрагментах в мочевом пузыре. Нередко источником этих камней могут быть камни устья мочеточника и камни уретероцеле, которые смещаются в мочевой пузырь после рассечения устья мочеточника, также цистолитоэкстракция применяется после смещения камня мочеиспускательного канала в мочевой пузырь.
Для цистолитотрипсии характерны те же осложнения, что и при трансуретральной резекции мочевого пузыря, однако есть ряд принципиальных отличий, отраженных различными исследователями [16,18, 26]:
1. практически отсутствует риск кровотечения с необходимостью гемотрансфузии или развитием тампонады мочевого пузыря.
2. значительно большая вероятность травмы мочеиспускательного канала при проведении тубуса нефроскопа, размером 26-28F, при необходимости выполнения трансуретральной пневматической цистолитотрипсии.
Вопрос об осложнениях цистолитотрипсии следует рассматривать в историческом аспекте, так первоначально использовались лишь механические средства для цистолитотрипсии, которые являлись достаточно эффективными и могли использоваться через тубус резектоскопа 26F. Существенным недостатком данных систем была их незначительная эффективность при крупных камнях и при наличии камней с достаточно гладкой поверхностью, которая препятствовала эффективному захвату и фрагментации камня. Наличие вышеуказанных сложностей и плохая визуализация либо вследствие кровотечения из варикозно расширенных вен шейки мочевого пузыря или проблем с ирригацией значительно повышают риск повреждения инструментом для литотрипсии не только слизистой мочевого пузыря, но и всей его стенки с возможностью развития значительного кровотечения и перфорации. Таким образом, наиболее типичными осложнениями механической цистолитотрипсии являются невозможность проведения цистолитотрипсии, по данным различных авторов частота данного осложнения составляла 5-13%, в настоящее время подобной информации большинство авторов не приводит в связи с повсеместным применением пневматической либо лазерной цистолитотрипсии [15]. Повреждение стенки мочевого пузыря с развитием кровотечения и (или) перфорации отмечалось в 2-4% случаев [16, 18]. Наиболее частым методом коррекции являлась цистоскопия, коагуляция кровоточащих сосудов. Перфорация мочевого пузыря при цистолитотрипсии является осложнением не только механической, но и электрогидравлических и ультразвуковых методов контактной литотрипсии, и в связи с прекращением использования данных методов дробления для цистолитотрипсии в настоящее время имеет лишь историческое значение. Пневматическая и лазерная цистолитотрипсия являются в настоящее время наиболее используемыми методами цистолитотрипсии. По данным авторов ни в одном случае не отмечено перфорации мочевого пузыря и кровотечения, требующим гемотрансфузии или повторной операции [48]. Тем не менее оба метода ни лишены недостатков, при лазерной литотрипсии таковыми является дороговизна метода, необходимость частой смены расходных материалов и невысокая скорость фрагментации камня, а значит и большая длительность дробления с возрастанием риска развития послеоперационных инфекционно-воспалительных осложнений.
Преимуществами пневматической цистолитотрипсии является ее высокая эффективность, особенно при сочетании с ультразвуковой литолапаксией, отсутствие риска повреждения стенки мочевого пузыря. Основным недостатком является необходимость использования цистоскопов с прямым рабочим каналом, которых, почему-то практически нет в России или нефроскопов размером 26-28F, что повышает риск травмы уретры и простаты при проведении инструмента и накладывает определенные ограничения. Другим недостатком является неотработанная система эвакуации фрагментов камня из мочевого пузыря, что затрудняет операцию и увеличивает ее продолжительность, приводит к большому расходу ирригационной жидкости и охлаждению пациента, что повышает риск развития послеоперационных инфекционно-воспалительных осложнений.
В литературе описаны осложнения цистолитотрипсии, связанные с интраоперационной поломкой оборудования при выполнении цистолитотрипсии. Данное осложнение более характерно для механической цистолитотрипсии, но и при использовании любых других видов дробления это осложнение возможно [26].
Еще одним из специфичных осложнений цистолитотрипсии является миграция фрагментов камня или мелких камней в дивертикулы мочевого пузыря, что в начале цистолитотрипсии остается невыявленным и камни, таким образом, остаются неудаленными. После удаления уретрального катетера это может приводить к выраженной дизурии у пациентов с возможностью развития острой задержки мочеиспускания при вклинении камня в мочеиспускательный канал или шейку мочевого пузыря. Основной мерой профилактики данного осложнения является неоднократный осмотр мочевого пузыря при наличии множественных дивертикулов на фоне наполнения и опорожнения мочевого пузыря, при необходимости или сомнениях операцию следует дополнить инцизией шейки дивертикула с осмотром полости дивертикула и удалением камня [21].
Трансуретральная инцизия шейки дивертикула, как и цистолитотрипсия, крайне редко является самостоятельной операцией и в большинстве случаев выполняется вместе с операцией, связанной с лечением заболевания, приводящего к инфравезикальной обструкции (стриктура уретры, склероз шейки мочевого пузыря, доброкачественная гиперплазия простаты).
Дивертикул мочевого пузыря можно охарактеризовать как добавочную полость, связанную с мочевым пузырем более или менее узкой шейкой. Достаточно распространенным является деление дивертикулов на врожденные или истинные и приобретенные или ложные. В качестве разделяющих критериев приводятся следующие параметры: наличие в составе стенки дивертикула всех слоев или только слизистой оболочки, число дивертикулов, их размеры, наличие или отсутствие сфинктера и др.[21]. Однако имеется ряд работ, в которых данное разделение подвергается вполне обоснованной критике [12,21]. В качестве доказательств приводятся наблюдения приобретенных дивертикулов, имевших в своем составе все слои пузырной стенки, и врожденных, состоявших только из одной слизистой. Таким образом, морфологически нельзя отличить эти две формы друг от друга. Дивертикул мочевого пузыря может появиться во внутри — и внеутробной жизни и в механизме его возникновения, по всей видимости, играют роль два основных фактора: с одной стороны наличие слабости определенных участков в мочевом пузыре (дисэмбриогенез); с другой – существование препятствия к опорожнению пузыря. Что касается сфинктера дивертикула, большинство авторов считают, что он образован сходящимися мышцами детрузора, и истинным сфинктером это образование называть нельзя [21]. До настоящего времени нет единой точки зрения на природу этих образований [21].
Относительно показаний к оперативному лечению единая концепция также отсутствует. Очевидными показаниями к оперативному лечению дивертикулов мочевого пузыря сегодня являются: сдавление дивертикулом шейки мочевого пузыря с нарушением акта мочеиспускания; суправезикальная обструкция, вызванная дивертикулом; тяжело протекающий цистит и дивертикулит; камни и новообразования в полости дивертикула [21]. Консервативные мероприятия, такие как: промывание полости мочевого пузыря антисептиками и дренирование мочевого пузыря показаны в качестве предоперационной подготовки у тяжелых и ослабленных больных, имеющих противопоказания к оперативному лечению [5,6].
Виды и методы оперативного лечения дивертикулов разнообразны. Оперативные вмешательства выполняют открытым, трансуретральным и лапароскопическим доступами. До настоящего времени основным радикальным методом лечения дивертикулов мочевого пузыря остается открытая операция, направленная, как правило, на удаление (резекцию) дивертикула или пластику его шейки [12]. Однако, подобные оперативные вмешательства отличаются повышенной травматичностью, сопровождаются длительной реабилитацией и социальной дезадаптацией и в ряде случаев не могут быть выполнены у некоторых пожилого возраста пациентов с отягощенным анамнезом [5,6,21].
Первоначальная техника операции включала в себя трансуретральное рассечение шейки дивертикула и осмотр его полости для исключения возможных патологических процессов в ней [21]. Позже подобную операцию стали совмещать с аблацией стенки дивертикула, с трансуретральной резекцией (ТУР) простаты по поводу ее доброкачественной гиперплазии или шейки мочевого пузыря по поводу ее склероза, а также с ТУР мочевого пузыря по поводу опухоли дивертикула [8]. Публикации на эту тему немногочисленны и основаны, в основном, на небольшом количестве наблюдений (не более 15 больных), при этом все авторы отмечают, что эндоскопическая инцизия шейки дивертикула мочевого пузыря является достаточно эффективной и малотравматичной операцией, не требует общего наркоза и длительного времени на выполнение, и, вследствии этого, может быть произведена у более широкого круга больных. А.Ю. Москалев [21] опубликовал опыт выполнения данной операции 29 пациентам, в возрасте от 44 до 90 лет (ср. возраст 65 лет). 25 (86,2%) больных имели выраженные сопутствующие заболевания и высокий риск анестезии, не позволяющие выполнить радикальную операцию. Объем дивертикулов мочевого пузыря, по данным предоперационной диагностики, составил от 20 до 700 мл. Диаметр шейки дивертикула варьировал в пределах от 0,3 до 2,0 см. У 10 больных имелись множественные дивертикулы мочевого пузыря. При урофлоуметрии максимальная скорость потока мочи (Qmax) составила от 2,1 до 5,3 мл/с . У всех пациентов операция производилась под эпидуральной анестезией одновременно с трансуретральной резекцией (ТУР) доброкачественной гиперплазии предстательной железы (18 больных), ТУР шейки мочевого пузыря или инцизией предстательной железы в связи с её склерозом (11 больных). При этом в 2 наблюдениях операция была дополнена ТУР мочевого пузыря по поводу папиллярного рака, локализовавшегося помимо стенки мочевого пузыря еще и в дивертикуле и в 6 наблюдениях выполнена одномоментная пневматическая или механическая цистолитотрипсия. Техника эндоскопического трансуретрального лечения дивертикула мочевого пузыря заключается в следующем: после уретроцистоскопии и внимательного осмотра дивертикула производится 3 (или более) разреза «горячим» ножом резектоскопа (hook-электродом) шейки дивертикула (обычно на 2, 6 и 10 часах условного циферблата), включая слизистый, подслизистый и частично мышечный слои стенки мочевого пузыря до широкого раскрытия шейки дивертикула. Производится тщательная эндоскопическая ревизия дивертикула и коагуляционный гемостаз. Затем выполняется цистолитотрипсия, операция на простате, шейке мочевого пузыря или на стенке мочевого пузыря. Подобная этапность операции обусловлена тем, что при раскрытой шейке дивертикула в значительной степени облегчается эвакуация кусочков резецированной ткани и фрагментов камня из мочевого пузыря. В послеоперационном периоде мочевой пузырь дренируется уретральным катетером в течение 2-5 суток. Авторами не отмечено развитие интраоперационных осложнений. В послеоперационном периоде адекватное самостоятельное мочеиспускание было восстановлено у всех пациентов. Трансуретральная инцизия шейки дивертикула мочевого пузыря позволила достичь желаемых результатов. При контрольном обследовании в сроки 6-48 месяцев после эндоскопического вмешательства максимальная скорость потока мочи (Qmax) по данным урофлоуметрии составила от 14,1 до 23,0 мл/сек. По данным УЗИ и цистографии у 13 пациентов дивертикул не определялся, у 16 — значительно уменьшился в размерах. У 14 больных с большими дивертикулами мочевого пузыря (200 мл и более) количество остаточной мочи в полости дивертикула не превышало 50 мл. У 1 пациента через 12 мес. после операции возник рецидив склероза предстательной железы, появилась остаточная моча – выполнена повторная ТУР простаты, дополнительного рассечения шейки дивертикула не потребовалось. Из послеоперационных осложнений у 1 пациента отмечен незначительный электроожог бедра, у 1 — острый эпидидимит, купированный консервативно и у 1 больного возникло раннее послеоперационное кровотечение, потребовавшее эндоскопической ревизии мочевого пузыря и коагуляции кровоточащего сосуда из рассеченной шейки дивертикула.
Трансуретральная инцизия шейки дивертикула мочевого пузыря является эффективной и малотравматичной операцией, которая у соматически тяжелого контингента больных может явиться альтернативой открытой операции, а у неотягощенных пациентов не усложнит выполнения открытого оперативного вмешательства (дивертикулэктомии), если дальнейшее течение заболевания будет диктовать его необходимость.
Проблема профилактики развития осложнений трансуретральных операций при раке мочевого пузыря, камнях и дивертикулах мочевого пузыря ещё далека от своего окончательного решения. Недостаточно хорошо изучены закономерности рецидива рака мочевого пузыря, не изучены методы профилактики интраоперационного кровотечения, перфорации мочевого пузыря. Остается открытым вопрос о вероятности отсева опухолевых клеток при перфорации мочевого пузыря, не изучены закономерности развития инфекционно-воспалительных осложнений после трансуретральных операций на мочевом пузыре, не отмечены закомерности течения послеоперационного периода у больных с сопутствующей доброкачественной гиперплазией простаты. Данные положения послужили основанием для проведения нашего исследования.
«Осложнения трансуретральных вмешательств на мочеточнике и почке»
4.1. Основные виды трансуретральных эндоскопических операций на мочеточнике и почке и их осложнения.
Hugh Hampton Young впервые описал возможность эндоскопического осмотра значительно расширенной нижней трети мочеточника с помощью педиатрического цистоскопа в 1912 году [117]. Однако до конца 70-х годов двадцатого века, когда Goodman [56] и Lyon et al. [78] независимо друг от друга не опубликовали свои небольшие наблюдения по эндоскопическому осмотру мочеточника, уретероскопия не использовалась в клинической практике. Авторы использовали педиатрический цистоскоп для осмотра мочеточника у взрослых пациентов. Во втором наблюдении из 5 пациентов уже было отмечено первое осложнение после проведения уретероскопии, когда 1 из больных испытывал почечную колику в течение 2 дней послеоперационного периода, которая разрешилась после отхождения небольшого сгустка крови. Его формирование было расценено как последствие избыточного давления в чашечно-лоханочной системе, обусловленное нагнетанием ирригационной жидкости во время операции. Lyon et al [78] предсказывали возможность перфорации стенки мочеточника при отсутствии необходимой настороженности у оперирующего уролога.
Быстрое развитие суправезикальной эндоурологии позволило урологам использовать уретеропиелоскопические методики в лечении уролитиаза, опухолей и стриктур верхних мочевых путей. Если использование коротких (длиной – 35 см) ригидных инструментов – «уретероскопов» позволяло производить осмотр мочеточника и часть чашечно-лоханочной системы (у небольшого количества больных), то внедрение и использование более длинных (длиной – 43см) ригидных инструментов, получивших название «уретеропиелоскопов» и фиброуретеропиелоскопов, сделали доступными для осмотра оперирующему урологу весь уротелий верхних мочевых путей и позволили значительно расширить перечень, выполняемых в настоящее время трансуретральных эндоскопических операций на мочеточнике и чашечно-лоханочной системе почки.
Основными трансуретральными эндоскопическими операциями, выполняемыми ригидными и гибкими уретеропиелоскопами, в урологических клиниках сегодня являются:
1. Трансуретральная уретеролитотрипсия, пиелокаликолитотрипсия;
2. Трансуретральная уретеропиелокаликолитоэкстракция;
3. Трансуретральная баллонная дилятация стриктур мочеточника, лоханочно-мочеточникового сегмента и шеек чашечек с использованием уретеропиелоскопа;
4. Трансуретральная эндотомия стриктур мочеточника, лоханочно-мочеточникового сегмента, стриктур шейки чашечки;
5. Трансуретральная уретероскопия, биопсия мочеточника, чашечно-лоханочной системы по поводу опухолей верхних мочевых путей;
6. Трансуретральная электрорезекция папиллярных опухолей мочеточника, чашечно-лоханочной системы;
7. Трансуретральная лазерная аблация папиллярных опухолей мочеточника, чашечно-лоханочной системы;
8. Трансуретральная уретероскопия с удаленим инородных тел мочеточника, чашечно-лоханочной системы (коррекция и/или удаление мигрировавшего или инкрустированного внутреннего стента, фрагментов струн-проводников, мочеточниковых катетеров);
9. Трансуретральная уретероскопия с ретроградной установкой внутреннего стента.
Как при выполнении цистоскопии и ТУР, так и при проведении уретероскопии встречаются ятрогенные повреждения. Перфорация простатической капсулы и формирование стриктуры уретры встречаются после проведения ТУР ДГП, также и при проведении уретероскопии были отмечены подобные осложнения. Необходимо отметить, что при эндоскопии ВМП вероятность возникновения повреждений мочеточника значительно выше, главным образом, вследствие меньших размеров мочеточника и тонкой стенки органа (по сравнению с размерами уретры). Снижение размеров эндоскопов, разработка новых методов интрауретеральной литотрипсии позволили снизить вероятность повреждения органа при выполнении данного вмешательства. Тем не менее, меры профилактики осложнений уретеропиелоскопии до сих пор детально не разработаны и требуют дополнительного изучения.
Классификация осложнений уретероскопии: наиболее часто, когда речь идет об осложнениях уретероскопии имеют ввиду ятрогенные повреждения мочеточника. Существует расширенная классификация осложнений уретероскопии (по времени возникновения и причине возникновения):
Интраоперационные осложнения:
на этапе проведения эндоскопа по нижним мочевыводящим путям —
· повреждение уретры, предстательной железы, мочевого пузыря;
· эрекция полового члена;
· сворачивание гибкого эндоскопа в уретре или в мочевом пузыре;
на этапе дилатации пузырно-мочеточникового устья и интрамурального отдела мочеточника —
· подслизистое расположение струны — проводника;
· недостаточное расширение ПМУ и интрамурального отдела мочеточника;
· миграция камня, находящегося в интрамуральном отделе мочеточника;
· травма и перфорация пузырно-мочеточникового устья;
на этапе осмотра мочеточника эндоскопом —
· перфорация мочеточника;
· плохая видимость при осмотре мочеточника;
· полный и частичный отрыв мочеточника;
· формирование ложного подслизистого хода;
· разрыв слизистой;
· повреждение стенки мочеточника вапортродом, лазером, зондом литотриптера
· поломка оборудования, экстракторов, световодов
· недостижимость патологического образования;
· ретроградная миграция конкремента;
Послеоперационные осложнения:
1. Ранние послеоперационные осложнения.
· развитие инфекционно-воспалительных осложнений (пиелонефрит, простатит, эпидидимит);
· образование свищей и мочевых затеков;
· осложнения, связанные с использованием стента — дискомфорт, миграция стента;
2. Поздние послеоперационные осложнения.
· стриктуры мочеточника;
· развитие пузырно-мочеточникового рефлюкса;
· рецидив основного заболевания.
Анестезиологические осложнения:
Уретероскопия проводится под перидуральной анестезией или под общим наркозом (дети и при противопоказаниях к перидуральной анестезии). При уретероскопии анестезиологические осложнения ничем не отличаются от таковых при других операциях и встречаются редко.
Осложнения на этапе проведения эндоскопа по нижним мочевым путям.
Повреждение нижних мочевыводящих путей: встречается редко. Подобные осложнения встречаются при проведении цистоскопа для осмотра мочевого пузыря и поиска мочеточникового устья. Травма уретры, простаты и мочевого пузыря при проведении уретеропиелоскопа встречаются еще реже. Риск повреждения повышается при наличии у больного аденомы простаты с увеличенной средней долей. При повреждении необходимо отложить проведение операции на несколько дней, нередко необходимо накладывать цистостому. Так как данные осложнения наиболее часто встречаются при цистоскопии и оперативных вмешательствах на нижних мочевыводящих путях (ТУР предстательной железы, ТУР мочевого пузыря и др.), подробная тактика при развитии данных осложнений изложена в главах, посвященных данным вмешательствам.
Эрекция полового члена: также является довольно частым явлением трансуретральных манипуляций, которое в ряде случаев можно рассматривать как интраоперационное осложнение. В подобной ситуации целесообразно выпустить жидкость из мочевого пузыря, обернуть половой член салфетками, смоченными холодным раствором. Возможно также выполнение уретероскопии через промежностную уретростомию.
Сворачивание гибкого эндоскопа в уретре или в мочевом пузыре: нередко встречается на этапе проведения фиброэндоскопа в мочеточник без рентгентелевизионного контроля. При обнаружении данного осложнения целесообразно проведение следующих мероприятий:
1) опорожнение мочевого пузыря путем введения в мочевой пузырь катетера;
2) извлечение фиброэндоскопа из уретры или мочевого пузыря (желательно под рентгенологическим контролем);
3) повторное введение фиброэндоскопа по более ригидной струне – проводнику, заведенной в устье мочеточника.
Полезным при развитии данного осложнения является использование метода гибкого кожуха — проводника.
Осложнения на этапе дилатации пузырно-мочеточникового устья и интрамурального отдела мочеточника.
Подслизистое расположение струны – проводника: является осложнением, которое происходит при проведении струны — проводника через ПМУ в мочеточник. Причиной развития данного осложнения является насильственное проведение струны — проводника в мочеточниковое устье. Данное осложнение может также происходить при проведении струны под защитой мочеточникового катетера. В таком случае дистальный конец струны-проводника, выступая за пределы катетера может повреждать мочеточник. Оперирующий уролог должен заподозрить данное осложнение, когда при проведении контрольного снимка конец струны-проводника образует плотный завиток на уровне ЛМС, а не образовывает завитки различной ширины в проекции ЧЛС. Следующим важным шагом в диагностике данного осложнения является проведение мочеточникового катетера размером 5F по струне-проводнику. Струна-проводник извлекается, затем по просвету катетера вводится рентгеноконтрастный препарат. Если препарат не заполняет ЧЛС, следовательно, более вероятно, что струна-проводник находилась в подслизистом слое. Подслизистое проведение струны-проводника может быть также диагностировано визуально. Эндоскопическая картина данного осложнения имеет следующее описание: вместо гладких стенок мочеточника, выстланных уротелием, окружающие ткани имеют неоднородное строение, когда участки жировой ткани сменяются участками фиброзной ткани. Следующим эндоскопическим ориентиром является несоотвествие между уровнем нахождения инструмента и предполагаемой локализации патологии (камень, стриктура, опухоль, инородное тело). В данном случае рекомендуется ввести контрастное вещество и уточнить положение инструмента. Также подслизистое расположение струны-проводника может быть заподозрено при установке стента, при этом дистальный завиток стента не формируется.
Наиболее безопасным способом коррекции данного осложнения является эндоскопическое обнаружение места перфорации уротелия, и затем установка струны-проводника в истинный просвет мочеточника. Если данная мера удалась, то следует установить внутренний или наружный стент на 3-4 недели. Если струну-проводник не удается установить в правильное положение, то необходимо проведение нефростомии, и если это возможно, провести катетер или стент в почку.
В литературе описаны случаи, когда подслизистое расположение струны-проводника остается нераспознанным [105]. В таком случае проводится дилатация мочеточника, а затем в ятрогенно созданное подслизистое пространство вводится инструмент. При этом в процессе процедуры, как правило, патологическое образование не обнаруживается. Операция заканчивается установкой стента. В послеоперационном периоде при проведении контрольных снимков подслизистое расположение стента, как правило, обнаруживается. Как правило, для коррекции осложнения в подобной ситуации необходима «открытая» реконструктивная операция.
Недостаточное расширение мочеточника: — наиболее часто встречающаяся проблема, возникающая на этапе дилатации ПМУ и интрамурального отдела мочеточника. Распознается это осложнение при попытке ввести уретеропиелоскоп. Нерасширенный сегмент интрамуральной части мочеточника не пропускает уретеропиелоскоп; этот сегмент двигается вместе с инструментом и при этом продвигается в сторону просвета. Повторные попытки продвинуть эндоскоп также неудачны. Для преодоления препятствия необходимо убрать инструмент и повторно провести расширение мочеточника, убедившись, что расширитель прошел проксимальнее суженного участка. Если суженный участок может быть осмотрен через уретеропиелоскоп, то хороший эффект достигается при введении через него под контролем зрения баллонного катетера.
Миграция камня, находящегося в интрамуральном отделе мочеточника: встречается во время расширения мочеточника, содержащего камень в области пузырно-мочеточникового сегмента. Контакт между расширяющим инструментом или проводником и камнем может привести к смещению камня проксимальнее. Следует избегать попыток сместить камень еще прокимальнее. Если невозможно провести проводник за камень, то необходимо расширить пузырно-мочеточниковый сегмент или, по крайней мере, дистальную часть интравезикальной порции мочеточника с использованием беспроводниковой технологии, например – металлический расширитель с коническим наконечником. Если камень находится более проксимально, то не следует проводить расширитель непосредственно к нему, чтобы избежать более проксимального смещения.
В некоторых случаях, особенно если камень находится непосредственно в области пузырно-мочеточникового сегмента, выгодно сдвинуть его проксимально в область более расширенного мочеточника. Однако следует обращать внимание на то, чтобы камень находился дистальнее подвздошных сосудов. Это положение в дистальной части мочеточника наиболее благоприятно для того, чтобы «надеть» на камень корзинку или другое приспособление для его извлечения или фрагментирования.
Травма пузырно-мочеточникового устья: наиболее часто встречается при анатомических аномалиях строения данного участка мочевых путей, при наличии камня интрамурального отдела мочеточника или нарушении техники операции, когда насильственное расширение данного участка приводит к его травме. В публикации Schuster и соавторов [105] данное осложнение было отмечено в 1,6% случаев из 322 выполненных уретеропиелоскопий. Наиболее частым видом повреждения пузырно-мочеточникового устья является проведение струны-проводника в подслизистом слое, что характеризуется повышенным сопротивлением при проведении струны-проводника и ее деформацией при рентгенологическом контроле. При подозрении на подслизистое расположение струны-проводника наиболее целесообразно ее удаление и установка струны-проводника под контролем уретеропиелоскопа. Настороженность и своевременная диагностика данного осложнения позволяют предотвратить более значительную травму мочеточника при уретероскопии. Более значительным повреждением пузырно-мочеточникового устья при уретероскопии является его перфорация с выходом струны-проводника в полость мочевого пузыря. В случае развития данного осложнения также целесообразно удалить струну и под визуальным контролем миниуретероскопа найти просвет мочеточника. Менее часто травма пузырно-мочеточникового устья отмечается при выполнении баллонной дилатации пузырно-мочеточникового устья и разрыве баллона при соприкосновении баллона с камнем, располагающимся в интрамуральном отделе. Адекватной мерой профилактики развития данного осложнения является выполнение операции под рентгенологическим контролем и избегание баллонной дилатации устья при камнях интрамурального отдела мочеточника.
Выявленное при выполнении уретероскопии повреждение пузырно-мочеточникового устья диктует необходимость послеоперационного дренирования мочеточника внутренним стентом на срок 4 недели.
Осложнения на этапе осмотра мочеточника эндоскопом
Травма ВМП: существует несколько видов повреждения мочеточника при выполнении уретероскопии – перфорация мочеточника, подслизистое проведение струны-проводиника, разрыв слизистой, полный и частичный отрыв мочеточника, также выделяют повреждения мочеточника, которые возникают в результате работы литотриптера, вапортрода и других рабочих инструментов при выполнении уретеропиелоскопии. Частота травматических осложнений и их последствий при выполнении уретеропиелоскопии по данным различных авторов приведена в таблице № 38.
Перфорация мочеточника может произойти на любом этапе проведения уретероскопии. На этапе дилатации ПМУ, помимо прямого повреждения стенки органа, возможен и непрямой механизм. Так не стоит размещать баллон-катетер в непосредственной близости с камнем. Во время дилатации баллон может порваться об острые края камня или может быть вдавлен в стенку мочеточника.
Повреждение мочеточника может также происходить на этапе проведения инструмента, проведения дополнительных инструментов, или во время извлечения конкремента из мочеточника. Существуют следующие предрасполагающие факторы для возникновения данного осложнения [39, 57]:
· форсированное проведение инструментов;
· отсутствие рентгенологического контроля;
· плохая видимость.
Таблица № 38. Частота повреждения мочеточника при выполнении уретеропиелоскопии.
|
Автор |
Операции, кол-во (100%) |
Отрыв, кол-во, (%) |
Перфо-рация, кол-во, (%) |
Разрыв слизис-той, кол-во, (%) |
Стриктура, кол-во, (%) |
|
Sofer M., [107] |
598 |
0 |
7, (1,2%) |
0 |
2 (0,3%) |
|
Chang R., [39] |
430 |
0 |
1 (0,2%) |
0 |
1 (0,2%) |
|
Sun Y., [108] |
285 |
3 (1%) |
2 (0,7%) |
0 |
1 (0,4%) |
|
Netto N., [95] |
295 |
0 |
7 (2,4%) |
4 (1,4%) |
2 (0,7%) |
|
Yinghao S., [116] |
145 |
3 (2,1%) |
2 (1,4%) |
— |
— |
|
Grasso M., [57] |
1000 |
0 |
4 (0,4%) |
— |
4 (0,4%) |
|
Jeromin L., [69] |
1575 |
4 (0,3%) |
5 (0,3%) |
20 (1,3%) |
6 (0,45) |
|
Мартов А.Г., [17] |
1000 |
0 |
4 (0,4%) |
12 (1,2%) |
1 (0,1%) |
Значительные (до визуализации парауретерального жира) повреждения мочеточника встречаются менее, чем в 6% случаев [57]
После проведения уретероскопии с перфорацией мочеточника через все слои в норме отмечается затек мочи в забрюшинное пространство. Однако, формирование значительного затека мочи встречается редко особенно в случае адекватного дренирования верхних мочевых путей. Также отмечено, что затек значительного количества мочи в забрюшинное пространство может приводить к стенозу вследствие нарастания фиброза в парауретеральной области. Свищи формируются в результате перфорации на фоне неадекватного дренирования верхних мочевых путей [14].
При обнаружении повреждения мочеточника следует закончить процедуру установкой внутреннего стента на срок 3-4 недели. Наличие страховой струны-проводника является гарантией того, что установка стента в подобной ситуации будет возможна. Если установка стента невозможна, то рекомендуется установка нефростомы. Следует отметить, что повреждения мочеточника в отдаленном периоде приводят к формированию стриктур мочеточника. Для коррекции данного осложнения может потребоваться повторное эндоурологическое вмешательство (баллонная дилатация, эндотомия) или проведение «открытого» вмешательства. Необходимость проведения подобных вмешательств возникает крайне редко. Большинство авторов отмечают, что меры профилактики перфорации мочеточника и других ятрогенных повреждений при выполнении уретероскопии детально не разработаны [32, 39].
Плохая видимость во время эндоскопического вмешательства может возникать вследствие значительного кровотечения (красная эндоскопическая картина). Хотя место кровотечения может быть эндоскопически коагулировано, однако, в большинстве случаев источников кровотечения несколько и каждое из них в отдельности незначительно. Когда обнаруживается кровотечение, обычно поле зрение может быть очищено усилением ирригации. Если кровотечение не прекращается, то рекомендуется закончить операцию, установить стент и отложить ее проведение на сроки от 2 до 20 дней [105].
Другой причиной плохой эндоскопической видимости является ситуация, когда уретероскоп излишне тесно подводится к уротелию с проникновением в подслизистый слой (белая эндоскопическая картина). При возникновении данного осложнения необходимо выдвинуть инструмент на 1-2 см назад для восстановления ориентации на просвет мочеточника. Если при наличии белой эндоскопической картины производится попытка насильственного проведения уретероскопа, то наиболее часто возникает перфорация стенки органа. Становится видимым парауретеральный жир (желтая эндоскопическая картина). В таких случаях операция должна быть закончена установкой стента [39].
Также имеются следующие причины плохой эндоскопической видимости: 1) неадекватная ирригация; 2) недостаточная мощность источника света. Размер инструмента, как правило, является, в определенных пределах, фактором, который лимитирует ирригацию. Для улучшения ирригации необходимо повысить давление ирригационной жидкости. Тем не менее, необходимо помнить, что длительное проведение операции (более 30 минут) при повышенном давлении промывной жидкости приводит к возникновению пиеловенозных рефлюксов, что было доказано в экспериментах на собаках.
Отрыв мочеточника является наиболее серьезным осложнением уретероскопии. По данным литературы данное осложнение встречается в 0,5% случаев [39, 105]. В большинстве случаев данное осложнение возникает при эндоскопической литоэкстракции корзинкой «вколоченных» камней мочеточника. При попытке извлечения таких камней стенка мочеточника, находящаяся в соприкосновении с камнем, отрывается. Первоначально, уролог отмечает сопротивление при извлечении камня. Как только, прилагается дополнительное усилие при извлечении камня, внезапно сопротивление пропадает, и камень легко извлекается. При цистоскопии выявляется выпадение оторванной стенки мочеточника через мочеточниковое устье. В подобных случаях рекомендуется предпринять экстренное оперативное вмешательство, имеющее цель восстановление целостности органа. Однако, описаны клинические случаи, когда возникшее осложнение было с успехом ликвидировано установкой стента по страховой струне – проводнику [105]. Надежных методов профилактики отрыва мочеточника при выполнении уретероскопии не разработано.
Частичный отрыв мочеточника: данное осложнение встречается редко и как полный отрыв мочеточника требует экстренного оперативного вмешательства, направленного на восстановление целостности мочеточника. Наиболее часто данное осложнение возникает при попытке экстракции большого фрагмента камня через узкий просвет мочеточника. В отличие от полного отрыва, когда дистальный участок мочеточника выворачивается из устья мочеточника при неполном отрыве оторванный фрагмент слизистой свободно флотирует в просвете мочеточника и может частично выворачиваться из устья мочеточника. Данное осложнение диагностируется при невозможности установки внутреннего стента после извлечения камня и должно быть заподозрено на основании визуального осмотра поврежденного мочеточника уретероскопом. В большинстве случаев, как и при полном отрыве мочеточнике, требуется открытое оперативное вмешательство (уретероцистоанастомоз, уретероуретероанастомоз или уретеропиелоанастомоз) [39].
Разрыв слизистой мочеточника: проведение уретероскопа по мочеточнику оказывает механическое воздействие на уротелий и при насильственном проведении инструмента отмечаются разрывы слизистой мочеточника. Основным последствием данного осложнения является развитие плохой видимости и повышение риска развития других травматических осложнений уретеропиелоскопии. Francesca и соавторы [52] описал развитие данного осложнение в 24% случаев после выполнения 248 уретеропиелоскопий инструментами размерами 9,5 или 11,5F, и только в 6% случаев после выполнения операции с помощью миниуретероскопов (размер инструментов 6-7,5F). Помимо интраоперационных проявлений разрывов слизистой, в послеоперационном периоде после удаления мочеточникового катетера повышенная отечность слизистой и сгустки крови могут создавать суправезикальную обструкцию и приводить к развитию атаки пиелонефрита. Основными мерами профилактики данного осложнения являются использование специальных гелей-любрикантов и использование миниуретероскопов для выполнения операции.
Термическое повреждение стенки мочеточника рабочими инструментами: при выполнении основного этапа операции во время уретероскопии (литотрипсия, вапоризация, аблация, эндотомия) при работе инструментов высвобождается энергия, которая, скапливаясь в избыточном количестве, может приводить к повреждению стенки мочеточника. Размер повреждений может колебаться от незначительных разрывов слизистой до больших участков некроза стенки мочеточника, что может требовать выполнения в дальнейшем реконструктивно-пластической операции. Повреждающее действие Nd:YAG лазера составляет 5-6 мм, его близкое расположение к стенке мочеточника может оказывать воздействие на данную глубину. Гольмиевый лазер и электрогидравлический литотриптер при работе также могут выделять значительное количества тепла и также оказывать повреждающее действие на стенку мочеточника. Риск развития данного осложнения гораздо выше при использовании электрогидравлического литотриптера. Basar и соавторы [35] отметили 2 случая перфорации мочеточника (1%) при выполнении 207 уретеропиелоскопий, вызванных воздействием электрогидравлического разряда на слизистую мочеточника. Глубина воздействия гольмиевого лазера составляет 0,5 – 1мм, поэтому риск значительного повреждений стенки мочеточника при работе с данным оборудованием минимизирован. В наблюдении Sofer и соавторов [107] из 598 уретероскопий с использованием фиброуретеропиелоскопа и гольмиевого литотриптера было отмечено 4 случая проблем с лазерным оборудованием, из них 1 перфорация (0,2%) и 3 случая поломки лазерного волновода внутри рабочего канала. Авторы работ отмечают, что в настоящее время детально не разработаны меры профилактики и коррекции данного вида осложнений.
Поломка оборудования: уменьшение размера уретеропиелоскопов, рабочих инструментов одновременно увеличило их хрупкость. Если интраоперационная поломка уретеропиелоскопа остается редкостью, то поломка литоэкстракторов, лазерных волноводов встречается гораздо часто. Abdel-Razzak и Bagley [32] сообщили о 2 случаях интраоперационной поломки оборудования при выполнении 290 уретеропиелоскопий. Авторы отмечают, что при отсутствии необходимого количества запасных инструментов в 1 случае операция не была завершена, в наблюдении Schuster и соавторов [105] таких случаев было 6 из 322. Истинная частота встречаемости данного осложнения неизвестна, так как большинство ведущих урологических центров имеют достаточное количество запасного оборудования, что является адекватной мерой профилактики развития данного осложнения. Также отмечается, что частота развития данного осложнения выше, чем больше в штате медицинского персонала обучающихся специалистов по эндоскопической урологии.
Недостижимость патологического образования: данное осложнение встречается тогда, когда при проведении уретероскопии по тем или иным причинам невозможно провести осмотр той части верхних мочевых путей в которой локализуется патологическое образование (камень, опухоль, инородное тело). Среди наиболее частых причин, приводящих к данному исходу следует назвать следующие [39]:
1)невозможность проведения уретероскопа по нижним мочевым путям – в таком случае необходимо провести тубус цистоскопа и по тубусу завести уретеропиелоскоп в устье соответствующего мочеточника.
2)невозможность проведения уретероскопа через ПМУ и интрамуральный отдел мочеточника – нередко предшествующие операции в данной области делают подобные попытки обреченными на неудачу. Среди наиболее типичных причин следует указать – наличие точечных устьев, инвертированных в сторону задней стенки мочевого пузыря, узкий интрамуральный отдел мочеточника, предшествующий уретероцистоанастомоз, средняя доля аденомы простаты, состояние после аденомэктомии, экстирпация матки с придатками с последующей лучевой терапией.
3)невозможность проведения уретероскопа до интересующего уровня: наиболее частыми причинами являются стриктура мочеточника и фиксированная девиация мочеточника. Нередко бывает возможным преодоление с использованием краниального смещения почки или используя мочеточниковый катетер, который проводится по рабочему каналу и выпрямляет стенку мочеточника, но подобная тактика приносит успех лишь при нефиксированных девиациях. При наличии значительного периуретерита после неоднократных оперативных вмешательств на мочеточнике вероятность преодоления подобных препятствий невелика. При обнаружении непреодолимого препятствия никогда не нужно пытаться форсировать его. В подобной ситуации необходимо прекратить вмешательство и установить мочеточниковый катетер или стент для пассивной дилатации ВМП.
Ретроградная миграция конкремента: при проведении уретероскопии при наличии камней мочеточника наиболее частым осложнением является ретроградная миграция камня. Данное осложнение подчас обуславливает неэффективность процедуры, особенно при выполнении ригидной уретероскопии, так как при данном виде исследования часть лоханки и нижняя чашка не могут быть исследованы. Частота ретроградной миграции камня зависит от локализации конкремента, она низка при локализации камня в дистальном отделе и крайне высока при нахождении конкремента в проксимальной трети мочеточника. Также частота миграции обратно пропорционально зависит от размеров камня, т.е. чем крупнее камень, тем ниже риск миграции конкремента. К методам профилактики ретроградной миграции камня при выполнении уретероскопии относится использование специальных нитиноловых «ловушек» различной конструкции.
При миграции конкремента в ЧЛС, особенно в нижнюю чашку операция заканчивается установкой стента и в последующем выполняется сеанс дистанционной литотрипсии на стенте. Альтернативой данной тактике является удаление уретероскопа и проведение фиброуретероскопии и лазерной уретеропиелокаликолитотрипсии.
Ранние послеоперационные осложнения
Инфекционно – воспалительные осложнения встречаются довольно часто в послеоперационном периоде, составляя от 4% до 44%[14, 17, 35, 105]. Вопросы профилактики инфекционно-воспалительных осложнений уретеропиелоскопии изучены недостаточно. Ряд авторов считает развитие гипертермии до 38С на первые сутки послеоперационного периода физиологической реакцией организма на ирригацию жидкости во время операции. Тем не менее, различная частота развития инфекционно-воспалительных осложнений, вопросы профилактики развития данной группы осложнений остаются в настоящее время практически не изученными.
Осложнения, связанные с использованием стента: включают в себя развитие растройств мочеиспускания, развитие пузырно – мочеточникового рефлюкса, миграцию стента, кальцификацию и окклюзию стента [14]. Расстройства мочеиспускания, по-видимому, являются универсальными и не зависят от вида стента.
Миграция стента: миграция стента в проксимальном или дистальном направлении может приводить к различным осложнениям. Стенты при обеих свернутых кольцах (double J) обычно не изменяют своего расположения в отличие от стентов с одним свернутым кольцом. Материал, из которого состоит стент также влияет на его способность к миграции. Наименее подвержены миграции стенты состоящие из полиуретана, а стенты, состоящие из силикона отмечаются сравнительно частой миграцией. Некоторые компании (Cook UrologicalÒ) выпускают специальные стенты, которые могут образовывать множественные завитки, делая тем самым, миграцию практически невозможной. Однако, наибольший риск миграции стента возникает при его интраоперационной установке при отсутствии рентгенологического контроля. Наиболее адекватной профилактикой миграции стента является использование стентов, изготовленных из полиуретана и установка стента под рентгенологическим контролем [14].
Пузырно-мочеточниковый рефлюкс: нередко при наличии внутреннего стента у больных отмечается клиническая картина пузырно-мочеточникового рефлюкса. Больные отмечают боли в поясничной области при мочеиспускании. При ультразвуковом исследовании отмечается пиелокаликоэктазия, увеличивающаяся после мочеиспускания. Явления пузырно-мочеточникового рефлюкса обычно купируются установкой уретрального катетера на 12 – 24 часов.
Катетер-ассоциированная инфекция: сразу же необходимо отметить, что инфекция мочевых путей не всегда является последствием установки стента или катетеризации. Также необходимо отличать колонизацию стента бактериями, что встречается довольно часто (при этом отсутствует обструкция верхних мочевых путей), от обострения хронического пиелонефрита, обусловленного обструкцией внутреннего стента. В первом случае нет необходимости изменения тактики лечения, а во втором случае необходимо удаление внутреннего стента с последующим дренированием почки вплоть до нефростомии.
Поздние послеоперационные осложнения
Стриктура мочеточника является серьезным осложнением. Частота возникновения данного осложнения варьирует от 0,5 до 3% [39, 105]. Стриктура мочеточника наиболее часто возникает при дилатации пузырно-мочеточникового устья и интрамурального отдела мочеточника. Для коррекции данного осложнения в последующем может потребоваться проведение баллонной дилатации или эндотомии, а также реимплантации мочеточника в мочевой пузырь в отдельных случаях. Следует соблюдать известные правила проведения расширения — проводить расширение до размера на 2-3F больше, чем размер проводимого инструмента. Не следует излишне травмировать мочеточник, но расширение следует проводить до тех пор, пока не будет возможным легко провести инструмент в мочеточник. При этом следует использовать минимально возможный размер инструментов. Следует также ограничивать длительность процедуры, особенно при наличии технических трудностей.
Считалось, что потенциальным осложнением трансуретральной уретеропиелоскопии может быть пузырно-мочеточниковый рефлюкс [14]. Любое воспаление или рубцевание пузырно-мочеточникового сегмента может вызвать рефлюкс, как отмечается при инфекциях мочевых путей. Исходя из имеющихся данных, расширение мочеточника у человека до 15F не нарушает его целостность или функцию. Следует отметить, что в данном вопросе остается слишком много неясного и необходимо проведение дополнительных исследований.
Рецидив заболевания: к данной группе отдаленных осложнений трансуретральных вмешательств относятся рецидив стриктуры после трансуретральной эндотомии, рецидив опухоли после трансуретральной резекции (аблации) опухоли мочеточника [105]. Эфективной профилактики данного вида осложнений, по-видимому, не существует. С накоплением опыта проведения трансуретральных операций каждый уролог определяет критерии эффективности и критерии отбора больных на данные оперативные вмешательства. Таким образом, правильное определение показаний и противопоказаний к выполнению операции позволяет снизить число рецидивов заболевания.
С другой стороны, в любом случае перед проведением операции пациент должен быть предупрежден и дать письменное согласие, о том что информирован о возможности возможности рецидива заболевания и знать о необходимости выполнения контрольных обследований в отдаленном послеоперационном периоде.
Осложнения могут быть сведены к минумуму при правильном подборе противопоказаний и показаний как со стороны пациента и характеристик патологии (локализация камня, протяженность стриктуры и др.), так и со стороны оперирующего хирурга. Уролог должен знать причины осложнений, уметь проводить их своевременную диагностику и коррекцию. Немаловажно отметить, что больной должен быть информирован обо всех возможных осложнениях перед проведением операции. Несмотря на значительный список возможных осложнений, уретеропиелоскопия на современном этапе развития эндоурологии имеет свои неоспоримые преимущества как диагностическая процедура, так и в лечении уролитиаза, стриктур и опухолей мочеточника. Тем не менее, не изучены меры профилактики развития осложнений при выполнении уретеропиелоскопии, не изучены факторы риска развития осложнений при уретеропиелоскопии, что обуславливает актуальность предпринятого нами исследования в данной области.
Список литературы
1. Гнатюк А.П. Ранняя повторная цистоскопия и биопсия мочевого пузыря в диагностике поверхностного рака мочевого пузыря. Дис. к-та мед. наук. – М., 2003.
2. Гнилорыбов В.Г., Сергиенко Н.Ф. Оперативное лечение протяженных посттравматических стриктур и облитераций задней уретры // Урол. и нефрол., 1991 №6. С. 49-55.
3. Гончар М. А., Ухаль М. И. Осложнения трансуретральных операций // Урология. — Киев, 1982, вып 16. — С. 73-75.
4. Горелов С.И., Старцев В.Ю., Коган О.Ф. Флюоресцентная цистоскопия в диагностике и лечении поверхностного рака мочевого пузыря. Материалы 4-й Всероссийской научной конференции с участием стран СНГ. Рак мочевого пузыря. Москва, 2002.: cт. 40-48.
5. Гориловский Л.М. Оперативное лечение урологических заболеваний в пожилом и старческом возрасте: Дис. д-ра мед. наук. – М., 1984.
6. Гориловский Л.М. Очерки гериартрической урологии.– М., 1993.
7. Гринев А.В. Эндоскопическое хирургическое лечение стриктур мочеиспускательного канала. Автореф. дис. канд. – М., 1987.
8. Камалов А.А. Современные методы эндоскопической диагностики и лечения доброкачественной гиперплазии предстательной железы, протяженных стриктур и облитераций уретры, рака мочевого пузыря. Автореф. дис. докторск. – М., 1998.
9. Лопаткин Н.А., Камалов А.А., Токарев Ф.В., Ефремов Е.А. Возможности флюоресцентной диагностики рака мочевого пузыря. Научно-исследовательский Институт Урологии МЗ РФ (Москва) Материалы 4-й Всероссийской научной конференции с участием стран СНГ, Москва. Рак мочевого пузыря 2002: стр.17-18.
10. Лопаткин Н.А., Мартов А.Г., Гущин Б.Л., Кудрявцев Ю.В., Сысоев П.А. Электровапоризация в лечении рака мочевого пузыря. Урология и нефрология. 1998, 5:cтр.9-12.
11. Лопаткин Н.А., Мартов А.Г., Даренков С.П. и др. Оперативное лечение опухолей мочевого пузыря. Урол. и нефролгия. 1999,1: стр. 26-31.
12. Лопаткин Н.А., Шевцов И.П. Оперативная урология. – М., 1986. – С. 312-324.
13. Мартов А.Г., Ергаков Д.В., Салюков Р.В. и др. Отдаленные результаты эндоскопического лечения стриктур уретры. – 2007. – Урология. — № 5. – с.27-33.
14. Мартов А.Г., Зенков С.С., Чепуров А.К. и др. Опасности и осложнения внутреннего дренирования мочевых путей Урология и нефрология 1995 (1):29-31.
15. Мартов А.Г., Лопаткин Н.А. Руководство по трансуретральной резекции предстательной железы. М., 1997г.
16. Мартов А.Г., Меринов Д.С., Корниенко С.И. Послеоперационные урологические осложнения трансуретральных электрохирургических вмешательств на предстательной железе по поводу аденомы. – 2006г. – Урология. — № 2. – с. 25-32.
17. Мартов А.Г., Меринов Д.С., Борисенко Е.А. и др. Контактная уретеролитотрипсия и уретеролитоэкстракция: опыт 1000 операций. 2006. В книге: Пленум правления РОУ. Достижения в лечении заболеваний верхних мочевых путей и стриктуры уретры.- Екатеринбург.- 14-16.06.2006.- с.219-220.
18. Мартов А.Г., Корниенко С.И., Гущин Б.Л. Интраоперационные урологические осложнения при трансуретральных оперативных вмешательствах по поводу доброкачественной гиперплазии предстательной железы. 2005г. – Урология. — № 4. – с.3-9.
19. Матвеев Б.П., Фигурин К.М., Карякин О.Б. Рак мочевого пузыря. Москва, 2001: стр. 6-231.
20. Меринов Д.С. Трансуретральная роторезекция в лечении доброкачественной гиперплазии предстательной железы. Дис…. к-та мед. наук. – М., 2002.
21. Москалев А.Ю. Трансуретральные эндоскопические методы лечения дивертикулов мочевого пузыря. Дис…. к-та мед. наук. – М., 2004.
22. Мустафаев Э.М., Мартов А.Г., Наумов А.Г. и другие. Профилактика и лечение воспалительных осложнений после трансуретральной резекции аденомы предстательной железы. – 2006. – Лечащий врач — № 7. – с.10-16.
23. Разумов С.В. Применение трансуретральной эндоскопической электровапоризации в лечении больных доброкачественной гиперплазией предстательной железы. Дис…. к-та мед. наук. – М., 2000.
24. Русаков В.И.: Хирургия мочеиспускательного канала. – М., «Медицина» 1991; С. 132-218.
25. Саидов И.Р. Эндоскопическое лечение облитерации уретры у мужчин. Автореф. дис. канд. – М., 2000.
26. Симонов В.Я. Трансуретральная электрорезекция при заболеваниях предстательной железы, мочевого пузыря и уретры: Автореф. дис. докт. мед. наук:, М., 1982. – 32 С.
27. Стриктура и облитерация мочеиспускательного канала // Руководство по урологии / Под ред. Н.А. Лопаткина. – М., 1998; Т.3. С. 72-88.
28. Тоскано М.Б., Пубильонес И.К., Фернандес М.Ф. и др. Осложнения трансуретральной резекции предстательной железы. Урол. и нефрол. – 1990. – №2.– С. – 32-34.
29. Трапезникова М.Ф., Базаев В.В., Уренков С.Б., Морозов А.П. Лечение облитераций задней уретры у мужчин // Урол. и нефрол., 1997 №6; С. 34-38.
30. Чепуров А.К., Зубарев А.В, Кривобородов Г.Г. и др. Использование биорастворимых стентов в лечении сложных стриктур мочеиспускательного канала. Урология 2002 (5):49-54.
31. Чепуров А.К., Неменова А.А. Осложнения трансуретральной резекции мочевого пузыря по поводу опухоли. Урология и нефрология. 1996, 2: стр. 21-23.
32. Abdel-Razzak OM, Bagley DH. Clinical experience with flexible ureteropyeloscopy. J Urol 1992;148: 1788–92.
33.Abel P., Henderson D., Benett M. et al. Differing interpretations by pathologists of the pT category and grade of transitional cell cancer of the bladder. Br J Urol. 1988, 62:339-342.
34. Albers P., Fichtner J., Bruhl P. et al. Long-term results of internal urethrotomy. J Urol. – V.156, №5. – p. 1611-4.
35. Basar H, Ohta N, Kageyama S, Suzuki K, Kawabe K. Treatment of ureteral and renal stones by electrohydraulic lithotripsy. Int Urol Nephrol 1997; 29:275–80.
36. Barry J.M. Visual urethrotomy in the management of the obliterated membranous urethra // Urol. Clin. North Am. 1989; 16: 319-324.
37. Blandy J. P. Transurethral Resection., London., “Pitman Medical”.,1971.
38. Braf Z, Chen J, Sofer M et al. Intraprostatic metal stents (Prostakath and Urospiral): more than 6 years’ clinical experience with 110 patients. J Endourol 1996 Dec;10(6):555-8.
39. Chang R, Marshall FF. Management of ureteroscopic injuries. J Urol 1987;137:1132–5.
40. Chiou R.K., Gonzalez R., Ortlip S., Fraley E.E. Endoscopic treatment of posterior urethral obliteration: long-term followup and comparison with transpubic urethroplasty // J. Urol. 1988; 140: 508-511.
41. Chiou R.K., Grune M., Rosinsky D. et al. Recanalization of obliterated urethra.// J. Endourology.- 1995.-Vol. 9 (12). P- 509.
42. Choiu R.K. Endourethroplasty in the management of complicated posterior urethral strictures // J. Urol. 1988; 140: 607.
43. Cohen J. K., Berg G., Carl G.H., Diamond D.D. Primary endoscopic realignment following posterior urethral disruption // J. Urol. 1991; 146: p. 1548-50.
44. Collado A. Complications of transurethral operations on the bladder. Int.Urol.Nephr. 2000. — № 4. – p. 1205-1213.
45. Djavan B, Madersbacher S, Klingler C, Marberger M. Urodynamic assessment of patients with acute urinary retention: is treatment failure after prostatectomy predictable? J Urol 1997; 158: 1829 – 33.
46. DeSautel MG, Burney TL, Diaz PA et al. Outcome of VaporTrode transurethral vaporization of the prostate using pressure-flow urodynamic criteria. Urology 1998; 51: 1013-7.
47. De Vries C.R., Anderson R.U. Endoscopic urethroplasty: an improved technique // J. Urol. 1990; 143: 1225.
48. Dich A. Complications of TUR of the bladder. Urologe A. 1980 № 3. – s. 3-10.
49. El-Abd S. Endoscopic treatment of impassable urethral obliteration, or inflammatory (abstr) // J. Urol. 1993; 149: 229A.
50. Faul P, Farin G, Reich 0, Steude U. The ‘Band electrode’: first experiences with a novel TURP procedure to improve hemostasis. Eur Urol 1996; 30: 403 – 8.
51. Floratos D.L., de la Rosette J.J.M.C.H. Lasers in urology. BJU Int.1999, 84, p.204-211.
52. Francesca F, Scattoni V, Nava L, Pompa P, Grasso M, Rigatti P. Failures and complications of transurethral ureteroscopy in 297 cases: conventional rigid instruments vs. small caliber semirigid ureteroscopes. Eur Urol 1995;28:112–5.
53. Gallucci M, Puppo P, Perachino M et al. Transurcthral electrovaporization of the prostate vs. transurethral resection: Results of a multicentric, randomized clinical study on 150 patients. Eur Urol 1998; 33: 359 – 64.
54. Glass R. E., Flynn J.T., King J.B., Blandy J.P. Urethral injury and fractured pelvis // Br. J. Urol. 1978; 50: 578.
55. Gonzalez R., Chiou R.K., Hekmat K. Fraley E.E. Endoscopic re-establishment of urethral continuity after traumatic disruption of the membranous urethra // J. Urol. 1983; 130: 785-87.
56. Goodman TM. Ureteroscopy with pediatric cystoscope in adults. Urology 1977;9: 394.
57. Grasso M. Complications of ureteropyloscopy. In: Taneja SS, Smith RB, Ehrlich RM, editors. Complications of urologic surgery. 3rd edition. Philadelphia: WB Saunders; 2001. p. 268–76.
58. Guille F., Cipolla B., Staerman F et al. Complete traumatic rupture of the posterior urethra: endoscopic realignment or end to end anastomosis // 23rd SIU World Congress 1994: 289 (abstr).
59. Gupta N.P., Gill I.S. Core-through optical internal urethrotomy in management of impassable traumatic posterior urethral strictures // J. Urol. 1986; 136: 1018.
60. Hammadeh M, Madaan S, Singh M et al. Transurethral electro-vaporization of the prostate, a possible alternative to standard TURP. Three years follow-up of a prospectively randomised trial. J Urol 1999; 161 (suppl): 391.
61. Harrison N W, de Souza J V. Prostatic stenting for outflow obstruction. Br J Urol 1990; 65: 192-196.
62. Heney, N. Natural history of superficial bladder cancer. Prognostic features and long-term disease course. Urol. Clin. North. Am. 1992, 19: p.373-429.
63. Herr H. The value of second transurethral resection in evaluating patients with bladder tumors. Urology 1999., 162: 74-76.
64. Holmang, S.: Follow-up of patients with noninvasive and superficially invasive bladder cancer. Semin Urol Oncol 2000., 18:273-281.
65. Holmang S. and Johansson S. et al. Stage Ta-T1 bladder cancer: The relationship between findings at first followup cystosscopy and subsequent recurrence and progression. J. Urol. 2002., 180:499-545.
66. Horninger W, Unterlechner H, Strasser H. Transurethral prostatectomy: mortality аnd morbidity. Prostate 1996; 28: 195 – 200.
67. Jensen KME, Jorgensen JB, Mogensen P. Long-term predictive role of urodynamics: an 8-year follow-up of prostatic surgery for lower urinary tract symptoms. Br J Urol 1996; 78: 213 – 8.
68. Jepson B.R., Boullier J.A., Moore R.G., Parra R.O. Traumatic posterior urethral injury and early primary endoscopic realignment: evaluation of long-term follow-up // J. Urol. 1999; 53(6): 1205-10.
69. Jeromin L, Sosnowski M. Ureteroscopy in the treatment of ureteral stones: over 10 years’ experience. Eur Urol 1998;34:344–9.
70. Jewett H. Strong, Infiltrating carcinoma of the bladder: relation of the depth of penetration of the bladder wall to incidence of local extension and metastasis. J. Urol. 1986, 123:1176-1214.
71. Kardos R, Magasi P, Karsza A. Nd-Yag laser treatment of bladder tumours. Int Urol Nephrol. 1994;26(3):317-22.
72. Koraitim M. Pelvic fracture urethral injuries: the unresolved controversy // J. Urol. 1999; 161(5): 1433-41.
73. Kriegmair M, Baumgartner R., Knuchel R.et al. Detection of early bladder cancer by 5-aminolevulinic acid induced porphyrin fluorescence. Urology 1996., 155:105-110.
74. Kurth К. Natural history and prognosis of untreated and treated superficial bladder cancer. In: Pagano I., Fair W., Bassi P., editors. Superficial Bladder Cancer. Oxford: ims Medical Media Ltd., 1997.:42-56.
75. Leonard M.P., Emtage J., Perez R., Morales A. Endoscopic management of urethral stricture: ‘cut to the light’ procedure // J. Urol. 1990; 35: 117.
76. Lesley K.C., George D.W. Endoscopic management of the obliterated anastomosis following radical prostatectomy // J. Urol. 1996; 156: 70-72.
77. Lieberman S.F., Barry J.M. Retreat from transpubic urethroplasty for obliterated membranous urethral stricture // J. Urol. 1982; 128; 379-380.
78. Lyon ES, Kyker JS, Schoenberg HW. Transurethral ureteroscopy in women: a ready addition to the urological armamentarium. J Urol 1978;119: 35–6.
79. Madersbacher S, Marberger M. Is transurethral resection of the prostate still justified? BJU Int. 1999; 83: 227 – 37.
80. Markus A. et al. Second transurethral resection of superficial transitional cell carcinoma of the bladder-a must even for experienced urologist. J.Urol. 2001., 165:p.298-316.
81. Marshall F.F., Chang R., Gearhart J.P. Endoscopic reconstruction of traumatic membranous urethral transaction // J. Urol. 1987; 138: 306-309.
82. Marshall F.F. Endoscopic reconstruction of traumatic urethral transaction // Urol. Clin. North Am. 1989; 16: 313-318.
83. Martov A.G., Kamalov A.A., Gushchin B.L. Obliteration of the urethra: Endoscopic “cut to bougie” technigue // PP2-275, s.129. J Endourol. 1995; Vol 9, Suppl., (13 World Congress on Endourology and SWL, Jerusalem, Israel).
84. McAninch J.M. [ed.] Traumatic and Reconstructive Urology, W.B. Saunders Company. — Philadelphia, London, Toronto, Montreal, Sydney, Tokyo, — 1996, p. 742.
85. McAninch J.W., Laing F.C., Brooke Jeffrey R. Sonourethrography in evaluation of urethral strictures: a preliminary report // J. Urol. 1988; vol. 139, p. 294-297.
86. McAninch J.W. Urethral injuries // World J. Urol. 1990; vol. 7, p. 184-188.
87. McCoy G.B., Barry J.M., Lieberman S.F., Pearse H.D., Wicklund R. Treatment of obliterated membranous and bulbous urethra by direct vision internal urethrotomy // J. Trauma 1987; vol. 27, p. 883.
88. McKiernan J.M., Kaplan S.A., Santarosa R.P., Te A.E., Sawczuk I.S. Transuretral electrovaporization of bladder cancer. Urology. 1996; (48): 207-210.
89. McRoberts J.W., Ragde H. The severed canine posterior urethra: a study of two distinct methods of repair // J. Urol. 1970; 104: 724-729.
90. McVary K.T., Grayhack J.T. Transrectal ultrasound in the repair of the posttraumatic urethra // J. Urol. 1991; 145: 367.
91. Mebust WK, Holtgrewe HL, Cockett ATK, Peters PC. and writing committee. Transurethral prostatectomy: immediate and postoperative complications. A cooperative study of 13 participating institutions evaluating 3,885 patients. J Urol 1989; 141: 243 – 7.
92. Michel MS, Kohrmann KU, Weber A, Kraulschick AW, Steidler A, Alken P. Standardized comparison of laser-vaporization, electro-vaporization and modified electro-loop-resection. J Urol 1997; 157 (Suppl.): 436.
93. Milroy E. Stents in therapy of urethral strictures Urologe A 1998 Jan;37(1):51-5.
94. Naude J. Early endoscopic skin graft urethroplasty in the management of complete rupture of the urethra // SIU Sydney 1994; (abstr 717).
95. Netto NR Jr, Ikonomidis J, Zillo C. Routine ureteral stenting after ureteroscopy for ureteral lithiasis: is it really necessary? J Urol 2001;166:1252–4.
96. Nielsen K K, Kromann-Andersen B, Poulsen A L et al. Subjective and objective evaluation of patients with prostatism and infravesical obstruction treated with both intraprostatic spiral and transurethral prostatectomy. Neurourol Urodyn 1994; 13: 13-19.
97. Niesel T., Moore R.G., Alfert H.J., Kavoussi L.R. Alternative endoscopic management in the treatment of urethral strictures // J. Endourol. 1995; 9: 31-39.
98. Nordling J, Ovesen H, Poulsen A L. The intraprostatic spiral: clinical results in 150 consecutive patients. J Urol 1992; 147: 645-647.
99. Pansadoro V, Emiliozzi P. Iatrogenic prostatic urethral strictures: classification and endoscopic treatment. Urology – 1999. – V. 53 – p. 784–789.
100. Rehman J., Samadi D., Ricciardi R.Jr., Kreutzer E. Early endoscopic realignment as primary therapy for complete posterior urethral disruptions // J. Endourol. 1998; 12(3): 283-9.
101. Sachse H. Die sichturethrotomie mit scharbem schnitt. Operative technik – indikation, komplikationen, ergebnisse // KongreBbericht Internationales Symposium. Wien. 1979; s. 11-14.
102. Sassine A M, Schulman C C. Intraurethral catheter in high-risk patients with urinary retention: 3 years experience. Eur Urol 1994; 25: 131-134.
103. Schatzl G, Madersbacher S, Lang T, Marberger M. The early postoperative morbidity of transurethral resection of the prostate and of 4 minimally invasive treatment alternatives. J Urol 1997; 158: 105 – 11.
104. Shokeir AA, Al-Sisi M, Farage MA et al. Transurethral prostatectomy: a prospective randomized study of conventional resection and electrovaporization in benign prostatic hyperplasia. Br J Urol 1997; 80: 570 – 6.
105. Schuster TG, Hollenbeck BK, Faerber GJ, Wolf JS Jr. Complications of ureteroscopy: analysis of predictive factors. J Urol 2001;166:538–40.
106. Smith G., Eiton R., Beynon L., et. al. Prognostic significance of biopsy results of normal-looking mucosa in cases of superficial bladder cancer. Br. J. Urol. 1983., 55: 665-69.
107. Sofer M, Watterson JD, Wollin TA, Nott L, Razvi H, Denstedt JD. Holmium:YAG laser lithotripsy for upper urinary tract calculi in 598 patients. J Urol 2002;167:31–4.
108. Sun Y, Wang L, Liao G, et al. Pneumatic lithotripsy versus laser lithotripsy in the endoscopic treatment of ureteral calculi. J Endourol 2001;15: 587–90.
109. Tauzin F. P., Sanz L. TUR-syndrome. // Ann. Fr. Anesth. Reanim. — 1992. — Vol.11, №2. — Р. 168-177.
110. Thomas P J, Britton J P, Harrison N W. The prostakath stent: four years experience. Br J Urol 1993; 71: 430-432.
111. Towler J.M., Eisen S.M. A new technique for the management of urethral injuries // Br. J. Urol. 1987; 60: 162.
112. Turner-Warwick R. Prevention of complications resulting from pelvic fracture urethral injuries—and from their surgical management. Urol.Clinic of North America. – 1989. – V.16, №2. – р. 335-58.
113. White J.L., Hirsch I.H., Bagley D.H. Endoscopic urethroplasty of posterior urethral avulsion // J. Urol. 1994; 44: 100.
114. Witjes J.еt al. The influence of review pathology on study outcome of a randomized multicentre superficial bladder cancer trial. Members of the Dutch South East Cooperative Urological Group. Br.J.Urol. 1994, 2:165-172.
115. Yasuda K., Yamanishi T., Isaka S., Okano T., Masai M., Shimazaki J. Endoscopic re-establishment of membranous urethral disruptions // J. Urol. 1991; 145: 977.
116. Yinghao S, Linhui W, Songxi Q, et al. Treatment of urinary calculi with ureteroscopy and Swiss lithoclast pneumatic lithotripter: report of 150 cases. J Endourol 2000;14:281–3.
117. Young HH, McKay RW. Congenital valvular obstruction of the prostatic urethra. Surg Gynecol Obstet 1929;48:509.
118. Zinman L.N. Rekonstruktion der hinteren Urethra // Urologe A. 1998; 37(1): 31-7.
Повреждения уретры обычно случаются у мужчин. Большинство повреждений уретры являются следствием тупой травмы. Проникающие повреждения уретры встречаются реже, в основном в результате огнестрельных ранений, или, как вариант, в результате введения предметов в уретру во время сексуальной активности, переломов пениса или вследствие психических заболеваний.
Осложнения проявляются инфекцией, недержанием мочи Недержание мочи Недержание мочи – это непроизвольное выделение мочи; по мнению некоторых экспертов, оно дебютирует только тогда, когда пациент отмечает наличие проблемы. Однако о наличии заболевания часто не… Прочитайте дополнительные сведения , эректильной дисфункцией Эректильная дисфункция Эректильная дисфункция – это неспособность достижения или поддержания эрекции, необходимой для полового акта. Большинство случаев эректильной дисфункции связано с сосудистыми, неврологическими… Прочитайте дополнительные сведения , и стриктурой Стриктура уретры Стриктура уретры – рубцовый процесс, приводящий к обструкции просвета передней уретры. Стриктура уретры бывает: Врожденная Приобретенныая Любой фактор, повреждающий эпителий уретры, или губчатое… Прочитайте дополнительные сведения или стенозом. («Стеноз» — это сужение задней уретры, тогда как «стриктура» относится исключительно к передней уретре).
Симптомы и признаки травмы уретры
К симптомам травмы мочеточника относятся болезненное мочеиспускание или неспособность помочиться. Наиболее важный признак повреждения – появление крови из устья уретры. К дополнительные признакам относятся кровоподтеки или отек промежности, мошонки, полового члена, половых губ. Аномальное расположение предстательной железы при ректальном исследовании (так называемая высокая посадка простаты) является ненадежным признаком травмы уретры. Кровь при ректальном или вагинальном исследованиях требует тщательного обследования.
-
Ретроградная уретрография
-
Обычно выполняется уретральная катетеризация (при ушибах) или надлобковая цистостомия (при разрывах)
-
Иногда эндоскопическая реконструкция или хирургическое восстановление (для отдельных травм)
-
Отложенная радикальная операция
Самым простым и безопасным вариантом для большинства пациентов с полным нарушением проходимости уретры является дренирование мочевого пузыря через надлобковую цистостому. Реконструктивную операцию откладывают на 8–12 недель до формирования рубца и излечения больного от любых сопутствующих травм.
Немедленное открытое восстановление повреждений уретры ограничивается случаями, связанными с переломами полового члена, проникающими травмами и всеми травмами у женщин.
-
Большинство повреждений задней уретры связаны с переломами таза. Передние повреждения уретры обычно происходят при тупой травме; травмы уретры с переломами полового члена или проникающие травмы встречаются реже.
-
Не забывать о травмах уретры, особенно у пациентов, имеющих переломы таза или травмы промежности, у которых обнаруживается кровь в отверстии мочеиспускательного канала или имеются трудности при мочеиспускании.
-
У мужчин до катетеризации уретры выполняется ретроградная уретрография.
-
У женщин проводят цистоскопию и тщательный вагинальный осмотр.
-
Ушибы лечатся катетеризацией уретры, а большинство разрывов уретры сначала требуют надлобковой цистостомии; в отдельных случаях рассматривают первичную пластику.
-
Хирургическая реконструкция должна быть отложена, за исключением некоторых травм (т.е., переломы полового члена, проникающие травмы и повреждения уретры у женщин).
ПРИМЕЧАНИЕ:
Это — Профессиональная версия.
ПОЛЬЗОВАТЕЛИ:
Просмотреть пользовательскую версию

Авторское право © 2023 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.



