Ответка
Задайте свой вопрос и получите ответ от профессионального преподавателя. Выберите лучший ответ.
Задать вопрос
-
Подготовка к ЕГЭ
- Подготовка к ОГЭ
- Подготовка к олимпиаде
Задать вопрос
-
Все вопросы
![]()
Мария
Биология
10 — 11 классы
05.10.2020 17:54
Найдите ошибки или неточности в тексте. Исправьте их. Сформулируйте и запишите верное утверждение.
Линейная последовательность аминокислотных остатков, соединённых пептидными связями, представляет первичную структуры белка. Каждый белок имеет свою уникальную первичную структуры, которая является его биологически активной формой и определяет форму, свойства и функции белковой молекулы.
Ответы на вопрос
Записаться
Бесплатные вебинары с ответами на все вопросы у нас на канале!
Смотреть
Репетиторы в городах:
- Репетитор в Жукове
- Репетитор в Моздоке
- Репетитор в Сринагаре
- Репетитор в Асино
- Репетитор в Каире
- Репетитор в Николаевске
- Репетитор в Тернополе
- Репетитор в Билибино
- Репетитор в Киренске
- Репетитор в Орле
- Репетитор в Усть-Каменогорске
Репетиторы по предметам:
- Репетитор по русскому языку
- Репетитор по английскому языку
- Репетитор по немецкому языку
- Репетитор по математике
- Репетитор по биологии
- Репетитор по физике
- Репетитор по химии
- Репетитор по французскому языку
- Репетитор по итальянскому языку
- Репетитор по китайскому языку

реализации генетической информации. Между белком и молекулой нуклеиновой кислоты образуются ионные связи.
6. Фосфопротеины. Белки, которые содержат в своем составе фосфорную кислоту. Используются для регуляции процессов жизнедеятельности (фосфорилирование / дефосфорилирование). Между белком и остатком фосфорной кислоты формируются сложноэфирные связи, в образовании которых участвует OH-группа серина.
Тема 2. МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БЕЛКОВ И ПЕПТИДОВ
Аминокислоты, соединяясь пептидной связью, образуют полипептидные цепи. Линейная последовательность аминокислотных остатков, соединенных между собой пептидными связями, определяет первичную структуру белковой молекулы.
ЭТАПЫ ИССЛЕДОВАНИЯ ПЕРВИЧНОЙ СТРУКТУРЫ БЕЛКОВ И ПЕПТИДОВ
1.Выделение белка из смеси в чистом виде (по одному из признаков: размер молекулы, заряд, специфическое сродство связывания). Определение молекулярной массы белка.
2.Определение N-концевой АК.
3.Определение С-концевой АК.
4.Определение АК-последовательности белковой цепи.
Выделение белка из биологического материала основано на его физико-химических свойствах. Чаще всего для этих целей используют кислотно-основные свойства белков (амфотерность, заряд молекулы, изоэлектрическое состояние).
От заряда белковых молекул зависит их: растворимость (минимальна в ИЭТ); электрофоретическая подвижность; структура и биологическая активность.
При растворении в водной среде на поверхности белковой молекулы формируется гидратная оболочка.
Устойчивость белка в растворе зависит:
1)от заряда белковой молекулы;
2)наличия гидратной оболочки;
3)от молекулярной массы белка.
Для выделения нативных белков (без изменения пространственной структуры) используют метод высаливания:
осаждение солями щелочноземельных металлов: хлорид натрия, сульфат аммония;
 осаждение другими водоотнимающими веществами: спиртом или ацетоном при низких температурах (около –20 С).
осаждение другими водоотнимающими веществами: спиртом или ацетоном при низких температурах (около –20 С).
При использовании этих методов белки лишаются гидратной оболочки и выпадают в осадок.
Денатурация — нарушение пространственной структуры белков (первичная структура молекулы сохраняется). Может быть обратимая (структура белка восстанавливается после устранения денатурирующего агента) или необратимая (пространственная структура молекулы не восстанавливается, например, при осаждении белков минеральными концентрированными кислотами, солями тяжелых металлов).
11
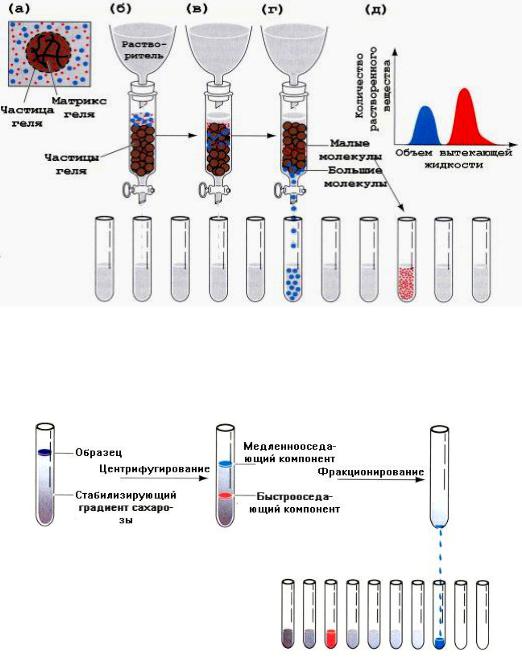
МЕТОДЫ РАЗДЕЛЕНИЯ БЕЛКОВ
Отделение белков от низкомолекулярных примесей
Метод мембранных сит (диализ)
Используют диализную мембрану, которая является полимером и имеет поры определенной величины. Малые молекулы (низкомолекулярные примеси) проходят через поры в мембране, а крупные (белки) задерживаются. Таким образом, белки отмывают от примесей.
Разделение белков по молекулярной массе
Гель-хроматография
Хроматографическую колонку заполняют гранулами геля (сефадекс), который имеет поры определенной величины. В колонку вносят смесь белков. Белки, размер которых меньше, чем размер пор сефадекса, задерживаются в колонке, так как «застревают» в порах, а остальные свободно выходят из колонки (рис. 2.1). Размер белка зависит от его молекулярной массы.
Рис. 2.1. Разделение белков методом гель-фильтрации
Ультрацентрифугирование
Этот метод основан на различной скорости седиментации (осаждения) белковых молекул в растворах с различным градиентом плотности (сахарозный буфер или хлорид цезия) (рис. 2.2).
Рис. 2.2. Разделение белков методом ультрацентрифугирования
12
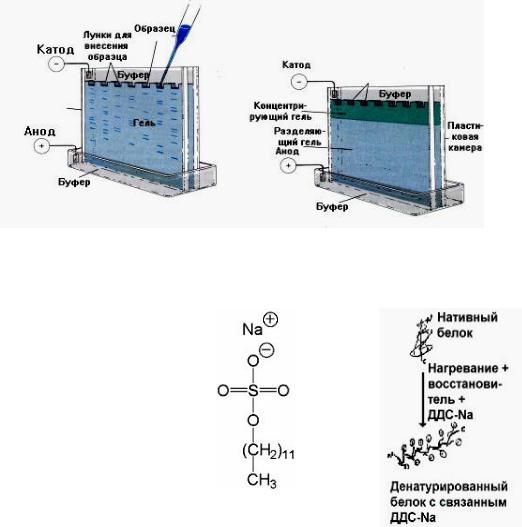
Электрофорез
Данный метод основан на различной скорости миграции белков и пептидов в электрическом поле в зависимости от заряда. Носителями для электрофореза могут служить бумага, крахмал, ацетатцеллюлоза, агар и другие гели.
Гель-электрофорез. Разделяемые молекулы движутся в геле в зависимости от их размера и формы: те из них, которые имеют бóльшие размеры, будут задерживаться при прохождении через поры геля. Следовательно, после проведения электрофореза бóльшие молекулы будут находиться ближе к старту, чем меньшие (рис. 2.3).
Рис. 2.3. Разделение белков методом электрофореза в геле
Методом электрофореза можно разделить белки и по молекулярной массе. Тогда его проводят в полиакриламидном геле в присутствии додецилсульфата натрия (ДДС-Na).
ДДС-Na является дифильной молекулой и содержит заряженную и гидрофобную группы. Белки связываются с ДДС-Na своими гидрофобными радикалами и при этом денатурируют. Таким образом, белки выравниваются по форме и заряду. После этого подвижность белка при электрофорезе будет зависеть только от его молекулярной массы.
ДДС-Na
Выделение индивидуальных белков
Изоэлектрофокусирование
Метод основан на различной величине ИЭТ белков. Белки разделяют методом электрофореза на пластине с амфолином (это вещество, которое формирует градиент pH в диапазоне от 3 до 10). При электрофорезе белки разделяются в соответствии со значением их ИЭТ (в ИЭТ заряд белка будет равен нулю, и он не будет передвигаться в электрическом поле).
Двухмерный электрофорез
Представляет собой сочетание изоэлектрофокусирования и электрофореза с ДДС-Na. Проводят сначала электрофорез в горизонтальном направлении на пластине с амфолином. Белки разделяются в зависимости от заряда. Затем обрабатывают пластину раствором ДДСNa и проводят электрофорез в вертикальном направлении. Белки разделяются в зависимости от молекулярной массы.
13
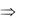
Аффинная хроматография
Метод основан на способности белков связываться со своими лигандами. Используется для выделения и очистки ферментов, иммуноглобулинов, рецепторных белков.
Колонку для аффинной хроматографии заполняют инертным веществом, к которому ковалентно присоединены лиганды (молекулы, с которыми специфически будут связываться определенные белки). При прохождении смеси белков через колонку искомый белок присоединяется к лиганду. Остальные белки свободно выходят из колонки. Белок, который остался в колонке, затем можно выделить с помощью буферного раствора, содержащего лиганд в свободном состоянии. Этот высокочувствительный метод позволяет выделить в чистом виде очень малые количества белка из клеточного экстракта, содержащего сотни других белков.
Анализ гомологичных белков
Гомологичные белки — белки, которые выполняют одну и ту же функцию, но различаются по первичной структуре (например, локализованы в различных органах или образуются при патологических состояниях). Например, HbA (содержит Glu) HbS (содержит Val) при серповидноклеточной анемии.
Метод пептидных карт (отпечатков пальцев), предложенный Ингремом
Этапы:
1)оба анализируемых белка расщепляют на фрагменты (пептиды);
2)смесь пептидов каждого белка наносят в виде пятна на угол листа хроматографической бумаги;
3)проводят электрофорез в горизонтальном направлении;
4)проводят распределительную хроматографию в вертикальном направлении;
5)полученные карты окрашивают и сравнивают;
6)различающиеся пептидные пятна выделяют и анализируют.
УСТАНОВЛЕНИЕ АК-ПОСЛЕДОВАТЕЛЬНОСТИ БЕЛКА
Определение N-концевой АК
1.Метод Сэнджера (ФДНБ — фтординитробензол — связывается с N-концевой АК с образованием соединения желтого цвета).
2.Метод Эдмана (используется ФИТЦ — фенилизотиоцианат, который также связывается с N-концевой АК с образованием соединения оранжевого цвета).
3.Дансилирование (взаимодействие N-концевой АК с дансилхлоридом с образованием флуоресцирующего соединения).
4.Ферментативный метод (использование аминопептидаз — это ферменты, которые избирательно отщепляют N-концевые АК, например, аланиновая аминопептидаза).
Определение С-концевой АК
1.Метод Акабори (гидразин разрушает все пептидные связи и реагирует со всеми АК, кроме С-концевой; С-концевую АК определяют после обработки смеси ФДНБ).
2.Ферментативный метод (карбоксипептидазы А отщепляют ароматические С-конце- вые АК, карбоксипептидазы В — основные С-концевые АК).
Определение АК-последовательности
1.Избирательный гидролиз.
2.Определение последовательности АК (используют прибор секвенатор, предложенный Эдманом).
14
Тема 3. БЕЛКИ СОЕДИНИТЕЛЬНЫХ ТКАНЕЙ (МОЛЕКУЛЫ ВНЕКЛЕТОЧНОГО МАТРИКСА)
Главный компонент внеклеточного матрикса — белки. Выделяют 3 группы белков: протеогликаны (ПГ); фибриллярные структурные белки (семейства коллагена и эластина);
фибриллярные адгезивные белки (семейства фибронектина и ламинина).
Все эти белки содержат углеводы, поэтому относятся к сложным белкам и называют-
ся белково-углеводные комплексы (БУК).
БУК классифицируются по двум критериям: количеству углеводов в комплексе и качественному углеводному составу:
протеогликаны (свыше 95 % углеводов); мукопротеины (10–50 % углеводов);
гликопротеины (менее 10 % углеводов).
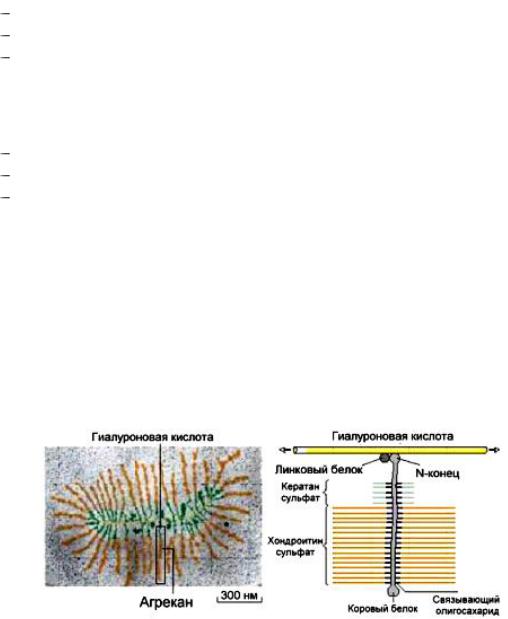
ПГ — это белковые комплексы, в которых с молекулами белка ковалентно связаны гликозаминогликаны (ГАГ). Белки ПГ называют коровыми белками (core — сердцевина, стержень).
ГАГ — гетерополисахариды, построенные по стандартному принципу: состоят из многократно повторяющихся дисахаридов, мономерами которых являются уроновые кислоты и гексозамины. Классифицируют ГАГ по строению остатков моносахаридов, типу связи между ними, числу и локализации сульфатных групп. Выделяют несколько семейств ГАГ
(рис. 3.1):
1)гиалуронаты;
2)хондроитин- и дерматансульфаты;
3)кератансульфаты;
4)гепарин и гепарансульфаты.
Рис. 3. 1. Строение главного ПГ хрящевой ткани — агрекана
Функции ПГ: 1) являются структурными компонентами внеклеточного матрикса; 2) специфически взаимодействуют с коллагеном, эластином, фибронектином, ламинином и другими белками матрикса; 3) как полианионы, они связывают поликатионы и катионы; 4) обеспечивают тургор (упругость) различных тканей, связывая воду; 5) противостоят компрессионным силами; 6) влияют на клеточную миграцию; 7) действуют как антикоагулянты.
Гликопротеины и мукопротеины часто считают синонимами, так как различия между ними касаются лишь количества углеводов в комплексе, а моносахариды глико- и мукопротеинов одинаковы: галактоза, манноза, гексозамины, нейраминовая и сиаловая кислоты.
Функции мукопротеинов: 1) как компоненты секретов слизистых оболочек, они обладают защитными свойствами, уменьшая трение соприкасающихся поверхностей; 2) обеспечивают групповую, видовую и тканевую специфичность; 3) обладают ферментативной ак-
15
тивностью.
Функции гликопротеинов: 1) являются структурными компонентами мембраны клетки, коллагеновых, эластиновых и фибриновых волокон, костного матрикса; 2) транспортные молекулы для витаминов, липидов, микроэлементов; 3) обеспечивают иммунную защиту; 4) обладают гормональной и ферментативной активностью (тиротропин, факторы свертывания крови).
В зависимости от типа связи между углеводной и белковой частями различают 2 типа
БУК:
 БУК с О-гликозидной связью между углеводом и СЕР, ТРЕ, гидроксиЛИЗ (ОНЛИЗ) белковой молекулы;
БУК с О-гликозидной связью между углеводом и СЕР, ТРЕ, гидроксиЛИЗ (ОНЛИЗ) белковой молекулы;
 БУК с N-гликозидной связью между углеводом и амидным азотом АСН белковой молекулы.
БУК с N-гликозидной связью между углеводом и амидным азотом АСН белковой молекулы.
Белковые части обоих типов БУК синтезируются по законам матричного синтеза, а углеводные части — нематрично по двум механизмам:
 углеводная цепь для БУК с О-гликозидной связью образуется путем постепенного добавления моносахаридов к синтезированной белковой части с помощью ферментов гликозилтрансфераз, обдадающих очень большой специфичностью;
углеводная цепь для БУК с О-гликозидной связью образуется путем постепенного добавления моносахаридов к синтезированной белковой части с помощью ферментов гликозилтрансфераз, обдадающих очень большой специфичностью;
 углеводная цепь для БУК с N-гликозидной связью синтезируется на специальной матрице — долихоле (полиизопреновое соединение) — и только затем присоединяется к синтезированной белковой части.
углеводная цепь для БУК с N-гликозидной связью синтезируется на специальной матрице — долихоле (полиизопреновое соединение) — и только затем присоединяется к синтезированной белковой части.
Распад БУК катализируется с помощью ферментов лизосом. Белковую часть расщепляют протеиназы, а углеводную цепь — гликозидазы. При врожденных дефектах гликозидаз возникают заболевания — мукополисахаридозы (болезни накопления БУК, лизосомные болезни).
Фибриллярные структурные белки
Коллагены — основные гликопротеины соединительных тканей. Они составляют 25 % всех белков организма человека и обеспечивают сопротивление растяжению в отличие
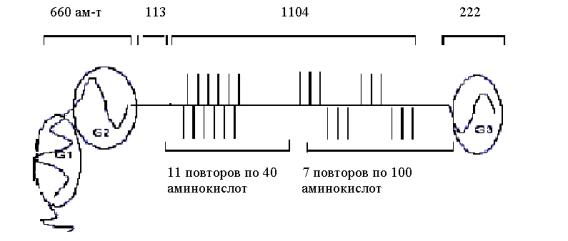
от ПГ, которые противодействуют сжатию. В геноме человека 30 генов, кодирующих коллагеновые α-цепи. Выделено свыше 20 типов коллагеновых молекул (изоколлагены) (табл. 3.1).
|
Таблица 3.1 |
||||||
|
Характеристика коллагенов |
||||||
|
Тип коллагена |
Длина волокна |
Состав |
Выделен |
|||
|
Тип I |
300 нм |
[ |
1(I)]2α2(I) |
Из кости, роговицы, дентина, кла- |
||
|
панов сердца, стенки матки |
||||||
|
Тип II |
300 нм |
[ |
1(II)]3 |
Из гиалинового хряща |
||
|
Тип III |
300 нм |
[ |
1(III)]3 |
Из дермы, клапанов сердца, десны |
||
|
Тип IV |
390 нм |
[ |
1(IV)]3 |
Из базальных мембран |
||
|
Тип V |
300 нм |
[ |
1(V)]2α2(V) |
Из кости, роговицы, больших сосу- |
||
|
дов, клапанов сердца |
||||||
|
Тип VI |
105 нм |
1(VI), 2(VI) |
Из кровеносных сосудов |
|||
|
Тип VII |
450 нм |
1(VII) |
Из эндотелия сосудов |
|||
|
Тип VIII |
150 нм |
1(VIII) |
Из эндотелия сосудов |
|||
|
Тип IX |
200 нм |
1(IX) α2(IX) |
Из хрящевой ткани |
|||
|
Тип X |
150 нм |
1(X) |
Из хрящевой ткани |
Изоколлагены типов I–III получили название фибрилформирующих коллагенов, а изоколлагены IX и XII — фибриллассоциируемых коллагенов, так как они обычно связаны с коллагеновыми волокнами, которые образовали фибрилформирующие коллагены. Фибриллассоциируемые коллагены обеспечивают соединение волокон с другими молекулами мат-
16
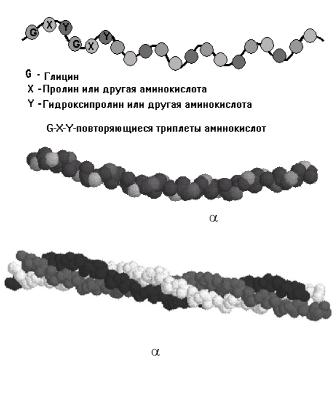
Рис. 3.3. Вторичная структура коллагена — тройная спираль из -цепей, каждая из которых состоит из 1000 аминокислот или
330 повторяющихся триплетов
рикса. Типы IV и VII называют сетьформирующими коллагенами. Они образуют сетевидные структуры и чаще всего находятся в базальных мембранах, обеспечивая связь клеточных слоев эпителия с подлежащей соединительной тканью. Это особенно важно для кожи.
Первичная структура коллагена — одиночная полипептидная цепь: 1/3 – ГЛИ, 1/5 – ПРО и гидроксиПРО (ОН-ПРО), есть и ОН-ЛИЗ (рис. 3.2). К ней присоединен дисахарид (глюкоза + галактоза). Полипептидная цепь — левозакрученная спираль, но водородные связи отсутствуют, так как много иминокислот.
Вторичная структура — особый коллагеновый тип: 3 полипептидные цепи сворачиваются в тройную, линейную, правозакрученную спираль. Такая молекула назы-
вается тропоколлаген (рис. 3.3).
Третичная структура — соединение
в пространстве молекул тропоколлагена между собой по горизонтали: «голова» к
|
«хвосту». |
Рис. 3.2. Первичная структура -цепи коллагена |
|
Четвертичная структура — ассоци- |
|
|
ация между собой молекул тропоколлагена, |
|
|
имеющих третичную структуру, по вертика- |
|
|
ли: в виде «лестницы». Каждая «ступенька» |
|
|
такой лестницы смещена относительно со- |
седней на 1/4 своей длины. В образующиеся в ходе такого сдвига пустоты в костной ткани и в твердых тканях зуба откладываются кристаллы фосфата кальция, которые стано-
вятся центром нуклеации (ядром) для роста кристаллов гидроксиапатита.
Синтез коллагена. Полипептидные цепи синтезируются на полисомах в виде препроколлагена («пре» указывает на наличие сигнального, лидирующего пептида; «про» — на наличие дополнительных пептидов на N- и С-концах). Затем начинается процессинг препроколлагена (табл. 3.2).
|
Таблица 3.2 |
||||
|
Порядок и локализация процессинга препроколлагена |
||||
|
Внутриклеточно |
Внеклеточно |
|||
|
1. |
Удаление сигнального пептида |
1. |
Удаление дополнительных пептидов |
|
|
2. |
Гидроксилирование ПРО и ЛИЗ |
2. |
Образование коллагеновых волокон с попе- |
|
|
3. |
Гликозилирование ОН-ЛИЗ |
речной исчерченностью |
||
|
4. |
Образование внутри- и межцепочечных |
3. |
Окислительное дезаминирование ε- |
|
|
S-S связей в дополнительных пептидах |
аминогрупп ЛИЗ и ОН-ЛИЗ с образованием |
|||
|
5. |
Образование тройной спирали |
альдегидных групп |
||
|
4. |
Образование поперечных связей в коллаге- |
|||
|
новых волокнах |
Разрушается коллаген коллагеназами и лизосомными ферментами — протеиназами и гликозидазами. О «возрасте» коллагена можно судить по количеству поперечных ковалентных связей в коллагеновых волокнах: чем «моложе» коллаген, тем меньше поперечных связей, тем легче и быстрее он разрушается, и наоборот.
Эластин. Молекула эластина состоит из двух типов фрагментов, чередующихся вдоль цепи: гидрофобные (фибриллярные) сегменты, которые ответственны за эластические свойства молекулы и глобулярные сегменты, богатые АЛА и ЛИЗ, имеющие форму α-спирали и участвующие в формировании поперечных связей между молекулами эластина. В отличие от
17
коллагена у эластина один генетический тип, мало ОН-ПРО, нет ОН-ЛИЗ, дополнительных пептидов, углеводов, не образуется тройная спираль. Синтезируется эластин в виде мономера, а внеклеточно происходит фибриллогенез с образованием поперечных связей с помощью аминокислоты десмозина — продукта межмолекулярной конденсации 4-х остатков ЛИЗ. Эластин — самый прочный из белков, известных в организме человека. Разрушается под действием фермента эластазы.
Фибриллярные адгезивные белки
Внеклеточный матрикс содержит большое число адгезивных неколлагеновых белков, структурной особенностью которых является наличие доменов, способных специфически связываться с другими макромолекулами и рецепторами на поверхности клетки. Непременным компонентом доменов, обеспечивающих взаимодействие с клетками, является последовательность аминокислот АРГ-ГЛИ-АСП (R-G-D).
Фибронектин — высокомолекулярный гликопротеин. Существуют множественные формы фибронектина. Одна из них — фибронектин плазмы и других биологических жидкостей. Он принимает участие в механизмах свертывания крови и заживления ран. Фибронектины тканей располагаются на поверхности клеток, образуя фибронектиновые филаменты. Фибронектин ускоряет клеточную миграцию, обеспечивая взаимодействие клеток с матриксом.
Фибриллин — структурный компонент микрофибрилл, обеспечивающих образование эластиновых волокон. Он найден в хрусталике, периосте, аорте. При мутации гена, кодирующего синтез фибриллина, развивается синдром Марфана: эктопия хрусталика, арахнодактилия («паучьи» пальцы), поражение суставов.
Ламинин и энтактин — гликопротеины базальной мембраны. Они связываются не только между собой, но и с изоколлагеном IV , гепарансульфатом, поверхностью эпителиальных клеток, причем для связывания с различными веществами имеются свои домены.
Каждый тип соединительной ткани имеет свои специфические наборы молекул: кроме соответствующих изоколлагенов, имеются и специфические неколлагеновые белки.
В хрящевой: главный ПГ (рис. 3.4) и минорные ПГ (фибромодулин — регулятор фибриллогенеза; бигликан — значение его пока неизвестно; декорин — способен связываться с изоколлагеном II и играет роль ингибитора фибринолиза; белки с разной молекулярной массой и не очень изученными функциями, из известных функций — связывание с хондроцитами, кристаллами гидроксиапатита, изоколлагеном II для его фиксации к хондроцитам).
Рис. 3.4. Схематическое строение главного протеогликана хряща
В костной: индукторы и ингибиторы остеогенеза, инициаторы минерализации — остеокальцин, остеонектин, остеопонтин, костный кислый гликопротеин, костный сиалопротеин, тромбоспондин.
18
19
Тема 4. ВВЕДЕНИЕ В ЭНЗИМОЛОГИЮ. СВОЙСТВА ФЕРМЕНТОВ
Катализатор — это вещество, которое ускоряет химическую реакцию, но само в ходе этой реакции не расходуется.
Энзим (en zyme — в дрожжах), фермент (fermentum — закваска) — термины для обозначения биологических катализаторов белковой природы.
Рибозим — это биологический катализатор рибонуклеиновой природы.
Субстратом (S) называют вещество, химические превращения которого в продукт (Р) катализирует фермент (Е).
Чтобы произошла химическая реакция, необходимы следующие условия:
1)молекулы должны сблизиться (столкнуться);
2)запас энергии молекул в момент столкновения должен быть не ниже энергетического барьера реакции.
КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ФЕРМЕНТОВ
В начале ХХ в. предложили называть ферменты по названию субстрата с добавлением суффикса -аза (amylum — амилаза, lipos — липаза, protein — протеиназа). В 1961 г. Международный Совет Биохимиков (IUB) предложил положить в основу названия и классификации ферментов тип химической реакции и ее механизм. Все ферменты разделили на 6 классов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы (синтетазы). Каждый класс состоит из 4–13 подклассов, а те в свою очередь из подподклассов.
1.Оксидоредуктазы — это ферменты, катализирующие окислительно-восстано- вительные реакции с участием двух субстратов А и В: А red + Вox Аox + Вred.
2.Трансферазы — это ферменты, катализирующие реакции межмолекулярного переноса группы Х, кроме водорода и кислорода, с субстрата А на субстрат В: А-Х + В <–>
А+ В-Х.
3.Гидролазы — это ферменты, которые катализируют расщепление внутримолеку-
лярных связей с участием воды. Например: Ацетилхолин + Н2О <–> Холин + Уксусная кислота.
4.Лиазы — это ферменты, отщепляющие группы от субстратов по негидролитическому механизму с образованием двойных связей и присоединением веществ по месту двойной связи.
5.Изомеразы катализируют превращения различных типов оптических, геометрических и позиционных изомеров.
6.Лигазы катализируют соединение двух молекул, сопряженное с разрывом пирофосфатной связи АТФ или другого макроэргического соединения.
Каждый фермент по классификации ферментов (КФ, ЕС) обозначается четырьмя цифрами (шифр фермента): 1— класс, 2 — подкласс, 3 — подподкласс, 4 — номер фермента в списке подподкласса. Так, например, КФ 2.7.1.1 означает: класс 2 (трансферазы), подкласс 7 (перенос фосфата), подподкласс 1 (алкогольная группа — акцептор фосфата). Конечное название — гексокиназа, или АТФ:D-гексоза-6-фосфотрансфераза, фермент, катализирующий перенос фосфата с АТФ на гидроксильную группу у шестого углеродного атома глюкозы.
СТРОЕНИЕ ФЕРМЕНТА
По сложности строения белковой молекулы выделяют простые (однокомпонентные) ферменты, состоящие только из белковой части, и сложные (двухкомпонентные) ферменты, имеющие кроме белковой части (апофермента) и небелковую часть (кофермент). В этом случае сложный фермент часто называют холофермент.
Кофермент часто называют кофактором или простетической группой. Отличие заключается в характере связывания с апоферментом. Кофермент связывается с ним некова-
20
Соседние файлы в папке Всякое
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
11. Вставьте пропущенные слова в тексте : «Аминокислотную последовательность в составе полипептидной цепочки относятся к ………… структуре белка.
В результате образования водородных связей между –СО — и –NН — группами разных аминокислотных остатков большинство белков имеют вид спирали – это ……….
Структура белка.
Более плотная, трехмерная пространственная «упаковка» полипептида — ……… структура белка.
Следующий уровень организации белковой молекулы — …….
, который возникает в результате соединения нескольких макромолекул с третичной структурой в сложный комплекс».
На этой странице сайта вы найдете ответы на вопрос 11. Вставьте пропущенные слова в тексте : «Аминокислотную последовательность в составе полипептидной цепочки относятся к ………… структуре белка?,
относящийся к категории Биология. Сложность вопроса соответствует базовым
знаниям учеников 10 — 11 классов. Для получения дополнительной информации
найдите другие вопросы, относящимися к данной тематике, с помощью поисковой
системы. Или сформулируйте новый вопрос: нажмите кнопку вверху страницы, и
задайте нужный запрос с помощью ключевых слов, отвечающих вашим критериям.
Общайтесь с посетителями страницы, обсуждайте тему. Возможно, их ответы
помогут найти нужную информацию.
1862. Фрагмент начала гена имеет следующую последовательность нуклеотидов (верхняя цепь — смысловая, нижняя — транскрибируемая):
5’ -А-Г-Ц-Т-Т-Г-Ц-А-Ц-Ц-Т-А-Ц-Т-А- 3’
3’ -Т-Ц-Г-А-А-Ц-Г-Т-Г-Г-А-Т-Г-А-Т- 5’
Определите последовательность аминокислот во фрагменте полипептидной цепи и обоснуйте свой ответ. Какие изменения могли произойти в результате генной мутации во фрагменте молекулы ДНК, если первая аминокислота в полипептиде заменилась на аминокислоту Цис?Какое свойство генетического кода определяет возможность существования разных фрагментов мутированной молекулы ДНК?Ответ обоснуйте. Для решения задания используйте таблицу генетического кода.
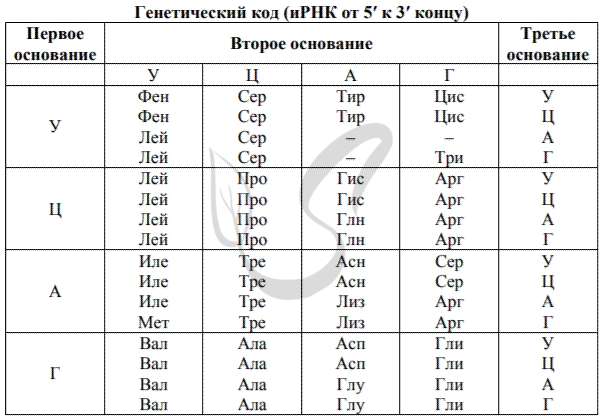

1) Последовательность аминокислот в полипептиде:
Сер-Лей-Гис-Лей-Лей — определяется по последовательности нуклеотидов в молекуле иРНК:
5’ -А-Г-Ц-У-У-Г-Ц-А-Ц-Ц-У-А-Ц-У-А- 3’
2) Во фрагменте белка первая аминокислота Сер заменилась на Цис, что возможно при замене первого триплета в смысловой цепи ДНК АГЦ на триплет ТГТ, ТГЦ; при замене первого триплета в транскрибируемой цепи ДНК ТЦГ на АЦА, АЦГ (первого кодона в РНК АГЦ на кодон УГУ, УГЦ)
3) Свойство генетического кода — избыточность (вырожденность), так как одной аминокислоте (Цис) соответствует более одного триплета (2 триплетa)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке
При обращении указывайте id этого вопроса — 1862.
1854. Установите последовательность процессов, происходящих при синтезе белка
у эукариот. Запишите в таблицу соответствующую последовательность цифр.
1) образование полипептида
2) синтез РНК
3) дозревание РНК в ядре
4) присоединение рибосомы к РНК
5) транспорт РНК в цитоплазму

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке
При обращении указывайте id этого вопроса — 1854.
1839. Все перечисленные ниже признаки, кроме трех, можно использовать для описания молекул транспортных РНК. Определите три признака, «выпадающих» из общего списка, и запишите цифры, под которыми они указаны.
1. не имеют двуцепочечных фрагментов2. способны к репликации3. переносят аминокислоты к рибосомам4. содержат кодон в центральной петле5. участвуют в синтезе белков6. синтезируются в ходе транскрипции

Верный ответ: 124
Молекулы тРНК синтезируются в ходе транскрипции (как и все РНК), тРНК переносят аминокислоты к месту синтеза белка (рибосомам), таким образом участвуя в процессе синтеза белка (трансляции)
Молекулы тРНК имеют двухцепочечные фрагменты, которые соединяют тРНК в трилистник (тРНК имеет форму клеверного листа), не способны к репликации (репликация — процесс удвоения ДНК), не содержат кодон в центральной петле (в центральной петле находится антикодон)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке
При обращении указывайте id этого вопроса — 1839.
1834. Фрагмент начала гена имеет следующую последовательность нуклеотидов
(верхняя цепь — смысловая, нижняя — транскрибируемая):
5’ -Г-Г-Т-Г-Ц-А-Т-Т-А-Т-Ц-Г-А-Т-Т- 3’
3’ -Ц-Ц-А-Ц-Г-Т-А-А-Т-А-Г-Ц-Т-А-А- 5’
В результате замены одного нуклеотида в ДНК третья аминокислота во фрагменте полипептида заменилась на аминокислоту Сер. Определите аминокислоту, которая кодировалась до мутации. Какие изменения произошли в ДНК, иРНК в результате замены одного нуклеотида? Благодаря какому свойству генетического кода одна и та же аминокислота у разных организмов кодируется одним и тем же триплетом? Ответ поясните. Для выполнения задания используйте таблицу генетического кода.


1) Третий триплет исходного фрагмента смысловой цепи ДНК — ТТА (транскрибируемой цепи ДНК — ААТ), определяем триплет иРНК: УУА, по таблице генетического кода определяем, что он кодирует аминокислоту Лей
2) Во фрагменте ДНК в третьем триплете смысловой цепи ТТА нуклеотид Т заменился на Ц (в транскрибируемой цепи в триплете ААТ нуклеотид А заменился на Т, а в иРНК в третьем кодоне (УУА) нуклеотид У заменился на Ц (УЦА)
3) Свойство генетического кода — универсальность.
Наличие в ответе множества триплетов считается ошибкой, так как в задании указано, что произошла замена одного нуклеотида.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке
При обращении указывайте id этого вопроса — 1834.
1831. Найдите ошибки в приведенном тексте. Укажите номера предложений, в которых сделаны ошибки, исправьте их.
1. Генетический аппарат клетки включает молекулы нуклеиновых кислот. 2. Хранителем наследственной информации является дезоксирибонуклеиновая кислота, содержащаяся в митохондриях и пластидах. 3. Кроме ДНК, в клетке имеется несколько
видов РНК: транспортная, рибосомная, информационная. 4. Процесс биосинтеза белка
имеет матричный характер и осуществляется на рибосомных РНК. 5. Транспортные
РНК участвуют в биосинтезе белка, доставляя к месту сборки полипептидной цепи
нуклеотиды.

Ошибки допущены в предложениях 2, 4, 5:
2) Хранителем наследственной информации является дезоксирибонуклеиновая кислота, содержащаяся в ядре.
4) Процесс биосинтеза белка имеет матричный характер и осуществляется на информационных (матричных) РНК.
5) Транспортные РНК участвуют в биосинтезе белка, доставляя к месту сборки полипептидной цепи аминокислоты.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке
При обращении указывайте id этого вопроса — 1831.
Для вас приятно генерировать тесты, создавайте их почаще
Естествознание, 10 класс
Урок 19. «Молекулярная структура живого»
Перечень вопросов, рассматриваемых в теме:
- Какие химические элементы входят в состав живой клетки;
- Какую роль играют углеводы и липиды;
- Как устроены белки, и как их молекулы приобретают определённую пространственную форму;
- Что такое ферменты, и как они распознают свои субстраты;
- Какое строение имеют молекулы РНК и ДНК;
- Какие особенности молекулы ДНК позволяют ей играть роль носителя генетической информации.
Глоссарий по теме:
Органические соединения – химические соединения, основой строения которых являются атомы углерода; составляют отличительный признак живого.
Полимер – (от греч поли – много, мерос – часть) – многозвеньевая цепь, образующаяся при соединении друг с другом относительно простых молекул – мономеров. Их называют высокомолекулярными соединениями или макромолекулами. К ним относят белки, полисахариды, нуклеиновые кислоты.
Мономеры – низкомолекулярные соединения, способные к образованию макромолекул. Мономерами белков являются аминокислоты; полисахаридов – моносахариды; нуклеиновых кислот – нуклеотиды.
Денатурация – нарушение природной структуры белка (изменение пространственной формы молекулы).
Принцип комплементарности – возможность возникновения водородной связи между определёнными (соответствующими) азотистыми основаниями. Комплементарные основания: А – Т, Г – Ц. Также компилементарными являются пары А – У.
Репликация – свойство молекулы ДНК заключающееся в самодублировании молекулы на основе принципа комплементарности. Этот процесс лежит в основе наследственности.
Основная и дополнительная литература по теме урока (точные библиографические данные с указанием страниц):
- Естествознание. 10 класс [Текст]: учебник для общеобразоват. организаций: базовый уровень / И.Ю. Алексашина, К.В. Галактионов, И.С. Дмитриев, А.В. Ляпцев и др. / под ред. И.Ю. Алексашиной. – 3-е изд., испр. – М.: Просвещение, 2017.: с 88-93.
Электронные ресурсы:
Основы биохимии. Портал открытая биология // Электронный доступ: https://biology.ru/textbook/chapter8/section1/paragraph1/
Химические вещества клетки .Проект «вся биология» // Электронный доступ: http://www.sbio.info/materials/obbiology/obbkletka/
Теоретический материал для самостоятельного изучения
Чтобы познакомиться с сущностью процессов, протекающих в живых организмах, следует, в первую очередь, познакомиться с их химическим составом. Представление о мельчайших структурах даёт понимание – как способствовать сохранению своего здоровья и биологических систем более высокого ранга.
Вы уже знаете, что из 104 элементов системы Д. И. Менделеева около 70 были обнаружены в живых организмах. Т.е., химический состав живой и неживой природы один и тот же, что свидетельствует об их единстве.
Атомы в клетках не существуют самостоятельно, они образуют различные соединения, которые выполняют определённую функцию.
Одним из важнейших неорганических соединений является вода, которая в клетках вода составляет 70-80%. Из школьного курса химии, вы знаете, что вода является хорошим растворителем. Из физики, что она обладает высокой теплоёмкостью и низкой теплопроводностью. Биологическая роль воды в организме состоит в том, что вода способствует движению веществ и нормальному ходу биохимических реакций, в ней хранится тепло. При недостатке воды, температура тела спортсмена может увеличиваться на 10°, а при движении – и более, так как метаболизм проходит непрерывно и интенсивно.
Основные вещества клетки представляют собой молекулы, состоящие из взаимосвязанных атомов углерода. Такие соединения углерода получили название органические соединения. Органические соединения клетки образуют макромолекулы, представляющие собой многозвеньевые цепи – полимеры. В их числе базовыми являются белки, жиры (липиды), углеводы и нуклеиновые кислоты. Липиды и углеводы играют важную роль в построении структур организмов, выполняют энергетическую и другие важные функции.
Однако, вторую по величине группу в вашем организме составляют белки, на их долю приходится около 50% соединений. Белки выполняют самые разнообразные задачи в организме: участвуют в построении мышечных волокон или соединительной ткани; порождают движение нашего тела; выполняют другие важные функции в организме. Например, – транспортную (гемоглобин), рецепторную, сигнальную, или регуляторную (белки-гормоны), каталитическую (белки-ферменты), защитную (антитела, интерфероны), энергетическую (при расщеплении 1г. белка выделяется 17,6 кДж энергии). Можно сказать, что практически нет таких процессов в биологической системе, которые бы шли без участия белков.
Структура белков. Белки (полипептиды) представляют собой высокомолекулярные соединения, которые состоят из большого количества остатков α-аминокислот соединённых пептидной связью . Эта молекулярная (или полипептидная) цепь (первичная структура) складывается всего из 20 аминокислот, несмотря на их огромное количество в природе. Вторичная структура (пространственное расположение молекулярной цепи) является результатом возникновения водородных связей между близко расположенных аминокислот в молекулярной цепи. В результате молекула приобретает форму спирали. Дальнейшая упаковка молекулы в компактные структуры приводит к образованию клубочков (глобул) – так называемой Третичной структуре. Под Четвертичной структурой понимают форму упаковки сложных белков, состоящих из двух или более полипептидных цепочек (например, гемоглобин, хлорофилл и др). Упаковка каждого типа белка уникальна, поскольку связана с первичной структурой, т.е. определённым набором и последовательностью аминокислот в цепочке. Именно в третичной и четвертичной структурах белок способен выполнять свои непосредственные функции.
Белок может терять, присущую ей, трёхмерную структуру (денатаруция). Это изменение может носить временный или постоянный характер, но и в том и в другом случае последовательность аминокислот белка остаётся неизменной. При денатурации молекула развёртывается и теряет способность выполнять свою обычную биологическую функцию. Вызвать денатурацию могут нагревание, воздействие различных излучений, взаимодействие с сильными кислотами, щелочами и концентрированными растворами солей, органическими растворителями. Обратный процесс – приобретение начальной структуры, получил название – ренатурация.
Такая способность к самоорганизации – уникальное свойство белков, определяющее выполнение ими функций. Свернувшись определённым образом, молекула-фермент может связаться только со своим специфичным веществом (субстратом), присоединив его к активному центру. При помощи белка-фермента происходят химические преобразования субстрата в конечный продукт. Например, фермент пищеварительного тракта липаза расщепляет только жиры. Биологическое значение ферментов – ускорение протекания биохимических реакций, т.е. являются биологическими катализаторами.
Собранные из 20-ти аминокислот белки можно представить как буквы в словах – их разные комбинации создают многообразие слов (белков). Набор белков для каждого организма уникален! Именно сочетание уникальных белков определяет различия и сходства организмов.
Каждому организму ежедневно требуется производить огромное количество белков. Как при этом не допускаются ошибки? В этом механизме безошибочной сборки белков участвуют нуклеиновые кислоты.
Нуклеиновые кислоты представляют собой многозвеньевые цепи, звеньями которых являются нуклеотиды. Нуклеотиды состоят из остатка фосфорной кислоты, углевода и азотистого основания. Различаются нуклеотиды по последнему компоненту: аденин, тимин, цитозин, гуанин и урацил (А, Т, Г, Ц, У – сокращённые буквенные обозначения).
Соединение нуклеотидов в цепочку происходит благодаря связи между углеводом одного нуклеотида и остатком фосфорной кислоты другого, что определяет направленность молекулы (начало-конец).
В зависимости от того, какой углевод входит в состав нуклеотида (рибоза или дезоксирибоза), различают рибонуклеиновые кислоты (РНК) и дезоксирибонуклеиновые кислоты (ДНК).
Модель строения молекулы ДНК предложили ДЖ.Уотсон и Ф.Крик в 1953 году. На основе экспериментальных данных было установлено, что количество А=Т, Г=Ц. Молекула ДНК состоит из двух цепочек закрученных спирально вправо. Цепочки удерживаются друг возле друга за счёт водородных связей, которые возникают между комплементарными азотистыми основаниями: А — Т и Г – Ц. Пара полинуклеотидных цепей расположенных комплементарно друг другу называют комплементарными цепями.
Принцип комплементарности позволяет не только молекуле безошибочно само восстанавливаться, но и само удваиваться. Процесс самодублирования молекулы ДНК – репликации, происходит при участии сложного набора ферментов, которые разъединяют комплементарные цепи. На каждой одиночной (материнской) полинуклеотидной цепи начинается сборка новых цепей ДНК. Под действием группы ферментов, так называемой ДНК-полимеразы, нуклеотиды соединяются в цепи и в результате воссоздаются две идентичные двойные спирали ДНК. Репликация молекулы ДНК может происходить безошибочно многократно.
Порядок расположения нуклеотидов в молекулах ДНК определяет порядок аминокислот в молекулах белков. ДНК организма хранит информацию о всём наборе белков, определяющим свойства клеток и организма в целом. Благодаря наличию механизма репликации, эта информация может быть передана поколениям потомков. Поэтому молекулы ДНК являются носителями наследственной информации.
В отличие от ДНК молекула РНК состоит из одной полинуклеотидной цепи. Существует несколько типов РНК, которые выполняют в клетке разные функции:
— информационная или матричная РНК (мРНК) – играет роль посредника при передаче генетической информации от ДНК к структурам клетки, синтезирующим белок, — рибосомам;
— рибосомные РНК (р-РНК) – вместе с белками формируют рибосомы,
— транспортные РНК (тРНК), доставляют аминокислоты к месту синтеза белка,
и некоторые другие.
Вывод
Клетки всех живых существ обладают схожестью элементного химического состава, а также обнаруживает общность живого и неживого. Молекулярную структуру живого составляют белки, липиды, углеводы и нуклеиновые кислоты. Органические соединения клетки образуют макромолекулы, представляющие собой многозвеньевые цепи – полимеры. Такое сходство химического состава является подтверждением единства происхождения всего живого.
Белки принимают участие практически во всех биохимических реакциях клетки и организма. Цепочки молекул белка построены из 20 аминокислот в разных комбинациях и последовательностях. Для каждого организма состав белков уникален. Последовательность аминокислот белков организма зашифрована в молекула ДНК. Способность ДНК к самокопированию (репликации) обеспечивает возможность передачи генетической информации в живой природе.
Примеры и разбор решения заданий тренировочного модуля:
Задание 1. Выберите один ответ:
Пространственную структуру в виде глобулы характерно для структуры белка называемой:
- Первичной;
- Вторичной;
- Третичной;
Ответ: Третичной
Пояснение: первичная структура линейная последовательность аминокислот белка, вторичная – молекула образует спираль.
Задание 2. Найдите ошибку (ошибки) и вычеркните их.
«Молекулы белков состоят из остатков аминокислот и азотистых оснований. Замена одного аминокислотного звена другим в белковой молекуле не изменяет её свойств. Нарушение природной структуры белка называется денатурацией. При этом белки не утрачивают биологическую активность. Денатурация может происходить под действием радиации, низкой температуры, ряда органических растворителей (спирт, ацетон), воды.»
Ответ: «Молекулы белков состоят из остатков аминокислот и азотистых оснований. Замена одного аминокислотного звена другим в белковой молекуле не изменяет её свойств. Нарушение природной структуры белка называется денатурацией. При этом белки не утрачивают биологическую активность. Денатурация может происходить под действием радиации, низкой температуры, ряда органических растворителей (спирт, ацетон), воды.»
Пояснение: азотистые основания не входят в состав белков, это составная часть нуклеотидов (мономеров нуклеиновых кислот).
ГДЗ к учебнику ХИМИЯ 10 КЛАСС Еремина и др. §23 Белки РЕШЕБНИК ОТВЕТЫ
Красным цветом приводится решение, а фиолетовым ― объяснение.
Задание 1
Какие функции выполняют в организме белки? Перечислите некоторые из них и приведите примеры.
1. Каталитическая (амилаза способен расщеплять углеводы).
2. Структурная (коллаген составляет основу соединительной ткани организма).
3. Защитная (фибриноген отвечает за свёртываемость крови при ранении).
4. Регуляторная (инсулин регулирует углеводный обмен).
5. Сигнальная (лептин отвечает за чувство голода).
6. Транспортная (гемоглобин переносит кислород).
7. Запасная (миозин является компонентом волокон мышц).
8. Двигательная (актомиозин отвечает за сокращение мышц).
Задание 2
Что представляют собой первичная и вторичная структуры белков?
Первичная структура белка ― это линейная последовательность расположения аминокислотных остатков в полипептидной цепи.
Вторичная структура белка ― это упорядоченное пространственное строение полипептидных цепей, обусловленное водородными связями между группами C=O и N―H разных аминокислот.
Задание 3
Сколько аминокислотных остатков содержит белок, изображённый на рисунке 69? 74 аминокислотных остатков.
Задание 4
Что такое денатурация белков? Денатурация белков ― разрушение пространственной структуры белка с сохранением его первичной структуры, т. е. без разрыва пептидных связей.
Какие факторы её вызывают? Нагревание, кислотная среда, органические растворители, действие излучения.
Задание 5
Обратима или нет денатурация белка, происходящая при варке яиц? Необратима, т.к. под воздействием температуры нарушается четвертичная, третичная и вторичная структуры яичных белков, которые нельзя ренатурировать до исходного состояния.
![]()
Опубликовано 13.06.2017 по предмету Биология от Гость
>> <<
Найдите ошибки или неточности в тексте. Исправте их. Сформулируйте и запишите верное утверждение.
Последовательность аминокислот в молекуле белка определяется последовательностью нуклеотидов в цепи ДНК. Существует 64 триплета, которые кодируют 20 типов аминокислот, входящих в состав белков.
![]()
Ответ оставил Гость
Триплет нуклеотида = аминокислота
Оцени ответ

Подпишись на наш канал в телеграм. Там мы даём ещё больше полезной информации для школьников!

(световой
процесс)
свет
12H2 + 6O2 +
энергия АТФ——————-С6H12O6 + H2О
(темновой
процесс)
Фотосинтез
единственный процесс в биосфере, ведущий к увеличению ее свободной энергии за
счет внешнего источника. Запасенная в продуктах фотосинтеза энергия основной
источник энергии для человечества.
Ежегодно в
результате фотосинтеза на Земле образуется 150 млрд. тонн органического
вещества и выделяется около 200 млн. тонн свободного кислорода.
Круговорот
кислорода, углерода и других элементов, вовлекаемых в фотосинтез, поддерживает
современный состав атмосферы, необходимый для жизни на Земле. Фотосинтез
препятствует увеличению концентрации СO2, предотвращая перегрев Земли
вследствие так называемого «парникового эффекта». Поскольку зеленые растения
представляют собой непосредственную или опосредованную базу питания всех других
гетеротрофных организмов, фотосинтез удовлетворяет потребность в пище всего
живого на нашей планете. Он важнейшая основа сельского и лесного хозяйства. Квадратный
метр поверхности листьев в течение одного часа продуцирует около одного грамма
сахара; это значит, что все растения, по приблизительной оценке, изымают из
атмосферы от 100 до 200 млрд. тонн С в год. Около 60 % этого количества
поглощают леса, занимающие 30 % непокрытой льдами поверхности суши, 32 %
окультуренные земли, а оставшиеся 8 % растения степей и пустынных мест, а
также городов и поселков.
2.)СИСТЕМА
ОПОРЫ И ДВИЖЕНИЯ.КОМПОНЕНТЫ<span>:скелет и мышцы.Функция скелета в организме:опора
тела или его частей,определение формы тела, защита внутренних органов от
механических повреждений.СХОДСТВО
СКЕЛЕТА ЧЕЛ И ЖИВ.Наличие в скелете человека и млекопит.жив. одних и
тех же отделов,образованных сходство расположенными костями .ОСОБЕННОСТИ СТРОЕНИЯ СКЕЛЕТА ЧЕЛ, СВЯЗ.
С ПРЯМОХОЖД.:Позвоночник ,имеющий четыре изгиба, грудная клетка,
расширенная в стороны, пояс нижних конечностей в виде чашки,кости нижних
конечностей более толстые и прочные, чем кости рук, свод в стопе.РУКА-ОРГАН ТРУДА.Развитие
большого пальца руки и его противопоставление всем остальным , благодаря ему
кисть способна выполнять разнообразные и чрезвычайно тонкие трудовые операции</span>

реализации генетической информации. Между белком и молекулой нуклеиновой кислоты образуются ионные связи.
6. Фосфопротеины. Белки, которые содержат в своем составе фосфорную кислоту. Используются для регуляции процессов жизнедеятельности (фосфорилирование / дефосфорилирование). Между белком и остатком фосфорной кислоты формируются сложноэфирные связи, в образовании которых участвует OH-группа серина.
Тема 2. МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БЕЛКОВ И ПЕПТИДОВ
Аминокислоты, соединяясь пептидной связью, образуют полипептидные цепи. Линейная последовательность аминокислотных остатков, соединенных между собой пептидными связями, определяет первичную структуру белковой молекулы.
ЭТАПЫ ИССЛЕДОВАНИЯ ПЕРВИЧНОЙ СТРУКТУРЫ БЕЛКОВ И ПЕПТИДОВ
1.Выделение белка из смеси в чистом виде (по одному из признаков: размер молекулы, заряд, специфическое сродство связывания). Определение молекулярной массы белка.
2.Определение N-концевой АК.
3.Определение С-концевой АК.
4.Определение АК-последовательности белковой цепи.
Выделение белка из биологического материала основано на его физико-химических свойствах. Чаще всего для этих целей используют кислотно-основные свойства белков (амфотерность, заряд молекулы, изоэлектрическое состояние).
От заряда белковых молекул зависит их: растворимость (минимальна в ИЭТ); электрофоретическая подвижность; структура и биологическая активность.
При растворении в водной среде на поверхности белковой молекулы формируется гидратная оболочка.
Устойчивость белка в растворе зависит:
1)от заряда белковой молекулы;
2)наличия гидратной оболочки;
3)от молекулярной массы белка.
Для выделения нативных белков (без изменения пространственной структуры) используют метод высаливания:
осаждение солями щелочноземельных металлов: хлорид натрия, сульфат аммония;
 осаждение другими водоотнимающими веществами: спиртом или ацетоном при низких температурах (около –20 С).
осаждение другими водоотнимающими веществами: спиртом или ацетоном при низких температурах (около –20 С).
При использовании этих методов белки лишаются гидратной оболочки и выпадают в осадок.
Денатурация — нарушение пространственной структуры белков (первичная структура молекулы сохраняется). Может быть обратимая (структура белка восстанавливается после устранения денатурирующего агента) или необратимая (пространственная структура молекулы не восстанавливается, например, при осаждении белков минеральными концентрированными кислотами, солями тяжелых металлов).
11

МЕТОДЫ РАЗДЕЛЕНИЯ БЕЛКОВ
Отделение белков от низкомолекулярных примесей
Метод мембранных сит (диализ)
Используют диализную мембрану, которая является полимером и имеет поры определенной величины. Малые молекулы (низкомолекулярные примеси) проходят через поры в мембране, а крупные (белки) задерживаются. Таким образом, белки отмывают от примесей.
Разделение белков по молекулярной массе
Гель-хроматография
Хроматографическую колонку заполняют гранулами геля (сефадекс), который имеет поры определенной величины. В колонку вносят смесь белков. Белки, размер которых меньше, чем размер пор сефадекса, задерживаются в колонке, так как «застревают» в порах, а остальные свободно выходят из колонки (рис. 2.1). Размер белка зависит от его молекулярной массы.
Рис. 2.1. Разделение белков методом гель-фильтрации
Ультрацентрифугирование
Этот метод основан на различной скорости седиментации (осаждения) белковых молекул в растворах с различным градиентом плотности (сахарозный буфер или хлорид цезия) (рис. 2.2).
Рис. 2.2. Разделение белков методом ультрацентрифугирования
12

Электрофорез
Данный метод основан на различной скорости миграции белков и пептидов в электрическом поле в зависимости от заряда. Носителями для электрофореза могут служить бумага, крахмал, ацетатцеллюлоза, агар и другие гели.
Гель-электрофорез. Разделяемые молекулы движутся в геле в зависимости от их размера и формы: те из них, которые имеют бóльшие размеры, будут задерживаться при прохождении через поры геля. Следовательно, после проведения электрофореза бóльшие молекулы будут находиться ближе к старту, чем меньшие (рис. 2.3).
Рис. 2.3. Разделение белков методом электрофореза в геле
Методом электрофореза можно разделить белки и по молекулярной массе. Тогда его проводят в полиакриламидном геле в присутствии додецилсульфата натрия (ДДС-Na).
ДДС-Na является дифильной молекулой и содержит заряженную и гидрофобную группы. Белки связываются с ДДС-Na своими гидрофобными радикалами и при этом денатурируют. Таким образом, белки выравниваются по форме и заряду. После этого подвижность белка при электрофорезе будет зависеть только от его молекулярной массы.
ДДС-Na
Выделение индивидуальных белков
Изоэлектрофокусирование
Метод основан на различной величине ИЭТ белков. Белки разделяют методом электрофореза на пластине с амфолином (это вещество, которое формирует градиент pH в диапазоне от 3 до 10). При электрофорезе белки разделяются в соответствии со значением их ИЭТ (в ИЭТ заряд белка будет равен нулю, и он не будет передвигаться в электрическом поле).
Двухмерный электрофорез
Представляет собой сочетание изоэлектрофокусирования и электрофореза с ДДС-Na. Проводят сначала электрофорез в горизонтальном направлении на пластине с амфолином. Белки разделяются в зависимости от заряда. Затем обрабатывают пластину раствором ДДСNa и проводят электрофорез в вертикальном направлении. Белки разделяются в зависимости от молекулярной массы.
13
Аффинная хроматография
Метод основан на способности белков связываться со своими лигандами. Используется для выделения и очистки ферментов, иммуноглобулинов, рецепторных белков.
Колонку для аффинной хроматографии заполняют инертным веществом, к которому ковалентно присоединены лиганды (молекулы, с которыми специфически будут связываться определенные белки). При прохождении смеси белков через колонку искомый белок присоединяется к лиганду. Остальные белки свободно выходят из колонки. Белок, который остался в колонке, затем можно выделить с помощью буферного раствора, содержащего лиганд в свободном состоянии. Этот высокочувствительный метод позволяет выделить в чистом виде очень малые количества белка из клеточного экстракта, содержащего сотни других белков.
Анализ гомологичных белков
Гомологичные белки — белки, которые выполняют одну и ту же функцию, но различаются по первичной структуре (например, локализованы в различных органах или образуются при патологических состояниях). Например, HbA (содержит Glu) HbS (содержит Val) при серповидноклеточной анемии.
Метод пептидных карт (отпечатков пальцев), предложенный Ингремом
Этапы:
1)оба анализируемых белка расщепляют на фрагменты (пептиды);
2)смесь пептидов каждого белка наносят в виде пятна на угол листа хроматографической бумаги;
3)проводят электрофорез в горизонтальном направлении;
4)проводят распределительную хроматографию в вертикальном направлении;
5)полученные карты окрашивают и сравнивают;
6)различающиеся пептидные пятна выделяют и анализируют.
УСТАНОВЛЕНИЕ АК-ПОСЛЕДОВАТЕЛЬНОСТИ БЕЛКА
Определение N-концевой АК
1.Метод Сэнджера (ФДНБ — фтординитробензол — связывается с N-концевой АК с образованием соединения желтого цвета).
2.Метод Эдмана (используется ФИТЦ — фенилизотиоцианат, который также связывается с N-концевой АК с образованием соединения оранжевого цвета).
3.Дансилирование (взаимодействие N-концевой АК с дансилхлоридом с образованием флуоресцирующего соединения).
4.Ферментативный метод (использование аминопептидаз — это ферменты, которые избирательно отщепляют N-концевые АК, например, аланиновая аминопептидаза).
Определение С-концевой АК
1.Метод Акабори (гидразин разрушает все пептидные связи и реагирует со всеми АК, кроме С-концевой; С-концевую АК определяют после обработки смеси ФДНБ).
2.Ферментативный метод (карбоксипептидазы А отщепляют ароматические С-конце- вые АК, карбоксипептидазы В — основные С-концевые АК).
Определение АК-последовательности
1.Избирательный гидролиз.
2.Определение последовательности АК (используют прибор секвенатор, предложенный Эдманом).
14

Тема 3. БЕЛКИ СОЕДИНИТЕЛЬНЫХ ТКАНЕЙ (МОЛЕКУЛЫ ВНЕКЛЕТОЧНОГО МАТРИКСА)
Главный компонент внеклеточного матрикса — белки. Выделяют 3 группы белков: протеогликаны (ПГ); фибриллярные структурные белки (семейства коллагена и эластина);
фибриллярные адгезивные белки (семейства фибронектина и ламинина).
Все эти белки содержат углеводы, поэтому относятся к сложным белкам и называют-
ся белково-углеводные комплексы (БУК).
БУК классифицируются по двум критериям: количеству углеводов в комплексе и качественному углеводному составу:
протеогликаны (свыше 95 % углеводов); мукопротеины (10–50 % углеводов);
гликопротеины (менее 10 % углеводов).
ПГ — это белковые комплексы, в которых с молекулами белка ковалентно связаны гликозаминогликаны (ГАГ). Белки ПГ называют коровыми белками (core — сердцевина, стержень).
ГАГ — гетерополисахариды, построенные по стандартному принципу: состоят из многократно повторяющихся дисахаридов, мономерами которых являются уроновые кислоты и гексозамины. Классифицируют ГАГ по строению остатков моносахаридов, типу связи между ними, числу и локализации сульфатных групп. Выделяют несколько семейств ГАГ
(рис. 3.1):
1)гиалуронаты;
2)хондроитин- и дерматансульфаты;
3)кератансульфаты;
4)гепарин и гепарансульфаты.
Рис. 3. 1. Строение главного ПГ хрящевой ткани — агрекана
Функции ПГ: 1) являются структурными компонентами внеклеточного матрикса; 2) специфически взаимодействуют с коллагеном, эластином, фибронектином, ламинином и другими белками матрикса; 3) как полианионы, они связывают поликатионы и катионы; 4) обеспечивают тургор (упругость) различных тканей, связывая воду; 5) противостоят компрессионным силами; 6) влияют на клеточную миграцию; 7) действуют как антикоагулянты.
Гликопротеины и мукопротеины часто считают синонимами, так как различия между ними касаются лишь количества углеводов в комплексе, а моносахариды глико- и мукопротеинов одинаковы: галактоза, манноза, гексозамины, нейраминовая и сиаловая кислоты.
Функции мукопротеинов: 1) как компоненты секретов слизистых оболочек, они обладают защитными свойствами, уменьшая трение соприкасающихся поверхностей; 2) обеспечивают групповую, видовую и тканевую специфичность; 3) обладают ферментативной ак-
15
тивностью.
Функции гликопротеинов: 1) являются структурными компонентами мембраны клетки, коллагеновых, эластиновых и фибриновых волокон, костного матрикса; 2) транспортные молекулы для витаминов, липидов, микроэлементов; 3) обеспечивают иммунную защиту; 4) обладают гормональной и ферментативной активностью (тиротропин, факторы свертывания крови).
В зависимости от типа связи между углеводной и белковой частями различают 2 типа
БУК:
 БУК с О-гликозидной связью между углеводом и СЕР, ТРЕ, гидроксиЛИЗ (ОНЛИЗ) белковой молекулы;
БУК с О-гликозидной связью между углеводом и СЕР, ТРЕ, гидроксиЛИЗ (ОНЛИЗ) белковой молекулы;
 БУК с N-гликозидной связью между углеводом и амидным азотом АСН белковой молекулы.
БУК с N-гликозидной связью между углеводом и амидным азотом АСН белковой молекулы.
Белковые части обоих типов БУК синтезируются по законам матричного синтеза, а углеводные части — нематрично по двум механизмам:
 углеводная цепь для БУК с О-гликозидной связью образуется путем постепенного добавления моносахаридов к синтезированной белковой части с помощью ферментов гликозилтрансфераз, обдадающих очень большой специфичностью;
углеводная цепь для БУК с О-гликозидной связью образуется путем постепенного добавления моносахаридов к синтезированной белковой части с помощью ферментов гликозилтрансфераз, обдадающих очень большой специфичностью;
 углеводная цепь для БУК с N-гликозидной связью синтезируется на специальной матрице — долихоле (полиизопреновое соединение) — и только затем присоединяется к синтезированной белковой части.
углеводная цепь для БУК с N-гликозидной связью синтезируется на специальной матрице — долихоле (полиизопреновое соединение) — и только затем присоединяется к синтезированной белковой части.
Распад БУК катализируется с помощью ферментов лизосом. Белковую часть расщепляют протеиназы, а углеводную цепь — гликозидазы. При врожденных дефектах гликозидаз возникают заболевания — мукополисахаридозы (болезни накопления БУК, лизосомные болезни).
Фибриллярные структурные белки
Коллагены — основные гликопротеины соединительных тканей. Они составляют 25 % всех белков организма человека и обеспечивают сопротивление растяжению в отличие
от ПГ, которые противодействуют сжатию. В геноме человека 30 генов, кодирующих коллагеновые α-цепи. Выделено свыше 20 типов коллагеновых молекул (изоколлагены) (табл. 3.1).
|
Таблица 3.1 |
||||||
|
Характеристика коллагенов |
||||||
|
Тип коллагена |
Длина волокна |
Состав |
Выделен |
|||
|
Тип I |
300 нм |
[ |
1(I)]2α2(I) |
Из кости, роговицы, дентина, кла- |
||
|
панов сердца, стенки матки |
||||||
|
Тип II |
300 нм |
[ |
1(II)]3 |
Из гиалинового хряща |
||
|
Тип III |
300 нм |
[ |
1(III)]3 |
Из дермы, клапанов сердца, десны |
||
|
Тип IV |
390 нм |
[ |
1(IV)]3 |
Из базальных мембран |
||
|
Тип V |
300 нм |
[ |
1(V)]2α2(V) |
Из кости, роговицы, больших сосу- |
||
|
дов, клапанов сердца |
||||||
|
Тип VI |
105 нм |
1(VI), 2(VI) |
Из кровеносных сосудов |
|||
|
Тип VII |
450 нм |
1(VII) |
Из эндотелия сосудов |
|||
|
Тип VIII |
150 нм |
1(VIII) |
Из эндотелия сосудов |
|||
|
Тип IX |
200 нм |
1(IX) α2(IX) |
Из хрящевой ткани |
|||
|
Тип X |
150 нм |
1(X) |
Из хрящевой ткани |
Изоколлагены типов I–III получили название фибрилформирующих коллагенов, а изоколлагены IX и XII — фибриллассоциируемых коллагенов, так как они обычно связаны с коллагеновыми волокнами, которые образовали фибрилформирующие коллагены. Фибриллассоциируемые коллагены обеспечивают соединение волокон с другими молекулами мат-
16

Рис. 3.3. Вторичная структура коллагена — тройная спираль из -цепей, каждая из которых состоит из 1000 аминокислот или
330 повторяющихся триплетов
рикса. Типы IV и VII называют сетьформирующими коллагенами. Они образуют сетевидные структуры и чаще всего находятся в базальных мембранах, обеспечивая связь клеточных слоев эпителия с подлежащей соединительной тканью. Это особенно важно для кожи.
Первичная структура коллагена — одиночная полипептидная цепь: 1/3 – ГЛИ, 1/5 – ПРО и гидроксиПРО (ОН-ПРО), есть и ОН-ЛИЗ (рис. 3.2). К ней присоединен дисахарид (глюкоза + галактоза). Полипептидная цепь — левозакрученная спираль, но водородные связи отсутствуют, так как много иминокислот.
Вторичная структура — особый коллагеновый тип: 3 полипептидные цепи сворачиваются в тройную, линейную, правозакрученную спираль. Такая молекула назы-
вается тропоколлаген (рис. 3.3).
Третичная структура — соединение
в пространстве молекул тропоколлагена между собой по горизонтали: «голова» к
|
«хвосту». |
Рис. 3.2. Первичная структура -цепи коллагена |
|
Четвертичная структура — ассоци- |
|
|
ация между собой молекул тропоколлагена, |
|
|
имеющих третичную структуру, по вертика- |
|
|
ли: в виде «лестницы». Каждая «ступенька» |
|
|
такой лестницы смещена относительно со- |
седней на 1/4 своей длины. В образующиеся в ходе такого сдвига пустоты в костной ткани и в твердых тканях зуба откладываются кристаллы фосфата кальция, которые стано-
вятся центром нуклеации (ядром) для роста кристаллов гидроксиапатита.
Синтез коллагена. Полипептидные цепи синтезируются на полисомах в виде препроколлагена («пре» указывает на наличие сигнального, лидирующего пептида; «про» — на наличие дополнительных пептидов на N- и С-концах). Затем начинается процессинг препроколлагена (табл. 3.2).
|
Таблица 3.2 |
||||
|
Порядок и локализация процессинга препроколлагена |
||||
|
Внутриклеточно |
Внеклеточно |
|||
|
1. |
Удаление сигнального пептида |
1. |
Удаление дополнительных пептидов |
|
|
2. |
Гидроксилирование ПРО и ЛИЗ |
2. |
Образование коллагеновых волокон с попе- |
|
|
3. |
Гликозилирование ОН-ЛИЗ |
речной исчерченностью |
||
|
4. |
Образование внутри- и межцепочечных |
3. |
Окислительное дезаминирование ε- |
|
|
S-S связей в дополнительных пептидах |
аминогрупп ЛИЗ и ОН-ЛИЗ с образованием |
|||
|
5. |
Образование тройной спирали |
альдегидных групп |
||
|
4. |
Образование поперечных связей в коллаге- |
|||
|
новых волокнах |
Разрушается коллаген коллагеназами и лизосомными ферментами — протеиназами и гликозидазами. О «возрасте» коллагена можно судить по количеству поперечных ковалентных связей в коллагеновых волокнах: чем «моложе» коллаген, тем меньше поперечных связей, тем легче и быстрее он разрушается, и наоборот.
Эластин. Молекула эластина состоит из двух типов фрагментов, чередующихся вдоль цепи: гидрофобные (фибриллярные) сегменты, которые ответственны за эластические свойства молекулы и глобулярные сегменты, богатые АЛА и ЛИЗ, имеющие форму α-спирали и участвующие в формировании поперечных связей между молекулами эластина. В отличие от
17

коллагена у эластина один генетический тип, мало ОН-ПРО, нет ОН-ЛИЗ, дополнительных пептидов, углеводов, не образуется тройная спираль. Синтезируется эластин в виде мономера, а внеклеточно происходит фибриллогенез с образованием поперечных связей с помощью аминокислоты десмозина — продукта межмолекулярной конденсации 4-х остатков ЛИЗ. Эластин — самый прочный из белков, известных в организме человека. Разрушается под действием фермента эластазы.
Фибриллярные адгезивные белки
Внеклеточный матрикс содержит большое число адгезивных неколлагеновых белков, структурной особенностью которых является наличие доменов, способных специфически связываться с другими макромолекулами и рецепторами на поверхности клетки. Непременным компонентом доменов, обеспечивающих взаимодействие с клетками, является последовательность аминокислот АРГ-ГЛИ-АСП (R-G-D).
Фибронектин — высокомолекулярный гликопротеин. Существуют множественные формы фибронектина. Одна из них — фибронектин плазмы и других биологических жидкостей. Он принимает участие в механизмах свертывания крови и заживления ран. Фибронектины тканей располагаются на поверхности клеток, образуя фибронектиновые филаменты. Фибронектин ускоряет клеточную миграцию, обеспечивая взаимодействие клеток с матриксом.
Фибриллин — структурный компонент микрофибрилл, обеспечивающих образование эластиновых волокон. Он найден в хрусталике, периосте, аорте. При мутации гена, кодирующего синтез фибриллина, развивается синдром Марфана: эктопия хрусталика, арахнодактилия («паучьи» пальцы), поражение суставов.
Ламинин и энтактин — гликопротеины базальной мембраны. Они связываются не только между собой, но и с изоколлагеном IV , гепарансульфатом, поверхностью эпителиальных клеток, причем для связывания с различными веществами имеются свои домены.
Каждый тип соединительной ткани имеет свои специфические наборы молекул: кроме соответствующих изоколлагенов, имеются и специфические неколлагеновые белки.
В хрящевой: главный ПГ (рис. 3.4) и минорные ПГ (фибромодулин — регулятор фибриллогенеза; бигликан — значение его пока неизвестно; декорин — способен связываться с изоколлагеном II и играет роль ингибитора фибринолиза; белки с разной молекулярной массой и не очень изученными функциями, из известных функций — связывание с хондроцитами, кристаллами гидроксиапатита, изоколлагеном II для его фиксации к хондроцитам).
Рис. 3.4. Схематическое строение главного протеогликана хряща
В костной: индукторы и ингибиторы остеогенеза, инициаторы минерализации — остеокальцин, остеонектин, остеопонтин, костный кислый гликопротеин, костный сиалопротеин, тромбоспондин.
18
19
Тема 4. ВВЕДЕНИЕ В ЭНЗИМОЛОГИЮ. СВОЙСТВА ФЕРМЕНТОВ
Катализатор — это вещество, которое ускоряет химическую реакцию, но само в ходе этой реакции не расходуется.
Энзим (en zyme — в дрожжах), фермент (fermentum — закваска) — термины для обозначения биологических катализаторов белковой природы.
Рибозим — это биологический катализатор рибонуклеиновой природы.
Субстратом (S) называют вещество, химические превращения которого в продукт (Р) катализирует фермент (Е).
Чтобы произошла химическая реакция, необходимы следующие условия:
1)молекулы должны сблизиться (столкнуться);
2)запас энергии молекул в момент столкновения должен быть не ниже энергетического барьера реакции.
КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ФЕРМЕНТОВ
В начале ХХ в. предложили называть ферменты по названию субстрата с добавлением суффикса -аза (amylum — амилаза, lipos — липаза, protein — протеиназа). В 1961 г. Международный Совет Биохимиков (IUB) предложил положить в основу названия и классификации ферментов тип химической реакции и ее механизм. Все ферменты разделили на 6 классов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы (синтетазы). Каждый класс состоит из 4–13 подклассов, а те в свою очередь из подподклассов.
1.Оксидоредуктазы — это ферменты, катализирующие окислительно-восстано- вительные реакции с участием двух субстратов А и В: А red + Вox Аox + Вred.
2.Трансферазы — это ферменты, катализирующие реакции межмолекулярного переноса группы Х, кроме водорода и кислорода, с субстрата А на субстрат В: А-Х + В <–>
А+ В-Х.
3.Гидролазы — это ферменты, которые катализируют расщепление внутримолеку-
лярных связей с участием воды. Например: Ацетилхолин + Н2О <–> Холин + Уксусная кислота.
4.Лиазы — это ферменты, отщепляющие группы от субстратов по негидролитическому механизму с образованием двойных связей и присоединением веществ по месту двойной связи.
5.Изомеразы катализируют превращения различных типов оптических, геометрических и позиционных изомеров.
6.Лигазы катализируют соединение двух молекул, сопряженное с разрывом пирофосфатной связи АТФ или другого макроэргического соединения.
Каждый фермент по классификации ферментов (КФ, ЕС) обозначается четырьмя цифрами (шифр фермента): 1— класс, 2 — подкласс, 3 — подподкласс, 4 — номер фермента в списке подподкласса. Так, например, КФ 2.7.1.1 означает: класс 2 (трансферазы), подкласс 7 (перенос фосфата), подподкласс 1 (алкогольная группа — акцептор фосфата). Конечное название — гексокиназа, или АТФ:D-гексоза-6-фосфотрансфераза, фермент, катализирующий перенос фосфата с АТФ на гидроксильную группу у шестого углеродного атома глюкозы.
СТРОЕНИЕ ФЕРМЕНТА
По сложности строения белковой молекулы выделяют простые (однокомпонентные) ферменты, состоящие только из белковой части, и сложные (двухкомпонентные) ферменты, имеющие кроме белковой части (апофермента) и небелковую часть (кофермент). В этом случае сложный фермент часто называют холофермент.
Кофермент часто называют кофактором или простетической группой. Отличие заключается в характере связывания с апоферментом. Кофермент связывается с ним некова-
20
Соседние файлы в папке Всякое
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #

