Цели урока:
- Сформулировать знания учащихся о
пространственном строении алканов. - Продолжить формировать понятия о гомологах.
- Рассмотреть химические свойства алканов,
показать взаимосвязь между строением и
свойствами. - Продолжить формирование умений анализировать,
сравнивать, делать выводы; развить навыки
культуры общения.
Тип урока: сообщение новых знаний.
Вид урока: лекция + элементы беседы.
Оборудование:
- Шаростержневая и объёмная модели молекулы
метана. - Таблицы:
- “Строение метана”;
- “Строение этана и бутана”;
- Кодограмма “Хлорирование метана”.
ХОД УРОКА
I. Организационный момент
II. Сообщение новых знаний
Знакомство с планом новой темы:
- Особенности пространственного строения
предельных углеводородов. - Анализ химических связей алканов.
- Химические свойства.
- Зависимость свойств предельных углеводородов
от их строения, характера химических связей.
III. Изложение лекционного материала учителем
в соответствии с планом
Современные представления о строении вещества
не сводятся только к установлению порядка
соединений атомов, но также включают
рассмотрение пространственного строения
молекул и электронной природы химических связей.
Предлагается написать молекулярную,
электронную, структурную формулы метана,
выяснить, что они показывают.
СН4 – молекулярная формула
(качественный, количественный состав);
–
электронная формула (ковалентная полярная
связь);
–
структурная формула (порядок соединения атомов в
молекуле).
Но данные формулы не отражают истинного
строения молекул метана. Молекула метана не
имеет плоского строения, как можно представить
на основании структурной формулы.
IV. Работа с моделями молекулы метана
Молекула метана в действительности имеет форму
тетраэдра. Тетраэдр – это пирамида, в основании
которой лежит равносторонний треугольник. В
центре тетраэдра находится атом углерода, а все
его четыре валентности направлены к вершинам
тетраэдра. Физическими методами исследования
установлено, что валентные углы равны 109о28′.
Учащимся предлагаются проблемные вопросы:
- Почему молекула метана имеет такую
пространственную форму? - Чем объясняется направление валентных связей
атома углерода от центра к вершинам тетраэдра?
Ответ следует искать в электронном строении
атома углерода и молекулы метана.
С 1S2 2S2 2P2
––> C
* 1S2 2S1 2P3
(основное
состояние) (возбужденное
состояние)
Так как на втором энергетическом уровне
Р-подуровне есть свободная орбиталь, то на неё
переходит один из 2S2-электронов. В
результате этого атом углерода в возбуждённом
состоянии имеет четыре неспаренных электрона,
т.е. становится четырёхвалентным.
(негибридные электронные
облака) (гибридные электронные
облака)
Облака всех четырёх валентных электронов атома
углерода выравниваются, становятся одинаковыми.
При этом они принимают форму вытянутых в
направлении к вершинам тетраэдра восьмёрок.
Явление, при котором происходит смешение и
выравнивание по форме и энергии электронных
облаков, называется гибридизацией.
Так как гибридизации подвергаются один S
и три Р-электрона, то такое состояние
называется SP3-гибридизацией.
Несимметричное распределение электронной
плотности означает, что вероятность нахождения
электрона по одну сторону от ядра больше, чем по
другую. Гибридные электронные облака вытянуты в
пространстве под углом 109о28′ к
вершинам воображаемого тетраэдра, и в этом
направлении они перекрываются с электронными
облаками атомов водорода.
Итак, молекула метана имеет тетраэдрическое
строение, что обусловлено SP3-гибридизацией
атома углерода, тетраэдрическим направлением
четырёх гибридных электронных облаков атома
углерода.
Сравнивая масштабную и шаростержневую модели
молекул метана, можно отметить, что
шаростержневая модель, появившаяся до
возникновения электронной теории, более
наглядно рассматривает строение молекулы
метана.
V. Работа с таблицами “Строение метана” и
“Строение этана и бутана”
Для активизации учащихся им предлагается
рассмотреть данные таблицы и ответить на вопросы
(анализ информации, заключённой в таблицах).
- Что общего в строении молекул метана, этана,
бутана вы видите? - Чему равны валентные углы в молекулах гомологов
метана? - Почему углеродный скелет у молекулы бутана
имеет зигзагообразную форму? - Виды химической связи в молекулах этана, бутана?
Проанализировав информацию, учащиеся делают
выводы.
Для гомологов метана характерно:
- тетраэдрическое строение атома углерода (SP3-гибридизация);
- одинаковое значение всех валентных углов;
- наличие С – С и С – Н химических связей.
VI. Анализ химических связей алканов
При рассмотрении второго вопроса плана
обращается внимание на характер С – С и С
– Н связей, являющихся ковалентными по
характеру образования. Углерод-углеродные и
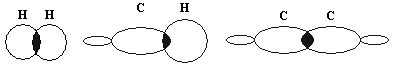
углерод-водородные связи в алканах относятся к ![]() (сигма)
(сигма)
связям.
![]() (сигма)
(сигма)
связь – это химическая связь, при образовании
которой перекрывание электронных облаков
происходит по прямой, соединяющей ядра атомов.
Эти связи разнообразны.
VII. Химические свойства алканов
Предельные углеводороды характеризуются малой
реактивной способностью. Их называют
инерционными, химически стойкими, парафинами (от
латинского parum affinis – “мало сродства”).
В данной лекции познакомимся со
взаимодействием алканов с кислородом,
галогенами, термическим разложением,
изомеризацией.
1. Горючесть алканов.
При поджигании (t = 600oС) алканы вступают в
реакцию с кислородом, при этом происходит их
окисление до углекислого газа и воды.
СnН2n+2 + O2 ––>CO2 + H2O
+ Q
например:
СН4 + 2O2 ––>CO2 + 2H2O + Q
Смесь метана с кислородом или воздухом при
поджигании может взрываться.
Наиболее сильный взрыв получается при объёмных
отношениях 1 : 2 (с кислородом) или 1 : 10 (с воздухом),
т.к. метан и кислород вступают в реакцию
полностью.
Подобные смеси опасны в каменноугольных
шахтах. Чтобы обеспечить безопасность работы в
шахтах, там устанавливают анализаторы,
сигнализирующие о появлении газа, и мощные
вентиляционные устройства.
С3Н8 + 5O2 ––>3CO2 + 4H2O
+ Q
Горение пропан-бутановой смеси можно
продемонстрировать на примере газовой
зажигалки.
При горении алканов выделяется много теплоты,
что позволяет использовать их в качестве
источника энергии. Но большая часть их
используется в качестве сырья для получения
других продуктов.
2. Разложение алканов.
СnН2n+2
C + H2
СН4
C + 2H2
С4Н10
4C + 5H2
Метан в термическом отношении более устойчив,
чем другие алканы. Причина этого в достаточной
прочности С – Н связей.
3. Реакции замещения (протекают с галогенами и
другими окислителями при определённых условиях:
свет, температура).
СН4 + Cl2
CH3Cl + HCl
СН3Cl + Cl2
CH2Cl2 + HCl (кодограмма)
СН2Cl2 + Cl2
CHCl3 + HCl
СНCl3 + Cl2
CCl4 + HCl
Механизм цепных реакций достаточно сложен,
объяснение ему было дано русским учёным Н.Н.
Семёновым, за что он в 1956 г. был удостоен
Нобелевской премии.
4. Реакции изомеризации характерны не для
всех алканов. Обращается внимание на возможность
превращения одних изомеров в другие, наличие
катализаторов.
С4Н10
C4H10
Уравнение вызывает недоумение, т.к. учащиеся не
встречались с реакциями, при которых состав
молекул не изменялся. Значит, химические реакции
могут сопровождаться не только изменением
состава веществ, но и изменением их строения, что
часто встречается в органической химии. Чтобы
выразить такое превращение, надо пользоваться
структурными формулами.
С уравнением учащиеся знакомятся
самостоятельно, работая с учебником.
VIII. Выводы
В конце лекции учащиеся записывают выводы,
вытекающие из содержания лекции, включая пункт №
4 плана. Алканы (предельные углеводороды)
характеризуются общими свойствами, на основании
которых объединяются в гомологические ряды:
- имеют общую формулу СnH2n+2;
- все атомы углерода находятся в них в состоянии SP3-гибридизации;
- имеют прочные ковалентные
 (сигма) связи;
(сигма) связи; - обладают сходными химическими свойствами,
способностью к полному, частичному, постепенному
окислению.
Свойства алканов находятся в зависимости от
электронно-пространственного строения, прочных
химических связей.
IX. Обобщение
По завершении лекции каждый учащийся заполняет
обобщающую таблицу о соответствующем гомологе
по образцу, выдаваемому учителем.
| Название вещества | Молекулярная формула | Структурная формула | Уравнения реакций | Тип реакции |
|
Метан |
СН4 |
|
СН4 + 2O2 ––> CO2 + 2H2O | Горение (полное окисление) |
| СН4 C + 2H2 |
Разложение (частичное окисление) | |||
| СН4 + Cl2 |
Замещение (постепенное окисление) |
Выводы и обобщающая таблица являются кратким
конспектом лекции.
X. Первичная проверка усвоения темы урока
После подведения итогов проводится небольшой
тест.
1. Укажите ошибочное определение алканов:
а) предельные углеводороды;
б) карбоциклические соединения (в молекулах
имеются циклы);
в) насыщенные углеводороды;
г) парафиновые углеводороды.
2. Общая формула алканов:
а) СnH2n;
б) СnH2n+1;
в) СnH2n+2;
г) СnН2n-2.
3. Признаки, характеризующие строение алканов:
а) SP3-гибридизация, плоская форма
молекул ![]() 120о,
120о, ![]() и
и ![]() -связи;
-связи;
б) SP-гибридизация, линейная форма молекул ![]() 180о,
180о, ![]() и
и ![]() -связи;
-связи;
в) SP3-гибридизация, форма молекул –
тетраэдр ![]() 109о28′,
109о28′,
![]() -связи.
-связи.
4. Невозбуждённый атом углерода имеет
электронную конфигурацию:
а) 1S22S12P3;
б) 1S22S22P2;
в) 1S22S22P3;
г) 1S22S22P4.
5. Возбужденный атом углерода имеет электронную
конфигурацию:
а) 1S22S22P3;
б) 1S22S22P2;
в) 1S22S22P4;
г) 1S22S12P3.
6. Всем алканам присущи свойства:
а) вступать в реакцию замещения;
б) окисляться при обычных условиях;
в) гореть в кислороде;
г) реагировать с активными металлами.
7. Найдите ошибку.
а) Все алканы – химически активные вещества.
б) Для алканов характерны реакции присоединения.
в) Алканы окисляются с трудом при высоких
температурах кислородом воздуха.
г) Для алканов характерны реакции с разрывом—
связи С – С и С – Н.
Учитель предлагает варианты правильных
ответов, учащиеся проводят самоконтроль.
КОНТРОЛЬНАЯ РАБОТА № 1 по теме: «АЛКАНЫ» (10 класс)
Вариант 1
ЧАСТЬ А
При выполнении заданий этой части для каждого задания (А1 – А10) запишите
цифру, которая соответствует номеру выбранного вами ответа.
Задание A1
Общая формула циклоалканов
1) С
n
H
2n–6
2) C
n
H
2n–2
3) C
n
H
2n
4) C
n
H
2n+2
Задание A2
Название углеводорода, формула которого C
5
H
12
1) этан
2) пентан
3) бутан
4) пропан
Задание A3
Изомером октана является:
1) 2,3-диметилгептан;
2) 2,3-диметилбутан;
3) 2,3-диметилпентан;
4) 2,3-диметилгексан.
Задание A4
Молекулярная формула бутана
1) СH
4
2) C
3
H
6
3) C
4
H
10
4) C
4
H
8
Задание A5
Гомологом 2,4—диметилоктана является:
1) 2,5-диметилгептан;
2) 3,3-диметилбутан;
3) 2,3-диметилпентан;
4) 2,4-диметилгексан.
Задание A6
Процесс разложения углеводородов нефти на более летучие вещества называется
1) крекинг
2) дегидрирование
3) гидрирование
4) дегидратация
Задание A7
Пропан реагируют
1) с водой
2) с раствором KMnO
4
3) с водородом
4) с хлором
Задание A8
Сумма коэффициентов в уравнении реакции полного сгорания этана равна
1) 10
2) 9
3) 19
4) 16
Задание A9
Известно термохимическое уравнение горения метана CH
4
+ 2O
2
→ CO
2
+2H
2
O + 896
кДж. Какое количество метана расходуется при выделении 89,6 кДж теплоты?
1) 0,1 моль
2) 0,2 моль
3) 0,25 моль
4) 0,5 моль
Задание A10
Реакция горения алкана
1) 2C
3
H
6
+ 9О
2
→6 CО
2
+6 H
2
О
2) 2С
2
H
2
+5О
2
→ 4CО
2
+ 2H
2
О
3) C
3
H
8
+ 5О
2
→ 3CО
2
+4 H
2
О
4) С
2
H
4
+3О
2
→ 2CО
2
+ 2H
2
О
ЧАСТЬ В
Ответом к заданиям этой части (В1 – В2) является набор чисел и букв, которые
следует записать как соответствия, например: 1—А, 2—Д, 3—Г, 4—В.
Задание B1
Установите соответствие между формулой органического вещества и названием , принадлежащим ему.
ФОРМУЛА
1) СН
3
— СН — СН
2
— СН
2
— СН
3
|
СН
3
2) СН
3
— СН
2
— СН
2
— СН
2
— CH
2
— CH
3
3) СН
3
— СH — CH
3
— СН
3
|
СН
3
4) СН
3
— СН — СН — СН
2
— CH
2
— CH
3
| |
НАЗВАНИЕ ВЕЩЕСТВА НАЗВАНИЕ ВЕЩЕСТВА
А) 2 — метилбутан
Б) 2 — метилпентан
В) 2 — метил — 3 — этилгексан
Г) гексан
СН
3
С
2
Н
5
Задание B2
Установите соответствие между названием вещества и формулой его гомолога.
НАЗВАНИЕ ВЕЩЕСТВА ФОРМУЛА ГОМОЛОГА
1) циклопентан A) СН
3
|
Н
3
С − С −
СН
2
− СН
3
|
СН
3
2) 2,4-диметилгептан Б) CH
3
– CH – CH
2
– CH – CH
3
|
|
CH
3
CH
3
3) Изобутан (2—метилпропан) В) CH
2
– CH
2
|
|
CH
2
– CH
2
4) 2,2-диметилгексан Г) CH
3
– CH
2
– CH – CH
3
|
CH
3
ЧАСТЬ С
При ответе на задания этой части запишите полный ответ
Задание C1
Составьте структурную формулу органического вещества
2,2,4 – триметилгексана.
Задание C2
При полном сгорании циклического углеводорода образовался оксид углерода (IV) массой 3,52 г и
вода массой 1,44 г. Относительная плотность этого углеводорода по воздуху равна 1,448. Найдите
молекулярную формулу углеводорода.
Примерное распределение времени, отводимое
на выполнение отдельных заданий составляет:
для каждого задания части 1–1-2 минуты;
для каждого задания части 2 – 5-7 минут;
для каждого задания части 3 – до 10—12 минут.
Оценки за тестовый вариант контрольной
работы:
10 — 13 баллов – оценка «3».
14-17 баллов – оценка «4»
18-21 балл – оценка «5».
ОТВЕТЫ (Вариант 1):
СН
3
|
Н
3
С − С −
СН
2
− СН−
СН
2
− СН
3
| |
СН
3
СН
3
1.Составим схему горения неизвестного углеводорода, представив его
формулу в виде C
x
H
y
.
C
x
H
y
+ O
2
→ CO
2
+ H
2
O
2. 44 г/моль CO
2
содержит 12 г/моль C
3,52 г CO
2
содержит y г C
m(C) = 0,96 г
3. 18 г/моль H
2
O содержит 2 г/моль H
1,44 г H
2
O содержит х г H
m(H) = 0,16 г
4. ν(C) = m(C)/M(C)
ν(C) = 0,96 г/12 г/моль
ν(C) = 0,08 моль
5. ν(H) = m(H)/M(H)
ν(H) = 0,16 г/1 г/моль
ν(H) = 0,16 моль
6. ν(C): ν(H) =0,08 моль : 0,16 моль (: 0,08 моль)
C: H=1:2
CH
2
–простейшая формула углеводорода
M(CH
2
)= 12+2=14 г/моль
7. M(C
x
H
y
) = D(возд.) ×M(возд.)
M(C
x
H
y
) = 1,448 × 29 г/моль = 42 г/моль
8. . n= M(C
x
H
y
) / M(CH
2
)= 42 г/моль: 14 г/моль=3
9. C
3
H
6
формула циклического углеводорода— циклопропана.
Ответ: C
3
H
6
— циклопропан.
КОНТРОЛЬНАЯ РАБОТА № 1 по теме: «АЛКАНЫ» (10 класс)
Вариант 2
ЧАСТЬ А
При выполнении заданий этой части для каждого задания (А1 – А10) запишите
цифру, которая соответствует номеру выбранного вами ответа.
Задание A1
Общая формула алканов
1) С
n
H
2n–6
2) C
n
H
2n–2
3) C
n
H
2n
4) C
n
H
2n+2
Задание A2
Название углеводорода, формула которого C
3
H
8
1) этан
2) пропан
3) бутан
4) пентан
Задание A3
Изомером гептана является:
1) 2,3-диметилгептан;
2) 2,3-диметилбутан;
3) 2,3-диметилпентан;
4) 2,3-диметилгексан.
Задание A4
Молекулярная формула циклобутана
1) СH
4
2) C
3
H
6
3) C
4
H
10
4) C
4
H
8
Задание A5
Гомологом 2,3—диметилоктана является:
1) 2,5-диметилгептан;
2) 3,3-диметилбутан;
3) 2,3-диметилпентан;
4) 2,4-диметилгексан.
Задание A6
Способом переработки нефти и нефтепродуктов, при котором не происходят химические
реакции, является
1) перегонка
2) крекинг
3) риформинг
4) пиролиз.
Задание A7
Метан реагируют
1) с раствором KMnO
4
2) с водородом
3) с кислородом
4) с бромной водой
Задание A8
Сумма коэффициентов в уравнении реакции полного сгорания пропана равна
1) 10
2) 12
3) 13
4) 26
Задание A9
Известно термохимическое уравнение горения метана CH
4
+ 2O
2
→ CO
2
+2H
2
O + 896 кДж.
Какое количество метана расходуется при выделении 448 кДж теплоты?
1) 0,1 моль
2) 0,2 моль
3) 0,25 моль
4) 0,5 моль
Задание A10
Схеме алкан + галоген
→
соответствует уравнение реакции
1) С
2
H
4
+ Н
2
О→ C
2
H
5
ОH
2) C
3
H
4
+ 2Cl
2
→ C
3
H
4
Cl
4
3) C
3
H
6
+ Вr
2
→ C
3
H
4
Вr
2
4) С
2
H
6
+ 2Cl
2
→ C
2
H
5
Cl+ HCl
ЧАСТЬ В
Ответом к заданиям этой части (В1 – В2) является набор чисел и букв, которые
следует записать как соответствия, например: 1—А, 2—Д, 3—Г, 4—В.
Задание B1
Установите соответствие между формулой алкана и названием, принадлежащим ему.
ФОРМУЛА
1) СН
3
— СН
2
— СН — СН — CH
2
— CH
3
| |
С
2
Н
5
СН
3
2) Н
3
С − СН
2
− СН
3
3) СН
3
— СН — CH
2
— СН
3
|
СН
3
4) СН
3
— СН
2
— СН — СН
2
— CH
3
|
С
2
Н
5
НАЗВАНИЕ ВЕЩЕСТВА НАЗВАНИЕ ВЕЩЕСТВА
А) пропан
Б) 3 — этилпентан
В) 3 — метил — 4 — этилгексан
Г) 2 — метилбутан
Задание B2
Установите соответствие между названием вещества и формулой его изомера.
НАЗВАНИЕ ВЕЩЕСТВА ФОРМУЛА ИЗОМЕРА
1) 2-метилпропан A) СН
3
|
Н
3
С − С −
СН
2
− СН
3
|
СН
3
2) 2,2-диметилгептан Б) CH
3
– CH – CH
2
– CH – CH
2
– CH
2
– CH
3
|
|
CH
3
CH
3
3) 2,3-диметилпентан В) CH
3
– CH
2
–CH
2
–CH
3
4) гексан Г) CH
3
– CH
2
– CH – CH
2
–CH
2
–CH
3
|
CH
3
ЧАСТЬ С
При ответе на задания этой части запишите полный ответ
Задание C1
Составьте структурную формулу органического вещества
2 – метил —3— этилпентана.
Задание C2
При полном сгорании углеводорода образовался оксид углерода (IV) массой 0,88 г и вода
массой 0,54 г. Относительная плотность этого углеводорода по водороду равна 15.
Найдите молекулярную формулу углеводорода.
Примерное распределение времени, отводимое
на выполнение отдельных заданий составляет:
для каждого задания части 1–1-2 минуты;
для каждого задания части 2 – 5-7 минут;
для каждого задания части 3 – до 10—12 минут.
Оценки за тестовый вариант контрольной
работы:
10 — 13 баллов – оценка «3».
14-17 баллов – оценка «4»
18-21 балл – оценка «5».
ОТВЕТЫ (Вариант 2):
СН
3
— СН
2
— СН — СН — CH
3
| |
С
2
Н
5
СН
3
1.Составим схему горения неизвестного углеводорода, представив его
формулу в виде C
x
H
y
.
C
x
H
y
+ O
2
→ CO
2
+ H
2
O
2. 44 г/моль CO
2
содержит 12 г/моль элемента C
0,88 г CO
2
содержит y г элемента C
m(C) = 0,24 г
3. 18 г/моль H
2
O содержит 2 г/моль элемента H
0,54 г H
2
O содержит х г элемента H
m(H) = 0,06 г
4. ν(C) = m(C)/M(C)
ν(C) = 0,24 г/12 г/моль
ν(C) = 0,02 моль
5. ν(H) = m(H)/M(H)
ν(H) = 0,06 г/1 г/моль
ν(H) = 0,06 моль
6. ν(C): ν(H) =0,02 моль : 0,06 моль
C: H=1:3
CH
3
–простейшая формула углеводорода
M(CH
3
)= 12+3=15 г/моль
7. M(C
x
H
y
) = D(H
2
) ×M(H
2
)
M(C
x
H
y
) = 15 × 2 г/моль = 30 г/моль
8. . n= M(C
x
H
y
) / M(CH
3
)= 30 г/моль: 15 г/моль=2
9. C
2
H
6
формула углеводорода, имеющего название этан.
Ответ: C
2
H
6
— этан.
Тест по теме:
«Химические свойства
и способы получения алканов»
10 класс
Ефимова Людмила Владимировна
учитель химии
МБОУ СОШ №89 г.Краснодара
I вариант
1. Для предельных углеводородов характерны реакции:
а) горение, б) замещения, в) присоединения. г) нейтрализации?
2. Дана цепочка превращений
1 2 3
С2Н6 → С2Н5Cl → С4Н10 → CO2:
вторая реакция называется а) Коновалова, б) Вюрца, в) Семенова.
Составьте уравнение всех реакций
3. Какое соединение используется для получения метана в лаборатории:
а) СНзСООН, б) СН3ОН, в) СН3С1, г) СH3СООNа
Составьте уравнение этой реакции.
4. Массовые доли углерода и водорода в углеводороде равны соответственно
92,31% и 7,69%. Плотность его паров по водороду составляет 39. Число
атомов водорода в молекуле равно а) 12; б) 6; в) 14.
II вариант
1. Какие из перечисленных химических свойств характерны для метана:
а) гидрирование, б) изомеризация, в) горение, г) каталитическое окисление?
2. В результате следующих превращений
Cl2 hl Na
СН4 → Х1 → Х2
образуется конечный продукт (Х2)
а) пропан, б) хлорэтан, в) этан, г) хлорметан?
Напишите уравнение всех реакций.
3. Укажите, какое соединение используется для получения этана (по реакции
Вюрца): а) С2Н4, б) СН3I, в) СН3 — О — СН3, г) С2Н5ОН?
Составьте уравнение реакции.
4. Массовая доля углерода в циклоалкане составляет 85,71%. Относительная
плотность его паров по воздуху равна 1,931. Число атомов углерода в
молекуле циклоалкана равно
а) 4; б) 2; в) 6 .
III вариант
1. Укажите, какие из перечисленных реакций характерны для бутана:
а) присоединение, б) крекинг, в) изомеризация, г) дегидрирование. Составьте уравнения этих реакций.
2. По какой реакции можно получить в лаборатории метан:
а) СН3ОН + Н2→ б) СН3Вг + Nа→
в) СаС2 + Н20 → г) А14С3 + Н20 →
- Укажите условия, которые необходимы для начала реакции между этаном и хлором: а) охлаждение, б) нагревание, в) повышение давления, г) освещение. Составьте уравнение соответствующей реакции.
- Массовые доли углерода и водорода в углеводороде равны соответственно 92,31% и 7,69%. Плотность его паров по водороду составляет 39. Число атомов водорода в молекуле вещества равно а) 12; б) 6; в) 14.
IV вариант
1. Определите, с какими из приведенных веществ и при каких условиях
взаимодействует метан:
а) гидроксид натрия, б) бром, в) азотная кислота, г) кислород.
2. Дана цепочка превращений
1 2 3
СН4 → СН3Вг → С2Н6 → С2Н5NO2
третья реакция называется реакцией:
а) Вюрца, б) Коновалова, в) Семёнова? Составьте уравнения всех реакций.
- Укажите продукт полного хлорирования метана: а) хлороформ, б) хлорметан, в) дихлорметан, г) тетрахлорметан. Составьте уравнение соответствующей реакции.
4. Найдите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 90%. Относительная плотность его по водороду равна 20. а) С5Н8, б) С3Н4. в) С3Н8.
Алканы. Тематические тесты для подготовки к ЕГЭ.
Алканы. Тестовые задания с выбором двух вариантов ответа.
Задание №1
Выберите два утверждения, справедливые для метана:
1) является гомологом пентана
2) при нормальных условиях является жидкостью
3) может быть получен гидролизом карбида кальция
4) является основным компонентом природного газа
5) может быть получен сплавлением пропионата калия с твердой щелочью
Решение
Ответ: 14
Задание №2
Выберите два утверждения, которые справедливы и для этана, и для пентана:
1) являются изомерами друг друга
2) все атомы углерода в молекулах находятся в состоянии sp2— гибридизации
3) могут образоваться в результате взаимодействия моногалогеналканов с металлическим натрием
4) все связи в молекулах ковалентные
5) являются основными компонентами природного газа.
Решение
Ответ: 34
Задание №3
Выберите два свойства, которые характерны для всех алканов с длиной углеродной цепи менее 15 углеродных атомов:
1) не имеют запаха
2) встречаются в природе
3) имеют изомеры
4) имеют гомологи
5) общая формула CnH2n
Решение
Ответ: 24
Задание №4
Выберите два утверждения, которые не справедливы для этана
1) молекула имеет плоское строение
2) все атомы связаны только σ-связями
3) входит в состав природного газа
4) может быть получен из карбида алюминия
5) не имеет запаха
Решение
Ответ: 14
Задание №5
Выберите два утверждения, справедливые и для гексана, и для гептана:
1) являются жидкостями при нормальных условиях
2) входят в состав нефти
3) могут быть получены гидрированием циклогексана и метилциклогексана соответственно
4) являются изомерами друг друга
5) содержат σ и π-связи в молекуле.
Решение
Ответ: 12
Задание №6
Выберите два утверждения, которые справедливы для пропана:
1) может быть получен гидрированием пропилена
2) является изомером пентана
3) плохо растворим в воде
4) образуется при декарбоксилировании пропионата калия
5) используется для получения полиэтилена
Решение
Ответ: 13
Задание №7
Выберите два утверждения, справедливые как для пропана, так и для гексана
1) относятся к непредельным углеводородам
2) имеют линейное строение молекулы
3) все атомы углерода находятся в состоянии sp3-гибридизации.
4) при нормальных условиях жидкости
5) являются гомологами метана
Решение
Ответ: 35
Задание №8
Выберите два свойства, которые характерны для всех алканов:
1) невозможность геометрической изомерии
2) хорошая растворимость в воде
3) могут быть получены в реакциях дегидрирования
4) входят в состав нефти и природного газа
5) все связи в молекуле ковалентные полярные
Решение
Ответ: 14
Задание №9
Для алканов характерно
1) наличие межклассовых изомеров
2) плохая растворимость в воде
3) могут быть получены в реакции нитрования
4) не входят в состав нефти
5) имеют общую формулу гомологического ряда CnH2n+2
Решение
Ответ: 25
Задание №10
Из перечисленных способов выберите два таких, которыми может быть получен пропан:
1) взаимодействие хлорэтана с металлическим натрием
2) гидрирование циклопропана
3) электролиз водного раствора пропаноата калия
4) крекинг гептана
5) гидролиз карбида алюминия.
Решение
Ответ: 24
[adsp-pro-3]
Задание №11
Выберите два способа, которыми нельзя получить бутан:
1) взаимодействие хлорэтана с металлическим натрием
2) гидратация бутена-1
3) электролиз водного раствора пропаноата калия
4) крекинг гептана
5) сплавление пропионата калия с гидроксидом калия
Решение
Ответ: 25
Задание №12
Из предложенного перечня веществ выберите два таких, с которыми реагирует метан:
1) водород
2) натрий
3) азотная кислота
4) пропан
5) бром
Решение
Ответ: 35
Задание №13
Из предложенного перечня, выберите два таких типа реакций, в которые могут вступать все алканы:
1) горения
2) обмена
3) разложения
4) присоединения
5) изомеризации
Решение
Ответ: 13
Задание №14
Из предложенного перечня реакций, выберите две таких, в которые может вступать как метан, так и бутан:
1) окисление раствором перманганата калия
2) дегидрирование
3) изомеризация в присутствии AlCl3
4) горение на воздухе
5) гидролиз
Решение
Ответ: 24
Задание №15
Из предложенного перечня реакций, выберите две таких, в которые может вступать бутан:
1) гидролиз
2) крекинг
3) гидрирование
4) гидратация
5) изомеризация
Решение
Ответ: 25
Задание №16
Из предложенного перечня выберите две пары таких реагентов, с каждым из которых реагирует этан:
- 1. O2, KMnO4
- 2. Cl2, O2
- 3. HNO3, Br2
- 4. HCl, HNO3
- 5. Cl2, H2
Решение
Ответ: 23
Задание №17
Из предложенного перечня реакций выберите две такие, в которые может вступать гексан:
1) крекинг
2) присоединение
3) гидратация
4) дегидроциклизация
5) гидролиз
Решение
Ответ: 14
Задание №18
Реакция пропана с хлором является
1) экзотермической
2) замещения
3) эндотермической
4) каталитической
5) разложения
Решение
Ответ: 12
Задание №19
Из предложенного перечня выберите два утверждения справедливые для гептана:
1) при нормальных условиях является газом
2) при дегидроциклизации из него образуется толуол
3) присоединяет воду
4) не вступает в реакцию с раствором азотной кислоты
5) при нагревании подвергается крекингу
Решение
Ответ: 25
Задание №20
Как метан, так и бутан могут вступать в реакции
1) окисления раствором дихромата калия
2) гидрогалогенирования
3) изомеризации в присутствии AlCl3
4) замещения с азотной кислотой
5) каталитического окисления кислородом воздуха
Решение
Ответ: 45
[adsp-pro-3]
Задание №21
Из предложенного перечня утверждений, выберите два таких, которые справедливы для алканов:
1) алканы хорошо растворимы в воде
2) при ароматизации гексана образуется бензол
3) во всех реакциях разложения алканов получается сажа
4) алканы вступают в реакцию с бромной водой
5) алканы можно получить из алкенов
Решение
Ответ: 25
Задание №22
Выберите утверждения верные для пропана
1) входит в состав природного газа
2) может быть получен дегидрированием пропена
3) реагирует с бромоводородной кислотой
4) хорошо растворим в воде
5) может быть получен гидрированием циклопропана
Решение
Ответ: 15
Задание №23
Из предложенного перечня утверждений выберите два таких, которые справедливы для метана:
1) обесцвечивает водный раствор перманганата калия
2) является основным компонентом природного газа
3) степень окисления углерода в молекуле равна +4
4) температура разложения метана до простых веществ составляет 15000С
5) атомы углерода находятся в состоянии sp3-гибридизации.
Решение
Ответ: 25
Задание №24
Из предложенного перечня реакций выберите две такие, с помощью которых может быть получен алкан:
1) взаимодействие моногалогеналканов с щелочью
2) взаимодействие моногалогеналканов с натрием
3) взаимодействие алкадиенов с водородом
4) дегидратация этанола
5) дегидрирование циклогексана
Решение
Ответ: 23
Задание №25
Пропан в отличие от гексана
1) в обычных условиях представляет собой жидкость
2) является гомологом метана
3) не имеет изомеров
4) не вступает в реакции дегидроциклизации
5) вступает в реакцию с раствором азотной кислоты
Решение
Ответ: 34
Задание №26
Реакции галогенирования алканов протекают
1) при ярком освещении
2) в присутствии катализатора
3) в присутствии серной кислоты
4) с образованием только одного галогенпроизводного
5) по радикальному механизму
Решение
Ответ: 15
Задание №27
Гексан в отличие от пропана
1) реагирует с водородом
2) имеет запах
3) может быть в одну стадию превращен в бензол
4) вступает в реакцию замещения с хлором
5) горит на воздухе
Решение
Ответ: 23
Задание №28
Реакция бромирования пропана
1) относится к реакциям присоединения
2) может протекать при нагревании
3) относится к каталитическим процессам
4) протекает преимущественно с образованием 2-бромпропана
5) протекает преимущественно с образованием 1-бромпропана
Решение
Ответ: 24
Задание №29
Из предложенного перечня утверждений выберите два таких, которые справедливы и для бутана, и для этана:
1) растворимы в воде
2) могут быть получены крекингом алканов
3) вступают в реакцию обмена с хлором
4) вступают в реакцию гидратации
5) входят в состав природного газа
Решение
Ответ: 25
Задание №30
Метан в отличие от гексана
1) плохо растворим в воде
2) не имеет запаха
3) при каталитическом окислении образует метаналь
4) вступает в реакцию нитрования
5) имеет плоское строение молекул
Решение
Ответ: 23
[adsp-pro-3]
Задание №31
Реакция галогенирования пропана:
1) является реакцией замещения, протекает по ионному механизму
2) является реакцией замещения, протекает по радикальному механизму
3) является эндотермической
4) протекает в присутствии платины, как катализатора
5) приводит к образованию смеси галогенпроизводных
Решение
Ответ: 25
Задание №32
Метан в отличие от бутана
1) при каталитическом окислении образует метанол
2) при каталитическом окислении образует уксусную кислоту
3) сгорает с образованием углекислого газа и воды
4) имеет запах
5) является основным компонентом природного газа
Решение
Ответ: 15
Задание №33
Бутан, в отличие от этана
1) при нормальных условиях представляет собой жидкость
2) при дегидрировании способен образовывать как алкен, так и алкадиен
3) способен вступать в реакцию присоединения с хлором
4) может вступать в реакцию изомеризации
5) реагирует с гидроксидом натрия
Решение
Ответ: 24
Задание №34
Бутан, также как и этан
1) хорошо растворим в воде
2) может быть получен из моногалогеналкана его взаимодействием с активным металлом
3) вступает в реакцию присоединения с хлором
4) вступает в реакцию с разбавленной азотной кислотой при нагревании
5) реагирует с хлороводородом
Решение
Ответ: 24
Задание №35
Реакция бутана с хлором
1) относится к реакциям соединения
2) экзотермическая
3) начинается с разрыва связи в молекуле хлора
4) протекает в присутствии воды
5) протекает по ионному механизму
Решение
Ответ: 23
Задание №36
Для пропана характерны
1) реакция окисления подкисленным раствором дихромата калия
2) реакции отщепления водорода
3) реакция изомеризации
4) взаимодействие со спиртовым раствором щелочи
5) реакция с хлором при освещении
Решение
Ответ: 25
Задание №37
Для этана верны утверждения
1) газ с неприятным запахом
2) используется для получения этилена
3) образуется при электролизе водного раствора этаноата натрия
4) при его галогенировании образуется метилхлорид
5) обесцвечивает бромную воду
Решение
Ответ: 23
Задание №38
Гомологами этана являются
1) 2-метилпропан
2) метан
3) 2,2-диметилбутан
4) пентан
5) этен
Решение
Ответ: 24
Задание №39
При галогенировании этана, возможно образование продуктов
1) хлорэтан
2) хлорэтен
3) 1,1-дибромэтан
4) 2,2-дихлорэтан
5) хлорметан
Решение
Ответ: 13
Задание №40
Структурным изомером гептана является
1) метилциклогексан
2) 2,3-диметилпентан
3) 2,3-диметилбутен-2
4) 2,5-диметилгексан
5) 2-метилгексан
Решение
Ответ: 25
[adsp-pro-3]
Задание №41
Из предложенного перечня выберите два углеводорода, содержание которых в природном газе является наибольшим:
1) бутан
2) пентан
3) гексан
4) этан
5) этен
Решение
Ответ: 14
Задание №42
Из предложенного перечня веществ выберите два с наименьшей температурой кипения:
1) пентан
2) пропан
3) гексан
4) метан
5) октан
Решение
Ответ: 24
Задание №43
К реакции замещения относится
1) нитрование
2) дегидрирование
3) галогенирование алканов
4) пиролиз
5) крекинг
Решение
Ответ: 13
Задание №44
Бромэтан можно получить
1) взаимодействием этана с бромом на свету
2) взаимодействием этана с бромоводородной кислотой
3) реакцией этана с раствором бромной воды
4) реакцией гидрогалогенирования этена
5) взаимодейстием дибромэтана с раствором щелочи
Решение
Ответ: 14
Задание №45
Реакцией, приводящей к укорачиванию углеродной цепи является
1) реакция декарбоксилирования солей карбоновых кислот при сплавлении со щелочами
2) крекинг алканов
3) разложение солей карбоновых кислот и щелочноземельных металлов при нагревании
4) реакция нитрования
5) дегидрирование алканов
Решение
Ответ: 12
Задание №46
При дегидроциклизации октана могут образоваться
1) толуол
2) 1,2- диметилбензол
3) бутан и бутен
4) этилбензол
5) октен
Решение
Ответ: 24
Задание №47
Структурными изомерами н-гексана являются
1) пентан
2) 2,2-диметилбутан
3) 2,2-диметилпропан
4) гептан
5) 3-метилпентан
Решение
Ответ: 25
Задание №48
Выберите два утверждения, которые справедливы для характеристики реакции пропана с хлором:
1) приводит к преимущественному образованию 2-хлорпропана
2) начинается с разрыва связей в молекуле пропана
3) происходит в присутствии катализатора
4) протекает по ионному механизму
5) протекает по радикальному механизму
Решение
Ответ: 15
Задание №49
Выберите два утверждения, которые справедливы для характеристики реакции метана с хлором:
1) относится к реакциям соединения
2) единственным продуктом реакции является хлорметан
3) идет по радикальному механизму
4) при ярком освещении
5) является эндотермической
Решение
Ответ: 34
Задание №50
Выберите два утверждения, которые справедливы для характеристики реакции метана с хлором:
1) относится к реакциям разложения
2) протекает с образованием различных хлорпроизводных
3) идет по ионному механизму
4) реакция протекает и в темноте
5) является экзотермической
Решение
Ответ: 25
[adsp-pro-3]
Задание №51
Выберите два утверждения, которые справедливы для характеристики реакции метана с хлором:
1) начинается с разрыва связей в молекуле метана
2) протекает с образованием только хлорэтана
3) идет по ионному механизму
4) является не каталитическим процессом
5) начинается с разрыва связей в молекуле хлора
Решение
Ответ: 45
Задание №52
Выберите два утверждения, которые справедливы для характеристики реакции 2-метилпропана с хлором:
1) протекает по правилу Марковникова
2) с промежуточным образованием частицы карбкатиона (СН3-СН+-СН3)
3) включает последовательно стадии: начало, развитие и обрыв цепи
4) протекает при условии яркого освещения в начале реакции
5) протекает по правилу Зайцева
Решение
Ответ: 34
Задание №53
Выберите два утверждения, которые справедливы для характеристики реакции метана с хлором:
1) начинается с разрыва связи между атомами углерода
2) протекает по радикальному механизму
3) включает последовательно стадии: начало, развитие и разрыв цепи
4) является окислительно-восстановительной
5) является каталитической
Решение
Ответ: 24
Задание №54
Выберите два утверждения, в которых приведены реакции, протекающие по радикальному механизму:
1) метана и хлора
2) пропена и хлороводорода
3) этана и азотной кислоты
4) этена и бромной воды
5) дегидрирование этана
Решение
Ответ: 13
Задание №55
По радикальному механизму протекают реакции
1) С3Н6 + Н2O = С3Н7ОН
2) СН4 + Сl2 = СН3Сl + НСl
3) С2Н6 + HNO3 = C2H5NO2 + H2O
4) С2Н2 + Н2O = СН3СНО
5) С2Н6 → С2Н4 + Н2
Решение
Ответ: 23
Задание №56
Из предложенного перечня выберите соответственно стадии развития и обрыва цепи, протекающие при хлорировании метана:
1) Сl2 → 2Сl•
2) СН4 → СН3 + Н•
3) Сl• + СН4 → НСl + СН3•
4) СН4 → С + 4Н
5) СН3• + Cl• → СН3Сl
Решение
Ответ: 35
Задание №57
Из предложенного перечня выберите два процесса, которые не протекают при хлорировании метана:
1) СН4 → СН3• + Н•
2) Сl2 → 2Сl•
3) Сl• + СН4 → НСl + СН3•
4) СН4 → С + 4Н•
5) СН3• + Cl• → СН3Сl
Решение
Ответ: 14
Задание №58
В одну стадию бутан можно получить из
1) пропионата натрия
2) бутанола-2
3) циклобутана
4) масляной кислоты
5) ацетата натрия
Решение
Ответ: 13
Задание №59
Выберите два вещества, которые являются гомологами 2-метилбутана
1) пентан
2) 2-метилгептан
3) 2-метилпропан
4) 2,2-диметилпропен
5) 1,1-диметилциклопропан
Решение
Ответ: 23
Задание №60
Выберите два утверждения, которые верны для алканов:
1) не содержатся в природе
2) окисляются раствором перманганата калия
3) реагируют с бромом
4) вступают в реакции замещения по ионному механизму
5) вступают в реакции замещения по радикальному механизму
Решение
Ответ: 35
[adsp-pro-3]
Алканы. Задания на установление соответствия.
Задание №1
Установите соответствие между формулой алкана и его структурным изомером
| АЛКАН | ИЗОМЕР АЛКАНА |
|
А) пентан Б) 2-метилбутан В) 2,2,3-триметилбутан Г) пропан |
1) 2,3,4-триметилпентан 2) бутан 3) 2,2,3-триметилпентан 4) 2,2-диметилпропан 5) 2,2-диметилпентан 6) изомеры отсутствуют |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 4456
Задание №2
Установите соответствие между формулой алкана и реакцией, в которой он может быть получен: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АЛКАН | СПОСОБ ПОЛУЧЕНИЯ |
|
А) метан Б) этан В) пентан |
1) декарбоксилирование бутаноата калия 2) электролиз раствора этаноата калия 3) кислотный гидролиз карбида алюминия 4) взаимодействие 1-хлорпропана и этилхлорида с натрием 5) гидрирование метилциклопропана |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 324
Задание №3
Установите соответствие между формулой алкана и основным продуктом его взаимодействия с хлором в молярном соотношении 1 к 2 соответственно: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АЛКАН | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
|
А) пропан Б) 2,2-диметилбутан В) этан Г) 2,3-диметилбутан |
1) 2,2-диметил-1,1-дихлорбутан 2) 2,2-дихлорпропан 3) 1,1-дихлорэтан 4) 3,3-диметил-2,2-дихлорбутан 5) 2,3-диметил-2,3-дихлорбутан 6) 1,2-дихлорэтан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 2435
Задание №4
Установите соответствие между формулой алкана и основным продуктом его взаимодействия с раствором азотной кислоты: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АЛКАН | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
|
1) пропан 2) 2-метилпропан 3) 2,2-диметилпропан 4) 2,2-диметилбутан |
1) 2-нитро-3,3-диметилбутан 2) 1-нитро-2,2-диметилбутан 3) 2-нитро-2-метилпропан 4) 2-нитропропан 5) 1-нитропропан 6) 1-нитро-2,2-диметилпропан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 4361
Задание №5
Установите соответствие между формулой алкана и возможным продуктом его дегидрирования: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| АЛКАН | ПРОДУКТ ДЕГИДРИРОВАНИЯ |
|
А) гексан Б) 2-метилгексан В) гептан Г) этан |
1) этин 2) этилциклогексан 3) бензол 4) о-ксилол 5) этилен 6) толуол |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 3665
[adsp-pro-3]
Задание №6
Установите соответствие между формулой алкана и возможным продуктом его дегидрирования: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АЛКАН | ПРОДУКТ ДЕГИДРИРОВАНИЯ |
|
А) метан Б) пропан В) гептан Г) бутан |
1) бутин-2 2) этин 3) бензол 4) пропен 5) дивинил 6) толуол |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 2465
Задание №7
Установите соответствие между моногалогеналканом и продуктом его взаимодействия с металлическим натрием: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГЕНТ | ПРОДУКТ |
|
А) хлорэтан Б) 2-хлорпропан В) 2-хлор-2-метилпропан Г) 2-бромбутан |
1) гексан 2) бутан 3) 2,3-диметилбутан 4) октан 5) 3,4-диметилгексан 6) 2,2,3,3-тетраметилбутан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 2365
Задание №8
Установите соответствие между участниками реакции и органическим продуктом, образующимся в результате нее: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| УЧАСТНИКИ РЕАКЦИИ | ПРОДУКТ РЕАКЦИИ |
|
А) хлорэтан + хлорметан + натрий Б) 2-хлорпропан + хлорметан + калий В) 1-хлорпропан +2-хлорпропан + калий Г) 2-бромбутан + этилбромид + натрий |
1) 2-метилбутан 2) 2,2-диметилпропан 3) 3-метилпентан 4) пропан 5) 2-метилпентан 6)2-метилпропан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 4653
Задание №9
Установите соответствие между формулой соли карбоновой кислоты и органическим продуктом, который образуется при электролизе ее водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГЕНТ | ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ |
|
А) ацетат калия Б) пропионат калия В) бутаноат натрия Г) 2-метилпропионат калия |
1) гексан 2) бутан 3) 2,3-диметилбутан 4) пропан 5) этан 6) 3,4-диметилгексан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 5213
Задание №10
Установите соответствие между формулой соли карбоновой кислоты и продуктом, который образуется при сплавлении ее со щелочью: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГЕНТ | ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ |
|
А) ацетат натрия Б) пропионат калия В) 2-метилпропионат калия Г) 2,2-диметилпропионат калия |
1) 2,2-диметилпропан 2) этан 3) бутан 4) пропан 5) метан 6) 2-метилпропан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 5246
[adsp-pro-3]
Задание №11
Установите соответствие между схемой реакции и органическим продуктом, который образуется в результате нее: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ОРГАНИЧЕСКИЙ ПРОДУКТ |
|
А) метан + 3моль Сl2 → Б) метан + О2 кат→ В) бутан + HNO3 (р-р) (to)→ Г) этан + HCl → |
1) метаналь 2) хлороформ 3) хлорметан 4) хлорэтан 5) 2-нитробутан 6) реакция не возможна |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 2156
Задание №12
Установите соответствие между реакцией и органическим продуктом, который может быть в результате нее получен: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАКЦИЯ | ПРОДУКТ РЕАКЦИИ |
|
А) дегидрирование бутана Б) неполный пиролиз метана В) каталитическое окисление бутана Г) крекинг бутана |
1) этан 2) ацетилен 3) этановая кислота 4) бутадиен-1,3 5) углерод 6) метановая кислота |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 4231
Задание №13
Установите соответствие между процессом и возможным продуктом, получаемым в результате него: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ПРОЦЕСС | ПРОДУКТ |
|
А) паровая конверсия метана Б) дегидроциклизация гексана В) дегидрирование пропана Г) ароматизация октана |
1) бензол 2) циклопропан 3) синтез-газ 4) пропен 5) этилбензол 6) метилбензол |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 3145
Применение алканов. Задания с выбором трех вариантов ответа.
Задание №1
Из предложенного перечня областей применения веществ выберите три, не подходящих для метана.
1) синтез уксусной кислоты
2) получение синтез-газа
3) в реакциях синтеза полимеров
4) получение сажи
5) получение водорода
6) получение циклопропана
Решение
Ответ: 136
Задание №2
Из предложенного перечня веществ выберите три вещества, которые могут быть получены из метана в одну стадию:
1) хлороформ
2) этанол
3) формальдегид
4) этин
5) циклогексан
6) этановая кислота
Решение
Ответ: 134
Задание №3
Из предложенного перечня выберите три вещества, которые могут быть получены в одну стадию из бутана:
1) этанол
2) дивинил
3) изопрен
4) ацетилен
5) бутен
6) этановая кислота
Решение
Ответ: 256
Задание №4
Из предложенного перечня областей применения веществ выберите три, подходящих для метана.
1) синтез этановой кислоты
2) получение формальдегида
3) в реакциях синтеза каучуков
4) в качестве топлива
5) получение ацетилена
6) получение циклогексана
Решение
Ответ: 245
Цепочки на алканы.
Задание №1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения.
Al4C3 X1
X2
X3
X4
X5
X6
Решение
Задание №2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
C2H6 X1
X2
X3
X4
X5
Решение
Задание №3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
пропан 2-хлорпропан
2,3-диметилбутан
Решение
Ответ:
Задание №4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
н-бутан этан
бромэтан
бутан
изобутан
Решение
Задание №5
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
карбид алюминия метан
X1
X2
X3
C4H10
Решение
[adsp-pro-3]
Задание №6
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
Решение
Задание №7
Навеску неизвестного углеводорода массой 5,8 г сожгли в избытке кислорода. В результате образовалось 17,6 г углекислого газа. Определите молекулярную формулу углеводорода.
Решение
Ответ:
Вычислим количество углекислого газа, образующегося при горении углеводорода:
n(CO2) = m/M = 17,6 л/44 г/моль = 0,4 моль.
Поскольку при горении углеводорода (CxHy) весь углерод переходит в углекислый газ, то n(CO2) = n(C) = 0,4 моль.
Вычислим массу углерода, входящего в состав углеводорода:
m(C) = M ⋅ n = 12 г/моль ⋅ 0,4 моль = 4,8 г.
Вычислим массу и количество вещества водорода, входящего в состав углеводорода:
m(H) = m(CxHy) — m(C) = 5,8 г — 4,8 г = 1 г, n(H) = 1 г/1 г/моль = 1 моль.
Количества углерода и водорода в молекуле углеводорода соотносятся между собой как 0,4 : 1 = 2 : 5. Поскольку в молекулу предельного углеводорода входит четное число атомов водорода, тогда индексы удваиваем и записываем молекулярную формулу углеводорода в виде C4H10.
Ответ: C4H10
Задание №8
При полном сгорании навески углеводорода образовалось 1,12 л углекислого газа (н.у.) и 1080 мг водяных паров. Определите молекулярную формулу углеводорода.
Решение
Ответ:
Вычислим количество углекислого газа, образующегося при горении углеводорода:
n(CO2) = V/Vm = 1,12 л/22,4 л/моль = 0,05 моль.
Поскольку при горении углеводорода (CxHy) весь углерод переходит в углекислый газ, то n(CO2) = n(C) = 0,05 моль.
Вычислим массу углерода, входящего в состав углеводорода:
m(C) = M ⋅ n = 12 г/моль ⋅ 0,05 моль = 0,6 г.
Вычислим массу и количество вещества водорода, входящего в состав воды:
m(H2O) = m/M = 1,08 г/18 г/моль = 0,06 моль. Тогда n(H) = 2n(H2O) = 2 ⋅ 0,06 моль = 0,12 моль.
Углерод и водород соотносятся между собой как x : y = 0,05 : 0,12 = 5 : 12. Молекулярную формулу искомого углеводорода записываем в виде C5H12.
Ответ: C5H12
Задание №9
При сжигании навески неизвестного углеводорода массой 4,3 г образовалось 6,3 г паров воды и углекислый газ. Определите молекулярную формулу углеводорода и его структуру, если известно, что его молекула содержит два третичных атома углерода.
Решение
Ответ:
Вычислим количество воды, образующейся при горении углеводорода:
n(H2O) = m/M = 6,3 г/18 г/моль = 0,35 моль.
Тогда количество и масса содержащегося в ней водорода составит n(H) = 2n(H2O) = 0,35 моль ⋅ 2 = 0,7 моль,
m(H) = 0,7 моль ⋅ 1 г/моль = 0,7 г.
Вычислим массу и количество вещества углерода, входящего в состав углеводорода:
m(C) = m(CxHy) — m(H) = 4,3 г — 0,7 г = 3,6 г,
n(C) = m/M = 3,6 г/12 г/моль = 0,3 моль.
Углерод и водород соотносятся между собой как x : y = 0,3 : 0,7 = 3 : 7. Поскольку в молекулу предельного углеводорода входит четное число атомов водорода, тогда индексы удваиваем и записываем молекулярную формулу углеводорода в виде C6H14.
Поскольку углеводород содержит 2 третичных атома углерода, то его структурой является 2,3-диметилбутан:
Ответ: C6H14
[adsp-pro-3]
Задание №10
Навеску неизвестного углеводорода массой 3,6 г сожгли в избытке кислорода и получили 5,6 л углекислого газа (н.у.) и пары воды. Определите молекулярную формулу углеводорода и его структуру, если известно, что его бромирование приводит к единственному монобромпроизводному.
Решение
Ответ:
Вычислим количество углекислого газа, образующегося при горении углеводорода (CxHy):
n(CO2) = V/Vm = 5,6 л/22,4 л/моль = 0,25 моль.
При горении углеводорода весь содержащийся в нем углерод переходит в углекислый газ,
тогда n(C) = n(CO2) = 0,25 моль.
Вычислим массу углерода: m(C) = M ⋅ n = 12 г/моль ⋅ 0,25 моль = 3 г.
Масса и количество вещества водорода, входящего в структуру углеводорода, составляет:
m(H) = m(CxHy) — m (C) = 3,6 г — 3 г = 0,6 г, n(H) = 0,6 г/1 г/моль = 0,6 моль.
Углерод и водород соотносятся между собой как x : y = 0,25 : 0,6 = 5 : 12. Поскольку бромирование углеводорода приводит к единственному монобромпроизводному, то структурную формулу исходного углеводорода (2,2-диметилпропан — C5H12) представим в виде:
Ответ: C5H12
Задание №11
При сгорании навески неизвестного алкана образовалось 5,5 г углекислого газа и 2,7 г воды. Определите молекулярную формулу углеводорода и его структуру, если известно, что его молекула имеет разветвленный скелет и один вторичный атом углерода.
Решение
Ответ:
Вычислим количество углекислого газа, образующегося при горении углеводорода (CxHy):
n(CO2) = m/M = 5,5 г/44 г/моль = 0,125 моль.
При горении углеводорода весь содержащийся в нем углерод переходит в углекислый газ,
тогда n(C) = n(CO2) = 0,125 моль.
Количество вещества воды и водорода, входящего в структуру углеводорода, составляет:
n(H2O) = m/M = 2,7 г/18 г/моль = 0,15 моль,
тогда n(H) = 2n(H2O ) = 2 ⋅ 0,15 моль = 0,3 моль.
Углерод и водород соотносятся между собой как x : y = 0,125 : 0,3 = 5 : 12. Поскольку молекула углеводорода имеет разветвленный скелет и один вторичный атом углерода, то искомым углеводородом является 2-метилбутан, структурную формулу которого представим в виде:
Ответ: C5H12
[adsp-pro-10]
2 варианта с ответами контрольной работы по химии 10 класс на тему Алканы.
Ссылка для скачивания контрольной работы: скачать в PDF
Решать контрольную работу по химии 10 класс алканы онлайн:
1)Какие из перечисленных веществ, формулы которых C2H4, C2H6, C3H8, C3H6, C5H12, C5H10, C6H6, C4H8, C10H22, являются гомологами метана? Назовите их.
2)Составьте структурную формулу 2,4,4-триметилгексана
3)Из формул веществ, углеродные скелеты которых изображены ниже, выпишите формулы: а) гомологов; б) изомеров.
4)Сколько разных веществ обозначено схемами? Назовите все вещества по международной номенклатуре.
5)Какие химические свойства характерны для этана? Ответ подтвердите уравнениями химических реакций.
6)Установите формулу газообразного углеводорода, если при полном сжигании 0,7 г этого вещества получили 1,12 л оксида углерода(IV) (н. у.) и 0,9 г воды. Относительная плотность паров этого вещества по водороду составляет 42.
7)Какие из перечисленных веществ, формулы которых C3H8, C2H2, C5H12, C6H12, C7H16, C20H42, CH4, C4H8, C5H8, принадлежат к классу предельных углеводородов (алканов)?
8)Составьте структурную формулу 2,2,3-триметилпентана.
9)Из формул веществ, углеродные скелеты которых изображены ниже, выпишите формулы: а) гомологов; б) изомеров.
10)Установите формулу углеводорода, массовая доля углерода в котором составляет 82,2 %. Плотность этого вещества равна 2,59 г/л.
Тренировочные варианты ЕГЭ по химии с ответами:
Тренировочные варианты ЕГЭ по химии 11 класс задания с ответами
14.04.2021 варианты ХИ2010501-ХИ2010504 ответы и задания по химии 11 класс ЕГЭ 2021
ПОДЕЛИТЬСЯ МАТЕРИАЛОМ
Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода.
Гомологический ряд алканов
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Все алканы легче воды, не растворимы в воде и не смешиваются с ней.
Строение алканов
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp3:

При образовании связи С–С происходит перекрывание sp3-гибридных орбиталей атомов углерода:

При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:

Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу:

Это соответствует тетраэдрическому строению молекулы.
Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода



Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
Наример, пространственное строение н-бутана — зигзагообразное

Изомерия алканов
Структурная изомерия
Для алканов характерна структурная изомерия – изомерия углеродного скелета.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
Например.
Для н-бутана (алкана с линейной цепью) существует изомер с разветвленным углеродным скелетом – изобутан
С увеличением числа атомов углерода в молекуле увеличивается количество изомеров, соответствующих данной формуле. У метана CH4, этана C2H6 и пропана C3H8 структурных изомеров нет.
Количество изомеров в ряду алканов:
| Молекулярная формула | Число структурных изомеров |
| C4H10 | 2 |
| C5H12 | 3 |
| C6H14 | 5 |
| C7H16 | 9 |
| C8H18 | 18 |
| C9H20 | 35 |
| C10H22 | 75 |
Оптическая изомерия
Если атом углерода в молекуле связан с четырьмя различными заместителями (атомами или атомными группами), например:

то возможно существование двух соединений с одинаковой структурой, но различным пространственным строением.Молекулы таких соединений относятся друг к другу, как зеркальные изображение и предмет. При этом никаким вращением нельзя получить одну молекулу из другой.
Номенклатура алканов
В названиях алканов используется суффикс -АН.
Например, алкан имеет название 2-метилпропан.

Для простейших алканов (метан, этан, пропан, бутан и изобутан) используют тривиальные названия. Начиная с пятиатомного углероводорода, в названии неразветвленных (нормальных) алканов используют корень, который показывает число атомов углерода в молекуле, и добавляют соответствующий суффикс (для алканов – ан, для алкенов – ен, и т.д.).
Название разветвленных алканов строится по следующим правилам:
1. Выбирают главную углеродную цепь. При этом считают, что углеводородные радикалы, которые не входят в главной цепь, являются в ней заместителями. При этом главная цепь должна быть самой длинной. Например, в молекуле на рисунке главной является цепь, отмеченная на рисунке а:
Главная цепь должна быть самой разветвленной.
Например, в молекуле, изображенной на рисунках а и б, выделены цепи с одинаковым числом атомов углерода. Но главной будет цепь, изображенная на рисунке а, т.к. от нее отходит 2 заместителя, а от цепи на рисунке б – только один:
2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода, которые соединены с заместителями, получили минимальные возможные номера. Причем нумерацию следует начинать с более близкого к старшей группе конца цепи.
3. Называют все радикалы, указывая впереди цифры, которые обозначают их расположение в главной цепи.
Например, 2-метилпропан:

Для одинаковых заместителей эти цифры указывают через запятую, при этом количество одинаковых заместителей обозначается приставками ди- (два), три- (три), тетра- (четыре), пента- (пять) и т.д.
Например, 2,2-диметилпропан или 2,2,3-триметилпентан.
4. Названия заместителей со всеми приставками и цифрами располагают в алфавитном порядке.
Например: 2,2-диметил-3-этилпентан.
5. Называют главную углеродную цепь, т.е. соответствующий нормальный алкан.
Например, название молекулы на рисунке:

2,2,4-триметил-4-этилгексан
Химические свойства алканов
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
![]() Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:

Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно.
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан:
Бромирование протекает более медленно и избирательно.
Избирательность бромирования: сначала замещается атом водорода у третичного атома углерода, затем атом водорода у вторичного атома углерода, и только затем первичный атом.
С третичный–Н > С вторичный–Н > С первичный–Н
Например, при бромировании 2-метилпропана преимущественно образуется 2-бром-2-метилпропан:

Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
![]()
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:

Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:

1.2. Нитрование алканов
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
Например. При нитровании пропана образуется преимущественно 2-нитропропан:

2. Реакции разложения
2.1. Дегидрирование и дегидроциклизация
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Уравнение дегидрирования алканов в общем виде:
CnH2n+2 → CnH2n-х + (х+1)H2
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Например, при дегидрировании этана образуются этилен или ацетилен:
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
![]()
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
![]()
Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:

Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:


Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:

2.2. Пиролиз (дегидрирование) метана
При медленном и длительном нагревании до 1500оС метан разлагается до простых веществ:
![]()
Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:![]()
Пиролиз метана – промышленный способ получения ацетилена.
2.3. Крекинг
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы с более короткой углеродной цепью и алкены.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Например, при крекинге н-пентана образуется смесь, в состав которой входят этилен, пропан, метан, бутилен, пропилен, этан и другие углеводороды.

Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Реакции окисления алканов
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
CH4 + 2O2 → CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Например, горение пропана в недостатке кислорода:
2C3H8 + 7O2 → 6CO + 8H2O
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
CH4 + O2 → C + 2H2O
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление
- Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:
![]()
- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:

- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.
![]()
Продукт реакции – так называемый «синтез-газ».
4. Изомеризация алканов
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.
Например, н-бутан под действием катализатора хлорида алюминия и при нагревании превращается в изобутан:

Получение алканов
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета.
Например, хлорметан реагирует с натрием с образованием этана:
![]()
Хлорэтан взаимодействует с натрием с образованием бутана:
![]()
Реакция больше подходит для получения симметричных алканов.
При проведении синтеза со смесью разных галогеналканов образуется смесь разных алканов.
Например, при взаимодействии хлорметана и хлорэтана с натрием помимо пропана образуются этан и бутан.
![]()
2. Электролиз солей карбоновых кислот (электролиз по Кольбе)
Это электролиз водных растворов солей карбоновых кислот.
В общем виде:
2R–COONa + 2H2O → H2 + 2NaOH + 2CO2 + R–R
В водном растворе ацетат натрия практически полностью диссоциирует:
CH3COONa → CH3COO– + Na+
При этом на катод притягиваются катионы натрия Na+ и молекулы воды H2O.
Разряжаться на катоде будут молекулы воды:
Kатод(-): 2H2O + 2e = H2 + 2OH–
На аноде окисляются ацетат-ионы, а именно, атом углерода карбоксильной группы.
При этом от карбоксильной группы отрывается углекислый газ и остаются метильные радикалы, которые образуют газообразный этан:
Aнод(+): 2CH3COO– – 2e = 2CO2 + CH3–CH3
Суммарное уравнение электролиза водного раствора ацетата натрия:
2CH3COONa + 2H2O = H2 + 2NaOH + 2CO2 + CH3–CH3
4. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия:

5. Гидрирование алкенов, алкинов, циклоалканов, алкадиенов
![]()
При гидрировании этилена образуется этан:
![]()
При полном гидрировании ацетилена также образуется этан:
![]()
При гидрировании циклопропана образуется пропан:

6. Синтез Фишера-Тропша
Из синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды:
nCO + (2n+1)H2 = CnH2n+2 + nH2O
Это промышленный процесс получения алканов.
7. Получение алканов в промышленности
В промышленности алканы получают из нефти, каменного угля, природного и попутного газа. При переработке нефти используют ректификацию, крекинг и другие способы.
Цели урока:
- Сформулировать знания учащихся о
пространственном строении алканов. - Продолжить формировать понятия о гомологах.
- Рассмотреть химические свойства алканов,
показать взаимосвязь между строением и
свойствами. - Продолжить формирование умений анализировать,
сравнивать, делать выводы; развить навыки
культуры общения.
Тип урока: сообщение новых знаний.
Вид урока: лекция + элементы беседы.
Оборудование:
- Шаростержневая и объёмная модели молекулы
метана. - Таблицы:
- “Строение метана”;
- “Строение этана и бутана”;
- Кодограмма “Хлорирование метана”.
ХОД УРОКА
I. Организационный момент
II. Сообщение новых знаний
Знакомство с планом новой темы:
- Особенности пространственного строения
предельных углеводородов. - Анализ химических связей алканов.
- Химические свойства.
- Зависимость свойств предельных углеводородов
от их строения, характера химических связей.
III. Изложение лекционного материала учителем
в соответствии с планом
Современные представления о строении вещества
не сводятся только к установлению порядка
соединений атомов, но также включают
рассмотрение пространственного строения
молекул и электронной природы химических связей.
Предлагается написать молекулярную,
электронную, структурную формулы метана,
выяснить, что они показывают.
СН4 – молекулярная формула
(качественный, количественный состав);
–
электронная формула (ковалентная полярная
связь);
–
структурная формула (порядок соединения атомов в
молекуле).
Но данные формулы не отражают истинного
строения молекул метана. Молекула метана не
имеет плоского строения, как можно представить
на основании структурной формулы.
IV. Работа с моделями молекулы метана
Молекула метана в действительности имеет форму
тетраэдра. Тетраэдр – это пирамида, в основании
которой лежит равносторонний треугольник. В
центре тетраэдра находится атом углерода, а все
его четыре валентности направлены к вершинам
тетраэдра. Физическими методами исследования
установлено, что валентные углы равны 109о28′.
Учащимся предлагаются проблемные вопросы:
- Почему молекула метана имеет такую
пространственную форму? - Чем объясняется направление валентных связей
атома углерода от центра к вершинам тетраэдра?
Ответ следует искать в электронном строении
атома углерода и молекулы метана.
С 1S2 2S2 2P2
––> C
* 1S2 2S1 2P3
(основное
состояние) (возбужденное
состояние)
Так как на втором энергетическом уровне
Р-подуровне есть свободная орбиталь, то на неё
переходит один из 2S2-электронов. В
результате этого атом углерода в возбуждённом
состоянии имеет четыре неспаренных электрона,
т.е. становится четырёхвалентным.
(негибридные электронные
облака) (гибридные электронные
облака)
Облака всех четырёх валентных электронов атома
углерода выравниваются, становятся одинаковыми.
При этом они принимают форму вытянутых в
направлении к вершинам тетраэдра восьмёрок.
Явление, при котором происходит смешение и
выравнивание по форме и энергии электронных
облаков, называется гибридизацией.
Так как гибридизации подвергаются один S
и три Р-электрона, то такое состояние
называется SP3-гибридизацией.
Несимметричное распределение электронной
плотности означает, что вероятность нахождения
электрона по одну сторону от ядра больше, чем по
другую. Гибридные электронные облака вытянуты в
пространстве под углом 109о28′ к
вершинам воображаемого тетраэдра, и в этом
направлении они перекрываются с электронными
облаками атомов водорода.
Итак, молекула метана имеет тетраэдрическое
строение, что обусловлено SP3-гибридизацией
атома углерода, тетраэдрическим направлением
четырёх гибридных электронных облаков атома
углерода.
Сравнивая масштабную и шаростержневую модели
молекул метана, можно отметить, что
шаростержневая модель, появившаяся до
возникновения электронной теории, более
наглядно рассматривает строение молекулы
метана.
V. Работа с таблицами “Строение метана” и
“Строение этана и бутана”
Для активизации учащихся им предлагается
рассмотреть данные таблицы и ответить на вопросы
(анализ информации, заключённой в таблицах).
- Что общего в строении молекул метана, этана,
бутана вы видите? - Чему равны валентные углы в молекулах гомологов
метана? - Почему углеродный скелет у молекулы бутана
имеет зигзагообразную форму? - Виды химической связи в молекулах этана, бутана?
Проанализировав информацию, учащиеся делают
выводы.
Для гомологов метана характерно:
- тетраэдрическое строение атома углерода (SP3-гибридизация);
- одинаковое значение всех валентных углов;
- наличие С – С и С – Н химических связей.
VI. Анализ химических связей алканов
При рассмотрении второго вопроса плана
обращается внимание на характер С – С и С
– Н связей, являющихся ковалентными по
характеру образования. Углерод-углеродные и
углерод-водородные связи в алканах относятся к ![]() (сигма)
(сигма)
связям.
![]() (сигма)
(сигма)
связь – это химическая связь, при образовании
которой перекрывание электронных облаков
происходит по прямой, соединяющей ядра атомов.
Эти связи разнообразны.

VII. Химические свойства алканов
Предельные углеводороды характеризуются малой
реактивной способностью. Их называют
инерционными, химически стойкими, парафинами (от
латинского parum affinis – “мало сродства”).
В данной лекции познакомимся со
взаимодействием алканов с кислородом,
галогенами, термическим разложением,
изомеризацией.
1. Горючесть алканов.
При поджигании (t = 600oС) алканы вступают в
реакцию с кислородом, при этом происходит их
окисление до углекислого газа и воды.
СnН2n+2 + O2 ––>CO2 + H2O
+ Q
например:
СН4 + 2O2 ––>CO2 + 2H2O + Q
Смесь метана с кислородом или воздухом при
поджигании может взрываться.
Наиболее сильный взрыв получается при объёмных
отношениях 1 : 2 (с кислородом) или 1 : 10 (с воздухом),
т.к. метан и кислород вступают в реакцию
полностью.
Подобные смеси опасны в каменноугольных
шахтах. Чтобы обеспечить безопасность работы в
шахтах, там устанавливают анализаторы,
сигнализирующие о появлении газа, и мощные
вентиляционные устройства.
С3Н8 + 5O2 ––>3CO2 + 4H2O
+ Q
Горение пропан-бутановой смеси можно
продемонстрировать на примере газовой
зажигалки.
При горении алканов выделяется много теплоты,
что позволяет использовать их в качестве
источника энергии. Но большая часть их
используется в качестве сырья для получения
других продуктов.
2. Разложение алканов.
СnН2n+2
C + H2
СН4
C + 2H2
С4Н10
4C + 5H2
Метан в термическом отношении более устойчив,
чем другие алканы. Причина этого в достаточной
прочности С – Н связей.
3. Реакции замещения (протекают с галогенами и
другими окислителями при определённых условиях:
свет, температура).
СН4 + Cl2
CH3Cl + HCl
СН3Cl + Cl2
CH2Cl2 + HCl (кодограмма)
СН2Cl2 + Cl2
CHCl3 + HCl
СНCl3 + Cl2
CCl4 + HCl
Механизм цепных реакций достаточно сложен,
объяснение ему было дано русским учёным Н.Н.
Семёновым, за что он в 1956 г. был удостоен
Нобелевской премии.
4. Реакции изомеризации характерны не для
всех алканов. Обращается внимание на возможность
превращения одних изомеров в другие, наличие
катализаторов.
С4Н10
C4H10
Уравнение вызывает недоумение, т.к. учащиеся не
встречались с реакциями, при которых состав
молекул не изменялся. Значит, химические реакции
могут сопровождаться не только изменением
состава веществ, но и изменением их строения, что
часто встречается в органической химии. Чтобы
выразить такое превращение, надо пользоваться
структурными формулами.
С уравнением учащиеся знакомятся
самостоятельно, работая с учебником.
VIII. Выводы
В конце лекции учащиеся записывают выводы,
вытекающие из содержания лекции, включая пункт №
4 плана. Алканы (предельные углеводороды)
характеризуются общими свойствами, на основании
которых объединяются в гомологические ряды:
- имеют общую формулу СnH2n+2;
- все атомы углерода находятся в них в состоянии SP3-гибридизации;
- имеют прочные ковалентные
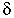 (сигма) связи;
(сигма) связи; - обладают сходными химическими свойствами,
способностью к полному, частичному, постепенному
окислению.
Свойства алканов находятся в зависимости от
электронно-пространственного строения, прочных
химических связей.
IX. Обобщение
По завершении лекции каждый учащийся заполняет
обобщающую таблицу о соответствующем гомологе
по образцу, выдаваемому учителем.
| Название вещества | Молекулярная формула | Структурная формула | Уравнения реакций | Тип реакции |
|
Метан |
СН4 |
|
СН4 + 2O2 ––> CO2 + 2H2O | Горение (полное окисление) |
| СН4 C + 2H2 |
Разложение (частичное окисление) | |||
| СН4 + Cl2 |
Замещение (постепенное окисление) |
Выводы и обобщающая таблица являются кратким
конспектом лекции.
X. Первичная проверка усвоения темы урока
После подведения итогов проводится небольшой
тест.
1. Укажите ошибочное определение алканов:
а) предельные углеводороды;
б) карбоциклические соединения (в молекулах
имеются циклы);
в) насыщенные углеводороды;
г) парафиновые углеводороды.
2. Общая формула алканов:
а) СnH2n;
б) СnH2n+1;
в) СnH2n+2;
г) СnН2n-2.
3. Признаки, характеризующие строение алканов:
а) SP3-гибридизация, плоская форма
молекул ![]() 120о,
120о, ![]() и
и ![]() -связи;
-связи;
б) SP-гибридизация, линейная форма молекул ![]() 180о,
180о, ![]() и
и ![]() -связи;
-связи;
в) SP3-гибридизация, форма молекул –
тетраэдр ![]() 109о28′,
109о28′,
![]() -связи.
-связи.
4. Невозбуждённый атом углерода имеет
электронную конфигурацию:
а) 1S22S12P3;
б) 1S22S22P2;
в) 1S22S22P3;
г) 1S22S22P4.
5. Возбужденный атом углерода имеет электронную
конфигурацию:
а) 1S22S22P3;
б) 1S22S22P2;
в) 1S22S22P4;
г) 1S22S12P3.
6. Всем алканам присущи свойства:
а) вступать в реакцию замещения;
б) окисляться при обычных условиях;
в) гореть в кислороде;
г) реагировать с активными металлами.
7. Найдите ошибку.
а) Все алканы – химически активные вещества.
б) Для алканов характерны реакции присоединения.
в) Алканы окисляются с трудом при высоких
температурах кислородом воздуха.
г) Для алканов характерны реакции с разрывом—
связи С – С и С – Н.
Учитель предлагает варианты правильных
ответов, учащиеся проводят самоконтроль.
Государственное бюджетное образовательное учреждение
Средняя общеобразовательная школа №733
Юго-Восточного округа города Москвы
Тест по химии
«Химические свойства предельных углеводородов»
подготовила
учитель биологии и химии
Червинская Елена Владимировна
2012год
Химические свойства предельных углеводородов.
Вариант № 1
А1
В качестве катализатора в реакциях изомеризации алканов используют:
-
платину
-
серную кислоту
-
эфир
-
оксид алюминия
А2
В результате термического разложения метана образуются
-
СO2 и Н2O
-
С и Н2
-
CO и Н2
-
НCНO и Н2
А3
Этан взаимодействует с каждым из пары веществ:
-
Cl2 и O2
-
N2 и NaOH
-
HBr и Н2O
-
I2 и Н2
А4
В результате следующих превращений
+Na + Cl2
СН3Br —› Х1 —› Х2
выделяется вещество Х2
-
этилат натрия
-
бромметан
-
хлорэтан
-
этан
А5
К реакциям замещения не относится:
-
хлорирование
-
дегидрирование
-
бромирование
-
нитрование
А6
Продукт взаимодействия 2-бромпропана с натрием
-
2,3 – диметилбутан
-
пропен
-
гексан
-
циклогексан
А7
Метан нельзя получить в одну стадию из
-
ацетата натрия СН3COONa
-
оксида углерода (II) и водорода
-
хлорметана
-
углерода и водорода
А8
Хлорметан можно получить в результате взаимодействия
-
метана с раствором хлора в воде
-
метана с хлороводородом
-
метана с соляной кислотой
-
метана с хлором при освещении
А9
Алканы не вступают в реакции
-
горения
-
присоединения
-
изомеризации
-
замещения
А10
В реакции бромирования пропана необходимым условием является:
-
присутствие катализатора
-
нагревание
-
освещение солнечным светом
-
реакция происходит в обычных условиях
А11
Верны ли следующие утверждения об алканах?
А. Все алканы – химически активные вещества.
Б. Для алканов характерны реакции присоединения.
1. верно только А
2. верно только Б
3. верны оба утверждения
4.оба утверждения неверны
Часть II
В1
Для этана характерны реакции:
-
горения
-
гидрирования
-
изомеризации
-
хлорирования
-
нитрования
-
гидратации
Ответ _________________________
В2
2- метилбутан
-
вступает в реакцию Вюрца
-
изомер н-пентана
-
взаимодействует с хлором при нагревании
-
взаимодействует с бромом при освещении
-
гомолог 2-метилгексана
-
хорошо растворим в воде
Ответ________________________
В3
Установите соответствие между реагирующими веществами и продуктами реакции
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
|
ПРОДУКТЫ РЕАКЦИИ |
|
|
А) C2H6 + O2 |
1) СН3СН2СН3 + Н2О |
|
Б) СН3СН2СН2СН3 + Сl2 |
2) CO2 + H2O |
|
В) CО + Н2 |
3) СН3СН2СН2СН2Сl + HCl |
|
Г) СН4 + О2 |
4) СН3СНСlСН2СН3 + HCl |
|
5) CO + H2O |
А
В4
Бутан можно получить:
-
из хлорметана реакцией Вюрца
-
крекингом гексана
-
хлорированием пропана
-
гидрированием циклобутана
-
из бромэтана
-
из углерода и водорода
Ответ___________________
Химические свойства предельных углеводородов.
Вариант № 2
А1
В качестве катализатора в реакциях нитрования алканов используют:
-
платину
-
серную кислоту
-
хлорид алюминия
-
оксид алюминия
А2
В результате горения метана образуются
-
С и Н2
-
CO и Н2
-
НCООН и Н2
-
СO2 и Н2O
А3
Пропан взаимодействует с каждым из пары веществ:
-
HBr и Н2O
-
Br 2 и O2
-
HNO3 и Na
-
Cl2 и Н2
А4
В результате следующих превращений
+ Cl2 +Na
СН4 —› Х1 —› Х2
вещество Х2 — это
-
этилат натрия
-
хлорметан
-
хлорэтан
-
этан
А5
К реакциям замещения относится:
-
горение
-
дегидрирование
-
изомеризация
-
нитрование
А6
Продукт взаимодействия 2-хлорбутана с натрием
-
2,3 – диметилбутан
-
октан
-
3,4-диметилгексан
-
циклогексан
А7
Этан можно получить в одну стадию из
-
ацетата натрия СН3COONa
-
хлорметана
-
оксида углерода (II) и водорода
-
циклобутана
А8
Бромпропан можно получить в результате взаимодействия
-
пропана с раствором брома в воде
-
этана с бромом
-
пропана с бромом при освещении
-
пропана с бромоводородом
А9
Алканы не вступают в реакции
-
нитрования
-
реакцию Вюрца
-
хлорирования
-
замещения
А10
В реакции хлорирования этана необходимым условием является:
-
нагревание
-
освещение светом
-
присутствие катализатора
-
реакция происходит в обычных условиях
А11
Верны ли следующие утверждения об алканах?
А. Большинство реакций характерных для алканов, протекают с разрывом связи С-С
Б. Для алканов характерны реакции замещения
1. верно только А
2. верно только Б
3. верны оба утверждения
4.оба утверждения неверны
Часть II
В1
Для пропана характерны реакции:
-
гидрирования
-
гидратации
-
горения
-
нитрования
-
изомеризации
-
бромирования
Ответ _________________________
В2
3- этилпентан
-
изомер н-пентана
-
вступает в реакцию Вюрца
-
взаимодействует с хлором при нагревании
-
взаимодействует с азотной кислотой
-
гомолог 3-этилгексана
-
горит в кислороде
Ответ _____________________________
В3
Установите соответствие между реагирующими веществами и продуктами реакции
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
|
ПРОДУКТЫ РЕАКЦИИ |
|
|
А) СН4 + O2 |
1) CH3CH3 + NaCl |
|
Б) СН3Cl + Na |
2) CO2 + H2O |
|
В) CH3CH2CH2CH3 + HNO3 |
3) CH4 + NaCl |
|
Г) СН3CH3 + O2 |
4) CH3CHNO2CH2CH3 + H2O |
|
5) CH3CH2CH2CH2 NO2 + H2O |
А
В4
Этан можно получить:
-
из нитроэтана
-
из хлорметана
-
крекингом гексана
-
хлорированием пропана
-
гидрированием циклобутана
-
из оксида углерода(II) и водорода
Ответ ____________________________
Ответы
|
А1 |
А2 |
А3 |
А4 |
А5 |
А6 |
А7 |
А8 |
А9 |
А10 |
А11 |
|
|
Вар. 1 |
4 |
2 |
1 |
3 |
2 |
1 |
3 |
4 |
2 |
3 |
4 |
|
Вар. 2 |
2 |
4 |
2 |
4 |
4 |
3 |
3 |
3 |
2 |
2 |
2 |
|
В1 |
В2 |
В3 |
В4 |
|
|
Вар. 1 |
145 |
245 |
2412 |
245 |
|
Вар. 2 |
346 |
456 |
2142 |
236 |
Литература
1. Химия. Органическая химия. Учебник для 10 класса. Рудзитис Г.Е., Фельдман Ф.Г. (2010, 160с.)
2. Химия. 10 класс. Базовый уровень. Габриелян О.С. (2007, 192с.)
3. Органическая химия. Полезные сведения для школьников и учителей. Гуревич П.А., Кабешов М.А. (2004, 348с.)
Урок-лекция по теме: «Строение и химические свойства предельных углеводородов»
Цели урока:
Сформулировать знания учащихся о пространственном строении алканов.
Продолжить формировать понятия о гомологах.
Рассмотреть химические свойства алканов, показать взаимосвязь между строением и свойствами.
Продолжить формирование умений анализировать, сравнивать, делать выводы; развить навыки культуры общения.
Тип урока: сообщение новых знаний.
Вид урока: лекция + элементы беседы.
Оборудование:
Шаростержневая и объёмная модели молекулы метана.
Таблицы:
“Строение метана”;
“Строение этана и бутана”;
Кодограмма “Хлорирование метана”.
ХОД УРОКА
I. Организационный момент
II. Сообщение новых знаний
Знакомство с планом новой темы:
Особенности пространственного строения предельных углеводородов.
Анализ химических связей алканов.
Химические свойства.
Зависимость свойств предельных углеводородов от их строения, характера химических связей.
III. Изложение лекционного материала учителем в соответствии с планом
Современные представления о строении вещества не сводятся только к установлению порядка соединений атомов, но также включают рассмотрение пространственного строения молекул и электронной природы химических связей.
Предлагается написать молекулярную, электронную, структурную формулы метана, выяснить, что они показывают.
СН4 – молекулярная формула (качественный, количественный состав);
– электронная формула (ковалентная полярная связь);
– структурная формула (порядок соединения атомов в молекуле).
Но данные формулы не отражают истинного строения молекул метана. Молекула метана не имеет плоского строения, как можно представить на основании структурной формулы.
IV. Работа с моделями молекулы метана
Молекула метана в действительности имеет форму тетраэдра. Тетраэдр – это пирамида, в основании которой лежит равносторонний треугольник. В центре тетраэдра находится атом углерода, а все его четыре валентности направлены к вершинам тетраэдра. Физическими методами исследования установлено, что валентные углы равны 109о28‘.
Учащимся предлагаются проблемные вопросы:
Почему молекула метана имеет такую пространственную форму?
Чем объясняется направление валентных связей атома углерода от центра к вершинам тетраэдра?
Ответ следует искать в электронном строении атома углерода и молекулы метана.
С 1S2 2S2 2P2 ––> C * 1S2 2S1 2P3
(основное состояние) (возбужденное состояние)
Так как на втором энергетическом уровне Р-подуровне есть свободная орбиталь, то на неё переходит один из 2S2-электронов. В результате этого атом углерода в возбуждённом состоянии имеет четыре неспаренных электрона, т.е. становится четырёхвалентным.
(негибридные электронные облака) (гибридные электронные облака)
Облака всех четырёх валентных электронов атома углерода выравниваются, становятся одинаковыми. При этом они принимают форму вытянутых в направлении к вершинам тетраэдра восьмёрок.
Явление, при котором происходит смешение и выравнивание по форме и энергии электронных облаков, называется гибридизацией.
Так как гибридизации подвергаются один S и три Р-электрона, то такое состояние называется SP3-гибридизацией.
Несимметричное распределение электронной плотности означает, что вероятность нахождения электрона по одну сторону от ядра больше, чем по другую. Гибридные электронные облака вытянуты в пространстве под углом 109о28‘ к вершинам воображаемого тетраэдра, и в этом направлении они перекрываются с электронными облаками атомов водорода.
Итак, молекула метана имеет тетраэдрическое строение, что обусловлено SP3-гибридизацией атома углерода, тетраэдрическим направлением четырёх гибридных электронных облаков атома углерода.
Сравнивая масштабную и шаростержневую модели молекул метана, можно отметить, что шаростержневая модель, появившаяся до возникновения электронной теории, более наглядно рассматривает строение молекулы метана.
V. Работа с таблицами “Строение метана” и “Строение этана и бутана”
Для активизации учащихся им предлагается рассмотреть данные таблицы и ответить на вопросы (анализ информации, заключённой в таблицах).
Что общего в строении молекул метана, этана, бутана вы видите?
Чему равны валентные углы в молекулах гомологов метана?
Почему углеродный скелет у молекулы бутана имеет зигзагообразную форму?
Виды химической связи в молекулах этана, бутана?
Проанализировав информацию, учащиеся делают выводы.
Для гомологов метана характерно:
тетраэдрическое строение атома углерода (SP3-гибридизация);
одинаковое значение всех валентных углов;
наличие С – С и С – Н химических связей.
VI. Анализ химических связей алканов
При рассмотрении второго вопроса плана обращается внимание на характер С – С и С – Н связей, являющихся ковалентными по характеру образования. Углерод-углеродные и углерод-водородные связи в алканах относятся к (сигма) связям.
(сигма) связь – это химическая связь, при образовании которой перекрывание электронных облаков происходит по прямой, соединяющей ядра атомов.
Эти связи разнообразны.
VII. Химические свойства алканов
Предельные углеводороды характеризуются малой реактивной способностью. Их называют инерционными, химически стойкими, парафинами (от латинского parum affinis – “мало сродства”).
В данной лекции познакомимся со взаимодействием алканов с кислородом, галогенами, термическим разложением, изомеризацией.
1. Горючесть алканов.
При поджигании (t = 600oС) алканы вступают в реакцию с кислородом, при этом происходит их окисление до углекислого газа и воды.
СnН2n+2 + O2 ––>CO2 + H2O + Q
например:
СН4 + 2O2 ––>CO2 + 2H2O + Q
Смесь метана с кислородом или воздухом при поджигании может взрываться.
Наиболее сильный взрыв получается при объёмных отношениях 1 : 2 (с кислородом) или 1 : 10 (с воздухом), т.к. метан и кислород вступают в реакцию полностью.
Подобные смеси опасны в каменноугольных шахтах. Чтобы обеспечить безопасность работы в шахтах, там устанавливают анализаторы, сигнализирующие о появлении газа, и мощные вентиляционные устройства.
С3Н8 + 5O2 ––>3CO2 + 4H2O + Q
Горение пропан-бутановой смеси можно продемонстрировать на примере газовой зажигалки.
При горении алканов выделяется много теплоты, что позволяет использовать их в качестве источника энергии. Но большая часть их используется в качестве сырья для получения других продуктов.
2. Разложение алканов.
СnН2n+2= C + H2
СН4 =C + 2H2
С4Н10 = 4C + 5H2
Метан в термическом отношении более устойчив, чем другие алканы. Причина этого в достаточной прочности С – Н связей.
3. Реакции замещения (протекают с галогенами и другими окислителями при определённых условиях: свет, температура).
СН4 + Cl2= CH3Cl + HCl
СН3Cl + Cl2 =CH2Cl2 + HCl
СН2Cl2 + Cl2= CHCl3 + HCl
СНCl3 + Cl2 =CCl4 + HCl
Механизм цепных реакций достаточно сложен, объяснение ему было дано русским учёным Н.Н. Семёновым, за что он в 1956 г. был удостоен Нобелевской премии.
4. Реакции изомеризации характерны не для всех алканов. Обращается внимание на возможность превращения одних изомеров в другие, наличие катализаторов.
С4Н10= C4H10
Уравнение вызывает недоумение, т.к. учащиеся не встречались с реакциями, при которых состав молекул не изменялся. Значит, химические реакции могут сопровождаться не только изменением состава веществ, но и изменением их строения, что часто встречается в органической химии. Чтобы выразить такое превращение, надо пользоваться структурными формулами.
С уравнением учащиеся знакомятся самостоятельно, работая с учебником.
VIII. Выводы
В конце лекции учащиеся записывают выводы, вытекающие из содержания лекции, включая пункт № 4 плана. Алканы (предельные углеводороды) характеризуются общими свойствами, на основании которых объединяются в гомологические ряды:
имеют общую формулу СnH2n+2;
все атомы углерода находятся в них в состоянии SP3-гибридизации;
имеют прочные ковалентные (сигма) связи;
обладают сходными химическими свойствами, способностью к полному, частичному, постепенному окислению.
Свойства алканов находятся в зависимости от электронно-пространственного строения, прочных химических связей.
IX. Обобщение
По завершении лекции каждый учащийся заполняет обобщающую таблицу о соответствующем гомологе по образцу, выдаваемому учителем.
|
Название вещества |
Молекулярная формула |
Структурная формула |
Уравнения реакций |
Тип реакции |
|
Метан |
СН4 |
|
СН4 + 2O2 ––> CO2 + 2H2O |
Горение (полное окисление) |
|
СН4= C + 2H2 |
Разложение (частичное окисление) |
|||
|
СН4 + Cl2 = CH3Cl + HCl |
Замещение (постепенное окисление) |
Выводы и обобщающая таблица являются кратким конспектом лекции.
X. Первичная проверка усвоения темы урока
После подведения итогов проводится небольшой тест.
1. Укажите ошибочное определение алканов:
а) предельные углеводороды;
б) карбоциклические соединения (в молекулах имеются циклы);
в) насыщенные углеводороды;
г) парафиновые углеводороды.
2. Общая формула алканов:
а) СnH2n;
б) СnH2n+1;
в) СnH2n+2;
г) СnН2n-2.
3. Признаки, характеризующие строение алканов:
а) SP3-гибридизация, плоская форма молекул 120о, и п -связи;
б) SP-гибридизация, линейная форма молекул 180о, и п-связи;
в) SP3-гибридизация, форма молекул – тетраэдр 109о28‘,п -связи.
4. Невозбуждённый атом углерода имеет электронную конфигурацию:
а) 1S22S12P3;
б) 1S22S22P2;
в) 1S22S22P3;
г) 1S22S22P4.
5. Возбужденный атом углерода имеет электронную конфигурацию:
а) 1S22S22P3;
б) 1S22S22P2;
в) 1S22S22P4;
г) 1S22S12P3.
6. Всем алканам присущи свойства:
а) вступать в реакцию замещения;
б) окисляться при обычных условиях;
в) гореть в кислороде;
г) реагировать с активными металлами.
7. Найдите ошибку.
а) Все алканы – химически активные вещества.
б) Для алканов характерны реакции присоединения.
в) Алканы окисляются с трудом при высоких температурах кислородом воздуха.
г) Для алканов характерны реакции с разрывом — связи С – С и С – Н.
Учитель предлагает варианты правильных ответов, учащиеся проводят самоконтроль
Члены гомологического ряда алканов имеют общие химические свойства. В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированной серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями – КМnО4 и т.п
Видеоопыт «Отношение метана к раствору перманганата калия и бромной воде»
Химическая устойчивость алканов объясняется высокой прочностью σ–связей С ─ С и С ─ Н, а также их неполярностью. Неполярные связи С ─ С и С ─ Н в алканах не склонны к ионному разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. Поэтому для алканов характерны радикальные реакции (реакции замещения), в результате которых получаются соединения, где атомы водорода замещены на другие атомы или группы атомов.
Алканы вступают в реакции, протекающие по свободно-радикальному (цепному) механизму и протекают обычно на свету или при нагревании. По этому механизму легче всего замещаются атомы водорода у третичных, затем вторичных и первичных атомов углерода. При хлорировании эта закономерность не соблюдается при T>400˚C.
Алканы относятся к углеводородам, в которых отсутствуют кратные связи. Из-за предельности алканов реакции присоединения для них нехарактерны.
Реакции замещения (разрыв связей С ─ Н)
1. Галогенирование (замещение атома водорода атомом галогена — F, Cl, Br с образованием галогеналкана).
Реакция галогенирования алканов протекает по радикальному цепному механизму, т.е. как цепь последовательных превращений с участием свободно-радикальных частиц.
Теорию цепных реакций разработал советский ученый, один из основоположников химической физики, академик Н.Н. Семенов (1896—1986), за что в 1956 г. был награжден Нобелевской премией.
Скорость реакции зависит от активности галогенов, которая уменьшается с увеличением радиуса атома.
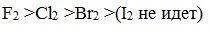
Алканы очень активно реагируют с фтором, реакция алканов с его участием сопровождается взрывом и окислением до СF4.
Реакции хлорирования и бромирования протекают под действием света (фотохимическая цепная реакция) или при 300–400оC.
Иодирование проходит обратимо, поэтому требуется окислитель для удаления НI из реакции.
Низшие алканы (СН4, С2Н6, С3Н8) можно прохлорировать полностью. В молекуле метана атомы хлора могут заместить от одного до четырех атомов водорода в зависимости от соотношения реагентов
Хлорирование метана:
(hv — формула кванта света)
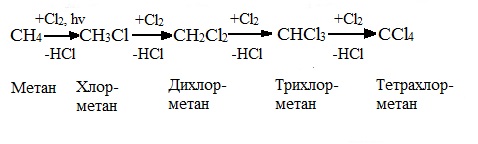
Тривиальное название трихлорметана – хлороформ.
Механизм реакции
Реакция осуществляется в три стадии:
А) Инициирование (зарождение цепи) – гомолитическое расщепление молекулы Сl2 с образованием свободных радикалов хлора:

Свободные радикалы – это атомы или группы атомов с неспаренными электронами (•Сl, •Н, •СН3…)
Б) Развитие цепи (взаимодействие радикала хлора с молекулой алкана, метильного радикала с новой молекулой хлора и т.д.):
В) Обрыв цепи (происходит при соединении двух радикалов друг с другом):
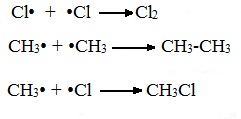
Монохлорирование метана
Скорость реакции замещения водорода на атом галогена у галогеналканов выше, чем у соответствующего алкана, это связано с взаимным влиянием атомов в молекуле:
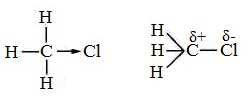
Электронная плотность связи С – Cl смещена к более электроотрицательному атому хлора, в результате этого на нем образуется частичный отрицательный заряд, а на атоме углерода – частичный положительный заряд.
На атоме углерода в метильной группе (-СН3) создаётся недостаток электронной плотности, поэтому он оттягивает на себя электронную плотность от соседних атомов водорода, в результате этого связи С – Н становятся менее прочными и атомы водорода легче замещаются на атомы хлора.
При увеличении углеводородного радикала наиболее подвижными остаются атомы водорода у атома углерода ближайшего к заместителю:
Алканы обесцвечивают раствор брома при нагревании, вступая в реакцию радикального замещения.
Видеоопыт «Взаимодействие алканов с бромом при нагревании»
2.Нитрование (замещение атома водорода нитрогруппой – NO2 с образованием нитроалканов R-NO2). Нитрующий реагент – разбавленная азотная кислота HNO3 (НО─NО2).
Нитрование разбавленной азотной кислотой при t = 1400С и при повышенном или нормальном давлении — реакция М.И.Коновалова.
В результате реакции образуется смесь изомерных нитросоединений. Наиболее легко замещаются атомы водорода у третичного атома углерода, труднее – у вторичного, наиболее трудно – у первичного:
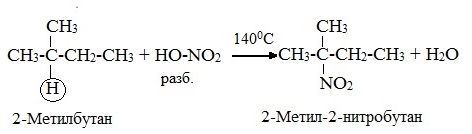
3.Сульфирование (замещение атомов водорода сульфогруппой SO3Н с образованием алкансульфокислот RSO3Н). Сульфирующий реагент – серная кислота Н2SO4 (НО─SO3Н). Сульфирование алканов происходит при действии очень концентрированной Н2SO4 при небольшом нагревании.
Наиболее легко замещается атом водорода у третичного атома углерода:
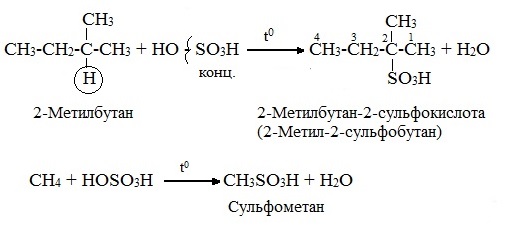
Реакции окисления
Алканы – соединения с низкими степенями окисления углерода и в зависимости от условий реакции они могут окисляться с образованием различных соединений.

При обычных условиях алканы устойчивы к действию сильных окислителей (КМnO4, К2Сr2О7).
1. Горение (окисление кислородом воздуха при высоких температурах)
А) Полное окисление (избыток О2)
При избытке кислорода происходит полное окисление алканов до СО2, где углерод имеет высшую степень окисления +4, и воды. Горение углеводородов приводит к разрыву всех связей С–С и С–Н и сопровождается выделением большого количества тепла (экзотермическая реакция).
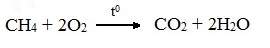
Низшие гомологи (метан, этан, пропан, бутан) образуют с воздухом взрывоопасные смеси, что необходимо учитывать при их использовании. С увеличением молекулярной массы алканы загораются труднее.
Сжиженная пропан-бутановая смесь, горение
Видеоопыт «Взрыв смеси метана с кислородом»
Видеоопыт «Горение жидких алканов»
Видеоопыт «Горение твердых углеводородов (на примере парафина)»
Процесс горения углеводородов широко используется для получения энергии (в двигателях внутреннего сгорания, в тепловых электростанциях и т.п.).
Общий вид реакции горения алканов:
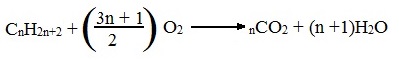
Б) Неполное окисление (недостаток О2)
При горении высших алканов ((n >>1)) при недостатке кислорода образуются продукты частичного окисления: угарный газ СО (степень окисления углерода +2), сажа (мелкодисперсный углерод, со степенью окисления 0).
Поэтому высшие алканы горят на воздухе коптящим пламенем, выделяя токсичный угарный газ, представляющий опасность для человека.
Горение метана при недостатке кислорода происходит по уравнениям:
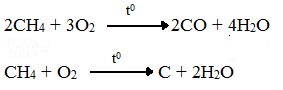
Последняя реакция используется в промышленности для получения сажи из природного газа, содержащего 80-97% метана.
2. Каталитическое окисление
Частичное окисление алканов при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С–С и С–Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов.
Например, при неполном окислении бутана происходит разрыв связи (С2–С3) и получается две молекулы уксусной кислоты:
Этим способом в промышленности получают уксусную кислоту.
При мягком окислении метана кислородом воздуха в присутствии катализаторов могут быть получены метиловый спирт, формальдегид и муравьиная кислота.
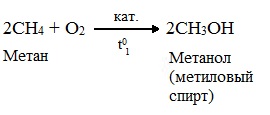
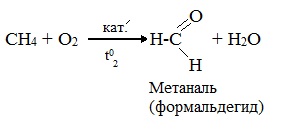
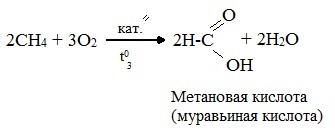
Высшие алканы (n>25) под действием кислорода воздуха в жидкой фазе в присутствии солей марганца превращаются в смесь карбоновых кислот со средней длиной цепи С12–С18, которые используются для получения моющих средств и поверхностно-активных веществ.
Учебный фильм «Каталитическое окисление высших парафиновых углеводородов»
Термические превращения алканов (реакции разложения)
1.Крекинг (анг. сracking — расщепление) алканов является основой переработки нефти с целью получения продуктов меньшей молекулярной массы, которые используются в качестве моторных топлив, смазочных масел, а также сырья для химической и нефтехимической промышленности.
Для осуществления этого процесса используют два способа: термический крекинг (при нагревании без доступа воздуха) и каталитический крекинг (более умеренное нагревание в присутствии катализатора).
Термический крекинг — это разрыв связей С ─ С в молекулах алканов с длинными углеродными цепями, в результате которого образуются алканы и алкены с меньшим числом атомов углерода.
Термический крекинг (пиролиз) осуществляется при температуре 450 – 7000С:
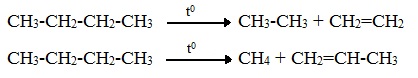
Крекинг н-гексана (работа Литвишко Алексея, г. Самара)
Каталитический крекинг проводят в присутствии катализаторов (обычно оксидов алюминия и кремния) при температуре 5000С и атмосферном давлении. При этом с разрывом молекул происходит реакция изомеризации и дегидрирования.
Крекинг октана (работа Литвишко Алексея, г. Самара)
2.При нагревании метана или этана до температуры 10000С начинается пиролиз – разложение на простые вещества:
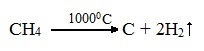
Полученный этим способом углерод является достаточно чистым, в технике называется сажей и используется, например, при производстве автомобильных покрышек.
3. Конверсия метана с образованием синтез – газа (СО + Н2)
Важное значение имеет реакция взаимодействия метана с водяным паром, в результате которой образуется смесь оксида углерода (II) с водородом – «синтез-газ» (водяной газ, генераторный газ):
Эта реакция используется для получения водорода. Синтез-газ служит сырьем для получения различных углеводородов.
Реакции отщепления
1.Дегидрирование (отщепление водорода; происходит в результате разрыва связей С ─ Н; осуществляется в присутствии катализатора при повышенных температурах).
В ходе пропускания алканов над катализатором (Pt, Pd, Ni, А1203, Сг203) при высокой температуре (400 — 600°С) происходит отщепление молекулы водорода и образование алкена:
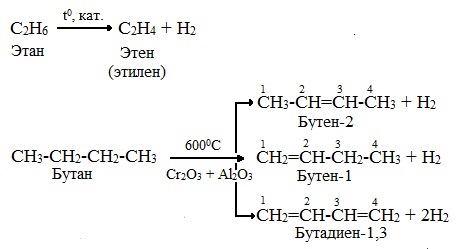
2. Если метан нагреть до более высокой температуры (15000С) и быстро охладить, то происходит межмолекулярное дегидрирование и образуется этин (ацетилен):
3.Дегидроциклизация (ароматизация) — реакция дегидрирования, которая приводит к замыканию цепи в устойчивый цикл.
Алканы, содержащие в основной цепи больше 4-х атомов углерода, используются для получения циклических соединений.
Если основная цепь молекулы алкана содержит 5 (но не более) атомов углерода (н-пентан и его алкильные производные), то при температуре 3000С над Pt-катализатором атомы водорода отщепляются от концевых атомов углеродной цепи и образуется пятичленный цикл (циклопентан или его производные):
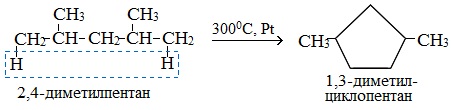
Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола м его производных:
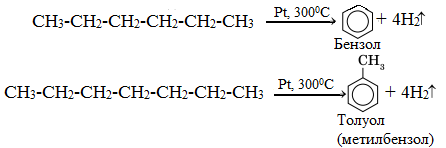
Реакции перегруппировки (изомеризация)
1.Изомеризация (превращение химического соединения в его изомер):
Нормальные алканы под влиянием катализаторов и при нагревании способны превращаться в алканы с разветвленной цепью без изменения состава молекул. В этих случаях участвуют алканы, молекулы которых содержат не менее 4-х углеродных атомов:
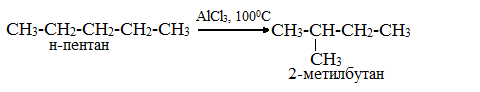
Эта реакция является важной для производства бензина, поскольку наличие в его составе разветвленных углеводородов повышает октановое число, т.е. качество топлива.
Видеоопыт «Установление качественного состава предельных углеводородов«
Алканы (предельные углеводороды)
