Определение теплового эффекта химической реакции нейтрализации
Направление – химия, физика
Выполнили: ученики 9 а класса МБОУ «Гимназия № 5» г. Брянска Агейченкова Диана, Козлова Елизавета, Игнатичев Иван
Руководители: учитель химии МБОУ «Гимназия №5» Жирешонкова Л. В., доцент кафедры агрохимии, почвоведения и экологии БГАУ Мартынова Е. В.
Брянск 2018
Содержание
Введение………………………………………….. ……………….………3
Методика и результаты исследования…………… ……………..…….5
Выводы……………………………………………………………………..10
Заключение……………………………………………………………..….11
Список использованных источников……………………………..……12
Приложение…………………………………………………….………….12
Введение
Химическая термодинамика – раздел химии, изучающий энергетические эффекты химических реакций. Термохимия – раздел термодинамики, который изучает тепловые явления, сопровождающие химические реакции. Изучение этих явлений имеет большое значение для термодинамических и технологических расчётов. Тепловым эффектом реакции называется количество теплоты, выделяющееся или поглощающееся при необратимом протекании реакции, если продукты реакции и исходные вещества имеют одинаковую температуру.
По знаку теплового эффекта все реакции делятся на экзотермические и эндотермические. Экзотермические – реакции, протекающие с выделением тепла из системы в окружающую среду. Эндотермические – реакции, протекающие с поглощением тепла из окружающей среды.
Тепловой эффект реакции, измеренный при постоянных температуре и давлении, называется теплотой реакции Qр, а величина, описывающая изменение состояния системы и противоположная по знаку – энтальпией реакции ∆H. Энтальпии образования известны для нескольких тысяч веществ. Это позволяет расчётным путём установить энергетические эффекты разных процессов. Для измерения теплоты в системе СИ установлена единица джоуль [2, 7].
Для описания тепловых явлений в химических реакциях используют термохимические уравнения. Термохимические уравнения – химические уравнения с указанием теплового эффекта реакций.
Цель работы: определение теплового эффекта реакции нейтрализации сильной кислоты сильным основанием калориметрическим методом.
Задачи работы:
изучить и проанализировать литературу по проблеме исследования;
освоить калориметрический метод определения тепловых эффектов химических реакций;
провести исследования по определению тепловых эффектов реакции нейтрализации;
описать этапы работы и сделать выводы.
Методы исследования: изучение литературы, химический и физико-химический эксперимент, обработка результатов, наблюдение.
Объект исследования – взаимодействие сильной кислоты с сильным основанием.
Предмет исследования – тепловой эффект реакции нейтрализации.
Практическая значимость заключается в способности использования основных законов естественнонаучных дисциплин в практической деятельности, применения методов математического анализа и моделирования, теоретического и экспериментального исследования. Результаты нашей работы могут быть использованы на уроках химии и физики.
Мы изучили литературу (учебники Глинка Н.Л., Коровин Н.В. Общая химия, Мануйлов А.В., Родионов В.И. Основы химии, Смолова Л. М. Руководство к практическим занятиям по общей химии и другие) по темам «Тепловые эффекты химических реакций», «Определение теплоты реакций», «Энтальпия», «Термохимические уравнения».
Методика и результаты исследований.
Исследование проходило на базе Брянского государственного аграрного университета.
Реактивы, посуда и оборудование: модуль «Термостат», универсальный контроллер, мерные цилиндры, стаканы, растворы 0,15 моль/л NаOH, KOH 5 моль/л HCl, HNO3, H2SO4, дистиллированная вода. (Приложение 1)
Для определения теплоты нейтрализации мы использовали 0,15 м растворы NaOH, KOH. В стакан налили 100 мл щелочи и установили его в калориметр. Проводим нейтрализацию 5-ти молярные раствор соляной, серной и азотной кислот объёмом 3 мл из пипетки. В течение 4 минут фиксируем температуру «предварительного периода».
Определяем теплоту нейтрализации и разведения q1, приливая к большому объёму щелочи небольшой объём кислоты.
Определяем теплоту разведения кислоты q2, вливая раствор кислоты в воду. Объёмы кислоты и щелочи взяты в таких же объёмах, как при нейтрализации [6, 8].
Полученные данные заносим в таблицу.
Опыт №1
NаOH + HCl → NaCl + Н2О
Н++ОН—→ Н2О
Таблица 1
|
Время (т), мин |
||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
NаOH |
24,215 |
24,222 |
24,228 |
24,204 |
26,040 |
25,952 |
25,889 |
25,814 |
|
Н2О |
23,201 |
23,301 |
23,364 |
23,432 |
23,627 |
23,664 |
23,683 |
23,708 |
Опыт (щелочь и кислота) ∆t1 = t8 – t4 = 1,61
Контроль (вода и кислота) ∆t2 = t8 – t4 = 0,27
Теплоту нейтрализации определяют по формуле
q = (m1c1+m2c2+K) ∆t1 – (m2c2+m3c3+K) ∆t2
где m1, c1 – масса и теплоемкость щелочи;
m2, c2 – масса и теплоемкость кислоты;
m3, c3 – масса и теплоемкость воды;
∆t1, ∆t2 – разность температур при нейтрализации и разведении соответственно.
Полученный тепловой эффект (Дж) пересчитывают на 1 моль кислоты
Q = g 1000/V C
где V – объём кислоты, см3, с – концентрация кислоты, моль/л;
с (NаOH) = 0,15м, р (NаOH) = 1,005 г/см3
с (KOH) = 0,15м, р (KOH) = 1,001 г/см3
с (HCl) = 5м, р (HCl) = 1,082 г/см3
с (HNO3) = 5м, р (HNO3) = 1,16 г/см3
с (H2SO4) = 5м, р (H2SO4) = 1,137 г/см3
V щёлочи = 100 мл, V кислоты = 3 мл.
Расчёты – Приложение 2

Опыт №2
NаOH + HNO3 → NaNO3 + Н2О
Н++ОН—→ Н2О
Таблица 2
|
Время (т), мин |
||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
NаOH |
23,476 |
23,483 |
23,435 |
23,495 |
25,300 |
25,256 |
25,218 |
25,147 |
|
Н2О |
22,606 |
22,662 |
22,706 |
22,744 |
22,838 |
22,863 |
22,888 |
22,925 |
Опыт (щелочь и кислота) ∆t1 = t8 – t4 = 1,652
Контроль (вода и кислота) ∆t2 = t8 – t4 = 0,181

Опыт №3
2NаOH + H2SO4 → Na2SO4 + 2Н2О
Н++ОН—→ Н2О
Таблица 3
|
Время (т), мин |
||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
NаOH |
23,896 |
23,902 |
23,896 |
23,896 |
25,770 |
25,707 |
25,657 |
25,613 |
|
Н2О |
22,775 |
22,844 |
22,913 |
22,975 |
23,144 |
23,176 |
23,207 |
23,251 |
Опыт (щелочь и кислота) ∆t1 = t8 – t4 = 1,717
Контроль (вода и кислота) ∆t2 = t8 – t4 = 0,276

Опыт №4
KOH + HCl → KCl + Н2О
Н++ОН—→ Н2О
Таблица 4
|
Время (т), мин |
||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
KOH |
24,146 |
24,140 |
24,146 |
24,153 |
25,601 |
25,563 |
25,519 |
25,494 |
|
Н2О |
22,869 |
22,925 |
22,982 |
23,112 |
23,232 |
23,263 |
23,295 |
23,313 |
Опыт (щелочь и кислота) ∆t1 = t8 – t4 = 1,391
Контроль (вода и кислота) ∆t2 = t8 – t4 = 0,201

Опыт №5
KOH + HNO3 → KNO3 + Н2О
Н++ОН—→ Н2О
Таблица 5
|
Время (т), мин |
||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
KOH |
24,197 |
24,190 |
24,190 |
24,165 |
25,508 |
25,488 |
25,486 |
25,499 |
|
Н2О |
22,856 |
22,932 |
22,988 |
23,099 |
23,144 |
23,182 |
23,213 |
23,221 |
Опыт (щелочь и кислота) ∆t1 = t8 –t4 = 1,334
Контроль (вода и кислота) ∆t2 = t8 – t4 = 0,122

Опыт №6
2KOH + H2SO4 → K2SO4 + 2Н2О
Н++ОН—→ Н2О
Таблица 6
|
Время (т), мин |
||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
KOH |
24,021 |
24,021 |
24,015 |
24,021 |
25,557 |
25,500 |
25,437 |
25,495 |
|
Н2О |
23,025 |
23,107 |
23,157 |
23,213 |
23,370 |
23,395 |
23,420 |
23,451 |
Опыт (щелочь и кислота) ∆t1 = t8 – t4 = 1,474
Контроль (вода и кислота) ∆t2 = t8 – t4 = 0,238

Выводы
Мы изучили калориметрический метод определения теплового эффекта реакции нейтрализации сильной кислоты сильным основанием.
Мы определили тепловой эффект реакции, он приблизительно составил 55,9 кДж/моль (при температуре 298 К), что соответствует справочным данным. Проведенные опыты показали, что при взаимодействии одинаковых количеств (1 моль) сильной кислоты с сильным основанием в водных растворах выделяется примерно одинаковое количество теплоты. Теплота реакции нейтрализации постоянна, так как при взаимодействии сильных кислот и оснований, которые полностью диссоциируют в водных растворах, протекает реакция: Н++ОН—→ Н2О (ж) [9].
Мы рассчитали относительную ошибку опыта по формуле
П = Qтеор. – Qэксп./ Qтеор..100%.
Результаты были занесены в таблицу.
|
Взаимодействующие реагенты |
NаOH + HCl |
NаOH + HNO3 |
NаOH + H2SO4 |
KOH + HCl |
KOH + HNO3 |
KOH + H2SO4 |
|
Q, кДж |
54,715 |
60,144 |
58,903 |
48,42 |
49,4 |
50,36 |
|
П, % |
2,12 |
7,6 |
5,37 |
13,38 |
11,6 |
9,9 |
Заключение
В ходе выполнения данной работы были проанализированы различные учебники по теории и практическим занятиям по химии.
Во время выполнения работы были получены или улучшены следующие практические и исследовательские навыки: умение формулировать цели и задачи, выбирать методики и работать в соответствии с ними, подбирать соответствующие реактивы, собирать приборы, определять тепловой эффект реакции калориметрическим методом, наблюдать и фиксировать происходящее, оформлять результаты. Мы поняли, что в научных исследованиях тесно связаны все естественнонаучные дисциплины.
В ходе эксперимента были применены знания, полученные при изучении химии, математики, физики, информатики, мы определяли тепловой эффект калориметрическим методом, проводили математическую обработку результатов анализа, представляли данные в графическом виде.
Поставленная цель была достигнута, а задачи выполнены. Результаты работы считаем успешными.
В дальнейшем планируется продолжить изучение общих закономерностей химических процессов в разделе «Химическая кинетика. Скорость химических реакций. Химическое равновесие».
Список использованных источников
Глинка Н.Л. Общая химия. − Москва. Химия, 2003. − 728 с.
Под редакцией д.х.н., профессора С.Ф. Дунаева. Практическое пособие по общей и неорганической химии. – Москва. МГУ. 2002.
Коровин Н.В. Общая химия. − Москва. Высшая школа, 1998. − 557 с.
Мануйлов А.В., Родионов В.И. Основы химии. Новосибирский государственный университет. – Москва. Издательство «Центрополиграф», 2016. – 416 с.
Савельев Г.Г., Смолова Л.М. Общая химия. – Томск. Издательство Томского политехнического университета, 2005. − 206 с.
Смолова Л. М. Руководство к практическим занятиям по общей химии: учебное пособие. –Томск. Издательство Томского политехнического университета, 2010. – 152 с.
http://www.chem.msu.su/rus/teaching/general/praktika/part2.html
https://studfiles.net/preview/1770798/page:21/
http://chem-bsu.narod.ru/umk_chem_webCD/lwork/lr3.htm
Приложение 1. Реактивы, посуда и оборудование.


 [6].
[6].
схема калориметра.

модуль «Термостат»
Приложение 2. Расчёты.






Приложение 3. Фотоотчёт.





Авторы материала: Е. Козлова (9 класс), Д. Агейченкова (9 класс), И. Игнатичев (9 класс)
Подборка по базе: Правила оформления сводного отчета о прохождении производственно, Отчет о работе (1).doc, ИСП — отчет (копия).docx, Приложения к отчетам ЭЭбз-21-1,2,3 учебная (навыки ПО) (1).docx, Шишкин отчёт финал.docx, Отчет о воспитательной работе 3Б класс.docx, итоговый отчет.docx, новый отчет.docx, Тема №11.9 Узлы, используемые при работе с альпинистким снаряжен, Развитие нейрореаниматологии и формирование критериев смерти моз
Министерство науки и высшего образования Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего образования
Иркутский НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ
технический университет
Институт Заочно-вечернего обучения
Отчет по лабораторной работе «Определение теплоты реакции нейтрализации»
по дисциплине «Химия»
8 Вариант
Выполнил
Студент группы: ЭПбз — 21 — 1 ___________ А.Е. Андреев
Проверил преподаватель дисциплины: ___________ Ю.Н. Пожидаев
Иркутск 2022 г.
Лабораторная работа
Определение теплоты реакции нейтрализации
Выполнение работы
Любая реакция нейтрализации сильной кислоты щелочью сводится к процессу
Н+ + ОН‾ → Н2О.
Для определения теплового эффекта реакции можно воспользоваться упрощенным калориметром, состоящим из двух стаканов – внешнего и внутреннего.
Работу следует выполнять в следующем порядке.
В сухой внутренний стакан калориметра с помощью мерного цилиндра налить 25 мл 1 н. раствора щелочи. В отдельный сухой стакан налить 25 мл 1 н. раствора серной кислоты. Опустить в раствор щелочи термометр. Записать температуру раствора и, не вынимая термометр из калориметра, быстро влить кислоту в щелочь. Осторожно помешивая раствор термометром, отметить и записать максимальную температуру. Эту температуру считать конечной.
Требования к результатам работы
Исходные данные и результаты расчетов занести в таблицу 1.
Таблица 1
Данные опыта и результаты расчетов
| Температура Т, К | Изменение
энтальпии ∆Н, кДж |
∆Н°нейтр.практ., кДж/моль | ∆Н°нейтр. теор.,
кДж/моль |
Относит. ошибка опыта
Е, % |
|
| начальная | конечная | ||||
| 299,15 | 304,15 | 1,12 | 44,8 | 285,8 | 84.3 |
1. Вычислить изменение энтальпии реакции ∆Н по формуле:
ΔH = −V ∙ ρ ∙ c ∙ ΔТ=50*1*4,18*5,35=1,12кДж
где V – общий объем раствора, мл; ρ – плотность раствора, г/мл; с – теплоемкость раствора, Дж/(г∙К); ΔТ – разность между конечной и начальной температурами. Принять плотность раствора после нейтрализации равной 1 г/мл, а теплоемкость раствора − равной теплоемкости воды, т.е. 4,18 Дж/(г∙К).
2. Вычислить тепловой эффект реакции нейтрализации ∆Н°нейтр.(практ.) в расчете на 1 моль эквивалентов кислоты. Так как 1 моль эквивалентов кислоты содержится в 1 л раствора (концентрация равна 1 н.), а для реакции было взято 25 мл, то
 =
=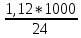 =44,8кДж
=44,8кДж
3. Используя следствие из закона Гесса, рассчитать теоретическое значение изменения энтальпии реакции нейтрализации ∆Н°нейтр.(теор.) для уравнения реакции:
Н+ + ОН‾ → Н2О.
соответственно равны 0; -230,2 и -285,8 кДж/моль.
Таблица 2
Стандартные энтальпии образования ∆Н°298
| Вещество | ∆Н°298, кДж/моль |
| Н+ | — |
| ОН‾ | -230,2 |
| Н2О | -285,8 |
4. Рассчитать относительную ошибку опыта Е (%):
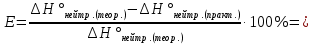
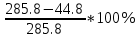 =84.3
=84.3
Цель
работы:
изучить основные понятия термохимии
(экзо- и эндотермические реакции, тепловой
эффект, энтальпия, энтальпия образования
вещества) , закон Гесса и следствие из
закона Гесса.
Задание:
провести реакцию нейтрализации и
определить повышение температуры. На
основании полученных данных рассчитать
теплоту и тепловой эффект реакции.
Выполнить требования к результатам
работы, оформить отчет, решить задачу.
Теоретическое введение
Химические
реакции сопровождаются выделением или
поглощением энергии
(чаще всего теплоты). Реакции,
протекающие с выделением теплоты,
называются экзотермическими,
а с поглощением
теплоты
– эндотермическими.
Количество
теплоты, которое выделяется или
поглощается
при химической реакции,
называется тепловым
эффектом реакции.
Тепловой эффект
реакции, протекающей при постоянном
давлении, равен изменению энтальпии
системы ΔН. При экзотермической реакции
энтальпия системы уменьшается
(ΔН
< 0), а при эндотермической – энтальпия
системы увеличивается (ΔН
> 0).
Если исходные
вещества и продукты реакции находятся
в стандартном состоянии, то в этом случае
энтальпию реакции называют стандартной
и обозначают ΔН0.
Определение
тепловых эффектов может быть осуществлено
опытным путем с
помощью калориметра или путем вычислений.
В основе термохимических расчетов
лежит закон
Гесса: тепловой
эффект химической реакции (т. е. изменение
энтальпии
ΔН)
зависит только от начального и конечного
состояния участвующих в реакции веществ
и не зависит от промежуточных стадий
процесса.
Часто
в термохимических расчетах применяют
следствие
из
закона
Гесса: энтальпия
химической реакции равна сумме энтальпий
образования продуктов реакции
за вычетом суммы энтальпий образования
исходных веществ с учетом стехиометрических
коэффициентов. Например,
стандартная энтальпия реакции
nА
+ mВ
→ рС + qD
рассчитывается
по формуле
ΔН
0х..р
== ( р Δ
f
Н
0
С
+ q
Δ
f
Н
0
,
D)
− ( n
Δ
f
Н
0
А
+ mΔ
f
Н0B),
где
Δ
f
Н0
– стандартная энтальпия образования
вещества.
Стандартной
энтальпией образования
вещества
называется
стандартная
энтальпия реакции образования 1 моль
данного вещества из простых веществ.
Выполнение работы
Любая реакция
нейтрализации сильной кислоты щелочью
сводится к процессу
Н+
+
ОН‾
→ Н2О
Для
определения теплового эффекта реакции
можно воспользоваться упрощенным
калориметром, состоящим из трех стаканов
– внешнего и двух внутренних.
В сухой внутренний
стакан калориметра с помощью мерного
цилиндра налить 25 мл раствора щелочи.
В другой сухой стакан налить 25 мл раствора
серной кислоты. Опустить в раствор
щелочи термометр. Записать температуру
и, не вынимая термометр из стакана,
быстро влить кислоту в щелочь. Осторожно
помешивая раствор термометром,
отметить и записать максимальную
температуру. Эту температуру считать
конечной.
Требования к
результатам работы:
Полученные данные занести в таблицу.
|
Температура Т, |
Изменение ∆Н, |
∆Н0нейтр.практ, |
∆Н0нейтр. кДж/моль |
Относит. ошибка Е, |
|
|
начальная |
конечная |
||||
Вычислить (все
вычисления пояснить словами):
1. Изменение
энтальпии реакции ∆Н по формуле
ΔH
= −V
∙
![]()
∙ c
∙ ΔТ,
где V
– общий объем раствора, мл;
– плотность раствора г/мл; с – теплоемкость
раствора, Дж/г ∙ К; ΔТ – разность между
конечной и начальной температурами.
Принять плотность раствора после
нейтрализации равной 1 г/мл, а
теплоемкость его
− равной теплоемкости воды, т. е. 4,18 Дж/г
∙ К.
2.
Тепловой эффект реакции нейтрализации
∆Н0нейтр.практ
в расчете на 1 моль эквивалентов
кислоты. Так как 1 моль эквивалентов
кислоты
содержится
в 1 л (1000 мл) раствора, а для реакции было
взято 25 мл, то
![]()
3.
Теоретическое
значение изменение энтальпии реакции
нейтрализации
![]()
для
уравнения Н+
+
ОН‾
→ Н2О.
Энтальпии образования Δ
f
Н0
Н+,
ОH‾
и Н2О
соответственно равны
0, -230,2 и -285,8 кДж/моль.
4.
Относительную
ошибку опыта (Е)

Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Министерство образования и науки Челябинской области
государственное бюджетное профессиональное
образовательное учреждение
«Южно-Уральский многопрофильный колледж»
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО
ВЫПОЛНЕНИЮ
лабораторной работы
ОПРЕДЕЛЕНИЕ ТЕПЛОТЫ НЕЙТРАЛИЗАЦИИ И ТЕПЛОВЫЕ ЭФФЕКТЫ
РЕАКЦИЙ РАСТВОРЕНИЯ
по ОП 06
Физическая химия
для студентов специальности
22.02.01 Металлургия чёрных металлов
Челябинск, 2017
ОДОБРЕНО:
ЦМК
Председатель _________________ / Г.В.Карзунова
Протокол № ______ от
__________________ 2017
Составитель:
преподаватель ГБПОУ
«ЮУМК» ________З.Ф. Скороходова
Рецензент:
Преподаватель спецдисциплин,
ПЦК «Коксохимическое
производство»
__________В.А.Дружинина
Методические указания по выполнению практических работ разработаны на
основе рабочей программы по ОП 06 «Физическая
химия»
Содержание практических работ
ориентировано на подготовку студентов к освоению – Общепрофессиональной
дисциплины программы подготовки специалистов среднего звена по специальности
«Металлургия черных металлов» и овладению
профессиональными компетенциями.
|
Содержание |
|
|
1.Введение |
4 |
|
2.Методические указания по |
5 |
|
3. |
7 |
|
4. Литература |
8 |
1 ВВЕДЕНИЕ
Содержание практических и лабораторных работ
направлено на реализацию Федеральных государственных требований к минимуму
содержания и уровню подготовки выпускников средних специальных учебных
заведений и составлено на основе рабочей программы по ОП 06 «Физическая химия».
Ведущей
дидактической целью практических занятий является формирование профессиональных
практических умений необходимых в последующей учебной деятельности по общепрофессиональным дисциплинам.
В соответствии с рабочей программой учебной ОП 06 «Физическая химия » предусмотрено проведение лабораторных занятий.
В результате их выполнения, обучающийся должен:
уметь:
— методы оценки свойств металлов и сплавов;
знать:
—
теоретические основы химических и физико-химических процессов, лежащих в основе
металлургического производства
Содержание практических работ
ориентировано на подготовку студентов к освоению Общей профессиональной
дисциплины программы подготовки
специалистов среднего звена основной по
специальности и овладению профессиональными компетенциями:
ПК 1.1. Осуществлять
технологические операции по производству черных металлов.
ПК 1.2. Использовать системы
автоматического управления технологическим процессом.
ПК 1.3. Эксплуатировать
технологическое и подъемно-транспортное оборудование, обеспечивающее процесс
производства черных металлов.
ПК 1.4. Анализировать качество
сырья и готовой продукции.
ПК 2.1. Планировать и
организовывать собственную деятельность, работу подразделения, смены, участка,
бригады, коллектива исполнителей.
ПК 3.1. Принимать участие в
разработке новых технологий и технологических процессов.
ПК 3.2. Участвовать в обеспечении и
оценке экономической эффективности.
А также формированию
общих компетенций:
OK 1. Понимать сущность и
социальную значимость своей будущей профессии, проявлять к ней устойчивый
интерес.
ОК 2. Организовывать собственную
деятельность, выбирать типовые методы и способы выполнения профессиональных
задач, оценивать их эффективность и качество.
ОК 3. Принимать решения в
стандартных и нестандартных ситуациях и нести за них ответственность.
ОК 4. Осуществлять поиск и
использование информации, необходимой для эффективного выполнения
профессиональных задач, профессионального и личностного развития.
ОК 5. Использовать
информационно-коммуникационные технологии в профессиональной деятельности.
ОК 6. Работать в коллективе и
команде, эффективно общаться с коллегами, руководством, потребителями.
ОК 8. Самостоятельно определять
задачи профессионального и личностного развития, заниматься самообразованием,
осознанно планировать повышение квалификации.
Выполнение студентами лабораторных работ по учебному
плану ОП .06 «Физическая
химия» направлено на:
—
обобщение, систематизацию, углубление, закрепление, развитие и детализацию полученных теоретических знаний по
конкретным темам учебной дисциплины;
—
формирование умений применять полученные знания на практике, реализацию
единства интеллектуальной и практической деятельности;
— формирование и развитие умений:
наблюдать, сравнивать, сопоставлять, анализировать, делать выводы и обобщения, самостоятельно вести
исследования, пользоваться различными приемами измерений, оформлять
результаты в виде таблиц, схем, графиков;
—
приобретение навыков работы с различными
приборами, аппаратурой, установками и другими техническими средствами
для проведения опытов;
2 МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Лабораторная работа № 2
«Определение теплоты нейтрализации и тепловые эффекты реакций
растворения»
Опыт 1. Определение теплоты нейтрализации.
Цель работы. Научиться пользоваться
техническими весами и работе с лабораторными термометрами. Определить теплоту
нейтрализации сильной кислоты сильным основанием.
Приборы и реактивы. Химический стакан. Мерные
цилиндры. Термометр. Растворы: 0,1 М HCl; 0,1 М NaOH.
Порядок выполнения работы
1. На технических весах взвесить и
определить массу химического стакана.
2. Отмерить мерным цилиндром 25 мл
0,1 М раствора NaOH и перелить в химический стакан. Измерить температуру
раствора щелочи с точностью до 0,1 оС.
3. Отмерить мерным цилиндром 25 мл
0,1 М раствора HCl. Быстро влить кислоту в химический стакан со щелочью,
перемешать содержимое стеклянной палочкой или на магнитной мешалке и отметить
максимальную температуру, которую покажет термометр после объединения
растворов.
4. Определение повторить два раза
и взять для дальнейших расчетов средний результат.
5. По результатам опыта заполнить
таблицу.
|
Масса калориметрического стакана m, |
Объем жидкости в калориметрическом |
Температура t, оС |
|
|
начальная |
конечная |
||
6. Записать уравнение реакции
нейтрализации в молекулярном и ионном виде между реагирующими веществами и рассчитать ![]() ,
,
пользуясь следствием из закона Гесса.
![]() ,
,
зная, что ![]() ;
;![]() кДж/моль;
кДж/моль; ![]() кДж/моль.
кДж/моль.
7. По полученным данным
определить:
— разницу температур: ∆t = tк – tн,
K;
— массу жидкости в калориметрическом
стакане: m = ρ∙V, если
ρр–ра = 1,0 г/мл;
— теплоемкость системы (∑С):
∑С = С1m1 + C2m2;
[Дж/K],
где m1 и m2 –
массы калориметрического стакана и жидкости в стакане, кг;
С1 и С2 –
удельные теплоемкости стекла и жидкости.
Сстекла = 0,75∙103 Дж/кг∙K; Сжидкости =
4,18∙103 Дж/кг∙K;
— количество теплоты Q,
выделившейся при реакции
Q = ∑C∙∆t; [Дж];
— число молей воды, учитывая, что из 1
моля щелочи получается 1 моль воды, а СNaOH = СHCl =
0,1 моль/л
![]() моль;
моль;
— практическое изменение энтальпии реакции
нейтрализации, кДж/моль
![]() ;
;
— ошибку опыта α, % по формуле
α =  ∙100,
∙100,
%;
— изменение энтропии реакции
нейтрализации, ![]() ,
,
для чего воспользуемся следствием из закона Гесса и табличными значениями
![]() ;
;
![]() ;
; ![]() Дж/моль∙K;
Дж/моль∙K; ![]() Дж/моль∙K;
Дж/моль∙K;
— изменение энергии Гиббса ∆Gх.р. реакции
нейтрализации по формуле
![]() S
S![]() ,
,
где Т – начальная
температура, K.
8. Сделать вывод о соответствии
величины и знака ∆Gх.р. самопроизвольному течению проделанной
Вами реакции нейтрализации.
Опыт 2. «Тепловые эффекты реакций растворения»
Цель работы. Экспериментально определить тепловые эффекты реакций
растворения веществ. Составить термохимические уравнения.
Приборы и реактивы. Технические весы. Термометр. Химические стаканы. Мерные
цилиндры. Конические колбы. Стеклянные палочки.![]() Медный
Медный
купорос (CuSO4). Цинковая пыль (Zn). Хлорид натрия (NaCl). Нитрат
аммония (NH4NO3). Гидроксид натрия (NaOH). Вода
дистиллированная.
Порядок выполнения работы
Опыт 2.1. Определение теплового эффекта реакции
замещения меди из раствора ее соли цинком.
1. Взвесить на технических весах 5 г медного купороса и
растворить в 50 мл воды. Замерить и записать температуру полученного раствора (Тн).
2. Взвесить 1 г цинковой пыли и всыпать ее в раствор
сульфата меди.
3. При помощи термометра определить максимальную
температуру раствора (Тк). Количество выделившегося при
реакции тепла рассчитать по формуле:
![]() ,
,
где ∆T – изменение температуры раствора (∆T = Tк – Tн),
K;
C –
удельная теплоемкость, Cводы = 4,18 кДж/кг∙K;
m – масса
веществ, кг.
4. Полученный результат пересчитать на 1 моль цинка и
записать термохимическое уравнение данной реакции.
Опыт 2.2 Тепловые явления при растворении твердых
веществ.
1. Налить в три стакана или колбы по 25 мл воды. Измерить
температуру воды (Тн).
2. Взвесить на технических весах по 5 г хлорида натрия,
нитрата аммония и гидроксида натрия.
3. Всыпать: в первый стакан хлорид натрия, во второй –
нитрат аммония, в третий – гидроксид натрия (осторожно).
4. Навески веществ размешать в воде до полного растворения
и измерить температуры полученных растворов (Тк).
5. По полученным данным рассчитать количество выделившейся
или поглощенной при реакции теплоты по формуле:
![]() ,
,
где ∆T – изменение температуры раствора, K (∆T = Тк – Тн);
m1 – масса воды, кг;
m2 – масса кристаллического вещества, кг;
C –
теплоемкость воды, C = 4,18 кДж/кг∙K.
6. Полученный результат пересчитать на 1 моль
кристаллического вещества, раствор которого готовили, и записать
термохимическое уравнение данного процесса.
7. По полученным данным заполнить таблицу.
|
Вещество |
Температура Т, оС |
Q, кДж |
Выводы* |
||
|
начальная |
конечная |
∆Т |
|||
* Указать, является ли данный процесс растворения
термохимическим, если да, то эндотермическим или экзотермическим.
Вопросы для контроля:
1. Дайте определение тепловой эффект реакции.
2. Сформулируйте основной закон термохимии –
закон Гесса.
3. Что такое энтальпия и ее физический смысл?
4. Что такое энтропия и ее физический смысл?
4 ЛИТЕРАТУРА
Основные источники:
1.
Белик, В.В.
Физическая и коллоидная химия [Текст]: учебник для студентов учреждений сред.
проф. образ./ В.В. Белик, К.И. Киенская. -8-е изд., испр. -М.: Академия, 2013-
228 с. :ил.,табл.(Среднее проф.образование.)
2.
Горбунцов, С.В.
Физическая и коллоидная химия [Текст]: учеб. для проф. образ./ С.В. Горбунцов,
Э.А. Муллоярова. – М.: Альфа-М ИНФРА -М, 2010.-240с.:ил.,табл.
Дополнительные
источники:
1. Шварцман Л.А..
Начала физической химии для металлургов[Текст]: учеб. для проф. образ./ Л.А.
Шварцман, А. М. Жуховицкий.- А.: Металлургия, 2001 -352с.:ил.
2. Стромберг. А.Г. Физическая химия [Текст]: учеб.
для проф. образ./ А.Г. Стромберг.- М.: Высшая школа, 2001-98с.:ил.
3. Борнацкий, И.И. Основы физической химии [Текст]:
учеб. для проф. образ. / И.И. Борнацкий. — М.: Металлургия, 1999-152с.:ил.
4.
Ипполитов
Е.Г.. Физическая химия [Текст]:учеб. для проф. образ ./ Е.Г. Ипполитов, Н.В.
Артемов.- М.: Академия, 2005. -310с. :ил.
Интернет-ресурсы:
1. http://lcr.tsu.ru/kurzina/download/файл4_Labornii%20practicum_Kurzina.pdf
