В протолитометрии
различают 4 вида индикаторных
ошибок: водородная, гидроксильная,
кислотная и основная.
-
Водородная
(Н+) ошибка
возникает при титровании сильных
электролитов (сильное – сильное)
и обусловлена избытком протонов в
растворе. Эта ошибка имеет место, если
сильная кислота
недотитрована, а сильное основание
– перетитровано. -
Гидроксильная
(ОН–) ошибка
также характерна для титрования
системы сильное – сильное и возникает
при избытке гидроксо—групп
в растворе. Сильная кислота при этом
будет перетитрована, а сильное
основание – недотитровано. -
Кислотная
ошибка проявляется при титровании
слабой кислоты сильным основанием,
в том случае, когда слабая кислота
недотитрована и в растворе избыток
протонов. -
Основная ошибка
характеризует систему слабое
основание
сильная кислота в момент, когда
слабое основание недотитровано, т.е.
при избытке в растворе гидроксо-групп.
Так как при
титровании слабых электролитов в
качестве титранта обычно используют
сильный электролит (щелочь или кислоту),
то в перетитрованном растворе
избыток титранта создает погрешность
1-го или 2-го типа: водородную или
гидроксильную ошибку.
Главным критерием
применимости того или иного индикатора
является значение индикаторной ошибки,
которая не должна превышать 0,5%. Если
погрешность выше, то такой индикатор
применять нельзя.
4.3. Методы и способы титрования. Титр, титр по определяемому веществу
Аналитическая
характеристика каждого титриметрического
метода включает наиболее существенные
его особенности: приготовление и свойства
рабочих растворов, виды кривых титрования,
погрешности определения, способы
индикации точки эквивалентности и
практическое применение. На основании
этого все методы титрования
классифицируют
по 2-м признакам: типу
реакции,
лежащей в основе
метода
и способу проведения анализа.
Каждый вид титрования имеет свои
особенности и закономерности и может
осуществляться различными способами.
Как видно из схемы (рис. 4.9), в зависимости
от типа
реакции,
лежащей в основе метода, различают 4-ре
вида
титрования:
-
кислотно-основное
или метод нейтрализации (протолитометрия); -
окислительно-восстановительное
(редоксиметрия); -
комплексометрическое;
-
осадительное
(метод седиментации).

Рисунок
4.9 – Классификация методов титрования
в соответствии с типом химической
реакции (где L
– комплексный ион; МеL
– образовавшийся комплекс; А – осаждаемое
вещество, В – титрант, АВ – осадок).
4.3.1 Способы титрования.
Так как напрямую,
реакцией с титрантом, можно анализировать
далеко не любое вещество, особенно, если
оно неустойчиво на воздухе, то для
решения подобных задач было разработано
несколько приемов
(способов)
проведения анализа. Они
позволяют заменять неустойчивые,
в данных условиях соединения,
на эквивалентное количество более
устойчивого, которое не подвергается
гидролизу или окислению. Известны
следующие основные способы
проведения титриметрического анализа:
-
прямое
титрование; -
реверсивное;
-
обратное титрование
или титрование по остатку; -
косвенное
титрование или по замещению (по
заместителю).
В таблице 4.1 показаны
области применения различных способов
в зависимости от вида титрования.
Таблица 4.1 –
Применение различных видов и способов
титрования.
|
название метода |
частное название метода; (рабочий раствор) |
вещества, |
||
|
прямым |
обратным |
косвенным |
||
|
Протолито-метрия |
Ацидиметрия
(кислоты: |
основания;
соли, образован-ные сильным |
соли слабых оснований и сильных кислот; органические соединения |
|
|
Алкалиметрия
(щелочи: |
кислоты;
соли, образован-ные слабым |
|
|
|
|
Редокси-метрия |
Перманганато-метрия |
восстановители |
окислители |
вещества, реагирующие с восстанови-телями |
|
Иодометрия
( и |
восстановители |
восстановители |
окислители; кислоты |
|
|
Комплексо-метрия |
Комплексоно- метрия (ЭДТА) |
катионы, образующие с ЭДТА комплексы |
катионы в водо-нерастворимых катионы,
для которых отсутствует |
катионы, образующие с ЭДТА |
|
Метод |
Аргентометрия
( |
Анионы, образую-щие с |
катионы, образующие |
|
Рассмотрим подробнее
суть различных способов титрования.
1. Прямое
титрование заключается в
непосредственном взаимодействии
титранта и титруемого вещества. В
процессе титрования к аликвоте или
навеске вещества постепенно добавляют
раствор титранта, объем которого точно
фиксируют в Т. Э. В качестве титранта
используют рабочий раствор известной
концентрации. Расчет содержания вещества
в образце выполняют по закону эквивалентов:
![]()
=
![]()
(4.1)
где
– количество моль-эквивалентов
анализируемого вещества в титруемом
образце; а
количество
моль-эквивалентов титранта, вступившего
в реакцию с определяемым компонентом
А.
Концентрацию
компонента А в растворе вычисляют
по формуле:
![]()
(4.2)
где
![]()
– молярная концентрация эквивалента
(нормальность) титруемого раствора
(определяемого компонента), моль-экв/л;
![]()
– объем аликвоты титруемого раствора,
мл;
![]()
–
концентрация и
![]()
объем титранта в
точке эквивалентности. При титровании
методом отдельных навесок формула
(4.2) преобразуется в выражение (4.3):
![]()
(4.3)
Метод применяется
во всех случаях, когда нет каких-либо
ограничений. Например, при анализе
кислот, определении жесткости воды.
2. Реверсивное
титрование – это разновидность
прямого титрования, когда рабочий и
титруемый растворы меняют местами. В
этом случае для анализа отбирают
аликвоты рабочего раствора, а в Т.Э.
измеряют израсходованный на
титрование объем анализируемого
раствора. Вычисления проводят также,
как и в прямом титровании, по формулам
(4.2) или (4.3). Метод позволяет ограничить
площадь поверхности раствора,
контактирующей с воздухом, при
стандартизации относительно неустойчивых
соединений, как например NaOH.
Титрование по
заместителю (косвенное) и титрование
по остатку (обратное) основаны
на использовании вспомогательного
раствора, взаимодействующего с
определяемым компонентом. Такой прием
позволяет выполнять анализ химически
нестойких объектов или же при отсутствии
подходящего индикатора.
В косвенном
титровании сначала осуществляют
реакцию определяемого вещества
А со вспомогательным раствором
В, а затем титруют
эквивалентное количество
образовавшегося продукта реакции
С (заместитель). Этот способ
можно представить в виде схемы: А + В
![]()
С + (т-т) , исходя из которой запишем
выражение для закона эквивалентов:
=
![]()
=
![]()
.
(4.4)
Из равенства (4.4)
следует, что
=
и расчет можно также выполнять по
формулам (4.2) и (4.3), используемых для
прямого титрования. Для полноты реакции
вспомогательный раствор всегда берут
с небольшим избытком. Такой метод
титрования реализуется в йодометрии.
В обратном
титровании также сначала протекает
реакция между определяемым
веществом А и
взятым в избытке вспомогательным
раствором В, но затем титруют
остаток не прореагировавшего
вспомогательного раствора. Поэтому
необходимо точно знать концентрацию
вспомогательного раствора В и его
объем, взятый для анализа. Определение
компонента А выполняется согласно
схеме: А + В
Вост + (т-т). Исходя из
условий титрования, закон эквивалентов
можно записать в виде:
![]()
–
=
.
(4.5)
Откуда имеем:
=
.
(4.6)
Если все вещества
взяты в виде растворов, то формула (4.6)
примет вид
![]()
(4.7)
Если хотя бы одно
из веществ взято в сухом виде (известна
его масса), то следует воспользоваться
выражением (4.6) и записать значение
![]()
для каждого из веществ индивидуально.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
В протолитометрии
различают 4 вида индикаторных
ошибок: водородная, гидроксильная,
кислотная и основная.
-
Водородная
(Н+) ошибка
возникает при титровании сильных
электролитов (сильное – сильное)
и обусловлена избытком протонов в
растворе. Эта ошибка имеет место, если
сильная кислота
недотитрована, а сильное основание
– перетитровано. -
Гидроксильная
(ОН–) ошибка
также характерна для титрования
системы сильное – сильное и возникает
при избытке гидроксо—групп
в растворе. Сильная кислота при этом
будет перетитрована, а сильное
основание – недотитровано. -
Кислотная
ошибка проявляется при титровании
слабой кислоты сильным основанием,
в том случае, когда слабая кислота
недотитрована и в растворе избыток
протонов. -
Основная ошибка
характеризует систему слабое
основание
сильная кислота в момент, когда
слабое основание недотитровано, т.е.
при избытке в растворе гидроксо-групп.
Так как при
титровании слабых электролитов в
качестве титранта обычно используют
сильный электролит (щелочь или кислоту),
то в перетитрованном растворе
избыток титранта создает погрешность
1-го или 2-го типа: водородную или
гидроксильную ошибку.
Главным критерием
применимости того или иного индикатора
является значение индикаторной ошибки,
которая не должна превышать 0,5%. Если
погрешность выше, то такой индикатор
применять нельзя.
4.3. Методы и способы титрования. Титр, титр по определяемому веществу
Аналитическая
характеристика каждого титриметрического
метода включает наиболее существенные
его особенности: приготовление и свойства
рабочих растворов, виды кривых титрования,
погрешности определения, способы
индикации точки эквивалентности и
практическое применение. На основании
этого все методы титрования
классифицируют
по 2-м признакам: типу
реакции,
лежащей в основе
метода
и способу проведения анализа.
Каждый вид титрования имеет свои
особенности и закономерности и может
осуществляться различными способами.
Как видно из схемы (рис. 4.9), в зависимости
от типа
реакции,
лежащей в основе метода, различают 4-ре
вида
титрования:
-
кислотно-основное
или метод нейтрализации (протолитометрия); -
окислительно-восстановительное
(редоксиметрия); -
комплексометрическое;
-
осадительное
(метод седиментации).

Рисунок
4.9 – Классификация методов титрования
в соответствии с типом химической
реакции (где L
– комплексный ион; МеL
– образовавшийся комплекс; А – осаждаемое
вещество, В – титрант, АВ – осадок).
4.3.1 Способы титрования.
Так как напрямую,
реакцией с титрантом, можно анализировать
далеко не любое вещество, особенно, если
оно неустойчиво на воздухе, то для
решения подобных задач было разработано
несколько приемов
(способов)
проведения анализа. Они
позволяют заменять неустойчивые,
в данных условиях соединения,
на эквивалентное количество более
устойчивого, которое не подвергается
гидролизу или окислению. Известны
следующие основные способы
проведения титриметрического анализа:
-
прямое
титрование; -
реверсивное;
-
обратное титрование
или титрование по остатку; -
косвенное
титрование или по замещению (по
заместителю).
В таблице 4.1 показаны
области применения различных способов
в зависимости от вида титрования.
Таблица 4.1 –
Применение различных видов и способов
титрования.
|
название метода |
частное название метода; (рабочий раствор) |
вещества, |
||
|
прямым |
обратным |
косвенным |
||
|
Протолито-метрия |
Ацидиметрия
(кислоты: |
основания;
соли, образован-ные сильным |
соли слабых оснований и сильных кислот; органические соединения |
|
|
Алкалиметрия
(щелочи: |
кислоты;
соли, образован-ные слабым |
|
|
|
|
Редокси-метрия |
Перманганато-метрия |
восстановители |
окислители |
вещества, реагирующие с восстанови-телями |
|
Иодометрия
( и |
восстановители |
восстановители |
окислители; кислоты |
|
|
Комплексо-метрия |
Комплексоно- метрия (ЭДТА) |
катионы, образующие с ЭДТА комплексы |
катионы в водо-нерастворимых катионы,
для которых отсутствует |
катионы, образующие с ЭДТА |
|
Метод |
Аргентометрия
( |
Анионы, образую-щие с |
катионы, образующие |
|
Рассмотрим подробнее
суть различных способов титрования.
1. Прямое
титрование заключается в
непосредственном взаимодействии
титранта и титруемого вещества. В
процессе титрования к аликвоте или
навеске вещества постепенно добавляют
раствор титранта, объем которого точно
фиксируют в Т. Э. В качестве титранта
используют рабочий раствор известной
концентрации. Расчет содержания вещества
в образце выполняют по закону эквивалентов:
![]()
=
![]()
(4.1)
где
– количество моль-эквивалентов
анализируемого вещества в титруемом
образце; а
количество
моль-эквивалентов титранта, вступившего
в реакцию с определяемым компонентом
А.
Концентрацию
компонента А в растворе вычисляют
по формуле:
![]()
(4.2)
где
![]()
– молярная концентрация эквивалента
(нормальность) титруемого раствора
(определяемого компонента), моль-экв/л;
![]()
– объем аликвоты титруемого раствора,
мл;
![]()
–
концентрация и
![]()
объем титранта в
точке эквивалентности. При титровании
методом отдельных навесок формула
(4.2) преобразуется в выражение (4.3):
![]()
(4.3)
Метод применяется
во всех случаях, когда нет каких-либо
ограничений. Например, при анализе
кислот, определении жесткости воды.
2. Реверсивное
титрование – это разновидность
прямого титрования, когда рабочий и
титруемый растворы меняют местами. В
этом случае для анализа отбирают
аликвоты рабочего раствора, а в Т.Э.
измеряют израсходованный на
титрование объем анализируемого
раствора. Вычисления проводят также,
как и в прямом титровании, по формулам
(4.2) или (4.3). Метод позволяет ограничить
площадь поверхности раствора,
контактирующей с воздухом, при
стандартизации относительно неустойчивых
соединений, как например NaOH.
Титрование по
заместителю (косвенное) и титрование
по остатку (обратное) основаны
на использовании вспомогательного
раствора, взаимодействующего с
определяемым компонентом. Такой прием
позволяет выполнять анализ химически
нестойких объектов или же при отсутствии
подходящего индикатора.
В косвенном
титровании сначала осуществляют
реакцию определяемого вещества
А со вспомогательным раствором
В, а затем титруют
эквивалентное количество
образовавшегося продукта реакции
С (заместитель). Этот способ
можно представить в виде схемы: А + В
![]()
С + (т-т) , исходя из которой запишем
выражение для закона эквивалентов:
=
![]()
=
![]()
.
(4.4)
Из равенства (4.4)
следует, что
=
и расчет можно также выполнять по
формулам (4.2) и (4.3), используемых для
прямого титрования. Для полноты реакции
вспомогательный раствор всегда берут
с небольшим избытком. Такой метод
титрования реализуется в йодометрии.
В обратном
титровании также сначала протекает
реакция между определяемым
веществом А и
взятым в избытке вспомогательным
раствором В, но затем титруют
остаток не прореагировавшего
вспомогательного раствора. Поэтому
необходимо точно знать концентрацию
вспомогательного раствора В и его
объем, взятый для анализа. Определение
компонента А выполняется согласно
схеме: А + В
Вост + (т-т). Исходя из
условий титрования, закон эквивалентов
можно записать в виде:
![]()
–
=
.
(4.5)
Откуда имеем:
=
.
(4.6)
Если все вещества
взяты в виде растворов, то формула (4.6)
примет вид
![]()
(4.7)
Если хотя бы одно
из веществ взято в сухом виде (известна
его масса), то следует воспользоваться
выражением (4.6) и записать значение
![]()
для каждого из веществ индивидуально.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
|
|
Макеты страниц
Индикаторная ошибка. Изменение цвета индикатора происходит не абсолютно точно в точке эквивалентности, а раньше или позже, поэтому химик-аналитик допускает некоторую ошибку, прекращая титрование раньше или позже требуемого момента. Такую ошибку называют индикаторной ошибкой. Величина ее может колебаться в самых широких пределах в зависимости от того, насколько удачно выбран примененный индикатор.
Предположим, что для титрования 0,1 н. раствора слабой кислоты с  н. раствором сильной щелочи мы использовали два индикатора: метиловый оранжевый
н. раствором сильной щелочи мы использовали два индикатора: метиловый оранжевый  и фенолфталеин
и фенолфталеин  . Посмотрим, что произойдет в обоих случаях титрования.
. Посмотрим, что произойдет в обоих случаях титрования.  исходной кислоты равен 2,87; в точке эквивалентности
исходной кислоты равен 2,87; в точке эквивалентности  (см. § 16).
(см. § 16).
В случае прибавления к титруемой кислоте метилового оранжевого раствор окрасится в красный цвет. Вскоре после прибавления первых порций сильного основания  раствора станет равным 3,1 и раствор окрасится в оранжевый цвет, а при
раствора станет равным 3,1 и раствор окрасится в оранжевый цвет, а при  раствор окрасится в желтый цвет, не изменяющийся при дальнейшем добавлении щелочи. Следовательно, после прибавления нескольких миллилитров, а быть может и капель щелочи придется прекратить титрование раньше достижения точки эквивалентности. Рассчитанное количество титруемой кислоты может оказаться в несколько раз ниже, чем действительное ее содержание, и индикаторная ошибка может достичь 75—85%.
раствор окрасится в желтый цвет, не изменяющийся при дальнейшем добавлении щелочи. Следовательно, после прибавления нескольких миллилитров, а быть может и капель щелочи придется прекратить титрование раньше достижения точки эквивалентности. Рассчитанное количество титруемой кислоты может оказаться в несколько раз ниже, чем действительное ее содержание, и индикаторная ошибка может достичь 75—85%.
Если же к титруемой кислоте прибавить фенолфталеин, то раствор будет оставаться бесцветным до тех пор, пока по мере прибавления к нему щелочи  раствора не достигнет 8,0. При
раствора не достигнет 8,0. При  раствор порозовеет, а при
раствор порозовеет, а при  раствор окрасится в красный цвет.
раствор окрасится в красный цвет.
Так как в точке эквивалентности  что укладывается в интервал
что укладывается в интервал  , то рассчитанное количество кислоты будет практически отвечать действительному ее содержанию и индикаторная ошибка составит
, то рассчитанное количество кислоты будет практически отвечать действительному ее содержанию и индикаторная ошибка составит  .
.
Таким образом, если индикатор выбран правильно, то индикаторную ошибку не принимают во внимание; если же индикатор выбран неправильно, то индикаторная ошибка превышает допустимые погрешности и может достигать очень большой величины. В случаях, требующих более точных результатов, следует учитывать индикаторные ошибки.
Типы индикаторных ошибок. К индикаторным ошибкам относят такие, которые вызываются недотитрованием или перетитрованием исследуемого раствора. В методе нейтрализации различают несколько типов индикаторных ошибок.
а) Водородная ошибка титрования, вызываемая наличием в титруемом растворе по окончании титрования избытка ионов водорода, остающихся в растворе в результате недотитрования сильной кислоты сильной щелочью (обозначается  -ошибка) или перетитрования сильного основания сильной кислотой (обозначается
-ошибка) или перетитрования сильного основания сильной кислотой (обозначается  -ошибка).
-ошибка).
б) Гидроксильная ошибка титрования, вызываемая наличием в титруемом растворе по окончании титрования избытка ионов гидроксила, остающихся в растворе в результате недотитрования сильного основания сильной кислотой ( -ошибка) или перетитрования сильной кислоты сильной щелочью (
-ошибка) или перетитрования сильной кислоты сильной щелочью ( -ошибка).
-ошибка).
в) Кислотная ошибка титрования, вызываемая присутствием в титруемом растворе по окончании титрования нейтральных молекул недотитрованной слабой кислоты ( -ошибка).
-ошибка).
г) Щелочная ошибка титрования, вызываемая присутствием в титруемом растворе по окончании титрования нейтральных молекул недотитрованного слабого основания ( -ошибка).
-ошибка).
Примеры вычисления ошибок титрования.  шибка. Предположим, что для титрования сильной кислоты сильным основанием выбран индикатор с
шибка. Предположим, что для титрования сильной кислоты сильным основанием выбран индикатор с  (например, метиловый оранжевый). Титрование заканчивается при
(например, метиловый оранжевый). Титрование заканчивается при  , т. е. при
, т. е. при  (в кислой среде). Следовательно, часть титруемой кислоты будет недотитрована и мы допустим
(в кислой среде). Следовательно, часть титруемой кислоты будет недотитрована и мы допустим  -ошибку. Вычислим ее величину.
-ошибку. Вычислим ее величину.
Пусть концентрация титруемой кислоты  начальный объем кислоты
начальный объем кислоты  объем раствора в конце титрования
объем раствора в конце титрования  .
.
Каждый миллилитр 0,1 н. раствора кислоты или щелочи содержит  г-экв. Для
г-экв. Для  титрования взято
титрования взято  г-экв кислоты.
г-экв кислоты.
Неоттитрованных ионов водорода  останется
останется  , или
, или  раствора
раствора  г-экв кислоты. Эта величина и составляет водородную ошибку титрования, обусловливаемую недотитрованием
г-экв кислоты. Эта величина и составляет водородную ошибку титрования, обусловливаемую недотитрованием  -ионов.
-ионов.
Величину  -ошибки (в процентах) вычисляют согласно пропорции:
-ошибки (в процентах) вычисляют согласно пропорции:  ошибка
ошибка 

В нашем примере

 -шибка. Предположим, что для титрования сильной кислоты сильным основанием выбран индикатор с
-шибка. Предположим, что для титрования сильной кислоты сильным основанием выбран индикатор с  (например, фенолфталеин). В этом случае титрование заканчивается при
(например, фенолфталеин). В этом случае титрование заканчивается при  , т. е. при
, т. е. при  щелочной среде. Следовательно, при титровании будет прилит некоторый избыток щелочи, что приведет к
щелочной среде. Следовательно, при титровании будет прилит некоторый избыток щелочи, что приведет к  -ошибке. Вычислим ее величину.
-ошибке. Вычислим ее величину.
Концентрация щелочи к концу титрования составит:

или

В  раствора
раствора  г-экв щелочи.
г-экв щелочи.
Эта величина и составляет гидроксильную ошибку титрования, обусловливаемую перетитрованием кислоты щелочью.
В процентах:

В нашем примере (при  :
:

Это означает, что при титровании сильной кислоты сильным основанием в присутствии метилового оранжевого изменение окраски индикатора наступает раньше, а при титровании в присутствии фенолфталеина (при условии отсутствия в растворе  ) — после достижения точки эквивалентности, причем ошибка титрования при использовании фенолфталеина в 10 раз меньше ошибки титрования с индикатором метиловым оранжевым.
) — после достижения точки эквивалентности, причем ошибка титрования при использовании фенолфталеина в 10 раз меньше ошибки титрования с индикатором метиловым оранжевым.
Так как величина концентрации титруемого раствора входит в знаменатель дроби, то ошибка титрования будет тем больше, чем менее концентрированный раствор титруют.
Поэтому, чтобы избежать больших ошибок титрования, не следует титровать слишком разбавленные растворы очень разбавленными титрантами.
Влияние области интервала перехода индикатора на величину ошибки титрования. При титровании оснований в присутствии индикатора метилового оранжевого  необходимо не только прибавить требуемое по расчету количество сильной кислоты, но и добавить некоторый ее избыток, для того чтобы окраска индикатора изменилась от желтой к оранжево-красной.
необходимо не только прибавить требуемое по расчету количество сильной кислоты, но и добавить некоторый ее избыток, для того чтобы окраска индикатора изменилась от желтой к оранжево-красной.
Если  , то этот избыток (
, то этот избыток ( ) вычисляют по формуле:
) вычисляют по формуле:

При  эта величина возрастает до
эта величина возрастает до  . Такая ошибка совершенно недопустима. Поэтому, чтобы избежать слишком больших ошибок титрования, не следует применять при титровании оснований индикаторы, интервалы перехода которых лежат ниже
. Такая ошибка совершенно недопустима. Поэтому, чтобы избежать слишком больших ошибок титрования, не следует применять при титровании оснований индикаторы, интервалы перехода которых лежат ниже  .
.
При титровании кислоты в присутствии фенолфталеина  необходимо прибавить некоторый избыток щелочи, чтобы индикатор из бесцветной формы перешел в окрашенную. Избыток
необходимо прибавить некоторый избыток щелочи, чтобы индикатор из бесцветной формы перешел в окрашенную. Избыток  находят по формуле:
находят по формуле:

При  , равном 11 и 12, эта величина возрастает до 0,5 и
, равном 11 и 12, эта величина возрастает до 0,5 и  . Такая ошибка совершенно недопустима.
. Такая ошибка совершенно недопустима.
Поэтому, чтобы избежать слишком больших ошибок титрования, не следует применять при титровании кислот индикаторы, интервалы перехода которых лежат выше  .
.
Гидроксильная ошибка титрования. Предположим, что для титрования сильного основания сильной кислотой выбран индикатор с  концентрация титруемого основания
концентрация титруемого основания  начальный объем основания
начальный объем основания  объем в конце титрования
объем в конце титрования  .
.
Каждый миллилитр 0,1 н. раствора основания содержит г-экв.
Для титрования взято  г-экв основания. Титрование заканчивают при
г-экв основания. Титрование заканчивают при  (в щелочной среде); следовательно,
(в щелочной среде); следовательно,  , т. е.
, т. е.  . Таким образом, часть титруемой щелочи будет недотитрована, и мы допустим
. Таким образом, часть титруемой щелочи будет недотитрована, и мы допустим  -ошибку. Вычислим ее величину.
-ошибку. Вычислим ее величину.
Концентрация ионов гидроксила в конце титрования составит  или
или  .
.
В  раствора
раствора  основания.
основания.
Эта величина и составляет гидроксильную ошибку титрования, обусловленную недотитрованием ОН « -ионов.
-ионов.
Величину  -ошибки (в процентах) вычисляют по формуле:
-ошибки (в процентах) вычисляют по формуле:

В нашем примере

Если выполнять титрование в присутствии индикатора с  , то необходимо прибавить некоторый избыток кислоты.
, то необходимо прибавить некоторый избыток кислоты.
Водородная ошибка титрования. Предположим, что для титрования сильного основания сильной кислотой выбран индикатор  . Титрование заканчивают при
. Титрование заканчивают при  — составляет водородную ошибку титрования, обусловленную перетитрованием щелочи кислотой.
— составляет водородную ошибку титрования, обусловленную перетитрованием щелочи кислотой.
В процентах

 — ошибка
— ошибка  (57)
(57)
Если  , то в этом случае получим:
, то в этом случае получим:

Кислотная ошибка титрования. Предположим, что для титрования дана слабая кислота  . Титрование ведут в присутствии индикатора с
. Титрование ведут в присутствии индикатора с  . В этом случае
. В этом случае

или

Так как  для слабого электролита равна
для слабого электролита равна  , то можно написать:
, то можно написать:

 Титрование заканчивается при
Титрование заканчивается при  , следовательно,
, следовательно,  -ошибка равна:
-ошибка равна:

Отношение можно рассматривать как отношение концентраций неоттитрованной части кислоты к оттитрованной ее части и считать это отношение критерием кислотной ошибки титрования. В нашем примере  -ошибка
-ошибка  или
или  . При титровании той же самой кислоты в присутствии индикатора с
. При титровании той же самой кислоты в присутствии индикатора с  соответствующая ошибка увеличилась бы в
соответствующая ошибка увеличилась бы в  :
:

Пример. Вычислите ошибку титрования 0,1 н. раствора  0,1 н. раствором
0,1 н. раствором  в присутствии индикатора метилового оранжевого
в присутствии индикатора метилового оранжевого  :
:

Следовательно, на каждую оттитрованную молекулу  приходится 5,5 неоттитрованных.
приходится 5,5 неоттитрованных.

Это значит, что 85% кислоты будет не оттитровано, если титровать  раствором
раствором  в присутствии метилового оранжевого. Следовательно, титровать
в присутствии метилового оранжевого. Следовательно, титровать  с индикаторами, имеющими
с индикаторами, имеющими  , нельзя.
, нельзя.
Щелочная ошибка титрования. Предположив, что для титрования дано слабое основание КЮН, щелочную ошибку титрования вычисляют аналогично кислотной ошибке:
 (59)
(59)
Пример. Вычислите ошибку титрования 0,1 н. раствора аммиака  0,1 н. раствором
0,1 н. раствором  в присутствии индикатора фенолфталеина
в присутствии индикатора фенолфталеина  :
:

Следовательно, на каждую оттитрованную молекулу  приходится 0,55 неоттитрованной:
приходится 0,55 неоттитрованной:

Это значит, что около 35% аммиака будет не оттитровано, если его титровать раствором  в присутствии фенолфталеина. Следовательно, титровать раствор
в присутствии фенолфталеина. Следовательно, титровать раствор  с индикатором, имеющим
с индикатором, имеющим  , нельзя.
, нельзя.
1
Оглавление
- ПРЕДИСЛОВИЕ К ПЕРВОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ КО ВТОРОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ К ТРЕТЬЕМУ ИЗДАНИЮ
- ВВЕДЕНИЕ
- § 1. Понятие о количественном анализе
- § 2. Классификация методов количественного анализа
- § 3. Характеристика методов количественного анализа
- § 4. Анализ больших и малых количеств вещества
- § 5. Отбор средней пробы
- § 6. Подготовка вещества для взвешивания
- § 7. Взвешивание
- § 8. Техника взвешивания на аналитических весах
- § 9. Правила обращения с аналитическими весами
- § 10. Приготовление раствора для анализа
- § 11. Запись результатов анализа
- Часть первая. Объемный анализ
- § 1. Сущность объемного анализа
- § 2. Общее уравнение реакции титрования и выводы из него
- Б. ТЕХНИКА ХИМИЧЕСКОГО ЭКСПЕРИМЕНТА В ОБЪЕМНОМ АНАЛИЗЕ
- § 3. Измерение объемов растворов
- § 4. Посуда, применяемая для измерения объемов растворов
- § 5. Работа с мерными колбами
- § 6. Работа с пипетками
- § 7. Работа с бюретками
- § 8. Приготовление стандартных растворов
- В. ВЫЧИСЛЕНИЯ В ОБЪЕМНОМ АНАЛИЗЕ
- § 9. Концентрация растворов и способы ее выражения
- § 10. Способы вычисления в объемном анализе
- § 11. Связь между точностью измерений и точностью вычислений
- § 12. Краткие сведения о статистической обработке экспериментальных данных
- Г. ПОЛУМИКРООБЪЕМНЫЙ МЕТОД АНАЛИЗА
- § 13. Понятие о полумикрообъемном анализе
- § 14. Особенности техники измерения объемов растворов в полумикрометоде
- Д. БЕЗБЮРЕТОЧНЫЕ МЕТОДЫ ТИТРОВАНИЯ
- § 15. Понятие о безбюреточных методах титрования
- § 16. Классификация методов безбюреточного титрования
- Е. АВТОМАТИЧЕСКИЕ МЕТОДЫ
- § 17. Химико-аналитический контроль производства
- § 18. Автоматические методы титрования
- ГЛАВА II. МЕТОДЫ НЕЙТРАЛИЗАЦИИ, ИЛИ МЕТОДЫ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
- § 1. Характеристика метода
- § 2. Установление точки эквивалентности
- § 3. Графический метод изображения процесса нейтрализации
- § 4. Вычисление концентрации ионов водорода в водных растворах сильных кислот и оснований
- § 5. Вычисление активности ионов водорода в водных растворах сильных кислот и оснований
- § 6. Титрование сильной кислоты сильным основанием
- § 7. Вычисление концентрации ионов водорода в растворах слабых кислот и оснований
- § 8. Вычисление активности ионов водорода в водных растворах слабых кислот и оснований
- § 9. Равновесия в водных буферных растворах слабых кислот в присутствии солей этих кислот
- § 10. Равновесия в водных буферных растворах слабых оснований в присутствии солей этих оснований
- § 11. Вычисление концентрации ионов водорода в водных буферных растворах
- § 12. Вычисление активности ионов водорода в водных буферных растворах
- § 13. Вычисление концентрации ионов водорода и степени гидролиза в водных растворах гидролизующихся бинарных солей
- § 14. Вычисление активности ионов водорода в водных растворах гидролизующихся бинарных солей
- § 15. Титрование слабой кислоты сильным основанием
- § 16. Титрование слабого основания сильной кислотой
- § 17. Титрование многоосновных кислот
- § 18. Титрование солей, образованных катионами сильных оснований и анионами слабых многоосновных кислот
- § 19. Изменение активности и показателя активности ионов водорода в процессе титрования водных растворов кислот и оснований
- § 20. Выводы, вытекающие из рассмотрения кривых нейтрализации
- § 21. Индикаторы
- § 22. Интервал перехода индикатора
- § 23. Выбор индикатора
- § 24. Ошибки титрования
- Б. ПРАКТИЧЕСКАЯ ЧАСТЬ
- § 25. Организация рабочего места
- § 26. Приготовление стандартных (титрованных) растворов
- § 27. Приготовление 0,1 н. раствора хлористоводородной кислоты
- § 28. Установка титра 0,1 н. раствора хлористоводородной кислоты
- § 29. Приготовление 0,1 н. раствора едкого натра
- § 30. Установка титра 0,1 н. раствора едкого натра
- § 31. Определение карбонатов
- § 32. Определение содержания H2SO4 в технической серной кислоте
- § 33. Определение содержания уксусной кислоты
- § 34. Определение содержания Na2CO3 и NaOH при их совместном присутствии
- § 35. Определение содержания Na2CO3 и NaHCO3 при их совместном присутствии
- § 36. Определение жесткости воды
- § 37. Определение аммонийного азота в солях аммония
- § 38. Определение содержания фосфорной кислоты
- В. КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ В НЕВОДНЫХ СРЕДАХ
- § 39. Неводные растворы
- § 40. Современные представления о кислотах и основаниях
- § 41. Диссоциация электролитов в неводных растворах
- § 42. Влияние неводных растворителей на силу кислот и оснований
- § 43. Применение закона действия масс к растворам сильных электролитов
- § 44. Титрование кислот и оснований в неводных растворах
- § 45. Методы кислотно-основного титрования в неводных средах
- § 46. Примеры практических определений в неводных растворах
- ГЛАВА III. МЕТОДЫ ОКИСЛЕНИЯ—ВОССТАНОВЛЕНИЯ (ОКСИДИМЕТРИЯ, ОКСРЕДМЕТРИЯ, РЕД-ОКС-МЕТОДЫ)
- § 1. Значение окислительно-восстановительных потенциалов
- § 2. Реакции окисления—восстановления и комплексообразования
- § 3. Примеры окислительно-восстановительного титрования
- § 4. Константы равновесия окислительно-восстановительных реакций
- § 5. Связь между константами равновесия окислительно-восстановительных реакций и нормальными потенциалами
- § 6. Вычисление констант равновесия окислительно-восстановительных реакций
- § 8. Зависимость скорости реакций окисления—восстановления от различных факторов
- § 9. Графический метод изображения процесса окисления—восстановления
- § 10. Фиксирование точки эквивалентности в методах окисления—восстановления
- § 11. Окислительно-восстановительные индикаторы (ред-окс-индикаторы)
- Б. ПЕРМАНГАНАТОМЕТРИЯ
- § 12. Основы перманганатометрии
- § 13. Титрование перманганатом в кислой среде
- § 14. Титрование перманганатом в щелочной среде
- § 15. Приготовление стандартного (титрованного) раствора перманганата калия
- § 16. Установка титра стандартного раствора перманганата калия
- § 17. Установка титра и нормальности раствора перманганата калия по оксалату аммония
- § 18. Вещества, определяемые методом перманганатометрии
- ОПРЕДЕЛЕНИЕ ВОССТАНОВИТЕЛЕЙ
- § 19. Определение щавелевой кислоты и оксалатов
- § 20. Определение соединений железа (II)
- § 21. Определение содержания металлического железа в присутствии окислов железа
- § 22. Определение азотистой кислоты и нитритов
- § 23. Определение содержания марганца (II) в рудах
- ОПРЕДЕЛЕНИЕ ОКИСЛИТЕЛЕЙ
- § 24. Определение соединений железа (III)
- § 25. Определение нитратов
- § 26. Определение бихроматов
- § 27. Определение содержания MnO2 в пиролюзите
- ОПРЕДЕЛЕНИЕ ДРУГИХ ВЕЩЕСТВ
- § 28. Определение ионов кальция
- В. ИОДОМЕТРИЯ
- § 29. Основы иодометрии
- § 30. Методы иодометрического титрования
- § 31. Преимущества и недостатки иодометрического метода
- § 32. Приготовление стандартного (титрованного) раствора тиосульфата и установка его титра
- § 33. Приготовление стандартного (титрованного) раствора иода и установка его титра
- МЕТОДЫ ПРЯМОГО ТИТРОВАНИЯ
- § 34. Определение мышьяка (III)
- МЕТОДЫ ОБРАТНОГО ТИТРОВАНИЯ
- § 35. Определение сульфита натрия
- § 36. Определение содержания формальдегида в формалине
- МЕТОДЫ КОСВЕННОГО ОПРЕДЕЛЕНИЯ
- § 37. Определение ионов меди (II)
- § 38. Определение двуокиси свинца в сурике
- МЕТОД ТИТРОВАНИЯ ЗАМЕСТИТЕЛЕЙ
- § 39. Определение содержания двуокиси марганца в пиролюзите
- МЕТОД ОПРЕДЕЛЕНИЯ КИСЛОТ
- § 40. Определение хлористоводородной кислоты
- § 41. Определение воды по Фишеру
- Г. ПОНЯТИЕ О ДРУГИХ МЕТОДАХ ОКИСЛЕНИЯ — ВОССТАНОВЛЕНИЯ
- § 42. Хроматометрия
- § 43. Определение содержания железа (II)
- § 44. Цериметрия
- § 45. Броматометрия
- § 46. Ванадатометрия
- § 47. Аскорбинометрия
- § 48. Титанометрия
- ГЛАВА IV. МЕТОДЫ ОСАЖДЕНИЯ И КОМПЛЕКСООБРАЗОВАНИЯ
- § 1. Общая характеристика методов
- § 2. Классификация методов осаждения и комплексообразования
- § 3. Применение теории осаждения к объемному анализу
- § 4. Вычисление растворимости электролитов в воде с учетом коэффициентов активности
- § 5. Влияние одноименных ионов на растворимость малорастворимого электролита
- § 6. Солевой эффект
- § 7. Влияние концентрации ионов водорода на растворимость малорастворимых соединений
- § 8. Кривые титрования в методе осаждения
- § 9. Общие выводы, вытекающие из рассмотрения кривых осаждения
- § 10. Адсорбционные явления, наблюдаемые при титровании по методу осаждения
- Б. АРГЕНТОМЕТРИЯ
- § 11. Характеристика метода
- § 12. Приготовление 0,1 н. раствора нитрата серебра
- § 13. Приготовление стандартного раствора хлорида натрия
- § 14. Установка титра 0,1 н. раствора нитрата серебра по точной навеске хлорида натрия
- §15. Определение ионов хлора в техническом хлориде натрия по методу Мора
- § 16. Определение хлоридов по методу Фаянса
- В. РОДАНОМЕТРИЯ
- § 17. Характеристика метода
- § 18. Приготовление 0,1 н. раствора роданида аммония
- § 19. Определение ионов хлора в растворимых хлоридах по методу Фольгарда
- § 20. Определение серебра в сплавах
- Г. МЕРКУРИМЕТРИЯ
- § 21. Характеристика метода
- § 22. Приготовление 0,1 н. раствора нитрата ртути (II)
- § 23. Установка титра раствора нитрата ртути (II)
- § 24. Определение ионов хлора в воде меркуриметрическим методом
- Д. МЕРКУРОМЕТРИЯ
- § 25. Краткая характеристика метода
- Е. КОМПЛЕКСОНОМЕТРИЯ (ХЕЛАТОМЕТРИЯ)
- § 26. Характеристика метода
- § 27. Теоретические основы комплексонометрического титрования
- § 28. Классификация методов комплексонометрического титрования
- § 29. Установка титра раствора комплексона III
- § 30. Определение содержания кальция
- § 31. Определение жесткости воды комплексонометрическим методом
- § 32. Анализ смеси ионов кальция и магния
- § 33. Определение содержания алюминия
- § 34. Раздельное определение ионов кальция и алюминия
- § 35. Раздельное определение ионов алюминия и железа
- Часть вторая. Весовой анализ
- § 1. Сущность весового анализа
- § 2. Классификация методов весового анализа
- § 3. Расчеты в весовом анализе
- Б. ТЕХНИКА ВЕСОВОГО АНАЛИЗА
- § 4. Взятие и растворение навески
- § 5. Техника осаждения
- § 6. Фильтрование и промывание осадков
- § 7. Получение весовой формы
- § 8. Взвешивание весовой формы
- В. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
- § 9. Теоретические основы выделения осадков из растворов с помощью специфических неорганических и органических реактивов
- § 10. Требования, предъявляемые к осадкам
- § 11. Методы повышения точности весовых определений
- § 12. Теоретические обоснования выбора оптимальных условий для весового определения
- Г. ПРАКТИЧЕСКАЯ ЧАСТЬ
- § 13. Определение кристаллизационной воды в BaCl2 2H2O
- § 14. Определение сульфат-ионов или серы
- § 15. Определение ионов железа (III)
- § 16. Определение содержания кальция в карбонате кальция
- § 17. Определение содержания магния
- § 18. Определение ионов хлора в растворимых хлоридах или в хлористоводородной кислоте
- § 19. Анализ силикатов
- § 20. Анализ доломита
- § 21. Анализ бронзы и латуни
- Д. МЕТОДЫ ВЕСОВЫХ ОПРЕДЕЛЕНИЙ, ОСНОВАННЫЕ НА ПРИМЕНЕНИИ ОРГАНИЧЕСКИХ РЕАКТИВОВ
- § 22. Определение никеля
- § 23. Определение алюминия
- Часть третья. Понятие о физических и физико-химических (инструментальных) методах анализа
- § 1. Электрохимические методы
- § 2. Спектральные (оптические) методы
- § 3. Хроматографические методы
- § 4. Радиометрические методы
- § 5. Масс-спектрометрические методы
- ГЛАВА VII ЭЛЕКТРОВЕСОВЫЕ МЕТОДЫ АНАЛИЗА
- § 1. Характеристика методов электроанализа
- § 2. Химические процессы, протекающие при электролизе
- § 3. Методы электроанализа
- § 4. Электровесовой анализ
- § 5. Метод внутреннего электролиза
- § 6. Определение меди в растворе сульфата меди с применением платиновых сетчатых электродов
- § 7. Определение меди и свинца в латуни с применением платиновых сетчатых электродов
- § 8. Определение малых количеств меди методом внутреннего электролиза
- ГЛАВА VIII. ОБЪЕМНЫЕ ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- § 1. Особенности объемных электрохимических методов анализа
- § 2. Кондуктометрическое титрование
- § 3. Высокочастотное титрование
- § 4. Потенциометрическое титрование
- § 5. Полярографический метод анализа
- § 6. Амперометрическоб титрование
- § 7. Кулонометрическое титрование
- ГЛАВА IX. СПЕКТРАЛЬНЫЕ (ОПТИЧЕСКИЕ) МЕТОДЫ АНАЛИЗА
- § 1. Понятие об эмиссионном спектральном анализе
- Б. КОЛОРИМЕТРИЯ
- § 2. Особенности колориметрических методов анализа
- § 3. Характеристика колориметрических методов анализа
- В. ОПТИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ ТОЧКИ ЭКВИВАЛЕНТНОСТИ
- § 4. Спектрофотометрическое титрование
- § 5. Фототурбидиметрическое и фотонефелометрическое титрование
- Г. ЛАБОРАТОРНЫЕ РАБОТЫ
- § 6. Определение содержания ионов железа методом колориметрического титрования
- § 7. Определение содержания титана
- ГЛАВА X. МЕТОДЫ РАЗДЕЛЕНИЯ, ВЫДЕЛЕНИЯ И КОНЦЕНТРИРОВАНИЯ ОТДЕЛЬНЫХ КОМПОНЕНТОВ АНАЛИЗИРУЕМЫХ СМЕСЕЙ
- § 1. Определение следов элементов (микропримесей)
- § 2. Метод осаждения малорастворимых соединений
- § 3. Электрохимические методы разделения
- § 4. Метод экстрагирования
- § 5. Методы отгонки летучих соединений
- § 6. Хроматографические методы разделения
- § 7. Метод флотации

Расчет индикаторных погрешностей кислотно-основного титрования
Согласно ионно-хромофорной теории индикаторов, интервал перехода окраски индикатора 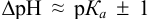 (табл. 12). Середина области перехода окраски (при этом pH близко к
(табл. 12). Середина области перехода окраски (при этом pH близко к 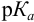 ) называется показателем титрования с данным индикатором или рТ индикатора. Индикаторные погрешности отсутствуют, когда рТ индикатора практически совпадает с pH в ТЭ. Основой для выбора индикатора является расчет и построение кривой титрования, определение области скачка и pH в ТЭ.
) называется показателем титрования с данным индикатором или рТ индикатора. Индикаторные погрешности отсутствуют, когда рТ индикатора практически совпадает с pH в ТЭ. Основой для выбора индикатора является расчет и построение кривой титрования, определение области скачка и pH в ТЭ.
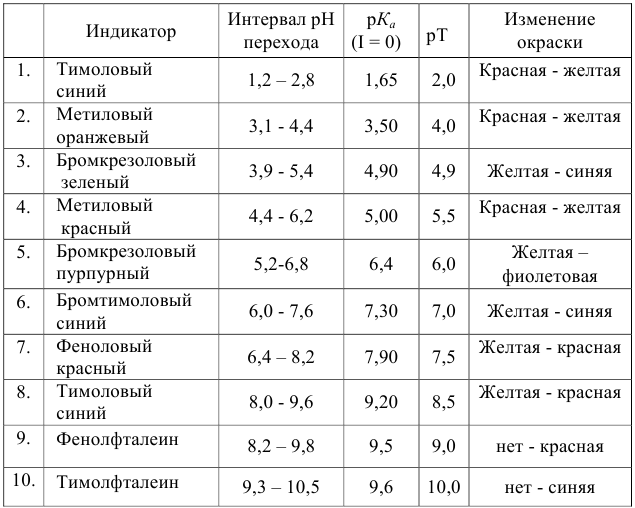
Таблица 8.12
Важнейшие кислотно-основные индикаторы
При правильно выбранном индикаторе индикаторная ПТ не должна превышать заданную погрешность измерения объема раствора в титриметрии. Типы (виды) индикаторных ПТ кислотно-осиовиого титрования и названия, встречающиеся в разных учебниках и сборниках задач, происхождение погрешностей и формулы для расчета приведены в табл. 8.13. Формулы легко выводятся из определения погрешности титрования как отношения недотитро-ванного или перетитрованного количества кислоты или основания к первоначально взятому для титрования (то есть к произведению 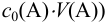 . Погрешность выражают в %, а вид и знак устанавливают по ходу процесса (кривой) титрования и составу раствора в КТТ (табл. 8.13, примеры 8.28 и 8.29).
. Погрешность выражают в %, а вид и знак устанавливают по ходу процесса (кривой) титрования и составу раствора в КТТ (табл. 8.13, примеры 8.28 и 8.29).
Таблица 8.13
Индикаторные погрешности кислотно-основного титрования

Пример 8.28.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании а)  и б)
и б) 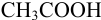 рабочим раствором
рабочим раствором 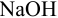 в условиях примера 8.21, если считать относительную погрешность измерения объема 0,4 %.
в условиях примера 8.21, если считать относительную погрешность измерения объема 0,4 %.
Решение:
а). Как следует из табл. 8.4 и рис. 8.1(1), для случая титрования  при погрешности определения объема 0,4 % область скачка на кривой титрования соответствует изменению pH от 3,4 до 10,9, а
при погрешности определения объема 0,4 % область скачка на кривой титрования соответствует изменению pH от 3,4 до 10,9, а  равен 7,0. Следовательно, для титрования можно выбрать индикаторы от №2 до №10 (табл. 8.12), т. к. их рТ и интервалы перехода окраски находятся в области скачка кривой.
равен 7,0. Следовательно, для титрования можно выбрать индикаторы от №2 до №10 (табл. 8.12), т. к. их рТ и интервалы перехода окраски находятся в области скачка кривой.
Однако используемые для расчета ПТ формулы показывают, что чем ближе рТ и  , тем меньше ПТ. «Идеально» подходит бромтимоловый синий, поскольку его рТ 7 практически совпадает с
, тем меньше ПТ. «Идеально» подходит бромтимоловый синий, поскольку его рТ 7 практически совпадает с  .
.
Рассчитаем величину ПТ с двумя индикаторами: с рТ <  и с р Г >
и с р Г >  и проверим их пригодность для титрования в заданных условиях.
и проверим их пригодность для титрования в заданных условиях.
С индикатором метиловым красным (рТ 5,5 <  ) в растворе остается неоттитрованная сильная кислота, следовательно, возникает протонная ошибка со знаком «-» (см. формулы в табл. 8.13):
) в растворе остается неоттитрованная сильная кислота, следовательно, возникает протонная ошибка со знаком «-» (см. формулы в табл. 8.13):
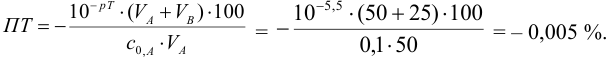
С индикатором фенолфталеином (рТ 9,0 >  ) в растворе -избыток сильного основания, в результате чего ПТ представляет собой
) в растворе -избыток сильного основания, в результате чего ПТ представляет собой 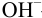 — ошибку (гидроксидную) со знаком «+»:
— ошибку (гидроксидную) со знаком «+»:
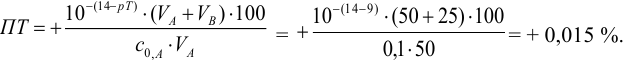
В данном случае оба индикатора пригодны, поскольку вычисленные значения ПТ не превышают заданную погрешность титрования (0,4%), но с метиловым красным систематическая индикаторная погрешность меньше.
б). При титровании  (табл. 8.5, рис. 8.1(2)) для той же точности титрования (99,6%) величина скачка меньше и составляет 7,2 — 10,9, а
(табл. 8.5, рис. 8.1(2)) для той же точности титрования (99,6%) величина скачка меньше и составляет 7,2 — 10,9, а  — 8,9. Круг пригодных индикаторов сужается до №7 — №9. Для индикаторов с рТ >
— 8,9. Круг пригодных индикаторов сужается до №7 — №9. Для индикаторов с рТ >  , как и в случае (а), ПТ соответствует
, как и в случае (а), ПТ соответствует  — ошибке (гидроксидной) со знаком «+».
— ошибке (гидроксидной) со знаком «+».
Например, при выборе фенолфталеина (рТ = 9,0):
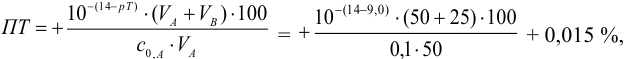
а при выборе тимолфталеина (рТ = 10,0) погрешность возрастает в 10 раз: 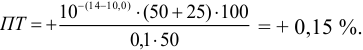
Выбор фенолфталеина приводит к меньшей индикаторной погрешности титрования 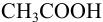 , но могут использоваться оба индикатора.
, но могут использоваться оба индикатора.
При титровании с индикаторами, для которых рТ < рНтэ, в растворе остается неоттитрованная слабая кислота, т. е. присутствует НА-ошибка (кислотная) со знаком «-» (см. табл. 8.13). Если использовать индикатор бромтимоловый синий (рТ 7,0), то вычисленная ПТ не удовлетворяет заданной точности, индикатор не пригоден:
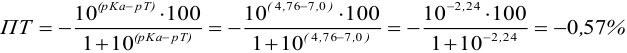
или при проведении расчета по приближенной формуле:
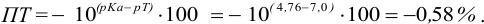
Пример 8.29.
Какой индикатор позволяет оттитровать 0,1000 М гидразин  0,1000 М раствором
0,1000 М раствором  с меньшей погрешностью: бромкрезоловый пурпурный (рТ 6,0) или метиловый красный (рТ 5,5)?
с меньшей погрешностью: бромкрезоловый пурпурный (рТ 6,0) или метиловый красный (рТ 5,5)?
Решение:
Реакция титрования:
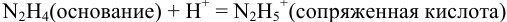
приводит к образованию слабой сопряженной кислоты 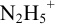
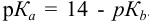 . Тогда
. Тогда 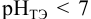 и вычисляется с учетом того, что
и вычисляется с учетом того, что 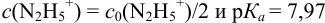 :
:
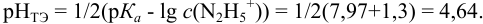
Сравнивая рТ индикаторов и  , видим, что в обоих случаях остается неоттитрованный гидразин, поэтому для оценки ПТ рассчитываем
, видим, что в обоих случаях остается неоттитрованный гидразин, поэтому для оценки ПТ рассчитываем 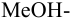 ошибку (основную) со знаком «-». С бромкрезоловым пурпурным (рТ 6):
ошибку (основную) со знаком «-». С бромкрезоловым пурпурным (рТ 6):
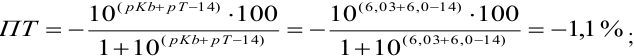
и с метиловым красным (рТ 5,5):
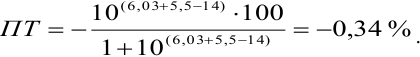
Из предложенных индикаторов метиловый красный позволяет провести титрование гидразина с меньшей погрешностью.
Расчет индикаторных погрешностей окислительно-восстановительного титрования
При использовании окислительно-восстановительных (редокс) индикаторов потенциал в ТЭ  может не совпадать с потенциалом
может не совпадать с потенциалом  , который связан с
, который связан с  . (табл. 8.14) и интервалом перехода его окраски
. (табл. 8.14) и интервалом перехода его окраски  .
.
Таблица 8.14
Примеры распространенных окислительно-восстановительных индикаторов
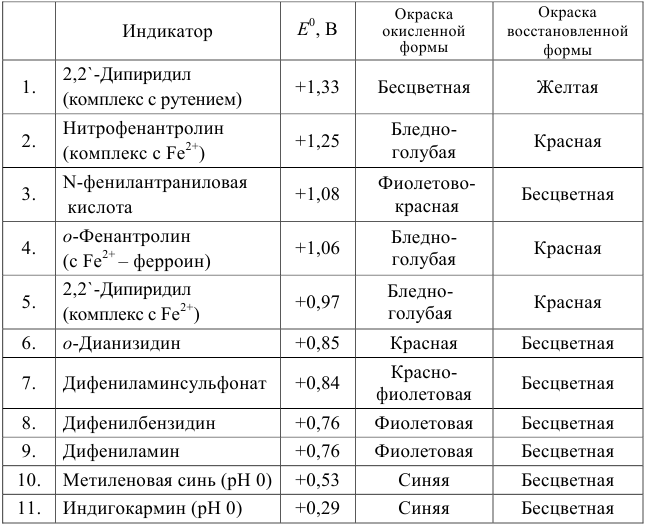
Полуреакция восстановления и интервал перехода индикатора:

Наиболее часто в полуреакции восстановления (окисления) индикатора участвуют 2 электрона. Для индикаторов №1 — №6 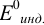 слабо зависит от pH. При расчете ПТ необходимо:
слабо зависит от pH. При расчете ПТ необходимо:
- сравнить
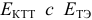 для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
Например, если 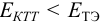 при титровании восстановителя (пример 8.30-а), то реакция не завершена; из уравнения Нернста для полуреакции титруемого компонента находят (объемы раствора в числителе и знаменателе одинаковы):
при титровании восстановителя (пример 8.30-а), то реакция не завершена; из уравнения Нернста для полуреакции титруемого компонента находят (объемы раствора в числителе и знаменателе одинаковы):

Сумма числителя и знаменателя здесь составляет 100 % титруемого вещества. Индикатор считается пригодным, если ПТ не превышает 0,1 -0,2%.
Пример 8.30.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании раствора соли  раствором соли
раствором соли  .
.
Решение:
Как следует из табл. 8.8 и рис. 8.3 (кривая 1, пример 8.25), область скачка (при относительной погрешности измерения объема 0,1 %) на кривой титрования 0,95 — 1,26 В, а 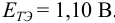 . Следовательно, для титрования можно выбрать индикаторы от №3 до №5 (табл. 8.14).
. Следовательно, для титрования можно выбрать индикаторы от №3 до №5 (табл. 8.14).
Выберем для рассмотрения порядка расчета два индикатора:
а) с 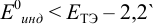 -дипиридил, для которого
-дипиридил, для которого 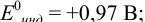
б) с 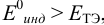 , например нитрофенантролин
, например нитрофенантролин 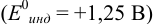 .
.
В случае а) интервал перехода индикатора:
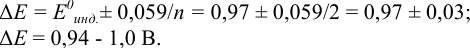
Изменение окраски заканчивается при  = 1,0 В. В растворе остаются неоттитрованными ионы
= 1,0 В. В растворе остаются неоттитрованными ионы 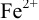 (оттитрованные ионы -ионы
(оттитрованные ионы -ионы  ). Для расчета ПТ используем уравнение Нернста для ре-докс- пары титруемого компонента (
). Для расчета ПТ используем уравнение Нернста для ре-докс- пары титруемого компонента ( /
/ ):
):
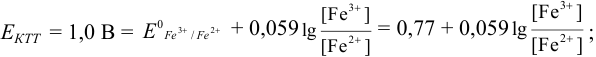
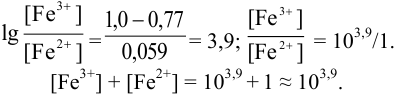
Тогда: ПТ = 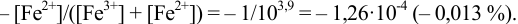
В случае б) интервал перехода индикатора нитрофенантролина в виде комплекса с  составляет:
составляет:
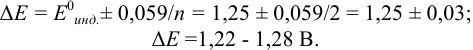
Изменение окраски заканчивается при  = 1,28 В и раствор перетитровывается. В этом случае ПТ имеет положительный знак и рассчитывается по уравнению Нернста для редокс-пары, образуемой титрантом
= 1,28 В и раствор перетитровывается. В этом случае ПТ имеет положительный знак и рассчитывается по уравнению Нернста для редокс-пары, образуемой титрантом  .
.
Тогда количество  (после ТЭ образования
(после ТЭ образования  не происходит) соответствует количеству взятых для титрования ионов
не происходит) соответствует количеству взятых для титрования ионов 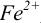 , а количество
, а количество 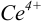 — их перетитрованному количеству.
— их перетитрованному количеству.
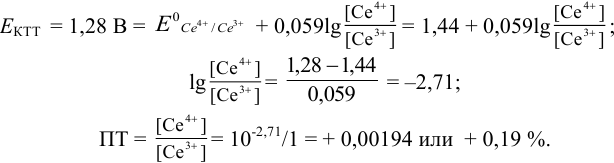
Таким образом, оба выбранных индикатора оказались приемлемыми.
Расчет индикаторных погрешностей комплексонометрического титрования
В конечной точке титрования общие концентрации определяемого иона с(М) и титранта c(Y) можно представить выражениями {для упрощения записи в общем виде упустим заряды ионов):
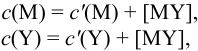
где 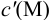 — концентрация всех форм определяемого иона, кроме входящего в комплекс
— концентрация всех форм определяемого иона, кроме входящего в комплекс 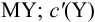 — концентрация всех форм титранта, кроме входящего в комплекс MY.
— концентрация всех форм титранта, кроме входящего в комплекс MY.
Условные константы устойчивости (см. выражение 8.16) связывают 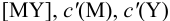
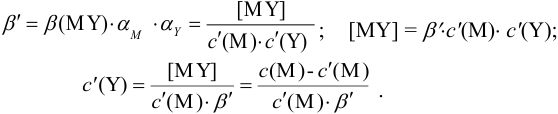
Отсюда относительная погрешность титрования (ПТ) определяется выражением (с учетом (8.18) и (8.19)):
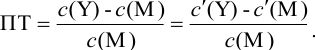
Подставляем в это уравнение выражение для 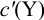 (8.20):
(8.20):
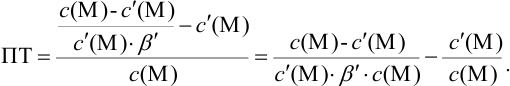
Вблизи ТЭ 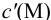 очень мала, поэтому
очень мала, поэтому 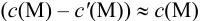 ,
,
следовательно: 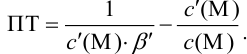
Выражение (8.21) тождественно выражению: 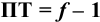 . Если конечная точка титрования находится после точки эквивалентности (степень оттитрованности
. Если конечная точка титрования находится после точки эквивалентности (степень оттитрованности 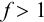 ), то относительная погрешность будет положительной. В случае недотитровывания, т. е. когда конечная точка титрования будет зафиксирована с помощью индикатора до точки эквивалентности
), то относительная погрешность будет положительной. В случае недотитровывания, т. е. когда конечная точка титрования будет зафиксирована с помощью индикатора до точки эквивалентности 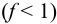 , ПТ будет со знаком «-».
, ПТ будет со знаком «-».
Конечная точка титрования определяется интервалом перехода окраски индикатора (интервалом рМ, в котором индикатор меняет свою окраску):
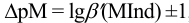 , где
, где 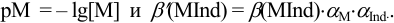
Интервал перехода окраски 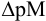 индикатора эриохром черный Т
индикатора эриохром черный Т 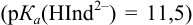 , образующего комплексы с ионами металлов при pH 10, составляет для ионов:
, образующего комплексы с ионами металлов при pH 10, составляет для ионов: 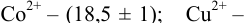
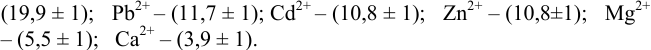
Пример 8.31.
Рассчитайте погрешность титрования 0,1 ОМ раствора 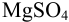 0,10 М раствором ЭДТА в присутствии индикатора эриохром черный Т в аммиачном буферном растворе при pH 10 и
0,10 М раствором ЭДТА в присутствии индикатора эриохром черный Т в аммиачном буферном растворе при pH 10 и  = 0,2 моль/л (см. условия в примере 8.27).
= 0,2 моль/л (см. условия в примере 8.27).
Решение:
В данных условиях 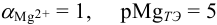 ,
,
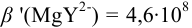 (пример 8.23). Интервал перехода окраски индикатора:
(пример 8.23). Интервал перехода окраски индикатора: 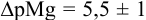 или в интервале концентраций магния от
или в интервале концентраций магния от 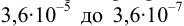 . Точка эквивалентности попадает в указанный интервал, индикатор считается пригодным для титрования
. Точка эквивалентности попадает в указанный интервал, индикатор считается пригодным для титрования  , КТТ наступает после ТЭ, когда
, КТТ наступает после ТЭ, когда 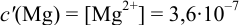 моль/л.
моль/л.
Погрешность титрования  с «эриохром черным Т»:
с «эриохром черным Т»:
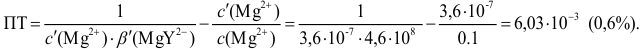
Пример 8.32.
Докажите возможность использования индикатора эриохром черный Т для титрования 0,010 М раствора 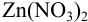 0,010 М раствором ЭДТА при pH = 10 и
0,010 М раствором ЭДТА при pH = 10 и  = 0,10 моль/л. Рассчитайте погрешность титрования при использовании этого индикатора.
= 0,10 моль/л. Рассчитайте погрешность титрования при использовании этого индикатора.
Решение:
1. Рассчитаем условную константу 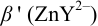 .
.
Общие константы устойчивости для аммиачных комплексов  (табл. 4 приложения):
(табл. 4 приложения): 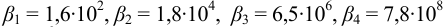 . Для свободных ионов
. Для свободных ионов  по формуле (2.8) предварительно рассчитаем
по формуле (2.8) предварительно рассчитаем 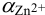 :
:
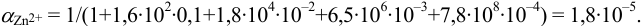
По табл. 7 и табл. 4 приложения находим 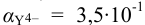 ,
, 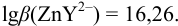 . Константа устойчивости комплекса
. Константа устойчивости комплекса  с ЭДТА при заданных условиях с учетом выражения (8.16):
с ЭДТА при заданных условиях с учетом выражения (8.16):
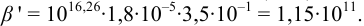
В точке эквивалентности:
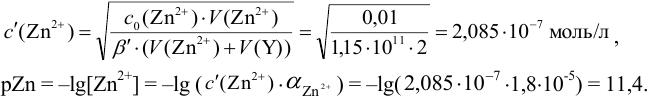
Интервал перехода окраски индикатора эриохром черный Т в случае титрования ионов цинка при pH 10: 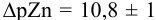 , т.е. от 9,8 до 11,8 или от
, т.е. от 9,8 до 11,8 или от 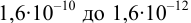 моль/л. Точка эквивалентности попадает в интервал концентраций, при которых индикатор меняет свою окраску. Следовательно, эриохром черный Т пригоден для титрования
моль/л. Точка эквивалентности попадает в интервал концентраций, при которых индикатор меняет свою окраску. Следовательно, эриохром черный Т пригоден для титрования  при заданных условиях.
при заданных условиях.
2. Конечная точка титрования наступает при [ ], равной
], равной 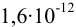 моль/л, отсюда концентрация всех форм
моль/л, отсюда концентрация всех форм  , за исключением связанных в комплекс с ЭДТА, составляет:
, за исключением связанных в комплекс с ЭДТА, составляет:
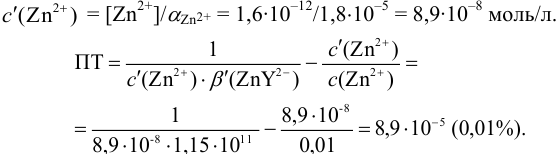
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

В университете на практическом курсе аналитической химии мне приходилось много титровать. Я помню осторожное дозирование титранта стеклянной бюреткой, неудобный процесс повторного наполнения бюретки и постоянное опасение, что я неправильно выбрала конечную точку.
Все студенты в группе получали разные результаты, но мы так и не поняли почему. В те годы у меня было мало знаний. Сейчас, после 10 лет опыта титрования, я поняла, что результаты ручного титрования очень сильно зависят от человека, который проводит анализ. Ниже я перечислю основные источники ошибок, и как вы можете их избежать.

Правильный выбор индикатора
Значение pH конечной точки титрования зависит от константы кислотной диссоциации (Ka) используемых кислоты и основания. Если сильное основание титруют сильной кислотой, значение pH в конечной точке составляет около 7. Титрование сильного основания слабой кислотой смещает конечную точку в сторону диапазона щелочи. Титрование сильной кислоты слабым основанием – в зону кислот. Это объясняет, почему при кислотно-щелочном титровании используются несколько разных индикаторов. Какой мы выберем?
На приведенной выше диаграмме показаны самые популярные pH индикаторы. Из графика видно, что не получите правильных результатов при pH конечной точки = 7, если в качестве индикатора вы используете кристаллический фиолетовый или метиловый оранжевый. К счастью, в большинстве стандартов и в стандартных методиках работы индикатор уже указан. Если будете следовать инструкциям, все будет хорошо!

Субъективность распознавания конечной точки
Проблемы начинаются в процессе определения конечной точки. Вы когда-нибудь задумывались о тонкостях изменения цвета?
На рисунке вы видите пять стадий кислотно-щелочного титрования c(HCl) = 1 моль/л с c(NaOH) = 1 моль/л. Единственная разница между соседними фотографиями заключается в одной капле титранта. На каком из них истинная конечная точка?
Может это конечная точка на рисунке 1 с бледно-розовым оттенком? Или на картинке под номером 3 с более интенсивным цветом? Или даже на картинке 5, где розовый цвет наиболее яркий? Между 1 и 5 было добавлено всего четыре капли титранта. Одна капля – это 50 мкл, а добавленный в сумме объем составляет 200 мкл титранта или примерно 7,3 мг соляной кислоты. Для фармацевтического анализа – это колоссальная ошибка.

Считываем объем на бюретке
Вы помните, как правильно считывать значения на бюретке? Нужно убедиться, что фиксируете значение мениска четко по горизонтали. Знаете почему?
Значение объема зависит от угла, под которым вы смотрите на бюретку. На данном рисунке данные отличаются от фактического значения до 0,2 мл (200 мкл) в зависимости от угла обзора. Чем больше ваш ракурс отклоняется от горизонтали, тем более неточными будут значения и сам результат. Вы можете допустить среднюю ошибку 200 мкл. Но для титрования это недопустимо много, на предыдущем примере я рассказала почему.
Повышаем объективность и точность оценки
Как можно исключить эти ошибки? Легче всего просто обойти возможную неточность. Решением станет использование электронной бюретки. Все, что вам нужно сделать, это заполнить ее титрантом, а затем нажать кнопку. Устройство автоматически измерит объем и выдаст оцифрованный результат. Использование электронной бюретки уже обеспечит высокий уровень объективности ваших результатов.
Электронная бюретка также повысит и точность данных. Мне не нужно рассказывать вам, насколько важна точность в аналитической химии, но я приведу пример. Представьте, что вы определили чистоту золота в 90%, а на самом деле оно чистое на 99%. Вы бы потеряли много денег, продавая свое золото с этой иллюзией!
Ранее я показала, что визуальное распознавание конечной точки с цветовым индикаторам может привести к ошибкам до 200 мкл. Неточность ручной бюретки может вызвать погрешность в дополнительных 200 мкл. Хотя электронная бюретка не помогает добиться лучшей объективизации при распознавании конечной точки, она добавляет куда меньший объем титранта: вместо прежних 50 мкл на каплю, всего 0,25 мкл в зависимости от объема используемой бюретки. Это существенно снизит ошибку при распознавании конечной точки. Самые распространенные бюретки описаны ниже:
| Объем цилиндра бюретки (мл) | Мин. добавляемый объем (µл) |
| 5 | 0.25 |
| 10 | 0.50 |
| 20 | 1.00 |
| 50 | 2.50 |
Следующий шаг: автоматическое титрование
Если вы хотите закрыть все источники ошибок, про которые мы говорили, вам придется перейти на автоматическое титрование или автотитрование. В этом случае вы будете использовать электрод для анализа изменения pH в образце и математический алгоритм для детектирования конечной точки — индикатор вам больше не потребуется. Кроме того, вы получите ту же точность, что и с электронной бюреткой.
Ознакомьтесь с соответствующей записью в блоге для получения дополнительной информации.
How to Transfer Manual Titration to Autotitration
Author

Iris Kalkman
Product Specialist TitrationMetrohm International Headquarters, Herisau, Switzerland

