Как рассчитать экспериментальную ошибку в химии
На чтение 1 мин Просмотров 392 Опубликовано 05.06.2021
Ошибка – это мера точности значений в вашем эксперименте. Важно уметь вычислить экспериментальную ошибку, но есть несколько способов ее вычислить и выразить. Вот наиболее распространенные способы вычисления экспериментальной ошибки:
Содержание
- Формула ошибки
- Формула относительной ошибки
- Формула процента ошибки
- Пример расчета ошибки
Формула ошибки
В общем, ошибка – это разница между принятым или теоретическое значение и экспериментальное значение.
Ошибка = экспериментальное значение – известное значение
Формула относительной ошибки
Относительная ошибка = ошибка/известное значение
Формула процента ошибки
% Error = относительная ошибка x 100%
Пример расчета ошибки
Допустим, исследователь измеряет массу образца, который должен быть 5,51 грамм. Известно, что фактическая масса образца составляет 5,80 грамма. Рассчитайте погрешность измерения.
Экспериментальное значение = 5,51 грамма
Известное значение = 5,80 грамма
Ошибка = экспериментальное значение – известное значение
Ошибка = 5,51 г – 5,80 грамма
Ошибка = – 0,29 грамма
Относительная ошибка = ошибка/известное значение
Относительная ошибка = – 0,29 г/5,80 г
Относительная ошибка = – 0,050
% Error = относительная ошибка x 100%
% Error = – 0,050 x 100%
% Error = – 5,0%
Тепловым
эффектом
химической реакции называется суммарное
количество тепловой энергии, выделяющейся
или поглощающейся системой в ходе
реакции при проведении её в условиях
постоянной температуры и постоянного
давления. Химические взаимодействия,
протекающие с выделением энергии,
называются экзотермическими, с поглощением
– эндотермическими.
Все
опыты по определению тепловых эффектов
химических реакций проводятся в
калориметрах различных конструкций,
которые представляют собой как можно
лучше изолированный от теплообмена
с окружающей
средой сосуд с мешалкой и термометром.
Простейший калориметр состоит из двух
стаканов – внутреннего и внешнего;
во внутренний
стакан опускаются термометр и мешалка.
Во всех опытах условно примем плотности
растворов равными 1 г/см3,
а теплоёмкости растворов – 4,184 Дж/г·К.
Для данной
лабораторной работы вам потребуются
следующие реактивы:
1.
Магний Mg;
2.
Гидроксид натрия NaOH;
3.
Серная кислота Н2SO4.
Вопросы для
допуска к выполнению лабораторной
работы:
1. Что называется
энтальпией (теплотой) образования
химического соединения?
2. Чему равны
энтальпии образования простых веществ?
3.
Какие термодинамические параметры
считаются стандартными?
Опыт
№1. Определение теплового эффекта
реакции нейтрализации
Реакция
нейтрализации является экзотермической,
так как происходит с выделением теплоты.
Методика
опыта. Во
внутренний стакан калориметра наливаем
20 см3
раствора серной кислоты Н2SO4
с молярной концентрацией эквивалентов
1 моль/дм3.
Запишите
начальную температуру данного раствора.
Затем добавляем 20 см3
раствора гидроксида натрия NaOH
с молярной концентрацией эквивалентов
1 моль/дм3.
Запишите
максимальную температуру реакции.
В ходе опыта
происходит следующая реакция:
Н2SO4
+ 2 NaOH
= Na2SO4
+ 2 H2O
Тепловой эффект
реакции нейтрализации рассчитываем по
формуле:
![]() ,
,
где
ρ – плотность раствора, г/см3;
V
– объём раствора, см3;
С
– удельная теплоёмкость раствора,
Дж/г·К;
Δt
– разность температур, °С;
100
– коэффициент пересчёта на один моль
взятой кислоты;
0,001
– коэффициент пересчёта Дж в кДж.
Запишите
расчёт теплового эффекта реакции
нейтрализации по вышеуказанной
формуле.
Запишите
расчёт теоретического значения теплового
эффекта реакции нейтрализации ΔНтеор
по первому следствию из закона Гёсса:
сначала в общем виде, а затем с
подставленными табличными значениями
энтальпий образования веществ (см.
приложение Б).
Относительную
ошибку опыта рассчитываем по формуле:
![]() ,
,
где
ΔНтеор
– теоретическое значение величины
теплового эффекта, кДж;
ΔНопытн
– значение величины теплового эффекта,
полученное в ходе опыта, кДж.
Запишите
расчёт величины относительной ошибки
опыта по вышеуказанной
формуле.
Сделайте
вывод о тепловом эффекте реакции
нейтрализации и укажите,
с какой ошибкой он был найден в данном
случае.
Опыт
№2. Определение теплового эффекта
реакции взаимодействия металла с
кислотой
Реакция
взаимодействия металла с кислотой
является экзотермической, так как
происходит с выделением теплоты.
Методика
опыта. Во
внутренний стакан калориметра помещаем
небольшое количество гранулированного
магния Mg
и наливаем 2,5 см3
раствора серной кислоты H2SO4
с молярной концентрацией эквивалентов
1 моль/дм3.
Запишите,
чему была равна температура кислоты на
момент начала реакции и какая максимальная
температура была достигнута в ходе
реакции.
В ходе опыта
происходит следующая реакция:
Mg
+ H2SO4
= MgSO4
+ H2↑
Тепловой эффект
реакции взаимодействия металла с
кислотой рассчитываем по формуле:
![]() ,
,
где
ρ – плотность раствора кислоты, г/см3;
V
– объём раствора кислоты, см3;
С
– удельная теплоёмкость раствора,
Дж/г·К;
Δt
– разность температур, °С;
800
– коэффициент пересчёта на один моль
взятой кислоты;
0,001
– коэффициент пересчёта Дж в кДж.
Запишите
расчёт теплового эффекта реакции
взаимодействия металла с кислотой по
вышеуказанной формуле.
Запишите
расчёт теоретического значения теплового
эффекта реакции взаимодействия металла
с кислотой ΔНтеор
по первому следствию из закона Гёсса:
сначала в общем виде, а затем с подставленными
табличными значениями энтальпий
образования веществ (см. приложение Б).
Относительную
ошибку опыта рассчитываем по формуле:
![]() ,
,
где
ΔНтеор
– теоретическое значение величины
теплового эффекта, кДж;
ΔНопытн
– значение величины теплового эффекта,
полученное в ходе опыта, кДж.
Запишите
расчёт величины относительной ошибки
опыта по вышеуказанной
формуле.
Сделайте вывод
о тепловом эффекте реакции взаимодействия
металла с кислотой и укажите, с какой
ошибкой он был найден в данном случае.
Вопросы
для защиты лабораторной работы:
1.
Что такое энтальпия (тепловой эффект)
химической реакции?
2.
Как называются химические реакции,
протекающие с выделением теплоты?
3.
Как называются химические реакции,
протекающие с поглощением теплоты?
4.
Формулировка закона Гёсса.
5.
Первое следствие из закона Гёсса.
6.
Как рассчитать тепловой эффект реакции
по значениям энтальпий образования
вступающих в реакцию и образующихся
веществ?
7.
Второе следствие из закона Гёсса.
Рекомендуемая
литература:
1. Н.Л. Глинка. «Общая
химия». Главы «Превращения энергии при
химических реакциях», «Термохимия»,
«Термохимические расчеты», «Термодинамические
величины. Внутренняя энергия и энтальпия»,
Стандартные термодинамические величины.
Химико-термодинамические расчеты».
2. Е.М. Рыбалкин,
О.Ю. Ковалик. «Химия. Учебное наглядное
пособие». Глава «Химическая термодинамика».
3.
П.Г. Пермяков, М.Х. Ахметов, С.В. Зенцова.
«Основные закономерности протекания
химических процессов в газообразных
и конденсированных системах. Учебное
пособие». Глава «Химическая термодинамика».
4.
Р.М. Белкина, Р.И. Славкина, В.Ф. Горюшкин.
«Энергетика химических процессов.
Задания для практических занятий».
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Интересный сюжет, отличная развязка, авторский стиль.
Нет.
Доброго времени суток.
Хочу оставить отзыв о классном детективе, от знаменитого прозаика. Он может иметь название — «Ошибка в химическом опыте».
Написан был в 1946 году и входит в цикл «Йокнапатофская сага».
Рассказ был экранизироап в 1954 году (режиссер: Уильям Х. Браун — мл.)
Фильм не видел, потому не могу его советовать.
Эту историю о непонятном убийстве рассказывает племянник окружного прокурора. У Фолкнера он принимает участие в нескольких рассказах. Его имя Чарльз (Чика) Мэллисон.
Джоэл Флинт позвонил шерифу и признался, что он убил свою жену. Служитель закона прибывает на место преступления и уточняет, не был ли это несчастный случай. Но Джоэл уверяет, что он убил намеренно и просит поместить его под арест. Шериф это и делает, ведь Джоэл янки, который приехал не очень давно и остался здесь жить, женившись на женщине с причудами. Ее отец не может понять, как янки попал в их семью. Для него это позор…
Больше по сюжету писать ничего не буду. Рассказ написан в детективном жанре и каждое лишнее слово может лишить его привлекательности для тех, кто его ещё не читал. А прочитать наверное стоит, если нравится такой жанр и хочется поупражняться в угадывании личности убийцы.
Рассказ Фолкнера понравился, даже очень.
Отличный детектив, с замечательным, умным, продуманным сюжетом. Читателю очень тяжело раскрутить клубок с преступлением, не дочитав его до конца. Есть несколько совершенно неожиданных поворотов.
При всем этом, написано произведение в лёгком стиле и читается быстро, с интересом. Главное, что не попадает под категорию детективов — «Пиф — паф, ой — ой — ой. Умирает зайчик мой!». Примитивизмом здесь не пахнет, что и не удивительно, исходя из масштаба писателя. Фолкнер не мог себе такое позволить, за что собственно его многие любят и с удовольствием читают.
Один из главных героев в рассказе — окружной прокурор Гэвин Стивенс. Он присутствует у писателя в нескольких произведениях. Глубоко положительный образ порядочного юриста, для которого закон превыше всего. Чувствуется, что сам автор питает к нему симпатию. Не встречал моментов в рассказах, где бы Стивенс кривил душой, или шел на должностные преступления ради достижения своих целей. Нам бы такого, да в Генеральные.
Повторюсь, детектив хороший и финал его достаточно неожиданный.
Как бы не было сомнения, что преступника раскроют. Кстати, все на это указывало. Только вот не понятен был его мотив. Да и убийца — весьма темная личность, задачи которого были туманны. Поэтому искреннее удивился, что он оказался чуть ли не криминальным гением. Такое замутить — нужно обладать феноменальными способностями в своем роде. Слишком хитроумная комбинация и только при одном обидном проколе. Обидном, мелком, но фатальном.
Свои впечатления взял из самого рассказа. Мне понравились именно эти слова. В какой-то мере они слегка передают смысл этого произведения. Поэтому, решил ничего не выдумывать от себя.
Если подводить итоги вышеизложенному, тогда хочется оценить рассказ «Ошибка в химической формуле», Уильяма Фолкнера на высшую оценку.
Считаю, что это справедливо.
Рекомендую его прочитать, если нравится творчество американского писателя и есть интерес к детективному жанру.
Не могу сообщить, есть ли аудиоверсия этого произведения. Специально её поиском в интернете не занимался. Электронный вариант хорош и его без труда можно найти на многих книжных, литературных сайтах. Это сейчас не проблема.
Всего хорошего. Всем крепкого здоровья и благодарю за внимание к моим отзывам.
Ошибка опыта 5 / находится по формуле [c.147]
По данным [561 ошибка опыта [у] = 3,24, = 3. [c.150]
Si.fl [у] — соответственно дисперсия неадекватности и ошибка опыта эти величины находят по формулам (VII.26) и (VII.27) со значениями степеней свободы Д и /2, вычисленными из равенств (VI 1.51) и (VI 1.52). [c.157]
При 800° С количество углерода, отложившегося в виде кокса примерно такое же, как для бензола (в пределах ошибки опыта). Но при 900 и 1000° С наблюдается заметно ббльшая скорость разложения. Последнее противоречит утверждению Тиличеева, однако возможно, что при таких высоких температурах скорость разложения уже не зависит от нафталина и бензола, как таковых, а скорее от высших продуктов конденсации. Разложение нафталина в этой области катализируется контактным веществом с примесью кокса или углерода. [c.98]
Расчеты изобарных потенциалов и констант равновесия различных реакций легко выполняются путем комбинирования изобарных потенциалов реакций образования соединений из простых веществ. Стандартный изобарный потенциал любой химической реакции равен алгебраической сумме соответствующих величин для реакций образования всех участников реакции. Таблицы стандартных изобарных потенциалов образования химических соединений при 1 атм и 25 X являются важнейшей сводкой исходных данных для термодинамических расчетов. Эти табличные данные в большинстве случаен вычислены путем комбинации данных для других реакций. Поэтому онн связаны с ошибками опыта, которые суммируются при сочетании величин ЛС и могут составить большую относительную величину, если значение AG° образования невелико и получено путем вычитания больших величин. [c.300]
Полученные данные сопоставить с рассчитанными величинами по уравнению Нернста, указав ошибки опыта в процентах. [c.303]
Определение элементного состава нефтей проводится общепринятыми методами анализа органических соединений, в частности углерод и водород — сожжением, по Либиху, или в калориметрической бомбе, азот, — по Дюма, сера, — по Кариусу, а кислород, — по разности, причем на процент его содержания ложатся все ошибки опыта. [c.76]
Изучение скоростей реакций при обычных концентрациях показало, что расход олефина подчиняется первому кинетическому порядку, концентрации О2 и NHg не влияют на кинетику процесса, а суммарная энергия активации равна 16—20 ккал/моль (66,9-10 —83,6- 10 Дж/моль). Найдено, что в пределах ошибки опыта скорости окисления и окислительного аммонолиза идентичны [87]. Формальная кинетическая схема [c.160]
Оказалось, что растворимость 2 %-ного водного раствора ДЭГ в гексане не отличается от растворимости воды в гексане (в пределах ошибки опыта) и равна 0,008 % при 20°С, отсюда ориентировочные потери ДЭГ за счет [c.58]
Остаточная сумма квадратов складывается из дисперсии, обусловленной ошибкой опыта, и дисперсии, обусловленной взаимодействиями факторов, если такие имеются [c.103]
Из этой схемы видно, что двумя способами было получено одно и то же значение теплового эффекта (в пределах ошибки опыта). Химическое уравнение вместе с теплотой процесса называется термохимическим уравнением. С ними можно производить любые четыре алгебраических действия. [c.67]
Давление пара серного эфира при 293 К равно 0,589-10 Па, а давление пара раствора, содержащего 0,0061 кг бензойной кислоты в 0,05 кг эфира при той же температуре, равно 0,548-10 Па. Рассчитайте молекулярную массу бензойной кислоты в эфире и относительную ошибку опыта в процентах по сравнению с величиной, приведенной в справочных таблицах. [c.202]
Различие в степени соответствия экспериментальным данным уравнений (111,85) и (1И,87) совершенно незначительно и может быть объяснено ошибками опыта. [c.93]
Распределение исходного фиксированного радиоактивного углеродного атома в (1- С] фенилциклогексане протекает медленнее, чем межмолекулярный перенос циклогексильной группы между фенилциклогексаном и [1—6- С] бензолом в таких же условиях. Особенно быстро межмолекулярная миграция циклогексильной группы протекает в начальный период реакции диспропорционирования (г/= 0,73 ч- ), в то время как распределение радиоактивности между атомами углерода этой группы в первые 30 мин вообще не наблюдается или настолько мало, что составляет величину, меньшую ошибки опыта. [c.205]
С учетом погрешности измерения температуры 0,5 К отклонения АТ укладывались в пределах ошибки опыта. [c.107]
При невысоком содержании непредельных углеводородов (до 10%) метод йодных чисел довольно точен. При больших значениях йодных чисел ошибка опыта возрастает. Свет, повышение температуры уменьшают точность определения в связи с развитием побочных реакций (например, замещения). При анализе высокомолекулярных топлив (например, дизельных) для улучшения условий реакций навеску топлива растворяют в небольшом количестве ацетона. [c.138]
Коэффициенты уравнений регрессии и ошибка опыта рассчитывались по известным формулам 14—5]. [c.140]
Таким образом, введение второго заместителя в положение 6 привело к более заметному повышению стойкости углеводородного димера, чем введение в положение 3. То есть в рассмотренных случаях, в среде Д, УА и А, стойкость димеров и КПЗ была ниже, если оба -заместителя находились в одном кольце. Исключение составил Э, в котором КПЗ с 2,3-ДМН оказался несколько прочнее, но в этом случае разница была невелика и сопоставима с ошибкой опыта. Тот факт, что наибольшая разница стойкости димеров [c.134]
Если УРгг значительно превосходит величину ошибки опыта, то это указывает на криволинейный характер поверхности отклика и требует введения в уравнение регрессии членов с квадратичными эффектами. [c.148]
Однако, результаты расчетов термодинамических величин для предельных углеводородов, выполненных в предположении о свободном вращении групп атомов вокруг связи С—С, не согласуется с опытом. Например, вычисленная величина энтропии этана для 298° К отличается на 1,57 кал град моль от найденной экспериментально, полученной из. измерений зависимости теплоемкости этана от температуры п широком интервале температур. Это расхождение, превышающее ошибку опыта примерно в десять раз, было объяснено тем, что вращение метильных групп вокруг связи С—С происходит не свободно, а заторможено с потенциалом торможения порядка 3000 кал/молъ. Торможение вращения группы около С—С связи является следствием взаимных влияний атомов вращающихся групп. [c.190]
В исследованиях Джоуля, Роуланда (1880), Микулеску (1892) и др. использовались методы трения в металлах, удара, прямого превращения работы электрического тока в теплоту, растяжения твердых тел и др. Коэффициент J всегда постоянен в пределах ошибки опыта. [c.30]
Колебания величины Кх не закономерны и могут быть объяснены ошибками опыта. Если принять Кх= и вычислить У по уравнению (VIII, 38), то полученные величины оказываются близкими к опытным. Раствор четырех участников реакции оказывается близким к идеальному при любых концентрациях, что является, скорее, исключением. [c.285]
Это расхождение уже нельзя объяснить ни ошибками опыта, ни неправильностью в выборе стэфф- В частности, для совпадения расчетных и опытных значений пришлось бы принять [c.127]
По методу Раста ohjhj определено, что температура плавлении смеси, содержащей 0,0152 г нафталина и 0,2568 г камфоры, составляла 156,5°, а температура нлав ления чистой камфоры 180, О. Для кам( юры Кэ == 49,8°. Рассчитать молекуля.п-ный вес нафталина и относительную ошибку опыта в процентах. [c.195]
Азот определяется по Дюма, а кислород по разности, поэтому все ошибки опытов ложатся на кислород. Опособ непосредственного определения т ислорода (в виде воды) Ван-Молена дает достаточно точные результаты. Определение элементарного анализа не входит в круг тех обычных исследований, которым подвергается нефть и про-ИЗВ0Д1ГГСЯ в случае научного анализа. В таблице 1 приведены результаты анализа нефтей главных месторождений. [c.20]
Как вывод из этон таблицы, можно сгса зать, что результаты определения индукционных периодов б обоих приборах практически одинаичовы. Разница между ними не превосходит ошибки опыта при параллельных определениях в одном и том же приборе. [c.182]
Как И В предыдуш ем случае, эти коэфициенты сохраняют силу для масел различных вязкостей, но только для вискозиметра Энглера. Таблицу Ганса можно еш,е дополнить данньши Оффер-мана (190), коюрЫй предложил коэфициент для 25 сл, причем наблюдается время истечения только 10 сл в вискозиметре Уббелоде. Для веретенных и машинных масел при 50° он равен 13,07, нри 20° — 13,03 для цилиндровых при 50° = 12,9. Необходимо заметить, что скорость вьггекания небольших объемов масла слишком велика, и при постоянной ошибке опыта она обусловливает более высокий процент погрешности. [c.259]
Для всех- контрольных точек значения /-крнтерня для уровня значимости Я = 0 05 меньше табличное. На рис. 53 показаны линии равного значения актив-иогт I катализатора, (/[ и прочности уз, построенные но уравнениям (VI. 17) и (VI. 18). Наибольшая активность ката-лиза/ора соответствует области, где значения компонента Х >0,4. Прочность, равн и 65%. является вполне удовлетворительной. Наибольший интерес представ, .яют точки, лежащие па пересечении лини 1 равного выхода /2 = 65% с линией равного выхода (/1=100%, Опыт 10 (см. таблицу, рнс, 53). поставленный в указанной области, дал хорошее (в пределах ошибки опыта) совпадение расчет-Н1.1Х и экспериментальных результатов. [c.273]
Можно показать, что в по очень широком температурном интервале при обычных ошибках опыта значения константы скорости, вычисляемые по простой формуле Аррепиуса (2.11) и формуле, в которой учитывается зависимость предэкспоненциального множителя от температуры, часто оказываются неразличимыми. [c.12]
Значения начальных скоростей реакции превращения бензол-карбоксилатов калия представлены в табл. 2. Из таблицы следует, что начальная скорость превращения исходного вещества (в пределах ошибки опыта) может быть определена как сумма начальных скоростей отщепления карбоксилатной группы (декарбоксилиро-вание) и присоединения к другой молекуле исходного вещества (карбоксилирование). Так как скорости декарбоксилирования и карбоксилирования равны, то обмен карбоксилатными группами может быть выражен уравнением [c.160]
Результаты опытов по термическому превращению пиперилена при атмосферном давлении, температурах 650—750 °С и разбавлении водяным паром в мольном отношении 1 7,6 показали, что скорости распада пиперилена и образования дивинила и циклопентадиена формально описываются уравнениями второго порядка. Однако эти реакции не могут иметь второй порядок, так как изменение разбавления водяным паром от 1 до 16 моль на 1 моль пиперилена в пределах ошибки опыта на результаты термического превращения пиперилена не влияет. Хорошее совпадение расчетной кривой и экспериментальных точек (см. рис. 29.3) было получено, когда для описания изменения концентраций основных продуктов были использованы уравнения скорости первого порядка для самотормозящихся реакций [20], а распад дивинила и циклопентаднена описывался уравнениями скоростей второго порядка [c.240]
протекающие с выделением энергии, называются экзотермическими, с поглощением – эндотермическими.
Все опыты по определению тепловых эффектов химических реакций проводятся в калориметрах различных конструкций, которые представляют собой как можно лучше изолированный от теплообмена с окружающей средой сосуд с мешалкой и термометром. Простейший калориметр состоит из двух стаканов – внутреннего и внешнего; во внутренний стакан опускаются термометр и мешалка. Во всех опытах условно примем плотности растворов равными 1 г/см3, а теплоѐмкости растворов – 4,184 Дж/г·К.
Для данной лабораторной работы вам потребуются следующие реактивы:
1.Магний Mg;
2.Гидроксид натрия NaOH;
3.Серная кислота Н2SO4.
Вопросы для допуска к выполнению лабораторной работы:
1.Что называется энтальпией (теплотой) образования химического соединения?
2.Чему равны энтальпии образования простых веществ?
3. Какие термодинамические параметры считаются стандартными?
Опыт №1. Определение теплового эффекта реакции нейтрализации
Реакция нейтрализации является экзотермической, так как происходит с выделением теплоты.
Методика опыта. Во внутренний стакан калориметра наливаем 20 см3 раствора серной кислоты Н2SO4 с молярной концентрацией эквивалентов 1 моль/дм3. Запишите начальную температуру данного раствора. Затем добавляем 20 см3 раствора гидроксида натрия NaOH с молярной концентрацией эквивалентов 1 моль/дм3. Запишите максимальную температуру реакции.
30

В ходе опыта происходит следующая реакция:
Н2SO4 + 2 NaOH = Na2SO4 + 2 H2O
Тепловой эффект реакции нейтрализации рассчитываем по формуле:
Н 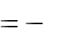
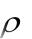 V
V  C
C  t 100
t 100  0,001,
0,001,
где ρ – плотность раствора, г/см3; V – объѐм раствора, см3;
С – удельная теплоѐмкость раствора, Дж/г·К; t – разность температур, °С;
100 – коэффициент пересчѐта на один моль взятой кислоты; 0,001 – коэффициент пересчѐта Дж в кДж.
Запишите расчѐт теплового эффекта реакции нейтрализации по вышеуказанной формуле.
Запишите расчѐт теоретического значения теплового эффекта реакции нейтрализации Нтеор по первому следствию из закона Гѐсса: сначала в общем виде, а затем с подставленными табличными значениями энтальпий образования веществ (см. приложение Б).
Относительную ошибку опыта рассчитываем по формуле:
|
Х |
Нтеор |
Нопытн |
100% |
||||
|
Н |
, |
||||||
|
теор |
|||||||
|
где Нтеор – теоретическое значение величины теплового эффекта, кДж; |
|||||||
|
Нопытн |
– значение величины теплового эффекта, полученное |
||||||
|
в ходе опыта, кДж. |
|||||||
|
Запишите |
расчѐт |
величины |
относительной |
ошибки опыта |
|||
|
по вышеуказанной формуле. |
|||||||
|
Сделайте |
вывод о |
тепловом |
эффекте |
реакции |
нейтрализации |
и укажите, с какой ошибкой он был найден в данном случае.
31

Опыт №2. Определение теплового эффекта реакции взаимодействия металла с кислотой
Реакция взаимодействия металла с кислотой является экзотермической, так как происходит с выделением теплоты.
Методика опыта. Во внутренний стакан калориметра помещаем небольшое количество гранулированного магния Mg и наливаем 2,5 см3 раствора серной кислоты H2SO4 с молярной концентрацией эквивалентов 1 моль/дм3.
Запишите, чему была равна температура кислоты на момент начала реакции и какая максимальная температура была достигнута
входе реакции.
Входе опыта происходит следующая реакция:
Mg + H2SO4 = MgSO4 + H2↑
Тепловой эффект реакции взаимодействия металла с кислотой рассчитываем по формуле:
Н 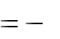
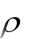 V
V  C
C  t
t  800
800  0,001,
0,001,
где ρ – плотность раствора кислоты, г/см3; V – объѐм раствора кислоты, см3;
С – удельная теплоѐмкость раствора, Дж/г·К; t – разность температур, °С;
800 – коэффициент пересчѐта на один моль взятой кислоты; 0,001 – коэффициент пересчѐта Дж в кДж.
Запишите расчѐт теплового эффекта реакции взаимодействия металла с кислотой по вышеуказанной формуле.
Запишите расчѐт теоретического значения теплового эффекта реакции взаимодействия металла с кислотой Нтеор по первому следствию из закона Гѐсса: сначала в общем виде, а затем с подставленными табличными значениями энтальпий образования веществ (см. приложение Б).
Относительную ошибку опыта рассчитываем по формуле:
32

|
Х |
Нтеор |
Нопытн |
100% |
|||||
|
Н |
, |
|||||||
|
теор |
||||||||
|
где Нтеор – теоретическое значение величины теплового эффекта, кДж; |
||||||||
|
Нопытн |
– значение величины теплового эффекта, полученное |
|||||||
|
в ходе опыта, кДж. |
||||||||
|
Запишите |
расчѐт |
величины |
относительной ошибки опыта |
|||||
|
по вышеуказанной формуле. |
Сделайте вывод о тепловом эффекте реакции взаимодействия металла с кислотой и укажите, с какой ошибкой он был найден в данном случае.
Вопросы для защиты лабораторной работы:
1. Что такое энтальпия (тепловой эффект) химической реакции?
2. Как называются химические реакции, протекающие с выделением теплоты?
3. Как называются химические реакции, протекающие с поглощением теплоты?
4. Формулировка закона Гѐсса.
5. Первое следствие из закона Гѐсса.
6. Как рассчитать тепловой эффект реакции по значениям энтальпий образования вступающих в реакцию и образующихся веществ?
7. Второе следствие из закона Гѐсса.
Рекомендуемая литература:
1.Н.Л. Глинка. «Общая химия». Главы «Превращения энергии при химических реакциях», «Термохимия», «Термохимические расчеты», «Термодинамические величины. Внутренняя энергия и энтальпия», Стандартные термодинамические величины. Химико-термодинамические расчеты».
2.Е.М. Рыбалкин, О.Ю. Ковалик. «Химия. Учебное наглядное пособие». Глава «Химическая термодинамика».
33
3. П.Г. Пермяков, М.Х. Ахметов, С.В. Зенцова. «Основные закономерности протекания химических процессов в газообразных и конденсированных системах. Учебное пособие». Глава «Химическая термодинамика».
4. Р.М. Белкина, Р.И. Славкина, В.Ф. Горюшкин. «Энергетика химических процессов. Задания для практических занятий».
Лабораторная работа №7
Электролитическая диссоциация
Электролитическая диссоциация – это процесс распада электролита на ионы в растворах и расплавах.
Все электролиты делятся на сильные и слабые. Сильные электролиты практически полностью диссоциируют на ионы. Диссоциация слабых электролитов – процесс обратимый, в растворах слабых электролитов устанавливается равновесие между ионами и недиссоциированными молекулами.
|
Отношение |
числа молекул электролита, |
распавшихся |
на ионы, |
|
|
к общему числу |
растворенных |
молекул, |
называется |
степенью |
|
диссоциации электролита. Сила |
кислот |
и |
гидроксидов |
связана |
|
со степенью их диссоциации: чем больше |
степень диссоциации, тем |
|||
|
сильнее соответствующая кислота или гидроксид. |
Химические взаимодействия в растворах электролитов записывают в виде ионно-молекулярных уравнений. Правило составления таких уравнений состоит в следующем: все малорастворимые, летучие вещества
ислабые электролиты записывают в виде молекул, а сильные, легко растворимые – в виде ионов. Обязательным условием протекания ионообменных процессов является удаление из раствора тех или иных ионов, например, вследствие образования слабодиссоциирующих веществ
ивеществ, выделяющихся из раствора в виде осадка или газа.
Для данной лабораторной работы вам потребуются следующие реактивы:
1.Гидроксид калия КOH;
2.Гидроксид кальция Са(ОН)2;
34
3.Фосфорная кислота Н3РО4;
4.Соляная кислота HCl;
5.Карбонат натрия Na2CO3;
6.Карбонат кальция СаСО3;
7.Нитрат калия KNO3;
8.Сульфат натрия Na2SO4;
9.Хлорид аммония NH4Cl;
10.Хлорид кальция CaCl2;
11.Хлорид бария ВаCl2;
12.Хлорид кобальта CoCl2;
13.Хлорид меди CuCl2;
14.Индикатор фенолфталеин.
Вопросы для допуска к выполнению лабораторной работы:
1.Какие вещества являются электролитами?
2.Вещества каких классов неорганических соединений относятся
кэлектролитам?
3. Что такое электролитическая диссоциация?
4. Что такое катионы и анионы?
5. Что такое степень электролитической диссоциации?
6. Что такое константа электролитической диссоциации?
7. Какие реакции относятся к ионообменным?
Опыт №1. Диссоциирующее действие воды
Вода оказывает диссоциирующее действие на молекулы веществ; его можно обнаружить, например, в том случае, если молекулы в спиртовом растворе, где они находятся в недиссоциированном состоянии, и ионы в водном растворе имеют различную окраску.
Методика опыта. В пробирку наливаем 2 мл спиртового раствора хлорида кобальта CoCl2 и добавляем 2 мл дистиллированной воды. Окраска раствора изменяется с синей на розовую.
Составьте уравнение диссоциации хлорида кобальта.
Сделайте вывод о данном способе обнаружения диссоциирующего действия воды.
35
Опыт №2. Действие одноимѐнного иона на диссоциацию гидроксида кальция
В растворах слабых электролитов увеличение концентрации одного из ионов данного электролита уменьшает степень диссоциации электролита.
Методика опыта. В пробирку наливаем 2-3 мл раствора гидроксида кальция Са(ОН)2 и добавляем каплю индикатора фенолфталеина; раствор окрашивается в красный цвет. Затем добавляем 2 мл раствора хлорида кальция CaCl2; окраска фенолфталеина ослабевает. Для сравнения проведем аналогичный опыт, добавив вместо раствора хлорида кальция такое же количество воды, чтобы убедиться, что простое разбавление раствора не вызывает такое ослабление окраски.
Сделайте вывод о влиянии одноимѐнного иона на диссоциацию слабого электролита.
Опыт №3. Сравнение химической активности кислот
Методика опыта. В одну пробирку наливаем 3 мл раствора соляной кислоты HCl, в другую – такое же количество раствора фосфорной кислоты Н3РО4. В обе пробирки вносим по одинаковому кусочку мела (карбоната кальция СаСО3). Наблюдается выделение газообразного вещества, которое более бурное и продолжительное в пробирке с раствором соляной кислоты.
Составьте уравнение взаимодействия карбоната кальция с соляной кислотой в молекулярном, а также полном и сокращѐнном ионномолекулярном виде.
Составьте уравнение взаимодействия карбоната кальция с фосфорной кислотой в молекулярном и ионно-молекулярном виде.
Сделайте вывод, какая кислота более сильная.
Опыт №4. Сравнение химической активности гидроксидов
Методика опыта. В две пробирки наливаем по 3 мл раствора хлорида меди CuCl2 и добавляем в одну 2 мл раствора гидроксида калия КOH, а в другую 2 мл насыщенного раствора гидроксида
36
кальция Са(ОН)2. В первой пробирке выпадает голубой осадок, во второй наблюдается незначительное помутнение раствора.
Составьте уравнение взаимодействия хлорида меди с гидроксидом калия в молекулярном, а также полном и сокращѐнном ионномолекулярном виде.
Составьте уравнение взаимодействия хлорида меди с гидроксидом кальция в молекулярном, а также полном и сокращѐнном ионномолекулярном виде.
Сделайте вывод, какой гидроксид более сильный.
Опыт №5. Ионообменные процессы
Ионообменные процессы протекают до конца в случае выпадения осадка, выделения газообразного вещества или образования слабого электролита.
|
Методика опыта. |
|
|
А) В пробирку наливаем 2-3 |
мл раствора хлорида бария ВаCl2 |
|
и добавляем небольшое количество |
раствора сульфата натрия Na2SO4 |
до выпадения осадка сульфата бария белого цвета.
Составьте уравнение взаимодействия хлорида бария с сульфатом натрия в молекулярном, а также полном и сокращѐнном ионномолекулярном виде.
Б) В пробирку наливаем 2-3 мл раствора карбоната натрия Na2CO3 и добавляем 1-2 мл раствора соляной кислоты HCl. Наблюдается выделение газообразного вещества.
Составьте уравнение взаимодействия карбоната натрия с соляной кислотой в молекулярном, а также полном и сокращѐнном ионномолекулярном виде.
В) В пробирку наливаем 2-3 мл раствора хлорида аммония NH4Cl и добавляем такое же количество раствора гидроксида калия КOH. Ощущается характерный запах аммиака.
37
Составьте уравнение взаимодействия хлорида аммония с гидроксидом калия в молекулярном, а также полном и сокращѐнном ионно-молекулярном виде.
Г) В пробирку наливаем 2-3 мл раствора нитрата калия KNO3 и добавляем такое же количество раствора сульфата натрия Na2SO4. Изменений не наблюдается.
Сделайте вывод об условиях протекания ионообменных процессов.
Вопросы для защиты лабораторной работы:
1. Чем объясняется электропроводность растворов электролитов?
2. Какое значение имеет вода в процессе электролитической диссоциации?
3. Почему водопроводная вода проводит электрический ток, а дистиллированная нет?
4. Чем отличаются ионы, содержащиеся в кристаллической решѐтке вещества, от ионов, содержащихся в растворе этого же вещества?
5. Чем различаются сильные и слабые электролиты?
6. В молекулах каких электролитов (сильных или слабых) ионы связаны прочно, а в каких слабо?
7. Чему равна степень диссоциации сильных и слабых электролитов? 8. От чего зависит степень электролитической диссоциации?
9. Как можно увеличить или уменьшить степень диссоциации слабого электролита?
10. От чего зависит константа электролитической диссоциации?
11. В каких случаях ионообменные реакции протекают необратимо? 12. Как составляются ионно-молекулярные уравнения?
Рекомендуемая литература:
1.Н.Л. Глинка. «Общая химия». Главы «Теория электролитической диссоциации», «Процесс диссоциации», «Степень диссоциации. Сила электролитов», «Константа диссоциации», «Свойства кислот, оснований
исолей с точки зрения теории электролитической диссоциации», «Ионномолекулярные уравнения», «Смещение ионных равновесий».
2.Е.М. Рыбалкин, О.Ю. Ковалик. «Химия. Учебное наглядное пособие». Главы «Растворы электролитов. Электролитическая диссоциация», «Ионно-молекулярные уравнения реакций».
38
3.П.Г. Пермяков, С.В. Зенцова. «Истинные растворы неэлектролитов и электролитов. Методические указания и контрольные задания». Глава «Свойства растворов электролитов».
4.Р.М. Белкина, С.В. Зенцова. «Растворы. Методические указания». Главы «Электролиты и неэлектролиты», «Ионные уравнения».
5.Р.И. Славкина. «Химия. Методические рекомендации». Глава «Ионные уравнения».
Лабораторная работа №8
Гидролиз солей
Гидролиз – это взаимодействие вещества с водой, при котором составные части вещества соединяются с составными частями воды. При этом образуется молекула или ион слабого электролита и изменяется реакция среды.
Гидролизу могут подвергаться соли, в составе которых есть катион или анион, соответствующий слабому гидроксиду или слабой кислоте. Соли, образованные сильными гидроксидами и сильными кислотами, гидролизу не подвергаются, так как ни один из ионов соли не будет связывать молекулы воды с образованием слабого электролита.
Протекает гидролиз в основном только по первой ступени. Для процессов гидролиза так же можно записывать ионно-молекулярные и сокращѐнные ионные уравнения, руководствуясь общими правилами записи ионообменных процессов.
Для данной лабораторной работы вам потребуются следующие реактивы:
1.Карбонат натрия Na2CO3;
2.Гидрокарбонат натрия NaНСO3;
3.Сульфат алюминия Al2(SO4)3;
4.Сульфит натрия Na2SO3;
5.Хлорид алюминия AlCl3;
6.Хлорида цинка ZnCl2;
7.Хлорид олова SnCl2;
8.Индикатор фенолфталеин;
9.Индикатор лакмус.
39
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
При оценке правильности или воспроизводимости результатов необходимо различать понятия об абсолютной и относительной ошибках. Абсолютной ошибкой называют разницу в абсолютных цифрах между полученным результатом и истинным (или наиболее достоверным) или средним значением. Относительной ошибкой называют отношение обычно в процентах) абсолютной ошибкой к истинному или среднему) значению. [c.480]
Абсолютная и относительная ошибки…………………………….465 [c.495]
Абсолютная и относительная ошибки [c.480]
АБСОЛЮТНАЯ И ОТНОСИТЕЛЬНАЯ ОШИБКИ [c.452]
Решение. Пределы расхода реактива 30 0,4 мл. Среднее арифметическое измерений N = 30. Максимальная ошибка измерений 0,4. Абсолютная и относительная ошибки измерений (при N = 30) [c.38]
По объему, плотности и процентной концентрации раствора рассчитывают содержание в нем сухой соли и ее процентное содержание в исходной смеси. Результат проверяют у преподавателя, находят абсолютную и относительную ошибки определения. Данные опыта и результаты записывают по форме [c.41]
Абсолютная и относительная ошибка. Абсолютная ошибка е при определении массы представляет собой разность между истинной массой В и массой , полученной опытным путем [c.15]
Вычислите молекулярный вес Мсо, тремя способами,- указанными в начале описания работы. Определите абсолютную и относительную ошибки опыта. [c.38]
Определение плотности вещества проведите не менее трех раз, а затем вычислите среднее значение рэ(ср.). После этого найдите справочное значение плотности вещества рв (см. Приложение 2) и рассчитайте абсолютную и относительную ошибку измерения плотности — так же, как для определения пикнометрическим методом. [c.98]
Найти значение титра с учетом только достоверных цифр наблюдения, абсолютную и относительную ошибки определения, а также измерение с наиболее существенной ошибкой. [c.28]
При анализе образца технического хлорида бария получены следующие значения содержания хлора (%) 29,08 29,15 29,31 29,10 29,12. Рассчитайте абсолютную и относительную ошибку для каждого результата. Выявите грубые погрешности. [c.196]
Абсолютные и относительные ошибки расчетов покрытий [c.103]
Рассчитать значение х по приведенным данным и определить абсолютную и относительную ошибку расчета. [c.19]
Результаты сдайте преподавателю. Вычислите абсолютную и относительную ошибки. Абсолютная ошибка е представляет собой разность между истинной величиной В и величиной, полученной в опыте Ь) [c.24]
Абсолютная и относительная ошибки в измерении константы равновесия определяются формулами [c.168]
Затем рассчитывают Кср, а потом абсолютную и относительную ошибки. [c.800]
Вывести уравнение для расчета абсолютной и относительной ошибки при измерении длины волны в зависимости от ошибок измерения Дг, Да, Дй, [c.31]
Находят /Сер, абсолютную и относительную ошибки. [c.792]
Найти абсолютную и относительную ошибки измерения и измерение с наиболее существенной ошибкой. [c.28]
Находят Кср И сравнивают со значением к, полученным из графика. Рассчитывают абсолютную и относительную ошибки. [c.797]
По разности вз—найти массу двуокиси углерода в колбе (вв) Из найденных весов и определить относительную плотность двуокиси углерода по воздуху и вычислить молекулярный вес (с точностью до 0,01). Определить абсолютную и относительную ошибки опыта. [c.33]
По опытным данным вычислить молекулярный вес кислорода с точностью до 0,01 и определить абсолютную и относительную ошибки. [c.33]
Найти значение Сд , абсолютную и относительную ошибку измерения. Ответ С =6,54-10 вд.=0,8%. [c.29]
Вычислите абсолютную и относительную ошибки опыта Абсолютная ошибка = 5теор С- [c.88]
Для оценки точности измерения вычисляют абсолютную и относительную ошибки конечного результата. Абсолютная ошибка есть разность между теоретическим значением величины Ь и значением величины с, полученным в опыте [c.37]
Найдите абсолютную и относительную ошибки определения. Результаты сдайте преподавателю. [c.28]
Сравните значение энтальпии растворения АЯэ, полученное экспериментально, с табличным значением (Приложение 11), рассчитайте абсолютную и относительную ошибку. С чем связано отклонение полученной величины от табличного значения ДЯ растворения [c.61]
Какая связь между абсолютной и относительной ошибками опыта [c.29]
Абсолютная и относительная ошибки. Ошибка может бь выражена абсолютным или относительным значением. [c.216]
Определить абсолютную и относительную ошибку опыта [c.35]
В этой таблице приведены данные для условии (высокое давление, низкая температура), при которых следует ожидать максимальную ошибку при определении состава газа для принятого в справочнике диапазона изменения параметров процесса конверсии углеводородов. Из таблицы следуе , что абсолютные и относительные ошибки для наименее благоприятного случая невелики. Следовательно, для практических расчетов справочные таблицы вполне пригодны. [c.12]
Вычислите абсолютную и относительную ошибки определения (см. с. 166). [c.212]
Абсолютные и относительные ошибки [c.12]
Абсолютную и относительную ошибки расчета по этому уравнению вычисляют по формулам, приведенным в табл. 3. Для величины у—по формулам (П1) и (И1а) [c.22]
Определение абсолютной и относительной ошибки непосредственного измерениякакой-нибудь величины [c.11]
По полученным данным рассчитать содержание окиси меди в исходной соли (в %). По формуле Си2(ОН)2СОз вычислить содержание окиси меди в осповном карбонате меди и сравнить экспериментально полученный результат с теоретическим. Определить абсолютную и» относительную ошибку (в %). [c.45]
Значение к рассчитывают по (Х111. 136), а также графически— на основании зависимости 1п(1 оо—V) от t. Вычисляют J p, абсолютную и относительную ошибку. [c.782]
Порядки реакций рассчитывают по формулам (ХП1. 141) и (XIII. 142). Полученные значения ос и р округляют до ближайшего целого положительного числа, подставляют в (XIII. 138) и рассчитывают константу скорости. Находят /Сср, абсолютную и относительную ошибки. Сравнивают стехиометрические коэффициенты со значениями порядков. Учитывая механизм реакции, дают объяснение значениям аир. [c.785]
Константу скорости рассчитывают по формуле (XIII. 168). На основании полученных данных находят Кср, а также абсолютные и относительные ошибки. [c.804]
Для вычисления абсолютной п относительной ошибок определения расчленяем форк улу на составляющие, как это указано выше, и после несложных преобгагсЕзь пй находим выражения для абсолютной и относительной ошибки [c.24]
How to Calculate Experimental Error in Chemistry
Updated on September 08, 2019
Error is a measure of accuracy of the values in your experiment. It is important to be able to calculate experimental error, but there is more than one way to calculate and express it. Here are the most common ways to calculate experimental error:
Error Formula
In general, error is the difference between an accepted or theoretical value and an experimental value.
Error = Experimental Value — Known Value
Relative Error Formula
Relative Error = Error / Known Value
Percent Error Formula
% Error = Relative Error x 100%
Example Error Calculations
Let’s say a researcher measures the mass of a sample to be 5.51 grams. The actual mass of the sample is known to be 5.80 grams. Calculate the error of the measurement.
Experimental Value = 5.51 grams
Known Value = 5.80 grams
Error = Experimental Value — Known Value
Error = 5.51 g — 5.80 grams
Error = — 0.29 grams
Relative Error = Error / Known Value
Relative Error = — 0.29 g / 5.80 grams
Relative Error = — 0.050
% Error = Relative Error x 100%
% Error = — 0.050 x 100%
% Error = — 5.0%
Не пойму, что я делаю не правильно:
p.s. по лабораторной работе «определение теплоты нейтрализации»
Чтобы найти относительную погрешность опыта надо: е = (Qтеорит-Qэксп)/Qтеорит * 100%
Qтеорит = 56,9 кдж/моль, а Qэксп я нашла , получилось 1161,4 Дж и перевела в килоджоули 1,1614 кДж.
Но когда я их подставляю в формулу, у меня получается значение 98!
Такое может быть? Или где-то ошибка?
