- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Соколова А.В.
1
Малишевская Н.П.
2
1 Клиника «Уральская»
2 Государственное бюджетное учреждение Свердловской области «Уральский научно-исследовательский институт дерматовенерологии и иммунопатологии»
В России в течение последних 15 лет отмечается рост заболеваемости меланомой кожи (МК) на 70%. Наиболее неблагоприятны по своим последствиям ошибки в диагностике МК. Проведено клиническое и дерматоскопическое исследование 1030 новообразований кожи у 800 пациентов, последовательно обратившихся на прием к дерматологу. В выборку включены все пациенты с новообразованиями кожи, после удаления которых было произведено гистологическое исследование материала и получено патоморфологическое заключение (n=441). Из 441 гистологического исследования новообразований кожи совпадение с клинически установленным диагнозом было в 355 случаях (80,5%), расхождение — в 86 случаях (19,5%). Из 86 случаев расхождения диагнозов установлено 24 (27,9%) случая гиподиагностики диспластических невусов и меланомы кожи, 34 (39,5%) случая гипердиагностики диспластических невусов и меланомы кожи. Проанализированы причины расхождения клинического и дерматоскопического с патоморфологическим диагнозом в случаях сложной дифференциальной диагностики новообразований кожи, к которым относятся больные с диспластическими невусами и меланомой кожи, особенно на ранних стадиях. Основными причинами гиподиагностики меланоцитарных новообразований кожи являются малый размер новообразования, визуальная однородность цвета, беспигментные или мало пигментированные новообразования, визуально и дерматоскопически определяемые ровные и четкие контуры.
меланома кожи
диспластический невус
ошибки в диагностике меланомы
гиподиагностика меланомы кожи.
1. Демидов Л.В., Харкевич Г.Ю., Маркина И.Т. Меланома и другие злокачественные новообразования кожи // Энциклопедия клинической онкологии: руководство для практических врачей. — М.: РЛС, 2005. — С. 341–364.
2. Малишевская Н.П., Игликов В.А. и др. Эпидемиология злокачественных новообразований кожи на Среднем Урале / Кунгуров Н.В. (ред.) // Злокачественные новообразования кожи: заболеваемость, ошибки диагностики, организация раннего выявления, профилактика. — Курган: Зауралье, 2010. – С. 8-33.
3. Чиссов В.И., Старинский В.В., Петрова Г.В. Качественные новообразования в России в 2011 году (заболеваемость и смертность). — М.: ФП «МНИОИ им. П.А. Герцена» Минздрава России, 2013. — 289 с.
4. Chen S.T., Geller A.C., Tsao H. Update on the epidemiology of melanoma // Curr. Dermatol. Rep. — 2013. — № 2 (1). — Р. 24–34.
5. Малишевская Н.П., Кохан М.М., Соколова А.В и др. Дерматоонкология (злокачественные новообразования кожи, первичные лимфомы кожи): атлас / под общ. ред. проф. Н.В. Кунгурова. – Екатеринбург: Изд-во Урал. ун-та, 2016. – 68 с.
6. Состояние онкологической помощи населению России в 2016 году / под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. — М.: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИРЦ» Минздрава России, 2017. — 236 с.
В России в течение последних 15 лет отмечается рост заболеваемости меланомой кожи (МК) на 70% [1-4]. Наиболее неблагоприятны по своим последствиям ошибки в диагностике МК. О значительном количестве диагностических ошибок на разных уровнях оказания медицинской помощи пациентам свидетельствует сохраняющийся высокий удельный вес больных с МК, выявленной на поздних стадиях опухолевого процесса [5]. За период с 2006 по 2016 год в РФ показатели запущенности по меланоме кожи значительно снизились (-40,6%), однако они по-прежнему остаются на недопустимо высоком уровне (18,9%) для опухолей визуальных локализаций [6]. Следует отметить, что гипердиагностика МК не влечет столь трагических последствий, как гиподиагностика, которая всегда связана с ухудшением прогноза течения заболевания и риском для жизни больного.
Цель исследования — установить причины расхождения результатов клинического и стандартного дерматоскопического обследования с патоморфологическим диагнозом в случаях сложной дифференциальной диагностики НОК. Проведено клиническое и дерматоскопическое исследование 1030 новообразований кожи (НОК) у 800 пациентов, последовательно обратившихся на прием к дерматологу. Из них в 441 (42,8%) случае выполнено удаление НОК радиоволновым или хирургическим методом с последующим гистологическим исследованием. Показаниями для удаления новообразований кожи явились подозрение на МК и диспластические невусы, все случаи сложной дифференциальной диагностики, а также все меланоцитарные новообразования, находящиеся в местах постоянного травмирования или имеющие большие размеры (>6 мм). В случаях подозрения на МК пациенты направлялись в Государственное бюджетное учреждение Свердловской области «Свердловский областной онкологический диспансер» для хирургического иссечения НОК и последующего лечения. В выборку включены все пациенты с верифицированными диагнозами НОК, в том числе пациенты с меланомой кожи на ранних (I-II) стадиях и диспластическими невусами, когда правильная и своевременная диагностика наиболее важна для дальнейшего прогноза течения заболевания (табл. 1).
Таблица 1
Структура новообразований кожи (n=441)
|
Меланоцитарные новообразования кожи |
Число больных с правильно установленным диагнозом, абс. (%) |
|
|
визуальный осмотр с использованием дерматоскопии |
гистологическое заключение |
|
|
Доброкачественные НОК |
349 (79,1%) |
361 (81,9%) |
|
Диспластические невусы кожи |
82 (18,6%) |
67 (15,2%) |
|
Меланома кожи на ранних стадиях |
10 (2,3%) |
13 (2,9%) |
Группу доброкачественных новообразований кожи составили меланоцитарные невусы без признаков дисплазии (n=263), себорейный кератоз (n=74) и гемангиомы кожи (n=12) в случаях их травмирования, с наличием геморрагических корочек на поверхности новообразований, затрудняющих визуальную и дерматоскопическую диагностику.
Таким образом, в данной выборке достоверных различий в правильности постановки диагноза при клиническом осмотре дерматолога с применением рутинной дерматоскопии и результатом гистологии не выявлено (табл. 1).
Из 441 гистологического исследования НОК совпадение с клинически установленным диагнозом было в 355 случаях (80,5%), расхождение — в 86 случаях (19,5%). Совпадение клинического дерматоскопического и гистологического диагнозов (n=355) выявлено в случаях доброкачественных новообразований кожи (n=305), диспластических невусов (n=45) и меланомы кожи (n=6). Из 86 случаев расхождения диагнозов установлено 24 (27,9%) случая гиподиагностики диспластических невусов и меланомы кожи, 34 (39,5%) случая их гипердиагностики.
Проанализированы причины расхождения клинического и стандартного дерматоскопического обследования с патоморфологическим диагнозом в случаях сложной дифференциальной диагностики НОК, к которым относятся больные с диспластическими невусами и меланомой кожи, особенно на ранних (I-II) стадиях (табл. 2).
Таблица 2
Визуальные признаки НОК, влияющие на гиподиагностику диспластических невусов и МК с использованием дерматоскопии (n=24)
|
Признак |
Частота встречаемости |
|
|
абс. |
% |
|
|
1. Малый размер новообразования (<6 мм) |
17 |
70,8 |
|
2. Визуально и дерматоскопически определяемые ровные четкие контуры |
3 |
12,5 |
|
3. Клинически и дерматоскопически определяемая однородность цвета |
6 |
25,0 |
|
4. Беспигментные или мало пигментированные новообразования |
5 |
20,8 |
Примечание: у одного больного могло быть несколько причин гиподиагностики, в связи с чем общая частота встречаемости признака превышает 100%.
B соответствии с приведенными данными основными причинами гиподиагностики пигментированных новообразований кожи являются малый размер новообразования (70,8%, рис. 1), визуальная однородность цвета (25,0%, рис. 2), беспигментные или мало пигментированные новообразования (20,8%, рис. 3), визуально и дерматоскопически определяемые ровные и четкие контуры (12,5%, рис. 4).
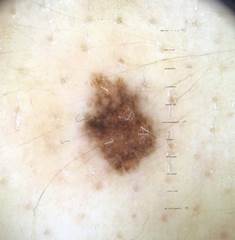
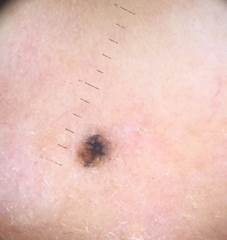
Рис. 1. Линейный размер меланомы кожи меньше 6 мм (дерматоскопическое изображение)
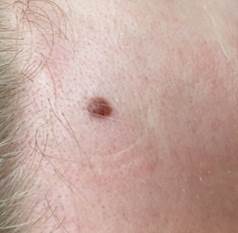
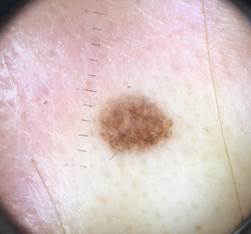
Рис. 2. Клиническое и дерматоскопическое изображение диспластического невуса кожи лба: клинически определяется визуальная однородность цвета
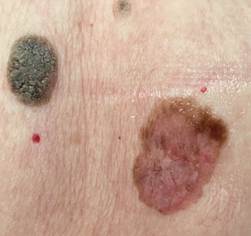
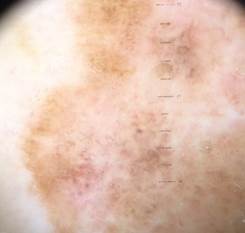
Рис. 3. Клиническое и дерматоскопическое изображение мало пигментированной меланомы кожи живота с участками регресса, выше – себорейный кератоз
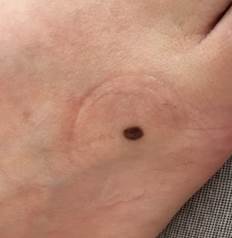
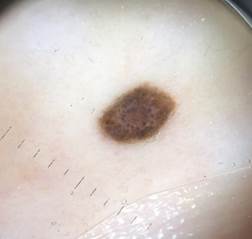
Рис. 4. Клиническое и дерматоскопическое изображение меланомы кожи тыльной поверхности стопы
Проанализированы причины гипердиагностики меланоцитарных новообразований кожи в случаях, когда возникают трудности в дифференциальной диагностике диспластических невусов и меланомы кожи (табл. 3).
Таблица 3
Визуальные признаки НОК, влияющие на гипердиагностику диспластических невусов и МК с дерматоскопией (n=34)
|
Признак |
Частота встречаемости |
|
|
абс. |
% |
|
|
1. Большой (свыше 10 мм) размер новообразования |
13 |
54,2 |
|
2. Клинически и дерматоскопически определяемые неровные контуры и асимметричность новообразования |
9 |
37,5 |
|
3. клинически и дерматоскопически определяемая неоднородность цвета |
15 |
62,5 |
|
4. Наличие в новообразовании фрагментов темно-коричневого и черного цвета при дерматоскопии новообразований |
8 |
33,3 |
Примечание: у одного больного могли быть несколько причин гипердиагностики, в связи с чем общая частота встречаемости признака превышает 100%.
B соответствии с данными таблицы 3 основными причинами, которые приводят к гипердиагностике диспластических невусов и меланомы кожи, являются неоднородность цвета (62,5%, рис. 5, 7), размер новообразований более 10 мм (54,2%, рис. 6), неровные контуры и асимметричность новообразования (37,5%, рис. 5), а также наличие в новообразовании фрагментов темно-коричневого и черного цвета (33,3%, рис. 5-7).
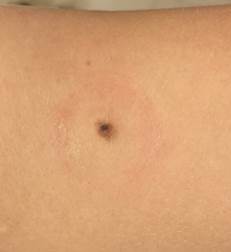
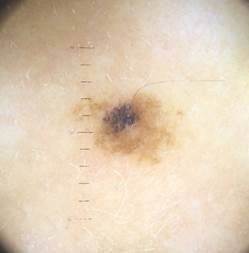
Рис. 5. Клиническое и дерматоскопическое изображение диспластического невуса кожи плеча: неоднородность цвета, неровные контуры и асимметричность новообразования, наличие в новообразовании эксцентрично расположенных фрагментов темно-коричневого и черного цвета
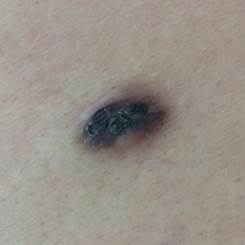
Рис. 6. Пигментированная дерматофиброма кожи бедра
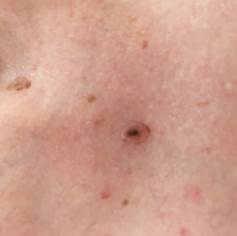
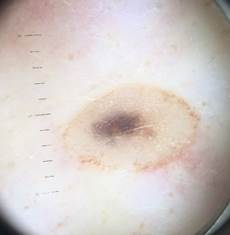
Рис. 7. Клиническое и дерматоскопическое изображение диспластического невуса кожи живота
Результаты расчета показателей диагностической точности, чувствительности и специфичности клинического осмотра с применением дерматоскопии для диагностики НОК продемонстрировали, что чувствительность клинического осмотра с применением дерматоскопии для доброкачественных новообразований кожи (91,2%) на 45,0% выше, чем чувствительность диагностики меланомы кожи (46,2%). Но при этом определяется высокая (99,1%) специфичность клинической и дерматоскопической диагностики меланомы кожи, что свидетельствует о большой вероятности совпадения диагноза с данными патоморфологического исследования. Точность диагностики меланомы кожи составляет 97,5%, что на 9,1% выше, чем точность диагностики доброкачественных новообразований кожи (88,4%) с применением метода дерматоскопии.
На следующем этапе исследования был разработан «показатель гиподиагностики», т.е. число больных, которым необходимо провести клиническое и дерматоскопическое исследование новообразований кожи для того, чтобы у одного из них установленный клинический диагноз не подтвердился результатом гистологического исследования. Показатель гиподиагностики рассчитывали как отношение неверно диагностированных случаев ко всем случаям НОК в данной группе. Этот показатель составил 18,4 в случае диспластических невусов и меланомы кожи, и 63,0 в случае только меланомы кожи. Таким образом, при осмотре 63 больных с НОК в ситуациях сложной дифференциальной диагностики дерматолог допускает один случай гиподиагностики меланомы кожи.
Диагностические ошибки за счет гиподиагностики процесса имеют наиболее неблагоприятные для течения заболевания и прогноза жизни последствия, что диктует необходимость внедрения в клиническую практику новых современных неинвазивных методов обследования меланоцитарных новообразований кожи (спектрофотометрического интрадермального анализа, конфокальной лазерной сканирующей микроскопии).
Библиографическая ссылка
Соколова А.В., Малишевская Н.П. ОШИБКИ В ДИАГНОСТИКЕ МЕЛАНОЦИТАРНЫХ НОВООБРАЗОВАНИЙ КОЖИ // Современные проблемы науки и образования. – 2018. – № 2.
;
URL: https://science-education.ru/ru/article/view?id=27502 (дата обращения: 25.06.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
ряда цитокинов являются участниками сложных внутриклеточных каскадов, экспрессия которых может привести к онкогенной трансформации клеток и развитию промоции.
ОШИБКИ ПРИ ИСПОЛЬЗОВАНИИ ЛУЧЕВОЙ ДИАГНОСТИКИ У ПАЦИЕНТОВ С ОПУХОЛЯМИ ГОЛОВНОГО МОЗГА
О. В. Могучая, И.Г. Захматов, В. В. Щедренок,
Е.И. Усанов, А.Ю. Улитин
РНИ нейрохирургический институт
им. проф. А.Л. Поленова, г. Санкт-Петербург, Россия
Е-mail авторов: igz@bk.ru
Цель исследования: уточнить критерии целесообразности, достаточности и сроков выполнения лучевых методов исследования у пациентов с нейроонкологией, и оценить качество лучевой диагностики на основании его соответствия принятым стандартам объема медицинской помощи.
Материалы и методы. Проведен анализ 231 истории болезни пациентов с опухолями головного мозга, находившихся на лечении в 7 стационарах Санкт-Петербурга в 2009 г., которым в различном объеме выполнены лучевые методы обследования. Выявлены наиболее распространенные ошибки в назначении, трактовке и своевременности выполнения современных методов лучевой диагностики.
Результаты и обсуждение. В 32% случаев пациентам была выполнена только МРТ, данные которой не позволяют в полной мере судить о плотности опухолевой ткани, степени деструкции костных структур при менингососудистой природе новообразования.
У 54% пациентов не была выполнена МРТ, обследование ограничивалось только данными СКТ, которые не дают должного представления о распространении процесса, выраженности перитуморозного отека, степени компрессии и деформации структур головного мозга, окружающих патологический процесс.
Введение контрастного вещества во время выполнения лучевых методов исследования при диагностике опухолей головного мозга отмечено лишь у 68% пациентов.
В соответствии с действующими стандартами и протоколами ведения этих больных оптимальной тактикой обследования является обязательное выполнение МРТ в Т1ВИ, Т2ВИ и FLAIR режимах в сагиттальной, фронтальной и аксиальной проекциях, с введением контрастного вещества, а также СКТ-исследование с оценкой плотностных характеристик для разных гистологических типов внутримозговых опухолей.
Ангиография, МР-ангиография либо СКТ-ангиография были выполнены только у 8% пациентов, хотя подозрение на вовлечение в процесс основных артерий, глубоких вен мозга и синусов имели место в 17% случаев, то есть более половины пациентов были оперированы без достаточной информации
о характере кровоснабжения опухоли.
В 52% анализированных историй болезни контрольные МРТ или СКТ-исследования не были назначены в динамике после выписки из стационара. Оптимальная тактика лучевого обследования в данном случае должна основываться на степени анапла-зии опухоли.
При анаплазии 1-2 степени контрольное МРТ-исследование с контрастированием целесообразно назначать через 6 мес. При анаплазии 3-4 степени МРТ с контрастированием необходимо повторять через каждые 3 месяца в течение года после выписки.
Выводы.
1. До настоящего времени не разработан единый алгоритм обследования пациентов с опухолями головного мозга перед операцией, несмотря на наличие целого ряда регламентирующих документов.
2. Для улучшения диагностики пациентам с опухолями головного мозга клинико-лучевые алгоритмы дооперационного периода должны включать обязательное выполнение МРТ с контрастированием в аксиальной, сагиттальной и фронтальной проекциях, СКТ, а также селективной ангиографии, либо МР-или СКТ-ангиографии при локализации новообразования в области основных артерий, вен мозга или венозных синусов.
ВРАЧЕБНЫЕ ОШИБКИ
ПРИ ДИАГНОСТИКЕ МЕЛАНОМЫ КОЖИ
Е.С. Никитина
Саратовский ГМУ им В.И. Разумовского, Россия E-mail авторов: kiti-ormanti@rambler.m
Выявлять меланому кожи должны, в первую очередь, врачи первого контакта. Поэтому диагностические ошибки на догоспитальном этапе влияют не только на тактику лечения, но и на прогноз.
Цель исследования: проанализировать причины ошибок в диагностике меланомы кожи на догоспитальном этапе.
Материалы и методы. Анализировались медицинские документы и анамнестические данные. Всего проведен анализ 150 больных, находившихся на лечении в клинике онкологии с 2009 по 2011 годы. Большинство пациентов (89,9%) обнаружили у себя опухоль самостоятельно. При профилактическом осмотре меланома выявлена у 10,1%.
Результаты и обсуждение.
45, 2012 Тюменский медицинский журнал
Из анамнеза выяснено, что длительно существующие пигментные образования на коже имелись у 78,7% пациентов. Из них у 28,7% они были врожденными, а у 50 % — появились в течение жизни.
При анализе установлено, что время, прошедшее от появления клинических признаков до обращения к врачу, у большинства больных — 69,6%, составляло от
1 до 12 месяцев. Поводом для обращения к врачу были: быстрое увеличение пигментного образования (у 71,3 % больных), кровотечение из очага (у 21,4% пациентов), изменение цвета пигментного образования (у 5,2% больных), появление увеличенных лимфатических узлов (у 2,1% пациентов). Длительность существования указанных выше симптомов различна. Чаще всего они развивались в течение 6 месяцев, что было отмечено 47,3% больными. Активизация за 7-12 месяцев была у 27,1% пациентов, а в срок до двух лет — у 25,6% человек. Не всегда больные обращались к врачу сразу после обнаружения активизации пигментных образований. Это сделали лишь 52,4%. Поздние сроки обращения за консультацией показывают, что население не обладало информацией о необходимости обследования у врачей. Первым пунктом обращения к врачу у всех больных была районная поликлиника. Основное число пациентов (74%) посетили дерматолога или хирурга. Врач первого контакта сразу направил к онкологу 42,7% пациентов. У остальных пациентов действия врачей не были направлены на уточнение диагноза. Часто врач самостоятельно давал рекомендации и назначал лечение без консультации с онкологом и верификации. Подобная тактика, впоследствии приведшая к тому, что все поступили в клинику с изъязвленной, распадающейся или метастатической меланомой, применена у 34,8%. Наблюдение в условиях поликлиники было рекомендовано 22,5% больным. Морфологическое исследование и консультация онколога, в этих наблюдениях, не были использованы. Таким образом, возможности своевременного выявления меланомы врачом поликлиники были упущены.
Выводы.
Анализ ошибок при диагностике меланомы показал, что причинами запущенности больных меланомой кожи являются формальное проведение массовых профилактических осмотров на раннее выявление меланомы и предмеланомных состояний, некачественная диспансеризация лиц с фоновой патологией, недооценка клинических данных, онкологическая неграмотность врачей первого контакта и населения, недостаточное и нерациональное использование эффективных диагностических методов.
НЕДОСТАТОЧНОСТЬ АНТИОКСИДАНТНОЙ СИСТЕМЫ ТКАНЕЙ КАК ВЕДУЩИЙ ПАТОГЕНЕТИЧЕСКИЙ ФАКТОР ДЕСТРУКТИВНОГО ДЕЙСТВИЯ ТЕРМИЧЕСКОЙ ТРАВМЫ
Н.В. Полутова, Н.П. Чеснокова, Н.В. Островский
Саратовский ГМУ, г. Саратов, Россия E-mail авторов: polutovanat@mail.ru
Актуальность проблемы термической травмы определяется ее высокой распространенностью среди всех возрастных групп населения. Так, термическая травма занимает второе место в общей структуре травматизма вслед за механическими повреждениями тканей.
До настоящего момента отсутствуют системате-зированные сведения о состоянии процессов липопе-роксидации при термическом поверхностном поражении кожи, их динамических сдвигах в период острого воспаления и на фоне развития репаративной регенерации.
Цель исследования: изучение состояния процессов липопероксидации и антирадикальной защиты клеток крови больных с ожоговой раной на фоне традиционной комплексной терапии в динамике развития патологии.
Материал и методы.
В работе представлены результаты комплексного клинико-лабораторного обследования 30 больных с поверхностными ожогами (ожог I, II и ША степени) в динамике патологии, находившихся на стационарном лечении в Саратовском центре термических поражений в 2007- 2011 гг. Первый забор крови для исследования производился на 1-е сутки патологии, что соответствовало развитию реактивно-
воспалительных процессов в ожоговой ране. Второй забор крови осуществлялся на 10-е сутки заболевания. В этот период времени начинался процесс эпи-телизации раны. Третий забор крови производился на 18-е сутки патологии (период выздоровления).
О развитии ситемных метаболических сдвигов при поверхностных ожогах кожи судили по степени интенсивности свободнорадикальной дестабилизации клеток крови, в частности по показателям содержания в крови промежуточных продуктов липо-пероксидации: диеновых конъюгатов (ДК) и малонового диальдегида (МДА). О состоянии антиоксидант-ной системы крови судили по показателям активности супероксиддисмутазы (СОД), каталазы, уровню витамина Е, 8И-групп, которые определялись общепринятыми спектрофотометрическими методами исследования.
Результаты исследования показали, что на 1-и и 10-е сутки с момента развития ожоговой раны отмечались интенсификация процессов липоперокси-дации и нарастание уровня промежуточных продуктов липопероксидации: МДА в эритроцитах и плазме крови, а ДК в эритроцитах — по сравнению с таковыми показателями контрольной группы. Избыточное накопление промежуточных продуктов липоперокси-дации сочеталось с недостаточностью механизмов антиоксидантной защиты клеток крови, на что указывало подавление активности СОД и каталазы эрит-
Тюменский медицинский журнал № 2, 2412
Ошибки гистологии. Вчера у меня появилось две истории связанные с этим явлением. Вообще, написали сразу аж восемь человек и я даже ответить еще не успел на все, но две эпопеи, именно в части ошибок, оказались похожими и, собственно, вот :
I. РМЖ — МЕЛАНОМА
В 2014 году у жены диагностировали рак молочной железы, прошли курс химиотерапии, в 2017 диагностировали меланому, прежний диагноз оказался ошибочным. В марте 2017 г. сделали ПЭТ и в начале мая КТ нашли пятно 5мм в легком диагностировали метастаз. Вы пишите что лечились успешно от меланомы, не было ли у вас такого распространения метастаз и что посоветуете для успешного лечения.
(где происходило и происходит действо я не знаю, т.к. если ваши камменты оставляют «след» в виде ip адресов, то письма и тексты, отправленные через форму на сайте, совсем анонимные приходят прим Дядя Вадик)
В 2012г я ,читая подобные письма с началом действа в начале двухтысячных, думал — ну сейчас то ведь на 2001г, сейчас то ведь УЖЕ НЕ ОШИБАЮТСЯ. НЮ-НЮ… Сейчас, по прошествии уже 5 лет, понимаю, что такие ошибки в гистологических исследованиях будут всегда.
Дальнейшей переписки не будет, но могу сказать, что онколог извинился за проведенную мастэктомию (тут ведь главное извиниться.)
Но это цветочки и напечатано только для «разминки»
а вот «ягодки»:
II ФИБРОСАРКОМА — МЕЛАНОМА
Вводные:
Городок в полутора тысячах километрах от Санкт-Петербурга. Называется Инта.
Девушка-красавица (фото я вам, конечно, не покажу, но поверьте на слово, читайте ниже)
2012г фибросаркома на голове. Удалена
2015г рецидив. Терапия (в препаратах этих я не разбираюсь)
2016г пересмотр гистологии в НИИ Петрова — меланома, есть BRAF V600
2016г КИ по BCD-100 (безрезультатно, но данный факт к основной канве относится лишь небольшим боком)
2017г апрель. Начало приема Тафинлара… (вот это самое «интересное»)
**********
Здравствуйте, хочу попросить у вас совета, по всей видимости как у профессионала (люди, в очередной раз хочу отметить, что профессионалы учатся много лет и сидят в кабинетах одев белые халаты. На этом сайте таких нет. Тут собрались только «любители» и все что вы читаете и «мотаете на ус» нужно согласовывать со своим врачом! Ну если есть с кем вообще согласовывать… прим Дядя Вадик) .
После 20 ти дневного принятия дабрафениба повысилась температура до 39, 8. Держится уже 4 дня, сбиваю, а потом опять, хотя до этого чихала несколько раз в день, и хотелось бы верить что это не побочный эффект тафинлара, а просто вирус, посоветуйте мне пожалуйста что делать. Спасибо
Добрый день!
В первую очередь определить причину температуры.
Как пример: моя знакомая участвует в КИ по Кейтруда+Тафинлар+Мекинист и вот после начала приема лекарств у нее поднялась температура под 40 и вообще никак не сбивалась.
Через несколько дней выяснилось, что у нее «нарисовалась» пневмония.
Кейтруду исключили, а Тафинлар с Мекинистом уменьшили дозу.
Когда победили пневмонию , Таф+Мек вернули к обычным дозам.По этому — к врачу вам и побыстрее!
У меня сегодня была температура 41,6. На сколько максимум можно приостановить прием препарата. Спасибо вам что ответили.
огого Ну на несколько дней точно можно. Ничего не случится. Но, повторюсь, надо скорее определить причину. Тем более такая температура дикая! Врача на дом, рентген легких, ну или флюорографию (я путаю их) . А эти 20 дней вообще не было побочек?
Все было хорошо, я «слезла» с наркотиков, перестала даже трамадол колоть, до этого муки были невыносимые, иногда даже наркотики не помогали, и опухоль за ухом после КИ выросла с мой кулак, все это кровило без конца, она частично сгнивала я уже смердила заживо потеряла вес от почти 70 до 45 за месяц, гемоглобин был 33, это меня так Питер домой отправил, с одним назначением поднимать гемоглобин и наблюдаться по месту жительства, а я живу почти возле Воркуты, онкология в Сыктывкаре, ехать сутки. У нас онколога вообще нет.
И вот я уже умирала, пока мне не позвонила девочка с которой мы проходили КИ по би си ди. У нее кстати тоже после ки образовались 21 мтс в головном мозге, и ей врач порекомендовал лечиться этим препаратом, она на тот момент когда мне звонила уже месяц его принимала. И вот она мне рассказала о своих результатах посоветовала мне начать принимать его самой без назначения, у нас с ней одинаковые диагнозы.
Мне люди добрые насобирали деньги, и мы купили первую баночку, выбора у меня не было. Сыктывкар (это до которого ехать сутки прим Дядя Вадик) предлагал мне только химию. А какая мне химия я стала скелетом. Тем более до этого меня лечили год от саркомы, т.е они не пересмотрели стекла с блоками и первично неправильно был поставлен диагноз.
Химии были агрессивные мучительные по 4суток, и когда ничего не помогало они меня в Питер. На 5 день принятия Тафинлара. у меня рассосались мелкие лимфоузлы на шее, а к 10 дню опухоль стала кусками отваливаться вообще без кровотечения, так покровит незначительно, хотя до лечения Тф. каждый день по 150 — 200 гр. крови терялось до потери сознания.
Опухоль постоянно травмировалась это же за ухом и на пол головы, я спала почти сидя. Ну так вот а потом стали уменьшаться твердые большие лимфоузлы в которых мтс. Сейчас их вообще не видно ухо развернулось, а то опухоль совсем к лицу ухо свернуло, в общем болезнь меня изуродовала и с врачами не повезло. А до температуры шло все как надо. И вот что случилось. Даже не хочу верить в то что он мне не подойдет. Я только оживать стала, вес набираю, аппетит хороший, но такой температуры я даже не знала что она есть, я думала 40 и все. И плохо мне было просто не описать, все перепугались даже скорая. Извините что не в двух словах, вот такая моя печальная история, обратилась с красным пятнышком, а домой отправили с огромной опухолью, мучениями и безнадежностью. Спасибо вам за поддержку.
Елена, здравствуйте!
Вам спасибо что написали!У меня вопрос:
Получается что после прогрессирования на Ки по bcd100 вам врач не назначил ингибиторы БРАФ?Даже не рассматривался этот вопрос что ли?
Меня сняли с 7 курса (если так можно назвать) всего их 9, т.к. опухоль прогрессировала она сильно кровоточила, и тем более я ее постоянно беспокоила одевая шапки и снимая, а там еще и повязки, бывало доезжала до дома родственников весь шарф и свитер до джинсов в крови, и гемоглобин дошел до 33. Они тут же меня отправили домой, хотя до этого я просили назначить мне зербалаф, это то о чем я знала на тот момент..
А приехала домой почитала документы и ужаснулась. Потому что везде в фондах куда обращалась, и они даже готовы были помочь не много, везде требовали рекомендации этого препарата от врача, я с ней созванивалась она несколько дней не брала трубку, а потом когда я ей написала смс, а потом позвонила, врач коротко и ясно дала понять что с таким гемоглобином меня никто даже принимать не будет, и этот препарат который я прошу он не входит в список жизненноважных препаратов. Хотя девочке моей с которой в КИ назначили и зелб
Со мной этот вопрос вообще не рассматривался, я все узнавала от своей девочки. Я думала они меня будут дальше лечить, но ошиблась. Да что тут говорить, я в НИИ Петрова сознание потеряла на 2 минуты примерно, очнулась возле меня врачи, профессора, кандидаты наук, отвезли меня на каталке в процедурный каб. и благополучно вызвали мне скорую из Сестрорецка соседнего городка, поставив мне диагноз инсульт, подозрение на инфаркт, хотя все это время я с ними разговаривала и убеждала что у меня просто бессилие и такого со мной никогда не было, а когда скорая приехала они удивились увидев такой диагноз, а там меня исследовали всю, анализы взяли, кт сделали всего. И отправили тоже домой.
Я и мои родственники были в шоке от такого обращения.
Так, ну недалекое прошлое мне понятно. Теперь о будущем. Елена, Вы уже сколько Тафинлара купили и сколько курсов пропили? По хорошему, с таким ответом на терапию, вам однозначно положен препарат бесплатно. И не просто Тафинлар, а еще и с Мекинистом!
Вот: Жить здорово. Очень интересный выпуск . Я думаю что вам надо написать письмо в Минздрав и пусть только попробуют отказать!
Только в начале апреля этого 2017 года гемоглобин повысился до 90, все это в период от февраля до апреля, т.к и вот тут мы созвонились с ***** девочкой с которой мы в КИ. Я пожаловалась ей на невыносимые боли, на растущую, и кровоточащую рану, и еще бы чуть чуть я жевать не смогла бы, опухоль вывернула ухо прямо на щеку, на лицо, шея распухла до размеров лица от лимфоузлов, и помощи ждать неоткуда пока не подниму гемоглобин, а поехать тем более невозможно, она тут же мне сказала про Дабрафениб и все что с ним связано, и я тут же стала связываться с Сыктывкаром , а они с глав.врачом.
Я в надежде на бесплатное получение препарата ждала, а они в этом отказали, зато предложили химиотерапию зная в каком я состоянии, а до этого мне город насобирал деньги, и когда я получила отказ мы рискнули купить Тафинлар. Как только я его получила сразу стала принимать на 5 сутки …………. и с этого момента вы уже все знаете. Это моя первая баночка до второй осталось 10 дней.
А ведь еще в 2016г врач местный уже рекомендовал BRAF -ингибиторы, только я вот не пойму, о каком «комплексном лечении» идет речь?

Температура с утра была 35.2, а весь день все нормально. Но я вчера с вечера прекратила пить лекарство.
ясно.
****, давайте вы еще завтра вот ему напишите: http://www.onconet.ru/forumdisplay.php?f=21Именно вопрос про перерыв в приеме Тафинлара. Я ведь не могу точно сказать, на сколько его можно прерывать.
Ну и мне думается, что нужно теперь повторно связаться с «глав врачом» и снова , объяснив «вновь открывшиеся обстоятельства» в виде прекрасного ответа на лечение, попросить созвать комиссию и назначить Тафинлар (желательно с Мекинистом!)
**********************
Вот это все вчера закончилось в час ночи…
Сначала я поудалял все названия и имена, но потом обратился к Яндексу и вот:
Публикация раз
Публикация два
Единственное в чем ошиблись журналисты — нужные лекарства ВЫДЕЛЯЮТСЯ МИНЗДРАВОМ, тем более, что лечение уже началось и ответ на это самое лечение ЕСТЬ.
Но даже если все пойдет «по плану» и Елене удастся получить требуемый Тафинлар, на это уйдет несколько месяцев, по этому вот:
Как помочь Елене Головачёвой:
тут были реквизиты
*************************
Ну что, товарищи? Мне чего теперь, вставать под знамена автора вот этого поста? Не хочу, но смотрите — получается , что человека попользовали, выжали как лимон и потом выкинули в ведро.
Я не могу сказать, можно ли быстро поднять гемоглобин и как это сделать, но мне кажется, нет ничего невозможного. Как пример: нашу знакомую не брали на химию по той же причине, но она пошла к гематологу и та ей буквально за несколько дней гемоглобин подняла (это вообще без подробностей и я естественно не знаю, можно ли было в случае Елены так поступать).
Но даже это не главное! Главное то, что ЛЕКАРСТВА ТО ЕСТЬ И ИХ МОЖНО ПОЛУЧИТЬ, а человека отправляют умирать из ведущего онкоучреждения страны! Я могу понять, когда все испробовано и вариантов ну просто нет (это случается регулярно, к сожалению), но тут то совсем другое дело.
Короче, уважаемые жители Ленинграда. Подскажите мне еще какую-нибудь стоящую больницу в вашем городке, дабы я ее у себя в верхнем меню справа добавил, потому как видимо звездить на ютубе и участвовать в конференциях — это одно, а реально лечить людей — другое.
Ну и естественно:
ПЕРЕПРОВЕРЯЙТЕ ГИСТОЛОГИЮ. ОШИБКИ ГИСТОЛОГИИ БЫЛИ ЕСТЬ И БУДУТ.
ЛЮБУЮ!
Нет у вас денег на пересмотр результатов в Израиле, черт с ним, просто сделайте это в соседней лаборатории/больнице. Получите второе мнение.
Вот если лаборатория откроется и мне в июле удастся взять интервью у патолога в Израиле , то я обязательно спрошу: как можно перепутать РМЖ с меланомой, или фибросаркому с меланомой? Неужели это все под микроскопом настолько идентично выглядит?
Не болейте!
З.Ы Я считаю, что результаты таких ошибок в гистологиях должны рассматриваться в суде. Ну это же бардак.
Не, во многих случаях пациенты сами виноваты в том, что помощь оказывается слишком поздно (это сплошь и рядом происходит), но одно дело, когда вы, обнаружив боль в животе приходите к врачу уже с перитонитом и умираете на операционном столе, и совсем другое — когда конкретный врач допускает конкретную ошибку, которая приводит к таким жутким последствиям.
И можно еще «понять и простить», когда ошибка гистолога происходит «в другую сторону», как тут: Танцы с бубном вокруг гистологии , хотя я знаю многих людей, у которых после постановки диагноза просто происходил нервный срыв, но в конце-концов от таких ошибок не умирают. Ну а в вышеописанных случаях нужно однозначно в суд идти.
ДОБАВОЧКА 15.05.2017
Уважаемые читатели, в связи с тем, что мне уже понаписали кучу писем по поводу фигурирующего в рассказе лекарства, хочу отметить следующее:
В этом посте не анализируется действие нового препарата для лечения меланомы (BCD-100). I фаза КИ не предназначена для оценки эффективности. Там другое проверяется. По этому , если у вас есть возможность попасть во II фазу, о которой говорится тут: Жить здорово, то даже не секунды не сомневайтесь!
*******************************************
Елены не стало осенью 2017г.
Пересмотр стекол
Москва,
Духовской переулок, 22Б
350015,
Краснодар,
Северная ул, 315
198035,
Санкт-Петербург,
Межевой канал, д.4, лит.А
603155,
Нижний Новгород,
Большая Печёрская ул., д.26
Обновлено: 06 июля 2022
62802
При онкологических заболеваниях материал опухоли берут для гистологического или цитологического исследования. Это необходимо для подтверждения диагноза и определения тактики дальнейшего ведения пациента.
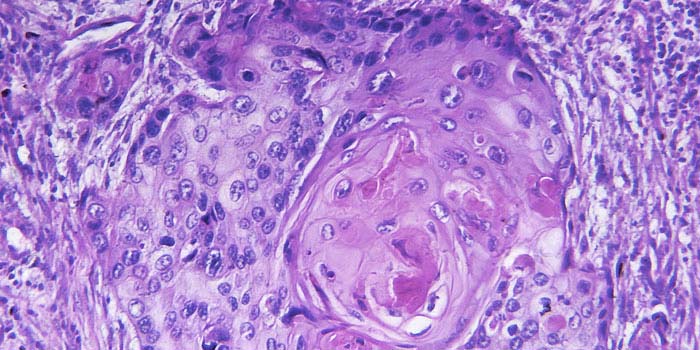
Пересмотр гистологических стекол: опухолевая ткань
Полученный во время операции или на биопсии образец ткани (или клеточный материал) специальным образом фиксируют и окрашивают, чтобы изучить под микроскопом и иммуногистохимическими методами. Последние позволяют даже определить органопринадлежность опухоли. [1]
Что такое блоки и стекла?
Эти термины обозначают ткань, полученную во время биопсии и подготовленную особым образом. В первую очередь образцы заливают раствором формалина и проводят специальную обработку. Это нужно для того, чтобы зафиксировать материал, чтобы клетки не разрушились. Затем ткани необходимо придать нужную степень плотности. Для этого ее помещают в парафин – так получаются гистологические блоки.

Гистологические блоки, образец ткани помещен в парафин
Но и такие образцы пока еще не готовы к исследованию. Ткань в блоке нельзя рассмотреть под микроскопом, потому что она не пропускает свет, а слои клеток накладываются друг на друга. Чтобы ткань стала прозрачной и доступной для изучения, блок нужно нарезать на очень тонкие слои с помощью специального инструмента – микротома. Эти тоненькие слои помещают на стекла и фиксируют – получаются гистологические стёкла. [2,3]

Гистологические стекла
Если у пациента обнаружен рак, то лаборатория обязана хранить гистологические блоки пожизненно, а если патологии не выявлено – в течение пяти лет. Гистологические стекла при диагностированном онкологическом заболевании тоже хранятся пожизненно. Если нужно выполнить пересмотр, то можно обратиться в лабораторию, где проводилось исследование, и получить оба этих вида материала. [4]
Когда и почему необходим пересмотр стекол?
Если морфологическое заключение не соответствует клинической картине опухоли, а также снимкам МРТ или КТ, то стекла отправляют на пересмотр в другое лечебное учреждение. Обычно пересмотром стекол занимаются специалисты с многолетним стажем работы и уникальным опытом диагностики редких опухолей. Дополнительный ручной пересмотр исключает возможность ошибки, связанной с использованием автоматических анализаторов.

Почему могут возникать ошибки при первичном просматривании стекол?
- неправильный забор материала, например, захвачен не весь слой эпителия, и невозможно судить о глубине поражения;
- проведена биопсия участка здоровой ткани;
- некачественная обработка материала в лаборатории;
- малое количество изученных срезов;
- недостаточная квалификация патоморфолога. [5]
Качественное микроскопическое и иммуногистохимическое исследование позволяет начать оправданное и своевременное лечение опухоли, а значит, увеличивает шансы на излечение и выживаемость пациента при онкологических заболеваниях. Оптимально, если морфологический диагноз будет подтвержден двумя специалистами.
Список литературы:
- Tatyana S. Gurina; Lary Simms. Histology, Staining. Treasure Island (FL): StatPearls Publishing; 2021 Jan-.
- В. А. Корьяк, Л. А. Николаева. Основы гистологической техники. Учебное пособие.
- Гистологическое изучение микропрепаратов тканей и органов. Гистология, эмбриология, цитология. Под ред. д.м.н., доц. Н. Ю. Матвеевой. Владивосток, Медицина ДВ, 2015.
- Приказ МЗ РФ № 179н от 24.03.2016 г. «О правилах проведения патолого-анатомических исследований».
- P. Morelli, E. Porazzi, M. Ruspini, U. Restelli, and G. Banfi. Analysis of errors in histology by root cause analysis: a pilot study. J Prev Med Hyg. 2013 Jun; 54(2): 90–96.
Первый МГМУ им. И.М. Сеченова, Москва, 119991, Российская Федерация
Мордовцева В.В.
Государственный институт усовершенствования врачей Министерства обороны РФ

Меланома кожи с явлениями регресса: описание клинического случая и обзор литературы
Авторы:
Сергеев Ю.Ю., Мордовцева В.В.
Как цитировать:
Сергеев Ю.Ю., Мордовцева В.В. Меланома кожи с явлениями регресса: описание клинического случая и обзор литературы. Клиническая дерматология и венерология.
2017;16(5):36‑41.
Sergeev IuIu, Mordovtseva VV. Skin melanoma with regression phenomena: case report and literature review. Klinicheskaya Dermatologiya i Venerologiya. 2017;16(5):36‑41. (In Russ.)
https://doi.org/10.17116/klinderma201716536-41

Клинические проявления меланомы достаточно разнообразны, что может объяснять несвоевременную диагностику данной метастазирующей опухоли. Для повышения точности диагностики меланомы предложен ряд неинвазивных методик [1], однако «золотым стандартом» диагностики считается гистологическое исследование. Существенным ограничением используемых методов является их зависимость от опыта исследователей, недостаточность которого приводит к диагностическим ошибкам. Так, точность дерматоскопического исследования зависит от прохождения специализированной подготовки [2], а расхождения при трактовке гистологических препаратов меланоцитарных новообразований встречаются среди экспертов в 1/3 случаев [3].
Признаки регресса опухоли считаются одним из гистологических критериев, свидетельствующих о меланоме [4]. Тем не менее эти признаки нередко остаются незамеченными патоморфологами, что влечет за собой отсрочку в постановке диагноза или неверное стадирование злокачественного опухолевого процесса. Приводим описание клинического случая ошибки в диагностике меланомы кожи с явлениями регресса (МсР) и обзор литературы по данной проблеме.
Пациентка Н., 49 лет, была направлена для осмотра внутридермального невуса в подмышечной области. При полном осмотре кожных покровов были выявлены явления хронического фотоповреждения в верхней трети спины, единичные клинически атипичные невусы (рис. 1). В нижней трети левого бедра было обнаружено асимметричное по форме и окрашиванию образование с неровными границами, размером 9×6 мм, в пределах которого имелся плотный экзофитный компонент (рис. 2). Проксимальнее образования определялся нормотрофический рубец 3×1 см после хирургического иссечения «родинки» в условиях онкологического диспансера. Пациентка затруднялась точно указать давность существования образования и наличие в нем какой-либо динамики, а также результаты предыдущего оперативного лечения. Семейный анамнез по злокачественным опухолям кожи не был отягощен. При дерматоскопическом осмотре (рис. 3) была выявлена асимметрия образования по структурам и цвету, участки атипичной пигментной сети по периферии образования, участки рубцово-подобной депигментации и структуры регресса в центральной части образования. В пределах папулезного компонента определялись преимущественно сосуды в виде шпилек. По результатам клинического и дерматоскопического осмотра был выставлен предварительный диагноз: меланома кожи бедра, поверхностно-распространяющаяся форма с явлениями регресса. По результатам гистологического исследования в онкологическом диспансере был поставлен диагноз: сложный меланоцитарный невус. Пересмотр гистологических препаратов подтвердил диагноз поверхностно-распространяющейся формы МсР. На момент хирургического лечения клинических и лабораторных данных, свидетельствующих о наличии метастазов, не получено. На дальнейшее динамическое наблюдение у дерматолога пациентка не возвращалась.



Под регрессом меланомы понимают спонтанное исчезновение клеток первичной опухоли. Явления частичного регресса встречаются в меланомах с частотой от 10 до 35% вне зависимости от толщины опухоли по Бреслоу, а в меланомах толщиной менее 1 мм признаки частичного регресса регистрируются достоверно чаще — до 61% [5]. Полный регресс встречается крайне редко (0,22—0,27%), но такие случаи значительно труднее документировать [6]. Регрессу чаще подвергаются опухоли, расположенные на коже туловища или нижних конечностей [7].
Клинически регресс меланомы чаще всего характеризуется появлением белых или серо-голубых пятнистых участков в пределах образования. Расположение очагов регресса по периферии может затруднить правильную интерпретацию границ образования. С течением времени папулезный компонент меланомы стадии вертикального роста может стать плоским, а опухоль полностью регрессировать. В некоторых случаях регрессу предшествует воспалительная реакция или зуд в области образования, кровотечение из образования после незначительной травмы [8].
Дерматоскопические проявления частичного регресса меланомы включают ряд признаков, наиболее известными из которых являются участки рубцово-подобной депигментации и структуры регресса. Определения употребляемых в статье дерматоскопических признаков приведены в табл. 1. Указанные признаки изредка могут встретиться и в ряде меланоцитарных невусов (рис. 4), что обусловливает сложности при проведении дифференциальной диагностики между МсР и меланоцитарными невусами с явлениями регресса (МНсР). Обязательным показанием для проведения эксцизионной биопсии является одновременное наличие структур регресса и участков рубцово-подобной депигментации в образовании или степень их выраженности более 50% (т.е. занимают более половины площади образования) [9].


Для проведения дифференциальной диагностики между МсР и МНсР была предложена клинико-дерматоскопическая шкала, учитывающая шесть дерматоскопических структур, размер образования, пол и возраст пациента (табл. 2). Пороговое значение, при котором показано удаление образования, составляет 5 баллов и более. Образования, набравшие 4 балла и менее, требуют динамического наблюдения с повторным дерматоскопическим осмотром через 6 мес. По данным P. Rubegni и соавт. [10], чувствительность метода в диагностике меланомы составляет 98%, а специфичность — 76%.

Отдельной проблемой является полностью регрессировавшая меланома (пРМ). Таких случаев на сегодняшний день описано не более 50, причем большинство из них сопровождались развитием регионарных и/или отдаленных метастазов. Средний возраст пациентов на момент обращения составлял 48 лет, несколько чаще заболевание выявляли у мужчин. Погибали через 13 мес 1/3 пациентов после диагностирования метастатической меланомы [11]. Клинически пРМ может быть представлена беспигментными очагами, напоминающими рубец; частично или полностью пигментированными очагами с различной окраской, включая оттенки красного, серого и синего цвета. При дерматоскопическом исследовании возможно обнаружение участков рубцово-подобной депигментации, структур регресса, атипичных линейно-извитых сосудов, сосудов в виде точек или глыбок, розовой вуали, остаточной пигментации коричневого или черно-серого цвета и структур по типу хризалид [8].
Гистологически регресс напоминает формирование рубцовой ткани и проявляется атрофией эпидермиса, уплощением эпидермальных отростков, фиброзом, неоангиогенезом и наличием лимфоцитарного инфильтрата с примесью меланофагов (рис. 5) [12]. По гистологическим признакам регресс меланомы можно условно разделить на три стадии: начальную, промежуточную и позднюю. Ранняя стадия характеризуется выраженной инфильтрацией опухоли лимфоцитами. Затем происходит полное или частичное разрушение клеток меланомы на всем протяжении или сегментарно, формируется фиброз различной степени выраженности и прочие выше перечисленные признаки регресса [13]. Для выявления меланоцитарной природы образования может потребоваться иммуногистохимическое исследование (окрашивание на антиген S100, Melan-A, реакция на тирозиназу) [14]. Критерии постановки диагноза пРМ (табл. 3) были предложены J. Smith и J. Stehlin [11] в 1965 г. и позднее модифицированы разными авторами.


Как показывают результаты иммуногистохимических исследований, в основе феномена спонтанного регресса лежат иммуноопосредованные механизмы. В частности, происходит активация нативного противоопухолевого иммунитета с участием цитолитических Т-лимфоцитов [15]. Некоторые авторы [16] полагают, что травма или инфекция могут усилить противоопухолевый ответ организма и вызвать регресс опухоли. Согласно другой теории, регресс первичной меланомы запускается через иммунную систему только при наличии метастазов в регионарных лимфатических узлах. Существующие теории предполагают, что клеточные компоненты врожденного иммунитета способны распознавать определенные структуры на раковых клетках и запускать процесс регресса первичной опухоли. Развитие метастатического процесса может означать ускользание клеток опухоли от иммунной системы благодаря мутациям или подавлению активности системы HLA, снижению продукции супрессивных цитокинов и другим нарушениям в противоопухолевой защите организма [17, 18].
Прогностическое значение регресса меланомы неоднозначно. По мнению R. Scolyer и соавт. [13], большинство исследователей, изучавших прогностическое значение регресса, не указывали стадию процесса, использовали разные критерии диагностики и включения пациентов в исследование. Все это затрудняет интерпретацию гистологических признаков регресса в контексте других прогностических факторов.
Однако большинство исследователей все же считают регресс отрицательным прогностическим признаком. При диагностированном полном регрессе первичной опухоли отдаленные метастазы выявляются у 4—10% больных. При наличии метастазов и полном регрессе первичной опухоли у пациентов обычно наблюдается быстрое прогрессирование болезни с летальным исходом в кратчайшие сроки. «Тонкие» меланомы при наличии в них значительного регресса (50% и более) также сопровождаются повышенным риском метастазирования на момент диагностики. Высказываются мнения о двух возможных причинах такого феномена. Первое — ошибка диагностики, связанная с неправильным определением толщины меланомы по Бреслоу (заниженное значение), и, как следствие, — с неверным стадированием опухолевого процесса. Второе — изначально неблагоприятный биологический потенциал опухоли, который ассоциирован со спонтанным регрессом [6].
Проблема «тонких» меланом с признаками регресса состоит еще и в том, что при них наблюдается довольно высокий процент ложноотрицательных результатов биопсии «сторожевого» лимфатического узла: т. е. на момент исследования поражение «сторожевого» узла отсутствует, а в дальнейшем развивается метастатический процесс. J. Rubinstein и соавт. [18] изучали прогностическую значимость локальных метастазов в случаях «тонких» меланом (с толщиной менее 1 мм) в одном учреждении на протяжении 15 лет. За это время биопсия «сторожевых» лимфатических узлов была проведена 252 пациентам. В исследование включались как пациенты с выявленными метастазами, так и пациенты с ложно-отрицательными результатами. Предпринималась попытка сопоставить гистологические изменения с поражением лимфоузлов и клиническим течением болезни. В среднем наблюдение за пациентами продолжалось в течение 45,5 мес. Метастазы в регионарных лимфатических узлах наблюдались у 12 (4,8%) пациентов, причем у 6 (2,4%) больных отсроченные метастазы развились в среднем через 37,5 мес после постановки диагноза. Гистологические признаки регресса не коррелировали с наличием метастазов, однако были предикторами ложноотрицательных результатов биопсии «сторожевых» лимфатических узлов. У пациентов с отсроченными метастазами гистологические признаки регресса первичной опухоли отмечались в 60% случаев, в то время как у пациентов с наличием положительного «сторожевого» узла — только в 16%.
Таким образом, отсутствие метастазов в «сторожевом» узле на момент удаления первичной опухоли с признаками регресса, независимо от ее толщины, не исключает возможность дальнейшего прогрессирования болезни. Пациентам с гистологическими признаками регресса меланомы возможно требуется более активное динамическое наблюдение с целью раннего выявления поражения регионарных лимфатических узлов. Низкая приверженность пациентов к динамическому наблюдению за новообразованиями кожи может служить препятствием в выявлении ранних симптомов прогрессирования заболевания [19].
Мордовцева В.В. — http://orcid.org/0000−0002−6396−2720
Сергеев Ю.Ю. — http://orcid.org/0000−0002−4193−1579
Авторы заявляют об отсутствии конфликта интересов.
