Выскабливание матки – хирургическая процедура, которая проводится в диагностических или лечебных целях. Ее назначают для изучения эндометрия, а также выполнения гистологического исследования. Последующая гистология позволяет определить функционирование слизистой оболочки матки.

- Особенности гистологических исследований
- Показания к выскабливанию матки с последующей гистологией
- Подготовка к выскабливанию
- Проведение гистологии
- Результаты
- Возможные осложнения
Особенности гистологических исследований
Гистология – один из наиболее эффективных методов диагностики гинекологических заболеваний. С помощью такой процедуры можно выявить онкологические процессы на ранних стадиях, а также предраковые состояния.
Материал для гистологического исследования получают путем раздельного выскабливания полости матки и стенок шеечного канала, иногда – путем выполнения аспирационной биопсии.
Раздельное выскабливание матки представляет собой процедуру соскабливания внутреннего поверхностного эпителия органа и цервикального канала. Полученный материал направляют на гистологию.
Раздельное выскабливание проводят не только в диагностических целях: при его проведении можно удалить полип или остановить кровотечение.

Показания к выскабливанию матки с последующей гистологией
Процедура проводится при наличии таких показаний:
- полипы и другие новообразования на слизистой оболочке матки;
- чрезмерное утолщение эндометрия;
- маточные кровотечения, в том числе – слишком продолжительные менструации с обильными выделениями;
- невозможность зачать ребенка;
- угроза развития злокачественных новообразований (например, при плохом семейном анамнезе);
- злокачественные новообразования матки или шейки матки (либо подозрение на них);
- частое наступление внематочных беременностей.
Гистология после выскабливания может быть назначена для уточнения информации, полученной при проведении УЗИ, а также перед плановыми операциями на органах репродуктивной системы. Также ее проводят перед началом лечения злокачественных новообразований матки или шейки матки.

Подготовка к выскабливанию
Пациенткам, которым назначают диагностическое выскабливание для получения гистологического материала, назначают несколько исследований. Это:
- общий осмотр и консультация гинеколога;
- общий анализ крови;
- оценка свертывающей способности крови;
- анализы на вирус гепатита В и С, сифилис и ВИЧ;
- ЭКГ;
- мазок из влагалища.
За 2 недели до назначенной процедуры нужно прекратить прием любых лекарственных препаратов (предварительно необходимо проконсультироваться с врачом.
За 2–3 дня до назначенной процедуры нужно:
- отказаться от половых контактов;
- прекратить выполнение спринцеваний;
- отказаться от использования гигиенических тампонов;
- осуществлять интимную гигиену без использования мыла, геля и других средств;
- прекратить использование вагинальных свечей.
За 8–12 часов до начала процедуры нужно отказаться от приема пищи.

Проведение гистологии
Для получения достоверного результата гистологию материала из матки проводят в несколько этапов, строго соблюдая порядок действий. Процедура состоит из таких частей:
- Фиксация полученного материала. Соскобленные частицы погружают в химический раствор, чтобы не допустить разрушения тканей.
- Промывка материала от избыточного количества раствора.
- Обезвоживание. Полученную ткань постепенно проводят через растворы спирта, повышая концентрацию.
- Заливка. Полученные ткани перемещают в смесь, состоящую из смеси воска с парафином. Далее нужно дождаться полного затвердевания смеси.
- Подготовка срезов. Специальным острым ножом блоки затвердевшего парафина разрезают на отдельные срезы, толщина которых не превышает нескольких микрометров.
- Окрашивание. С частиц удаляют остатки парафина и окрашивают реактивами и красками, подобранными специально для каждого вида ткани.
На завершающем этапе окрашенные срезы снова промывают, обезвоживают и просветляют. После этого на предметное стекло со срезом кладут специальный препарат, накрывают предметным стеклом и передают на исследование гистологу.
На основе изучения представленного материала делают его макро- и микроскопическое описание и составляют заключение.
Описанная методика является плановой и выполняется в течение 5–11 дней. Если ответ нужно получить быстрее, исследуемый материал замораживают, затем делают срезы и изучают их под микроскопом. В этом случае гистологическое исследование занимает 45 минут.
Результаты
По результатам проведенной гистологии определяют доброкачественные и злокачественные новообразования матки.
К доброкачественным относятся:
- Миомы и фибромиомы. Они редко озлокачествляются, но могут достигать больших размеров и провоцировать обширные кровотечения.
- Полипы. Наросты на матке часто вызывают боли и кровотечения. Если они расположены на участках выхода маточных труб, то могут стать причиной бесплодия.
- Кисты эндометрия. Новообразования не склонны к перерождению в рак, но, в случае множественного образования, способны стать причиной бесплодия.
- Диффузная гиперплазия. Такое явление характеризуется утолщением эндометрия по всей площади и может стать причиной кровотечений.
- Аденоматозные полипы. Чаще всего такие новообразования формируются у женщин в период климакса. Они склонны к перерождению в раковую опухоль.
- Очаговая гиперплазия. Эндометрий уплотнен на некоторых участках, а не по всей площади, как при диффузной форме. Внешне такое образование напоминает опухоль. Есть высокий риск перерождения в рак.
Также по результатам процедуры могут быть выявлены признаки злокачественных новообразований. Это:
- Аденокарцинома. Это самая распространенная раковая опухоль матки. При такой опухоли клетки могут в большей или меньшей степени отличаться от здоровых. От степени дифференциации зависит выживаемость.
- Светлоклеточный рак. Такое новообразование чаще диагностируют в пожилом возрасте. В случае раннего обнаружения прогноз благоприятный. В остальных случаях выживаемость снижается из-за частых рецидивов.
- Саркомы матки. Опухоли имеют крайне неблагоприятный прогноз. Они быстро дают метастазы в легкие и брюшную полость.

Возможные осложнения
В случае ошибок, допущенных при проведении выскабливания матки для получения материала на гистологию, могут возникнуть такие осложнения, как:
- перфорация матки;
- надрыв шейки матки;
- скопление крови в полости матки;
- повреждение слизистой оболочки (при избыточном выскабливании).
Чтобы снизить риск осложнений, нужно на протяжении двух недель после выскабливания не заниматься сексом, проводить тепловые процедуры (посещение бани и сауны, прием горячей ванны), заниматься спортом и подвергаться повышенным физическим нагрузкам.
Зачем нужно проводить такое исследование?
Гистологическое исследование (ГИ) — это изучение под микроскопом образцов тканей, полученных при биопсии или во время операции.
ГИ необходимо при подозрении на злокачественное новообразование шейки матки. Без гистологического подтверждения поставить диагноз “рак” невозможно. Врач-патологоанатом изучает характеристики биопсийного материала (структуру измененных клеток, их расположение, тип роста), факторы риска (лимфоваскулярная инвазия), и формулирует гистологический диагноз. В гистологическом заключении излагается информация о типе опухоли (плоскоклеточный рак/аденокарцинома или другие, редкие варианты), ВПЧ-статусе, степени дифференцировки (когда она имеет значение), стадии заболевания. После морфологического подтверждения рака шейки матки строится тактика лечения пациентки.
Патоморфологическое исследование операционного материала необходимо для:
- оценки радикальности выполненной операции,
- уточнения стадии,
- определения факторов неблагоприятного прогноза.
В случае проведения предоперационного (неоадъювантного) лечения в гистологическом заключении отразят степень патоморфологического ответа (выраженность эффекта противоопухолевой терапии). Эта информация важна для выбора дальнейшей тактики лечения.
На что нужно обратить внимание в заключении?
На основании результатов ГИ и объективных методов диагностики врач формулирует клинический диагноз и составляет план лечения. Основные пункты гистологического заключения:
- гистологический тип опухоли с ВПЧ статусом,
- размер опухоли,
- глубина инвазии опухоли,
- толщина шейки матки в месте наибольшего прорастания опухоли (инвазии),
- распространение на влагалище, параметрий,
- опухолевые эмболы в кровеносных и/или лимфатических сосудах.
Все это позволяет судить о стадии опухолевого процесса.
При исследовании послеоперационного материала в заключении есть дополнительные пункты:
- лимфоваскулярная инвазия, когда раковые клетки обнаружены в кровеносном или лимфатическом сосуде (один из основных факторов риска рецидива для раннего рака шейки матки;
- переход опухоли на тело матки;
- край резекции (позитивный край — раковые клетки обнаруживаются в краях иссеченных тканей, это фактор риска локального рецидива РШМ);
- общее число удаленных и пораженных лимфоузлов, если их удаляли во время операции;
- метастатическое поражение яичников, маточных труб;
- прорастание опухоли в стенку мочевого пузыря, прямой кишки;
- степень патоморфологического ответа первичной опухоли и метастатически пораженных лимфоузлов в случае предоперационного лечения.
Гистологическое заключение по послеоперационному материалу влияет на выбор дальнейшего лечения. Необходимость адъювантной (послеоперационной) терапии (химиотерапия и/или лучевая терапия) определяется наличием факторов риска, таких как большой размер опухоли (более 4 см), глубокая инвазия, обнаружение раковых клеток в кровеносном и/или лимфатическом сосуде, прорастание опухоли в соседние органы. Адъювантная терапия может снижать риск рецидива.
Что делать, если результат долго не приходит?
Согласно законодательству, на выполнение гистологического исследования выделяется не более 15 рабочих дней со дня поступления материала в патологоанатомическое отделение (ПАО). Срок выполнения зависит от необходимости дополнительных окрасок, изготовления парафиновых срезов, иммуногистохимических, молекулярно-биологических, генетических исследований. Если ожидание результатов превышает 2 недели, следует связаться с лечащим врачом-онкологом. Одной из причин задержки может быть сомнительный результат (при недостаточном количестве и/или плохом качестве забранного материала), что требует дополнительных методов исследования для постановки окончательного диагноза. К сожалению, при получении сомнительного результата гистологии иногда необходима повторная биопсия.
С кем обсудить результат исследования?
Полученные заключения нужно обсудить с лечащим врачом-онкологом. Он поможет понять терминологию и обозначения стадии (TNM классификация), ответит на вопросы.
Важность гистологического заключения трудно переоценить, на кону выбор лечения и исход заболевания. Распространенной практикой стало получение второго мнения, в частности, пересмотр гистологического материала в патоморфологической лаборатории, например в медицинских учреждениях федерального уровня или за рубежом, что снижает риск ложноположительных результатов. В более оснащенной лаборатории могут быть выполнены дополнительные тесты для уточнения клинического диагноза и выбора максимально эффективного лечения.
Выводы
- Без гистологического исследования нельзя поставить диагноз “рак”.
- Исходя из морфологических характеристик опухоли устанавливается стадия онкопроцесса.
- План лечения основывается на результатах гистологического исследования.
- Результаты исследования в первую очередь обсуждаются с лечащим врачом.
Что еще почитать?
- Методические рекомендации от Европейского Общества Патологов — РШМ (на английском языке).
- Cervical cancer basics (NCCN guidelines for patients) (на английском языке).
ЛЕКЦИИ ф
Новости клинической цитологии Russian News of Clinical Cytology
2020, т.24, №1, с. 17-22 2020, vol.24, no 1, pp.17-22
https://doi.org/10.24411/1562-4943-2020-10103
ОШИБКИ ЦИТОЛОГИЧЕСКОМ ДИАГНОСТИКИ ЗАБОЛЕВАНИИ ШЕЙКИ МАТКИ
Н.Н. Волченко, О.В. Борисова
МНИОИ им. ПА. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России, Москва, Россия.
Резюме: в данной статье авторы анализируют наиболее распространенные ошибки интерпретации цитологической картины мазков с шейки матки, приводящие к гипо- и гипердиагностике. Отражены диагностические проблемы, приводящие к ошибочным цитологическим заключениям и возможные пути их решения. Особое внимание уделено доброкачественным поражениям, которые имитируют предрак и рак шейки матки: незрелая плоскоклеточная метаплазия, герпес, микрогландулярная гиперплазия, и на-ооборот, поражения, которые наиболее часто недооцениваются цитологом: дисплазия на фоне атрофии, эндоцервикальная аденокарцинома, рак на фоне постлучевых изменений.
Ключевые слова: шейка матки, ошибки, цитологическое исследование.
Информация об авторе:
Волченко Н.Н. — док-р.мед.наук, проф., заведующая отделом онкоморфологии МНИОИ имени П.А. Герцена филиала ФГБУ «Национальный медицинский центр радиологии» МЗ РФ,
https://orcid.org/0000-0003-0421-4172 Борисова О. В. — канд.мед.наук., с.н.с. отделения онкоци-тологии МНИОИ имени П.А. Герцена филиала ФГБУ «Национальный медицинский центр радиологии» МЗ РФ, https://orcid.org/0000-0001 -5160-3168
Автор, ответственный за переписку: Борисова Олеся Владимировна — канд.мед.наук., с.н.с. отделения онкоцитологии МНИОИ им. П.А. Герцена e-mail: borisova07@bk.ru
Как цитировать:
Волченко Н.Н., Борисова О. В. Ошибки цитологической диагностики заболеваний шейки матки. Новости клинической цитологии России. 2020;24(1 ):17-22. https:// doi.org/10.24411 /1562-4943-2020-10103
К ошибкам цитологической диагностики относят расхождения цитологических и гистологических данных об опухолевой или неопухолевой природе поражения, злокачественности или до-
брокачественности процесса, ошибки в определении гистологической формы опухоли. Критерием достоверности цитологических заключений служат данные гистологического исследования операционного или биопсийного материала, а также ближайшие и отдаленные результаты лечения больных.
Анализ цитологических ошибок в зависимости от причин их вызывающих показал, что ошибки могут быть систематизированы по трем основным группам: объективные, субъективные и технические. Объективные ошибки обусловены особенностями строения опухоли, отсутствием четких признаков злокачественности и гистогенетической принадлежности опухоли, степени дифференци-ровки, четких дифференциально-диагностических критериев. Субъективные ошибки вызваны недостаточной профессиональной подготовкой, отсутствием клинических данных, неправильной трактовкой врачом-клиницистом морфологических заключений, неиспользование или неправильное использование современных методов уточняющей диагностики, а также проведение исследования на неадекватном материале. Ошибки по техническим причинам обуславливаются нарушением процессов получения и обработки материала. Все эти факторы могут привести к гипо- и гипердиагностике опухолевого процесса [1].
Неадекватное взятие материала с шейки матки для цитологического исследования является причиной 2/3 ложнонегативных результатов (аномальный эпителий не попадает в препарат). Наша статья посвящена ошибкам интерпретации цитологической картины, которые обусловлены неправильной оценкой цитологом имеющихся морфологических изменений, и хотя составляют они 1/3 от всех ошибок, их анализ наиболее важен для цитолога.
Большое значение на морфологическую трактовку влияет правильно оформленное направление с указанием возраста, фазы менструального цикла, анамнеза, клинических данных, данных визуального осмотра шейки матки, позволяющее цитологу сопоставить клинические данные с морфологическими.
Залогом адекватной оценки является получение информативного материала. Необходимо внимательно и не торопясь просматривать весь препарат, так как единичные патологические комплексы могут быть пропущены цитологом.
Цель данного исследования — улучшить цитологическую диагностику заболеваний шейки матки путем анализа, наиболее часто встречающихся цитологических ошибок.
Реактивные изменения плоского эпителия
Реактивные изменения плоского эпителия представляют наибольшие трудности при дифференциальной диагностики с дисплазией и раком и развиваются как реакция на какой-то патологический процесс — воспаление, наличие инфекции, гормональные процессы, после различных инструментальных манипуляций на шейки матки.
Наиболее частые диагностические ошибки между CIN и неопухолевыми морфологическими изменениями шейки матки:
незрелая плоскоклеточная метаплазия (реактивная атипия, репаративные изменения); атрофия плоского эпителия; герпетическая инфекция.
Незрелая плоскоклеточная метаплазия
Незрелая плоскоклеточная метаплазия, реактивная атипия и репаративные процессы — это морфологически сходные изменения клеток, связанные с регенеративными изменениями при эктопии, когда происходит пролиферация и диффе-ренцировка резервных клеток в плоский эпителий, заменяющий эктопированный эндоцервикальный железистый эпителий. Этот процесс незрелой плоскоклеточной метаплазии может сопровождаться выраженными реактивными изменениями вплоть до атипии в виде укрупнения и гиперхромии ядер, появления крупных нуклеол, нарушения полярности клеточного пласта, что можно ошибочно принять за CIN3 [2] (таблица 1) (вклейка 8, рис.1,2).
Все морфологические цитологические критерии дифференциальной диагностики между незрелой плоскоклеточной метаплазией и CIN3 достаточно относительны, и цитологически однозначно решить вопрос о характере процесса крайне сложно. Достаточно часто имеет место дисплазия мета-
плазированного эпителия, так как ВПЧ для внедрения и репликации использует чаще всего процессы метаплазии (зону трансформации), которую сложно дифференцировать также с незрелой плоскоклеточной метаплазией (вклейка 8, рис. 3). Кроме того, выделяют папиллярную незрелую метаплазию, чаще связанную с ВПЧ низкого риска (типы 6, 11 или 42), реже с ВПЧ высокого риска (16, 16/18 и 33 типы) и, возможна, смешанная ВПЧ инфекция (6/16 и 11/58 типов). Гистологически папиллярная незрелая метаплазия образует либо папиллярные структуры, либо слегка приподнятую плоскую бляшку. Койлоцитоз выявляется в более половине случаев. Папиллярная незрелая метаплазия представляет собой отдельную подгруппу LSIL, демонстрирующую продуктивную ВПЧ-инфекцию. Во всех этих случаях в настоящее время рекомендовано применять ИЦХ исследование с белком р16(ШК4а) (возможно, совместно с белком Ki67 (набор CINtek plus)), который является суррогатным биомаркером HSIL (CIN 2-3). Иммуноморфо-логическое исследование с белком p16(INK4a) является вспомогательным методом позволяющим дифференцировать атипическую реактивную незрелую плоскоклеточную метаплазию от CIN и папиллярной незрелой плоскоклеточной метаплазии, связанной с ВПЧ высокого канцерогенного риска [3,4] (вклейка 8, рис. 4).
Атрофия плоского эпителия
Около 30% случаев рака шейки матки (РШМ) встречаются у женщин старше 60 лет, а уровень смертности составляет около 70% в этой возрастной группе из-за поздней диагностики. Тестирование на ВПЧ показывает более высокую чувствительность и специфичность при выявлении CIN у пожилых женщин, тогда как при цитологическом исследовании чрезвычайно низкая чувствительность (около13-30%). Это, в первую очередь, связано с тем, что у женщин в постменопаузе из-за гормональных изменений зона трансформации, где развиваются предраковые поражения, находится высоко в цервикальном канале и поэтому недоступна для надлежащего обследования и получения адекватного материала для цитологического исследования [5]. Но так же, по нашим данным, имеет место гиподиагностика CIN3 плоского эпителия на фоне атрофии.
Таблица 1
Дифференциальная диагностика незрелой плоскоклеточной метаплазии и CIN3
Незрелая плоскоклеточная метаплазия ^N3 плоского эпителия
Клетки парабазального типа с повышенным ядерно-ци-топлазматическим соотношением Клетки парабазального типа с резко нарушенным ядерно-цитоплазматическим соотношением
Гиперхромия ядер выражена слабо или умеренно Резко выражена гиперхромия ядер
Полиморфизм ядер отсутствует или умеренно выражен Выражен полиморфизм и атипия ядер
Митозы редкие в базальных слоях эпителия, отсутствуют патологические митозы Митозы на разных уровнях эпителиального пласта, патологические митозы
Сохраняется полярность клеток Потеря полярности клеток
Таблица 2
Дифференциальная диагностика атрофии плоского эпителия и ^N3 на фоне атрофии
Атрофия плоского эпителия ОК3 плоского эпителия на фоне атрофии
Более или менее однородная цитологическая картина из клеток глубоких слоев плоского эпителия, расположенных в скоплениях и разрозненно Появление на фоне однородной цитологической картины атрофии плотных скоплений из гиперхромных клеток
Возможно наличие «голых ядер» клеток, иногда гигантских с признаками атипии, но без гиперхромии Наличие отдельно лежащих не гиперхромных «голых ядер» не характерно
Скопления из клеток недостаточно плотные Плотные скопления, ядра наползают друг на друга
Сохраняется относительная полярность ядер в скоплениях Ядра в скоплениях неорганизованы, расположенны в различных направлениях
Клетки среднего размера, гиперхромия в клетках не-выражена, контур ядер ровный Клетки могут быть различного размера от мелких до крупных, гиперхромные, контур ядер может быть неровный
Хроматин однородный, ядрышки могут быть при реактивных изменениях Хроматин тяжистый, неоднородный, грубый; полиморфизм ядер от слабого до выраженного; могут быть ядрышки
Клетки чаще округлой формы Клетки могут быть округлой формы, на отдельных участках вытянутой формы
Атрофия плоского эпителия — это чаще физиологический процесс, сопровождающийся нарушением созревания клеток в эпителиальном пласте и преобладанием клеток глубоких слоев плоского эпителия. Дисплазия плоского эпителия — это патологический процесс, при котором нарушается стратификация клеточного пласта (созревание клеток) вследствие потери способности клеток к дифференцировки с одновременной атипией ядер. Часто при атрофии плоского эпителия может быть реактивная атипия, которую сложно дифференцировать с дисплазией (вклейка 9, рис. 5). С другой стороны, цитолог может пропустить дисплазию плоского эпителия на фоне атрофии. Для CIN3 на фоне атрофии характерно появление плотных комплексов из крупных или мелких клеток с ги-перхромией ядер, ядра в комплексах наползают друг на друга, характерен полиморфизм клеток и ядер, хроматин неоднородный тяжистый, нарушение структурированности клеток в скоплениях (таблица 2) (вклейка 9, рис. 6,7,8).
Диффренциальная диагностика атрофии с реактивной атипией эпителия от CIN3 на основании только морфологического исследования в некоторых случаях достаточно сложная задача, поэтому рекомендуется также иммуноморфологическое исследование с белком рЩШЕ^) или набором CINtek plus.
Герпетическая инфекция шейки матки
Генитальный герпес является относительно распространенной инфекцией, вызываемой вирусом простого герпеса 1 и 2 типов. В последнее время наблюдается рост числа инфекций, вызванных вирусом простого герпеса 1 типа. Большинство новых случаев генитального герпеса не диагностируются, так как клинические симптомы кра-тковременны или во многих случаях заболевание протекает бессимптомно. В острый период герпе-
тической инфекции (2-3 недели) на шейки матки, влагалище или вульве может быть язва, клинически имитирующая рак [6]. Если в этот период взять мазки, то цитологическую картину при незнании морфологических критериев герпетической инфекции также можно принять за рак. Наблюдается резкое увеличение размеров клеток и ядер в отдельных клетках плоского, эндоцервикально-го и метапластического эпителия, характерной чертой является наличие многоядерных клеток с большим количеством «плотно упакованных» крупных, иногда гигантских ядер с выраженными признаками гиперхромиии и полиморфизма, просматриваются крупные нуклеолы. Цитологические признаки атипии могут быть выражены резче, чем при раке (вклейка 10, рис. 9).
Предраковые поражения шейки матки
Главной целью цитологического исследования мазков шейки матки является выявление диспла-зии и рака шейки матки (РШМ). Дисплазия I и II степени диагностируются, как правило, всегда без особых проблем. Имеет место небольшая гипердиагностика ВПЧ-инфекции и легкой дисплазии вследствие реактивных или гормональных изменений клеток плоского эпителия в виде укрупнения ядер. Для избежания гипердиагностики ВПЧ-инфекции необходимо внимательно просматривать цитологические препараты с целью выявления истинных койлоцитов.
В настоящее время гинекологическая практика сталкивается с проблемами, связанными с двусмысленной интерпретацией ASC-US. С момента своего появления в 1988 году, ASC-US является проблематичным и спорным диагнозом. Заключение ASC-US может быть вызвано качеством мазка и его интерпретацией. Тестирование на ВПЧ, коль-поскопия и биопсия рекомендуется для лечения
пациентов с цитологическим заключением ASC-US (вклейка 10, рис.10). Доказано, что при цитологическом заключении ASC-US HSIL при гистологическом исследовании выявляется от 10% до 20% наблюдений, инвазивный рак — 0,1% [7,8]. Поэтому в классификацию Bethesda введена категория ASC-H (атипичные клетки плоского эпителия, не исключающие тяжелое плоскоклеточное внутри-эпителиальное поражение). При цитологическом заключении ASC-H, ASC-US или AGC(NOS) рекомендовано иммуноцитохимическое исследование с белком р16(ШК4а).
Наиболее часты ошибки определения степени дисплазии шейки матки. Более чем у 2/3 больных с CIN и микроинвазивным раком одновременно присутствуют эпителиальные повреждения разной степени в разном сочетании от CIN 1-2 до микроинвазивного рака, что отражает процесс канцерогенеза, свидетельствуя о прогрессии неопластического процесса в результате появления все новых очагов неоплазии от эпителиальных клонов с нарастающими генетическими повреждениями. В связи с этим разделение предрака шейки матки на 3 степени CIN условно и необходимо для воспроизведения диагноза, который должен устанавливаться по максимальной степени повреждений [8]. Поэтому CIN3 при цитологическом исследовании зависит от появления в цитологических препаратах даже единичных комплексов глубоких слоев плоского эпителия с признаками атипии, а не от количества и степени полиморфизма клеточных элементов.
РШМ
Плоскоклеточный РШМ хорошо диагностируется цитологически. Наибольшие проблемы возникают при высокодифферецированном плоскоклеточном раке, особенно веррукозном, когда ядра мелкие, фактически пикнотичные, без выраженных признаков полиморфизма, но необходимо обращать внимание на ороговение цитоплазмы, наличие ороговения сразу должно настораживать в отношении плоскоклеточного рака (вклейка 10, рис. 11). Цитологически можно пропустить малодифференцированный плоскоклеточный рак из мелких клеток, которые можно принять за глубокие слои плоского эпителия, особенно на фоне атрофии. Появление «грязного» фона, некроза, разрушенных клеток, относительно более выраженный полиморфизм и гиперхромия клеточных элементов, свидетельствуют в пользу инвазивного рака (вклейка 10-11, рис.12,13).
Аденокарцинома шейки матки
В развитых странах заболеваемость плоскоклеточным раком шейки матки снижается, тогда как доля аденокарцином растет, особенно среди молодых женщин, и составляет 7-17%. Диагностика аденокарциномы шейки матки, особенно ранняя, представляет серьезную проблему. Цитологическое исследование имеет ограниченные
возможности в диагностике аденокрацином шейки матки: поражения желез, часто расположены в цервикальном канале, более трудны для получения адекватного материала для цитологического исследования, предраковые поражения желез и аденокарциному эндоцервикального типа сложно обнаружить цитологически, потому что атипия может быть слабо выражена или отсутствовать (вклейка 11, рис. 14,15), также отсутствуют четкие критерии для обоснования кольпоскопическо-го подозрения на предраковое поражение желез [9]. Часто процесс расположен глубоко в криптах, а слизистая практически не изменена. Чувствительность цитологического метода в диагностики цер-викальных аденокарцином составляет около 60%, необходимо отметить, что чувствительность ВПЧ-тестирования при аденокарциномах также составляет 60-85%, так как высока доля ВПЧ-негативных аденокарцином шейки матки [10]. Цервикаль-ные аденокарциномы охватывают разнообразную группу опухолей с несколькими различными гистологическими типами, которые включают эн-доцервикальную, эндометриоидную, кишечную, аденоплоскоклеточную, виллогландулярную, пер-стневидноклеточную, серозную, мезонефральную, муцинозную и желудочного типа. Эндоцервикаль-ная аденокарцинома характеризуется наличием в глубоких слоях эндоцервикса многочисленных желез, которые существенно различаются по форме и размерам, могут быть выстланы клетками в один слой, иногда без признаков атипии. Часто опухоль прорастает глубоко в шейку матки и распространяется по криптам вверх по стенке цервикального канала, затрудняя постановку диагноза.
Дифференциальная диагностика аденокарци-ном шейки матки включает:
1. реактивные изменения при эндоцервиците;
2. трубная метаплазия;
3. эндометриоз эндоцервикса;
4. микрогландулярная гиперплазия;
5. атипия желез, обусловленная действием инфекционных агентов, радиации, лекарств и гормонов.
Наиболее часто аденокарциному шейки матки необходимо дифференцировать с микроглан-дулярной гиперплазией. Микрогландулярная гиперплазия — это поражение слизистой оболочки шейки матки характеризующееся пролиферацией цилиндрического эпителия, иногда с образованием сосочковоподобных структур, часто связанно с употреблением противозачаточных средств или беременностью (таблица 3) (вклейка 11, рис. 16).
При любом цитологическом подозрении на патологию железистого эпителия рекомендуется использовать термин AGS(NOC) по классификации Бетесда для более углубленного обследования цер-викального канала.
При низкодифференцированных раках возможна ошибка в определении гистологической формы между плоскоклеточным и железистым раком, так как теряются специфические признаки принадлежности к той ткани, из которой возникла
Таблица 4
Дифференциальная диагностика между лучевым патоморфозом и постлучевыми изменениями
Таблица 3
Дифференциальная диагностика микрогландулярной гипреплазии и эндоцервикальной аденокарциномы
Микрогландулярная гиперплазия Эндоцервикальная аденокарцинома
Многочисленные мелкие плотно упакованные железы, иногда без просвета. В просвете желез часто обнаруживаются нейтрофилы Округлые или овальные железы со слабой продукцией муцина
Железы выстланы уплощенным кубическим эпителием Эпителий напоминает цервикальный с псевдостратификацией
Цитоплазма зернистая, содержит перинуклеарные вакуоли Цитоплазма эозинофильная
Ядра однообразные нежные пузырьковидные с единичными ядрышками Ядра укрупненные, вытянутые, гиперхромные, с заметными ядрышками и апоптотическими тельцами
Митозы редкие или отсутствуют Характерны поверхностные «всплывающие» митозы
Рецидив рака на фоне постлучевых изменений Постлучевые изменения в неопухолевых клетках
Гигантские клетки с уродливыми гиперхромными ядрами Могут быть гигантские клетки с уродливыми гиперхромными ядрами
Увеличение размеров клеток и ядер Клетки и ядра могут быть крупнее, чем в раке
Гиперхромия ядер более выражена Гиперхромия ядер менее выражена
В некоторых клетках сохраняется плотный гиперх-ромный грубый хроматин, присутствуют крупные нуклеолы Характерна разряженная деконденсированная структура хроматина, фрагментация ядер, крупные нуклеолы
Цитоплазма более плотная, сохраняются признаки ороговения Цитоплазма клеток похожа на метаплазированный эпителий, как правило, обильная с дегенеративно-дистрофическими изменениями
опухоль (вклейка 12, рис. 17). Определение гистологической формы является важным, так как аденокарцинома обладает более неблагоприятным прогнозом и тактика хирургического лечения даже при небольшом очаге поражения более агрессивна (как правило, экстирпация матки с придатками, лимфаденэктомия и резекция большого сальника), при плоскоклеточном раке при небольших очагах поражения иногда возможно органосохраняющее лечение.
Цитологически в некоторых наблюдениях крайне сложно дифференцировать лечебный па-томорфоз опухолевых клеток от постлучевых изменений в неопухолевых клетках и решить вопрос о наличии или отсутствии рецидива заболевания. К основным цитоморфологическим признакам лучевых повреждений опухолевых и неопухолевых клеток относятся: гигантсткие клетки с уродливыми гиперхромными ядрами, увеличение размеров клеток и ядер, гиперхромия, могут быть выражены ядрышки, встречается фрагментация ядер, многоядерность, дистрофические изменения в виде вакуолизации, лизис и пикноз ядер, некроз, разрастание соединительной ткани, снижение митотической активности, увеличение числа патологических митозов, отложение в зоне опухоли рогового вещества, солей извести, кристаллов холестерина, скопление макрофагальных и лим-
фоидно-гистиоцитарных клеток. При постлучевых изменениях цитологическая картина может быть более «страшная», чем при рецидиве заболевания (вклейка 12, рис. 18). О резистентности опухоли к проводимой терапии или рецидиве заболевания свидетельствует появление на фоне вышеописанных изменений опухолевых клеток или скоплений из клеток с плотным гиперхромным грубым хроматином как до начала лечения (таблица 4) (вклейка 12, рис. 19,20).
Заключение
Морфологическая диагностика доброкачественных, предопухолевых и злокачественных процессов шейки матки многогранна и трудна. С целью снижения диагностических цитологических ошибок необходимо разрабатывать наиболее информативные дифференциально-диагностические морфологические критерии определенных нозологических форм с использованием современных морфологических классификаций, применением высокотехнологичных методов уточняющей диагностики, а также повышение квалификации врачей-морфологов.
Авторы заявляют об отсутствии конфликта интересов.
Литература/References
1. Чиссов В.И., Трахтенберг А.Х. Ошибки в клинической онкологии. М.: Медицина; 2001. [Chissov V.I., Trakhtenberg A.Kh. Errors in clinical oncology. M.: Medicine; 2001 (In Russ.).]
2. Sazonova Vlu., Fedorova V.E., Danilova N.V. Algorithm for the differential diagnosis of precancerous and regenerative changes in the cervix uteri. Arkh. Patol. 2013 Jan-Feb;75(1):46-51.
3. Skapa P., Robova H., Rob L., Zamecnik J. p16(INK4a) immunoprofiles of squamous lesions of the uterine cervix-implications for the reclassification of atypical immature squamous metaplasia. Pathol. Oncol. Res. 2013 0ct;19(4):707-14. https://doi.org/10.1007/s12253-013-9633-1.
4. Hong S.A., Yoo S.H., Choi J., Robboy S.J., Kim K.R. A Review and Update on Papillary Immature Metaplasia of the Uterine Cervix: A Distinct Subset of Low-Grade Squamous Intraepithelial Lesion, Proposing a Possible Cell of Origin. Arch. Pathol. Lab., Med. 2018 Aug;142(8):973-981. https://doi.org/ 10.5858/ arpa.2017-0267-OA.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
5. Hermansson R.S., Olovsson M., Hoxell E., Lindstrom A.K. HPV prevalence and HPV-related dysplasia in elderly women. PLoS One. 2018. Jan 10;13(1):e0189300. https://doi.org/10.1371/journal.pone.0189300.
6. Garland S.M., Steben M. Genital herpes. Best Pract. Res. Clin. Obstet Gynaecol. 2014 Oct;28(7):1098-110. https://doi.org/10.1016/j.bpobgyn.2014.07.015.
7. Saslow D., Solomon D., Lawson H.W., Killackey M., Kulasingam S.L., Cain J. et al. American Cancer Society, American Society for Colposcopy and Cervical Pathology, and American Society for Clinical Pathology screening guidelines for the prevention and
early detection of cervical cancer. CA Cancer J.Clin. 2012 May-Jun;62(3):147-72. https://doi.org/10.3322/ caac.21139.
8. Короленкова Л. И. Цервикальные интраэпители-альные неоплазии и ранние формы рака шейки матки: клинико-морфологическая концепция церви-кального канцерогенеза. Москва; 2017. [Korolenkova L. I. Cervical intraepithelial neoplasia and early forms of cervical cancer: a clinical and morphological concept of cervical carcinogenesis. Moscow; 2017. (In Russ.).]
9. Mancini S., Ravaioli A., Giuliani O., Vattiato R., Falcini F., Ferretti S., Costa S., Bucchi L. Incidence and survival trends of cervical adenocarcinoma in Italy: Cytology screening has become more effective in downstaging the disease but not in detecting its precursors. Int. J. Cancer. 2017 Jan 1;140(1):247-248. https://doi/org/10.1002/ ijc.30435.
10. Xie F., Zhang L., Zhao D., Wu X., Wei M., Zhang X., Wu X., Fang H., Xu X., Yang M., Qi D. Prior cervical cytology and high-risk HPV testing results for 311 patients with invasive cervical adenocarcinoma: a multicenter retrospective study from China’s largest independent operator of pathology laboratories. BMC Infect. Dis. 2019 Nov. 11;19(1):962. https://doi. org/10.1186/s12879-019-4614-y.
Участие авторов:
Концепция и дизайн исследования: Н.Н.В., О.В.Б. Сбор и обработка материала: Н.Н.В., О.В.Б. Написание текста: О.В.Б. Редактирование: Н.Н.В.
ERRORS IN CERVICAL CYTOLOGICAL DIAGNOSTICS
N.N. Volchenko, O.V. Borisova
PA Herzen Moscow Oncology Research Institute, Branch, National Medical Radiology Research Center, Ministry of Health of Russia, Moscow, Russia
Summary: in this article, the authors analyze the most common mistakes in the interpretation of cytological pictures of smears with the cervix, leading to hypo- and overdiagnosis. Diagnostic problems are reflected, lead to erroneous cytological conclusions and possible solutions. Particular attention is paid to benign lesions that mimic cervical precancer and cancer: immature squamous metaplasia, herpes, microglandular hyperplasia, and vice versa, a lesion that are often underestimated by a cytologist: dysplasia amid atrophy changes, endocervical adenocarcinoma, cancer amid post-radiation changes.
Key words: cervix, errors, cytological examination.
Corresponding author:
Borisova O.V. https://orcid.org/0000-0001-5160-3168- email: borisova07@bk.ru
To Cite This Article: Volchenko N.N., Borisova O.V. Errors in cervical cytological diagnostics. Russian News of Clinical Cytology 2020;24(1):17-22. https://doi.org/10.24411/1562-4943-2020-10103
The authors declare no conflict of interest.
Information about the authors:
Volchenko N.N. — https://orcid.org/0000-0003-0421-4172 Borisova O.V. — https://orcid.org/0000-0001-5160-3168
Illustrations for the article «ERRORS IN CERVICAL CYTOLOGICAL DIAGNOSTICS» Volchenko N.N., Borisova O.V., рage 17
Рис. 1. Незрелая плоскоклеточная метаплазия с реактивны- Рис. 2. Незрелая плоскоклеточная метаплазия (репаративные
ми изменениями. Окр. по Паппенгейму, х500.
Fig. 1. Immature squamous metaplasia with reactive changes.
Pappenheim stain, х500.
изменения). Окр. по Паппенгейму, х500. Fig. 2. Immature squamous metaplasia (reparative changes). Pappenheim stain, х500.
Рис. 3. CIN3 метаплазированного эпителия. Окр. по Паппенгейму, х500.
Рис. 4. Иммуноцитохимическое исследование с белком p16(INK4a). Отмечается ядерная и цитоплазматическая экс-
Fig. 3. CIN3 in metaplasized epithelium. Pappenheim stain, х500. пРессия белка р^ШЮк) при ОШ ш-та^азиротанното
эпителия. Окр. по Паппенгейму, х200.
Fig. 4. Immunocytochemistry with protein p16 (INK4a). Nuclear and cytoplasmic expression of p16 protein (INK4a) is noted in CIN3 metaplasized epithelium. Pappenheim stain, х200.
Illustrations for the article «ERRORS IN CERVICAL CYTOLOGICAL DIAGNOSTICS» Volchenko N.N., Borisova O.V., рage 17
Рис. 5. Реактивная атипия плоского эпителия на фоне атро- Рис. 6. CIN3 плоского эпителия на фоне атрофии.
фии. Окр. по Паппенгейму, х200. Окр. по Паппенгейму, х500.
Fig. 5. Reactive atypia of squamous epithelium with atrophy. Fig. 6. CIN3 of squamous epithelium with atrophy.
Pappenheim stain, х200. Pappenheim stain, х200.
Рис. 7. CIN3 плоского эпителия на фоне атрофии. Окр. по Паппенгейму, х500.
Fig. 7. CIN3 of squamous epithelium with atrophy. Pappenheim stain, х500.
Рис. 8. CIN2 плоского эпителия на фоне атрофии. Окр. по Паппенгейму, х500. Fig. 8. CIN2 of squamous epithelium with atrophy. Pappenheim stain, х500.
Illustrations for the article «ERRORS IN CERVICAL CYTOLOGICAL DIAGNOSTICS» Volchenko N.N., Borisova O.V., рage 17
Рис. 9. Многоядерные клетки с гиперхромными полиморф- Рис. 10. Атипия плоского эпителия неясного значения — ASC-
ными ядрами при герпетической инфекции. US. Окр. по Паппенгейму, х500.
Окр. по Паппенгейму, х500. Fig. 10. ASC-US of squamous epithelium. Pappenheim stain,
Fig. 9. Polynuclear cells with hyperchromic polymorphic nucleus х500. with herpetic infection. Pappenheim stain, х500.
Рис. 11. Плоскоклеточный веррукозный рак. Окр. по Паппен- Рис. 12. Малодифференцированный плоскоклеточный рак
гейму, х500. из мелких клеток. Окр. по Паппенгейм, х500. Fig. 11. Verrucous squamous cell carcinoma Pappenheim stain, Fig. 12. Low-grade squamous cell carcinoma from small cells.
х500. Pappenheim stain, х500.
Illustrations for the article «ERRORS IN CERVICAL CYTOLOGICAL DIAGNOSTICS» Volchenko N.N., Borisova O.V., рage 17
Рис. 13. Малодифференцированный плоскоклеточный рак на Рис. 14. Аденокарцинома эндоцервикального типа.
фоне атрофии. Окр. по Паппенгейму, х500.
Окр. по Паппенгейму, х500.
Fig. 13. Low-grade squamous cell carcinoma in the presence of Fig. 14- Endocervical type adenocarcinoma.
atrophy. Pappenheim stain, х500.
Pappenheim stain, х500.
Рис. 15. Аденокарцинома эндоцервикального типа. Окр. по Паппенгейму, х500.
Рис. 16. Микрогландулярная гиперплазия цилиндрического эпителия. Окр. по Паппенгейм, х500.
Fig. 15- Endocervical type adenocarcinoma. Pappenheim stain, Fig. 16. Microglandular hyperplasia of the cylindrical epithelium.
х500.
Pappenheim stain, х500.
Illustrations for the article «ERRORS IN CERVICAL CYTOLOGICAL DIAGNOSTICS» Volchenko N.N., Borisova O.V., рage 17
Рис. 17. Низкодифференцированный рак, цитологически сложно дифференцировать между плоскоклеточным и железистым. Окр. по Паппенгейму, х500.
Fig. 17. Low-grade cancer, it is cytologically difficult to differentiate between squamous and glandular type. Pappenheim stain, х500.
Рис. 19. Малодифференцированный плоскоклеточный рак на фоне постлучевых изменений. Окр. по Паппенгейму, х500. Fig. 19. Low-grade squamous cell carcinoma with postradiation changes. Pappenheim stain, х500.
Рис. 18. Постлучевые изменения клеток плоского эпителия. Окр. по Паппенгейму, х500. Fig. 18. Postradiation changes of squamous cells. Pappenheim stain, х500.
Рис. 20. Плоскоклеточный ороговевающий рак на фоне постлучевых изменений. Окр. по Паппенгейму, х500. Fig. 20. Squamous keratinizing cancer with postradiation changes. Pappenheim stain, х500.

Врач онколог, маммолог, хирург Алексей Галкин. Стаж 18+ лет. Принимает в Университетской клинике. Стоимость приема от 2000 руб.
Золотой стандарт для определения HER2 не установлен. Согласно ASCO/CAPs примерно 20% тестов HER2 могут быть неточными. К ним относятся преаналитические, аналитические и постаналитические переменные.
Причины неточностей анализа статуса HER2/neu
К таким преаналитическим переменным, которые влияют на производительность ИГХ или FISH относятся:
- время, необходимое для фиксации образца ткани;
- продолжительность его нахождения в растворе фиксатора;
- последующая обработка.
Такие переменные считаются менее значимыми при использовании методов гибридизации ISH, основанных на амплификации генов, и более значимыми для ИГХ, поскольку ДНК более стабильна, чем белок.
Время до фиксации, то есть время между биопсией или резекцией и помещением образца в фиксатор, должно быть как можно короче. Длительность фиксации оказывает большое влияние на результаты и является основным источником изменчивости. Для ИГХ предложен минимальный период фиксации 6-8 ч, руководящие принципы ASCO/CAP рекомендуют, чтобы фиксация не превышала 48 ч.
ИГХ обнаруживает сверхэкспрессию HER2 на уровне белка и зависит от условий проведения процедур тестирования. К ним относятся в дополнение к трем вышеперечисленным: денатурация, нагревание, извлечение антигена, используемая процедура окрашивания и интерпретация окрашивания. Несмотря на то, что существуют методы извлечения антигена, они могут привести к ложноположительным результатам иммуногистохимии.
Для определенного анализа нужно выбирать свой способ фиксации тканей.
Некоторые фиксаторы, химические вещества или тепло, могут помешать анализу FISH. Однако всегда применяется внутренний контроль для того, чтобы отличить отрицательный результат от неинформативного.
А например, иммуногистохимия способна ошибочно классифицировать опухоли на основе фиксированных формалином и внедренных в парафин образцов. А если использовать замороженный образец ткани того же пациента, то можно получить более точный результат. Фиксация формалином и парафиновое встраивание приводят к появлению множества артефактов, которые сбивают результаты анализа с толку. Очень трудно понять, получается действительно достоверный результат или ошибочный. Так утверждают многие специалисты. Результаты теста ИГХ наиболее надежны для свежих или замороженных образцов тканей. ИГХ является ненадежным способом тестирования тканей, которые сохраняются в воске или других химических веществах.
![]()
Тестирование FISH является предпочтительным способом оценки сохраненных образцов тканей.
- Аналитические факторы – аппаратура и квалификация специалиста также играют роль, и оказывают влияние на достоверность анализа HER2. Чтобы избежать ошибок, необходима регулярная калибровка микроскопов, использование стандартизированных лабораторных процедур, постоянное профессиональное развитие и специализированные программы обучения персонала.
- Постаналитические факторы связаны с интерпретацией результатов анализа, анализом изображений, отчетностью и постоянным обеспечением качества. Интерпретация ИГХ обычно выполняется вручную, включается субъективный фактор и результаты могут варьироваться в зависимости от опыта и бдительности наблюдателя. Например, при анализе ИГХ можно опросить двух патологоанатомов, смотрящих на один и тот же слайд, и один может назвать это 2+ положительное окрашивание, а другой может назвать это 3+ положительное окрашивание.
Оценка с помощью FISH и более новых методов тестирования HER2 CISH, SISH или DDISH, автоматизирована, поэтому является более объективным и количественным, чем с помощью иммуногистохимии. Например, интерпретация теста Fish HER2 – это гораздо более объективный процесс. С помощью анализа FISH патологоанатом подсчитывает фактические копии генов HER2, которые появляются в виде красного “сигнала” в окрашенном в синий цвет ядре раковой клетки, видимом через микроскоп.
Выделяют еще три основных фактора, которые могут привести к неправильному результату:
- Второй анализ на новом срезе фиксированной формалином, залитой парафином ткани, которая поступает из другой части опухоли, может дать другой результат. Хотя такие опухоли встречаются нечасто, но они могут быть HER2-положительными в одних местах и HER2-отрицательными в других.
- Иногда вся хромосома, на которой расположен ген HER2 (наряду с тысячами других генов), амплифицируется в опухолевой ткани. Это называется полисомией хромосомы 17, и ее можно неверно истолковать как амплификацию гена HER2.
- Техническая ошибка в анализе ИГХ (например, если дозатор, который выпускает каплю окрашивающего реагента на предметное стекло, не открывается) может быть обнаружена только путем включения контрольного образца ткани, а он, как известно, набирает 3+ на том же предметном стекле, что и тестируемая ткань. Если такой контрольный образец не используется, отсутствие окрашивания может быть неверно истолковано как отрицательный результат теста. Анализы FISH, в отличие от ИГХ, имеют встроенный контроль для предотвращения ложных отрицательных результатов.
Независимо от того, какой выбран метод определения HER2/neu статуса (иммуногистохимический или с помощью гибридизации FISH, CISH, SISH или DDISH), необходимо, чтобы он был проведен с соблюдением всех требований. Если получен двусмысленный результат, требуется проведение повторного анализа другим методом. Только так можно получить достоверные сведения о статусе HER2. И только таким образом определить возможность проведения таргетной терапии, которая значительно повышает выживаемость пациентов с раком молочной железы.
Продолжение статьи
- Часть 1. Статус HER2 при диагностике опухолей молочных желез. Характеристика. Часть 1.
- Часть 2. Статус HER2 при диагностике опухолей молочных желез. Иммуногистохимическое тестирование. Тесты ISH.
- Часть 3. Ошибки при определении статуса HER2.
Дата публикации 1 июля 2020Обновлено 30 июня 2021
Определение болезни. Причины заболевания
Рак шейки матки — это онкологическое заболевание, которое поражает слизистую оболочку шейки матки.
Заболевание чаще всего протекает без симптомов. Они появляются только при развитии осложнений.
В этих случаях к признакам рака шейки матки относятся: кровянистые выделения из половых путей, хронические боли малого таза и поясницы, нарушение менструального цикла, мочеиспускания и дефекации.
Распространённость рака шейки матки
Согласно статистике, рак шейки матки по распространённости занимает пятое место в популяции и четвёртое место — среди женщин. Ежегодно выявляется около 600 000 новых случаев и регистрируется около 300 000 смертей от рака шейки матки [9]. В России ежегодно выявляется около 20 000 случаев, смертность от заболевания в возрасте от 15 до 39 лет составляет 21,1 % [1].
Анатомия матки:
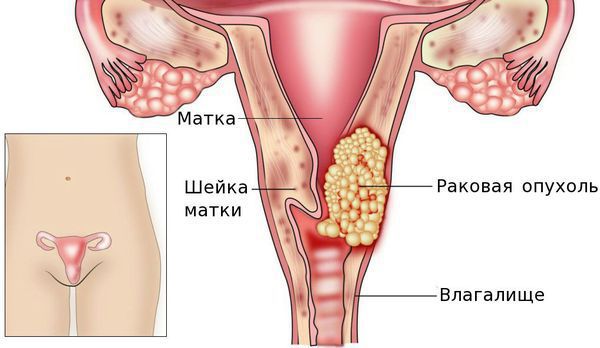
Факторы риска
Возникновение рака шейки матки носит спорадический характер. Это значит, что данная патология не имеет наследственной природы, а возникает под влиянием факторов внешней среды. Основной причиной развития рака шейки матки является вирус папилломы человека.
В большинстве случаев выявляют ВПЧ 16 и 18 типа. Инфицированность ВПЧ в популяции, по данным различных исследований, составляет от 80 до 95 % [8]. Важно понимать, что решающее значение имеет не факт выявления папилломавирусной инфекции, а длительность её нахождения в организме.
Онкологическому заболеванию предшествует возникновение предраковых заболеваний, называемых интраэпителиальной неоплазией или дисплазией шейки матки. Это предраковое заболевание, которое без лечения часто переходит в рак. Развитие онкопатологии от стадии дисплазии до рака занимает 7–10 лет. В течение этого периода заболевание клинически никак себя не проявляет
Дисплазия шейки матки успешно диагностируется. Лечение чаще всего несложное, органосохраняющее, не нарушающее репродуктивную функцию и в большинстве случаев гарантирующее полное выздоровление. Поэтому возникновение рака является апофеозом упущенных возможностей, что делает отсутствие своевременного скрининга дисплазии и рака шейки матки актуальной проблемой для современной медицины и общества.
К факторам риска развития рака шейки матки относят:
- раннее начало половой жизни;
- частую смену половых партнеров;
- отказ от барьерного метода контрацепции;
- использование оральных контрацептивов;
- курение;
- наличие инфекций, передающихся половым путем;
- приём иммуносупрессивной терапии при аутоиммунных заболеваниях и лечении онкологических заболеваний других локализаций [2].
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы рака шейки матки
Заболевание чаще всего протекает без симптомов. Клиническая картина проявляется только в случае возникновения осложнений, которые выражаются следующими симптомами:
- кровянистые выделения из половых путей после полового контакта или гинекологического осмотра;
- кровянистые выделения из половых путей в период постменопаузы;
- межменструальные кровянистые выделения из половых путей;
- изменение характера менструальных выделений;
- обильные кровотечения, которые сложно остановить;
- выделения из половых путей с гнилостным запахом;
- хронические боли малого таза и поясницы;
- нарушение мочеиспускания и дефекации;
- отёки ног [1][2].
Патогенез рака шейки матки
Вирус папилломы человека проникает внутрь эпителиальной клетки, встраивается в её геном и начинает использовать её ресурсы для того, чтобы синтезировать свои белки и размножаться. При этом ВПЧ может повредить участки генов, которые отвечают за апоптоз (запрограммированную гибель клетки). При длительном пребывании вируса в организме риск повреждения участков генов и возникновения мутаций растёт. Мутации могут приводить к бесконтрольному делению клетки.
Раковым клеткам свойственен инвазивный рост, способность проникать в лимфатические и кровеносные сосуды и метастазировать — образовывать вторичные очаги опухолевого роста в других тканях.
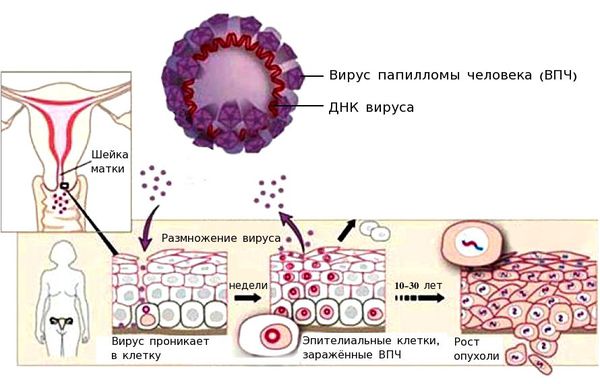
Классификация и стадии развития рака шейки матки
Гистологически (по структуре тканей) выделяют следующие типы рака шейки матки:
- плоскоклетоный рак, возникающий из клеток эпителия цервикального канала и экзоцервикса (внешней части шейки матки, которая доступна для осмотра в зеркалах), доля его составляет около 70-80 % от всех случаев;
- аденокарцинома или железистый рак, возникающий из эпителия желёз шейки матки, составляет около 10-20 % от всех случаев;
- низкодифференцированный рак — 10 % всех случаев;
- другие гистологические типы злокачественных опухолей — менее 1 % (стекловидноклеточный рак, нейроэндокринные опухоли, аденобазальный рак и др.) [1][2][3].
Как и для любого другого злокачественного заболевания, для рака шейки матки разработана классификация TMN — международная классификация стадий злокачественных новообразований. С её помощью определяют распространённость опухолевого процесса.
Выделяют клиническую стадию и патоморфологическую. Клиническую стадию выставляют до начала лечения на основании данных осмотра, пальпации, кольпоскопии, биопсии шейки матки, выскабливания цервикального канала, урографии, цистоскопии, ректороманоскопии, компьютерной томографии грудной клетки, данных УЗИ, КТ и МРТ малого таза. От клинического стадирования зависит тактика лечения.
Патоморфологическое стадирование проводят после оперативного вмешательства на основании гистологического исследования, оно является наиболее точным и определяет дальнейшую тактику лечения и прогноз заболевания.
Также в клинической практике для определения стадии онкологического процесса используется классификация FIGO. Ниже представлена классификация по стадиям развития рака шейки матки (по FIGO, 2009 г.) и по распространённости опухолевого процесса (TMN, 2010 г.):
- Тх — недостаточно данных для оценки распространённости опухоли.
- Tis — рак на месте, это значит, что опухолевый процесс не проник через базальную мембрану, многие специалисты приравнивают к данной стадии дисплазию шейки матки тяжёлой степени (CIN III). По FIGO стадия 0.
- Т1 — распространение опухолевого процесса в пределах шейки матки. Стадия по FIGO 1.
- Т1а — инвазивная опухоль, не визуализируется, определяется только при гистологическом исследовании. Стадия по FIGO 1а.
- Т1а1 — инвазия в строму шейки не превышает 3 мм в глубину, горизонтальное распространение не более 7 мм. Стадия по FIGO 1а1.
- Т1а2 — инвазия в строму шейки от 3 до 5 мм, горизонтальное распространение не более 7 мм. Стадия по FIGO 1а2.
- T1b — клинически определяемое поражение большего размера, чем Т1а и Т1а2, то есть глубина инвазии более 5 мм или горизонтальное распространение более 7 мм. Стадия по FIGO 1b.
- T1b1 — опухоль менее 4 см. Стадия по FIGO 1b1.
- T1b2 — опухоль более 4 см. Стадия по FIGO 1b1.
- Т2 — распространение опухоли за пределы шейки матки, но без вовлечения параметрия (клетчатки, окружающей матку ). Стадия по FIGO 2.
- T2a — опухоль менее 4 см. Стадия по FIGO 2a.
- T2b — опухоль более 4 см. Стадия по FIGO 2b.
- Т3 — распространённость опухолевого процесса за пределы шейки матки с вовлечением стенок малого таза и нижней трети влагалища, а также случаи, сопровождаемые гидронефрозом (расширением почечных лоханок и чашечек, приводящих к нарушению функции почек). Стадия по FIGO 3.
- Т3а — опухоль, поражающая нижнюю треть влагалища. Стадия по FIGO 3a.
- T3b — опухоль, которая поражает стенку таза и/или приводит к гидронефрозу и нефункционирующей почке. Стадия по FIGO 3b.
- Т4 — опухоль, прорастающая в мочевой пузырь и прямую кишку. Стадия по FIGO 4а.
- MX — данных для оценки наличия отдалённых метастазов недостаточно.
- M1 — наличие отдалённых метастазов. Стадия по FIGO 4b.
- NX — данных для оценки распространённости опухолевого процесса в лимфатической системе недостаточно.
- N0 — нет признаков вовлечения регионарных лимфатических узлов (группа лимфоузлов, к которым идут лимфатические сосуды от поражённых органов).
- N1 — метастазы в регионарных лимфатических узлах [1][2].
Осложнения рака шейки матки
Осложнениями рака шейки матки являются:
- болевой синдром;
- синдром сдавления органов малого таза;
- кровотечения.
Болевой синдром появляется на поздних стадиях болезни, когда опухоль прорастает в тазовые нервные сплетения, тазовую брюшину и сдавливает соседние органы. Как правило, боли характеризуются как постоянные, ноющие и зачастую плохо поддающиеся терапии.
Синдром сдавления органов малого таза заключается в нарушении работы мочевыводящей системы и прямой кишки. Опухоль может приводить к ухудшению проходимости мочеточников, что приводит к гидронефрозу и нарушению функций почек. При сдавлении мочевого пузыря возникают боли внизу живота при мочеиспускании и учащаются позывы к мочеиспусканию. Нарушение функции прямой кишки проявляется болью при дефекации, изменениями формы стула и запорами. Сдавление вен и лимфатических сосудов может приводить к отёкам нижних конечностей.
Кровянистые выделения из половых путей могут появиться и на ранних стадиях. На поздних стадиях кровотечения становятся обильными, сложно купируются и часто становятся причиной смерти больных с раком шейки матки.
На поздних стадиях возможно формирование свищей между влагалищем и мочевым пузырем или влагалищем и прямой кишкой, которые проявляются в виде выделения мочи или каловых масс из половых путей [1][2][6].
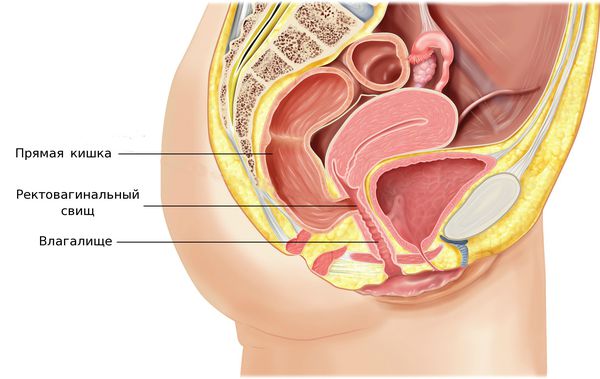
Диагностика рака шейки матки
К какому врачу обратиться
Если появились симптомы, характерные для рака шейки матки, то нужно немедленно обратиться к гинекологу.
Диагноз «Рак шейки матки» ставят только на основании гистологического исследования ткани. Как правило, этому предшествуют:
- взятие мазка на простую или жидкостную онкоцитологию (ПАП-тест, тест Папаниколау);
- анализ на вирус папилломы человека, проводимый методом ПЦР;
- гинекологический осмотр с кольпоскопией, или расширенная кольпоскопия (обычная «кольпоскопия» означает просто осмотр влагалища и шейки матки, а окраска йодом и уксусом — это уже расширенная кольпоскопия, сейчас под термином «кольпоскопия» всегда подразумевают «расширенную кольпоскопию»);
- биопсия шейки матки и/или выскабливание цервикального канала.
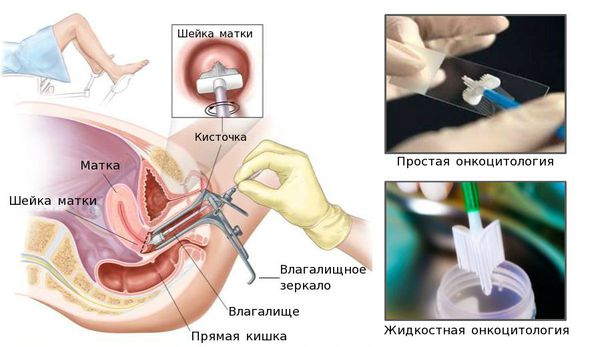
Скрининг
В России под скринингом рака шейки матки понимается мазок на онкоцитологию (тест Папаниколау, ПАП-тест). В возрасте от 21 до 65 лет его нужно делать раз в 3 года. Исследование выявляет дисплазию шейки матки — предраковое состояние, которое хорошо лечится.
Далее для определения стадии рака шейки матки, оценки распространённости опухоли и выбора оптимальной тактики лечения проводятся:
- УЗИ органов малого таза, брюшной полости, забрюшинного пространства;
- рентгенограмма органов грудной клетки;
- определение уровня онкомаркера SCC в сыворотке крови (при плоскоклеточном раке);
- МРТ малого таза с внутривенным контрастированием;
- КТ малого таза, брюшной полости, забрюшинного пространства.
В качестве дополнительных методов исследования используются:
- гистероскопия — эндоскопическое исследование полости матки и цервикального канала;
- цистоскопия — эндоскопическое исследование мочевого пузыря и уретры, рекомендовано выполнять при наличии жалоб, а также при распространении опухоли на переднюю стенку влагалища и при опухоли более 4 см;
- ректороманоскопия — эндоскопическое исследование прямой и сигмовидной кишки, проводят при наличии жалоб, при распространении опухоли на заднюю стенку влагалища, при опухоли более 4 см;
- экскреторная урография — рентгенологическое исследование, при котором контрастируются мочевыводящие пути (лоханки почек, мочеточники, мочевой пузырь, уретра);
- сцинтиграфия костей — рентгенологический метод, направленный на выявление метастазов в костях, выполняется при наличии жалоб;
- лапароскопия с лимфаденэктомией — оперативное вмешательство, направленное на взятие эксцизинной биопсии (орган удаляется целиком) лимфатических узлов для определения метастазов;
- ПЭТ-КТ — рентгенологическое исследование, направленное на выявление отдалённых метастазов и поражения лимфатических узлов, чаще используется для оценки эффективности терапии;
- МРТ головного мозга для определения метастазов в головном мозге, выполняется при наличии жалоб [1][2][6].
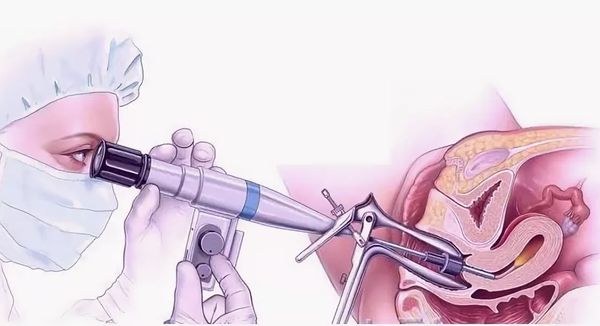
Лечение рака шейки матки
Объём лечебных мероприятий зависит от степени распространённости опухоли и стадии заболевания.
Хирургическое лечение
Гарантировать полное излечение может только хирургический метод. Когда радикальное лечение невозможно, применяют лучевую и химиотерапию.
Возможные виды хирургического вмешательства:
- конизация шейки матки — удаление части шейки матки в виде конуса, основание которого приходится на наружный зев, в пределах здоровой ткани;
- операция I типа — удаление матки с шейкой;
- операция II типа — удаление матки с шейкой, частью связок и региональных лимфатических узлов;
- операция III типа — удаление матки с шейкой, связками матки, лимфатическими узлами и верхней третью влагалища;
- трахелэктомия — удаление шейки матки с клетчаткой, верхней третью влагалища, регионарными лимфатическими узлами с наложением анастомоза (сообщения) между телом матки и влагалищем; целью такого рода вмешательства является попытка сохранить способность женщины к вынашиванию плода.
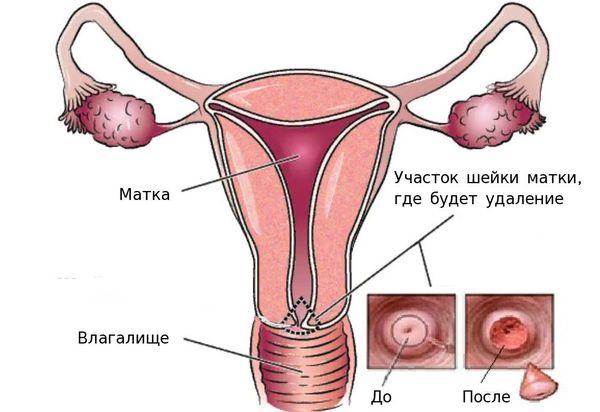
Лучевая терапия
Опухолевые клетки уничтожают с помощью высокоэнергетических рентгеновских лучей.
В зависимости от стадии рака лучевая терапия используется в двух направлениях:
- Как часть основного лечения. Для некоторых стадий лучевая терапия назначается как самостоятельный метод или как дополнение к хирургическому лечению. В большинстве случаев лучевая и химиотерапия проводятся вместе. Такой метод называется химиолучевым лечением и является предпочтительным, так как химиопрепараты усиливают действие облучения.
- Для лечения рака шейки матки на поздних стадиях (с метастазами) или при рецидиве опухоли.
Чаще всего применяют:
- Дистанционную лучевую терапию (ДЛТ, наружное облучение) — основной метод лечения рака шейки матки у пациенток, которые не перенесут химиолучевую терапию и операцию или отказались от неё. Лучевой аппарат не контактируют с телом, процедура безболезненна. Один сеанс длится всего несколько минут, однако подготовка занимает больше времени. Количество сеансов определяет врач-радиолог в зависимости от стадии заболевания, гистологического типа опухоли, а также факторов риска. Химиолучевая терапия наиболее часто выполняется с Цисплатином. Она занимает около пяти недель и проводится пять дней в неделю. Химиотерапия назначается одновременно с лучевой терапией, её частота зависит от конкретного препарата, например Цисплатин вводят один раз в неделю.
- Брахитерапия (внтуреннее облучение с влагалищным аппликатором). Радиоактивный элемент находится в специальном тубусе, который устанавливают во влагалище. Брахитерапия занимает существенно меньше времени, чем дистанционная лучевая терапия.
Осложнения лучевой терапии
При облучении органов малого таза лучевая терапия неизбежно воздействует на мочевой пузырь, прямую кишку, влагалище, яичники, меняя структуру здоровых тканей.
Наиболее часто возникают следующие осложнения:
- Лучевой цистит — сопровождается учащённым, иногда болезненным мочеиспусканием.
- Лучевой ректит — проявляется учащённым, жидким или кашицеобразным стулом, иногда с примесью крови.
- Нарушение менструального цикла — почти неизбежно возникает после нескольких сеансов облучения из-за необратимой гибели яичников.
- Боль и зуд в промежностии/или влагалище — появляется из-за истончения слизистой и кожи при лучевом воздействии. Эти осложнения затрудняют половую жизнь.
- Стеноз влагалища или прямой кишки — возникает из-за хронического воспаления (без профилактических мер) и дистрофических изменений при лечении. Может потребоваться хирургическое вмешательство.
Курение повышает риск побочных эффектов лучевой терапии и снижает её эффективность.
Химиотерапия при раке шейки матки
При химиотерапии препараты вводятся внутривенно или принимаются в таблетках. Не все пациентки со злокачественными опухолями шейки матки нуждаются в химиотерапии.
Она может быть рекомендована:
- как часть основного лечения (см. выше);
- как самостоятельный метод при рецидиве.
Основные лекарства: Цисплатин, Карбоплатин, Паклитаксел (Таксол), Топотекан — могут использоваться самостоятельно или в комбинации. Бевацизумаб (Авастин) — таргетный препарат, часто эффективно дополняет химиотерапию.
Лечение проводят циклами, которые сменяются периодами восстановления. Промежуток между капельницами обычно составляет 21 день [11].
Фотодинамическая терапия (ФДТ)
Эффективность ФДТ при лечении дисплазии и рака шейки матки — спорный вопрос, единого мнения у врачей о нём нет.
Можно выделить несколько проблем:
- Метод не стандартизирован, а значит и нет убедительных доказательств его эффективности.
- Не изучено, как ФДТ влияет на смежные органы, и нет данных об отдалённых последствиях.
- Отсутствует гистологическая верификация. Если операция подразумевает не только лечение, но и диагностику (стадирование), то при ФДТ определить точную стадию невозможно. Особенно эта проблема актуальна для лечения дисплазии тяжёлой степени, поскольку именно эту нишу активно пытаются занять сторонники ФДТ.
Лечение рака шейки матки в зависимости от стадий
Рак на месте или дисплазия тяжёлой степени (CIN III) — конизация шейки матки с возможным выскабливанием цервикального канала. Далее производится оценка краёв резекции, в случае отсутствия в них раковых клеток лечение считается достаточным.
Т1а, микроинвазивная карцинома — конизация шейки матки с выскабливанием цервикального канала с последующей гистологической оценкой краёв резекции [1][2].
Т1а1 — конизация шейки матки с выскабливанием цервикального канала с последующей гистологической оценкой краев резекции. При наличии сопутствующей гинекологической патологии (миома матки, аденомиоз, и др.) и при отсутствии необходимости сохранения фертильности проводят операцию первого типа (удаление матки). При наличии «положительного» края резекции конизацию шейки матки проводят повторно. При отсутствии возможности реконизации, пациентка ведётся как Т1В1 [1][2].
Т1а2 — модифицированное расширенное удаления матки (операция второго типа). При наличии противопоказаний к оперативному вмешательству возможно применение лучевой терапии. Для сохранения фертильности выполняют широкую конизацию шейки матки с лимфоадэнэктомией (лапароскопическим или влагалищным доступом) или трахелэктомию [1][2].
T1b1, T1b2 — расширенная экстирпация матки (операция третьего типа). В качестве альтернативного метода лечения может быть рассмотрена лучевая терапия с сохранением органа. Для сохранения фертильности может быть выполнена трахелэктомия. Далее оценивается риск развития рака: при высоком и промежуточном риске после операции проводится химиолучевая терапия [1][2].
T2a, T2b — возможны следующие варианты лечения:
- расширенная экстирпация матки (операция третьего типа);
- химиолучевое лечение;
- химиотерапия с последующей расширенной экстирпацией матки [1][2].
IIB-IVB — проводят химиолучевую терапию. При отсутствии поражения стенки таза одним из вариантов лечения является экзентерация малого таза (удаление мочевого пузыря, прямой кишки, матки с шейкой и придатками), особенно при наличии свищей. При наличии асимметричного отёка нижней конечности, болей в ноге, блокирования оттока мочи в мочеточнике, поражения стенки малого таза пациентке может быть предложена лишь паллиативная помощь (направленная не на излечение, а на облегчение симптомов)[1][2].
Реабилитация
Реабилитация зависит от того, как женщина перенесла химио- или лучевую терапию, и часто сводится к устранению осложнений. После завершения лечения пациенткам можно порекомендовать правильно питаться, принимать витамины, вести в меру активный образ жизни и посетить психолога.
Онкологический диагноз во многих случаях не является приговором. Ограничений после лечения не так уж и много, пациенткам можно и нужно вести здоровую и полноценную жизнь.
Прогноз. Профилактика
Прогноз при раке шейки матки зависит от стадии заболевания. В онкологии принято оценивать пятилетнюю выживаемость:
- при I стадии она составляет 88,8 %
- при II стадии — 74 %;
- при III стадии — 51,4 %;
- при IV стадии — 7,8 % [10].
Профилактика направлена на выявление проблемы на стадии предракового заболевания, когда возможно полное излечение и низкий риск рецидивирования.
Для этого рекомендовано проходить следующие обследования:
- мазок на онкоцитологию (пап-тест) — один раз в год;
- кольпоскопия — также один раз в год (в любой день, кроме дней менструации);
- ПЦР-диагностика на ВПЧ — при каждой смене полового партнера или один раз в пять лет.
Предотвращает ли прививка от ВПЧ рак шейки матки
К методам специфической профилактики относится вакцинирование против ВПЧ детей в возрасте от 12 до 14 лет до начала половой жизни. Делать вакцину взрослым нецелесообразно, так как при начале половой жизни каждый взрослый сталкивается в ВПЧ с вероятностью в 87-97 %.
Разработаны различные типы вакцин, отличающиеся друг от друга количеством штаммов, от которых они защищают. На данный момент максимально эффективная вакцина действует против 6, 11, 16, 31, 33, 45, 52, 58 типов ВПЧ. Препарат вводится в дельтовидную мышцу три раза с интервалом в два месяца, а затем повторно через шесть месяцев. Однако, необходимо помнить, что вакцинация снижает риски возникновения рака шейки матки, но не является полной альтернативой скринингу.
За дополнение статьи благодарим Антона Ильина — онколога-гинеколога, научного редактора портала «ПроБолезни».
