ПЭТ-КТ — это современный метод обследования, совмещающий позитронно-эмиссионную томографию (ПЭТ) и компьютерную томографию (КТ). Иногда метод называется просто ПЭТ. В его основе лежит регистрация гамма-излучения от введенного в организм радиофармпрепарата.
КАК ЧАСТО ОШИБАЕТСЯ ПЭТ-КТ, БЫВАЮТ ЛИ ОШИБКИ ПЭТ-КТ?
Вопрос важный, ведь это обследование проходят те, кому очень нужен точный диагноз!
Увы, ошибки диагностики при ПЭТ-КТ встречаются в определенном проценте случаев. Это обусловлено двумя факторами.
1. Объективный фактор, заключающийся в самой методике. В любом диагностическом методе, будь то КТ, МРТ или ПЭТ, изначально заложен определенный процент ошибок. Если мы возьмем какую-нибудь болезнь — например, рак молочной железы, то не все случаи рака молочной железы могут быть выявлены с помощью ПЭТ (это называется ложноотрицательный результат). Кроме того, иногда при отсутствии рака на снимках ПЭТ-КТ могут выявляться ее признаки (это называется ложноположительный результат). Есть несколько причин этого феномена: несовершенство аппаратуры, наличие сопутствующих болезней, имеющих сходную симптоматику, плохая выявляемость болезни на ранней стадии. Нужно отметить, что с каждым годом аппаратура ПЭТ-КТ становится все точнее, и поэтому процент ложных результатов постепенно уменьшается.
2. Субъективный фактор — более важный. Он обусловлен неверной трактовкой результатов ПЭТ-КТ. Врач, анализирующий снимки ПЭТ-КТ, может совершить ошибку и неправильно описать имеющиеся изменения! Нужно понимать, что любая аппаратура, даже самая современная — это всего лишь «железо» для получения изображений. А расшифровка изображений ПЭТ-КТ — это дело врача-радиолога, и от его опыта и знаний напрямую зависит достоверность диагностики.
Диагностические ошибки ПЭТ-КТ, обусловленные неправильной расшифровкой снимков, встречаются не так уж редко. В России этот метод только начинает развиваться. Количество квалифицированных специалистов по ПЭТ пока ограничено, и почти все они работают в нескольких профильных центрах в крупных городах (например, Институт мозга человека РАН). Встречается ситуация, когда в лечебное учреждение поставили новое оборудование ПЭТ, а опытного специалиста для работы на нем не найти. Это касается как государственных, так и частных центров ПЭТ.
В этих случаях не нужно отчаиваться. Если у вас или ваших лечащих врачей после проведения ПЭТ-КТ остаются вопросы по диагнозу, снимки можно проконсультировать у более опытного специалиста. Сегодняшняя ситуация такова, что такой специалист не обязательно должен жить в том же городе — результаты можно переслать ему по сети интернет.
ПЭТ-КТ В ДИАГНОСТИКЕ РАКА — КАК ИЗБЕЖАТЬ ОШИБОК?
Второе мнение по ПЭТ-КТ — распространенная услуга во всем мире. Для онкологических пациентов крайне важно не ошибиться с диагнозом — например, знать точную стадию рака, количество пораженных лимфатических узлов, достоверно исключить метастазы в печень, кости и другие органы. Пересмотр ПЭТ-КТ опытным врачом-диагностом — это способ свести риск ошибки к минимуму.
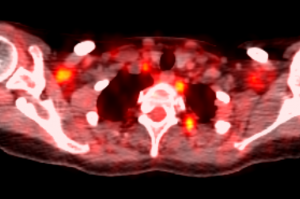
Может ли ПЭТ-КТ дать ошибку по метастазам? На примере — очаги накопления радиофармпрепарата [18F]-дезоксиглюкозы в подмышечной области и вдоль позвоночника, которые первоначально были расценены как метастазы в лимфатические узлы. Более внимательный анализ в ходе второго мнения показал, что эти очаги не являются злокачественной опухолью, а представляют собой участки бурого жира, отличающиеся повышенной метаболической активностью. На этом примере мы видим, как пересмотр результатов ПЭТ-КТ помог сделать диагноз менее опасным.
Заказать второе мнение по ПЭТ-КТ можно из любого города России, не выходя из дома. Врачи-радиологи Санкт-Петербургского Института мозга человека обладают огромным опытом в расшифровке ПЭТ-КТ головного мозга с метионином, ПЭТ-КТ всего тела с глюкозой, и других видов ПЭТ. Достаточно отправить им снимки через систему Национальной телерадиологической сети, и получить в течение суток подробное и квалифицированное заключение. Пересмотр результатов ПЭТ осуществляется под руководством З. Л. Бродской — корифея отечественной радиологии, многолетнего соратника знаменитой Н. П. Бехтеревой.
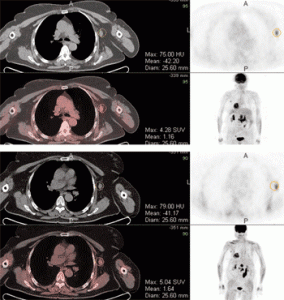
ПЭТ-КТ при раке молочной железы. Тщательный анализ характеристик накопления РФП (SUV) в подмышечных лимфатических узлах помогают различить метастазы и доброкачественное увеличение узлов.
Читать подробнее о Втором мнении
Читать подробнее о телемедицине

Кандидат медицинских наук, член Европейского общества радиологов
- Case report
- Open Access
- Published: 05 March 2020
BMC Medical Imaging
volume 20, Article number: 26 (2020)
Cite this article
-
5835 Accesses
-
3 Citations
-
1 Altmetric
-
Metrics details
Abstract
Background
The F-18 fluorodeoxyglucose positron emission/computed tomography (FDG PET/CT) has become an established diagnostic imaging for malignancy. However, there are other diseases that can also be identified with FDG, some of them are infections such as tuberculosis.
Case presentation
In this case report, two patients showed multiple hypermetabolic tuberculosis lesions on FDG PET/CT, with one of the patients having history of malignancy. The objective of the present case report is to emphasize the need to use other differential diagnosis techniques for tuberculosis especially in tuberculosis-endemic countries when interpreting FDG PET/CT.
Conclusion
By analyzing diagnostic imaging alone, there is a high chance of misinterpreting asymptomatic tuberculosis patient as having malignancy. Therefore, there is need for correlation with clinical data as well as other imaging modalities and PET/CT with more specific tracer in order to differentiate malignancy from benign disease such as tuberculosis.
Peer Review reports
Background
The bacteria responsible for tuberculosis is Mycobacterium tuberculosis, which is a serious contagious pathogen in many countries. Based on the data released by the World Health Organization in 2009, one-third of the world’s population, almost 2 billion people, are infected with M. tuberculosis [1, 2].
Tuberculosis is a major health problem in most developing countries including Indonesia. The incidence rate of tuberculosis in Indonesia was 391 per 100,000 population in 2015 and was marked as the ninth most common country with Tuberculosis [3].
M. Tuberculosis usually affects the lung but to some extent may also involve other susceptible extra-pulmonary organs. Also, there is a challenge with the identifying the infection at the extra-pulmonary site as it is often difficult to obtain specimen for definitive diagnosis of tuberculosis [4, 5].
FDG PET/CT is a diagnostic imaging procedure which provides a unique information of cellular glucose metabolism. By using the anomalous hallmark of cancer cell in reprogramming glucose metabolism and upregulating glucose transporter, the uptake of FDG is markedly increased in cancer cells [6]. However, there are some limitations with respect to the specificity of FDG PET/CT in that it sometimes gives false negative or positive results. The false positive findings are majorly associated with high FDG uptake in infectious or inflammatory tissue [7]. Granulocytes and mononuclear cells use glucose as an energy source during their metabolic burst [8], consequently, high FDG uptake could be seen in tuberculosis. Two cases of malignancy-like lesions in tuberculosis patients were reported which resulted in false positive findings with FDG PET/CT (Table 1).
Full size table
Case presentation
The FDG PET/CT images were acquired on a PET/CT scanner (Gemini, Phillips Healthcare, USA). All patients were subjected to fasting for over 6 h with blood sugar level below 150 mg/dL before the intravenous injection of FDG with a dose of 0.10 mCi/kgBW. The images were then acquired between 45 to 90 min after the injection. The acquisition was carried out from head to feet with arms above the head position using 700-mm field of view (FOV) and slice thickness of 10 mm. Also, three-dimensional data acquisition was performed for 3 min per bed position, followed by image reconstruction with the 3D-ordered-subsets expectation maximization method. Segmented attenuation was corrected by X-ray CT (140 kV, 120–240 mAs) to produce 128 × 128 matrix image. CT images were reconstructed using a conventional filtered back projection method.
Case 1
A 47-year old male with nasopharyngeal cancer for 2 years complained of a stuffed nose and hearing derivation in the right ear for about 2 weeks before being subjected to FDG PET/CT. He had no history of exposure to tuberculosis patient, weight loss, cough, low-grade fever, decreased appetite, or night sweat.
The results from laboratory tests showed normal blood count and serum carcinoma embryonic antigen (CEA) level. Contrast enhanced head and neck CT scan showed no sign of relapse in the nasopharyngeal wall with multiple metastases neck lymphadenopathies.
However, FDG PET/CT showed high FDG uptake by these multiple neck lymphadenopathies and the right nasopharyngeal wall (Fig. 1). The highest SUVmax of multiple neck lymphadenopathies was 11.05 that located in the right jugular superior, meanwhile SUVmax of the right nasopharyngeal wall was 4.51. Mild FDG-avid ground glass opacities with thick cavitation and calcification were also found at the apex of the left lung. Based on these FDG PET/CT findings, the biopsy was performed in the right nasopharyngeal that positive for tuberculous infection.
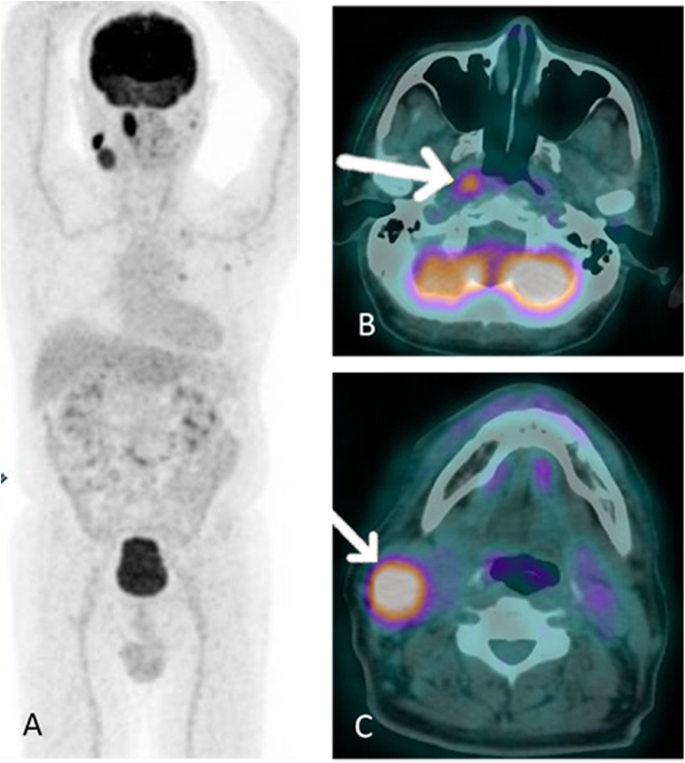
FDG PET/CT of patient number 1. Hypermetabolic lesions in several parts of head and neck. a MIP. b hypermetabolic lesion at right nasopharyngeal wall. c hypermetabolic enlarge lymph node at neck region
Full size image
Case 2
A 58-year old female presented with occasional dizziness for almost 4 months. She had history of smoking but none for tuberculosis exposure.
The CT scan on the brain showed multiple metastatic nodules (Fig. 2b). Also, the FDG PET/CT showed high FDG uptake at the left superior bronchial wall (Fig. 2c) and mild FDG uptake of bronchial thickening at posterior region of the left superior lung lobe. There were also multiple high FDG uptakes at the neck, mediastinal, abdominal, and pelvic lymphadenopathies with the highest SUVmax was 4.05 that located at left hilar. High FDG uptake of lytic lesion at fourth lumbar and right parieto-occipital nodule were also seen. All these findings were interpreted as metastatic lung cancer to the lymph nodes, brain, and bone. Based on these FDG PET/CT findings, the biopsy was performed at the left hilar lymph node and positive for tuberculous infection.
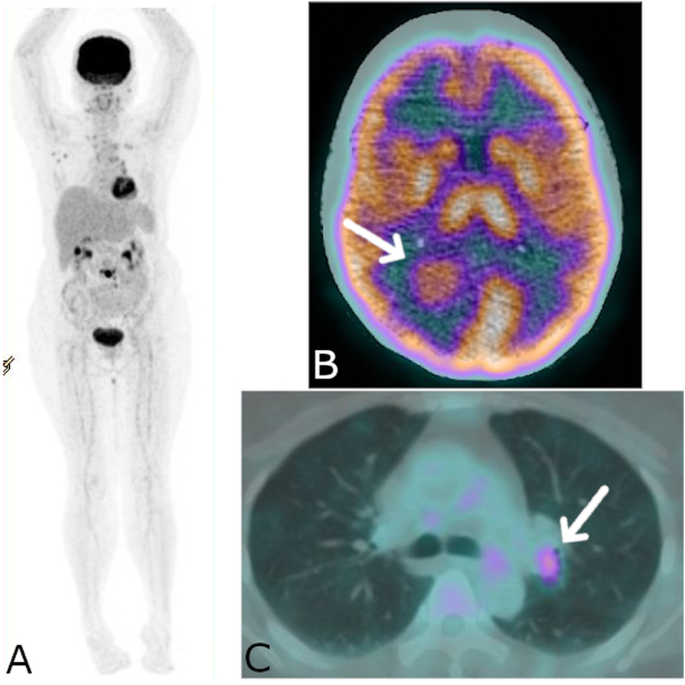
FDG PET/CT of patient number 2. a MIP showed multiple hypermetabolic lesions. b hypermetabolic nodule at brain highly suspicious for metastasis. c hypermetabolic lesion at left hilar region
Full size image
All patients underwent lymph nodes biopsy and were reported as tuberculosis infections. Consequently, anti-tuberculosis drugs such as rifampicin, pyrazinamide, isoniazid, and streptomycin were administered according to the histopathology results. Also, all the patients underwent contrast enhanced CT scan three to 5 months after the initial anti-tuberculosis treatment for response evaluation. All cases showed good response to the treatment and were all considered as complete remission.
Discussion and conclusion
There were two reported cases of malignancy-like lesions in tuberculosis patients that resulted in false positive findings with FDG PET/CT. All the lesions showed high FDG malignant-like lesions uptake and the FDG PET/CT findings misinterpreted as malignancy. However, tuberculosis was confirmed as final diagnosis by the histopathology studies.
In all these cases, the initial CT scan did not show typical characteristics finding for extrapulmonary tuberculosis, however, the FDG PET/CT showed high FDG lesions uptake which is generally viewed as malignant lesions. The extrapulmonary tuberculosis commonly develop from the pulmonary tuberculosis which subsequently spread outside the lungs through the lymphatic system. However, there are conditions whereby extrapulmonary tuberculosis develops without any evidence of pulmonary lesions [9, 10]. These two cases were found with mild FDG uptake of pulmonary lesions without any typical radiological findings for tuberculosis.
The case number one showed marked hypermetabolic lesion at right nasopharyngeal wall, suggesting nasopharyngeal cancer recurrence. This case was misinterpreted as malignancy because of the patients’ history, lesions sites, and atypical pulmonary radiologic finding lesions for tuberculosis. However, subject in case number two had no history of malignancy but showed typical metastatic distribution with hypermetabolic lesion at bronchial wall which is a suspicious sign for malignancy.
According to WHO criteria for classification, extrapulmonary tuberculosis is defined as an infection caused by M. Tuberculosis which affects tissues and organs outside the pulmonary parenchyma. The incidence rate of extrapulmonary tuberculosis is between 20 and 25% of all tuberculosis cases [11]. One of the most common extrapulmonary tuberculosis form is lymphadenopathy tuberculosis that counts for 30–40% of all extrapulmonary tuberculosis. The most common predilection site for lymphadenopathy tuberculosis is neck region (63–77%), however, it can also be found in other regions [12]. Fever and other typical systemic symptoms may not always present until the late stage of extrapulmonary tuberculosis [13].
The PET/CT study using F-18 FDG as a glucose analogue is a rapidly producing functional imaging modality which has been very beneficial in the detection of primary, recurrent, and metastatic tumour, planning, and therapy monitoring. The growth of cancer cell is an energy-related process which is supported by increased glucose metabolism. It is widely known that glucose transporter (GLUT) proteins, a membrane protein, are responsible for the transport of glucose across cellular membranes. Consequently, cancer cells have higher rates of GLUT expressions compared to normal cells. Together with this mechanism, some types of tumour is also associated with a higher rate of phosphorylation, lower rate of dephosphorylation of intracellular phosphorylated glucose, and higher activity of hexokinase.
These characteristics of cancer cell make the FDG accumulation much higher than normal cell. FDG PET/CT is known as superior but less specific for diagnostic imaging in malignancy. Through glucose transporters that are overexpressed both in cancer and inflammatory cells hence result in FDG accumulation, is not only visible in cancer cells but also in inflammatory cells such as activated macrophages, lymphocytes, and neutrophils at the site of inflammation or infection [14].
There is a similarity between the FDG uptake mechanism of both cancer and inflammatory cells. Both cells need high glucose consumption to fulfill the high energy demands. Glucose enter the cells through energy-dependent transporters. There are seven types of glucose transporter, known as GLUT-1 to GLUT-7 [11]. It was discovered in a study that a relative higher FDG uptake was observed in some of the inflammatory lesions, in which the expression level of GLUT-3 was much higher compared to GLUT-1. Also, Fu et all found that mRNA analysis in inflammatory cells showed GLUT-1 expression increased to 3.5 times, whereas GLUT-3 increased to 6 times, following the activation of inflammatory factors [9, 12]. The expressions of GLUT-1 and GLUT-3 in the inflammatory lesions are related to the type, quantity, and degree of activation of the inflammatory cells. Another study reported the important roles played by cytokines and growth factors in promoting the affinity of glucose transporter. Therefore, FDG uptake mechanism in inflammatory cells is almost similar compared to tumour setting though different situations [9].
Many studies have been conducted in attempting to differentiate between malignancy and inflammation in FDG PET study, including variation of protocols, characteristic, and parameter. Traditionally, a threshold for single time point using SUV max has been proposed to differentiate the two processes, however this method was proven not effective with false positive rate above 60%. Other widely accepted method is using dual-time imaging, based on varying levels of glucose-6-phosphatase activity among different tumour cell types, inflammatory and normal cells. However, this method is not dependable for several reasons including histologic type of tumours, the combination or the coexisting of chronic and acute inflammation, necrosis, hypoxia, and degree of angiogenesis. Most recent proposed method is using influx rate constant (Ki). It is reported in lung inflammatory lesions that this parameter is closely related to neutrophil activation. However, it is not applicable in daily practice and therefore requires further study in various type of tumours.
Familiarity with oncologic pattern and correlation with other modalities such as tumour marker and anatomical imaging are important in FDG PET/CT interpretation to produce more accurate assessment in clinical setting. Also, it is important to understand the pitfall of tumour markers and other clinical assessments commonly used in diagnosing malignancy. Several studies showed CEA level which might also increase in inflammatory process in the lung [15, 16]. New specific radiopharmaceutical for tuberculosis, such as Tc-99 m-ethambutol might also be helpful in these setting [17, 18].
Conclusively, two cases of malignancy-like lesions in tuberculosis patients were reported but resulted in false positive findings in FDG PET/CT. By analyzing only diagnostic imaging, asymptomatic tuberculosis patient can be easily misinterpreted as having malignancy. There is need for correlation with clinical data, as well as other imaging modalities and PET/CT with more specific tracer, in order to be able to differentiate malignancy from benign disease such as tuberculosis.
Availability of data and materials
The datasets generated and/or analysed during the current study are de-identified and not publicly available considering the fact that not all the patients consented to it for publication but are available from the corresponding author on reasonable request.
Abbreviations
- CEA:
-
Carcinoma Embryonic Antigen
- CT:
-
Computed tomography
- FDG:
-
18F-fluorodeoxyglucose
- GLUT:
-
Glucose transporter
- PET:
-
Positron emission tomography
References
-
Polley P, Dunn R. Noncontiguous spinal tuberculosis: incidence and management. Eur Spine J. 2009;18(8):1096–101..
Article
Google Scholar
-
Khue PM, Truffot-Pernot C, Texier-Maugein J, Jarlier V, Robert J. A 10-year prospective surveillance of mycobacterium tuberculosis drug resistance in France 1995–2004. Eur Respir J. 2007;30(5):937–44.
Article
CASGoogle Scholar
-
Who report 2009. Global Tuberculosis control: epidemiología, strategy, financing. Geneva: World Health; 2009.
Google Scholar
-
Kanga I, Taylor JA, Jacobs C, Outerbridge G. Tuberculosis of the neuromusculoskeletal system: a review of two cases presenting as chiropractic patients. J Can Chiropr Assoc. 2015;59(1):13.
PubMed
PubMed CentralGoogle Scholar
-
Lee JY. Diagnosis and treatment of extra pulmonary tuberculosis. Tuberc Respir Dis. 2015;78:47–55.
Article
Google Scholar
-
Fletcher JW, Djulbegovic B, Soares HP, Siegel BA, Lowe VJ, Lyman GH, Coleman RE, Wahl R, Paschold JC, Avril N, Einhorn LH, Suh WW, Samson D, Delbeke D, Gorman M, Shields AF. Recommendation on the use of 18F-FDG PET in oncology. J Nucl Med. 2008;49:480–508.
Article
Google Scholar
-
Bakheet SM, Powe J, Kandil A, Ezzat A, Rostom A, Amartey J. F-18 FDG uptake in breast infection and inflammation. Clin Nucl Med. 2000;25:100–3.
Article
CASGoogle Scholar
-
Weisdorf DJ, Craddock PR, Jacob HS. Glycogenolysis versus glucose transport in human granulocytes: differential activation in phagocytosis and chemotaxis. Blood. 1982;60:888–93.
Article
CASGoogle Scholar
-
Fisher D, Elwood K. Nonrespiratory tuberculosis. In: Canadian thoracic society, Canadian Lung Association, and the Public Health Agency of Canada, editor. Canadian tuberculosis standards. 7th ed. Ottawa: Canadian Thoracic Society; 2013.
Google Scholar
-
Zuang H, Pourdehnad M, Lambright ES, Yamamoto AJ, Lanuti M, Li P, Mozley PD, Rossman MD, Albelda SM, Alavi A. Dual time point 18F-FDG PET imaging for differentiating malignant from inflammatory process. J Nucl Med. 2001;42:1412–7.
Google Scholar
-
Metser U, Even-Sapir E. Increased 18 F-fluorodeoxyglucose uptake in benign, nonphysiologic lesions found on whole-body positron emission tomography/computed tomography (PET/CT): accumulated data from four years of experience with PET/CT. In: Seminars in nuclear medicine. Philadelphia: Elsevier; 2007. p. 206–22.
Google Scholar
-
Wang ZG, Yu MM, Han Y, Wu FY, Yang GJ, Li DC, Liu SM. Correlation of Glut-2 and Glut-3 expression with F-18 FDG uptake in pulmonary inflammatory lesion. Medicine. 2016;95:48.
Google Scholar
-
Hammoudeh M, Khanjar I. Skeletal tuberculosis mimicking seronegative spondyloarthropathy. Rheumatol Int. 2004;24(1):50–2.
Article
Google Scholar
-
Kim IJ, Lee JS, Kim SJ, Kim YK, Jeong YJ, Jun S, Nam HY, Kim JS. Double-phase 18F-FDG PET-CT for determina- tion of pulmonary tuberculoma activity. Eur J Nucl Med Mol Imaging. 2008;35:808–14.
Article
Google Scholar
-
Quist J, Hill AR. Serum lactate dehydrogenase (LDH) in Pneumocystis carinii pneumonia, tuberculosis and bacterial pneumonia. Chest. 1995;108(2):415–8.
Article
CASGoogle Scholar
-
No JI, Yang JY, Hyun HJ, Yeon CS, Choi HJ. Factors associated with serum levels of carcinoembryonic antigen in healthy non-smokers. Korean J Fam Med. 2013;34(6):413–9. https://doi.org/10.4082/kjfm.2013.34.6.413.
Article
PubMed
PubMed CentralGoogle Scholar
-
Houshmand S, Salavati A, Basu S, et al. The role of dual and multiple time point imaging of FDG uptake in both normal and disease states. Clin Transl Imaging. 2014;2:281. https://doi.org/10.1007/s40336-014-0075-x.
Article
Google Scholar
-
Kartamihardja AHS, Kurniawati Y, Gunawan R. Diagnostic value of 99mTc-ethambutol scintigraphy in tuberculosis: compared to microbiological and histopathological tests. Ann Nucl Med. 2018;32(1):60–8.
Article
CASGoogle Scholar
Download references
Acknowledgements
Not Applicable.
Funding
There was no funding received for this study.
Author information
Authors and Affiliations
-
Department of Nuclear Medicine, Mochtar Riady Comprehensive Cancer Centre Siloam Hospital, Jakarta, Indonesia
Febby Hutomo, Ryan Yudistiro, Ivana Dewi Mulyanto & Hendra Budiawan
-
Department of Nuclear Medicine, School of Medicine of Pelita Harapan University, Tangerang, Indonesia
Ryan Yudistiro & Ivana Dewi Mulyanto
-
Department of Nuclear Medicine and Molecular Imaging, School of Medicine of Padjadjaran University, Dr Hasan Sadikin Hospital, Bandung, Indonesia
Hendra Budiawan
Authors
- Febby Hutomo
You can also search for this author in
PubMed Google Scholar - Ryan Yudistiro
You can also search for this author in
PubMed Google Scholar - Ivana Dewi Mulyanto
You can also search for this author in
PubMed Google Scholar - Hendra Budiawan
You can also search for this author in
PubMed Google Scholar
Contributions
FH collected patient data and drafted the manuscript. FH, RY, and IDM designed and organized this report and participated in writing the manuscript. HB reviewed and approved the final manuscript. All authors read and approved the final manuscript.
Corresponding author
Correspondence to
Ryan Yudistiro.
Ethics declarations
Ethics approval and consent to participate
Not Applicable.
Consent for publication
Not Applıcable.
Competing interests
The authors declare that they have no competing interests.
Additional information
Publisher’s Note
Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
Rights and permissions
Open Access This article is licensed under a Creative Commons Attribution 4.0 International License, which permits use, sharing, adaptation, distribution and reproduction in any medium or format, as long as you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons licence, and indicate if changes were made. The images or other third party material in this article are included in the article’s Creative Commons licence, unless indicated otherwise in a credit line to the material. If material is not included in the article’s Creative Commons licence and your intended use is not permitted by statutory regulation or exceeds the permitted use, you will need to obtain permission directly from the copyright holder. To view a copy of this licence, visit http://creativecommons.org/licenses/by/4.0/. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated in a credit line to the data.
Reprints and Permissions
About this article
Cite this article
Hutomo, F., Yudistiro, R., Mulyanto, I.D. et al. False positive finding from malignancy-like lesions on FDG PET/CT: case report of tuberculosis patients.
BMC Med Imaging 20, 26 (2020). https://doi.org/10.1186/s12880-020-00427-w
Download citation
-
Received: 04 June 2019
-
Accepted: 21 February 2020
-
Published: 05 March 2020
-
DOI: https://doi.org/10.1186/s12880-020-00427-w
Keywords
- Tuberculosis
- Malignancy
- FDG
- PET/CT
Содержание
- Точность метода МРТ
- Причины ошибок диагностики
- Достоверность ПЭТ КТ
- Как избежать постановки неправильного диагноза?
В случае с обследованием человеческого организма на наличие раковых заболеваний ни один из методов не может гарантировать 100% безошибочный результат. Для диагностики применяются ПЭТ КТ, МРТ, классическая КТ, УЗД — все они имеют свои плюсы и минусы. Рассмотрим более подробно МРТ и ПЭТ КТ. Могут ли они ошибаться? Если да, то каковы причины неверных результатов при диагностировании рака?
Точность метода МРТ
 Правильно поставленный диагноз является основным условием результативного лечения. Мировая медицинская практика показывает, что МРТ обследование заслуживает доверия. В результате его проведения получаются изображения тканей и сосудов высокой четкости. Обнаруженное новообразование специалист дифференцирует по признакам:
Правильно поставленный диагноз является основным условием результативного лечения. Мировая медицинская практика показывает, что МРТ обследование заслуживает доверия. В результате его проведения получаются изображения тканей и сосудов высокой четкости. Обнаруженное новообразование специалист дифференцирует по признакам:
- характер контура патологии;
- однородность содержимого;
- степень накопления контрастного вещества.
Это позволяет косвенно определить характер опухоли: доброкачественная или злокачественная. Окончательно подтвердить диагноз может только биопсия, но чем выше квалификация врача, выполняющего расшифровку, тем меньше возможность ошибки. Если соблюдать все правила проведения процедуры, то результат будет корректным.
Причины ошибок диагностики
Ошибки при заключении могут быть следствием неправильного размещения пациента на столе томографа, его движений при сканировании или появления артефактов на снимках. На всех изображениях, полученных при МРТ, есть разного рода артефакты, но они в большинстве случаев легко распознаются специалистом. Однако в некоторых ситуациях они могут имитировать патологические состояния, что требует от врача внимательности при расшифровке изображений.
Причины ошибок можно условно разделить на три группы:
- неправильная подготовка пациента к обследованию;
- недостаточная квалификация врача, проводящего процедуру;
- подбор неверной методики диагностики.
Нарушения процесса исследования из-за пациента
Одной из основных причин неправильных результатов МРТ является нарушение процесса диагностики пациентом. Чтобы подобного не случилось, человек должен:
 до начала обследования снять с себя предметы, в состав которых входит металл;
до начала обследования снять с себя предметы, в состав которых входит металл;- проинформировать лечащего врача о присутствии в теле имплантов из металла;
- в процессе обследования не совершать никаких телодвижений (соблюдать полную неподвижность).
Последний пункт имеет особое значение для точности результата. Малейшие шевеления пациента приводят к смазанности изображения. Именно поэтому лежать нужно не двигаясь, а это непросто при условии, что процесс длится достаточно долго.
Неверно подобранная методика
МРТ часто не может отличить раковые клетки от отечной жидкости и поэтому выдает неверный результат. Не всегда данный метод обследования может распознать опухоль головного мозга, а также легких из-за высокой воздушности и небольшого количества воды в тканях органов дыхания. Изучить состояние костных структур, используя МРТ, также не получится.
Для выявления новообразований лучше применить КТ. Компьютерная томография отлично справляется с поиском опухолей молочной железы и желудка, а МСКТ способна обнаружить образования величиной 2-3 мм.
Диагностические возможности аппарата напрямую зависят от его мощности. Снимки, полученные с помощью низкопольных установок, не обладают необходимой точностью. Для получения достоверных данных лучше применять оборудование с магнитным полем от 1,5 Тесла.
Недостаточная квалификация специалиста
Оборудование для МРТ очень точно воспроизводит изображение. Далее все снимки передаются рентгенологу, который должен их расшифровать. От его компетентности и уровня квалификации зависит постановка верного диагноза. Жировая клетчатка, мышцы, эпителий дают разный сигнал, поэтому иногда можно даже предположить из какой ткани состоит опухоль. К сожалению, многие врачи допускают ошибки в заключении из-за неверной расшифровки результатов.
Достоверность ПЭТ КТ
ПЭТ КТ (позитронно-эмиссионная томография, совмещенная с компьютерной томографией) — это исключительный способ радионуклидного обследования, при помощи которого осуществляется диагностика онкологических заболеваний, патологий ЦНС и эндокринной системы. Надежность исследования, в зависимости от исследуемого органа, колеблется в границах от 85 до 99%.
Несмотря на высокий процент точности, иногда ПЭТ КТ все же ошибается. Причиной этого являются разного рода объективные и субъективные факторы.
Основы работы метода
 Принцип работы ПЭТ КТ основывается на том, что раковые клетки активнее себя ведут в сравнении со здоровыми. В связи с этим поглощение и выделение продуктов жизнедеятельности носит усиленный характер. Так как ПЭТ КТ — это радионуклидный способ проведения обследования, то для обнаружения метаболических процессов, происходящих в организме, пациенту необходимо ввести РФП (радиофармпрепарат). РПФ — это безвредное вещество, не имеющее вкуса и запаха. В его состав входят радиоизотопы (фтор-18, углерод-11) и биохимические соединения (чаще всего глюкоза).
Принцип работы ПЭТ КТ основывается на том, что раковые клетки активнее себя ведут в сравнении со здоровыми. В связи с этим поглощение и выделение продуктов жизнедеятельности носит усиленный характер. Так как ПЭТ КТ — это радионуклидный способ проведения обследования, то для обнаружения метаболических процессов, происходящих в организме, пациенту необходимо ввести РФП (радиофармпрепарат). РПФ — это безвредное вещество, не имеющее вкуса и запаха. В его состав входят радиоизотопы (фтор-18, углерод-11) и биохимические соединения (чаще всего глюкоза).
Датчики ПЭТ фиксируют повышенный обмен РФП, как «горячую зону». КТ в это время делает множественные снимки, тем самым указывая точное место локализации патологии. Изображения, выполненные с применением радиофармпрепарата, накладываются поверх срезов, которые были получены при КТ.
Используя метод ПЭТ КТ, можно получить точную оценку строения органов и патологических процессов, узнать их характеристики. При КТ, УЗД и МРТ подобный анализ провести невозможно.
Главные причины ошибок
В основе ошибок ПЭТ КТ лежат следующие причины:
 параллельное существование еще одной патологии с аналогичными проявлениями;
параллельное существование еще одной патологии с аналогичными проявлениями;- низкое разрешение аппарата ПЭТ КТ;
- заболевание находится на ранней стадии развития;
- телодвижения пациента во время процедуры;
- неправильная подготовка к диагностике;
- присутствие на теле или одежде обследуемого предметов из металла;
- повышенный сахар в крови;
- передвижения пациента в момент распределения РПФ в организме;
- неправильное толкование срезов специалистами.
Как избежать постановки неправильного диагноза?
Для того, чтобы в результате обследования получить правильный диагноз, необходимо:
- правильно подготовиться к предстоящему процессу;
- заранее снять все предметы, в состав которых входит металл;
- не совершать никакой активности во время распределения контраста по организму и в период исследования;
- проинформировать врача о наличии серьезных заболеваний (например, сахарный диабет);
- проходить процедуру в специализированных центрах с высококвалифицированным персоналом и качественным оборудованием.
Поделитесь с друьями!
ПЭТ-КТ — это современный метод обследования, совмещающий позитронно-эмиссионную томографию (ПЭТ) и компьютерную томографию (КТ). Иногда метод называется просто ПЭТ. В его основе лежит регистрация гамма-излучения от введенного в организм радиофармпрепарата.

КАК ЧАСТО ОШИБАЕТСЯ ПЭТ-КТ, БЫВАЮТ ЛИ ОШИБКИ ПЭТ-КТ?
Вопрос важный, ведь это обследование проходят те, кому очень нужен точный диагноз!
Увы, ошибки диагностики при ПЭТ-КТ встречаются в определенном проценте случаев. Это обусловлено двумя факторами.
1. Объективный фактор, заключающийся в самой методике. В любом диагностическом методе, будь то КТ, МРТ или ПЭТ, изначально заложен определенный процент ошибок. Если мы возьмем какую-нибудь болезнь — например, рак молочной железы, то не все случаи рака молочной железы могут быть выявлены с помощью ПЭТ (это называется ложноотрицательный результат). Кроме того, иногда при отсутствии рака на снимках ПЭТ-КТ могут выявляться ее признаки (это называется ложноположительный результат). Есть несколько причин этого феномена: несовершенство аппаратуры, наличие сопутствующих болезней, имеющих сходную симптоматику, плохая выявляемость болезни на ранней стадии. Нужно отметить, что с каждым годом аппаратура ПЭТ-КТ становится все точнее, и поэтому процент ложных результатов постепенно уменьшается.
2. Субъективный фактор — более важный. Он обусловлен неверной трактовкой результатов ПЭТ-КТ. Врач, анализирующий снимки ПЭТ-КТ, может совершить ошибку и неправильно описать имеющиеся изменения! Нужно понимать, что любая аппаратура, даже самая современная — это всего лишь «железо» для получения изображений. А расшифровка изображений ПЭТ-КТ — это дело врача-радиолога, и от его опыта и знаний напрямую зависит достоверность диагностики.
Диагностические ошибки ПЭТ-КТ, обусловленные неправильной расшифровкой снимков, встречаются не так уж редко. В России этот метод только начинает развиваться. Количество квалифицированных специалистов по ПЭТ пока ограничено, и почти все они работают в нескольких профильных центрах в крупных городах (например, Институт мозга человека РАН). Встречается ситуация, когда в лечебное учреждение поставили новое оборудование ПЭТ, а опытного специалиста для работы на нем не найти. Это касается как государственных, так и частных центров ПЭТ.
В этих случаях не нужно отчаиваться. Если у вас или ваших лечащих врачей после проведения ПЭТ-КТ остаются вопросы по диагнозу, снимки можно проконсультировать у более опытного специалиста. Сегодняшняя ситуация такова, что такой специалист не обязательно должен жить в том же городе — результаты можно переслать ему по сети интернет.
ПЭТ-КТ В ДИАГНОСТИКЕ РАКА — КАК ИЗБЕЖАТЬ ОШИБОК?
Второе мнение по ПЭТ-КТ — распространенная услуга во всем мире. Для онкологических пациентов крайне важно не ошибиться с диагнозом — например, знать точную стадию рака, количество пораженных лимфатических узлов, достоверно исключить метастазы в печень, кости и другие органы. Пересмотр ПЭТ-КТ опытным врачом-диагностом — это способ свести риск ошибки к минимуму.

Может ли ПЭТ-КТ дать ошибку по метастазам? На примере — очаги накопления радиофармпрепарата [18F]-дезоксиглюкозы в подмышечной области и вдоль позвоночника, которые первоначально были расценены как метастазы в лимфатические узлы. Более внимательный анализ в ходе второго мнения показал, что эти очаги не являются злокачественной опухолью, а представляют собой участки бурого жира, отличающиеся повышенной метаболической активностью. На этом примере мы видим, как пересмотр результатов ПЭТ-КТ помог сделать диагноз менее опасным.
Заказать второе мнение по ПЭТ-КТ можно из любого города России, не выходя из дома. Врачи-радиологи Санкт-Петербургского Института мозга человека обладают огромным опытом в расшифровке ПЭТ-КТ головного мозга с метионином, ПЭТ-КТ всего тела с глюкозой, и других видов ПЭТ. Достаточно отправить им снимки через систему Национальной телерадиологической сети, и получить в течение суток подробное и квалифицированное заключение. Пересмотр результатов ПЭТ осуществляется под руководством З. Л. Бродской — корифея отечественной радиологии, многолетнего соратника знаменитой Н. П. Бехтеревой.

ПЭТ-КТ при раке молочной железы. Тщательный анализ характеристик накопления РФП (SUV) в подмышечных лимфатических узлах помогают различить метастазы и доброкачественное увеличение узлов.
Читать подробнее о Втором мнении
Читать подробнее о телемедицине

Кандидат медицинских наук, член Европейского общества радиологов
[18F] 2-fluoro-2deoxy-D-glucose (18F-FDG) PET-CT imaging has become firmly established as an excellent clinical tool in the diagnosis, staging and restaging of cancer. 18F-FDG (a glucose analog) is taken up by cells via glucose transporter proteins. The glucose analog then undergoes phosphorylation by hexokinase to FDG-6 phosphate. Unlike glucose, FDG-phosphate does not undergo further metabolism and so becomes trapped in the cell as the cell membrane is impermeable to FDG-6 phosphate following phosphorylation [1].
Malignant tumors have a higher metabolic rate and generally express higher numbers of specific membrane transporter proteins than normal cells. This results in increased uptake of 18F-FDG by tumor cells and forms the basis of FDG-PET imaging [2]. Glucose however acts as a basic energy substrate for many tissues, and so 18F-FDG activity can be seen both physiologically and in benign conditions. In addition, not all tumors take up FDG [3–5]. The challenge for the interpreting physician is to recognize these entities and avoid the many pitfalls associated with 18F-FDG PET-CT imaging.
In this article we discuss false-positive and false-negative 18F-FDG PET-CT findings, common and atypical physiological sites of FDG uptake, and benign pathological causes of FDG uptake. We will focus on post-treatment conditions that can result in false-positive findings. We will highlight the importance of utilizing the CT component of the study, not only for attenuation correction but also in the interpretation of the study. The CT component of 18F-FDG PET-CT imaging can provide high-resolution anatomical information, which enables more accurate staging and assessment. For the purposes of this article, we refer to the descriptive terms “false-positive” and “false-negative” findings in the context of oncology imaging.
The authors acknowledge that there are recognized causes of FDG uptake that are not related to malignancy; however in this paper we refer to false-positive findings as FDG uptake that is not tumor related.
Patient preparation
Tumor uptake of FDG is reduced in the presence of raised serum glucose as glucose competes with FDG for uptake by the membrane transporter proteins. In order to prevent false-negative results, it is necessary for the patient to fast for at least 4–6 h prior to the procedure [6]. Induction of a euglycamic hypoinsulinaemic state also serves to reduce the uptake of glucose by the myocardium and skeletal muscle. In the fasting state, the decreased availability of glucose results in predominant metabolism of fatty acids by the myocardium. This reduces the intensity of myocardial uptake and prevents masking of metastatic disease within the mediastinum [6].
The radiotracer is administered intravenously (dose dependent on both the count rate capability of the system used and the patient’s weight), and the patient is left resting in a comfortable position during the uptake phase (60–90 min). Patient discomfort and anxiety can result in increased uptake in skeletal muscles of the neck and paravertebral regions. Muscular contraction immediately prior to or following injection can result in increased FDG activity in major muscle groups [6].
Patients are placed in a warm, quiet room with little stimulation, as speech during the uptake phase is associated with increased FDG uptake in the laryngeal muscles [7].
At our institution we perform the CT component with arms up except for head and neck studies where the arms are placed down by the side. This minimizes artifacts on CT. Depending on the type of cancer, oral contrast to label the bowel and intravenous contrast may also be given. The CT is performed with a full dose similar to a diagnostic CT, and lungs are analyzed following reconstruction with a lung algorithm. The PET scan is performed with 3–4 min per bed position; however the time per bed position will vary in different centers depending on both the dose of FDG administered and the specifications of the camera used for image acquisition. It is beyond the scope of this article to provide detailed procedure guidelines for 18F-FDG PET-CT imaging, and for this purpose we refer the reader to a comprehensive paper by Boellaard et al. [8].
Technical causes of false positives
Misregistration artifact
The evaluation of pulmonary nodules provides a unique challenge for combined PET-CT scanning due to differences in breathing patterns between CT and PET acquisition periods. CT imaging of the thorax is classically performed during a breath-hold; however PET images are acquired during tidal breathing, and this can contribute significantly to misregistration of pulmonary nodules on fused PET-CT images. Misregistration is particularly evident at the lung bases, which can lead to difficulty differentiating pulmonary nodules from focal liver lesions (Fig. 1) [9].
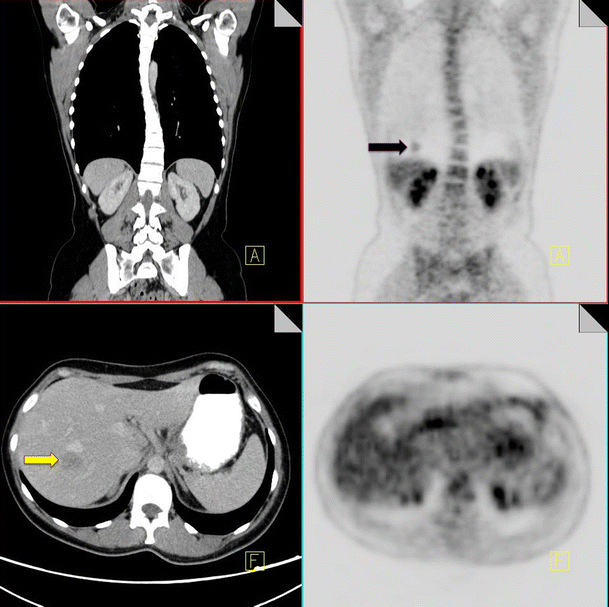
18F-FDG PET-CT performed in a 65-year-old male with colorectal cancer. On the coronal PET images, a focus of increased FDG uptake is seen at the right lung base (black arrow). Contrast CT does not show any pulmonary nodules but does demonstrate a liver metastasis in the superior aspect of the right lobe of the liver (yellow arrow)
Full size image
Acquiring CT imaging of the thorax during quiet respiration can help to minimize misregistration artifacts. It is also important to correlate your PET and CT findings by scrolling up and down to make sure that lesions match.
Injected clot
A further diagnostic pitfall in staging of intrathoracic disease can be caused by injected clot. Injection of radioactive clot following blood withdrawal into the syringe at the time of radiotracer administration can result in pulmonary hotspots [10]. The absence of a CT correlate for a pulmonary hotspot should raise the possibility of injected clot; however this is a diagnosis of exclusion, and it is important to carefully evaluate the adjacent slices to ensure the increased radiotracer activity does not relate to misregistration of a pulmonary nodule or hilar lymph node. The area of abnormal radiotracer uptake should also be closely evaluated on subsequent restaging CT to ensure there has been no interval development of an anatomical abnormality in the region of previously diagnosed injected clot (Fig. 2) [11].
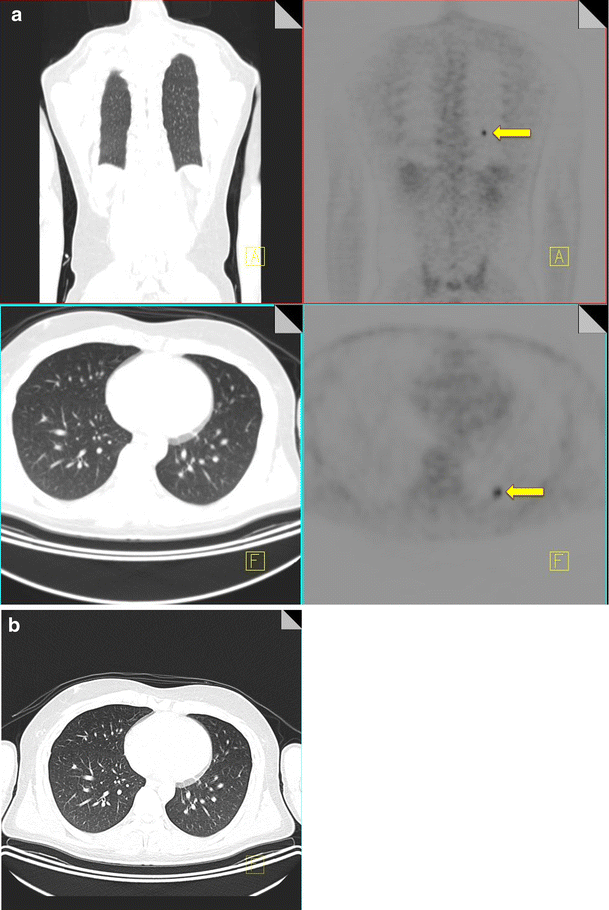
18F-FDG PET-CT performed in a 28-year-old male with an osteosarcoma of the femur. A focus of increased FDG uptake (yellow arrow) is identified in the left lower lobe with no CT correlate (a). A 3-month follow-up CT thorax again does not demonstrate any pulmonary nodules confirming that the uptake seen originally on the PET-CT was due to injected clot (b)
Full size image
Injection artifact
Leakage of radiotracer into the subcutaneous tissues at the injection site or tissued injection can result in subcutaneous tracking of FDG along lymphatic channels in the arm. This can result in spurious uptake in axillary nodes distal to the injection site [12]. Careful attention must be paid to the technical aspects of the study to ensure accurate staging. Injection at the side contralateral to the site of disease is advised where feasible to allow differentiation between artifactual and metastatic uptake, particularly in breast cancer patients. The side of injection should also be clearly documented during administration of radiotracer, and this information should be available to the reader in order to ensure pathological FDG uptake is not spuriously attributed to injection artifact (Fig. 3).
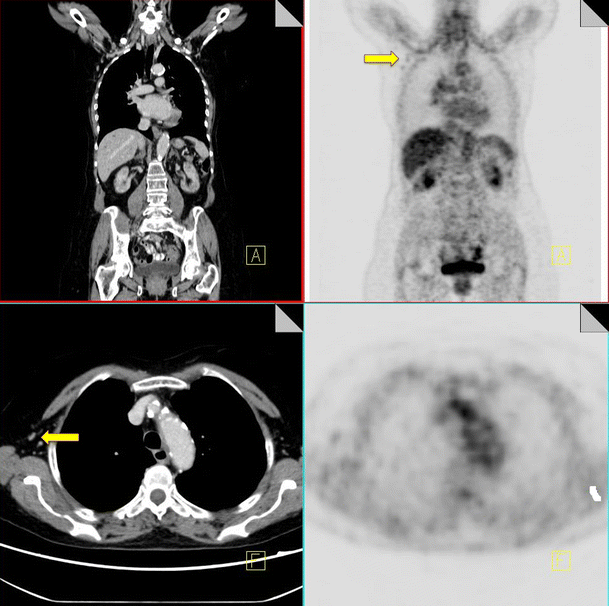
18F-FDG PET-CT performed in a 56-year-old woman with colorectal cancer. Some low grade FDG uptake is identified in non-enlarged right axillary nodes (yellow arrow) consistent with injection artifact
Full size image
Imaging of metallic implants
The use of CT for attenuation correction negates the need for traditional transmission attenuation correction, reducing scanning time. There are however technical factors relating to the use of CT imaging for attenuation correction, which lead to artefacts when imaging metal [9]. The presence of metal implants in the body produces streak artifact on CT imaging and degrades image quality. When CT images are used for attenuation correction, the presence of metal results in over attenuation of PET activity in this region and can result in artifactual ‘hot spots.’ Metal prostheses, dental fillings, indwelling ports and breast expanders and sometimes contrast media are common causes of streak artifact secondary to high photon absorption and can cause attenuation correction artifacts [9]. In order to avoid false positives, particularly when imaging metallic implants careful attenuation should be paid to the nonattenuation corrected images, which do not produce this artifact.
Sites of physiological FDG uptake
Physiological uptake in a number of organs is readily recognized and rarely confused with malignancy. These include cerebral tissue, the urinary system, liver and spleen. Approximately 20% of administered activity is renally excreted in the 2 h post-injection resulting in intense radiotracer activity in the renal collecting systems, ureters and bladder [13]. In order to minimize the intensity of renal activity, patients are advised to void prior to imaging. Moderate physiological FDG uptake is noted in the liver, spleen, GI tract and salivary glands. Uptake in the cecum and right colon tends to be higher than in the remainder of the colon due to the presence of glucose-avid lymphocytes [14].
Other sites of physiological FDG activity can be confused with malignancy. Examples include activity within brown fat, adrenal activity, uterus and ovaries.
Brown fat
FDG uptake in hyper-metabolic brown adipose tissue is well recognized as a potential source of false positive in 18F-FDG PET-CT imaging. The incidence of FDG uptake in brown fat has been reported as between 2.5–4% [15, 16].
Hypermetabolic brown fat is more commonly identified in children than in adults and is more prevalent in females than in males. It occurs more frequently in patients with low body mass index and in cold weather [15].
Glucose accumulation within brown fat is increased by sympathetic stimulation as brown fat is innervated by the sympathetic nervous system. In view of this, administration of oral propranolol is advised by some authors as it has been shown to reduce the uptake of FDG by brown fat [17]. This is not performed at our institution; however, attempts are made to reduce FDG uptake in brown fat by maintaining a warm ambient temperature and providing patients with blankets during the uptake phase.
The typical distribution of brown fat in a bilateral symmetric pattern in the supraclavicular and neck regions is rarely confused with malignancy. In cases where hypermetabolic brown fat is seen to surround lymph nodes, the CT images should be separately evaluated to allow morphological assessment of the lymph nodes. The classical CT features of pathological replacement of lymph nodes should be sought, namely increased short axis diameter, loss of the fatty hilum and loss of the normal concavity of the lymph node. If the morphology of the lymph node is entirely normal, malignancy can be confidently excluded and the increased uptake attributed to brown fat [18].
Atypical brown fat in the mediastinum can be misinterpreted as nodal metastases and has been identified in the paratracheal, paraoesophageal, prevascular regions, along the pericardium and in the interatrial septum. Extramediastinal sites of brown fat uptake include the paravertebral regions, perinephric, perihepatic and subdiaphragmatic regions and in the intraatrial septum [16].
The absence of an anatomical lesion on CT imaging in areas of FDG uptake should raise the possibility of brown fat to the reader. Careful evaluation of the CT images must be performed to confirm the presence of adipose tissue in the anatomical region correlating to the increased FDG activity on 18F-FDG PET before this activity be attributed to brown fat.
An awareness of the possibility of brown fat in atypical locations is vital to avoid overstaging, and correlation with CT imaging increases reader confidence in differentiating brown fat from malignancy (Fig. 4).
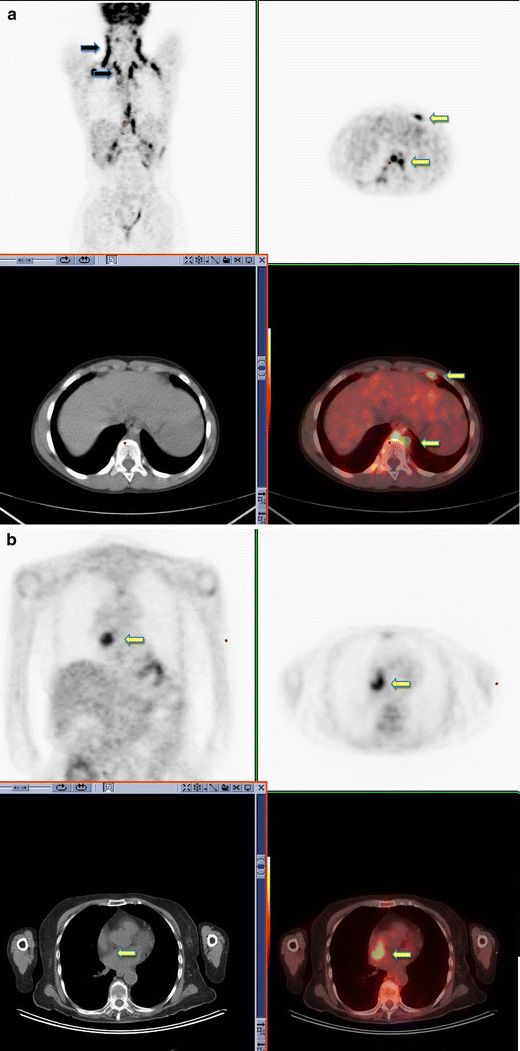
18F-FDG PET-CT surveillance scan performed in a 36-year-old male with a history of seminoma. Symmetrical uptake is noted in the neck, supraclavicular fossa and paravertebral regions consistent with typical appearance of brown fat activity (black arrow). Brown fat uptake is also seen in the left supradiaphragmatic region and left paraoesophageal region (yellow arrow) (a). 18F-FDG PET-CT performed in a 48-year-old male with a history of colorectal cancer. Increased FDG uptake is noted within brown fat associated with lipomatous hypertrophy of the intra-atrial septum (b)
Full size image
Uterine and ovarian uptake
In premenopausal women endometrial uptake of FDG varies cyclically and is increased both at ovulation and during the menstrual phase of the cycle with mean SUV values of 3.5–5 [19]. Endometrial uptake in postmenopausal women is abnormal and warrants further investigation; however benign explanations for increased FDG uptake include recent curettage, uterine fibroids and endometrial polyps [19].
Benign ovarian uptake of FDG in premenopausal women can be associated with ovulation. In postmenopausal women, ovarian uptake of FDG should be further investigated (Fig. 5).
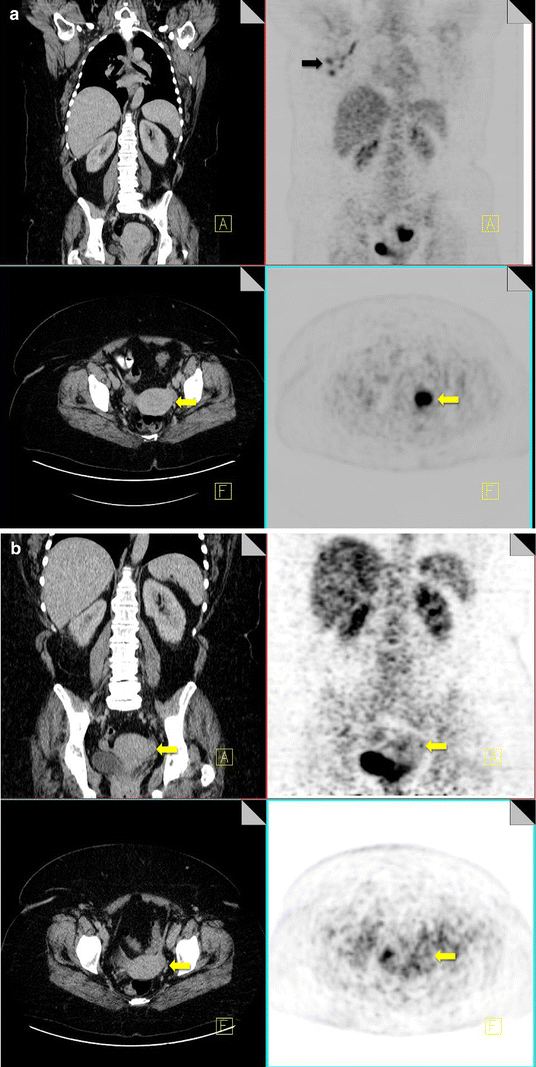
18F-FDG PET-CT performed in a 42-year-old premenopausal female with breast cancer. She was scanned during menstruation. FDG uptake is noted within metastatic right axillary nodes (black arrow). Increased FDG uptake is also noted within the endometrial canal of the uterus (yellow arrow), which is thickened on CT, consistent with active menstruation (a). 18F-FDG PET-CT performed in the same 42-year-old woman at a different stage in her menstrual cycle showing resolution of the previously identified uterine uptake (yellow arrow) (b)
Full size image
Adrenal uptake
18F-FDG PET imaging is commonly used for evaluation of adrenal masses in patients with diagnosed malignancies. Similarly incidental adrenal lesions are commonly identified on staging 18F-FDG PET-CT imaging. The positive predictive value of 18F-FDG PET-CT evaluation of adrenal lesions has been reported as high as 95% with a similarly high negative predictive value of 94% [20].
Causes of false-positive adrenal lesions include angiomyolipoma, adrenal hyperplasia and adrenal adenomas (up to 5%) [21, 24]. FDG activity greater than that of the liver is generally associated with malignancy; however benign lesions have been reported with greater activity than liver [21].
Evaluation of the CT component can provide additional diagnostic information with identification of HU attenuation values of <10 on noncontrast CT for adrenal adenomas or fat-containing myelolipomata [21].
Symmetrical intense FDG activity with no identifiable abnormality on CT is associated with benign physiological FDG uptake (Fig. 6).
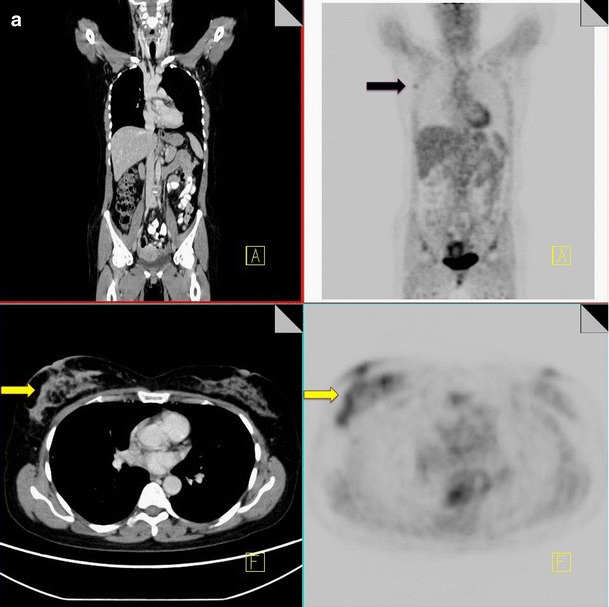
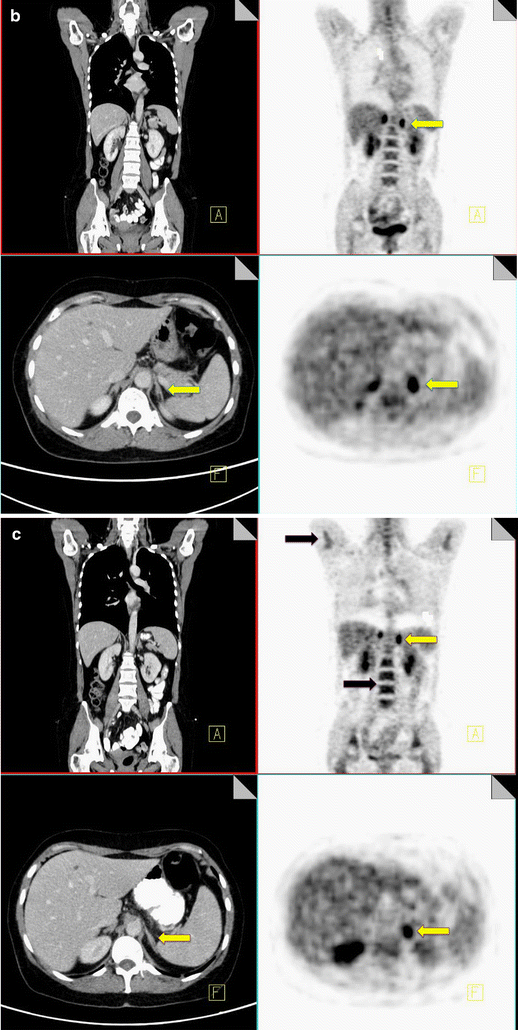
18F-FDG PET-CT performed in a 50-year-old woman with inflammatory breast cancer. Diffuse increased FDG uptake is noted within the right breast (yellow arrow) and in a right axillary node (black arrow), consistent with malignancy (a). Increased symmetrical uptake is also noted within both adrenal glands with no abnormal correlate on CT (yellow arrow) (b). Post-chemotherapy PET-CT performed 5 months later demonstrates resolution of the activity within the breast, increased uptake in the bone marrow consistent with post treatment effect (black arrow) and persistent increased uptake in the adrenal glands (yellow arrow), confirming benign physiological activity (c)
Full size image
Thyroid uptake
Thyroid uptake is incidentally identified on 18F-FDG PET imaging with a frequency of almost 4%, with a diffuse uptake pattern in roughly half of cases and a focal pattern in the remainder [22]. The majority of diffuse uptake represents chronic thyroiditis, multinodular goiter or Graves’ disease, whereas focal uptake is associated with a risk of malignancy that ranges from 30.9–63.6% in published studies [22, 23]. Focal thyroid uptake requires further investigation with ultrasound and tissue biopsy.
Uptake in the gastrointestinal tract
The pattern of physiological uptake within the GI tract is highly variable. Low-grade linear uptake is likely related to smooth muscle activity and swallowed secretions. More focal increased uptake in the distal esophagus is sometimes seen with Barrett’s esophagus. In view of this, referral for OGD may be reasonable in cases of increased uptake in the distal esophagus [14, 24].
The typical pattern of FDG uptake in the stomach is of low-grade activity in a J-shaped configuration. Small bowel typically demonstrates mild heterogeneous uptake throughout. Common pitfalls of small bowel evaluation relate to spuriously high uptake in underdistened or overlapping loops of bowel [14, 25].
Within the colon, FDG uptake is highly variable, however can be quite avid particularly in the cecum, right colon and rectosigmoid regions. Focal areas of FDG activity within the colon that are of greater intensity than background liver uptake should raise the suspicion of a colonic neoplasm (Fig. 7) [25, 26].
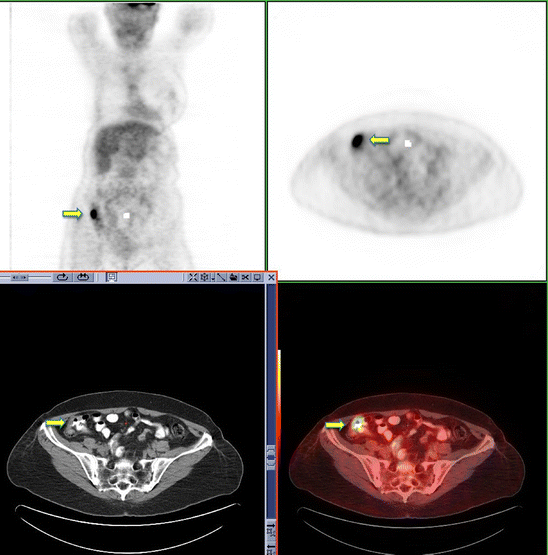
18F-FDG PET-CT restaging scan performed in a 65-year-old female with a history of breast cancer. Incidental focal uptake is identified in the ascending colon where some abnormal thickening is seen on the CT component (yellow arrow). Colonoscopy confirmed the presence of a T3 adenocarcinoma
Full size image
In a review of over 3,000 patients’ focal areas of abnormal FDG uptake within the gastrointestinal tract (GIT) were identified in 3% of cases of staging 18F-FDG PET-CT studies.
Incidental malignant lesions were identified in 19% of these patients with pre-malignant lesions including adenomas in 42% of the patients [27]. In view of this endoscopy referral is recommended in the absence of a clear benign correlate for focal areas of avid uptake on CT imaging.
Treatment-related causes of false-positive uptake
There are a number of conditions that can occur in patients undergoing treatment for cancer. When imaging these patients to assess for response, we often see these treatment-related conditions. It is important to recognize the imaging features to avoid misdiagnosis.
Thymus/thymic hyperplasia
Thymic hyperplasia post-chemotherapy is a well-described phenomenon. It is generally seen in children and young adults at a median of 12 months post chemotherapy [28]. The presence of increased FDG uptake in the anterior mediastinum can be attributed to thymic hyperplasia by identification of a triangular soft tissue density seen retrosternally on CT with a characteristic bilobed anatomical appearance [29]. In the presence of thymic hyperplasia, there is generally preservation of the normal shape of the gland despite an increase in size [30].
Superior mediastinal extension of thymic tissue is an anatomical variant that has been described in children and young adults (Fig. 8).
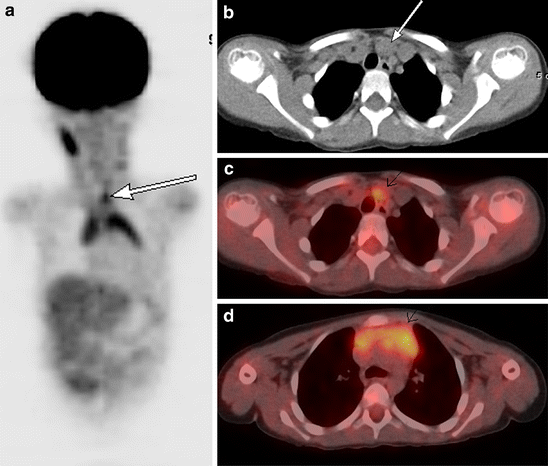
A 3.5-year-old boy with abdominal Burkitt’s lymphoma. Coronal 18F-FDG PET scan obtained 5 months after completion of treatment shows increased activity in the thymus in an inverted V configuration and in superior thymic extension (white arrow). Note physiologic activity within the right neck in the sternocleidomastoid muscle (a). Axial CT image from the same 18F-FDG PET-CT study performed 5 months after treatment shows a nodule (white arrow) anteromedial to the left brachiocephalic vein (b). Axial fusion image shows that the FDG activity in the superior mediastinum corresponds to this enlarged nodule anteromedial to left brachiocephalic vein (white arrow) (c). Axial fusion image shows increased activity in an enlarged thymus consistent with thymic hyperplasia (white arrow; standardized uptake value 3.0) of similar intensity to activity in superior mediastinum (d)
Full size image
It presents as a soft tissue nodule anteromedial to the left brachiocephalic vein and represents a remnant of thymic tissue along the path of migration in fetal life. In patients with thymic hyperplasia, a superior mediastinal nodule in this location may represent accessory thymic tissue. An awareness of this physiological variant is necessary to prevent misdiagnosis [28].
G-CSF changes
Granulocyte colony-stimulating factor is a glycoprotein hormone that regulates proliferation and differentiation of granulocyte precursors. It is used to accelerate recovery from chemotherapy-related neutropaenia in cancer patients. Intense increased FDG uptake is commonly observed in the bone marrow and spleen following GCSF therapy; however the bone marrow response to GCSF can be differentiated from pathological infiltration by its intense homogeneous nature without focally increased areas of FDG uptake. Increased FDG uptake attributable to GCSF uptake rapidly decreases following completion of therapy and generally resolves within a month (Fig. 9).
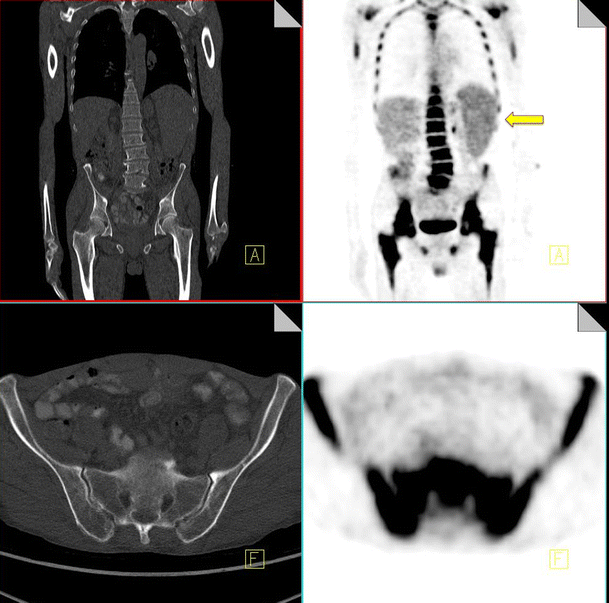
18F-FDG PET-CT performed in a 46-year-old male post four cycles of chemotherapy for lymphoma and 2 weeks post administration of G-CSF. Note the diffuse homogeneous increased uptake throughout the bone marrow and the increased uptake in the spleen (yellow arrow)
Full size image
Marked uptake in the bone marrow can also be seen following chemotherapy, reflecting marrow activation [31, 32].
Radiation pneumonitis
Inflammatory morphological changes in the radiation field post-irradiation of primary or metastatic lung tumor can result in false-positive diagnosis. Radiation pneumonitis typically occurs following high doses of external beam radiotherapy (>40 Gy). In the acute phase (1–8 weeks) radiation pneumonitis is characterized by ground-glass opacities and patchy consolidation. This can commonly lead to a misdiagnosis of infection. Chronic CT appearances of fibrosis and traction bronchiectasis in the radiation field allow correct interpretation of increased FDG uptake as radiation pneumonitis as opposed to disease recurrence [33, 34]. Other organs are also sensitive to radiation, and persistent uptake due to inflammatory change can persist for up to 1 year. It is important to elicit a history of radiation from the patient and to correlate the increased uptake with the CT findings to avoid missing a disease recurrence (Fig. 10).
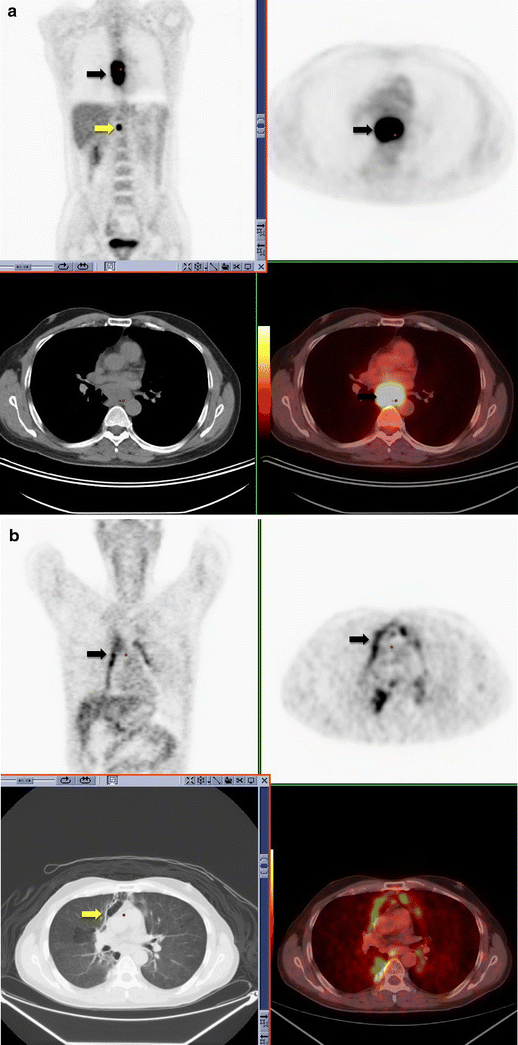
18F18-FDG PET-CT performed in a 52-year-old male with newly diagnosed esophageal carcinoma. Increased FDG uptake is identified within the esophagus (black arrow) and an upper abdominal lymph node (yellow arrow), consistent with malignancy (a). 18F18-FDG PET-CT performed 6 weeks post-completion of radiotherapy for esophageal carcinoma. Linear increased uptake is identified along the mediastinum in the radiation port (black arrow). This corresponds to areas of ground-glass change on CT (yellow arrow) consistent with acute radiation change (b)
Full size image
Infection
Bone marrow suppression places chemotherapy patients at increased risk of infection.
Inflammatory cells such as neutrophils and activated macrophages at the site of infection or inflammation actively accumulate FDG [35].
In the post-therapy setting it has been reported that up to 40% of FDG uptake occurs in non-tumor tissue [12]. Infection is one of the most common causes of false-positive 18F-FDG PET-CT findings post-chemotherapy. Chemotherapy patients are susceptible to a wide variety of infections, including upper respiratory chest infections, pneumonia, colitis and cholecystitis. Reactivation of tuberculous infection can occur in immunocompromised patients post,chemotherapy, and correlation with CT imaging can prevent misdiagnosis in suspected cases.
Atypical infections such as cryptococcosis and pneumocystis can also present as false-positives on FDG imaging (Fig. 11) [36].
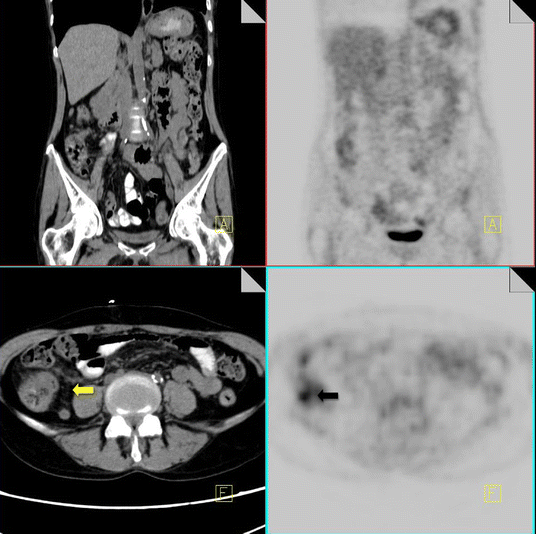
18F-FDG PET-CT performed in a 57-year-old male 2 weeks following chemotherapy for lung cancer. Increased FDG uptake is noted within the cecum (black arrow). On CT there is some thickening of the cecal wall and stranding of the pericecal fat (yellow arrow) consistent with typhilits
Full size image
Surgery and radiotherapy
There are inherent challenges in the interpretation of 18F-FDG PET-CT imaging in the postoperative patient. Non-tumor-related uptake of FDG is frequently identified in post-operative wound sites, at colostomy sites or at the site of post-radiation inflammatory change. 18F-FDG PET-CT imaging during the early postoperative/post-radiotherapy period may result in overstaging of patients because of non-neoplastic uptake of FDG [12]. Careful evaluation of the CT component in this setting is vital as CT imaging can provide valuable additional information regarding benign inflammatory conditions commonly encountered in the postoperative setting such as abscesses or wound infection. These conditions are often readily apparent on CT, particularly when oral and/or IV contrast CT is administered.
The reader should also bear in mind that avid uptake of FDG at postoperative/post radiotherapy sites may mask malignant FDG uptake in neighboring structures. In order to minimize non-tumoral uptake of FDG, it is advisable to allow at least 6 weeks post-surgery or completion of radiotherapy prior to performing staging 18F-FDG PET-CT [24].
Talc pleurodesis
Talc pleurodesis is a commonly performed procedure for the treatment of persistent pneumothorax or pleural effusion. The fibrotic/inflammatory reaction results in increased FDG uptake on 18F-FDG PET imaging with corresponding high-density areas of pleural thickening on CT. SUV values of between 2–16.3 have been seen years after the procedure [37].
When increased FDG uptake is indentified in the pleural space in a patient with a known history of pleurodesis, correlation with CT is recommended to detect pleural thickening of increased attenuation that suggests talc rather than tumor.
It is extremely important that a comprehensive history with relevant surgical interventions is available to the reader in order to ensure accurate diagnosis and staging (Fig. 12).
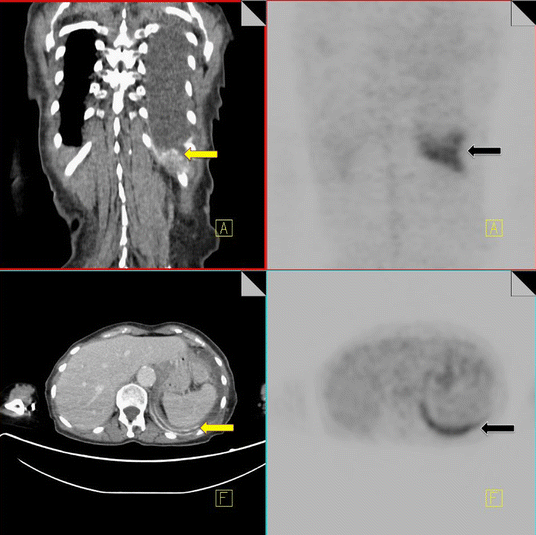
18F-FDG PET-CT performed in a 69-year-old male with a history of non-Hodgkin’s lymphoma. The patient had a previous talc pleurodesis for a persistent left pleural effusion. Increased FDG activity is identified within the left pleura (black arrow). CT demonstrates a pleural effusion with high density material along the left pleural surface consistent with talc (yellow arrow)
Full size image
Flare phenomenon
Bone healing is mediated by osteoblasts, and an early increase in osteoblast activity on successful treatment of metastatic disease has been described [38]. “Bone flare” refers to a disproportionate increase in bone lesion activity on isotope bone scan despite evidence of a therapeutic response to treatment in other lesions and has been well described in breast, prostate and lung tumors. ‘Flare phenomenon’ has also been described on 18F-FDG PET-CT in patients with lung and breast cancer who are receiving chemotherapy [39].
Differentiating between increased FDG uptake due to flare response and true disease progression may not be possible in the early post-treatment studies. While it is recognized that bone flare is a rare phenomenon, an increase in baseline skeletal activity and appearance of new bone lesions despite apparent response or stable disease elsewhere should be interpreted with caution to avoid erroneously suggesting progressive disease.
Osteonecrosis
Osteonecrosis or avascular necrosis has been well described as a complication of combination chemotherapy treatment, especially where it includes intermittent high-dose corticosteroids (e.g., lymphoma patients) [40]. Commonly encountered sites include the hip and less frequently the proximal humerus. Occasionally we can see a discrete entity known as jaw osteonecrosis. Patients receiving IV bisphosphonates for the management of bone metastases are at an increased risk of developing this [41]. The development of osteonecrosis in the mandible is frequently preceded by tooth extraction. Radiographic findings that may be visualized on CT include osteosclerosis, dense woven bone, thickened lamina dura and sub-periosteal bone deposition [42]. FDG uptake can be seen in areas of osteonecrosis (Fig. 13).
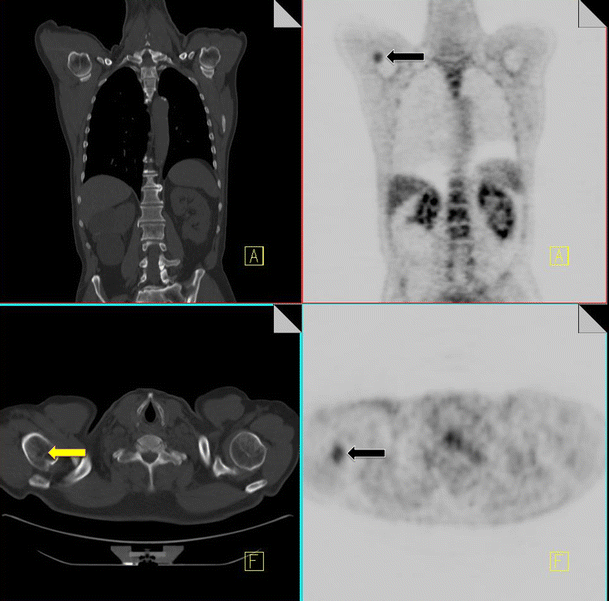
18F-FDG PET-CT performed in a 46-year-old gentleman with a history of non-Hodgkin’s lymphoma. Increased FDG uptake is identified in the right proximal humerus (black arrow). CT of the area demonstrates a corresponding vague area of sclerosis (yellow arrow). Biopsy of the area yielded osteonecrosis with no evidence of metastatic disease
Full size image
Insufficiency fractures
Pelvic insufficiency fractures have been described following irradiation for gynecological, colorectal, anal and prostate cancer. They commonly occur within 3–12 months post-radiation treatment, and osteoporosis is often a precipitating factor. FDG uptake in insufficiency fractures ranges from mild and diffuse to intense and heterogeneous. The maximum SUV values are variable with reported values of between 2.4–7.2 [43]. Differentiating insufficiency fractures from bone metastases can prove challenging; however they are often bilateral and occur in characteristic locations within the radiation field—sacral ala, pubic rami and iliac bones. Biopsy of insufficiency fractures can lead to irreparable damage and so careful correlation of 18F-FDG PET imaging with the CT component along with radiation history is vital for correct diagnosis. CT allows evaluation of the bone cortex and adjacent soft tissues, which can confirm the diagnosis of a pathological fracture or a metastatic deposit.
Follow-up of suspected insufficiency fractures demonstrates a reduction in FDG uptake over time (Fig. 14) [43].
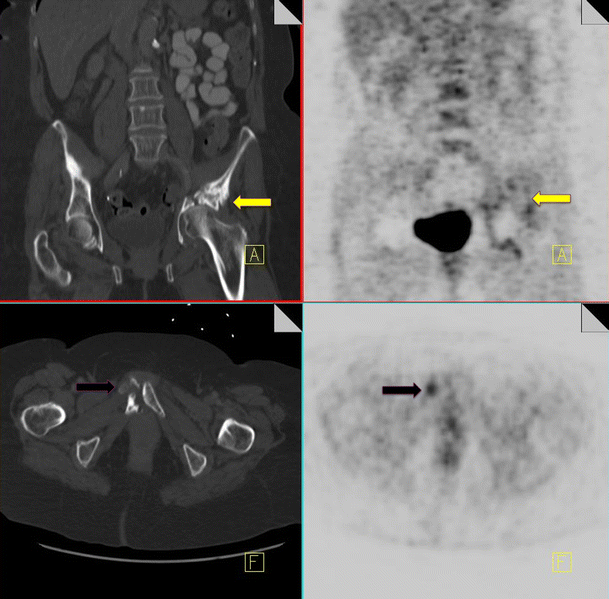
18F-FDG PET-CT performed in a 46-year-old female, 3 years post-chemo-radiation for cervical carcinoma. Low grade FDG uptake is identified in the left acetabulum and right pubic bone (black arrow). CT demonstrates pathological fractures in these areas consistent with insufficiency fractures (yellow arrow)
Full size image
Sarcoidosis
Sarcoidosis is a chronic multisystem disorder characterized by non-caseating granulomas and derangement of normal tissue architecture [36]. Sarcoidosis has been reported in association with a variety of malignancies either synchronously or post-chemotherapy. Aggregation of inflammatory cells post-chemotherapy is associated with accumulation of FDG, and the intensity of FDG uptake may correlate with disease activity [36].
When suspected disease recurrence presents with signs and symptoms compatible with sarcoidosis (i.e., mediastinal and bihilar lymphadenopathy), this must be excluded by clinical, radiological and pathological correlation to prevent mistreatment (Fig. 15).
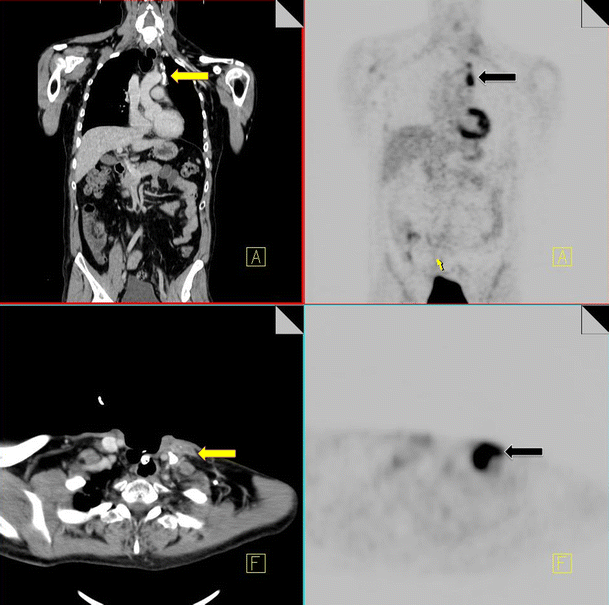
18F-FDG PET-CT performed in a 67-year-old male for restaging of laryngeal carcinoma. Increased FDG uptake is noted in the left lower neck and left mediastinum (black arrow). CT demonstrates lymphadenopathy in these areas (yellow arrow), some of which are calcified. Biopsy of the left lower neck node confirmed sarcoidosis
Full size image
FDG-PET negative tumors
There are a number of malignancies that can be FDG-PET negative. Examples include bronchoalveolar carcinoma and carcinoid tumors in the lung, renal cell carcinomas and hepatomas, mucinous tumors of the GIT and colon, and low grade lymphomas [3, 44–48]. Careful evaluation of the CT component of the study however will prevent a misdiagnosis (Fig. 16).
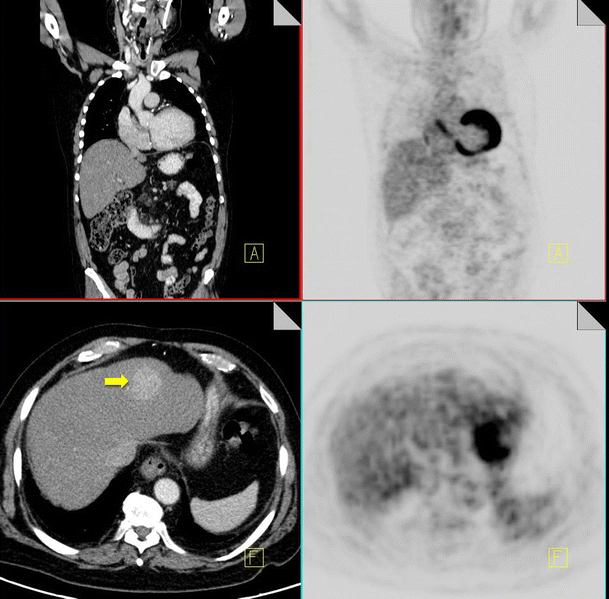
18F-FDG PET-CT performed in a 52-year-old female with breast cancer and chronic hepatitis. On the CT component a hyper-enhancing mass is identified in segment 4 of the liver (yellow arrow). No increased FDG activity is identified in this area on the PET component. Biopsy of the mass confirmed the diagnosis of a hepatocellular carcinoma
Full size image
Osteoblastic metastases
Bone metastases are diagnosed in up to 85% of patients with advanced breast cancer, leading to significant morbidity and mortality. Sclerotic bone metastases are commonly associated with breast carcinoma [49]. 18F-FDG PET imaging is superior to nuclear bone scan in detection of osteolytic breast metastases; however it commonly fails to diagnose osteoblastic or sclerotic metastases [50]. Review of bony windows on CT imaging allows identification of sclerotic metastases and ensures accurate staging of metastatic bone disease (Fig. 17).
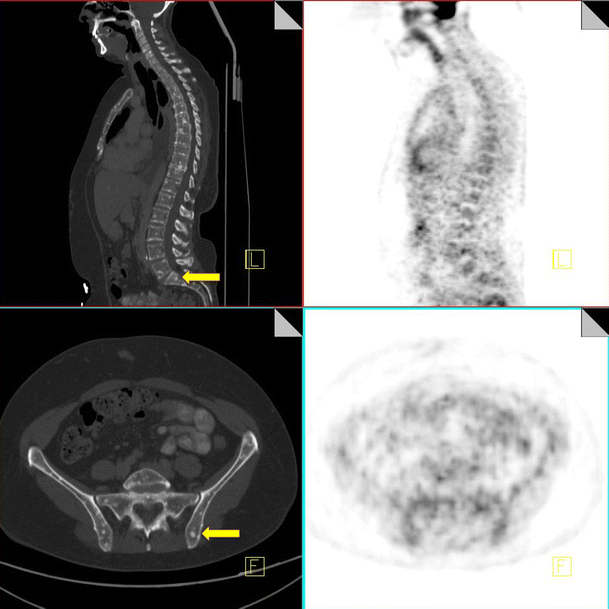
Staging 18F-FDG PET-CT performed in a 45-year-old female with newly diagnosed breast cancer. CT demonstrates multiple small sclerotic foci in the spine and pelvis (yellow arrow), consistent with bony metastases. These are FDG negative on the PET component of the study
Full size image
Discussion/conclusion
18F-FDG PET imaging has dramatically changed cancer staging, and findings of restaging studies commonly effect changes in treatment protocols. 18F-FDG however is not tumor specific. As interpreting physicians we need to be aware of these false positives and false negatives. In this review we have outlined atypical physiological sites of FDG uptake along with common causes of FDG uptake in benign pathological conditions, many of which are treatment related. With 18F-FDG PET-CT we have the advantage of two imaging modalities. The PET component gives us functional information and the CT, anatomical data. We have discussed the importance of dual-modality imaging and correlation with CT imaging of the above conditions. Furthermore CT imaging provides important diagnostic information in evaluation of tumors that poorly concentrate FDG. In light of the increased reliance of 18F-FDG PET-CT for cancer staging, it is vital that radiologists and nuclear medicine physicians be aware of pitfalls in 18F-FDG PET-CT imaging and correlate PET and CT components to avoid misdiagnosis, overstaging of disease and unnecessary biopsies.
[18F] 2-fluoro-2deoxy-D-glucose (18F-FDG) PET-CT imaging has become firmly established as an excellent clinical tool in the diagnosis, staging and restaging of cancer. 18F-FDG (a glucose analog) is taken up by cells via glucose transporter proteins. The glucose analog then undergoes phosphorylation by hexokinase to FDG-6 phosphate. Unlike glucose, FDG-phosphate does not undergo further metabolism and so becomes trapped in the cell as the cell membrane is impermeable to FDG-6 phosphate following phosphorylation [1].
Malignant tumors have a higher metabolic rate and generally express higher numbers of specific membrane transporter proteins than normal cells. This results in increased uptake of 18F-FDG by tumor cells and forms the basis of FDG-PET imaging [2]. Glucose however acts as a basic energy substrate for many tissues, and so 18F-FDG activity can be seen both physiologically and in benign conditions. In addition, not all tumors take up FDG [3–5]. The challenge for the interpreting physician is to recognize these entities and avoid the many pitfalls associated with 18F-FDG PET-CT imaging.
In this article we discuss false-positive and false-negative 18F-FDG PET-CT findings, common and atypical physiological sites of FDG uptake, and benign pathological causes of FDG uptake. We will focus on post-treatment conditions that can result in false-positive findings. We will highlight the importance of utilizing the CT component of the study, not only for attenuation correction but also in the interpretation of the study. The CT component of 18F-FDG PET-CT imaging can provide high-resolution anatomical information, which enables more accurate staging and assessment. For the purposes of this article, we refer to the descriptive terms “false-positive” and “false-negative” findings in the context of oncology imaging.
The authors acknowledge that there are recognized causes of FDG uptake that are not related to malignancy; however in this paper we refer to false-positive findings as FDG uptake that is not tumor related.
Patient preparation
Tumor uptake of FDG is reduced in the presence of raised serum glucose as glucose competes with FDG for uptake by the membrane transporter proteins. In order to prevent false-negative results, it is necessary for the patient to fast for at least 4–6 h prior to the procedure [6]. Induction of a euglycamic hypoinsulinaemic state also serves to reduce the uptake of glucose by the myocardium and skeletal muscle. In the fasting state, the decreased availability of glucose results in predominant metabolism of fatty acids by the myocardium. This reduces the intensity of myocardial uptake and prevents masking of metastatic disease within the mediastinum [6].
The radiotracer is administered intravenously (dose dependent on both the count rate capability of the system used and the patient’s weight), and the patient is left resting in a comfortable position during the uptake phase (60–90 min). Patient discomfort and anxiety can result in increased uptake in skeletal muscles of the neck and paravertebral regions. Muscular contraction immediately prior to or following injection can result in increased FDG activity in major muscle groups [6].
Patients are placed in a warm, quiet room with little stimulation, as speech during the uptake phase is associated with increased FDG uptake in the laryngeal muscles [7].
At our institution we perform the CT component with arms up except for head and neck studies where the arms are placed down by the side. This minimizes artifacts on CT. Depending on the type of cancer, oral contrast to label the bowel and intravenous contrast may also be given. The CT is performed with a full dose similar to a diagnostic CT, and lungs are analyzed following reconstruction with a lung algorithm. The PET scan is performed with 3–4 min per bed position; however the time per bed position will vary in different centers depending on both the dose of FDG administered and the specifications of the camera used for image acquisition. It is beyond the scope of this article to provide detailed procedure guidelines for 18F-FDG PET-CT imaging, and for this purpose we refer the reader to a comprehensive paper by Boellaard et al. [8].
Technical causes of false positives
Misregistration artifact
The evaluation of pulmonary nodules provides a unique challenge for combined PET-CT scanning due to differences in breathing patterns between CT and PET acquisition periods. CT imaging of the thorax is classically performed during a breath-hold; however PET images are acquired during tidal breathing, and this can contribute significantly to misregistration of pulmonary nodules on fused PET-CT images. Misregistration is particularly evident at the lung bases, which can lead to difficulty differentiating pulmonary nodules from focal liver lesions (Fig. 1) [9].

18F-FDG PET-CT performed in a 65-year-old male with colorectal cancer. On the coronal PET images, a focus of increased FDG uptake is seen at the right lung base (black arrow). Contrast CT does not show any pulmonary nodules but does demonstrate a liver metastasis in the superior aspect of the right lobe of the liver (yellow arrow)
Full size image
Acquiring CT imaging of the thorax during quiet respiration can help to minimize misregistration artifacts. It is also important to correlate your PET and CT findings by scrolling up and down to make sure that lesions match.
Injected clot
A further diagnostic pitfall in staging of intrathoracic disease can be caused by injected clot. Injection of radioactive clot following blood withdrawal into the syringe at the time of radiotracer administration can result in pulmonary hotspots [10]. The absence of a CT correlate for a pulmonary hotspot should raise the possibility of injected clot; however this is a diagnosis of exclusion, and it is important to carefully evaluate the adjacent slices to ensure the increased radiotracer activity does not relate to misregistration of a pulmonary nodule or hilar lymph node. The area of abnormal radiotracer uptake should also be closely evaluated on subsequent restaging CT to ensure there has been no interval development of an anatomical abnormality in the region of previously diagnosed injected clot (Fig. 2) [11].

18F-FDG PET-CT performed in a 28-year-old male with an osteosarcoma of the femur. A focus of increased FDG uptake (yellow arrow) is identified in the left lower lobe with no CT correlate (a). A 3-month follow-up CT thorax again does not demonstrate any pulmonary nodules confirming that the uptake seen originally on the PET-CT was due to injected clot (b)
Full size image
Injection artifact
Leakage of radiotracer into the subcutaneous tissues at the injection site or tissued injection can result in subcutaneous tracking of FDG along lymphatic channels in the arm. This can result in spurious uptake in axillary nodes distal to the injection site [12]. Careful attention must be paid to the technical aspects of the study to ensure accurate staging. Injection at the side contralateral to the site of disease is advised where feasible to allow differentiation between artifactual and metastatic uptake, particularly in breast cancer patients. The side of injection should also be clearly documented during administration of radiotracer, and this information should be available to the reader in order to ensure pathological FDG uptake is not spuriously attributed to injection artifact (Fig. 3).

18F-FDG PET-CT performed in a 56-year-old woman with colorectal cancer. Some low grade FDG uptake is identified in non-enlarged right axillary nodes (yellow arrow) consistent with injection artifact
Full size image
Imaging of metallic implants
The use of CT for attenuation correction negates the need for traditional transmission attenuation correction, reducing scanning time. There are however technical factors relating to the use of CT imaging for attenuation correction, which lead to artefacts when imaging metal [9]. The presence of metal implants in the body produces streak artifact on CT imaging and degrades image quality. When CT images are used for attenuation correction, the presence of metal results in over attenuation of PET activity in this region and can result in artifactual ‘hot spots.’ Metal prostheses, dental fillings, indwelling ports and breast expanders and sometimes contrast media are common causes of streak artifact secondary to high photon absorption and can cause attenuation correction artifacts [9]. In order to avoid false positives, particularly when imaging metallic implants careful attenuation should be paid to the nonattenuation corrected images, which do not produce this artifact.
Sites of physiological FDG uptake
Physiological uptake in a number of organs is readily recognized and rarely confused with malignancy. These include cerebral tissue, the urinary system, liver and spleen. Approximately 20% of administered activity is renally excreted in the 2 h post-injection resulting in intense radiotracer activity in the renal collecting systems, ureters and bladder [13]. In order to minimize the intensity of renal activity, patients are advised to void prior to imaging. Moderate physiological FDG uptake is noted in the liver, spleen, GI tract and salivary glands. Uptake in the cecum and right colon tends to be higher than in the remainder of the colon due to the presence of glucose-avid lymphocytes [14].
Other sites of physiological FDG activity can be confused with malignancy. Examples include activity within brown fat, adrenal activity, uterus and ovaries.
Brown fat
FDG uptake in hyper-metabolic brown adipose tissue is well recognized as a potential source of false positive in 18F-FDG PET-CT imaging. The incidence of FDG uptake in brown fat has been reported as between 2.5–4% [15, 16].
Hypermetabolic brown fat is more commonly identified in children than in adults and is more prevalent in females than in males. It occurs more frequently in patients with low body mass index and in cold weather [15].
Glucose accumulation within brown fat is increased by sympathetic stimulation as brown fat is innervated by the sympathetic nervous system. In view of this, administration of oral propranolol is advised by some authors as it has been shown to reduce the uptake of FDG by brown fat [17]. This is not performed at our institution; however, attempts are made to reduce FDG uptake in brown fat by maintaining a warm ambient temperature and providing patients with blankets during the uptake phase.
The typical distribution of brown fat in a bilateral symmetric pattern in the supraclavicular and neck regions is rarely confused with malignancy. In cases where hypermetabolic brown fat is seen to surround lymph nodes, the CT images should be separately evaluated to allow morphological assessment of the lymph nodes. The classical CT features of pathological replacement of lymph nodes should be sought, namely increased short axis diameter, loss of the fatty hilum and loss of the normal concavity of the lymph node. If the morphology of the lymph node is entirely normal, malignancy can be confidently excluded and the increased uptake attributed to brown fat [18].
Atypical brown fat in the mediastinum can be misinterpreted as nodal metastases and has been identified in the paratracheal, paraoesophageal, prevascular regions, along the pericardium and in the interatrial septum. Extramediastinal sites of brown fat uptake include the paravertebral regions, perinephric, perihepatic and subdiaphragmatic regions and in the intraatrial septum [16].
The absence of an anatomical lesion on CT imaging in areas of FDG uptake should raise the possibility of brown fat to the reader. Careful evaluation of the CT images must be performed to confirm the presence of adipose tissue in the anatomical region correlating to the increased FDG activity on 18F-FDG PET before this activity be attributed to brown fat.
An awareness of the possibility of brown fat in atypical locations is vital to avoid overstaging, and correlation with CT imaging increases reader confidence in differentiating brown fat from malignancy (Fig. 4).

18F-FDG PET-CT surveillance scan performed in a 36-year-old male with a history of seminoma. Symmetrical uptake is noted in the neck, supraclavicular fossa and paravertebral regions consistent with typical appearance of brown fat activity (black arrow). Brown fat uptake is also seen in the left supradiaphragmatic region and left paraoesophageal region (yellow arrow) (a). 18F-FDG PET-CT performed in a 48-year-old male with a history of colorectal cancer. Increased FDG uptake is noted within brown fat associated with lipomatous hypertrophy of the intra-atrial septum (b)
Full size image
Uterine and ovarian uptake
In premenopausal women endometrial uptake of FDG varies cyclically and is increased both at ovulation and during the menstrual phase of the cycle with mean SUV values of 3.5–5 [19]. Endometrial uptake in postmenopausal women is abnormal and warrants further investigation; however benign explanations for increased FDG uptake include recent curettage, uterine fibroids and endometrial polyps [19].
Benign ovarian uptake of FDG in premenopausal women can be associated with ovulation. In postmenopausal women, ovarian uptake of FDG should be further investigated (Fig. 5).

18F-FDG PET-CT performed in a 42-year-old premenopausal female with breast cancer. She was scanned during menstruation. FDG uptake is noted within metastatic right axillary nodes (black arrow). Increased FDG uptake is also noted within the endometrial canal of the uterus (yellow arrow), which is thickened on CT, consistent with active menstruation (a). 18F-FDG PET-CT performed in the same 42-year-old woman at a different stage in her menstrual cycle showing resolution of the previously identified uterine uptake (yellow arrow) (b)
Full size image
Adrenal uptake
18F-FDG PET imaging is commonly used for evaluation of adrenal masses in patients with diagnosed malignancies. Similarly incidental adrenal lesions are commonly identified on staging 18F-FDG PET-CT imaging. The positive predictive value of 18F-FDG PET-CT evaluation of adrenal lesions has been reported as high as 95% with a similarly high negative predictive value of 94% [20].
Causes of false-positive adrenal lesions include angiomyolipoma, adrenal hyperplasia and adrenal adenomas (up to 5%) [21, 24]. FDG activity greater than that of the liver is generally associated with malignancy; however benign lesions have been reported with greater activity than liver [21].
Evaluation of the CT component can provide additional diagnostic information with identification of HU attenuation values of <10 on noncontrast CT for adrenal adenomas or fat-containing myelolipomata [21].
Symmetrical intense FDG activity with no identifiable abnormality on CT is associated with benign physiological FDG uptake (Fig. 6).


18F-FDG PET-CT performed in a 50-year-old woman with inflammatory breast cancer. Diffuse increased FDG uptake is noted within the right breast (yellow arrow) and in a right axillary node (black arrow), consistent with malignancy (a). Increased symmetrical uptake is also noted within both adrenal glands with no abnormal correlate on CT (yellow arrow) (b). Post-chemotherapy PET-CT performed 5 months later demonstrates resolution of the activity within the breast, increased uptake in the bone marrow consistent with post treatment effect (black arrow) and persistent increased uptake in the adrenal glands (yellow arrow), confirming benign physiological activity (c)
Full size image
Thyroid uptake
Thyroid uptake is incidentally identified on 18F-FDG PET imaging with a frequency of almost 4%, with a diffuse uptake pattern in roughly half of cases and a focal pattern in the remainder [22]. The majority of diffuse uptake represents chronic thyroiditis, multinodular goiter or Graves’ disease, whereas focal uptake is associated with a risk of malignancy that ranges from 30.9–63.6% in published studies [22, 23]. Focal thyroid uptake requires further investigation with ultrasound and tissue biopsy.
Uptake in the gastrointestinal tract
The pattern of physiological uptake within the GI tract is highly variable. Low-grade linear uptake is likely related to smooth muscle activity and swallowed secretions. More focal increased uptake in the distal esophagus is sometimes seen with Barrett’s esophagus. In view of this, referral for OGD may be reasonable in cases of increased uptake in the distal esophagus [14, 24].
The typical pattern of FDG uptake in the stomach is of low-grade activity in a J-shaped configuration. Small bowel typically demonstrates mild heterogeneous uptake throughout. Common pitfalls of small bowel evaluation relate to spuriously high uptake in underdistened or overlapping loops of bowel [14, 25].
Within the colon, FDG uptake is highly variable, however can be quite avid particularly in the cecum, right colon and rectosigmoid regions. Focal areas of FDG activity within the colon that are of greater intensity than background liver uptake should raise the suspicion of a colonic neoplasm (Fig. 7) [25, 26].

18F-FDG PET-CT restaging scan performed in a 65-year-old female with a history of breast cancer. Incidental focal uptake is identified in the ascending colon where some abnormal thickening is seen on the CT component (yellow arrow). Colonoscopy confirmed the presence of a T3 adenocarcinoma
Full size image
In a review of over 3,000 patients’ focal areas of abnormal FDG uptake within the gastrointestinal tract (GIT) were identified in 3% of cases of staging 18F-FDG PET-CT studies.
Incidental malignant lesions were identified in 19% of these patients with pre-malignant lesions including adenomas in 42% of the patients [27]. In view of this endoscopy referral is recommended in the absence of a clear benign correlate for focal areas of avid uptake on CT imaging.
Treatment-related causes of false-positive uptake
There are a number of conditions that can occur in patients undergoing treatment for cancer. When imaging these patients to assess for response, we often see these treatment-related conditions. It is important to recognize the imaging features to avoid misdiagnosis.
Thymus/thymic hyperplasia
Thymic hyperplasia post-chemotherapy is a well-described phenomenon. It is generally seen in children and young adults at a median of 12 months post chemotherapy [28]. The presence of increased FDG uptake in the anterior mediastinum can be attributed to thymic hyperplasia by identification of a triangular soft tissue density seen retrosternally on CT with a characteristic bilobed anatomical appearance [29]. In the presence of thymic hyperplasia, there is generally preservation of the normal shape of the gland despite an increase in size [30].
Superior mediastinal extension of thymic tissue is an anatomical variant that has been described in children and young adults (Fig. 8).

A 3.5-year-old boy with abdominal Burkitt’s lymphoma. Coronal 18F-FDG PET scan obtained 5 months after completion of treatment shows increased activity in the thymus in an inverted V configuration and in superior thymic extension (white arrow). Note physiologic activity within the right neck in the sternocleidomastoid muscle (a). Axial CT image from the same 18F-FDG PET-CT study performed 5 months after treatment shows a nodule (white arrow) anteromedial to the left brachiocephalic vein (b). Axial fusion image shows that the FDG activity in the superior mediastinum corresponds to this enlarged nodule anteromedial to left brachiocephalic vein (white arrow) (c). Axial fusion image shows increased activity in an enlarged thymus consistent with thymic hyperplasia (white arrow; standardized uptake value 3.0) of similar intensity to activity in superior mediastinum (d)
Full size image
It presents as a soft tissue nodule anteromedial to the left brachiocephalic vein and represents a remnant of thymic tissue along the path of migration in fetal life. In patients with thymic hyperplasia, a superior mediastinal nodule in this location may represent accessory thymic tissue. An awareness of this physiological variant is necessary to prevent misdiagnosis [28].
G-CSF changes
Granulocyte colony-stimulating factor is a glycoprotein hormone that regulates proliferation and differentiation of granulocyte precursors. It is used to accelerate recovery from chemotherapy-related neutropaenia in cancer patients. Intense increased FDG uptake is commonly observed in the bone marrow and spleen following GCSF therapy; however the bone marrow response to GCSF can be differentiated from pathological infiltration by its intense homogeneous nature without focally increased areas of FDG uptake. Increased FDG uptake attributable to GCSF uptake rapidly decreases following completion of therapy and generally resolves within a month (Fig. 9).

18F-FDG PET-CT performed in a 46-year-old male post four cycles of chemotherapy for lymphoma and 2 weeks post administration of G-CSF. Note the diffuse homogeneous increased uptake throughout the bone marrow and the increased uptake in the spleen (yellow arrow)
Full size image
Marked uptake in the bone marrow can also be seen following chemotherapy, reflecting marrow activation [31, 32].
Radiation pneumonitis
Inflammatory morphological changes in the radiation field post-irradiation of primary or metastatic lung tumor can result in false-positive diagnosis. Radiation pneumonitis typically occurs following high doses of external beam radiotherapy (>40 Gy). In the acute phase (1–8 weeks) radiation pneumonitis is characterized by ground-glass opacities and patchy consolidation. This can commonly lead to a misdiagnosis of infection. Chronic CT appearances of fibrosis and traction bronchiectasis in the radiation field allow correct interpretation of increased FDG uptake as radiation pneumonitis as opposed to disease recurrence [33, 34]. Other organs are also sensitive to radiation, and persistent uptake due to inflammatory change can persist for up to 1 year. It is important to elicit a history of radiation from the patient and to correlate the increased uptake with the CT findings to avoid missing a disease recurrence (Fig. 10).

18F18-FDG PET-CT performed in a 52-year-old male with newly diagnosed esophageal carcinoma. Increased FDG uptake is identified within the esophagus (black arrow) and an upper abdominal lymph node (yellow arrow), consistent with malignancy (a). 18F18-FDG PET-CT performed 6 weeks post-completion of radiotherapy for esophageal carcinoma. Linear increased uptake is identified along the mediastinum in the radiation port (black arrow). This corresponds to areas of ground-glass change on CT (yellow arrow) consistent with acute radiation change (b)
Full size image
Infection
Bone marrow suppression places chemotherapy patients at increased risk of infection.
Inflammatory cells such as neutrophils and activated macrophages at the site of infection or inflammation actively accumulate FDG [35].
In the post-therapy setting it has been reported that up to 40% of FDG uptake occurs in non-tumor tissue [12]. Infection is one of the most common causes of false-positive 18F-FDG PET-CT findings post-chemotherapy. Chemotherapy patients are susceptible to a wide variety of infections, including upper respiratory chest infections, pneumonia, colitis and cholecystitis. Reactivation of tuberculous infection can occur in immunocompromised patients post,chemotherapy, and correlation with CT imaging can prevent misdiagnosis in suspected cases.
Atypical infections such as cryptococcosis and pneumocystis can also present as false-positives on FDG imaging (Fig. 11) [36].

18F-FDG PET-CT performed in a 57-year-old male 2 weeks following chemotherapy for lung cancer. Increased FDG uptake is noted within the cecum (black arrow). On CT there is some thickening of the cecal wall and stranding of the pericecal fat (yellow arrow) consistent with typhilits
Full size image
Surgery and radiotherapy
There are inherent challenges in the interpretation of 18F-FDG PET-CT imaging in the postoperative patient. Non-tumor-related uptake of FDG is frequently identified in post-operative wound sites, at colostomy sites or at the site of post-radiation inflammatory change. 18F-FDG PET-CT imaging during the early postoperative/post-radiotherapy period may result in overstaging of patients because of non-neoplastic uptake of FDG [12]. Careful evaluation of the CT component in this setting is vital as CT imaging can provide valuable additional information regarding benign inflammatory conditions commonly encountered in the postoperative setting such as abscesses or wound infection. These conditions are often readily apparent on CT, particularly when oral and/or IV contrast CT is administered.
The reader should also bear in mind that avid uptake of FDG at postoperative/post radiotherapy sites may mask malignant FDG uptake in neighboring structures. In order to minimize non-tumoral uptake of FDG, it is advisable to allow at least 6 weeks post-surgery or completion of radiotherapy prior to performing staging 18F-FDG PET-CT [24].
Talc pleurodesis
Talc pleurodesis is a commonly performed procedure for the treatment of persistent pneumothorax or pleural effusion. The fibrotic/inflammatory reaction results in increased FDG uptake on 18F-FDG PET imaging with corresponding high-density areas of pleural thickening on CT. SUV values of between 2–16.3 have been seen years after the procedure [37].
When increased FDG uptake is indentified in the pleural space in a patient with a known history of pleurodesis, correlation with CT is recommended to detect pleural thickening of increased attenuation that suggests talc rather than tumor.
It is extremely important that a comprehensive history with relevant surgical interventions is available to the reader in order to ensure accurate diagnosis and staging (Fig. 12).

18F-FDG PET-CT performed in a 69-year-old male with a history of non-Hodgkin’s lymphoma. The patient had a previous talc pleurodesis for a persistent left pleural effusion. Increased FDG activity is identified within the left pleura (black arrow). CT demonstrates a pleural effusion with high density material along the left pleural surface consistent with talc (yellow arrow)
Full size image
Flare phenomenon
Bone healing is mediated by osteoblasts, and an early increase in osteoblast activity on successful treatment of metastatic disease has been described [38]. “Bone flare” refers to a disproportionate increase in bone lesion activity on isotope bone scan despite evidence of a therapeutic response to treatment in other lesions and has been well described in breast, prostate and lung tumors. ‘Flare phenomenon’ has also been described on 18F-FDG PET-CT in patients with lung and breast cancer who are receiving chemotherapy [39].
Differentiating between increased FDG uptake due to flare response and true disease progression may not be possible in the early post-treatment studies. While it is recognized that bone flare is a rare phenomenon, an increase in baseline skeletal activity and appearance of new bone lesions despite apparent response or stable disease elsewhere should be interpreted with caution to avoid erroneously suggesting progressive disease.
Osteonecrosis
Osteonecrosis or avascular necrosis has been well described as a complication of combination chemotherapy treatment, especially where it includes intermittent high-dose corticosteroids (e.g., lymphoma patients) [40]. Commonly encountered sites include the hip and less frequently the proximal humerus. Occasionally we can see a discrete entity known as jaw osteonecrosis. Patients receiving IV bisphosphonates for the management of bone metastases are at an increased risk of developing this [41]. The development of osteonecrosis in the mandible is frequently preceded by tooth extraction. Radiographic findings that may be visualized on CT include osteosclerosis, dense woven bone, thickened lamina dura and sub-periosteal bone deposition [42]. FDG uptake can be seen in areas of osteonecrosis (Fig. 13).

18F-FDG PET-CT performed in a 46-year-old gentleman with a history of non-Hodgkin’s lymphoma. Increased FDG uptake is identified in the right proximal humerus (black arrow). CT of the area demonstrates a corresponding vague area of sclerosis (yellow arrow). Biopsy of the area yielded osteonecrosis with no evidence of metastatic disease
Full size image
Insufficiency fractures
Pelvic insufficiency fractures have been described following irradiation for gynecological, colorectal, anal and prostate cancer. They commonly occur within 3–12 months post-radiation treatment, and osteoporosis is often a precipitating factor. FDG uptake in insufficiency fractures ranges from mild and diffuse to intense and heterogeneous. The maximum SUV values are variable with reported values of between 2.4–7.2 [43]. Differentiating insufficiency fractures from bone metastases can prove challenging; however they are often bilateral and occur in characteristic locations within the radiation field—sacral ala, pubic rami and iliac bones. Biopsy of insufficiency fractures can lead to irreparable damage and so careful correlation of 18F-FDG PET imaging with the CT component along with radiation history is vital for correct diagnosis. CT allows evaluation of the bone cortex and adjacent soft tissues, which can confirm the diagnosis of a pathological fracture or a metastatic deposit.
Follow-up of suspected insufficiency fractures demonstrates a reduction in FDG uptake over time (Fig. 14) [43].

18F-FDG PET-CT performed in a 46-year-old female, 3 years post-chemo-radiation for cervical carcinoma. Low grade FDG uptake is identified in the left acetabulum and right pubic bone (black arrow). CT demonstrates pathological fractures in these areas consistent with insufficiency fractures (yellow arrow)
Full size image
Sarcoidosis
Sarcoidosis is a chronic multisystem disorder characterized by non-caseating granulomas and derangement of normal tissue architecture [36]. Sarcoidosis has been reported in association with a variety of malignancies either synchronously or post-chemotherapy. Aggregation of inflammatory cells post-chemotherapy is associated with accumulation of FDG, and the intensity of FDG uptake may correlate with disease activity [36].
When suspected disease recurrence presents with signs and symptoms compatible with sarcoidosis (i.e., mediastinal and bihilar lymphadenopathy), this must be excluded by clinical, radiological and pathological correlation to prevent mistreatment (Fig. 15).

18F-FDG PET-CT performed in a 67-year-old male for restaging of laryngeal carcinoma. Increased FDG uptake is noted in the left lower neck and left mediastinum (black arrow). CT demonstrates lymphadenopathy in these areas (yellow arrow), some of which are calcified. Biopsy of the left lower neck node confirmed sarcoidosis
Full size image
FDG-PET negative tumors
There are a number of malignancies that can be FDG-PET negative. Examples include bronchoalveolar carcinoma and carcinoid tumors in the lung, renal cell carcinomas and hepatomas, mucinous tumors of the GIT and colon, and low grade lymphomas [3, 44–48]. Careful evaluation of the CT component of the study however will prevent a misdiagnosis (Fig. 16).

18F-FDG PET-CT performed in a 52-year-old female with breast cancer and chronic hepatitis. On the CT component a hyper-enhancing mass is identified in segment 4 of the liver (yellow arrow). No increased FDG activity is identified in this area on the PET component. Biopsy of the mass confirmed the diagnosis of a hepatocellular carcinoma
Full size image
Osteoblastic metastases
Bone metastases are diagnosed in up to 85% of patients with advanced breast cancer, leading to significant morbidity and mortality. Sclerotic bone metastases are commonly associated with breast carcinoma [49]. 18F-FDG PET imaging is superior to nuclear bone scan in detection of osteolytic breast metastases; however it commonly fails to diagnose osteoblastic or sclerotic metastases [50]. Review of bony windows on CT imaging allows identification of sclerotic metastases and ensures accurate staging of metastatic bone disease (Fig. 17).

Staging 18F-FDG PET-CT performed in a 45-year-old female with newly diagnosed breast cancer. CT demonstrates multiple small sclerotic foci in the spine and pelvis (yellow arrow), consistent with bony metastases. These are FDG negative on the PET component of the study
Full size image
Discussion/conclusion
18F-FDG PET imaging has dramatically changed cancer staging, and findings of restaging studies commonly effect changes in treatment protocols. 18F-FDG however is not tumor specific. As interpreting physicians we need to be aware of these false positives and false negatives. In this review we have outlined atypical physiological sites of FDG uptake along with common causes of FDG uptake in benign pathological conditions, many of which are treatment related. With 18F-FDG PET-CT we have the advantage of two imaging modalities. The PET component gives us functional information and the CT, anatomical data. We have discussed the importance of dual-modality imaging and correlation with CT imaging of the above conditions. Furthermore CT imaging provides important diagnostic information in evaluation of tumors that poorly concentrate FDG. In light of the increased reliance of 18F-FDG PET-CT for cancer staging, it is vital that radiologists and nuclear medicine physicians be aware of pitfalls in 18F-FDG PET-CT imaging and correlate PET and CT components to avoid misdiagnosis, overstaging of disease and unnecessary biopsies.
ФГБУ «Национальный медицинский исследовательский центр сердечно-сосудистой хирургии им. А.Н. Бакулева» Минздрава России
Пурсанова Д.М.
ФГБУ «Национальный медицинский исследовательский центр сердечно-сосудистой хирургии им. А.Н. Бакулева» Минздрава России
Мухортова О.В.
ФГБУ «Национальный медицинский исследовательский центр сердечно-сосудистой хирургии им. А.Н. Бакулева» Минздрава России
Шурупова И.В.
ФГБУ «Национальный медицинский исследовательский центр сердечно-сосудистой хирургии им. А.Н. Бакулева» Минздрава России
Екаева И.В.
ФГБУ «Национальный медицинский исследовательский центр сердечно-сосудистой хирургии им. А.Н. Бакулева» Минздрава России
Аракелян В.С.
ФГБУ «Национальный медицинский исследовательский центр сердечно-сосудистой хирургии им. А.Н. Бакулева» Минздрава России
Голухова Е.З.
ФГБУ «Национальный медицинский исследовательский центр сердечно-сосудистой хирургии им. А.Н. Бакулева» Минздрава России
Мироненко В.А.
ФГБУ «Национальный медицинский исследовательский центр сердечно-сосудистой хирургии им. А.Н. Бакулева» Минздрава России
Гарманов С.В.
ФГБУ «Национальный медицинский исследовательский центр сердечно-сосудистой хирургии им. А.Н. Бакулева» Минздрава России
Попов Д.А.
ФГБУ «Национальный медицинский исследовательский центр сердечно-сосудистой хирургии им. А.Н. Бакулева» Минздрава России

Возможности ПЭТ/КТ С 18F-фтордезоксиглюкозой в диагностике инфекции сосудистых протезов
Авторы:
Асланиди И.П., Пурсанова Д.М., Мухортова О.В., Шурупова И.В., Екаева И.В., Аракелян В.С., Голухова Е.З., Мироненко В.А., Гарманов С.В., Попов Д.А.
Журнал:
Хирургия. Журнал им. Н.И. Пирогова. 2021;(2): 58‑66
Как цитировать:
Асланиди И.П., Пурсанова Д.М., Мухортова О.В., Шурупова И.В., Екаева И.В., Аракелян В.С., Голухова Е.З., Мироненко В.А., Гарманов С.В., Попов Д.А.
Возможности ПЭТ/КТ С 18F-фтордезоксиглюкозой в диагностике инфекции сосудистых протезов. Хирургия. Журнал им. Н.И. Пирогова.
2021;(2):58‑66.
Aslanidis IP, Pursanova DM, Mukhortova OV, Shurupova IV, Ekaeva IV, Arakelyan VS, Golukhova EZ, Mironenko VA, Garmanov SV, Popov DA. 18F-fluorodeoxyglucose PET/CT in the diagnosis of vascular graft infection. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2021;(2):58‑66. (In Russ.).
https://doi.org/10.17116/hirurgia202102158

?>
Введение
Инфекции сосудистых протезов (СП) являются нечастым, но грозным осложнением у больных после кардиохирургических вмешательств. Их распространенность составляет 1—6% случаев, при этом показатели смертности достигают 75—100% [1, 2].
Рандомизированные контролируемые исследования по диагностике инфекции СП отсутствуют, основные публикации по данной тематике представлены исследованиями крупных серий случаев [1—7]. Поэтому если для лечения инфекций других хирургических протезов (например, клапанов сердца и суставов) есть прочно утвердившиеся руководства, основанные на доказательной базе, то общепринятых рекомендаций по ведению больных с инфекцией СП нет [3—5]. В современной мировой клинической практике диагностика инфекции СП основывается на клинических, анамнестических и морфологических данных, а также на результатах лабораторных и инструментальных исследований [1—4]. Основными критериями постановки диагноза являются наличие лихорадки, положительные посевы крови, а также данные методов диагностической визуализации — трансторакальной и чреспищеводной эхокардиографии (эхоКГ), компьютерной томографии (КТ) с внутривенным контрастированием и магнитно-резонансной томографии [1—4].
В последние десятилетия для диагностики инфекционных процессов в сердце и сосудах стали также применять радионуклидные методы исследования, одним из которых является позитронно-эмиссионная томография, совмещенная с КТ (ПЭТ/КТ), с 18F-фтордезоксиглюкозой (18F-ФДГ). Преимуществом данного неинвазивного метода гибридной молекулярной визуализации является возможность ранней оценки метаболических изменений до появления структурного субстрата [7, 8]. В основе использования ПЭТ/КТ в диагностике воспаления лежит интенсивное накопление 18F-ФДГ клетками воспаления — полиморфноядерными лейкоцитами (активированные макрофаги и гранулоциты) и лимфоцитами, характеризуемыми повышенным уровнем гликолиза [8—10].
Инфекции СП имеют атипичную клиническую картину — основным клиническим проявлением является рецидивирующая лихорадка, в связи с этим больных неоднократно госпитализируют на длительное время (часто по несколько месяцев) в различные лечебные учреждения и назначают им эмпирическую антибактериальную терапию (АБТ) без четко установленного диагноза [1—4].
В последние годы в зарубежной литературе появились данные о многообещающих результатах ПЭТ/КТ с 18F-ФДГ для выявления инфекционных процессов у больных после кардиохирургических вмешательств [6, 7, 11]. В нашей стране аналогичные исследования не проводились.
Цель исследования — изучение диагностических возможностей ПЭТ/КТ с 18F-ФДГ у больных с подозрением на инфекцию СП.
Материал и методы
В проспективный анализ включены результаты 30 ПЭТ/КТ-исследований, выполненных 26 больным с подозрением на инфекцию СП после различных видов хирургического лечения (рис. 1); у 3 пациентов обследование проводилось неоднократно для оценки эффективности АБТ (у 2 дважды, у 1 трижды).

Рис. 1. Распределение случаев анализируемой группы (n=30) в зависимости от локализации сосудистого протеза.
В анализируемую группу случаев вошли 25 мужчин и 5 женщин; средний возраст 47±17 (15—82) лет. Интервал между имплантацией СП и проведением ПЭТ/КТ составил 3—276 мес, медиана 48 [20; 106] мес. Во всех случаях имплантированы синтетические СП (n=30).
В 1 (3%) случае пациентка обследована через 1 мес после хирургической обработки гнойного очага передней грудной стенки. У 3 (10%) пациентов ПЭТ/КТ выполняли неоднократно для оценки эффективности АБТ: у 1 — трижды по поводу медиастинита и остеомиелита грудины, у 2 — дважды по поводу инфекции шунта (n=1) и СП (n=1) грудной аорты. В остальных 23 (77%) случаях повышение температуры тела не было связано с известными воспалительными или инфекционными процессами.
В 11 (37%) из 30 случаев анализируемой группы в анамнезе зафиксированы эмболические события и другие инфекционные осложнения различной локализации (n=12): инфекционный эндокардит (ИЭ) нативного аортального клапана (n=2), инфекционный эндокардит протезированного клапана — ПК (n=2), в том числе в 1 случае с повторными острыми нарушениями мозгового кровообращения, стерномедиастинит (n=2), абсцесс паракондуитного пространства с ревизией средостения (n=1), ангина (n=1), абсцесс зуба (n=1), инфекция ложа электрокардиостимулятора — ЭКС (n=2), тромбоз подколенной артерии (n=1).
Общая характеристика случаев представлена на рис. 2. Во всех случаях на момент ПЭТ/КТ-обследования имелись результаты трансторакальной и/или чреспищеводной эхоКГ, КТ с внутривенным контрастированием, а также посевов крови.

Рис. 2. Распределение случаев анализируемой группы (n=30) в зависимости от результатов клинико-лабораторно-инструментального исследования при выполнении ПЭТ/КТ.
В анализируемой группе с подозрением на инфекцию СП (n=30) исходно до выполнения ПЭТ/КТ, согласно диагностическим критериям, диагноз был «подтвержденным» только у 23% (7) больных, тогда как у 77% (23) диагноз был «возможным» (n=11) или «исключенным» (n=12).
В 20 (67%) случаях в связи с высокой вероятностью инфекционного процесса по данным полного клинико-лабораторно-инструментального обследования, в том числе с учетом результатов ПЭТ/КТ, проведено повторное хирургическое лечение. Временной интервал между выполнением ПЭТ/КТ и операцией составил 1—28 дней, медиана — 10 [4; 21] дней.
Согласно интраоперационным данным (визуальная оценка и/или результат посева интраоперационного материала) в 17 (85%) из 20 случаев операций диагноз инфекции СП подтвержден. При этом в 13 (76%) случаях также выявлен инфекционный процесс другой локализации — в области нативного аортального клапана (n=1), ЭКС (n=1), протезированного и нативного клапанов (n=1), ПК (n=10); у 1 (6%) из пациентов исключена инфекция ЭКС. Посевы материала были положительными в 14 (82%) из 17 случаев с интраоперационно подтвержденной инфекцией СП.
В 3 (15%) из 20 случаев операций диагноз инфекции СП исключен, при этом у 2/3 из этих больных выявлена инфекция ЭКС, а у 1 — ИЭ ПК.
Два (6%) случая в анализируемой группе представлены повторными обследованиями одного и того же пациента. При первичной ПЭТ/КТ корректно диагностирован инфекционный процесс в области проксимальных отделов аорто-аортального шунта через 20 лет после хирургического лечения, а также в легком и селезенке. При повторном обследовании, выполненном после длительной АБТ спустя 12 мес, определялась полная резорбция выявленных ранее изменений.
В 8 (27%) из 30 случаев анализируемой группы по результатам комплексного клинико-лабораторного и инструментального обследований диагноз инфекции СП был исключен, из них в 5 (63%) из 8 случаев также исключен ИЭ ПК. Больные выписаны без операции, дальнейшее наблюдение в течение 6±3 мес подтвердило отсутствие инфекции СП и ИЭ ПК.
Таким образом, в анализируемой группе с подозрением на инфекцию СП диагноз подтвержден в 18 (60%) и исключен в 12 (40%) случаях.
Исследования выполняли на гибридной системе ПЭТ/КТ («Siemens») через 90 мин после внутривенного введения 18F-ФДГ (175—200 МБк) по стандартному протоколу в режиме обследования всего тела — от уровня глазниц до уровня верхней трети бедра. Более подробно методика выполнения ПЭТ/КТ изложена в [12].
Для выполнения статистических расчетов использовали программу SPSS Statistics. Результаты представлены в виде медианы и интерквартильного размаха (25-й и 75-й процентили). Значения средних по группам представлены как среднее арифметическое ± стандартное отклонение, 95% ДИ, который учитывает объем малой выборки.
Результаты
Положительные результаты ПЭТ/КТ, свидетельствовавшие о наличии инфекционного процесса, получены в 17 (94%) из 18 случаев с подтвержденным диагнозом инфекции СП. Отрицательные результаты ПЭТ/КТ, подтверждающие отсутствие инфекционного процесса, получены в 6 (50%) из 12 случаев с исключенным диагнозом. В 6 (20%) из 30 случаев получены ложноположительные и в 1 (3%) — ложноотрицательный результаты ПЭТ/КТ.
Среди случаев с истинно положительными результатами ПЭТ/КТ (n=17) в 16 (94%) инфекционный процесс выявлен в зоне аортальных СП, в 1 (6%) — в зоне восходяще-нисходящего шунта грудной аорты. В 13 (76%) случаях патологическое накопление радиофармпрепарата определялось не только в зоне СП, но и парапротезно, что свидетельствовало о наличии абсцессов, которые в последующем были верифицированы интраоперационно (рис. 3).

Рис. 3. Пример истинно положительного результата ПЭТ/КТ.
Пациентка Ф., 54 года, через 78 мес после протезирования восходящей аорты с переходом на дугу синтетическим протезом и 18 мес после имплантации электрокардиостимулятора; в анамнезе состояние после хирургической обработки гнойного очага передней грудной стенки, в процессе антибиотикотерапии в течение 4 мес, на момент выполнения ПЭТ/КТ температура тела нормальная, результаты эхокардиографии и посевов крови отрицательные. При ПЭТ/КТ патологическое накопление 18F-ФДГ определяется по ходу протеза восходящей аорты и дуги на всем протяжении (стрелки 1), (б) в том числе в зоне проксимального анастомоза, (а, в) в мягкотканном парапротезном компоненте с распространением на клетчатку переднего средостения и правую нижнешейную область (стрелки 2). Кроме того, патологическое накопление 18F-ФДГ определяется (в) в области рукоятки грудины с признаками остеомиелита (стрелки 3) и по ходу экстракардиальных отделов электродов (стрелка 4). По ходу интракардиальных отделов электродов патологического накопления 18F-ФДГ не выявлено (круг, стрелки 5) (г).
а — виртуальное трехмерное ПЭТ-изображение; б—г — сверху вниз аксиальные проекции КТ, ПЭТ и фузионированного ПЭТ/КТ изображений.
Важно, что в 12 (71%) из 17 случаев с истинно положительными результатами ПЭТ/КТ также корректно оценены другие зоны интереса — инфекционный процесс выявлен в области ПК (n=9), нативного аортального клапана (n=1), ЭКС (n=1) и исключен в области ЭКС (n=1). В 1 случае по данным ПЭТ/КТ не удалось подтвердить наличие ИЭ нативного митрального клапана, выявленного по данным эхоКГ и верифицированного интраоперационно.
Среди случаев с истинно отрицательными результатами ПЭТ/КТ (n=6) в 1 (17%) случае инфекционный процесс корректно исключен как в зоне СП, так и в области ПК. В 3 (50%) случаев инфекционный процесс корректно исключен в зоне СП, однако диагностирован в зоне ЭКС (n=2) и ПК (n=1). В 1 (17%) случае истинно отрицательный результат получен при повторной ПЭТ/КТ (рис. 4).

Рис. 4. Примеры истинно положительного и истинно отрицательного результатов ПЭТ/КТ у пациента (оценка эффективности консервативного лечения инфекции сосудистого протеза).
Пациент К., 36 лет, обследован через 240 мес после операции (резекция коарктации аорты с протезированием фторлон-лавсановым эксплантатом и ушивание дистального отдела дуги аорты, аксилло-бифеморальное шунтирование справа по поводу рекоарктации аорты, восходяще-нисходящее шунтирование грудной аорты синтетическим протезом с удалением аксилло-бифеморального шунта) по поводу подъемов температуры тела до 42 °C в течение 5 мес, посевы крови были стерильными. При первичной ПЭТ/КТ (а, б) патологическое накопление 18F-ФДГ определяется по ходу восходяще-нисходящего синтетического шунта грудной аорты (1) и в очагах в селезенке (2). При повторной ПЭТ/КТ (в, г) указанные изменения резорбировались () после длительной антибиотикотерапии.
а, в — виртуальное трехмерное ПЭТ-изображение; б, г сверху вниз аксиальные проекции КТ, ПЭТ и фузионированного ПЭТ/КТ-изображений.
Среди случаев с ложноположительными результатами ПЭТ/КТ (n=6) в 3 (50%) исследование проведено одному и тому же пациенту. Первичная ПЭТ/КТ выполнена в раннем послеоперационном периоде — через 3 мес, выявлены признаки стерномедиастинита, диффузное патологическое накопление 18F-ФДГ в зоне протезов аортального клапана и восходящей аорты. Повторные ПЭТ/КТ проведены для оценки АБТ через 4 и 9 мес после операции, при первом определена незначительная положительная динамика, при последующем — полная резорбция инфекционного процесса в средостении и грудине. На этом фоне в зоне ПК и СП аорты ложное патологическое накопление 18F-ФДГ одинаковой интенсивности сохранялось при всех трех исследованиях (рис. 5). После завершения 6-месячного курса АБТ у пациента нормализовалась температура, на основании результатов повторных трансторакальной и чреспищеводной ЭхоКГ, а также периода наблюдения в течение 18 мес диагноз ИЭ ПК и инфекции СП аорты исключен. Ретроспективно результат расценен как ложноположительный.

Рис. 5. Пример ложноположительного результата ПЭТ/КТ.
На фоне антибиотикотерапии остеомиелита грудины и медиастинита (стрелки 1) сохраняется без убедительной динамики патологическое накопление 18F-ФДГ в зоне протезированного клапана и сосудистого протеза восходящей аорты (стрелки 2). Инфекционный процесс в грудине и прилежащих мягких тканях (а, б) сохраняется без динамики при первых двух исследованиях и резорбируется при третьем сканировании через 6 мес антибиотикотерапиии (в) (виртуальные трехмерные ПЭТ-изображения).
У 1 пациента получен ложноотрицательный результат ПЭТ/КТ через 28 мес после операции Bentall de Bono. Временной интервал между выполнением ПЭТ/КТ и повторным хирургическим лечением составил 4 мес. Интраоперационно выявлен выраженный инфекционный процесс в зоне как СП, так и ПК, получены положительные посевы материала.
В анализируемой группе (n=30) временной интервал между имплантацией СП и проведением ПЭТ/КТ у 3 (10%) пациентов, т.е. в половине случаев с ложноположительными результатами ПЭТ/КТ, составил 3 (n=2) и 4 (n=1) мес. Во всех остальных случаях (n=27) указанный интервал составил более 5 мес (см. таблицу).
Временной интервал между предшествующим хирургическим лечением и выполнением ПЭТ/КТ и число больных, которым проводили антибактериальную терапию
|
Показатель |
Результаты ПЭТ/КТ |
|||
|
истинно положительный (n=17) |
ложноотрицательный (n=1) |
истинно отрицательный (n=6) |
ложноположительный (n=6) |
|
|
Время после предшествующего хирургического лечения, мес |
||||
|
медиана |
33 (18; 67) |
28 |
228 (75; 258) |
6,5 (3; 42) |
|
разброс значений |
(5—240) |
(48—276) |
(3—88) |
|
|
Антибактериальная терапия на момент выполнения ПЭТ/КТ, % |
59 (10) |
100 (1) |
83 (5) |
50 (3) |
Как указано выше, 19 (63%) пациентов находились в процессе длительной АБТ при выполнении ПЭТ/КТ. Среди случаев с подтвержденной инфекцией СП (n=18) эти больные составили 61% (n=11), тем не менее истинно положительные результаты ПЭТ/КТ получены у 17 (94%) из них (см. таблицу).
Среди случаев неоднократного проведения ПЭТ/КТ (n=7) у 3 больных результаты исследования позволили корректно оценить эффективность АБТ в 100% случаев: положительная динамика в зоне СП (n=2), отрицательная динамика в зоне СП и протеза аортального клапана (n=2), положительная динамика инфекционного процесса в грудине и в средостении (n=3).
Проведен анализ диагностических показателей ПЭТ/КТ с 18F-ФДГ: чувствительность, специфичность и точность метода в диагностике инфекции СП составили 94, 50 и 77% соответственно; положительная и отрицательная прогностическая ценность — 74 и 86%.
Важно, что 50% (3 из 6) ложноположительных результатов ПЭТ/КТ представлены исследованиями одного и того же пациента. При расчете диагностических показателей ПЭТ/КТ без двух указанных повторных исследований показатели специфичности возросли с 50 до 60%, точности — с 75 до 82%.
В анализируемой группе выполнение ПЭТ/КТ в режиме обследования «все тело» у 73% (22 из 30) позволило выявить очаги воспаления не только в зоне интереса (СП), но и другой локализации. Как указано выше, в 14 (64%) из 22 случаев дополнительно выявленные очаги воспаления определены в сердце и сосудах — ПК (n=11) и по ходу ЭКС (n=3). В 13 (59%) случаях очаги воспаления диагностированы в других областях: в грудине (n=9), в том числе в 2 случаях с признаками медиастинита и в 1 случае в сочетании с абсцессом легкого, в легком (n=1), в селезенке (n=1), в гемитораксе и прямой кишке (n=1), в анусе (n=1). Среди случаев с исключенной впоследствии инфекцией СП (n=12) и различными результатами ПЭТ/КТ, как истинно отрицательными (n=6), так и ложноположительными (n=6), выполнение исследования позволило установить возможную причину повышения температуры тела в 5 (42%) из 12 случаев.
Проанализировано распределение пациентов в зависимости от вероятности наличия инфекции СП (n=30) исходно до выполнения ПЭТ/КТ: у 77% (23) больных диагноз был «возможным» (n=12) или «исключенным» (n=11), у 23% (7) — «подтвержденным». Выполнение ПЭТ/КТ позволило корректно реклассифицировать 33% (10) случаев анализируемой группы: подтвердить инфекцию СП в 8 (67%) из 12 случаев с исходно «возможным» и в 2 (18%) из 11 случаев с исходно «исключенным» диагнозом; 13% (4) случаев анализируемой подгруппы реклассифицированы неправильно.
Таким образом, в анализируемой группе с подозрением на инфекцию СП (n=30) результаты ПЭТ/КТ позволили скорректировать тактику лечения в 80% (24) случаев: за счет реклассификации случаев с первоначально «возможным» и «исключенным» диагнозом и диагностики очагов воспаления вне зон интереса (СП) — 27% (8), за счет реклассификации случаев с первоначально «возможным» диагнозом — 7% (2), диагностики очагов воспаления экстракардиальной локализации — 53% (14).
Обсуждение
Диагностика инфекционных осложнений у больных с СП остается актуальным вопросом современной клинической медицины. Несмотря на комплексный подход с участием специалистов различных профилей в области кардиологии, кардиохирургии, инфекционных заболеваний и диагностической визуализации, постановка окончательного диагноза крайне сложна [1—4]. Это связано с неспецифической картиной заболевания, а также с высокой частотой получения отрицательных результатов лабораторно-инструментальных методов обследования, которые, однако, не исключают наличия инфекционного процесса [1—4]. Анализируемая группа в основном представлена именно такими случаями (пациенты с сомнительными или отрицательными лабораторно-инструментальными данными (77%), представляющие наибольший клинический интерес).
Как уже было сказано, частота инфекции СП невысока, в связи с этим большинство опубликованных исследований по изучению диагностических возможностей ПЭТ/КТ с 18F-ФДГ проведено в небольших разнородных группах (25—39 больных) [7, 11, 13—18]. Согласно опубликованным данным, диагностические показатели ПЭТ/КТ с 18F-ФДГ для данной патологии существенно различаются — чувствительность варьирует в пределах 77—100%, специфичность — 50—93% [11, 13, 17—21]. В единичном исследовании с более многочисленной группой больных (n=76) указанные показатели составили 98 и 76% соответственно [22]. По результатам метаанализа 2019 г. Kim и соавт., включившем 10 исследований (n=286), суммарные показатели чувствительности и специфичности составили 96 и 74% соответственно [20]. В настоящем исследовании возможности ПЭТ/КТ в диагностике инфекции СП проанализированы в группе из 30 больных — показатели чувствительности и специфичности составили 94 и 50% соответственно.
Значительные различия между диагностическими показателями в различных исследованиях, вероятно, связаны с дизайном исследования (анализ по пациентам или по зонам интереса), неоднородностью изучаемых подгрупп (биопротезы, синтетические СП, стенты, различные диаметры СП), методиками проведения ПЭТ/КТ-исследования, способами интерпретации результатов ПЭТ/КТ (в зависимости от характера интенсивности накопления 18F-ФДГ), их верификацией, а также с небольшими выборками больных. Тем не менее большинство исследователей отмечают, что, несмотря на высокую частоту ложноположительных результатов, отрицательные результаты ПЭТ/КТ позволяют избежать ненужного удаления СП [20, 21].
Доля ложноположительных результатов при подозрении на инфекцию СП в настоящем исследовании составила 20% (6 из 30). По данным метаанализа Kim и соавт., соответствующий показатель был несколько ниже — 13% (49 из 382) [20]. Высокая частота получения ложноположительных результатов может быть обусловлена рядом факторов. Одним из них является выраженный местный «стерильный» воспалительный процесс, связанный с обширным повреждением тканей при имплантации СП, а также их реакцией на наличие инородного синтетического материала. Среди пациентов с СП в раннем послеоперационном периоде так называемый постимплантационный синдром, не сопровождаемый клиническими проявлениями, встречается у 14—60% пациентов [23]. Причем воспалительная реакция различной степени может сохраняться на протяжении нескольких лет после имплантации СП [13].
Другим фактором, влияющим на получение ложноположительных результатов ПЭТ/КТ, может являться короткий интервал между предшествующим лечением и выполнением ПЭТ/КТ. В настоящем исследовании в подгруппе с ложноположительными результатами ПЭТ/КТ (n=6) интервал составлял от 3 до 88 мес, а в 50% (3 из 6) случаев исследование выполнено в раннем послеоперационном периоде — до 4 мес. Полученные данные, с одной стороны, свидетельствуют о наличии ложного патологического накопления 18F-ФДГ в зоне стерильного воспаления в области СП, с другой — подтверждают его длительное сохранение вне зависимости от времени, прошедшего после имплантации, что совпадает с данными других исследователей [7, 11, 14—18].
Ряд авторов полагают, что у пациентов с подозрением на инфекцию СП получение ложноотрицательных результатов ПЭТ/КТ обусловлено проведением АБТ перед исследованием [5, 6, 19]. В настоящем исследовании единственный ложноотрицательный результат получен у пациента, находящегося в процессе длительной АБТ. Тем не менее, несмотря на наличие данного фактора в 61% (11/18) случаев с подтвержденной инфекцией СП (n=18), истинно положительные результаты ПЭТ/КТ получены у 94% (17 из 18) больных. В исследовании Einspieler и соавт. (n=50) также показано, что проведение АБТ существенно не влияет на чувствительность метода [21].
Более того, результаты настоящего исследования показали, что выполнение ПЭТ/КТ-исследований в динамике позволило корректно оценить эффективность АБТ при невозможности проведения повторного хирургического лечения в 100% случаев. Таким образом, вопрос о влиянии АБТ на результаты ПЭТ/КТ с 18F-ФДГ при диагностике и оценке эффективности консервативного лечения инфекции СП остается открытым.
К одной из возможных причин получения единственного ложноотрицательного результата ПЭТ/КТ у вышеуказанного пациента мы также относим длительный временной интервал между выполнением ПЭТ/КТ и повторным хирургическим лечением (4 мес).
Важным вопросом при постановке диагноза инфекции СП является определение распространенности инфекционного процесса — диагностика септических эмболов и других очагов инфекции. Инфекционные эмболы являются нередким осложнением и могут встречаться у 20—50% больных, зачастую протекают без каких-либо клинических проявлений, в связи с этим их диагностика затруднена [21, 24, 25]. В настоящем исследовании в 43% (13 из 30) случаев анализируемой группы выполнение обследования в режиме всего тела позволило диагностировать дополнительные очаги инфекции за пределами сердца и сосудов, что определило тактику лечения больных.
Заключение
Полученные данные свидетельствуют о высокой информативности ПЭТ/КТ с 18F-ФДГ в диагностике инфекции СП: несмотря на ограниченную специфичность, метод обладает высокой чувствительностью и точностью. Включение ПЭТ/КТ с 18F-ФДГ в диагностический алгоритм позволило корректно реклассифицировать 33% пациентов с «возможным» и «исключенным» диагнозом — подтвердить инфекцию СП. Полученные результаты свидетельствуют о целесообразности применения ПЭТ/КТ с 18F-ФДГ у пациентов с подозрением на инфекцию СП, особенно при сомнительных или отрицательных данных лабораторно-инструментальных исследований. Важным преимуществом ПЭТ/КТ также является возможность диагностировать очаги инфекции иной локализации. Все вышеуказанное позволяет скорректировать тактику лечения больных данной категории.
Авторы заявляют об отсутствии конфликта интересов.
АННОТАЦИЯ
Точная диагностика и стадирование онкологического процесса необходимы для оптимального ведения больных раком. Позитронно-эмиссионная томография с 18F- фтордезоксиглюкозой, интегрированная с компьютерной томографией (18F-FDG PET / CT), стала мощным инструментом визуализации для выявления различных видов рака. Совместное получение ПЭТ и КТ имеет синергетические преимущества по сравнению с ПЭТ или КТ по отдельности и сводит к минимуму их индивидуальные ограничения. Этот метод является ценным инструментом для диагностики злокачественных образований и играет важную роль в выявлении рецидивов у бессимптомных пациентов с повышенным уровнем опухолевых маркеров и пациентов с отрицательными или сомнительными результатами традиционных методов визуализации. Также метод позволяет контролировать реакцию на терапию и своевременно изменять схемы лечения. Более чем в 30% случаев после проведения ПЭТ/КТ курс лечения изменен. Наличие неоспоримых преимуществ гибридной визуализации может сделать этот метод ключевым в онкологии. В этом реферате дается обзор о состоянии ПЭТ / КТ с 18F-ФДГ в диагностике на сегодняшний день, какие есть рекомендации, возможности и ограничения метода.
ВВЕДЕНИЕ
Позитронно-эмисионная томография совмещенная с компьютерной томографией (ПЭТ/КТ) является новым гибридным методом визуалиции, который содержит в себе ключевые положительные моменты обоих исследований. Отличительной чертой является именно наличие гибридного томографа, а не простое наложение изображений. Не являясь ещё повсеместно распространенным в нашей стране, этот метод очень динамично развивается в рамках частно-государственного сотрудничества – (более 90% квот в г.Москва реализовали учреждения частного сектора). Наиболее оснащенной по количеству гибридных томографов является г. Москва ( примерно 1,2 на 1 млн жителей). Годовой прирост количества обследований составил более 240% за 2017г. За 2018г определяется увеличение прироста на более 180% (34299 ПЭТ/КТ исследований), или 2722 ПЭТ/КТ исследований на 1млн человек. Однако, по научно-документальной базе — это очень «молодой» метод (по запросу «ПЭТ КТ (PET CT)» на отечественном ресурсе elibrary.ru — всего 446 работ (за все время), а на зарубежном — pubmed.gov 10,525 результатов).
Метод визуализации с фтордезоксиглюкозой (ФДГ), меченной радиоактивным фтором-18 (18F-ФДГ) значительно изменила подход к лечению. С введением комбинированных сканеров ФДГ-ПЭТ/КТ, произошло значительное улучшение в дифференциальной диагностике злокачественных новообразований (ЗНО) и точности их локализации. Поскольку коррекция аттенуации может быть достигнута с помощью КТ-изображений, время исследования ПЭТ значительно сократилось, во многих случаях на 50% и более, например, на рынке сейчас появился аппарат GE Discovery IQ c временем сканирования 10-12 мин для стандартного обследования и дополнительным пакетом постобработки QClear, который значительно увеличивает соотношение сигнал/шум получаемых изображений.
Первично были разделены компьютерная томография (КТ) и позитронно-эмиссионная (ПЭТ). По КТ мы можем получить данные о структурных изменениях, а по ПЭТ – функциональные, а в настоящее время появилась возможность объединить их. Получение изображений ПЭТ строиться на использовании нестабильных изотопов при переходе их в стабильное состояние, высвобождается позитрон. Он в свою очередь сталкиваясь с орбитальным электроном аннигилирует с образованием двух гамма-квантов, движущихся в диаметрально противоположных направлениях ( с известной энергией — 511 кэВ). Для их регистрации используют систему детекторов, которые соединены в электронную систему «совпадений». При регистрации сигнала с двух противоположных детекторов можно утверждать, что точка аннигиляции находиться на линии между ними, а по разнице появления сигнала на них можно определить положение места распада изотопа на этой линии (или молекулы F18-ФДГ). При таком подходе коллиматоры не нужны, это свойство было названо «электронной коллимацией».
Для проведения исследования необходим циклотрон (для синтеза радионуклидов), биосинтезатор (для присоединения к молекулам полученных изотопов) и гибридный ПЭТ/КТ томограф. Пригодными для ПЭТ являются и другие радионуклиды, как О15, N13, Rb82, Ga68 и другие. Однако, наибольшее распространение нашел радиофармпрепарат (РФП) – 18F-ФДГ. Он удобен как с точки зрения получаемой информации, так и с учётом достаточно длительного периода полураспада (110 мин). Его можно синтезировать в отдельном центре с медицинским циклотроном, а затем перевезти в ближайшие медицинские диагностические центры для проведения исследований.
Компьютерная томография – метод основанный на ослаблении рентгеновского излучения в различных средах. В настоящее время используются «мультиспиральные» или «мультисрезовые» томографы, позволяющие получать субмиллиметровые срезы с возможностью их реконструкции в любых плоскостях. Для получения изображения используется вращающаяся рентгеновская трубка и несколько рядов детекторов, расположенных в кольце гентри. А при сканировании пациент на автоматическом столе движется перпендикулярно плоскости узкого пучка рентгеновского излучения, совокупность этих двух движений и дает «спираль сканирования». На данный момент доступны 640-срезовые томографы с временем вращения трубки менее 0,5 с, позволяющие получать изображение без динамических артефактов за один оборот трубки. Плотность тканей измеряется по шкале Хаунсфилда, универсальной для всех томографов, где 0 соответствует плотности воды.
Дополнительные преимущества комбинированных изображений ПЭТ / КТ заключаются в способности преодолевать ограничения критериев размера, используемых для предположения наличия опухолевых отложений в лимфатических узлах нормального размера, и его способность локализовать и охарактеризовать функциональный аспект анатомического субстрата. Таким образом, комбинированные КТ/ПЭТ-изображения дают преимущество демонстрации метаболизма и структуры одновременно. Однако при простом наложении изображений от двух модальностей, им не хватало пространственного разрешения, так как эти изображения были получены отдельно и позже «слиты», возникали проблемы с определением точной локализации онкологического процесса. Разработка специальной гибридной системы КТ/ПЭТ преодолела многие проблемы, возникающие при объединении изображений КТ и ПЭТ, и это в целом улучшило уверенность радиологов в выявлении заболеваний, их локализации, а также их распространённости, что привело к заметному снижению неопределенных или сомнительных результатов.
В онкологии ПЭТ/КТ выгодно отличается от «чисто» анатомо-топографических методов лучевой диагностики (магнитно-резонансной и рентгеновской компьютерной томографии, ультразвуковой томографии), которые могут отслеживать динамику неопластического процесса по изменению размеров и структуры. Специфичность ПЭТ заключается в возможности определения его биологической активности, а также измерить степень жизнеспособности по степени накопления метаболическиактивного РФП в тканях. Этот метод позволяет получить уникальную информацию о перфузии и метаболизме нормальных и патологически измененных тканей, определить молекулярную биологию опухоли, оптимально подобрать химиотерапию, оценить чувствительность к конкретным методам терапии. Данные, полученные при ПЭТ/КТ, могут иметь решающее значение на всех этапах лечения онкологических больных (от первичного стадирования до отдалённого наблюдения).
Метаболизм 18F-ФДГ
Раковые клетки перестраивают свои метаболические пути, чтобы способствовать росту, пролиферации и выживанию. Общей чертой для поддержания этого динамического процесса является повышенный метаболизм и поглощение глюкозы для максимальной выработки энергии и обеспечения быстрого роста и деления злокачественных клеток. Это явление объясняется эффектом Варбурга, который утверждает, что раковые клетки будут иметь повышенное поглощение глюкозы, чтобы приспособиться к быстрой пролиферации. Это как раз и служит основой для ФДГ, биологического аналога глюкозы, которая поглощается клетками с повышенным потреблением глюкозы. Таким образом, раковые клетки будут активно накапливать ФДГ и могут быть визуализированы с использованием ПЭТ / КТ.
Молекула 18F-ФДГ после поглощения клеткой фосфорилируется гексокиназой (у большинства опухолевых клеток повышается её концентрация в митохондриях, также увеличивается активность трансмембранного транспорта глюкозы, фосфо-фруктокиназы и пируватдегидрогеназы). Следующий этап метаболизма глюкозы происходит с участием атома кислорода, а он заменен на фтор-18, поэтому последующих реакций с молекулой 18F-ФДГ не происходит.

Большинство опухолей, как правило, поддерживают этот путь и, следовательно, имеют тенденцию казаться более активными («горячими»), чем нормальные ткани. Причем множество исследований определяют зависимость между повышенным уровнем гликолиза и скоростью распространения опухоли, её злокачественным потенциалом.
Однако и доброкачественные процессы могут захватывать глюкозу. Кроме того, нормальное физиологическое поглощение может симулировать или скрывать заболевание (например, повышенный метаболизм в головном мозге, щитовидной железе, накопление ФДГ в мышцах после тренировки, в «буром» жире, в миокарде левого желудочка). К тому же большая часть тканей не может отщепить фосфат от полученного соединения после реакции с гексокиназой (исключением являются печень и почки), поэтому 18F-ФДГ накапливается в клетках и задерживается в них, до их разрушения. Этот эффект позволяет выявить «горячие» очаги с повышенным метаболизмом специфического характера. Вводят препарат внутривенно, до сих пор не известно о серьезных побочных реакциях после инъекции 18F-ФДГ.
Основным параметром определения активности является стандартное значение поглощения (SUV) или производное от него — максимальное значение SUV в обозначенном объёме (SUVmax). К сожалению, этот легко получаемый параметр, не может дифференцировать злокачественное новообразование от инфекционного и воспалительного поглощения, и не было найдено надежного, абсолютного порога SUV, который можно использовать для клинического различия доброкачественного и злокачественного поглощения из-за сходного механизма накопление ФДГ между опухолевыми клетками и лейкоцитами. Примерным общепринятым критерием разграничения воспаления и рака служит SUV выше 2,5 . Однако изменение активности очень зависит от введённой дозы, марки и модели аппарата, соблюдения подготовки, сроков и вида проведенной терапии, и как следствие большая вариативность показателей, даже у отдельно взятого пациента. При изучении мета-анализов, такой порог SUV варьировался от 5 до 15 (в зависимости от исследований), что говорит о том, что его использование зависит от места сканирования и специалистов.
В дополнение к обычным параметрам SUV, отражающим уровень поглощения метки очагом поражения, могут быть использованы другие параметры, такие как метаболически активный объем опухоли (MATV), который отражает объем поглощения опухоли, общий гликолиз поражения (TLG) определяется как произведение MATV на среднее значение SUV (среднее SUV каждого вокселя в объеме опухоли). Мета-анализ и несколько исследований показали, что количественные данные ПЭТ, такие как SUVmax, SUVmean, MTV, TLG, сильно и отрицательно коррелируют с выживаемостью. Пороговые значения для этих параметров при идентификации пациентов с высоким риском в литературе имеют широкий диапазон: для SUVmax 9–18, для MTV 9–30 мл и для TLG 56–70. Это изменение порогов отражает отсутствие стандартизации протоколов визуализации и методов постобработки в рамках исследований. На сегодняшний день исследователи не смогли точно определить пороговые значения для MATV и TLG, которые могли бы использоваться для определения точного прогноза. В отсутствие воспроизводимого порога, который можно было бы обобщить для всех исследований, прогностическая ценность количественных параметров (SUV, MATV или TLG) остается сомнительной. Как следствие, единственным международно признанным прогностическим показанием для ПЭТ-КТ является точное стадирование. Учитывая, что все еще существует некоторая неопределенность в отношении того, какие из этих параметров являются лучшими предикторами, необходимы дополнительные исследования или экспертные рекомендации для оптимизации порогов, позволяющих стратифицировать риск для потенциального клинического использования.
Определение распространённости процесса
Основной задачей диагностики на первых этапах выявление заболевания и оценка его распространённости, для этого используется международная классификация стадий новообразований (TNM). Сейчас ПЭТ/КТ вводиться в рекомендации как обязательный метод для стадирования по ТNМ 8 и ACR 2020 (американский колледж радиологов). Возможно за одну процедуру определить полностью распространение процесса по всему организму. Наиболее важным, по моему мнению, является именно N , т.к. при отсутствии поражения или вовлечении лимфоузла уровня N1 — преимущественно проводят хирургическое лечение, а вот уже при поражении N2 хирургическое вмешательство уже является предметом споров как по прогнозу, так и по эффективности. Метаболическая информация часто более чувствительна, чем обычная визуализация, особенно при рецидивирующих процессах. 18F-ФДГ-ПЭТ/КТ превосходит обнаружение опухолевых лимфатических узлов, имеющих нормальный размер, а также характеризует степень поражения увеличенных лимфоузлов. Отрицательная прогностическая точность ПЭТ/КТ поражения лимфоузлов составляет выше 90%.
По Т-стадированию, конечно, ПЭТ/КТ проигрывает магнитно-резонансной томографии (МРТ), но обыгрывает его в оценке распространённости процесса. Тем не менее ПЭТ / КТ, выполненная с КТ с контрастным усилением, обеспечивает анатомические и метаболические детали соизмеримые по чувствительности с МРТ, однако сейчас нет четкой рекомендации для рутинного использования ПЭТ / КТ при начальной стадии Т.
Для М-стадирования по различным данным чувствительность и специфичность ПЭТ/КТ с 18F-ФДГ превосходит 95%. Также есть возможность диагностики и динамики недоступных для УЗИ образований. По прогнозам следует ожидать замену комбинации УЗИ и биопсии сторожевого подмышечного лимфоузла на ПЭТ/КТ. Сцинтиграфия, ОФЭКТ и ПЭТ методы уже вытеснены ПЭТ/КТ за счёт скорости обследования, точности полученных данных, более высокой контрастности и разрешении. МРТ всего тела выступает главным конкурентом в определении распространённости процесса и является весьма перспективным методом, но из-за отсутствия нормативной базы (нет стандартизации показателей диффузии, числовых значений карт диффузии и b-фактора), сложности и длительности процедуры, необходимости наличия обширного опыта у клинической команды и рентгенологов не получило такого широкого распространения, однако на фоне постоянного совершенствования аппаратуры за этим методом представляется большое будущее.
Было также показано, что 18 F-ФДГ-ПЭТ и 18 F-ФДГ ПЭТ/КТ очень полезны для определения наиболее подходящего поражения для биопсии, а также его наиболее активной части, особенно на фоне изменённых тканей (ателектаз, фиброзные или постхирургические изменения). Однако нет однозначных данных на сколько это влияет на выживаемость. КТ / ПЭТ также часто используются при планировании лучевой терапии, и в одном из мета-исследований получены следующие данные: после проведения 18F-ФДГ разграничение общего объема опухоли (GTV) было увеличено на 25% случаев рака головы и шеи, легких более в 17% и в 33% опухолей таза. GTV был снижен на 25% или менее в 33% случаев рака головы и шеи, 67% случаев рака легких и 19% случаев рака таза. Общий объем лечения был изменен у 56% пациентов с помощью КТ / ПЭТ. Многочисленные исследования подтверждают рутинное использование 18F-ФДГ ПЭТ/КТ для определения целевых объемов при немелкоклеточном раке легкого (NSCLC), раке головы и шеи, лимфоме и раке пищевода. Обнадеживающие результаты были представлены и при других видах рака.
Контроль лечения
Примерно в 40-50% случаев происходит изменение или корректировка лечения на основе полученных данных ПЭТ/КТ. Например, реакция опухоли после лучевой терапии определяет последующие этапы ведения пациента (наблюдение, адъювантное или неадьювантное лечение, паллиативная помощь и т.д.).
Цели ПЭТ / КТ варьируются в зависимости от времени проведения:
— ПЭТ-КТ во время химиолучевой терапии (промежуточная оценка): цель состоит в том, чтобы изменить план лучевой терапии в соответствии с изменениями объема или функции опухоли. Временной интервал довольно узок, так как слишком рано ПЭТ / КТ может не обнаружить ответ опухоли, а если прождать слишком долго, визуализация может быть нарушена последующим воспалением, что снизит вероятность значительного изменения плана лучевой терапии;
— после проведенного лечения: оценить ответ и адаптировать последующее лечение, например, выбрать политику «смотреть и ждать», а не запланированную операцию в случае полного ответа;
— после химиолучевой терапии: для оценки ответа и выявления раннего рецидива, (не менее чем через 3 месяца после лучевой терапии для большинства видов рака);
— во время последующего наблюдения выявить и / или локализовать рецидив в рубце или метастазирование.
Оценка реакции опухоли во время химиолучевой терапии, возможно, открывает путь к снижению целевых объемов в случае регрессии опухоли, к снижению дозы лучевой терапии при чувствительных опухолях или к увеличению интенсивности лечения (общая доза, ускорение лучевой терапии, объём операции и т. д.) при резистентных опухолях. На практике, план лучевой терапии будет адаптирован («адаптивная лучевая терапия») к реакции опухоли путем повторного разграничения целевого объема, а также увеличения общей дозы облучения за фракцию. Эти адаптации так же были облегчены с помощью радиотерапии с модуляцией интенсивности (IMRT), где дозы, доставляемые в каждом «пучке», различны. При объединении нескольких модулированных пучков или вращающихся на 360 ° гентри вокруг пациента достигаются сложные и намеренно гетерогенные распределения дозы, которые точно соответствуют форме мишени и биологическим субобъемам. В идеале информация о реакции опухоли получается достаточно рано, чтобы можно было изменить значительную часть курса лучевой терапии.
Многочисленные исследования подтверждают будущую роль ПЭТ/КТ в прогнозировании ответа на неадъювантную химиотерапию. ПЭТ/ КТ имеет более высокую диагностическую ценность для стратификации прогностического риска по сравнению с традиционными методами. Действительно, некоторые метастатические поражения, такие как метастазы в кости, трудно оценить с помощью КТ. Как следствие, визуализация FDG PET была включена в пересмотренные критерии RECIST 1.1, и в настоящее время обнаружение новых поражений с помощью ФДГ ПЭТ используется для классификации пациента с прогрессирующим заболеванием. Считается, что ПЭТ-визуализация является подходящим инструментом для оценки лечения метастатического заболевания и обычно используется для контроля его лечения. Тем не менее, критерии интерпретации ПЭТ не так хорошо определены, как для компьютерной томографии, и, чаще всего, анализ является качественным и, следовательно, частично субъективным. RECIST далеко не всегда работает т.к. все же основана на диаметрах, на ее место приходит iRC, PERCIST и другие системы оценки, т.к. анатомическая регрессия обычно отстает от метаболической гибели клеток. Целью обследования после начальной и окончательной химиолучевой терапии является получение определённого ответа от врача-радиолога, для этого стараются внести стандартизацию заключений. Например, несколько классификаций (EORTC, PERCIST) различают 4 вида ответа по ПЭТ/КТ (прогрессирующее заболевание, стабильное заболевание, частичный ответ и полный ответ). 5-балльная шкала (критерии Deauville) была установлена для ФДГ-зависимой лимфомы, она дополнительно включает неопределенный ответ. Аналогичная 5-уровневая шкала была предложена для пациентов с местно-распространенным раком шейки матки, для которых 18F-FDG ПЭТ / КТ проводят через 3 месяца после радикальной химио- радиотерапии. Критерии Хопкинса были разработаны у пациентов с раком головы и шеи и разделяют первичную опухоль, правую и левую сторону и общую оценку.
Новые быстро развивающиеся направления такие как радиомика и радиогеномика (комплексная количественная оценка фенотипов опухолей путем применения большого количества количественных характеристик изображения) отмечают высокую значимость получаемых данных. Например, 18F-ФДГ ПЭТ / КТ были проведены до, через 2 недели после начала и через 4 недели после завершения начальной химиолучевой терапии у 27 пациентов с раком прямой кишки. Коэффициент вариации, текстурный параметр, связанный с гетерогенностью поглощения опухоли, рассчитанный на ПЭТ-КТ во время лечения, имел 68% чувствительности и 88% специфичности для прогнозирования гистопатологического ответа. Цифры составили 79% и 88% соответственно для ПЭТ-КТ после химиолучевой терапии.
Первичная (неадъювантная) химиолучевая терапия обычно является частью стандартного лечения местно-распространенного операбельного рака (например, прямой кишки и пищевода). Для локально-распространенного рака прямой кишки стандартным подходом является предоперационная химиолучевая терапия с последующей хирургической операцией. В случае полного клинического ответа после химиолучевой терапии у пациентов с высоким риском может быть принята политика «наблюдай и жди». В отношении плоскоклеточного рака пищевода рекомендации ESMO предусматривают, что после химиотерапии следует хирургическое вмешательство и окончательная химиотерапия, что является одинаково эффективным с точки зрения общей выживаемости. Пациентам, не желающим проводить операцию на пищеводе или имеющих медицинские противопоказания для проведения серьезного хирургического вмешательства, может быть предложена окончательная химиолучевая терапия. Как вариант, спасательная операция может обсуждаться в случае неполного ответа или локального рецидива после химиолучевой терапии. Достаточное количество доказательств подтверждает использование предоперационной лучевой терапии, а также неадъювантной химиотерапии терапии, и обе могут быть одинаково рекомендованы. Стратегия наблюдения и ожидания не может быть рекомендована при аденокарциномах до достижения полного морфологического ответа из-за небольшого количества научных работ. Что касается плоскоклеточного рака, то необходимо ещё выяснить соотношение пользы и риска между хирургическим вмешательством и наблюдением.
Изучение реакции опухоли в конце окончательной химиолучевой терапии полезна для прекращения лечения или дальнейшего паллиативного лечения. Морфологический ответ (размер опухоли на КТ) может отставать на несколько недель или месяцев от изменений в поглощении ФДГ, поэтому ПЭТ / КТ 18F-ФДГ может раньше и более точно определить терапевтический ответ, чем анатомические изменения. Однако лучевая и химиотерапия могут вызывать воспалительные изменения и диффузное повышение накопления 18F-ФДГ в неизмененных тканях, окружающих опухоль, что дает ложноположительные результаты. Основными видами рака, для которых наблюдаются ложноотрицательные результаты, являются типичные карциноидные опухоли, муцинозные раки и некоторые ранние формы аденокарциномы, такие как аденокарцинома in situ. Эти ограничения визуализации ПЭТ / КТ после лечения приводили к нежеланию его рутинного использования. Идеальное время для первого исследования ФДГ-ПЭТ после лучевой терапии может зависеть от типа рака и еще точно не определено. Высокие показатели ложноположительных и ложноотрицательных результатов были зарегистрированы, когда ПЭТ / КТ были получены слишком рано после завершения лучевой терапии. 18F-ФДГ ПЭТ / КТ следует выполнять по крайней мере через 3 месяца после лучевой терапии, чтобы избежать ложноположительных результатов из-за индуцированного постлучевого воспаления.
Широкий спектр клинических ситуаций, вариантов лечения (лучевая терапия может быть предоставлена отдельно, связанная с последовательной / сопутствующей химиотерапией, предшествующей операцией) и технических данных получения изображений приводит к широкой неоднородности в литературе. В результате чёткие рекомендации и доказательства отсутствуют во многих случаях.
Наблюдение и прогноз
ПЭТ / КТ обладает высокой чувствительностью и специфичностью для выявления локально-регионарных рецидивов и рекомендуется пациентам с бессимптомным течением опухолевых маркеров. Особенно значимыми являются данные получаемые при лимфопролиферативных заболеваниях. Лимфоузел после терапии может остаться неизменным по структуре и размерам, хотя в нем уже может и не быть опухолевой ткани, при этом чувствительность и специфичность составляет более 95%, а положительное и отрицательное прогностическое значение ПЭТ/КТ с ФДГ при диагностике активной ткани лимфомы достигает 100% и 80% соответственно. ПЭТ/КТ-визуализация может быть полезна для дифференциальной диагностики рецидивов или остаточных заболеваний, фиброза после лучевой терапии. Было показано, что метод хорошо работает для выявления рецидивов средостения или отдаленных метастатических участков. Эффективность только ПЭТ, ПЭТ-КТ и традиционных методов визуализации (рентгенография, КТ, сцинтиграфия костей и МРТ) для выявления рецидивирующего рака легкого сравнивали в метаанализе 13 исследований (1035 пациентов). Чувствительность и специфичность ПЭТ-КТ были значительно выше, чем у обычных изображений. Чувствительность ПЭТ/КТ, ПЭТ и обычной визуализации была оценена в 94%, 90% и 78% соответственно. Специфичность была 90%, 84% и 80%, соответственно.
Последующее наблюдение при многих раковых заболеваниях с использованием 18F-ФДГ ПЭТ/КТ считается превосходящим или эквивалентным традиционным методам для обнаружения локального или отдаленного рецидива. Однако есть некоторые нюансы его использования:
1) локальные воспалительные изменения и фиброз после лечения приводят к ложноположительным результатам и изменяют специфичность метода;
2) обнаружение метастазов головного мозга с помощью ПЭТ / КТ имеет те же ограничения, что и на стадии первичного стадирования;
3) следует принимать во внимание дополнительное облучение и более высокие медицинские расходы, связанные с ПЭТ / КТ.
Однако, основное отличие 18F-ФДГ ПЭТ/КТ для последующего наблюдения заключается в его высокой чувствительности и высокой отрицательной прогностической ценности. Доказано, что при неоднородности опухоли, в областях с более высокими значениями SUV существует более высокий риск рецидива и они являются целевыми объёмами для повышения дозы радиотерапии. Несколько метаанализов показали, что этот параметр как до, так и после химиолучевой терапии является независимым прогностическим показателем. ПЭТ/КТ с 18F-ФДГ представляет интерес так же для выявления рецидивов, доступных для тотального удаления на фоне местно-регионарной недостаточности, второго первичного рака или метохромного заболевания. Например, эффективность ПЭТ / КТ 18F-ФДГ при выявлении раннего рецидива или второго первичного рака ретроспективно сравнивали с КТ шеи и физикальным обследованием/эндоскопией у 99 пациентов с терапевтическим лечением. Чувствительность, специфичность, положительные и отрицательные прогностические значения для выявления местного рецидива, регионального рецидива, отдаленного рецидива и второго первичного рака составляли 100%, 87%, 57% и 100% соответственно для 18F-ФДГ ПЭТ/КТ, по сравнению с 62%, 95%, 67% и 94%, соответственно, для КТ шеи, 23%, 99%, 75% и 89%, соответственно, для физического обследования/эндоскопии. У 19 пациентов с истинно положительной 18F-ФДГ ПЭТ / КТ полученные данные свидетельствуют о значительном изменении в ведении заболевания, что вызвало либо повторное лечение, либо системную терапию. Метаанализ 23 исследований (2247 18F-ФДГ ПЭТ/КТ) показал, что примерная чувствительность и специфичность метода 92% и 87%, соответственно, для выявления рецидивов. Одним из вариантов для наблюдения онкологических пациентов было предложено объединить раннее (12 недель после химиолучевой терапии) и позднее (1 год) 18F-ФДГ ПЭТ/КТ для повышения частоты выявления рецидива. Хотя 18F ФДГ ПЭТ/КТ признана как потенциально полезный метод при наличии сомнительных результатов, этот подход еще не рекомендуется однозначно при типичных случаях. Синергизм между ПЭТ / КТ 18F-ФДГ и комбинированной МРТ еще только предстоит изучить ввиду ещё зачаточного и очень затратного ПЭТ-МРТ исследования.
ВЫВОДЫ
ПЭТ/КТ в настоящее время считается приемлемым, полезным клиническим инструментом в онкологии, и является экономически оправданным. Его первоначальное использование при ограниченном количестве злокачественных новообразований в настоящее время расширяется, и он может стать стандартом и, возможно, доминирующим способом визуализации. Поскольку ФДГ имеет ограничения в диагностике некоторых злокачественных новообразований, таких как поражения мочеполового тракта и головной мозг, разрабатываются различные новые маркеры, которые повышают существующую ценность визуализации ПЭТ. При многих раковых заболеваниях ПЭТ/КТ потенциально необходима для промежуточной оценки во время лучевой терапии, в конце неадъювантной лучевой терапии, в конце окончательного или во время последующего наблюдения, стадирования, рестадирования, диагностики метастазирования и выявления рецидивов. Несмотря на эту полезность, прежде чем принимать решение о целесообразности, необходимо принимать во внимание экономическую эффективность. Кроме того, должна быть достигнута более строгая стандартизация параметров оценки, особенно для новых лучевых характеристик опухолей. В этой области еще предстоит оценить комбинированную ПЭТ/МРТ, можно надеяться на синергетический эффект двух методов для лучшей терапевтической оценки.
Получение изображений ФДГ ПЭТ показано как для локально-регионарной, так и для распространённой стадии рака (за исключением метастазов в мозг), когда методы первой линии (УЗИ, МРТ, КТ грудной клетки / брюшной полости / таза с внутривенным контрастированием), не обнаруживают присутствия удаленных метастазов. Отрицательные результаты ПЭТ-КТ на стадии N2 позволяют избежать необходимости инвазивного исследования, за исключением следующих случаев: опухоль с вовлечением окружающих органов, сомнения в поражении лимфатических узлов, крупные лимфатические узлы при КТ-сканировании или низкий уровень поглощения ФДГ первичной опухолью.
Уровень поглощения 18F-ФДГ, который можно определить количественно с использованием различных параметров визуализации ПЭТ (SUV, MATV, TLG), это имеет прогностическое значение, однако в отсутствие определенного порога на различных этапах лечения прогностическая ценность количественных параметров ПЭТ, таких как SUV, MATV или TLG, остается сомнительной.
ПЭТ-КТ является потенциально значимым методом оценки ответа на неадъювантное лечение , сопутствующую радиохимиотерапию и химиотерапию у пациентов с метастатическим распространением. ПЭТ-КТ также представляется многообещающим для мониторинга пациентов, с рецидивирующим течением, множественными разнородными злокачественными образованиями или получающих лечение от других заболеваний. Тем не менее, его роль для этих показаний и его потенциальные преимущества по сравнению с другими методами необходимо подтвердить с помощью большего числа проспективных многоцентровых исследований.
ПЭТ-КТ с ФДГ работает лучше, чем КТ и МРТ, для определения целевого объема при планировании лучевой терапии , однако его потенциальное положительное влияние на общий уровень медицинской помощи и, в частности, на выживаемость пациентов еще предстоит подтвердить.
СПИСОК ЛИТЕРАТУРЫ
1. Абашин С.Ю., Аникеева О.Ю., Головин П.С., Иванников В.В. Клинические аспекты ПЭТ/КТ-диагностики опухолей репродуктивной системы. Онкогинекология, 2015; 3: 66-74
2. Абоян И.А., Березин К.В., Хасигов А.В. и др. ПЭТ/КТ в диагностике и дифференциальной диагностике адренокортикального рака. Онкоурология 2019;15(4):113–9.
3. Богатырева Т.И., Терехова А.Ю., Данилова М.А., Фалалеева Н.А. Промежуточная пэт/кт в оценке чувствительности больных лимфомой ходжкина к химиотерапии в различных прогностических группах. Исследования и практика в медицине 2019; 6 (S): 71-72
4. Г. Е. Труфанов, И. В. Бойков, В. В. Рязанов. Совмещенная позитронно-эмиссионная и компьютерная томография в характеристике рецидивов злокачественных новообразований органов грудной клетки и брюшной полости. Визуализация в медицине, 2016; 1(1): 30-37.
5. Гележе П. Б., Морозов С.П., Мандельблат Ю.Э., Либсон Е.И. Оценка ответа на терапию лимфом при помощи ПЭТ/КТ: сравнительный обзор критериев PERCIST 1.0 и CHESON 2007. Медицинский алфавит, 2014; 1-2 (8): 19-23.
6. Ж.Ж. Жолдыбай, Ж.К. Жакенова, Е.В. Филиппенко, Ж.Б. Аманкулова, Н. Бурхан, М.М., С.С. Байгулова, Ю.Т. Дауытова, А.Т. Канатова. Совмещенная позитронно-эмиссионная и компьютерная томография для диагностики рака легкого: ложноположительные и ложноотрицательные результаты (обзор литературы). Онкология и радиология Казахстана, №4 (54) 2019: 41-44
7. Жарков В.В., Подобед А.В., Парамонова Н.Ю. Позитронно-эмиссионная томография совмещенная с компьютерной томографией в диагностике диссеминированных поражений легких у онкологических пациентов. Онкологический журнал, 2019; 1(49): 50-54.
8. И. Л. Киселев, И. С. Пискунов, В. В. Хвостовой, С. М. Шевченко. Риск ориентированная модель расчета потребности в ПЭТ/КТ с фтордезоксиглюкозой у больных со злокачественными новообразованиями, сформированная на основании анализа 7 формы федерального статистического наблюдения. Лучевая диагностика и терапия, 2017; 4 (8): 87-94
9. Ипатов В. В., Бойков И.В., Мостовая О.Т. и др. ПЭТ/КИ и УЗИ — единый диагностический комплекс при лимфопролиферативных заболеваниях. Лучевая диагностика и терапия, 2017; 2 (8): 92-93
10. Машковцев К.А., Петренева Э.А. Опыт применения ПЭТ/КТ при планировании лучевой терапии в онкогинекологии. Уральский медицинский журнал, 2020; 2 (185): 34-36
11. Морозов С.П., Владзимирский А.В., Смолярчук М.Я. и др. Динамика показателей работы ПЭТ/КТ-центров в Москве в рамках системы обязательного медицинского страхования. Медицинская физика 2019; 4 (84): 34-35.
12. Морозов С.П., Смолярчук М.Я., Владзимирский А.В. ПЭТ/ КТ в здравоохранении Москвы: оснащенность, используемость, доступность. REJR 2018; 8(3):318-324.
13. Огнерубов Н. А., Шатов А. В., Шатов И. А. Радиогеномика и радиомика в диагностике злокачественных опухолей: обзор литературы. Вестник тамбовского университета. Серия: Естественные и технические науки, 2017: 22 (6-2): 1453-1460.
14. Российское общество радиологов и рентгенологов (РОРР) [Электронный ресурс] Режим доступа: https://russian-radiology.ru/, свободный
15. Рыжова О.Д., Долгушин М.Б., Михайлов А.И. и др. Позитронная эмиссионная томография с 18F-фтордезокси- глюкозой, совмещенная с компьютерной томографией, при плоскоклеточном раке головы и шеи (обзор литературы). Опухоли головы и шеи 2019;9(3):49–60.
16. Хоружик С. А., Жаврид Э. А., Дзюбан А. В., Поддубный К. В., Суколинская Е. В., Каленик О. А. Диффузионно-взвешенная магнитно-резонансная томография всего тела и позитронная эмиссионная томография, комбинированная с компьютерной томографией, при стадировании лимфом. Вестник радиологии и рентгенологии, 2019; 100 (6): 321-334.
17. American college of radiology (ACR) [Электронный ресурс] Режим доступа: https://www.acr.org/, свободный
18. Decazes P, Thureau S, Dubray B, Vera P. How to use PET/CT in the evaluation of response to radiotherapy. Q J Nucl Med Mol Imaging. 2018;62(2):152‐164.
19. European Society for Hybrid, Molecular and Translational Imaging (ESHI) [Электронный ресурс] Режим доступа: URL: https://www.eshi-society.org, свободный
20. Francis IR, Brown RK, Avram AM. The clinical role of CT/PET in oncology: an update. Cancer Imaging. 2005;5 Spec No A(Spec No A):S68‐S75. Published 2005 Nov 23.
21. Gaeta CM, Vercher-Conejero JL, Sher AC, Kohan A, Rubbert C, Avril N. Recurrent and metastatic breast cancer PET, PET/CT, PET/MRI: FDG and new biomarkers. Q J Nucl Med Mol Imaging. 2013;57(4):352‐366.
22. Groheux D, Espié M, Giacchetti S, Hindié E. Performance of FDG PET/CT in the clinical management of breast cancer. Radiology. 2013;266(2):388‐405.
23. Groheux D, Moretti JL, Giacchetti S, et al. Différents rôles de la TEP-TDM en sénologie : mise au point [PET/CT in breast cancer: an update]. Bull Cancer. 2009;96(11):1053‐1070.
24. Groheux D, Quere G, Blanc E, et al. FDG PET-CT for solitary pulmonary nodule and lung cancer: Literature review. Diagn Interv Imaging. 2016;97(10):1003‐1017.
25. Hegarty C, Collins CD. PET/CT and breast cancer. Cancer Imaging. 2010;10 Spec no A(1A):S59‐S62. Published 2010 Oct 4.
26. Huang SH, O’Sullivan B. Overview of the 8th Edition TNM Classification for Head and Neck Cancer. Curr Treat Options Oncol. 2017;18(7):40.
27. Lebron L, Greenspan D, Pandit-Taskar N. PET Imaging of Breast Cancer: Role in Patient Management. PET Clin. 2015;10(2):159‐195.
28. Park SB, Park JM, Moon SH, et al. Role of 18F-FDG PET/CT in patients without known primary malignancy with skeletal lesions suspicious for cancer metastasis. PLoS One. 2018;13(5): 196-808.
29. Paydary K, Seraj SM, Zadeh MZ, et al. The Evolving Role of FDG-PET/CT in the Diagnosis, Staging, and Treatment of Breast Cancer. Mol Imaging Biol. 2019;21(1):1‐10.
30. Rahman WT, Wale DJ, Viglianti BL, et al. The impact of infection and inflammation in oncologic 18F-FDG PET/CT imaging. Biomed Pharmacother. 2019;117:109168.
31. Riegger C, Herrmann J, Nagarajah J, et al. Whole-body FDG PET/CT is more accurate than conventional imaging for staging primary breast cancer patients. Eur J Nucl Med Mol Imaging. 2012;39(5):852‐863.
32. The International Society of Radiology (ISR) [Электронный ресурс] Режим доступа: http://isradiology.org/, свободный
33. The Radiological Society of North America (RSNA) [Электронный ресурс] Режим доступа: https://www.rsna.org/, свободный
34. Union for International Cancer Control (UICC) [Электронный ресурс] Режим доступа: https://www.uicc.org/, свободный
35. Yanarateş A, Budak E. Prognostic role of PET/CT in endometrial cancer. Ginekol Pol. 2019;90(9):491‐495
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Камаева И.А.
1
Лысенко И.Б.
1
Николаева Н.В.
1
Гайсултанова Я.С.
1
Саманева Н.Ю.
1
1 ФГБУ «Национальный медицинский исследовательский центр онкологии» Минздрава России
Первичная медиастинальная В-крупноклеточная лимфома (ПМВКЛ) – агрессивный вариант В-крупноклеточной лимфомы, клинически проявляющийся медиастинальный синдромом, синдромом верхней полой вены в связи с распространением большого конгломерата лимфоузлов в средостении. Диагностика данного варианта часто затруднена, и, если нет развития характерных клинических признаков, отсутствует периферическая лимфаденопатия, может являться случайной находкой. Несмотря на достижения иммунохимиотерапии в лечении данной патологии, остается большой процент пациентов, рефрактерных к лечению. Оценку динамики процесса проводят спустя 2–3 курса химиотерапии (ХТ) методами спирально-компьютерной томографии. Однако в настоящее время позитронно-эмиссионная томография (ПЭТ-КТ) играет не менее существенную роль как в первоначальной диагностике, стадировании процесса, так и в оценке эффекта от лечения. В зависимости от результатов ПЭТ-КТ существуют понятия «ПЭТ-позитивный ответ/результат», когда результат в баллах шкале Deauville составляет 4–5, «ПЭТ-негативный ответ/результат», когда результат в баллах шкалы Deauville составляет 1–2. Но не всегда ПЭТ-позитивный результат может считаться отсутствием эффекта от терапии. В исследовании обнаружена связь между общей и бессобытийной выживаемостью пациентов с ПМВКЛ и ПЭТ-ответом на проводимую терапию. Также выявлена более низкая выживаемость больных с ПМВКЛ при наличии «bulky disease».
первичная медиастинальная в-крупноклеточная лимфома
диагностика
общая выживаемость
бессобытийная выживаемость
пэт-кт
1. Luca Ceriani, Maurizio Martelli, Pier Luigi Zinzani, Andrés J. M. Ferreri, Barbara Botto, Caterina Stelitano, Manuel Gotti, Maria Giuseppina Cabras, Luigi Rigacci, Livio Gargantini, Francesco Merli, Graziella Pinotti, Donato Mannina, Stefano Luminari, Anastasios Stathis, Eleonora Russo, Franco Cavalli, Luca Giovanella, Peter W. M. Johnson, Emanuele Zucca; Utility of baseline 18FDG-PET/CT functional parameters in defining prognosis of primary mediastinal (thymic) large B-cell lymphoma. Blood. 2015. Vol. 126 (8). P. 950-956. DOI: 10.1182/blood-2014-12-616474.
2. Giulino-Roth L., O’Donohue T., Chen Z., Bartlett N.L., LaCasce A., Martin-Doyle W., Barth M.J., Davies K., Blum K.A., Christian B., Casulo C., Smith S.M., Godfrey J., Termuhlen A., Oberley M.J., Alexander S., Weitzman S., Appel B., Mizukawa B., Svoboda J., Afify Z., Pauly M., Dave H., Gardner R., Stephens D.M., Zeitler W.A., Forlenza C., Levine J., Williams M.E., Sima J.L., Bollard C.M., Leonard J.P. Outcomes of adults and children with primary mediastinal B-cell lymphoma treated with dose-adjusted EPOCH-R. Br J. Haematol. 2017. Vol. 179 (5). P. 739-747. DOI: 10.1111/bjh.14951.
3. Salem A.E., Zaki Y.H., El-Hussieny G., ElNoueam K.I., Shaaban A.M., Koppula B.R., Bustoros M., Salama M., Elsayes K.M., Morton K., Covington M.F. An Overview of Selected Rare B-Cell Lymphoproliferative Disorders: Imaging, Histopathologic, and Clinical Features. Cancers (Basel). 2021. Vol. 13 (22). P. 5853. DOI: 10.3390/cancers13225853.
4. Архипова О.Е., Черногубова Е.А., Тарасов В.А., Лихтанская Н.В., Кит О.И., Еремеева А.А., Матишов Д.Г. Уровень онкологических заболеваний как индикатор медико-экологической безопасности территорий (на примере Ростовской области) // Вестник Южного научного центра РАН. 2013. Т. 9. № 3. С. 7-14.
5. Камаева И.А., Лысенко И.Б., Николаева Н.В., Пушкарева Т.Ф., Капуза Е.А., Гайсултанова Я.С., Величко А.В. Применение иммунотерапии для лечения рефратерных форм лимфомы Ходжкина в реальной клинической практике // Южно-Российский онкологический журнал. 2021. № 2 (2). С. 34-41. DOI: 10.37748/2686-9039-2021-2-2-4.
6. Тумян Г.С. Значение лучевой терапии при первичной медиастинальной В-крупноклеточной лимфоме // Клиническая онкогематология. 2016. № 1. [Электронный ресурс]. URL: https://cyberleninka.ru/article/n/znachenie-luchevoy-terapii-pri-pervichnoy-mediastinalnoy-v-krupnokletochnoy-limfome (дата обращения: 12.01.2022).
7. Meignan M. Quantitative FDG-PET: a new biomarker in PMBCL. Blood. 2015. Vol. 126 (8). P. 924-926. DOI: 10.1182/blood-2015-07-653386.
8. Schmitz C., Hüttmann A., Müller S.P., Hanoun M., Boellaard R., Brinkmann M., Jöckel K.H., Dührsen U., Rekowski J. Dynamic risk assessment based on positron emission tomography scanning in diffuse large B-cell lymphoma: Post-hoc analysis from the PETAL trial. Eur. J. Cancer. 2020. Vol. 124. P. 25-36. DOI: 10.1016/j.ejca.2019.09.027.
9. Ильин Н.В., Тлостанова М.С., Ходжибекова М.М., Костеников Н.А., Тютин Л.А., Виноградова Ю.Н., Иванова Е.И., Иванова А.А., Крицкая А.В. Клиническая оценка значения позитронно-эмиссионной томографии всего тела с 18F-ФДГ при злокачественных лимфомах (обзор литературы) // Клиническая онкогематология. 2010. № 2. [Электронный ресурс]. URL: https://cyberleninka.ru/article/n/klinicheskaya-otsenka-znacheniya-pozitronno-emissionnoy-tomografii-vsego-tela-s-18f-fdg-pri-zlokachestvennyh-limfomah-obzor-literatury (дата обращения: 12.01.2022).
10. Wijetunga N.A., Imber B.S., Caravelli J.F., Mikhaeel N.G., Yahalom J. A picture is worth a thousand words: a history of diagnostic imaging for lymphoma. Br J. Radiol. 2021. Vol. 94 (1127). P. 20210285. DOI: 10.1259/bjr.20210285.
11. Illidge T., Mikhaeel N.G., Specht L., Yahalom J. Lymphoma: advances in imaging and radiotherapy — introductory editorial. Br J. Radiol. 2021. Vol. 94 (1127). P. 20219005. DOI: 10.1259/bjr.20219005.
12. Galimberti S., Genuardi E., Mazziotta F., Iovino L., Morabito F., Grassi S., Ciabatti E., Guerrini F., Petrini M. The Minimal Residual Disease in Non-Hodgkin’s Lymphomas: From the Laboratory to the Clinical Practice. Front Oncol. 2019. Vol. 9. P. 528. DOI: 10.3389/fonc.2019.00528.
13. Kirsch B.J., Chang S.J., Betenbaugh M.J., Le A. Non-Hodgkin Lymphoma Metabolism. Adv Exp Med Biol. 2021. Vol. 1311. P. 103-116. DOI: 10.1007/978-3-030-65768-0_7.
14. Ceriani L., Milan L., Johnson P.W.M., Martelli M., Presilla S., Giovanella L., Zucca E. Baseline PET features to predict prognosis in primary mediastinal B cell lymphoma: a comparative analysis of different methods for measuring baseline metabolic tumour volume. Eur. J. Nucl. Med. Mol. Imaging. 2019. Vol. 46 (6). P. 1334-1344. DOI: 10.1007/s00259-019-04286-8.
15. Pinnix C.C., Ng A.K., Dabaja B.S., Milgrom S.A., Gunther J.R., Fuller C.D., Smith G.L., Abou Yehia Z., Qiao W., Wogan C.F., Akhtari M., Mawlawi O., Medeiros L.J., Chuang H.H., Martin-Doyle W., Armand P., LaCasce A.S., Oki Y., Fanale M., Westin J., Neelapu S., Nastoupil L. Positron emission tomography-computed tomography predictors of progression after DA-R-EPOCH for PMBCL. Blood Adv. 2018. Vol. 2 (11). P. 1334-1343. DOI: 10.1182/bloodadvances.2018017681.
16. Oliveira M., Lasnon C., Nganoa C., Gac A.C., Damaj G., Aide N. Comprehensive analysis of the influence of G-CSF on the biodistribution of 18F-FDG in lymphoma patients: insights for PET/CT scheduling. EJNMMI Res. 2019. Vol. 9 (1). P. 79. DOI: 10.1186/s13550-019-0546-1.
17. Phillips E.H., Iype R., Wirth A. PET-guided treatment for personalised therapy of Hodgkin lymphoma and aggressive non-Hodgkin lymphoma. Br J. Radiol. 2021. Vol. 94 (1127). P. 20210576. DOI: 10.1259/bjr.20210576.
18. Fakhri B., Ai W. Current and emerging treatment options in primary mediastinal B-cell lymphoma. Ther Adv Hematol. 2021. Vol. 12. 20406207211048959. DOI: 10.1177/20406207211048959.
19. Takasaki H., Yamamoto W., Ishii Y., Takahashi H., Watanabe R., Harada T., Kawasaki R., Hashimoto C., Motomura S., Tomita N., Ishigatsubo Y., Sakai R. Post-treatment PET-CT Findings may predict the Prognosis of DLBCL with a Bulky Mass. Indian J. Hematol Blood Transfus. 2015. Vol. 31 (3). P. 346-351. DOI: 10.1007/s12288-014-0479-9.
20. Камаева И.А., Лысенко И.Б., Николаева Н.В., Капуза Е.А., Волошин М.В. Некоторые клинические факторы и терапевтические аспекты, влиящие на выживаемость пациентов с первичной медиастинальной в-крупноклеточной лимфомой // Современные проблемы здравоохранения и медицинской статистики. 2021. № 3. С. 50-66.
Первичная медиастинальная В-крупноклеточная лимфома (ПМВКЛ), не так давно выделенная в самостоятельную нозологию, является подтипом диффузной В-крупноклеточной лимфомы, возникающей из небольшой популяции В-клеток в тимусе [1]. Клинически характеризуется образованием конгломерата лимфоузлов в средостении с распространением на близлежащие ткани и органы. ПМВКЛ наблюдается преимущественно у молодых пациентов, а лечение агрессивными режимами химиотерапии в сочетании с ритуксимабом и лучевой терапией или без нее, по-видимому, дает лучшие результаты, чем при других ДВКЛ, отчасти в результате более молодого возраста пациентов, а 5-летняя выживаемость в недавних исследованиях составляет более чем 90% [2–5]. При прогнозировании риска раннего рецидива принято использовать Международный прогностический индекс, а также индекс, скорректированный по возрасту. Несмотря на агрессивность лечения, остается высокой частота рецидивов ПМВКЛ, а также первично-рефрактерных форм заболевания.
Согласно клиническим рекомендациям, оценку эффективности лечения проводят спустя 2–3 курса ХТ, а также после завершения иммунохимиотерапии. Наиболее информативным методом диагностики в таком случае является позитронно-эмиссионная томография (ПЭТ-КТ), чему посвящены многочисленные современные исследования [6–8]. ПЭТ-КТ – неинвазивный количественный метод визуализации биохимических, физиологических и биологических процессов in vivo. На сегодняшний день это наиболее специфичный и чувствительный метод визуализации. Опухоли имеют ускоренный гликолиз, при этом радиофармпрепарат (РФП) задерживается в тканях с повышенной метаболической активностью по сравнению с нормальными тканями [9].
Цель исследования: проанализировать результаты ПЭТ-контроля у пациентов после проведенного лечения, а также оценить общую и бессобытийную 5-летнюю выживаемость пациентов в зависимости от ПЭТ-ответа.
Материалы и методы исследования. В исследование были включены данные о 32 пациентах с установленным диагнозом первичной медиастинальной В-крупноклеточной лимфомы различных стадий, получающих лечение на базе онкогематологического отделения ФГБУ «НМИЦ онкологии» МЗ РФ в период с 2016 по 2021 гг. Пациенты разделены на группы в зависимости от ПЭТ-ответа, а также от полученной терапии. Статистическая обработка данных осуществлялась с использованием пакета STATISTICA13, метода Каплана–Мейера и логрангового критерия.
Результаты исследования и их обсуждение. ПЭТ-КТ для оценки эффективности иммунохимиотерапии применялась в качестве оценки динамики у всех 32 пациентов. Терапией первой линии во всех случаях стали стандартные CHOP-подобные режимы (R-CHOP, DAR-EPOCH) в сочетании с ритуксимабом (R).
ПЭТ-позитивный результат (4–5 баллов по шкале Deauville) после проведенной терапии 1-й линии наблюдался у 14 человек (43,75%). Среди этих пациентов преобладали больные с IV стадией процесса (85,7%), в основном за счет вовлечения легочной ткани и сосудов. «В-симптомы» наблюдались у 78,5% пациентов. ПЭТ-негативный результат (1–2 балла по шкале Deauville) наблюдался у 12 пациентов (37,5%), всем пациентам была назначена консолидирующая дистанционная лучевая терапия (ДЛТ). У 6 больных (18,75%) ответ расценен как неоднозначный результат (Deauville 3).
Средняя продолжительность жизни больных в группе с высокой метаболической активностью составила 30,8±9,0 месяца, тогда как у пациентов с низкой активностью – 34,5±4,2 месяца (р=0,0003). В группе пациентов, имеющих ПЭТ-позитивный ответ (4–5 баллов по шкале Deauville), 5-летняя общая выживаемость составила 32,1±14,6% (±SE), в то время как 5-летняя общая выживаемость в группе пациентов с низкой метаболической активностью составила 93,9±4,2% (±SE) (р=0,0003) (рис. 1).
В группе больных, имеющих ПЭТ-негативный результат, бессобытийная 50-месячная выживаемость составила 87,7±5,8% (±SE) (рис. 2). Средняя продолжительность бессобытийного периода жизни в группе пациентов, имеющих ПЭТ-позитивный ответ, составила 10,9±3,6 месяца, в группе пациентов с низкой метаболической активностью – 33,3±4,4 месяца (р=0,0000).
В нашем исследовании также обнаружена связь между наличием массивного конгломерата в средостении (bulky disease) и течением заболевания. В среднем объем конгломерата в средостении среди пациентов составил 109,73±60,55 мм (151; 222). В исследовании «bulky disease» обнаружен у 31 пациента (96,8%). ПЭТ-позитивный результат (4–5 баллов по шкале Deauville) в данной группе пациентов наблюдался у 12 больных (38,7%).
Средняя продолжительность жизни больных из группы пациентов, имеющих «bulky disease», составляет 28,5±4,3 месяца; в группе пациентов без «bulky disease» – 42,8±7,7 месяца. (±SE) (р=0,0111). Следует отметить, что 5-летняя общая выживаемость у пациентов без «bulky disease» составила 100% (рис. 3), в то время как у пациентов, имеющих «bulky disease», она составила 60,0±10,6% (±SE) (рис. 4). Медиана бессобытийной выживаемости достигнута только в одной группе пациентов с «bulky disease» и составляет 23,5 месяца. Средняя продолжительность бессобытийного периода жизни в группе без «bulky disease» – 35,8±7,0 месяца (±SE), а в группе c «bulky disease» – 21,8±3,8 месяца. Пятилетняя бессобытийная выживаемость без «bulky disease» – 87,5±8,3% (р=0,0086) (рис. 4), в то время как c «bulky disease» – 40,1±12,0% (±SE).
Рис. 1. Кривая общей 5-летней выживаемости по Каплану–Майеру в зависимости от наличия высокой метаболической активности по ПЭТ-КТ (4–5 баллов)
Группа 1 – пациенты, имеющие ПЭТ-позитивный ответ (4–5 баллов по шкале Deauville), обозначены синей линией.
Группа 2 – пациенты, имеющие ПЭТ-негативный ответ (1–3 балла по шкале Deauville), обозначены красной линией.
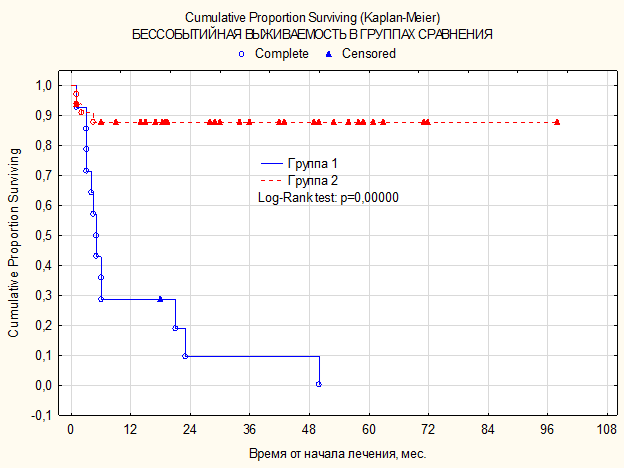
Рис. 2. Кривая бессобытийной выживаемости по Каплану–Майеру в зависимости от наличия высокой метаболической активности по ПЭТ-КТ (4–5 баллов)
Группа 1 – пациенты, имеющие ПЭТ-позитивный ответ (4–5 баллов по шкале Deauville), обозначены синей линией.
Группа 2 – пациенты, имеющие ПЭТ-негативный ответ (1–3 балла по шкале Deauville), обозначены красной линией.
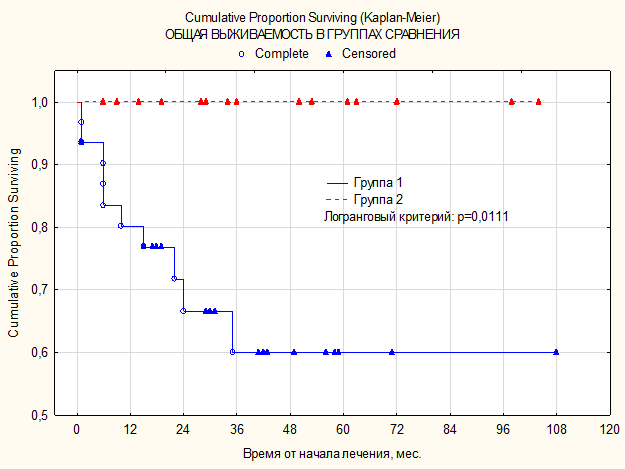
Рис. 3. Кривая общей 5-летней выживаемости по Каплану–Майеру в зависимости от наличия «bulky disease»
Группа 1 – пациенты, имеющие «bulky disease», обозначены синей линией.
Группа 2 – пациенты без «bulky disease», обозначены красной линией.
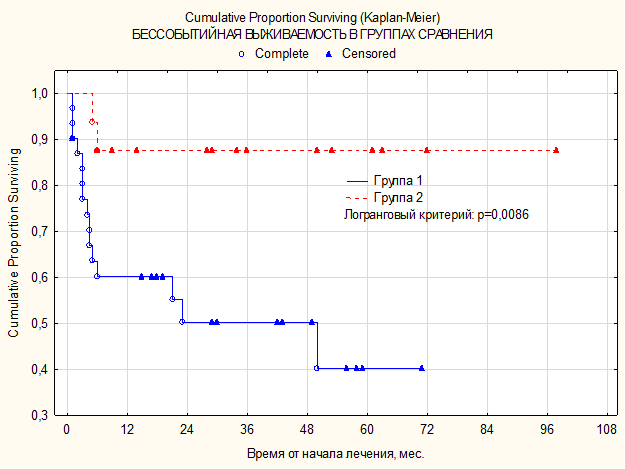
Рис. 4. Кривая бессобытийной выживаемости по Каплану–Майеру в зависимости от наличия «bulky disease»
Группа 1 – пациенты, имеющие «bulky disease», обозначены синей линией.
Группа 2 – пациенты без «bulky disease», обозначены красной линией.
По данным разных авторов, роль ПЭТ-КТ в диагностике неходжкинских лимфом (НХЛ) разной степени злокачественности противоречива [9, 10]. Имеются исследования о возможности дифференциальной диагностики ПМВКЛ и лимфомы Ходжкина (ЛХ) на основе некоторых лабораторных показателей и данных ПЭТ-КТ [11]. Также отмечается связь между накоплением Ki-67, накоплением РФП и прогнозом [12, 13]. ПЭТ-КТ может использоваться на различных этапах диагностики и лечения пациентов: как на этапе стадирования, так и для оценки проводимого лечения и определения тактики ведения больного. Все пациенты в нашем исследовании проходили контрольное исследование (ПЭТ-КТ) после завершения лечения и получали дальнейшую терапию в зависимости от результата.
Согласно литературным данным (L. Ceriani, L. Milan, PWM Johnson, 2019), сохранение ПЭТ-позитивности остаточного конгломерата может наблюдаться по нескольким причинам, одной из которых является накопление ФДГ остаточной тканью тимуса. В группе пациентов с неоднозначным ответом ориентировались на уровень накопления фармпрепарата в печени, что считается более информативным и прогностически значимым [14].
В статье (Pinnix CC, Ng AK,2018) ПЭТ-КТ применяется с целью возможности последующей интенсификации терапии при ПЭТ-позитивном результате [15]. Пациенты с ответом Deauville 4 и 5 после терапии по схеме DA-R-EPOCH нуждаются в обсуждении в каждом конкретном случае. В исследовании [16] 25 из 65 (38%) пациентов имели Deauville 4–5 после терапии DA-R-EPOCH, 12 из них в последующем перенесли рецидив. 2-летняя выживаемость без прогрессии составила 51%; при этом данный показатель был еще ниже для пациентов с Deauville 5 (22%).В этом исследовании ни у одного пациента с Deauville от 1 до 3 после DA-R-EPOCH не было зарегистрировано рецидива, что позволяет предположить, что оценка при помощи ПЭТ-КТ после DA-R-EPOCH может являться достоверной для таких пациентов.Это подтверждается и результатами недавнего исследования, в котором описаны данные о 156 взрослых пациентах с ПМВКЛ, получавших терапию DA-R-EPOCH, в котором 3-летняя безрецидивная выживаемость составила 95% для пациентов с Deauville 1–3 после терапии против 55% для пациентов с Deauville 4–5 [17]. В исследовании [18] не получено доказательств необходимости интенсификации лечения и перехода к терапии ко 2-й линии после CHOP-подобного режима c консолидацией ДЛТ и сохранении Deauville <5.
Стоит отметить отсутствие литературных данных относительно выживаемости пациентов с наличием «bulky disease» при ПМВКЛ. Согласно результатам исследования (H. Takasaki, W. Yamamoto, 2015), наличие «bulky disease» у пациентов с диффузной В-крупноклеточной лимфомой не коррелировало с ухудшением общей и бессобытийной выживаемости таких пациентов. В этом же исследовании оценивался ПЭТ-ответ в зависимости от наличия массивного конгломерата в средостении и без него. Общая выживаемость у пациентов с ПЭТ-позитивным результатом составила 34% против 75% у пациентов с ПЭТ-негативным ответом, бессобытийная выживаемость пациентов с ПЭТ-позитивным результатом и «bulky disease» составила 83% против 36% у пациентов с ПЭТ-негативным результатом (у=95%). Однако в данном исследовании при инвазии окружающих структур считалось, что у пациента – ПМВКЛ, что являлось критерием исключения [19].
Также существуют данные о возможных ложноположительных результатах вследствие остаточной ткани тимуса и применения моноклональных антител (МКА) и гранулоцитарных колониестимулирующих факторов (ГКСФ) в терапии 1-й линии [13]. Поскольку фтордезоксиглюкоза (ФДГ) поглощается инфильтрирующими опухоль лейкоцитами и ГКСФ, он стимулирует продукцию лейкоцитов и изменяет распределение ФДГ.
Выводы. Таким образом, ПЭТ-ответ может считаться фактором, влияющим на выживаемость пациентов с ПМВКЛ. Планирование дальнейшей терапии у пациентов с ПМВКЛ в зависимости от результатов ПЭТ-КТ является в настоящий момент критерием выбора для оценки динамики процесса и успешности проводимого лечения. В нашем исследовании ПЭТ-позитивный ответ (4–5 баллов) после проведенной ХТ 1-й линии коррелировал с более низкой общей и бессобытийной выживаемостью пациентов с ПМВКЛ. Особого внимания заслуживает распространенность ПЭТ-позитивных результатов у пациентов с наличием массивного конгломерата в средостении «bulky disease» (38,7%), так как наличие данного симптома может также служить причиной более низкой выживаемости больных с ПМВКЛ. При ПЭТ-негативном ответе пациентам в нашем исследовании проводилась ДЛТ, которая также улучшила общую выживаемость пациентов с ПМВКЛ [20]. Тактика ведения пациентов с неоднозначным ответом при ПЭТ-контроле требует дальнейшего изучения и обсуждения в каждом конкретном случае.
Ограничения исследования. Настоящее исследование имеет ряд ограничений, которые необходимо учитывать. Работа представляет собой одноцентровое ретроспективное исследование с небольшой выборкой пациентов, что могло повлиять на интерпретацию результатов.
Библиографическая ссылка
Камаева И.А., Лысенко И.Б., Николаева Н.В., Гайсултанова Я.С., Саманева Н.Ю. ПЭТ-ОТВЕТ КАК ПРЕДИКТОР ВЫЖИВАЕМОСТИ У ПАЦИЕНТОВ С ПЕРВИЧНОЙ МЕДИАСТИНАЛЬНОЙ В-КРУПНОКЛЕТОЧНОЙ ЛИМФОМОЙ // Современные проблемы науки и образования. – 2022. – № 1.
;
URL: https://science-education.ru/ru/article/view?id=31462 (дата обращения: 30.01.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Позитронно-эмиссионная томография в практике клинициста
Бойко Д.В., клинический ординатор кафедры госпитальной терапии №2 Челябинской Государственной Медицинской академии. Москва, Декабрь 2006
Позитронно-эмиссионная томография (ПЭТ) – это трехмерный визуализирующий лучевой метод исследования, основанный на способности радиоактивного изотопа накапливаться в тканях, обладающих высокой метаболической активностью.
Наиболее часто используемым изотопом является 2-дезокси-2-[фтор-18]-фторо-D-глюкоза (18-ФДГ ), аналог глюкозы, в котором гидроксильная группа замещена фтором-18. Период полураспада фтора-18 равен 110 минутам, что значительно больше, нежели у других изотопов, использующихся при ПЭТ. Так же могут использоваться изотопы: кислород-15 (период полураспада 2 минуты), азот-13 (период полураспада 10 минут) и углерод-11 (период полураспада 20 минут).
Изотопы для ПЭТ производятся в специальных ускорителях элементарных частиц – циклотронах. Получить изотоп для ПЭТ в простом ядерном реакторе невозможно, поскольку радиоактивная молекула инкорпорируется в биологическую молекулу (в глюкозу, например) для того, чтобы нормально участвовать в физиологических или патологических процессах организма, что невозможно воспроизвести в реакторе. Из-за избытка протонов в ядре, во время радиоактивного распада эти изотопы излучают позитроны (положительно заряженные электроны), являющиеся формой антиматерии. Позитроны быстро соединяются с электронами, и их масса переходит в энергию. При каждом таком событии (соединение позитрона и электрона) масса переходит в энергию в виде 2 мощных гамма-лучей или фотонов аннигиляции с энергией 511 кэВ, которые распространяются на 180? друг от друга. Современные ПЭТ-системы способны мгновенно распознавать такие пары фотонов аннигиляции, что и легло в основу концепции т.н. «электрического фазирования».
История вопроса и механизм методики
ПЭТ как метод исследования стала доступна около 20 лет назад – и только сейчас она начинает занимать достойное место среди методов исследования в клинике. Первоначально ПЭТ применялась для диагностики патологии головного мозга и сердца, т.е. тех локализаций, где были доступны более дешевые методы исследования (рутинное радиоизотопное исследование или УЗИ), где была возможна постановка диагноза клинически (например, при заболеваниях головного мозга) без получения данных о метаболизме в пораженном органе.
В 1990-х годах многие клиницисты стали достойно оценивать ПЭТ как метод, позволяющий поставить диагноз, определить стадию и оценить рецидив при многих злокачественных опухолях из-за высокой тропности изотопа 18-ФДГ к злокачественным клеткам с высокой метаболической активностью. Захват 18-ФДГ происходит по тому же механизму, что и захват обычной глюкозы, однако захват 18-ФДГ останавливается на этапе фосфорилирования аэробного гликолиза, изотоп соединяется с остатком фосфорной кислоты и остается в клетке. Это и обеспечивает получение снимков в течение 30-60 минут после инъекции, когда происходит фармакокинетическое распределение препарата по организму.
С конца 1990-х годов ПЭТ стала методикой, которая зарекомендовала себя, что стимулировало быстрый рост популярности и увеличение числа специалистов по ПЭТ среди радиологов, широкое одобрение методики, в особенности среди онкологов. Появлению рутинной ПЭТ способствовала доступность изотопа 18-ФДГ, чей период полураспада равен 110 минутам, таким образом, изотоп мог быть доставлен в любую клинику на расстояние 100 миль от любого крупного города США. На Ежегодном Симпозиуме Радиологов в Скоттсдейле в 2002 году была обсуждена настоящая и будущая роль ПЭТ с точки зрения методологии, технического обеспечения и клинической эффективности при многих заболеваниях .
Подготовка пациента к исследованию
Необходим голод в течение 4 часов (или несколько больше). В этот период пациент может употреблять только воду или некалорийные напитки для обеспечения гидратации и увеличения диуреза. Необходимо исследовать уровень глюкозы крови – он не должен превышать 13 ммоль/л. Высокие уровни глюкозы крови могут снизить захват 18-ФДГ клетками опухоли и ухудшить качество исследования, поэтому следует подумать о повторном проведении исследования, если уровень глюкозы выше 20 ммоль/л. Высокие уровни инсулина вследствие недавнего употребления углеводистой пищи, либо после его экзогенного введения, могут привести к значительному захвату изотопа мышечной тканью, что ухудшает качество исследования (Рисунок 1).
Пациенту следует избегать повышенной физической нагрузки за день до исследования, а после инъекции ФДГ следует расслабиться, прекратить разговаривать, жевать, необходимо избегать гипервентиляции – для того, чтобы минимизировать физиологический захват 18-ФДГ мышечной тканью. В особенности это касается пациентов с опухолями головы и шеи (необходимо свести к минимуму захват изотопа гортанными и жевательными мышцами). Некоторые авторы рекомендуют использовать бензодиазепины для релаксации мышц [6]. Применение мочегонных и/или катетеризация мочевого пузыря для уменьшения кумуляции изотопа в моче зависит от клинической ситуации и решения врача.
В настоящее время в литературе не сообщается о серьезных побочных эффектах после внутривенного введения 18-ФДГ. После введения изотопа пациент обычно ждет 50-60 минут для более равномерного его распределения в организме, а затем (перед выполнением снимков) мочится для уменьшения кумуляции и повышенной активности изотопа в мочевом пузыре. И, хотя возможно сделать снимок всего тела за 1 сессию, правильным считается снимок от основания черепа до середины бедра. Рутинное исследование головного мозга не проводится в большинстве центров, поскольку 18-ФДГ относительно нечувствителен к церебральным метастазам, особенно при их небольших размерах. Нижние конечности снимаются тех случаях, когда есть подозрение на их поражение специфическим процессом. Общее время сканирования зависит от площади изучаемой поверхности, протокола исследования и используемого оборудования. В обычных случаях исследование занимает 1 час (при сканировании от основания черепа до середины бедра) стандартным ПЭТ-сканером. С недавним введением в практику мерцающего кристалла ускорения LSO и ПЭТ/КТ общее время сканирования снизилось до 30 минут и менее.
Важные анамнестические данные, которые следует выяснить до исследования
Таблица 1 демонстрирует важные данные анамнеза, о которых следует помнить врачу, либо которые необходимо узнать у больного для оптимального ведения пациента и интерпретации данных ПЭТ.
| Подтвержденная или заподозренная беременность, лактация | Прекратить лактацию на 6 часов после введения 18-ФДГ, проанализировать соотношение риск-эффективность ПЭТ при беременности |
| Ранний послеоперационный период/состояние после открытой биопсии | Ожидать повышенного захвата изотопа в месте проведения операции; желательно исследование проводить через 4 недели минимум после операции [9] |
| Недавняя химиотерапия | Возможен измененный захват 18-ФДГ опухолью, возможны реактивные изменения (костный мозг, тимус); желательно проводить ПЭТ через несколько недель после химиотерапии или сразу перед следующим курсом химиотерапии |
| Недавняя лучевая терапия | Возможны постлучевые воспалительные изменения, желательно обеспечить 3-месячный перерыв между лучевой терапией и ПЭТ [9] |
| Применение колониестимулирующих факторов (например, Г-КСФ) | Может быть повышена активность костного мозга; желательно сделать перерыв на несколько недель после последнего назначения Г-КСФ для оптимальной оценки костного мозга |
| Воспалительные процессы (инфекции, абсцессы, саркоидоз) | Хорошо известные случаи ложноположительных результатов ПЭТ; необходима осторожность при трактовке результатов в таких случаях |
| Другие значимые характеристики (клаустрофобия, трудности с положением лежа у пациента | Возможно, потребуется вмешательство или изменение протокола сканирования |
Визуализация, нормальное распределение изотопа и артефакты при сканировании
Ослабление излучения изотопа является большой проблемой ПЭТ, поскольку совокупность путей движения обоих фотонов с энергией 511 кэВ должна по определению «покрывать» всю ширину тела пациента. Однако эта проблема неплохо решается с помощью коррекционных алгоритмов – программ, которые встраиваются в протокол сканирования. С появлением систем ПЭТ/КТ, вероятно, появятся еще более отработанные коррекционные алгоритмы. Артефакты при ПЭТ возникают из-за того, что тело человека представляет собой не сферу, а эллипс, поэтому возможны погрешности. Артефакты могут быть обусловлены следующим:
- Движением пациента во время исследования
- Контаминацией из места инъекции
- Предшествующим радионуклидным исследованием (незадолго до ПЭТ)
- Ослаблением излучения и геометрическими искривлениями
- Помехами и погрешностями (плохо отработанная статистическая методика исследования)
- Мышечные артефакты распределения 18-ФДГ
У некоторых больных, которые находятся в состоянии стресса или нервничают во время исследования, возможен аномальный захват 18-ФДГ мышечной тканью. Обычной локализацией такого захвата являются группы мышц шеи, плечевого пояса и верхних конечностей. Артефакты, обусловленные движением пациента, контаминацией из места инъекции, предшествующими радионуклидными исследованиями, могут быть сведены к минимуму путем простых методик (например, обертывание пациента, обучение пациента перед исследованием, уход). Доктор Barry Siegel из Mallinckrodt Institute of Radiology , г. Сент-Луис, США заметил, что артефакты, обусловленные геометрическими искажениями, статистическими погрешностями и ослаблением излучения, могут быть несколько уменьшены путем множественных повторяющихся реконструкций изображения (в противоположность старым методам восстановления снимков по их проекциям), в результате чего данные могут быть лучше «подогнаны» к индивидуальным характеристикам пациента.
Нормальный захват 18-ФДГ в значительной степени происходит в головном мозге и мочевом пузыре и, в меньшей степени, в печени, костном мозге и почках. Захват изотопа миокардом может быть неоднородным, что зависит от телосложения пациента и сопутствующей коронарной патологии. Для снижения захвата изотопа миокардом пациенту необходимо не есть в течение ночи перед утренним исследованием, либо съесть только легкий завтрак, если исследование назначено на вторую половину дня. Доктор Mark W . Groch из Northwestern University USA доказал, что необходим мониторинг уровня глюкозы крови перед введением 18-ФДГ, целевой уровень – 15 ммоль/л. Пациенты с уровнем глюкозы более 20 ммоль/л не исследуются, а те, которые имеют уровень глюкозы в пределах 15-20 ммоль/л, подвергаются исследованию только после консультации со специалистами.
Показания к ПЭТ
В основном ПЭТ применяется для диагностики и дифференциальной диагностики злокачественных и доброкачественных опухолей. Главными показаниями для проведения ПЭТ в онкологии являются:
- Диагностика впервые возникших опухолей, в том числе дифференциация доброкачественных опухолей от злокачественных
- Определение стадии заболевания, включая выявление отдаленных метастазов
- Оценка эффективности лечения
- Оценка рецидива заболевания
Однако эти показания для проведения ПЭТ не подходят для всех видов опухолей. В типичных случаях ПЭТ способна выявить очаги поражения размером не менее 7 мм, в редких случаях – 3-4 мм (если ткань очага интенсивно поглощает изотоп). Стандартные уровни поглощения изотопа ( SUVs – отношение захвата опухолью изотопа к введенной активности) помогают в дифференциальной диагностике злокачественных и доброкачественных опухолей, SUVs при злокачественных опухолях >2,5. Показано, что ПЭТ способна изменять курс лечения при онкологических заболеваниях и избегать ненужных хирургических вмешательств у значительного числа больных. И хотя применение ПЭТ для оценки состояния головного мозга развивается медленно, выглядит обещающей методика дифференциальной диагностики болезни Альцгеймера от другой патологии головного мозга при помощи ПЭТ. Доктор David Silverman из UCLA Medical Center , Los Angeles , USA показал, что стандарты клинической диагностики болезни Альцгеймера базируются на устаревшем делении деменций на «излечимые» и «неизлечимые». Тем не менее, некоторые публикации сообщают, что ПЭТ способна поставить диагноз болезни Альцгеймера за 3 года до начала проявления клинических симптомов.
ПЭТ способна четко выявить очаги некроза в миокарде – как самостоятельно, так и в сочетании со сцинтиграфией миокарда. По снимкам можно отличить живой миокард, гибернированный миокард и некроз миокарда.
Показания к применению ПЭТ в онкологии можно представить следующим образом:
| Онкологическое заболевание | Применение ПЭТ |
| Солитарные узлы в ткани легкого | Дифференциальная диагностика злокачественных и доброкачественных новообразований |
| Немелкоклеточный рак легкого | Постановка диагноза, определение стадии, рестадирование |
| Колоректальный рак | Постановка диагноза, определение стадии, рестадирование |
| Лимфома | Постановка диагноза, определение стадии, рестадирование |
| Рак пищевода | Постановка диагноза, определение стадии, рестадирование |
| Меланома* | Постановка диагноза, определение стадии, рестадирование |
| Опухоли головы и шеи** | Постановка диагноза, определение стадии, рестадирование |
| Рак молочной железы*** | Первичная постановка диагноза у больных с отдаленными метастазами Рестадирование у больных с местными рецидивами или отдаленными метастазами Мониторинг ответа на лечение у больных с далеко зашедшей стадией болезни, с отдаленными метастазами, когда планируется смена терапии |
| Рак щитовидной железы | Рестадирование рецидивирующего или остаточного рака щитовидной железы фолликулярного происхождения после тиреоэктомии и лечения радиоактивным йодом, повышенном уровне тиреоглобулина > 10 нг/мл и отрицательном результате сканирования с йодом-131 |
Примечание:
*Исследование регионарных лимфоузлов сюда не относится
**Злокачественные опухоли ЦНС не включены
***Диагностика первичного очага опухоли и исследование подмышечных лимфоузлов сюда не включены
Адаптировано из статьи Kostakoglu et al и Департамента здоровья человека США.
Противопоказания к проведению ПЭТ
- Сахарный диабет (суб- и декомпенсированный)
- Острые инфекционные заболевания и обострения хронических воспалительных процессов.
ПЭТ в диагностике неходжкинских лимфом и лимфогранулематоза
В США и странах Западной Европы лимфомы являются наиболее часто встречающимися злокачественными опухолями системы крови. В 2004 году в США ожидалось 62250 новых случаев лимфомы и 20730 случаев смерти от этого заболевания [11]. Неходжкинские лимфомы (НХЛ) являются системными заболеваниями и хирургические методы лечения здесь играют небольшую роль. НХЛ представляют собой очень разнородную группу болезней, и частота встречаемости НХЛ значительно возросла за последние десятилетия. НХЛ встречаются в 5 раз чаще, чем лимфогранулематоз (ЛГР), а смертность от НХЛ в 10 раз выше, чем от ЛГР. Программа лечения обязательно учитывает стадию и степень дифференцировки НХЛ. Главным видом лечения НХЛ является химиотерапия. Особый упор делается на лечение агрессивных форм НХЛ (промежуточной и высокой степени дифференцировки). 5-летняя выживаемость составляет 60% для быстропрогрессирующих НХЛ. Низкодифференцированные НХЛ, за исключением редких локализаций этих лимфом, являются некурабельными заболеваниями, и целью лечения является купирование симптомов и продление ремиссии.
ЛГР обычно поражает смежные группы лимфоузлов. Экстранодальное поражение при ЛГР развивается реже, чем при НХЛ. Стратегии лечения всегда зависят от стадии. ЛГР ранних стадий (стадия I и II) в сочетании с благоприятными факторами прогноза может быть лечен только местной лучевой терапией. ЛГР ранних стадий + неблагоприятные факторы прогноза или ЛГР запущенных стадий (стадия III и IV ) лечится с применением химиотерапии и/или консолидирующей лучевой терапии. Рецидивы заболевания могут быть лечены с использованием «терапии отчаяния» и/или трансплантацией стволовых клеток. В целом, прогноз благоприятен при ранних стадиях ЛГР (10-летняя выживаемость 80-85%) и значительно хуже при запущенных стадиях (10-летняя выживаемость при IV стадии – 40%).
ПЭТ высокочувствительна для диагностики классического ЛГР, агрессивных НХЛ и низкодифференцированных фолликулярных НХЛ. ПЭТ дает менее достоверные результаты при диагностике вялотекущих форм НХЛ: МАЛТ-лимфомы и лимфомы из малых лимфоцитов. ПЭТ редко используется для верификации диагноза лимфомы, так как большинство подозрительных новообразований подвергается биопсии с последующим морфологическим исследованием, что является стандартом диагностики. В некоторых случаях ПЭТ может применяться для выбора наиболее информативного участка опухоли для биопсии. ПЭТ является перспективным исследованием в отношении дифференциальной диагностики первичных лимфом ЦНС (обычно высокодифференцированных НХЛ с повышенным захватом 18-ФДГ в сравнении с серым веществом головного мозга) и церебрального токсоплазмоза (обычно не захватывает 18-ФДГ) у больных СПИДом.
В литературе недостаточно данных в отношении роли ПЭТ в стадировании нелеченных лимфом. КТ остается стандартным визуализирующим исследованием в первичной диагностике лимфом. ПЭТ лишь дополняет КТ в этом случае и не конкурирует с ним. ПЭТ компенсирует некоторые недостатки КТ: в частности, обнаружение лимфомы в лимфоузлах нормальных размеров, а также оценка состояния костного мозга, печени и селезенки. При исследовании пораженных лимфоузлов диагностическая точность ПЭТ эквивалентна или превышает таковую у КТ. Общая чувствительность ПЭТ превышает таковую у КТ на 15%, а специфичность их примерно одинакова. ПЭТ является многообещающей методикой в оценке поражения костного мозга и превосходит в этом отношении КТ, сканирование с галлием и сканирование костей. Было показано, что ПЭТ эквивалентна по достоверности биопсии костного мозга и в особенности подходит при опухолях некоторых локализаций (которые далеко расположены от задневерхних гребней подвздошных костей – типичных мест отбора материала для гистологического исследования). ПЭТ превосходит КТ и сканирование с галлием в определении поражения селезенки лимфомой. После рестадирования по данным ПЭТ лечебная тактика меняется не всегда. В целом, после ПЭТ-рестадирования стадия изменяется у 10-40% больных, а изменения в лечении происходят только у половины из них [18]. Общее сканирование организма ПЭТ без дополнительной лучевой нагрузки с улучшенной диагностической точностью (в сравнении с другими методами) до начала лечения, обеспечивает врача базисными данными о метаболизме ПЭТ-позитивного новообразования, что в особенности полезно для дальнейшей тактики ведения больного.
ПЭТ дает важную информацию о жизнеспособности опухоли, помогая отличить рубцовую ткань/некроз опухоли от активной остаточной лимфомы после завершения курса лечения. Для остаточных образований после химиотерапии ПЭТ имеет высокую отрицательную прогностическую ценность с 1-летней беспрогрессивной выживаемостью 86-100%.
Пациенты с остаточными опухолями по ПЭТ имеют гораздо более плохой прогноз – 1-летняя беспрогрессивная выживаемость 0-40%. Поскольку захват изотопа при ПЭТ не является патогномоничным только для опухолей, разумно подтвердить лимфоматозный процесс биопсией с гистологическим исследованием, перед тем как назначить агрессивную полихимиотерапию. Использование КТ/ПЭТ совместно улучшает уверенность в определении локализации и характера опухоли. Это очень ценно в определении места для биопсии опухоли, особенно в тех случаях, когда подозревается трансформация из низкодифференцированной лимфомы (где захват 18-ФДГ колеблется от низкого до среднего) в высокодифференцированную лимфому (где более значительный захват 18-ФДГ ожидается в некоторых локализациях опухоли).
Значительный интерес представляет использование ПЭТ для оценки ответа на терапию. Накапливаются сведения о том, что положительный результат промежуточной ПЭТ (после 1-4 курсов химиотерапии) имеет высокую прогностическую ценность в отношении последующего рецидива болезни. Аналогично в отношении пациентов, не ответивших на первоначальную химиотерапию, либо в отношении химиочувствительных больных, у которых развился рецидив. У них положительная ПЭТ после «терапии отчаяния» до начала высокодозной химиотерапии с пересадкой стволовых клеток имеет высокую прогностическую ценность в отношении рецидивирования заболевания. Однако отрицательный результат ПЭТ в ранний период химиотерапии или после «терапии отчаяния», проведенной перед пересадкой стволовых клеток, коррелирует с кратковременной беспрогрессивной выживаемостью.
Может ли ПЭТ/КТ ошибаться?
Может ли ПЭТ/КТ ошибаться?
ПЭТ/КТ по праву считается наиболее точным методом диагностики при выявлении злокачественных заболеваний. Достоверность обследования при этой методике составляет 85-98%, что на несколько пунктов выше, чем при МРТ и КТ. Однако оставшиеся 2-15% свидетельствуют о том, что и при этом виде обследования ошибки не исключены.
Следует понимать, что сама аппаратура ошибаться не может — она показывает все беспристрастно, так, как «видят» состояние внутренних органов специальные датчики. А вот снимки трактует врач — именно он может допустить неверное истолкование полученного изображения. В большинстве случаев ошибки ПЭТ/КТ связанны именно с человеческим фактором, когда врач неправильно расшифровал снимки. Это связано с тем, что по-настоящему опытных специалистов в области ПЭТ/КТ в нашей стране еще не так много. Исправить ситуацию поможет консультация с другим врачом, который изучит полученные снимки и вынесет свое заключение.
Вероятность ложного диагноза или его отсутствия может быть обусловлена и другими причинами:
- Неправильной подготовкой пациента, который не выполнял предписания врача: не соблюдал диету, поел перед обследованием, переутомился за 1-2 дня до процедуры.
- Повышенным уровнем сахара в крови. Диабетикам обязательно делают пробу, но и у обычных людей может произойти необоснованный скачок глюкозы, что недопустимо при обследовании с 18-фтордезоксиглюкозой.
- Активными воспалительными процессами внутренних органов, которые на снимке могут отображаться как злокачественные образования.
- ПЭТ/КТ проводился слишком рано после недавно пройденного курса химиотерапии или лучевого лечения.
- Приемом некоторых медикаментов. В частности колониестимулирующих, которые вызывают ложное накопление РФП в костном мозге.
- Несоблюдением техники обследования — если пациент не смог сохранить неподвижность и шевелился, разговаривал, кашлял при работе сканера. Из-за этого снимок получается нечетким.
Ошибаться при трактовке результатов ПЭТ/КТ можно и в том случае, когда обследование проводилось на устаревшем оборудовании или при использовании ферментов, утративших свои радиоактивные свойства.
Если ложные результаты были вызваны одной из этих причин, то придется провести еще одно обследование или при постановке диагноза руководствоваться снимками других видов сканирования. Во избежание ложноположительных результатов проводят ПЭТ/КТ сначала без РФП, а потом вместе с ним. Сам пациент может существенно снизить вероятность ошибки, если как следует подготовится.
Полезная информация

ПЭТ/КТ после химиотерапии
Химиотерапия — основное «оружие» в сфере медикаментозного лечения злокачественных опухолей. По сути химиотерапия представляет собой лечение рака цитотоксическими средствами.
читать полностью

ПЭТ/КТ после операции
Хирургическое удаление опухоли — наиболее радикальный метод лечение онкологических заболеваний. Такая операция должна проводиться только при наличии показаний и только после всестороннего диагностического обследования.
читать полностью
все статьи
