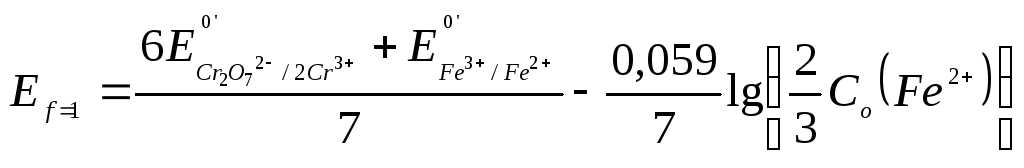Расчет индикаторных погрешностей кислотно-основного титрования
Согласно ионно-хромофорной теории индикаторов, интервал перехода окраски индикатора 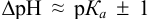 (табл. 12). Середина области перехода окраски (при этом pH близко к
(табл. 12). Середина области перехода окраски (при этом pH близко к 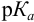 ) называется показателем титрования с данным индикатором или рТ индикатора. Индикаторные погрешности отсутствуют, когда рТ индикатора практически совпадает с pH в ТЭ. Основой для выбора индикатора является расчет и построение кривой титрования, определение области скачка и pH в ТЭ.
) называется показателем титрования с данным индикатором или рТ индикатора. Индикаторные погрешности отсутствуют, когда рТ индикатора практически совпадает с pH в ТЭ. Основой для выбора индикатора является расчет и построение кривой титрования, определение области скачка и pH в ТЭ.
Таблица 8.12
Важнейшие кислотно-основные индикаторы
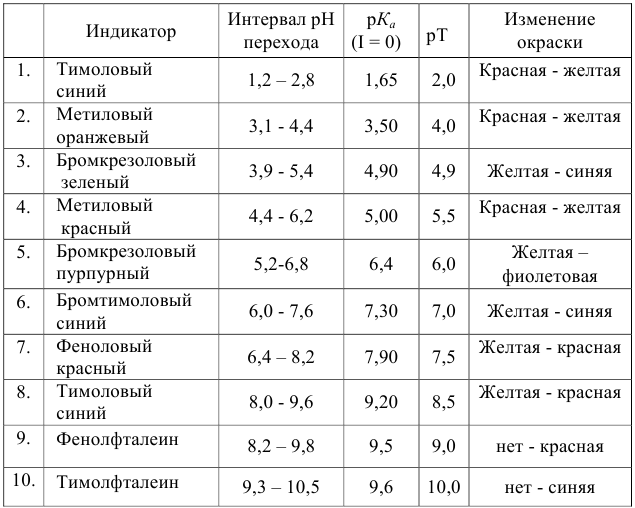
При правильно выбранном индикаторе индикаторная ПТ не должна превышать заданную погрешность измерения объема раствора в титриметрии. Типы (виды) индикаторных ПТ кислотно-осиовиого титрования и названия, встречающиеся в разных учебниках и сборниках задач, происхождение погрешностей и формулы для расчета приведены в табл. 8.13. Формулы легко выводятся из определения погрешности титрования как отношения недотитро-ванного или перетитрованного количества кислоты или основания к первоначально взятому для титрования (то есть к произведению 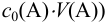 . Погрешность выражают в %, а вид и знак устанавливают по ходу процесса (кривой) титрования и составу раствора в КТТ (табл. 8.13, примеры 8.28 и 8.29).
. Погрешность выражают в %, а вид и знак устанавливают по ходу процесса (кривой) титрования и составу раствора в КТТ (табл. 8.13, примеры 8.28 и 8.29).
Таблица 8.13
Индикаторные погрешности кислотно-основного титрования

Пример 8.28.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании а)  и б)
и б) 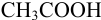 рабочим раствором
рабочим раствором 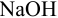 в условиях примера 8.21, если считать относительную погрешность измерения объема 0,4 %.
в условиях примера 8.21, если считать относительную погрешность измерения объема 0,4 %.
Решение:
а). Как следует из табл. 8.4 и рис. 8.1(1), для случая титрования  при погрешности определения объема 0,4 % область скачка на кривой титрования соответствует изменению pH от 3,4 до 10,9, а
при погрешности определения объема 0,4 % область скачка на кривой титрования соответствует изменению pH от 3,4 до 10,9, а  равен 7,0. Следовательно, для титрования можно выбрать индикаторы от №2 до №10 (табл. 8.12), т. к. их рТ и интервалы перехода окраски находятся в области скачка кривой.
равен 7,0. Следовательно, для титрования можно выбрать индикаторы от №2 до №10 (табл. 8.12), т. к. их рТ и интервалы перехода окраски находятся в области скачка кривой.
Однако используемые для расчета ПТ формулы показывают, что чем ближе рТ и  , тем меньше ПТ. «Идеально» подходит бромтимоловый синий, поскольку его рТ 7 практически совпадает с
, тем меньше ПТ. «Идеально» подходит бромтимоловый синий, поскольку его рТ 7 практически совпадает с  .
.
Рассчитаем величину ПТ с двумя индикаторами: с рТ <  и с р Г >
и с р Г >  и проверим их пригодность для титрования в заданных условиях.
и проверим их пригодность для титрования в заданных условиях.
С индикатором метиловым красным (рТ 5,5 <  ) в растворе остается неоттитрованная сильная кислота, следовательно, возникает протонная ошибка со знаком «-» (см. формулы в табл. 8.13):
) в растворе остается неоттитрованная сильная кислота, следовательно, возникает протонная ошибка со знаком «-» (см. формулы в табл. 8.13):
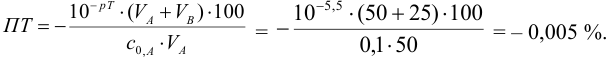
С индикатором фенолфталеином (рТ 9,0 >  ) в растворе -избыток сильного основания, в результате чего ПТ представляет собой
) в растворе -избыток сильного основания, в результате чего ПТ представляет собой 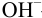 — ошибку (гидроксидную) со знаком «+»:
— ошибку (гидроксидную) со знаком «+»:
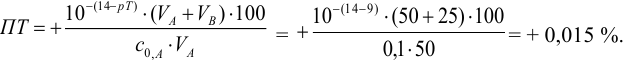
В данном случае оба индикатора пригодны, поскольку вычисленные значения ПТ не превышают заданную погрешность титрования (0,4%), но с метиловым красным систематическая индикаторная погрешность меньше.
б). При титровании 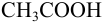 (табл. 8.5, рис. 8.1(2)) для той же точности титрования (99,6%) величина скачка меньше и составляет 7,2 — 10,9, а
(табл. 8.5, рис. 8.1(2)) для той же точности титрования (99,6%) величина скачка меньше и составляет 7,2 — 10,9, а  — 8,9. Круг пригодных индикаторов сужается до №7 — №9. Для индикаторов с рТ >
— 8,9. Круг пригодных индикаторов сужается до №7 — №9. Для индикаторов с рТ >  , как и в случае (а), ПТ соответствует
, как и в случае (а), ПТ соответствует  — ошибке (гидроксидной) со знаком «+».
— ошибке (гидроксидной) со знаком «+».
Например, при выборе фенолфталеина (рТ = 9,0):
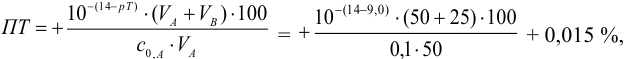
а при выборе тимолфталеина (рТ = 10,0) погрешность возрастает в 10 раз: 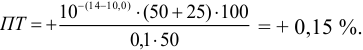
Выбор фенолфталеина приводит к меньшей индикаторной погрешности титрования 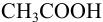 , но могут использоваться оба индикатора.
, но могут использоваться оба индикатора.
При титровании с индикаторами, для которых рТ < рНтэ, в растворе остается неоттитрованная слабая кислота, т. е. присутствует НА-ошибка (кислотная) со знаком «-» (см. табл. 8.13). Если использовать индикатор бромтимоловый синий (рТ 7,0), то вычисленная ПТ не удовлетворяет заданной точности, индикатор не пригоден:
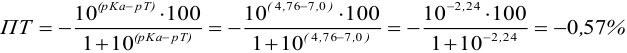
или при проведении расчета по приближенной формуле:
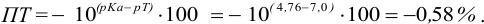
Пример 8.29.
Какой индикатор позволяет оттитровать 0,1000 М гидразин  0,1000 М раствором
0,1000 М раствором  с меньшей погрешностью: бромкрезоловый пурпурный (рТ 6,0) или метиловый красный (рТ 5,5)?
с меньшей погрешностью: бромкрезоловый пурпурный (рТ 6,0) или метиловый красный (рТ 5,5)?
Решение:
Реакция титрования:
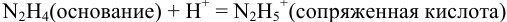
приводит к образованию слабой сопряженной кислоты 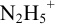
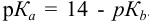 . Тогда
. Тогда 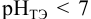 и вычисляется с учетом того, что
и вычисляется с учетом того, что 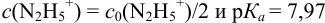 :
:
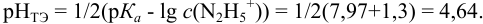
Сравнивая рТ индикаторов и  , видим, что в обоих случаях остается неоттитрованный гидразин, поэтому для оценки ПТ рассчитываем
, видим, что в обоих случаях остается неоттитрованный гидразин, поэтому для оценки ПТ рассчитываем 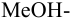 ошибку (основную) со знаком «-». С бромкрезоловым пурпурным (рТ 6):
ошибку (основную) со знаком «-». С бромкрезоловым пурпурным (рТ 6):
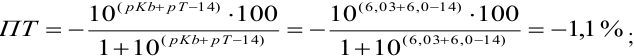
и с метиловым красным (рТ 5,5):
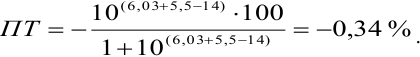
Из предложенных индикаторов метиловый красный позволяет провести титрование гидразина с меньшей погрешностью.
Расчет индикаторных погрешностей окислительно-восстановительного титрования
При использовании окислительно-восстановительных (редокс) индикаторов потенциал в ТЭ 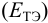 может не совпадать с потенциалом
может не совпадать с потенциалом  , который связан с
, который связан с 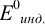 . (табл. 8.14) и интервалом перехода его окраски
. (табл. 8.14) и интервалом перехода его окраски 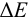 .
.
Таблица 8.14
Примеры распространенных окислительно-восстановительных индикаторов
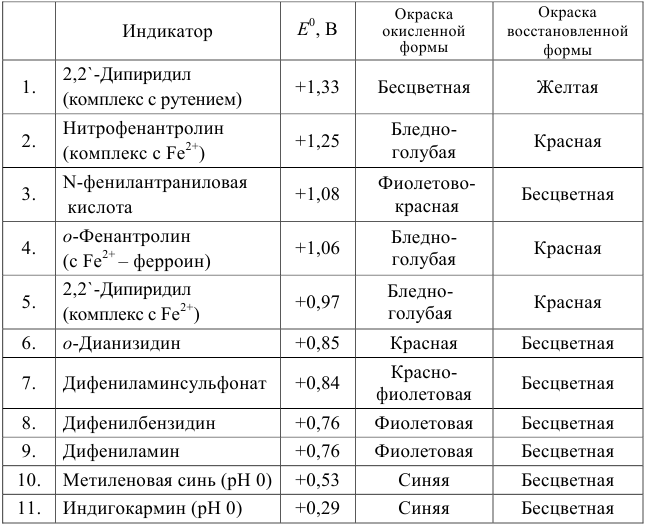
Полуреакция восстановления и интервал перехода индикатора:

Наиболее часто в полуреакции восстановления (окисления) индикатора участвуют 2 электрона. Для индикаторов №1 — №6 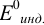 слабо зависит от pH. При расчете ПТ необходимо:
слабо зависит от pH. При расчете ПТ необходимо:
- сравнить
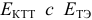 для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
Например, если 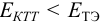 при титровании восстановителя (пример 8.30-а), то реакция не завершена; из уравнения Нернста для полуреакции титруемого компонента находят (объемы раствора в числителе и знаменателе одинаковы):
при титровании восстановителя (пример 8.30-а), то реакция не завершена; из уравнения Нернста для полуреакции титруемого компонента находят (объемы раствора в числителе и знаменателе одинаковы):

Сумма числителя и знаменателя здесь составляет 100 % титруемого вещества. Индикатор считается пригодным, если ПТ не превышает 0,1 -0,2%.
Пример 8.30.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании раствора соли  раствором соли
раствором соли  .
.
Решение:
Как следует из табл. 8.8 и рис. 8.3 (кривая 1, пример 8.25), область скачка (при относительной погрешности измерения объема 0,1 %) на кривой титрования 0,95 — 1,26 В, а 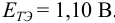 . Следовательно, для титрования можно выбрать индикаторы от №3 до №5 (табл. 8.14).
. Следовательно, для титрования можно выбрать индикаторы от №3 до №5 (табл. 8.14).
Выберем для рассмотрения порядка расчета два индикатора:
а) с 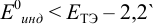 -дипиридил, для которого
-дипиридил, для которого 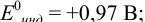
б) с 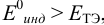 , например нитрофенантролин
, например нитрофенантролин 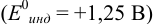 .
.
В случае а) интервал перехода индикатора:
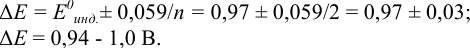
Изменение окраски заканчивается при  = 1,0 В. В растворе остаются неоттитрованными ионы
= 1,0 В. В растворе остаются неоттитрованными ионы 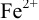 (оттитрованные ионы -ионы
(оттитрованные ионы -ионы  ). Для расчета ПТ используем уравнение Нернста для ре-докс- пары титруемого компонента (
). Для расчета ПТ используем уравнение Нернста для ре-докс- пары титруемого компонента ( /
/ ):
):
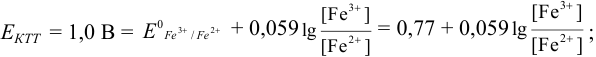
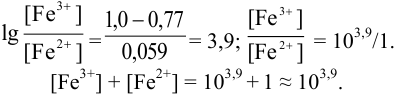
Тогда: ПТ = 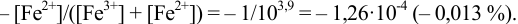
В случае б) интервал перехода индикатора нитрофенантролина в виде комплекса с  составляет:
составляет:
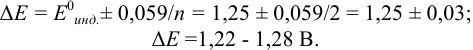
Изменение окраски заканчивается при  = 1,28 В и раствор перетитровывается. В этом случае ПТ имеет положительный знак и рассчитывается по уравнению Нернста для редокс-пары, образуемой титрантом
= 1,28 В и раствор перетитровывается. В этом случае ПТ имеет положительный знак и рассчитывается по уравнению Нернста для редокс-пары, образуемой титрантом  .
.
Тогда количество  (после ТЭ образования
(после ТЭ образования  не происходит) соответствует количеству взятых для титрования ионов
не происходит) соответствует количеству взятых для титрования ионов 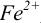 , а количество
, а количество 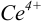 — их перетитрованному количеству.
— их перетитрованному количеству.
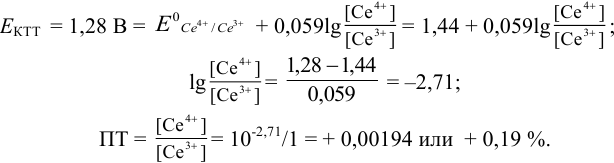
Таким образом, оба выбранных индикатора оказались приемлемыми.
Расчет индикаторных погрешностей комплексонометрического титрования
В конечной точке титрования общие концентрации определяемого иона с(М) и титранта c(Y) можно представить выражениями {для упрощения записи в общем виде упустим заряды ионов):
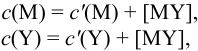
где 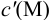 — концентрация всех форм определяемого иона, кроме входящего в комплекс
— концентрация всех форм определяемого иона, кроме входящего в комплекс 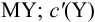 — концентрация всех форм титранта, кроме входящего в комплекс MY.
— концентрация всех форм титранта, кроме входящего в комплекс MY.
Условные константы устойчивости (см. выражение 8.16) связывают 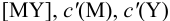
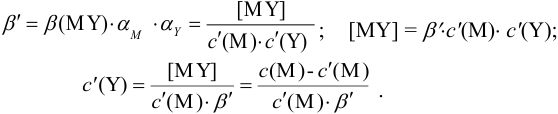
Отсюда относительная погрешность титрования (ПТ) определяется выражением (с учетом (8.18) и (8.19)):
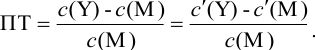
Подставляем в это уравнение выражение для 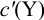 (8.20):
(8.20):
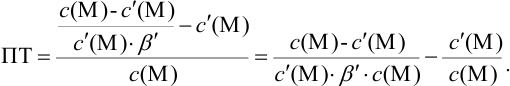
Вблизи ТЭ 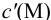 очень мала, поэтому
очень мала, поэтому 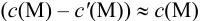 ,
,
следовательно: 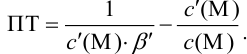
Выражение (8.21) тождественно выражению: 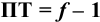 . Если конечная точка титрования находится после точки эквивалентности (степень оттитрованности
. Если конечная точка титрования находится после точки эквивалентности (степень оттитрованности 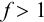 ), то относительная погрешность будет положительной. В случае недотитровывания, т. е. когда конечная точка титрования будет зафиксирована с помощью индикатора до точки эквивалентности
), то относительная погрешность будет положительной. В случае недотитровывания, т. е. когда конечная точка титрования будет зафиксирована с помощью индикатора до точки эквивалентности 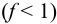 , ПТ будет со знаком «-».
, ПТ будет со знаком «-».
Конечная точка титрования определяется интервалом перехода окраски индикатора (интервалом рМ, в котором индикатор меняет свою окраску):
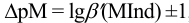 , где
, где 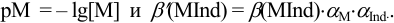
Интервал перехода окраски 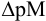 индикатора эриохром черный Т
индикатора эриохром черный Т 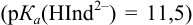 , образующего комплексы с ионами металлов при pH 10, составляет для ионов:
, образующего комплексы с ионами металлов при pH 10, составляет для ионов: 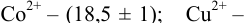
Пример 8.31.
Рассчитайте погрешность титрования 0,1 ОМ раствора 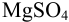 0,10 М раствором ЭДТА в присутствии индикатора эриохром черный Т в аммиачном буферном растворе при pH 10 и
0,10 М раствором ЭДТА в присутствии индикатора эриохром черный Т в аммиачном буферном растворе при pH 10 и  = 0,2 моль/л (см. условия в примере 8.27).
= 0,2 моль/л (см. условия в примере 8.27).
Решение:
В данных условиях 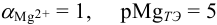 ,
,
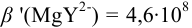 (пример 8.23). Интервал перехода окраски индикатора:
(пример 8.23). Интервал перехода окраски индикатора: 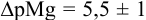 или в интервале концентраций магния от
или в интервале концентраций магния от 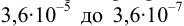 . Точка эквивалентности попадает в указанный интервал, индикатор считается пригодным для титрования
. Точка эквивалентности попадает в указанный интервал, индикатор считается пригодным для титрования  , КТТ наступает после ТЭ, когда
, КТТ наступает после ТЭ, когда 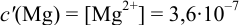 моль/л.
моль/л.
Погрешность титрования  с «эриохром черным Т»:
с «эриохром черным Т»:
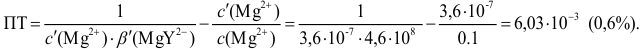
Пример 8.32.
Докажите возможность использования индикатора эриохром черный Т для титрования 0,010 М раствора 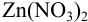 0,010 М раствором ЭДТА при pH = 10 и
0,010 М раствором ЭДТА при pH = 10 и  = 0,10 моль/л. Рассчитайте погрешность титрования при использовании этого индикатора.
= 0,10 моль/л. Рассчитайте погрешность титрования при использовании этого индикатора.
Решение:
1. Рассчитаем условную константу 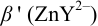 .
.
Общие константы устойчивости для аммиачных комплексов  (табл. 4 приложения):
(табл. 4 приложения): 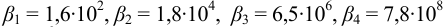 . Для свободных ионов
. Для свободных ионов  по формуле (2.8) предварительно рассчитаем
по формуле (2.8) предварительно рассчитаем 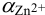 :
:
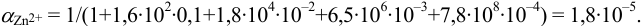
По табл. 7 и табл. 4 приложения находим 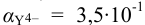 ,
, 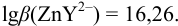 . Константа устойчивости комплекса
. Константа устойчивости комплекса  с ЭДТА при заданных условиях с учетом выражения (8.16):
с ЭДТА при заданных условиях с учетом выражения (8.16):
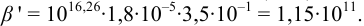
В точке эквивалентности:
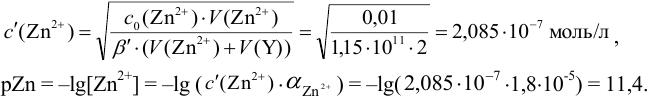
Интервал перехода окраски индикатора эриохром черный Т в случае титрования ионов цинка при pH 10: 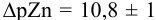 , т.е. от 9,8 до 11,8 или от
, т.е. от 9,8 до 11,8 или от 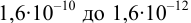 моль/л. Точка эквивалентности попадает в интервал концентраций, при которых индикатор меняет свою окраску. Следовательно, эриохром черный Т пригоден для титрования
моль/л. Точка эквивалентности попадает в интервал концентраций, при которых индикатор меняет свою окраску. Следовательно, эриохром черный Т пригоден для титрования  при заданных условиях.
при заданных условиях.
2. Конечная точка титрования наступает при [ ], равной
], равной 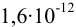 моль/л, отсюда концентрация всех форм
моль/л, отсюда концентрация всех форм  , за исключением связанных в комплекс с ЭДТА, составляет:
, за исключением связанных в комплекс с ЭДТА, составляет:
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

Погрешности титрования
|
№ |
f |
Состав |
Формула |
Значение |
|
1 |
0,1 |
(Cr2O72-) |
|
0,71 |
|
2 |
0,5 |
0,77 |
||
|
3 |
0,9 |
0,83 |
||
|
4 |
0,99 |
0,89 |
||
|
5 |
0,999 |
0,95 |
||
|
6 |
1 |
(Fe2+), |
|
1,25 |
|
7 |
1,001 |
(Fe2+),
|
|
1,31 |
|
8 |
1,01 |
1,32 |
||
|
9 |
1,1 |
1,33 |
||
|
10 |
1,5 |
1,34 |

Р

 ис
ис
2.Кривая титрования 0,1M
FeSO4
раствором 0,1M
K2Cr2O7.
Выбор индикатора
в окислительно-восстановительном
титровании.
Для обнаружения
конечной точки титрования (КТТ)
используют:
1.Безиндикаторное
титрование.
2.Специфические
индикаторы.
3.Окислительно-восстановительные
индикаторы.
К безиндикаторному
титрованию относится перманганатометрия.
После ТЭ появляется одна лишняя капля
титранта, и раствор окрашивается в
розовый цвет.
При титровании разбавленными растворами
(с концентрацией менее 0,02М) применяют
редокс-индикаторы, такие как дифениламин
сульфокислота или ферроин.
Специфические
индикаторы – вещества, которые образуют
либо с титрантом, либо с титруемым
раствором окрашенные соединения
(например, в иодометрии используют
специфический индикатор – крахмал).
Окислительно-восстановительные
(редокс-индикаторы) – органические
соединения, у которых окисленная и
восстановленная формы имеют различную
окраску.
В данном методе
для фиксирования точки эквивалентности
используем редокс-индикаторы – это
соединения,способные к окислению или
восстановлению, причем их окисленная
и восстановленная форма имеет разную
окраску. Таким образом, если редокс-индикатор
изменит окраску в пределах скачка
титрования и человек заметит это
изменение окраски, титрование можно
заканчивать и погрешноть составит в
пределах скачка титрования, то есть
![]() 0,1
0,1
.%
Обозначим IndOx
и IndRed-
как сопряжённые окисленная и восстановленная
формы индикатора.
Тогда для этой
пары:
IndOx
+ ne![]() IndRed
IndRed
Уравнение Нернста
(250С)
без учета конкурирующех реакций и ионной
силы имеет вид:
![]()
Таким образом
выбор индикатора зависит от стандартного
потенциала, при катором происходит
окисление или восстановление одной
формы в другую. При этом необходимо
учитывать, что человеческий глаз может
воспринимать окраску одной из форм при
определённой концентрации её в растворе.
Для двухцветного индикатора присутствие
одной из форм заметно, если концентрация
её примерно в 10 раз превышает концентрацию
другой формы.
И тогда если
 , будет наблюдаться окраска восстановленной
, будет наблюдаться окраска восстановленной
формы, при этом потенциал равен
![]()
А при
![]() будет наблюдаться окраска окисленной
будет наблюдаться окраска окисленной
формы и потенциал выражается соотношением
![]()
Тогда в пределах
потенциалов Е1-Е2—
происходит смена окраски индикатора.
Этот интервал
называется интервалом перехода окраски
индикатора и обозначается
![]() .
.

Потенциал,
при котором резко изменяется окраска
индикатора называется
показателем титрования индикатора и
для большинства индикаторов он
совпадает с серединой интервала, то
есть с стандартным (формальным)
потенциалом редокс-системы индикатора.
Таким
образом, при достижении показателя
титрования редокс-индикатора
необходимо закончить титрование. Точка
на кривой, когда заканчивается
титрования, называется конечной точкой
титрования (КТТ).
Идеальным индикатором являлся бы тот,
у которого показатель титрования
совпадал бы с точкой эквивалентности.
В
общем случае при выборе индикатора
учитывают следующее: интервал перехода
окраски его должен лежать внутри скачка
титрования (или частично накладывался
на скачок титрования).
Итак,
рассмотрим возможности применения
редокс-индикатора дифениламина
для фиксирования точки эквивалентности
титрования железа бихроматом
калия.
Интервал
перехода окраски индикатора дифениламина
Еинд
=0,75±0,03В.
Отмечаем интервал
перехода окраски индикатора на графике.
Видно,
что интервал перехода частично
накладывается на скачок второй кривой
титрования, и следовательно его можно
использовать при титровании
железа бихроматом калия в присутствии
защитной смеси. А если использовать
дифениламин в качестве индикатора в
отсутствии в титруемом
растворе фосфорной кислоты погрешность
титрования возрастет. Для
количественной оценки индикаторной
погрешности титрования необходимо
ее рассчитывать.
Расчет индикаторной
погрешности титровании.
Индикаторная
погрешность вызвана несовпадением
конечной точки
титрования с точкой эквивалентности.
Индикаторная
погрешность (ПТ ) — это систематическая
погрешность
и ее мы можем рассчитать.
ПТ=![]()
![]() или ПТ=+
или ПТ=+![]()
Мы
можем выразить ПТ через степень
оттитрованности.
ПT=-(l-
f)∙100%
или ПТ
=
+( f
-1)∙100%
Знаки + и — мы ставим
лишь для обозначения знака ошибки
(положительная — когда раствор
перетитрован, отрицательная — недотитрован).
Если
мы окончили титрование при f
=0,999, на сколько процентов
раствор оттитрован, перетитрован или
недотитрован?. На
0,1% раствор недотитрован. То есть по
грешность титрования ПТ=-0,1%
Таким
образом, если мы сможем вычислить, при
каком значении степени оттитрованности
мы заканчиваем титрование с; данным
индикатором,
мы можем вычислить погрешность титрования.
Мы заканчиваем титрование когда резко
изменилась
окраска индикатора.Резко изменяется
окраска индикатора
когда достигнут окислительно-восстановительный
потенциал сопряженной редокс-пары
индикатора, то есть это значение
показателя, то есть это значение
показателя титрования
редоксиндикатора Е°’инд-ox/
инд-red,
которое дается в справочниках.
Следовательно, зная потенциал системы
титруемого раствора в момент КТТ по тем
же формулам расчета кривой титрования
мы можем рассчитать степень оттитрованносги
(обратное действие расчету кривой
титрования).
В
качестве примера рассмотрим индикатор
дифениламин и рассчитаем ПТ в
присутствии защитной смеси и в отсутствии.
Показатель титрования дифениламина
равен 0,75 В. Потенциал КТТ 0,75 В, а потенциал
в ТЭ равен 1,24 В, поэтому раствор будет
недотитрован. Следовательно для расчета
используем формулу для расчета кривой
до точки
эквивалентности.
В это уравнение
подставляем потенциал системы в КТТ:

Расчет показывает,
что в отсутствии защитной смеси при
титроваие с индикатором дифениламином
ПТ=-6%
А в присутствии-ПТ=-0,1%.
Выводы
Кривая титрования
имеет s-образную
форму. Наблюдаются 3 участка на кривой
– пологий ход кривой титрования до
скачка титрования, скачок титрования
– в области точки эквивалентности, и
пологий ход кривой титрования после
кривой титрования.
Скачок титрования
– это участок на кривой титрования,
когда раствор недотитрован на 0,1% и
перетитрован на 0,1%. То есть скачок
титрования задается точностью, с которой
мы хотим оттитровать анализируемое
соединение.
По кривой титрования
мы видим, что скачок титрования лежит
в области потенциалов от 0,95 до 1,31 и
составляет 0,36 В.
Факторы, влияющие
на скачок окислительно-восстановительного
титрования
Величина скачка
зависит от разницы формальных и ОВ
потенциалов полуреакций, и следовательно
величина скачка зависит от всех тех
факторов, которые влияют на эти потенциалы
(ионная сила, конкурирующие реакции
осадкообразование, комплексообразование,
pH
раствора, температура.
-
Влияние pH
раствора на величину скачка титрования.Так
как в титриметрической реакции участвует
кислородсодержащая частица – бихромат-ион
– pH
будет влиять именно на ОВ потенциал
пары Cr2O72-/
2Cr3+.
Небольшое изменение концентрации ионов
водорода вызовет большое изменение ОВ
потенциала. Увеличение кислотности
титруемого раствора значительно
повышает окислительно-восстановительный
потенциал системы бихромат/хром
трехвалентный (правая ветвь кривой
смещается вверх) и скачок титрования
возрастает. Это достигается введением
в титруемый раствор серной кислоты 1
моль/литр. -
Влияние конкурирующей
реакции комплексообразования (Fe3+)
c
дигидрофосфат ионом.ОВ потенциал
уменьшился на 0,1 В и вся левая ветвь
смещается вниз на 0,1 В, а скачок титрования
при этом увеличивается.
Введение серной
кислоты в титруемый раствор повышает
потенциал системы бихромат ионов, а
введение фосфорной кислоты понижает
потенциал системы железа, что очень
сильно увеличивает скачок титрования.
Смесь серной и фосфорной кислот называется
– защитная смесь. В отсутствии защитной
смеси оттитровать железо бихроматом
калия невозможно.
3. Влияние разбавления
на скачок титрования.Разбавление
(увеличение объема титруемого раствора)
повышает ОВ потенциал системы бихромат
иона. В общем случае мы можем пренебречь
изменение объема титруемого раствора

Расчет индикаторных погрешностей кислотно-основного титрования
Согласно ионно-хромофорной теории индикаторов, интервал перехода окраски индикатора 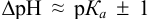 (табл. 12). Середина области перехода окраски (при этом pH близко к
(табл. 12). Середина области перехода окраски (при этом pH близко к 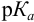 ) называется показателем титрования с данным индикатором или рТ индикатора. Индикаторные погрешности отсутствуют, когда рТ индикатора практически совпадает с pH в ТЭ. Основой для выбора индикатора является расчет и построение кривой титрования, определение области скачка и pH в ТЭ.
) называется показателем титрования с данным индикатором или рТ индикатора. Индикаторные погрешности отсутствуют, когда рТ индикатора практически совпадает с pH в ТЭ. Основой для выбора индикатора является расчет и построение кривой титрования, определение области скачка и pH в ТЭ.
Таблица 8.12
Важнейшие кислотно-основные индикаторы

При правильно выбранном индикаторе индикаторная ПТ не должна превышать заданную погрешность измерения объема раствора в титриметрии. Типы (виды) индикаторных ПТ кислотно-осиовиого титрования и названия, встречающиеся в разных учебниках и сборниках задач, происхождение погрешностей и формулы для расчета приведены в табл. 8.13. Формулы легко выводятся из определения погрешности титрования как отношения недотитро-ванного или перетитрованного количества кислоты или основания к первоначально взятому для титрования (то есть к произведению 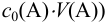 . Погрешность выражают в %, а вид и знак устанавливают по ходу процесса (кривой) титрования и составу раствора в КТТ (табл. 8.13, примеры 8.28 и 8.29).
. Погрешность выражают в %, а вид и знак устанавливают по ходу процесса (кривой) титрования и составу раствора в КТТ (табл. 8.13, примеры 8.28 и 8.29).
Таблица 8.13
Индикаторные погрешности кислотно-основного титрования

Пример 8.28.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании а)  и б)
и б) 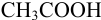 рабочим раствором
рабочим раствором 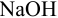 в условиях примера 8.21, если считать относительную погрешность измерения объема 0,4 %.
в условиях примера 8.21, если считать относительную погрешность измерения объема 0,4 %.
Решение:
а). Как следует из табл. 8.4 и рис. 8.1(1), для случая титрования  при погрешности определения объема 0,4 % область скачка на кривой титрования соответствует изменению pH от 3,4 до 10,9, а
при погрешности определения объема 0,4 % область скачка на кривой титрования соответствует изменению pH от 3,4 до 10,9, а  равен 7,0. Следовательно, для титрования можно выбрать индикаторы от №2 до №10 (табл. 8.12), т. к. их рТ и интервалы перехода окраски находятся в области скачка кривой.
равен 7,0. Следовательно, для титрования можно выбрать индикаторы от №2 до №10 (табл. 8.12), т. к. их рТ и интервалы перехода окраски находятся в области скачка кривой.
Однако используемые для расчета ПТ формулы показывают, что чем ближе рТ и  , тем меньше ПТ. «Идеально» подходит бромтимоловый синий, поскольку его рТ 7 практически совпадает с
, тем меньше ПТ. «Идеально» подходит бромтимоловый синий, поскольку его рТ 7 практически совпадает с  .
.
Рассчитаем величину ПТ с двумя индикаторами: с рТ <  и с р Г >
и с р Г >  и проверим их пригодность для титрования в заданных условиях.
и проверим их пригодность для титрования в заданных условиях.
С индикатором метиловым красным (рТ 5,5 <  ) в растворе остается неоттитрованная сильная кислота, следовательно, возникает протонная ошибка со знаком «-» (см. формулы в табл. 8.13):
) в растворе остается неоттитрованная сильная кислота, следовательно, возникает протонная ошибка со знаком «-» (см. формулы в табл. 8.13):
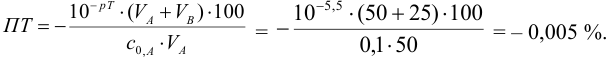
С индикатором фенолфталеином (рТ 9,0 >  ) в растворе -избыток сильного основания, в результате чего ПТ представляет собой
) в растворе -избыток сильного основания, в результате чего ПТ представляет собой 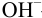 — ошибку (гидроксидную) со знаком «+»:
— ошибку (гидроксидную) со знаком «+»:
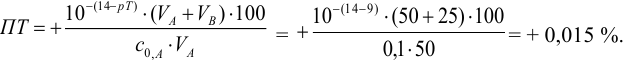
В данном случае оба индикатора пригодны, поскольку вычисленные значения ПТ не превышают заданную погрешность титрования (0,4%), но с метиловым красным систематическая индикаторная погрешность меньше.
б). При титровании 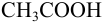 (табл. 8.5, рис. 8.1(2)) для той же точности титрования (99,6%) величина скачка меньше и составляет 7,2 — 10,9, а
(табл. 8.5, рис. 8.1(2)) для той же точности титрования (99,6%) величина скачка меньше и составляет 7,2 — 10,9, а  — 8,9. Круг пригодных индикаторов сужается до №7 — №9. Для индикаторов с рТ >
— 8,9. Круг пригодных индикаторов сужается до №7 — №9. Для индикаторов с рТ >  , как и в случае (а), ПТ соответствует
, как и в случае (а), ПТ соответствует  — ошибке (гидроксидной) со знаком «+».
— ошибке (гидроксидной) со знаком «+».
Например, при выборе фенолфталеина (рТ = 9,0):
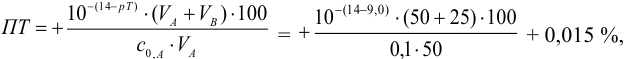
а при выборе тимолфталеина (рТ = 10,0) погрешность возрастает в 10 раз: 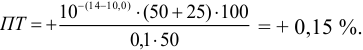
Выбор фенолфталеина приводит к меньшей индикаторной погрешности титрования 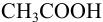 , но могут использоваться оба индикатора.
, но могут использоваться оба индикатора.
При титровании с индикаторами, для которых рТ < рНтэ, в растворе остается неоттитрованная слабая кислота, т. е. присутствует НА-ошибка (кислотная) со знаком «-» (см. табл. 8.13). Если использовать индикатор бромтимоловый синий (рТ 7,0), то вычисленная ПТ не удовлетворяет заданной точности, индикатор не пригоден:
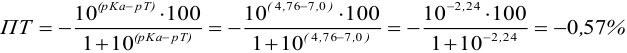
или при проведении расчета по приближенной формуле:
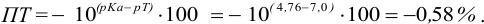
Пример 8.29.
Какой индикатор позволяет оттитровать 0,1000 М гидразин  0,1000 М раствором
0,1000 М раствором  с меньшей погрешностью: бромкрезоловый пурпурный (рТ 6,0) или метиловый красный (рТ 5,5)?
с меньшей погрешностью: бромкрезоловый пурпурный (рТ 6,0) или метиловый красный (рТ 5,5)?
Решение:
Реакция титрования:
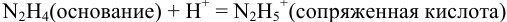
приводит к образованию слабой сопряженной кислоты 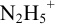
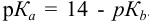 . Тогда
. Тогда 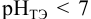 и вычисляется с учетом того, что
и вычисляется с учетом того, что 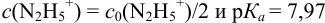 :
:
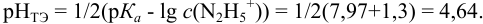
Сравнивая рТ индикаторов и  , видим, что в обоих случаях остается неоттитрованный гидразин, поэтому для оценки ПТ рассчитываем
, видим, что в обоих случаях остается неоттитрованный гидразин, поэтому для оценки ПТ рассчитываем 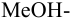 ошибку (основную) со знаком «-». С бромкрезоловым пурпурным (рТ 6):
ошибку (основную) со знаком «-». С бромкрезоловым пурпурным (рТ 6):
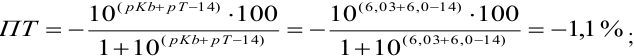
и с метиловым красным (рТ 5,5):
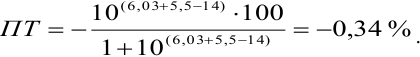
Из предложенных индикаторов метиловый красный позволяет провести титрование гидразина с меньшей погрешностью.
Расчет индикаторных погрешностей окислительно-восстановительного титрования
При использовании окислительно-восстановительных (редокс) индикаторов потенциал в ТЭ 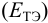 может не совпадать с потенциалом
может не совпадать с потенциалом  , который связан с
, который связан с 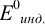 . (табл. 8.14) и интервалом перехода его окраски
. (табл. 8.14) и интервалом перехода его окраски 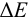 .
.
Таблица 8.14
Примеры распространенных окислительно-восстановительных индикаторов

Полуреакция восстановления и интервал перехода индикатора:

Наиболее часто в полуреакции восстановления (окисления) индикатора участвуют 2 электрона. Для индикаторов №1 — №6 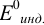 слабо зависит от pH. При расчете ПТ необходимо:
слабо зависит от pH. При расчете ПТ необходимо:
- сравнить
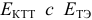 для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
Например, если 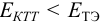 при титровании восстановителя (пример 8.30-а), то реакция не завершена; из уравнения Нернста для полуреакции титруемого компонента находят (объемы раствора в числителе и знаменателе одинаковы):
при титровании восстановителя (пример 8.30-а), то реакция не завершена; из уравнения Нернста для полуреакции титруемого компонента находят (объемы раствора в числителе и знаменателе одинаковы):

Сумма числителя и знаменателя здесь составляет 100 % титруемого вещества. Индикатор считается пригодным, если ПТ не превышает 0,1 -0,2%.
Пример 8.30.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании раствора соли  раствором соли
раствором соли  .
.
Решение:
Как следует из табл. 8.8 и рис. 8.3 (кривая 1, пример 8.25), область скачка (при относительной погрешности измерения объема 0,1 %) на кривой титрования 0,95 — 1,26 В, а 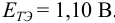 . Следовательно, для титрования можно выбрать индикаторы от №3 до №5 (табл. 8.14).
. Следовательно, для титрования можно выбрать индикаторы от №3 до №5 (табл. 8.14).
Выберем для рассмотрения порядка расчета два индикатора:
а) с 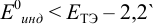 -дипиридил, для которого
-дипиридил, для которого 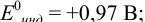
б) с 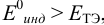 , например нитрофенантролин
, например нитрофенантролин 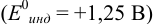 .
.
В случае а) интервал перехода индикатора:
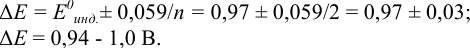
Изменение окраски заканчивается при  = 1,0 В. В растворе остаются неоттитрованными ионы
= 1,0 В. В растворе остаются неоттитрованными ионы 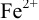 (оттитрованные ионы -ионы
(оттитрованные ионы -ионы  ). Для расчета ПТ используем уравнение Нернста для ре-докс- пары титруемого компонента (
). Для расчета ПТ используем уравнение Нернста для ре-докс- пары титруемого компонента ( /
/ ):
):
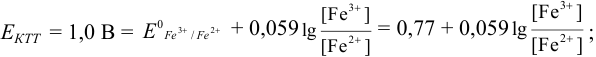
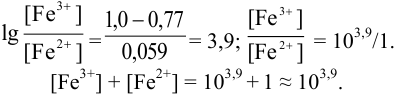
Тогда: ПТ = 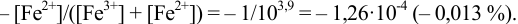
В случае б) интервал перехода индикатора нитрофенантролина в виде комплекса с  составляет:
составляет:
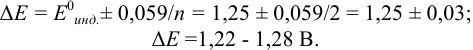
Изменение окраски заканчивается при  = 1,28 В и раствор перетитровывается. В этом случае ПТ имеет положительный знак и рассчитывается по уравнению Нернста для редокс-пары, образуемой титрантом
= 1,28 В и раствор перетитровывается. В этом случае ПТ имеет положительный знак и рассчитывается по уравнению Нернста для редокс-пары, образуемой титрантом  .
.
Тогда количество  (после ТЭ образования
(после ТЭ образования  не происходит) соответствует количеству взятых для титрования ионов
не происходит) соответствует количеству взятых для титрования ионов 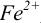 , а количество
, а количество 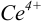 — их перетитрованному количеству.
— их перетитрованному количеству.
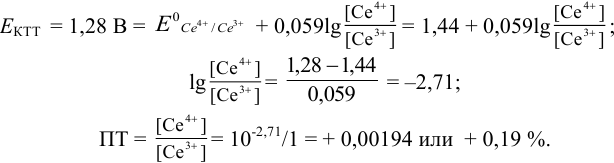
Таким образом, оба выбранных индикатора оказались приемлемыми.
Расчет индикаторных погрешностей комплексонометрического титрования
В конечной точке титрования общие концентрации определяемого иона с(М) и титранта c(Y) можно представить выражениями {для упрощения записи в общем виде упустим заряды ионов):
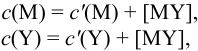
где 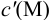 — концентрация всех форм определяемого иона, кроме входящего в комплекс
— концентрация всех форм определяемого иона, кроме входящего в комплекс 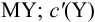 — концентрация всех форм титранта, кроме входящего в комплекс MY.
— концентрация всех форм титранта, кроме входящего в комплекс MY.
Условные константы устойчивости (см. выражение 8.16) связывают 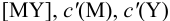
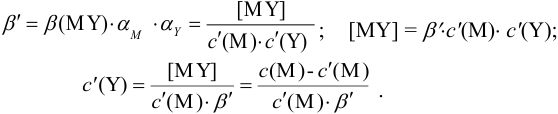
Отсюда относительная погрешность титрования (ПТ) определяется выражением (с учетом (8.18) и (8.19)):
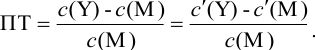
Подставляем в это уравнение выражение для 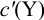 (8.20):
(8.20):
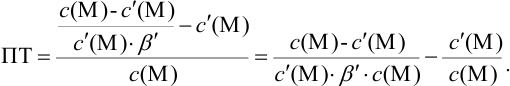
Вблизи ТЭ 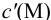 очень мала, поэтому
очень мала, поэтому 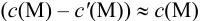 ,
,
следовательно: 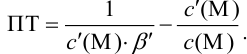
Выражение (8.21) тождественно выражению: 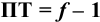 . Если конечная точка титрования находится после точки эквивалентности (степень оттитрованности
. Если конечная точка титрования находится после точки эквивалентности (степень оттитрованности 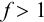 ), то относительная погрешность будет положительной. В случае недотитровывания, т. е. когда конечная точка титрования будет зафиксирована с помощью индикатора до точки эквивалентности
), то относительная погрешность будет положительной. В случае недотитровывания, т. е. когда конечная точка титрования будет зафиксирована с помощью индикатора до точки эквивалентности 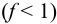 , ПТ будет со знаком «-».
, ПТ будет со знаком «-».
Конечная точка титрования определяется интервалом перехода окраски индикатора (интервалом рМ, в котором индикатор меняет свою окраску):
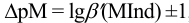 , где
, где 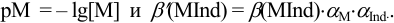
Интервал перехода окраски 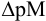 индикатора эриохром черный Т
индикатора эриохром черный Т 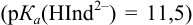 , образующего комплексы с ионами металлов при pH 10, составляет для ионов:
, образующего комплексы с ионами металлов при pH 10, составляет для ионов: 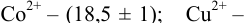
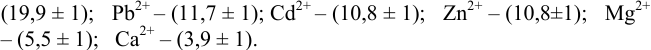
Пример 8.31.
Рассчитайте погрешность титрования 0,1 ОМ раствора 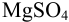 0,10 М раствором ЭДТА в присутствии индикатора эриохром черный Т в аммиачном буферном растворе при pH 10 и
0,10 М раствором ЭДТА в присутствии индикатора эриохром черный Т в аммиачном буферном растворе при pH 10 и  = 0,2 моль/л (см. условия в примере 8.27).
= 0,2 моль/л (см. условия в примере 8.27).
Решение:
В данных условиях 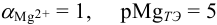 ,
,
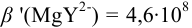 (пример 8.23). Интервал перехода окраски индикатора:
(пример 8.23). Интервал перехода окраски индикатора: 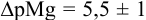 или в интервале концентраций магния от
или в интервале концентраций магния от 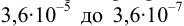 . Точка эквивалентности попадает в указанный интервал, индикатор считается пригодным для титрования
. Точка эквивалентности попадает в указанный интервал, индикатор считается пригодным для титрования  , КТТ наступает после ТЭ, когда
, КТТ наступает после ТЭ, когда 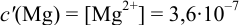 моль/л.
моль/л.
Погрешность титрования  с «эриохром черным Т»:
с «эриохром черным Т»:
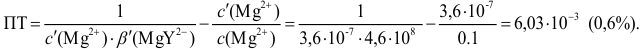
Пример 8.32.
Докажите возможность использования индикатора эриохром черный Т для титрования 0,010 М раствора 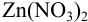 0,010 М раствором ЭДТА при pH = 10 и
0,010 М раствором ЭДТА при pH = 10 и  = 0,10 моль/л. Рассчитайте погрешность титрования при использовании этого индикатора.
= 0,10 моль/л. Рассчитайте погрешность титрования при использовании этого индикатора.
Решение:
1. Рассчитаем условную константу 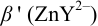 .
.
Общие константы устойчивости для аммиачных комплексов  (табл. 4 приложения):
(табл. 4 приложения): 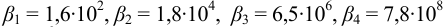 . Для свободных ионов
. Для свободных ионов  по формуле (2.8) предварительно рассчитаем
по формуле (2.8) предварительно рассчитаем 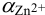 :
:
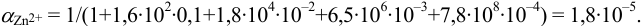
По табл. 7 и табл. 4 приложения находим 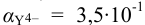 ,
, 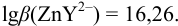 . Константа устойчивости комплекса
. Константа устойчивости комплекса  с ЭДТА при заданных условиях с учетом выражения (8.16):
с ЭДТА при заданных условиях с учетом выражения (8.16):
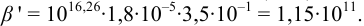
В точке эквивалентности:
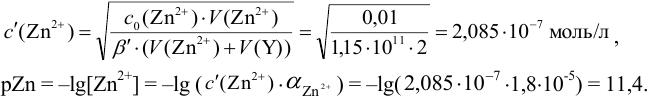
Интервал перехода окраски индикатора эриохром черный Т в случае титрования ионов цинка при pH 10: 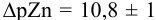 , т.е. от 9,8 до 11,8 или от
, т.е. от 9,8 до 11,8 или от 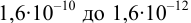 моль/л. Точка эквивалентности попадает в интервал концентраций, при которых индикатор меняет свою окраску. Следовательно, эриохром черный Т пригоден для титрования
моль/л. Точка эквивалентности попадает в интервал концентраций, при которых индикатор меняет свою окраску. Следовательно, эриохром черный Т пригоден для титрования  при заданных условиях.
при заданных условиях.
2. Конечная точка титрования наступает при [ ], равной
], равной 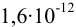 моль/л, отсюда концентрация всех форм
моль/л, отсюда концентрация всех форм  , за исключением связанных в комплекс с ЭДТА, составляет:
, за исключением связанных в комплекс с ЭДТА, составляет:
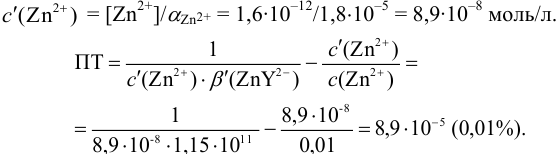
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы: