
Расчет индикаторных погрешностей кислотно-основного титрования
Согласно ионно-хромофорной теории индикаторов, интервал перехода окраски индикатора 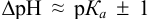 (табл. 12). Середина области перехода окраски (при этом pH близко к
(табл. 12). Середина области перехода окраски (при этом pH близко к 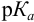 ) называется показателем титрования с данным индикатором или рТ индикатора. Индикаторные погрешности отсутствуют, когда рТ индикатора практически совпадает с pH в ТЭ. Основой для выбора индикатора является расчет и построение кривой титрования, определение области скачка и pH в ТЭ.
) называется показателем титрования с данным индикатором или рТ индикатора. Индикаторные погрешности отсутствуют, когда рТ индикатора практически совпадает с pH в ТЭ. Основой для выбора индикатора является расчет и построение кривой титрования, определение области скачка и pH в ТЭ.
Таблица 8.12
Важнейшие кислотно-основные индикаторы
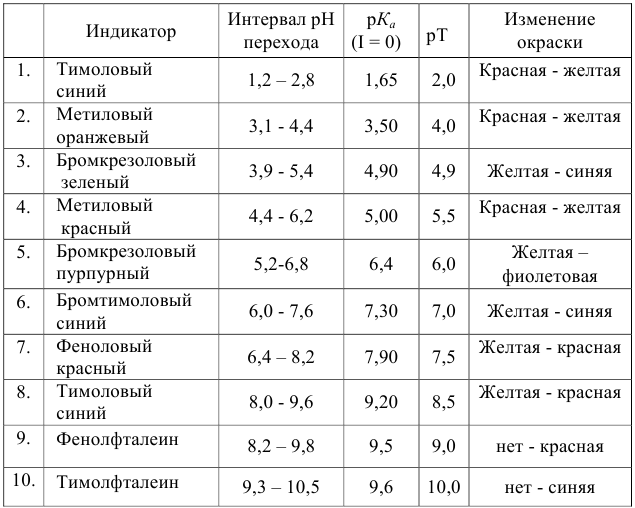
При правильно выбранном индикаторе индикаторная ПТ не должна превышать заданную погрешность измерения объема раствора в титриметрии. Типы (виды) индикаторных ПТ кислотно-осиовиого титрования и названия, встречающиеся в разных учебниках и сборниках задач, происхождение погрешностей и формулы для расчета приведены в табл. 8.13. Формулы легко выводятся из определения погрешности титрования как отношения недотитро-ванного или перетитрованного количества кислоты или основания к первоначально взятому для титрования (то есть к произведению 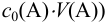 . Погрешность выражают в %, а вид и знак устанавливают по ходу процесса (кривой) титрования и составу раствора в КТТ (табл. 8.13, примеры 8.28 и 8.29).
. Погрешность выражают в %, а вид и знак устанавливают по ходу процесса (кривой) титрования и составу раствора в КТТ (табл. 8.13, примеры 8.28 и 8.29).
Таблица 8.13
Индикаторные погрешности кислотно-основного титрования

Пример 8.28.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании а)  и б)
и б) 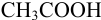 рабочим раствором
рабочим раствором 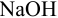 в условиях примера 8.21, если считать относительную погрешность измерения объема 0,4 %.
в условиях примера 8.21, если считать относительную погрешность измерения объема 0,4 %.
Решение:
а). Как следует из табл. 8.4 и рис. 8.1(1), для случая титрования  при погрешности определения объема 0,4 % область скачка на кривой титрования соответствует изменению pH от 3,4 до 10,9, а
при погрешности определения объема 0,4 % область скачка на кривой титрования соответствует изменению pH от 3,4 до 10,9, а  равен 7,0. Следовательно, для титрования можно выбрать индикаторы от №2 до №10 (табл. 8.12), т. к. их рТ и интервалы перехода окраски находятся в области скачка кривой.
равен 7,0. Следовательно, для титрования можно выбрать индикаторы от №2 до №10 (табл. 8.12), т. к. их рТ и интервалы перехода окраски находятся в области скачка кривой.
Однако используемые для расчета ПТ формулы показывают, что чем ближе рТ и  , тем меньше ПТ. «Идеально» подходит бромтимоловый синий, поскольку его рТ 7 практически совпадает с
, тем меньше ПТ. «Идеально» подходит бромтимоловый синий, поскольку его рТ 7 практически совпадает с  .
.
Рассчитаем величину ПТ с двумя индикаторами: с рТ <  и с р Г >
и с р Г >  и проверим их пригодность для титрования в заданных условиях.
и проверим их пригодность для титрования в заданных условиях.
С индикатором метиловым красным (рТ 5,5 <  ) в растворе остается неоттитрованная сильная кислота, следовательно, возникает протонная ошибка со знаком «-» (см. формулы в табл. 8.13):
) в растворе остается неоттитрованная сильная кислота, следовательно, возникает протонная ошибка со знаком «-» (см. формулы в табл. 8.13):
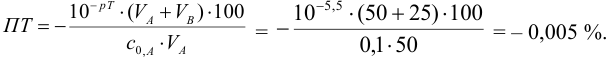
С индикатором фенолфталеином (рТ 9,0 >  ) в растворе -избыток сильного основания, в результате чего ПТ представляет собой
) в растворе -избыток сильного основания, в результате чего ПТ представляет собой 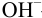 — ошибку (гидроксидную) со знаком «+»:
— ошибку (гидроксидную) со знаком «+»:
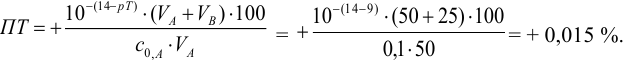
В данном случае оба индикатора пригодны, поскольку вычисленные значения ПТ не превышают заданную погрешность титрования (0,4%), но с метиловым красным систематическая индикаторная погрешность меньше.
б). При титровании 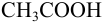 (табл. 8.5, рис. 8.1(2)) для той же точности титрования (99,6%) величина скачка меньше и составляет 7,2 — 10,9, а
(табл. 8.5, рис. 8.1(2)) для той же точности титрования (99,6%) величина скачка меньше и составляет 7,2 — 10,9, а  — 8,9. Круг пригодных индикаторов сужается до №7 — №9. Для индикаторов с рТ >
— 8,9. Круг пригодных индикаторов сужается до №7 — №9. Для индикаторов с рТ >  , как и в случае (а), ПТ соответствует
, как и в случае (а), ПТ соответствует  — ошибке (гидроксидной) со знаком «+».
— ошибке (гидроксидной) со знаком «+».
Например, при выборе фенолфталеина (рТ = 9,0):
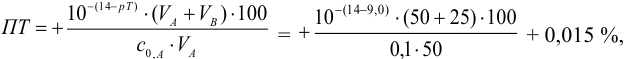
а при выборе тимолфталеина (рТ = 10,0) погрешность возрастает в 10 раз: 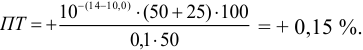
Выбор фенолфталеина приводит к меньшей индикаторной погрешности титрования 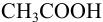 , но могут использоваться оба индикатора.
, но могут использоваться оба индикатора.
При титровании с индикаторами, для которых рТ < рНтэ, в растворе остается неоттитрованная слабая кислота, т. е. присутствует НА-ошибка (кислотная) со знаком «-» (см. табл. 8.13). Если использовать индикатор бромтимоловый синий (рТ 7,0), то вычисленная ПТ не удовлетворяет заданной точности, индикатор не пригоден:
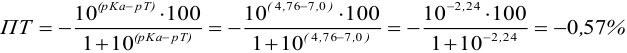
или при проведении расчета по приближенной формуле:
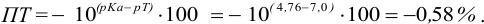
Пример 8.29.
Какой индикатор позволяет оттитровать 0,1000 М гидразин  0,1000 М раствором
0,1000 М раствором  с меньшей погрешностью: бромкрезоловый пурпурный (рТ 6,0) или метиловый красный (рТ 5,5)?
с меньшей погрешностью: бромкрезоловый пурпурный (рТ 6,0) или метиловый красный (рТ 5,5)?
Решение:
Реакция титрования:
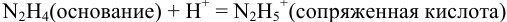
приводит к образованию слабой сопряженной кислоты 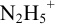
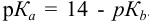 . Тогда
. Тогда 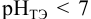 и вычисляется с учетом того, что
и вычисляется с учетом того, что 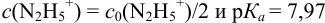 :
:
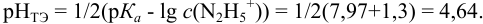
Сравнивая рТ индикаторов и  , видим, что в обоих случаях остается неоттитрованный гидразин, поэтому для оценки ПТ рассчитываем
, видим, что в обоих случаях остается неоттитрованный гидразин, поэтому для оценки ПТ рассчитываем 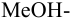 ошибку (основную) со знаком «-». С бромкрезоловым пурпурным (рТ 6):
ошибку (основную) со знаком «-». С бромкрезоловым пурпурным (рТ 6):
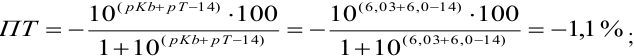
и с метиловым красным (рТ 5,5):
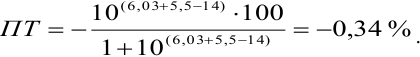
Из предложенных индикаторов метиловый красный позволяет провести титрование гидразина с меньшей погрешностью.
Расчет индикаторных погрешностей окислительно-восстановительного титрования
При использовании окислительно-восстановительных (редокс) индикаторов потенциал в ТЭ 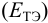 может не совпадать с потенциалом
может не совпадать с потенциалом  , который связан с
, который связан с 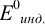 . (табл. 8.14) и интервалом перехода его окраски
. (табл. 8.14) и интервалом перехода его окраски 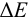 .
.
Таблица 8.14
Примеры распространенных окислительно-восстановительных индикаторов
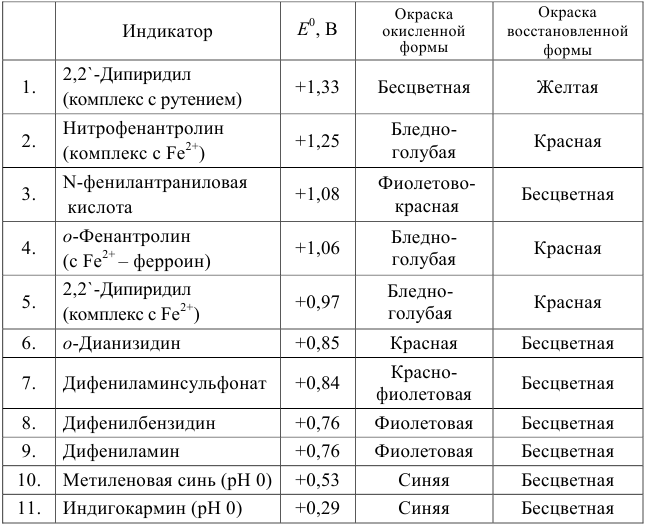
Полуреакция восстановления и интервал перехода индикатора:

Наиболее часто в полуреакции восстановления (окисления) индикатора участвуют 2 электрона. Для индикаторов №1 — №6 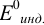 слабо зависит от pH. При расчете ПТ необходимо:
слабо зависит от pH. При расчете ПТ необходимо:
- сравнить
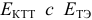 для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
для выбора редокс-пары участников реакции титрования и уравнения Нернста для расчета ПТ.
Например, если 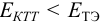 при титровании восстановителя (пример 8.30-а), то реакция не завершена; из уравнения Нернста для полуреакции титруемого компонента находят (объемы раствора в числителе и знаменателе одинаковы):
при титровании восстановителя (пример 8.30-а), то реакция не завершена; из уравнения Нернста для полуреакции титруемого компонента находят (объемы раствора в числителе и знаменателе одинаковы):

Сумма числителя и знаменателя здесь составляет 100 % титруемого вещества. Индикатор считается пригодным, если ПТ не превышает 0,1 -0,2%.
Пример 8.30.
Выберите подходящие индикаторы, определите тип индикаторных погрешностей и рассчитайте ПТ при титровании раствора соли  раствором соли
раствором соли  .
.
Решение:
Как следует из табл. 8.8 и рис. 8.3 (кривая 1, пример 8.25), область скачка (при относительной погрешности измерения объема 0,1 %) на кривой титрования 0,95 — 1,26 В, а 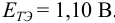 . Следовательно, для титрования можно выбрать индикаторы от №3 до №5 (табл. 8.14).
. Следовательно, для титрования можно выбрать индикаторы от №3 до №5 (табл. 8.14).
Выберем для рассмотрения порядка расчета два индикатора:
а) с 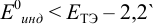 -дипиридил, для которого
-дипиридил, для которого 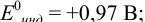
б) с 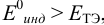 , например нитрофенантролин
, например нитрофенантролин 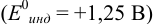 .
.
В случае а) интервал перехода индикатора:
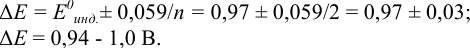
Изменение окраски заканчивается при  = 1,0 В. В растворе остаются неоттитрованными ионы
= 1,0 В. В растворе остаются неоттитрованными ионы 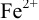 (оттитрованные ионы -ионы
(оттитрованные ионы -ионы  ). Для расчета ПТ используем уравнение Нернста для ре-докс- пары титруемого компонента (
). Для расчета ПТ используем уравнение Нернста для ре-докс- пары титруемого компонента ( /
/ ):
):
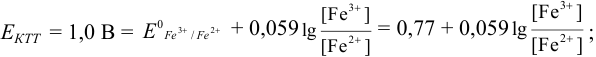
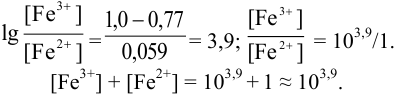
Тогда: ПТ = 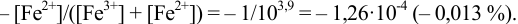
В случае б) интервал перехода индикатора нитрофенантролина в виде комплекса с  составляет:
составляет:
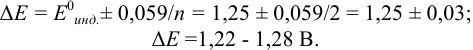
Изменение окраски заканчивается при  = 1,28 В и раствор перетитровывается. В этом случае ПТ имеет положительный знак и рассчитывается по уравнению Нернста для редокс-пары, образуемой титрантом
= 1,28 В и раствор перетитровывается. В этом случае ПТ имеет положительный знак и рассчитывается по уравнению Нернста для редокс-пары, образуемой титрантом  .
.
Тогда количество  (после ТЭ образования
(после ТЭ образования  не происходит) соответствует количеству взятых для титрования ионов
не происходит) соответствует количеству взятых для титрования ионов 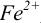 , а количество
, а количество 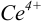 — их перетитрованному количеству.
— их перетитрованному количеству.
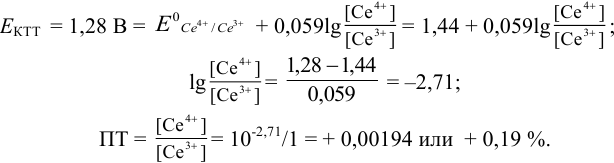
Таким образом, оба выбранных индикатора оказались приемлемыми.
Расчет индикаторных погрешностей комплексонометрического титрования
В конечной точке титрования общие концентрации определяемого иона с(М) и титранта c(Y) можно представить выражениями {для упрощения записи в общем виде упустим заряды ионов):
где 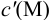 — концентрация всех форм определяемого иона, кроме входящего в комплекс
— концентрация всех форм определяемого иона, кроме входящего в комплекс 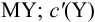 — концентрация всех форм титранта, кроме входящего в комплекс MY.
— концентрация всех форм титранта, кроме входящего в комплекс MY.
Условные константы устойчивости (см. выражение 8.16) связывают 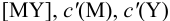
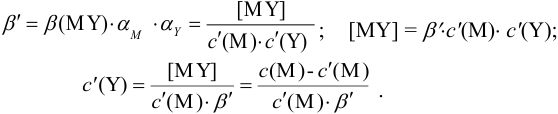
Отсюда относительная погрешность титрования (ПТ) определяется выражением (с учетом (8.18) и (8.19)):
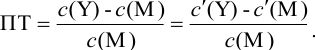
Подставляем в это уравнение выражение для 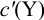 (8.20):
(8.20):
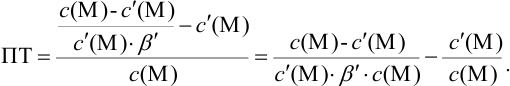
Вблизи ТЭ 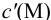 очень мала, поэтому
очень мала, поэтому 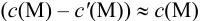 ,
,
следовательно: 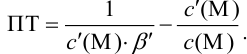
Выражение (8.21) тождественно выражению: 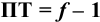 . Если конечная точка титрования находится после точки эквивалентности (степень оттитрованности
. Если конечная точка титрования находится после точки эквивалентности (степень оттитрованности 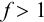 ), то относительная погрешность будет положительной. В случае недотитровывания, т. е. когда конечная точка титрования будет зафиксирована с помощью индикатора до точки эквивалентности
), то относительная погрешность будет положительной. В случае недотитровывания, т. е. когда конечная точка титрования будет зафиксирована с помощью индикатора до точки эквивалентности 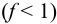 , ПТ будет со знаком «-».
, ПТ будет со знаком «-».
Конечная точка титрования определяется интервалом перехода окраски индикатора (интервалом рМ, в котором индикатор меняет свою окраску):
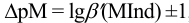 , где
, где 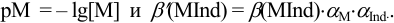
Интервал перехода окраски 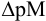 индикатора эриохром черный Т
индикатора эриохром черный Т 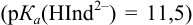 , образующего комплексы с ионами металлов при pH 10, составляет для ионов:
, образующего комплексы с ионами металлов при pH 10, составляет для ионов: 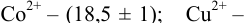
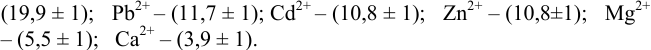
Пример 8.31.
Рассчитайте погрешность титрования 0,1 ОМ раствора 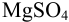 0,10 М раствором ЭДТА в присутствии индикатора эриохром черный Т в аммиачном буферном растворе при pH 10 и
0,10 М раствором ЭДТА в присутствии индикатора эриохром черный Т в аммиачном буферном растворе при pH 10 и  = 0,2 моль/л (см. условия в примере 8.27).
= 0,2 моль/л (см. условия в примере 8.27).
Решение:
В данных условиях 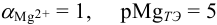 ,
,
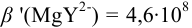 (пример 8.23). Интервал перехода окраски индикатора:
(пример 8.23). Интервал перехода окраски индикатора: 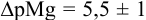 или в интервале концентраций магния от
или в интервале концентраций магния от 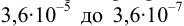 . Точка эквивалентности попадает в указанный интервал, индикатор считается пригодным для титрования
. Точка эквивалентности попадает в указанный интервал, индикатор считается пригодным для титрования  , КТТ наступает после ТЭ, когда
, КТТ наступает после ТЭ, когда 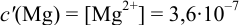 моль/л.
моль/л.
Погрешность титрования  с «эриохром черным Т»:
с «эриохром черным Т»:
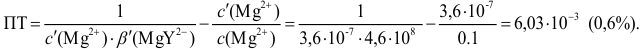
Пример 8.32.
Докажите возможность использования индикатора эриохром черный Т для титрования 0,010 М раствора 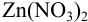 0,010 М раствором ЭДТА при pH = 10 и
0,010 М раствором ЭДТА при pH = 10 и  = 0,10 моль/л. Рассчитайте погрешность титрования при использовании этого индикатора.
= 0,10 моль/л. Рассчитайте погрешность титрования при использовании этого индикатора.
Решение:
1. Рассчитаем условную константу 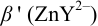 .
.
Общие константы устойчивости для аммиачных комплексов  (табл. 4 приложения):
(табл. 4 приложения): 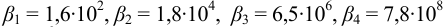 . Для свободных ионов
. Для свободных ионов  по формуле (2.8) предварительно рассчитаем
по формуле (2.8) предварительно рассчитаем 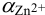 :
:
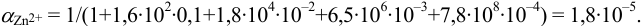
По табл. 7 и табл. 4 приложения находим 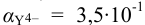 ,
, 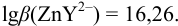 . Константа устойчивости комплекса
. Константа устойчивости комплекса  с ЭДТА при заданных условиях с учетом выражения (8.16):
с ЭДТА при заданных условиях с учетом выражения (8.16):
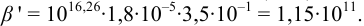
В точке эквивалентности:
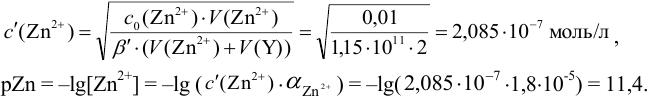
Интервал перехода окраски индикатора эриохром черный Т в случае титрования ионов цинка при pH 10: 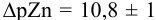 , т.е. от 9,8 до 11,8 или от
, т.е. от 9,8 до 11,8 или от 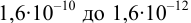 моль/л. Точка эквивалентности попадает в интервал концентраций, при которых индикатор меняет свою окраску. Следовательно, эриохром черный Т пригоден для титрования
моль/л. Точка эквивалентности попадает в интервал концентраций, при которых индикатор меняет свою окраску. Следовательно, эриохром черный Т пригоден для титрования  при заданных условиях.
при заданных условиях.
2. Конечная точка титрования наступает при [ ], равной
], равной 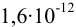 моль/л, отсюда концентрация всех форм
моль/л, отсюда концентрация всех форм  , за исключением связанных в комплекс с ЭДТА, составляет:
, за исключением связанных в комплекс с ЭДТА, составляет:
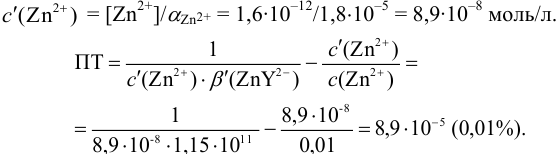
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

Индикаторные погрешности титрования
При титровании возможны случайные и
систематические погрешности. Случайные
погрешности связаны с измерением объема
и массы навески, но и значительную часть
погрешности титрования составляют
систематические погрешности, в частности,
индикаторная.
Случайные погрешности обрабатываются
по законам математической статистики.
Индикаторные погрешности связаны с
тем, что pT индикатора не
совпадает со значением pH
в ТЭ. Конечная точка титрования с данным
индикатором не совпадает с ТЭ.
При недотитровывании:
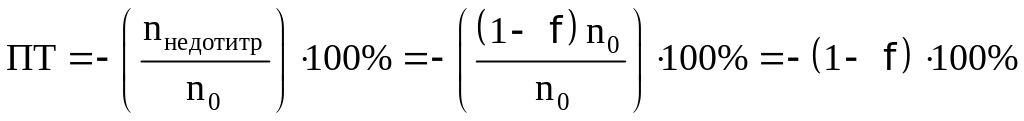
При перетитровывании:
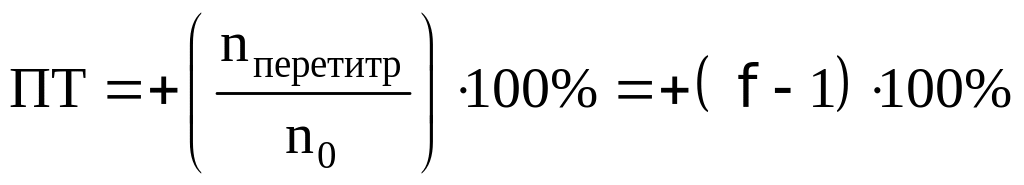
Возьмем индикаторы хризоидин (pT=5,50)
и хлорфеноловый красный (pT
= 5,80). В данном случае в КТТ pH
будет больше, чем pH в ТЭ
(pH = 5,28), а, следовательно,
в растворе будет неотитрованное
основание. Эта погрешность, обусловленная
содержанием неоттитрованного основания,
называется щелочной, будет определяться
уравнением
![]()
.
На данном этапе титрования pH
будет определяться по формуле
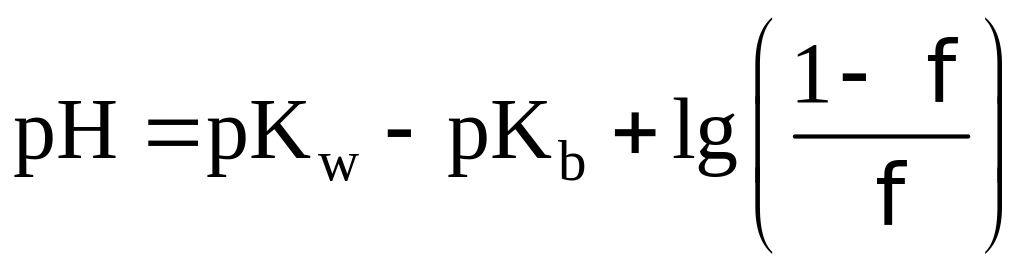
.
В КТТ pH раствора равен
pT. Следовательно, можно
найти и f
в КТТ:
![]()
.
Отсюда,

.
Посчитаем ПТ для данных индикаторов:
хризоидин:
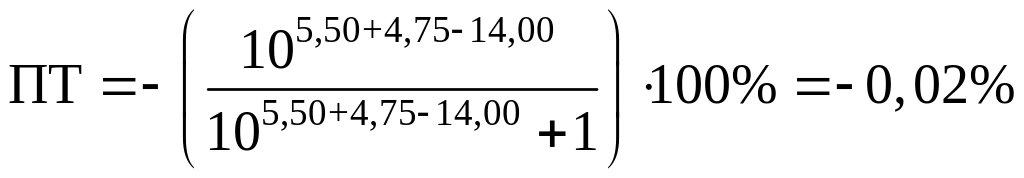
хлорфеноловый красный:
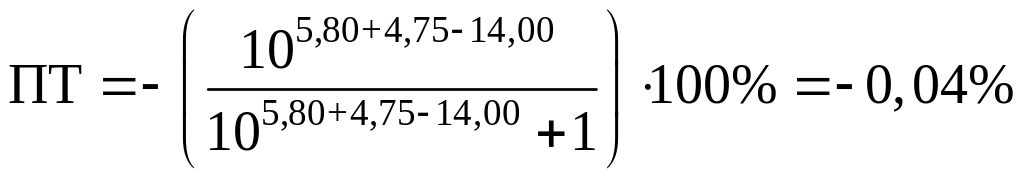
Оба эти индикатора подойдут для нашего
титрования. Рассмотрим ПТ для индикатора
розоловая кислота (pT=7,1).
По данной формуле получается ПТ=–0,70%,
что превышает обычно задаваемое значение
погрешности (±0,2%).
Рассмотрим же теперь случай, когда мы
используем индикаторы с pT
меньшим, чем pH в ТЭ. В КТТ
раствор будет перетитрован, и pH
будет определяться концентрацией
сильной кислоты (водородная погрешность),
и в нашей задаче определяться уравнением
.
Погрешность будет определяться по
формуле
![]()
Возьмем для примера индикаторы лакмоид
(pT=5,20), ализариновый красный
C (pT=4,45) и
бромфеноловый синий (pT=3,80).
pH раствора в КТТ равен
pT:
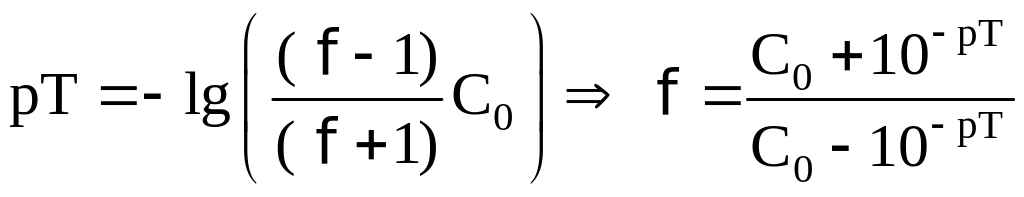
.
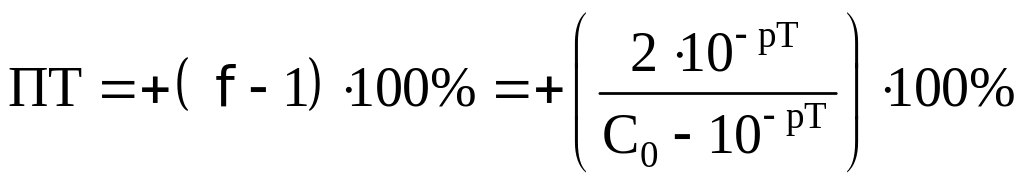
.
Рассчитаем ПТ для наших индикаторов:
Лакмоид:

Ализариновый красный C:
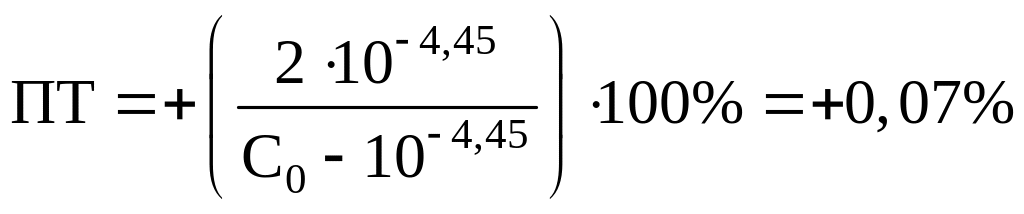
Бромфеноловый синий:

Вполне очевидно, что из двух предложенных
индикаторов наиболее подходящим является
ализариновый красный C.
Учитывая все расчеты, приходим к выводу,
что самыми подходящими для нашего опыта
индикаторами являются хризоидин (с
интервалом перехода 4,0 – 7,0, оранжевая
– желтая) и лакмоид (4,0 – 6,4, красная –
синяя).
Выводы
По кривой титрования аммиака можно
сделать ряд выводов.
В ходе титрования заметно плавное
уменьшение pH и заметен
скачок в области точки эквивалентности.
Скачок титрования полностью находится
в кислой области.
Точка эквивалентности расположена при
pH 5,28 и, очевидно, не
совпадает с точкой нейтральности. Скачок
титрования 0,1 М аммиака в пределах ±0,1%
от точки эквивалентности находится в
пределах pH от 6,25 до 4,30 и
составляет примерно 2 единицы pH,
что намного меньше скачка сильной щелочи
(6 единиц pH). С уменьшением
концентрации и увеличением температуры
скачок уменьшается.
В нашем случае одними из самых подходящих
являются лакмоид и хризоидин.
Окислительно-восстановительное титрование
Метод основан на реакциях
окисления-восстановления. Их называют
по применяемому тированному раствору
реагента, например: перманганатометрия,
йодометрия, бихроматометрия. В этих
методах в качестве титрантов применяют,
соответственно, KMnO4,
I2, K2Cr2O7.
В основе метода лежит изменение
окислительно-восстановительного
потенциала, обусловленного протеканием
окислительно-восстановительной реакции
между титрантом и определяемым веществом.
![]()
В процессе титрования происходит
изменение концентраций окисленной и
восстановленной форм, а, следовательно,
изменяется окислительно-восстановительный
потенциал титруемого раствора, включающей
две редоксопары.
В соответствии с уравнением Нернста
окислительно-восстановительный потенциал
для любой редоксопары:
![]()
Для каждого отдельного метода
окислительно-восстановительного
титрования используются свои стандартные
растворы.
Рассмотрим наш случай – перманганатометрия.
Рабочим раствором этого метода является
раствор перманганата калия KMnO4,
он неустойчив из-за реакции с водой,
катализируемый диоксидом марганца и
на свету:
![]()
Поэтому растворы перманганата калия
следует готовить, используя чистую воду
(органические примеси в воде могут
реагировать с
![]()
и давать MnO2, ускоряющий
разложение реагента), отфильтровать от
диоксида марганца и хранить в темных
склянках; раствор следует выдержать
несколько недель для окончания протекания
всех процессов. Очевидно, что раствор
следует стандартизировать, для чего
используют оксалат натрия и другие
восстановители. Реакция
![]()
катализируется ионами Mn2+.
Первые капли перманганата даже в горячем
растворе обесцвечиваются очень медленно.
В ходе титрования концентрация ионов
Mn2+ возрастает и
скорость реакции увеличивается: реакция
автокаталитическая.
Титр перманганата калия можно установить
также по оксиду мышьяка(III)
или металлическому железу.
В перманганатометрии применяют также
растворы восстановителей – слои Fe(II),
щавелевую кислоту и некоторые другие
– для определения окислителей методом
обратного титрования. Соединения Fe(II)
на воздухе медленно окисляются, особенно
в нейтральном растворе. Подкисление
замедляет процесс окисления, однако
обычно рекомендуется перед применением
раствора Fe(II)
в анализе проверить его титр. Оксалаты
и щавелевая кислота в растворе медленно
разлагаются. Этот процесс ускоряется
на свету, поэтому растворы оксалатов
рекомендуется хранить в темных склянках.
Подкисленные растворы оксалатов более
устойчивы, чем нейтральные или щелочные.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Подборка по базе: Элементы теории вероятностей, применяемые в инжиниринге качества, ГСМ и спец. жидкости применяемые при переводе ВВТ на сезонный ре, Современные фитопрепараты и сборы применяемые в комплексной тер, Лекция 9 Материалы и металлы, применяемые для проектирования.Пу, Технологии, применяемые при работе с детьми с ОВЗ..doc, _Установка окислительного вакуумирования металла.doc, Химические вещества применяемые в косметике.docx, тема 2 ТС, оборудование, инструменты, приборы, механизмы, приспо, Конспект на тему_ Термопринтеры, сканеры штрих-кодов, терминалы , Задания по теме Окислительно восстановительные реакции.doc
МИНИСТЕРСТВО ВЫСШЕГО ОБРАЗОВАНИЯ, НАУКИ И ИННОВАЦИЙ РЕСПУБЛИКИ УЗБЕКИСТАН
КАРАКАЛПАКСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ИМЕНИ БЕРДАХА
ХИМИКО-ТЕХНОЛОГИЧЕСКИЙ ФАКУЛЬТЕТ
КАФЕДРА ФИЗИЧЕСКОЙ И КОЛЛОИДНОЙ ХИМИИ
КУРСОВАЯ РАБОТА
по предмету
«АНАЛИТИЧЕСКАЯ ХИМИЯ»
Тема: Индикаторы, применяемые в окислительно- восстановительном методе и расчет ошибок индикатора.
Выполнил: ____________ студент 2 курса химии Юлдошов Ж.Б.
Преподаватель: _____________ к.х.н., доцент Узакбергенова З.Д.
Нукус — 2023
Содержание
Глава 1. Литературный обзор 5
1.1. Описание окислительно-восстановительного метода 5
1.2. Что такое индикаторы и почему они важны в этом методе 9
1.3. Классификация индикаторов по принципу действия 12
Глава 2. Экспериментальная часть 15
2.1. Реактивы и приборы 15
2.2. Особенности применения индикаторов в различных типах реакций (кислородно-восстановительные, кислородно-окислительные) 17
2.3. Примеры применения индикаторов в различных областях (анализ воды, фармакология, пищевая промышленность и др.) 20
Глава 3. Обсуждение результатов 23
Для более точного расчета концентрации вещества с использованием индикатора необходимо также учитывать погрешности, связанные с измерениями, и ошибки индикатора. 27
3.1. Расчет ошибки индикатора с помощью формулы неопределенности 27
3.2. Влияние факторов на ошибку индикатора (концентрация реагентов, качество индикатора, методика измерения и др.) 30
Заключение 32
Список использованной литературы 34
Введение
Актуальность темы. Окислительно-восстановительный метод является одним из наиболее распространенных методов анализа, используемых в различных областях науки и технологии. В этом методе используется химическая реакция, в которой происходит перенос электронов между реагентами, сопровождающийся изменением окислительного состояния этих реагентов. Одним из ключевых элементов в проведении окислительно-восстановительных реакций являются индикаторы, которые используются для определения точки эквивалентности и концентрации вещества.
Цель этой работы — рассмотреть различные типы индикаторов, используемых в окислительно-восстановительном методе, а также их применение и расчет ошибок индикатора. В первой главе работы будет дано введение в окислительно-восстановительный метод и индикаторы, а также будет проведена классификация индикаторов по принципу действия. Во второй главе будет рассмотрено применение индикаторов в окислительно-восстановительном методе, а также приведены примеры их использования в различных областях науки и технологии. В третьей главе будет рассмотрен расчет ошибок индикатора, в том числе определение понятия «ошибка индикатора», расчет ошибки с помощью формулы неопределенности, а также влияние факторов на ошибку индикатора и пути ее уменьшения.
Таким образом, изучение индикаторов в окислительно-восстановительном методе имеет большое значение для получения точных результатов анализа и улучшения качества проводимых исследований.
Важность индикаторов в окислительно-восстановительном методе заключается в том, что они позволяют определить конечную точку реакции и узнать, достигнута ли точка эквивалентности. Индикаторы используются для отслеживания изменений окраски реакционной смеси и определения момента, когда происходит изменение окислительного состояния реагентов.
Существует большое разнообразие индикаторов, каждый из которых реагирует на определенный тип химических реакций.
БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССОВ. Процессы обмена веществ, дыхания, гниения, брожения, фотосинтеза являются в своей основе окислительно-восстановительными процессами. В случае аэробного метаболизма основным окислителем является молекулярный кислород, а восстановителем – органические вещества продуктов питания. Показателем того, что в основе жизнедеятельности организма лежат окислительно-восстановительные реакции, являются биоэлектрические потенциалы органов и тканей. Биопотенциалы являются качественной и количественной характеристикой направления, глубины и интенсивности протекания биохимических процессов. Поэтому регистрация биопотенциалов органов и тканей широко применяется в клинической практике при изучении их деятельности, в частности при диагностике сердечно-сосудистых заболеваний снимают электрокардиограмму, при измерении биопотенциалов мышц снимают электромиограмму. Регистрация потенциалов мозга – энцефалография – позволяет судить о патологических нарушениях нервной системы. Источником энергии жизнедеятельности клеток служит мембранный потенциал, равный 80 мВ, обусловленный возникновением ионной асимметрии, т.е. неодинаковым распределением по обе стороны мембраны катионов и анионов. Мембранный потенциал имеет ионную природу. В многоядерных комплексах протекают процессы, связанные с переносом электронов и протонов между частицами, которые сопровождаются изменением степени окисления реагирующих частиц и возникновением окислительно-восстановительного потенциала. Окислительно-восстановительный потенциал имеет электронную природу. Эти процессы имеют обратимый циклический характер и лежат в основе многих важных физиологических процессов. Михаэлис отмечал важную роль окислительно-восстановительных процессов в жизни: «Окислительно-восстановительные процессы, происходящие в живых организмах, относятся к разряду тех, которые не только бросаются в глаза и могут быть опознаны, но и являются самыми важными для жизни и с биологической, и с философской точки зрения».
Сущность окислительно-восстановительных процессов. В 1913 году Л.В. Писаржевский выступил с электронной теорией окислительно-восстановительных процессов, которая является в настоящее время общепринятой. Этот тип реакций осуществляется за счет перераспределения электронной плотности между атомами реагирующих веществ (переходом электронов), что проявляется в изменении степени окисления.
Реакции, в результате которых изменяются степени окисления атомов, входящих в состав реагирующих веществ вследствие переноса электрона между ними, называются окислительно-восстановительными реакциями.
Окислительно-восстановительный процесс состоит из 2 элементарных актов или полуреакций: окисления и восстановления.
Окисление – это процесс потери (отдачи) электронов атомом, молекулой или ионом.
Глава 1. Литературный обзор
1.1. Описание окислительно-восстановительного метода
Окислительно-восстановительный метод является одним из основных методов аналитической химии и широко используется для определения концентрации ряда веществ в различных областях науки и техники. Этот метод основан на процессах окисления и восстановления, которые происходят в растворах при взаимодействии веществ с окислителями и восстановителями.
Для того чтобы точно определить концентрацию вещества методом окислительно-восстановительной реакции, необходимо использовать индикаторы, которые помогут контролировать процесс химической реакции и определить ее конец. Индикаторы могут быть органическими или неорганическими веществами, которые изменяют свой цвет или свойства в зависимости от того, какой стадии процесса они находятся.
В данной работе мы рассмотрим различные индикаторы, которые используются в окислительно-восстановительном методе анализа, а также рассмотрим способы расчета ошибок индикатора. В результате, мы получим более полное представление о том, как работают индикаторы в окислительно-восстановительных реакциях и какие ошибки могут возникнуть в процессе их использования.
Важно отметить, что выбор индикатора зависит от химической реакции, которую мы исследуем, и от свойств используемых растворов. Некоторые индикаторы могут работать только в кислой или щелочной среде, в то время как другие могут быть использованы только в определенном диапазоне концентраций.
Помимо этого, при использовании индикаторов важно учитывать возможные ошибки, которые могут возникнуть в процессе эксперимента. Ошибки могут быть вызваны не только неточностью индикатора, но и неточностью проведения эксперимента, ошибками в измерении объемов растворов, использованием не очищенной посуды и т.д.
В этой работе мы рассмотрим основные индикаторы, используемые в окислительно-восстановительном методе, такие как перманганат калия, ферроцианид калия, тиосульфат натрия и другие, а также различные методы расчета ошибок индикаторов.
Таким образом, изучение индикаторов, применяемых в окислительно-восстановительном методе, и расчет ошибок индикатора является важной задачей аналитической химии. Знание особенностей работы индикаторов и способов их расчета помогает получить более точные и достоверные результаты анализа.
В рамках данной работы также будет рассмотрено влияние некоторых факторов на точность измерений при использовании индикаторов. К таким факторам относятся изменение температуры, концентрация и состав растворов, длительность эксперимента и т.д.
Для изучения этих факторов используются различные методы анализа, такие как градуировочная кривая, метод внешнего стандарта и метод добавления стандартного раствора. Каждый из этих методов имеет свои особенности и может быть применен в зависимости от условий эксперимента и требований точности измерений.
Также в работе будет представлен пример расчета ошибки индикатора на конкретном примере, что позволит лучше понять особенности работы с индикаторами в практических задачах.
Таким образом, данная работа имеет целью описать основные индикаторы, применяемые в окислительно-восстановительном методе, и методы их использования и расчета ошибок. Работа может быть полезна как студентам, изучающим аналитическую химию, так и специалистам, работающим в области анализа и контроля качества различных продуктов и материалов.
Важным аспектом, который следует учитывать при работе с индикаторами, является выбор подходящего индикатора для конкретной задачи. При выборе индикатора необходимо учитывать pH раствора, который анализируется, а также диапазон изменения pH в процессе реакции.
Например, при анализе раствора с pH 4 можно использовать индикатор бромтимоловый синий, который имеет переходный диапазон от красного (pH 3,0) до желтого (pH 4,6). Однако, если раствор имеет pH 7, то бромтимоловый синий уже не будет подходящим индикатором, и для анализа такого раствора лучше использовать фенолфталеин.
Также необходимо учитывать свойства самого индикатора, такие как его степень чувствительности к изменению pH и скорость перехода цвета. Некоторые индикаторы могут быть более чувствительными к изменению pH, но могут переходить между цветами слишком быстро, что может затруднить наблюдение за процессом перехода цвета.
Стоит учитывать, что в окислительно-восстановительном методе используются различные реактивы, которые также могут влиять на выбор индикатора. Например, в присутствии фосфатов и сульфатов некоторые индикаторы могут образовывать сложные соединения, что может привести к искажению результатов анализа.
Важно также учитывать условия эксперимента, такие как температура, давление и концентрация реактивов, которые могут влиять на точность и надежность результатов. Для минимизации ошибок необходимо контролировать эти параметры и обеспечивать одинаковые условия при проведении анализов.
Также следует учитывать, что при расчете ошибок индикатора необходимо учитывать не только погрешности при измерении, но и вклад систематических ошибок, таких как ошибки при приготовлении реактивов или использовании нечетких границ перехода цвета индикатора. Поэтому при работе с индикаторами необходимо строго следить за всеми этапами анализа и проводить необходимые корректировки и проверки. Таким образом, индикаторы играют важную роль в окислительно-восстановительном методе.
1.2. Что такое индикаторы и почему они важны в этом методе
Индикаторы — это вещества, которые меняют свой цвет в зависимости от изменения pH раствора, температуры или концентрации определенного вещества. Они являются неотъемлемой частью окислительно-восстановительного метода, который используется для определения содержания различных веществ в растворах, например, воде.
В окислительно-восстановительном методе важно контролировать процесс окисления и восстановления веществ, происходящий в растворе. Индикаторы помогают контролировать этот процесс, так как они меняют свой цвет при определенных изменениях pH или концентрации веществ в растворе. Индикаторы могут быть использованы для определения конечной точки реакции, то есть момента, когда все вещества в растворе окислены или восстановлены до конца. Благодаря индикаторам можно определить точное количество окислителя или восстановителя, которое требуется для проведения реакции до конца.
Таким образом, индикаторы являются важным элементом окислительно-восстановительного метода, так как позволяют получить точные результаты анализа. Они позволяют контролировать процесс реакции и определить конечную точку реакции, что позволяет определить количество веществ в растворе.
Важность использования индикаторов в окислительно-восстановительном методе связана с тем, что этот метод широко используется в различных отраслях, таких как медицина, пищевая промышленность, анализ воды и т.д. Он позволяет определять содержание различных веществ в растворах, например, уровень загрязнения воды или содержание антиоксидантов в пищевых продуктах. Без использования индикаторов невозможно получить точные результаты анализа.
Существует множество различных индикаторов, каждый из которых обладает своими уникальными свойствами и используется в зависимости от конкретных задач анализа. Некоторые индикаторы обладают высокой точностью и чувствительностью, что позволяет определять содержание веществ в небольших количествах. Другие индикаторы обладают более широким диапазоном pH, что позволяет использовать их для анализа растворов с различным уровнем кислотности.
Кроме того, важно учитывать ошибки, которые могут возникнуть при использовании индикаторов. Например, ошибки могут возникнуть из-за неправильной калибровки индикатора или из-за неоднородности раствора. Поэтому необходимо проводить точные расчеты, чтобы уменьшить вероятность возникновения ошибок и получить точные результаты анализа.
Таким образом, использование индикаторов в окислительно-восстановительном методе является важным шагом в получении точных результатов анализа. Они позволяют контролировать процесс реакции и определить конечную точку реакции, что позволяет получить точные результаты. Однако необходимо учитывать возможные ошибки, которые могут возникнуть при использовании индикаторов, и проводить точные расчеты, чтобы получить наиболее точные результаты анализа.
Другим важным показателем, используемым в окислительно-восстановительных методах, является точность определения содержания вещества. В этом контексте ошибка индикатора, которая может возникнуть при использовании индикатора, играет большую роль. Ошибка индикатора обычно определяется экспериментально путем сравнения измеренного значения с известным и считается как процент отклонения от ожидаемого значения.
Точность определения содержания вещества зависит от различных факторов, таких как качество используемых реактивов, состояние инструментов и условия эксперимента. Поэтому важно проводить контроль качества и корректировать ошибки при необходимости.
Несмотря на возможные ошибки, индикаторы продолжают играть важную роль в окислительно-восстановительных методах и являются необходимым инструментом для определения содержания вещества в образцах.
Ошибка индикатора обычно определяется экспериментально путем сравнения.
1.3. Классификация индикаторов по принципу действия
Индикаторы могут классифицироваться по различным принципам, включая их принцип действия. В окислительно-восстановительных методах индикаторы используются для определения концентрации вещества в образце путем изменения цвета раствора в зависимости от окислительно-восстановительных свойств реагента.
В соответствии с принципом действия индикаторы могут быть классифицированы следующим образом:
- Окислительно-восстановительные индикаторы: эти индикаторы изменяют цвет в зависимости от окислительно-восстановительных свойств реагента. Например, калий-дихромат используется в качестве индикатора в окислительно-восстановительных титрах, где он окисляет вещество, которое содержит вещество, реагирующее с ним.
- Комплексообразующие индикаторы: эти индикаторы изменяют цвет в зависимости от концентрации металла, образующего комплекс с индикатором. Например, этилендиаминтетрауксусная кислота (EDTA) может использоваться в качестве индикатора, который образует комплекс с металлом и меняет цвет, когда металл исчезает из раствора.
- pH-индикаторы: эти индикаторы меняют цвет в зависимости от pH-значения раствора. Например, универсальный индикатор содержит несколько индикаторов, которые меняют цвет в зависимости от конкретного pH-значения раствора.
- Индикаторы окраски: эти индикаторы используются для определения наличия или отсутствия вещества, которое может быть определено по цвету. Например, Фенилгидразин используется в качестве индикатора для определения наличия альдегидов и кетонов, которые окрашиваются в желтый цвет.
В зависимости от требуемой точности и специфичности, в окислительно-восстановительных методах могут использоваться различные типы индикаторов.
Одним из наиболее распространенных классификаций индикаторов является классификация по принципу действия. В этой классификации индикаторы делятся на несколько категорий в зависимости от того, каким образом они реагируют на изменения pH, температуры или других параметров, которые характеризуют окислительно-восстановительный процесс.
Одной из главных категорий индикаторов являются кислотно-основные индикаторы. Они реагируют на изменения pH раствора и меняют свой цвет в зависимости от того, находится ли раствор в кислой, щелочной или нейтральной среде. К кислотно-основным индикаторам относятся такие вещества, как фенолфталеин, метилоранж, лакмус и многие другие.
Еще одной категорией индикаторов являются окислительно-восстановительные индикаторы. Они реагируют на изменения окислительно-восстановительного потенциала раствора и меняют свой цвет в зависимости от того, присутствует ли в растворе окислитель или восстановитель. К окислительно-восстановительным индикаторам относятся, например, перманганат калия и дихромат калия.
Термохромные индикаторы — это индикаторы, которые реагируют на изменение температуры раствора и меняют свой цвет в зависимости от того, какой температуре он был подвержен. К таким индикаторам относятся, например, растворы фенолового типа, которые могут менять цвет от желтого до красного или обратно при изменении температуры.
Другой категорией индикаторов являются флуоресцентные индикаторы. Они реагируют на изменения pH и меняют свой спектральный состав, что приводит к изменению цвета или яркости свечения. К таким индикаторам относятся, например, флуоресцеин и родамин.
Классификация индикаторов по принципу действия важна для понимания принципов работы каждого индикатора и выбора подходящего индикатора для конкретной задачи. Они классифицируются по принципу действия и имеют различные преимущества и недостатки в зависимости от используемой реакции и требуемой точности измерения.
Глава 2. Экспериментальная часть
2.1. Реактивы и приборы
Для проведения эксперимента по определению концентрации вещества с помощью индикатора в окислительно-восстановительном методе необходимы следующие реактивы и приборы:
- Вещество, концентрацию которого нужно определить
- Окислитель и восстановитель, соответствующие выбранному методу
- Индикатор, подходящий для данной реакции
- Дистиллированная вода
- Штатив и мерный колба для приготовления растворов
- Флакончик для хранения индикатора
- Пипетки для измерения объема растворов
- Бюретка для точного измерения объема реактивов
- Конические колбы для приготовления растворов окислителя и восстановителя
- Штатив для фиксации колб с реактивами
- Термостат для поддержания постоянной температуры реакционной смеси
- Фотометр или спектрофотометр для измерения оптической плотности индикатора
- Компьютер с программным обеспечением для обработки данных и расчета концентрации вещества.
Перед началом эксперимента необходимо тщательно изучить инструкции по использованию реактивов и приборов, а также соблюдать все меры предосторожности при работе с химическими веществами.
Инструкции по проведению эксперимента:
- Подготовить стандартное раствор EDTA путем растворения 0,937 г EDTA в 1 л дистиллированной воде. Растворить 2 г NH4Cl и 7 г NH4OH в 50 мл дистиллированной воды и добавить это к раствору EDTA. Добавить дистиллированную воду до объема 1 л.
- Подготовить раствор индикатора Морина путем растворения 0,1 г Морина в 100 мл этилового спирта.
- Подготовить образцы с различными концентрациями ионов Ca2+. Для этого разбавить стандартный раствор CaCl2 различными объемами дистиллированной воды, чтобы получить растворы с концентрациями 0,01 М, 0,02 М, 0,03 М, 0,04 М и 0,05 М.
- Перенести по 25 мл каждого раствора Ca2+ в пяти различных пробирках.
- Добавить в каждую пробирку по 5 мл раствора EDTA и 5 мл дистиллированной воды.
- Добавить в каждую пробирку по 1 мл раствора индикатора Морина.
- Перемешать содержимое каждой пробирки и оставить на 5 минут для полной реакции.
- Измерить поглощение растворов при длине волны 590 нм с помощью спектрофотометра.
- Построить график зависимости поглощения от концентрации Ca2+.
- Рассчитать точку эквивалентности и определить концентрацию Ca2+ в неизвестном образце.
- Рассчитать ошибку индикатора с помощью формулы неопределенности.
Примечание: Эксперимент необходимо проводить с использованием перчаток и защитных очков в соответствии с правилами безопасности в лаборатории.
При применении индикаторов в окислительно-восстановительном методе могут использоваться различные реактивы и приборы в зависимости от конкретной задачи. Однако, некоторые из наиболее распространенных реактивов и приборов в этом методе включают в себя:
- Различные окислители и восстановители, такие как серная кислота, калий перманганат, калий дихромат, йодид калия, гидроксид натрия, натрий тиосульфат и др.
- Индикаторы, такие как крахмал, фенолфталеин, бромтимоловый синий, метиловый оранжевый, бромкрезол зеленый и др.
2.2. Особенности применения индикаторов в различных типах реакций (кислородно-восстановительные, кислородно-окислительные)
Индикаторы широко используются в окислительно-восстановительных реакциях, которые могут быть разделены на два основных типа: кислородно-восстановительные и кислородно-окислительные.
В кислородно-восстановительных реакциях индикаторы используются для определения концентрации окислителя или восстановителя. Например, индикатор перманганата калия используется для определения концентрации железа в растворе путем окисления железа (II) до железа (III) и последующей реакции с избытком перманганата калия, который изменяет свой цвет с фиолетового на бесцветный. Концентрация железа (II) может быть определена по количеству перманганата калия, которое было использовано для его окисления.
В кислородно-окислительных реакциях индикаторы используются для определения концентрации окислителя или восстановителя. Например, индикатор йодида калия используется для определения концентрации хлора в растворе путем реакции с йодидом калия, который окисляется до йода. Концентрация хлора может быть определена по количеству йода, которое было образовано.
Однако не все реакции могут использовать индикаторы. Например, некоторые реакции могут быть очень быстрыми или иметь низкую чувствительность к индикаторам, что делает их непригодными для использования в таких реакциях. В таких случаях может потребоваться использование более чувствительных методов анализа, таких как спектрофотометрия или хроматография.
Кроме того, есть индикаторы, которые используются только в определенных типах реакций. Например, в кислородно-восстановительных реакциях для определения концентрации перекиси водорода (H2O2) используется индикатор калия йодида (KI), который окисляется перекисью водорода до йодида (I-), а затем этот йодид можно титровать раствором натрия тиосульфата (Na2S2O3) с использованием крахмала в качестве индикатора. В кислородно-окислительных реакциях, например, в титрации перманганатом калия (KMnO4), используется индикатор оксаловой кислоты, который реагирует с избытком перманганата калия и меняет свой цвет.
Также стоит упомянуть о применении индикаторов в реакциях окисления-восстановления в аналитической химии, например, в методе Каппера для определения содержания глюкозы в моче. В этом методе глюкоза восстанавливает медь (II) до меди (I), при этом образуется окисленная форма глюкозы – глюконовая кислота. Индикатором в данном случае выступает раствор фенолфталеина, который при изменении рН раствора меняет свой цвет и позволяет точно определить конечную точку титрования.
Таким образом, выбор индикатора для конкретной реакции зависит от ее типа и характеристик веществ, участвующих в реакции. Он также может быть связан с особенностями проведения титрования и требованиями к точности результата.
Другой тип реакций, в которых широко используются индикаторы, — это кислородно-окислительные реакции, такие как процессы сжигания и окисления. В этих реакциях индикаторы используются для определения концентрации кислорода или других окислителей. Одним из таких индикаторов является крахмал-йодный индикатор, который используется для определения наличия кислорода в газовых смесях, например, в атмосферном воздухе или в дыхательном газе.
Кроме того, индикаторы могут использоваться и в других типах реакций, например, в реакциях нейтрализации или в реакциях превращения аминокислот. В реакциях нейтрализации индикаторы используются для определения конечной точки реакции, т.е. момента, когда все кислоты или основания были нейтрализованы. Для этого можно использовать, например, фенолфталеин, который при изменении pH меняет цвет с безцветного на розовый.
2.3. Примеры применения индикаторов в различных областях (анализ воды, фармакология, пищевая промышленность и др.)
Индикаторы имеют широкое применение в различных областях, где требуется определение концентрации вещества в растворе. Ниже приведены несколько примеров использования индикаторов в различных областях.
- Анализ воды: Индикаторы используются для определения концентрации различных химических веществ в воде, таких как хлор, фториды, сульфаты, нитраты и другие. Например, индикатор DPD (диэтилпарафенилендиамин) используется для определения концентрации хлора в воде для питья.
- Фармакология: Индикаторы используются для определения концентрации лекарственных веществ в крови. Например, индикатор фенилгликолида используется для определения концентрации лития в крови пациента при лечении биполярного расстройства.
- Пищевая промышленность: Индикаторы используются для определения концентрации различных веществ в пищевых продуктах. Например, индикатор бромтирометан используется для определения содержания жира в молочных продуктах.
- Химическая промышленность: Индикаторы используются для контроля за процессами химического синтеза и очистки продуктов. Например, индикатор фенольфталеин используется для определения конечной точки нейтрализации кислоты или щелочи в химических реакциях.
- Экология: Индикаторы используются для оценки загрязнения окружающей среды. Например, индикатор DHBA (дигидроксибензойная кислота) используется для определения концентрации тяжелых металлов в почве и воде.
Таким образом, индикаторы являются важным инструментом для определения концентрации различных веществ в растворе и имеют широкое применение в различных областях науки и промышленности.
Индикаторы находят широкое применение в различных областях науки и промышленности. Например, в области анализа воды они используются для определения концентрации растворенных веществ, таких как кислород, хлор, аммиак и других. В фармакологии индикаторы используются для определения pH растворов, что позволяет контролировать стабильность и эффективность лекарственных препаратов.
В пищевой промышленности индикаторы используются для контроля качества и безопасности пищевых продуктов. Например, многие индикаторы используются для определения концентрации кислот и щелочей в продуктах питания, что позволяет контролировать кислотность, свежесть и безопасность продуктов.
Также индикаторы используются в других областях, таких как геология, медицина, биология, экология и др. В геологии они могут использоваться для изучения свойств пород, определения pH грунта и т.д. В медицине они могут использоваться для контроля pH крови и других жидкостей в организме. В экологии они могут использоваться для контроля качества воды и определения концентрации загрязняющих веществ в окружающей среде.
Таким образом, индикаторы являются важным инструментом в различных областях науки и промышленности, позволяя определять концентрацию веществ, контролировать pH и качество продуктов, а также изучать свойства материалов и окружающей среды.
Кроме того, в пищевой промышленности индикаторы могут использоваться для определения содержания различных компонентов в пищевых продуктах, таких как содержание жиров, белков, углеводов и других веществ. Например, для определения содержания жиров в продуктах используют индикаторы на основе щелочных металлов, которые реагируют с жирами и образуют мыльные соли. Затем, измеряя количество образовавшихся мыльных солей, можно определить содержание жиров в продукте.
В фармакологии индикаторы широко применяются для анализа состава и концентрации лекарственных препаратов.
Глава 3. Обсуждение результатов
Индикаторы в окислительно-восстановительном методе используются для определения конечной точки реакции. Конечная точка является моментом, когда вещество, подвергающееся окислению или восстановлению, полностью перешло в другое состояние.
Индикаторы могут быть добавлены к образцу в качестве реактивов или использоваться в виде внешних индикаторов. Внешние индикаторы добавляются к образцу и обеспечивают изменение цвета, что позволяет наблюдать за процессом реакции. Внутренние индикаторы, с другой стороны, являются частью образца и изменяют свой цвет, когда реакция достигает конечной точки.
Примером внешнего индикатора является фенилгликолевая кислота, которая используется в титровании перманганата калия с оксалатом натрия. При добавлении фенилгликолевой кислоты к раствору, начальный цвет раствора становится желтым. При постепенном добавлении перманганата калия цвет раствора становится розовым, а затем фиолетовым. Конечная точка достигается, когда цвет раствора становится почти безцветным.
Примером внутреннего индикатора является крахмал, который используется для титрования йода с тиосульфатом натрия. При добавлении йода к раствору, содержащему тиосульфат натрия и крахмал, раствор становится голубым. Конечная точка достигается, когда весь йод был потребован тиосульфатом натрия, и раствор вновь становится безцветным.
Индикаторы также могут использоваться для контроля качества и мониторинга процессов. Например, изменение цвета индикатора может указывать на изменение концентрации определенного компонента в реакционной системе. Это может быть полезно для определения, когда нужно добавлять реагенты или изменять условия реакции.
Помимо выбора правильного индикатора, важным аспектом является правильная подготовка растворов и образцов, а также выполнение точных и повторяемых измерений. Кроме того, необходимо учитывать возможные ошибки в работе с индикаторами и производить расчеты для определения точности и достоверности полученных результатов.
Индикаторы являются неотъемлемой частью окислительно-восстановительного метода и широко применяются в различных областях, таких как анализ воды, почвы, пищевых продуктов, медицинских препаратов и многих других. Правильный выбор и применение индикаторов позволяет получить точные и надежные результаты, что в свою очередь способствует улучшению качества и безопасности продукции.
Таким образом, использование индикаторов в окислительно-восстановительном методе имеет большое значение для получения точных и надежных результатов анализа, что является особенно важным в области контроля качества и безопасности продукции.
Расчет концентрации вещества в окислительно-восстановительном методе с использованием индикаторов осуществляется путем определения количества добавленного реагента до появления цвета индикатора. Для этого необходимо провести следующие расчеты.
Предположим, что мы хотим определить концентрацию железа(II) в образце с помощью окислительно-восстановительного метода, используя индикатор перманганата калия (KMnO4). Для этого мы добавляем раствор KMnO4 к образцу, пока цвет индикатора не изменится. Нам необходимо знать объем раствора KMnO4, который был добавлен до появления цвета индикатора, а также его концентрацию.
Пусть V1 — объем образца, мл; С1 — концентрация железа(II) в образце, мг/л; V2 — объем раствора KMnO4, мл; С2 — концентрация раствора KMnO4, моль/л.
Тогда количество вещества железа(II), присутствующее в образце, можно вычислить по формуле:
n(Fe2+) = С1 x V1 x 10^-3
Количество вещества KMnO4, добавленного к образцу, можно вычислить по формуле:
n(KMnO4) = С2 x V2 x 10^-3
Поскольку в соответствии с уравнением реакции KMnO4 и железа(II) молярное соотношение равно 1:5, то количество вещества железа(II), соответствующее добавленному количеству KMnO4, равно:
n(Fe2+) = 5 x n(KMnO4)
Используя эти формулы, мы можем вычислить концентрацию железа(II) в образце:
С1 = 5 x С2 x V2 x 10^-3 / V1
Таким образом, зная объем раствора KMnO4, который был добавлен до появления цвета индикатора, а также его концентрацию, мы можем определить концентрацию железа(II) в образце с использованием индикатора перманганата калия.
Для расчета концентрации вещества с использованием индикатора необходимо выполнить несколько шагов. Сначала необходимо провести титрование, добавляя титрант к раствору с анализируемым веществом до тех пор, пока не произойдет изменение цвета индикатора. Затем следует определить точку эквивалентности, что можно сделать путем анализа изменений цвета раствора и индикатора.
Далее, используя объем титранта, необходимый для достижения точки эквивалентности, и известную концентрацию титранта, можно рассчитать количество моль титранта, необходимого для нейтрализации анализируемого вещества. Затем можно рассчитать концентрацию анализируемого вещества, используя уравнение реакции и известное количество моль титранта.
Для более точного расчета концентрации вещества с использованием индикатора необходимо также учитывать погрешности, связанные с измерениями, и ошибки индикатора.
3.1. Расчет ошибки индикатора с помощью формулы неопределенности
Расчет ошибки индикатора с помощью формулы неопределенности является одним из методов оценки точности результатов анализа. Формула неопределенности выражает связь между погрешностью измерения и погрешностью определения.
Для расчета ошибки индикатора с помощью формулы неопределенности необходимо знать следующие величины:
- Предел точности индикатора (ПТИ) – минимальное изменение концентрации анализируемого вещества, которое может быть обнаружено индикатором с определенной вероятностью.
- Предел обнаружения индикатора (ПОИ) – минимальное количество индикатора, которое можно обнаружить с определенной вероятностью.
- Коэффициент вариации (КВ) – отношение среднеквадратического отклонения (СКО) к среднему значению (среднее арифметическое) результатов измерений.
Формула неопределенности имеет следующий вид:
δх = ± tкр ⋅ σх,
где δх – погрешность измерения; tкр – коэффициент Стьюдента для заданной доверительной вероятности и числа степеней свободы; σх – среднеквадратическое отклонение; х – измеренное значение.
Погрешность измерения δх может быть выражена через ПТИ и ПОИ следующим образом:
δх = ± (ПТИ / К) + ПОИ,
где К – коэффициент доверия, определяемый из таблиц статистики.
Таким образом, для расчета погрешности индикатора необходимо определить ПТИ, ПОИ и КВ. Расчет погрешности проводится с использованием формулы неопределенности, которая учитывает влияние всех факторов, влияющих на точность измерения.
Формула неопределенности также известна как формула Гейзенберга и используется для оценки ошибок измерений в квантовой механике. Она также может быть применена для расчета ошибок в экспериментах, включая измерение концентрации веществ с помощью индикаторов.
Формула неопределенности имеет вид:
ΔA * ΔB ≥ h/2π
где ΔA и ΔB — неопределенности измеряемых величин, h — постоянная Планка, π — математическая константа.
Для расчета ошибки индикатора можно использовать эту формулу, принимая в качестве измеряемой величины концентрацию вещества, а в качестве второй величины — коэффициент пропорциональности между концентрацией вещества и сигналом, который регистрируется с помощью индикатора.
Например, для измерения концентрации аскорбиновой кислоты с помощью индикатора DPIP можно использовать формулу:
Δc * ΔV ≥ (h/2π) * (1/ε)
где Δc — неопределенность концентрации, ΔV — неопределенность объема, ε — коэффициент пропорциональности между концентрацией аскорбиновой кислоты и изменением оптической плотности, вызванным ее окислением, h — постоянная Планка, π — математическая константа.
Таким образом, расчет ошибок индикатора может быть выполнен с помощью формулы неопределенности, что позволяет оценить точность измерения концентрации вещества с использованием индикаторов.
Кроме формулы неопределенности, существует и другой способ расчета ошибки индикатора — метод стандартного добавления.
Метод стандартного добавления заключается в том, что к измеряемой пробе последовательно добавляют одинаковые порции раствора стандартного вещества известной концентрации. После каждого добавления раствора стандартного вещества производят определение индикатора.
3.2. Влияние факторов на ошибку индикатора (концентрация реагентов, качество индикатора, методика измерения и др.)
Ошибки индикатора могут быть вызваны различными факторами, такими как концентрация реагентов, качество индикатора, методика измерения, а также условия эксперимента.
Концентрация реагентов может оказать влияние на точность измерений, так как неправильная концентрация может привести к слишком слабой или слишком сильной реакции, что повлияет на точность измерений.
Качество индикатора также может влиять на ошибку измерения. Некачественный или старый индикатор может давать неточные результаты из-за потери своих свойств.
Методика измерения также может повлиять на точность измерений. Некоторые методы могут быть более чувствительны к ошибкам, чем другие.
Условия эксперимента, такие как температура, pH, освещение и т.д., также могут повлиять на точность измерений и, следовательно, на ошибку индикатора.
Для уменьшения ошибки индикатора необходимо тщательно подобрать метод измерения и концентрацию реагентов, использовать качественный индикатор и контролировать условия эксперимента. Также можно проводить повторные измерения и использовать методы статистического анализа для уменьшения ошибки.
Факторы, которые могут влиять на ошибку индикатора, включают:
- Концентрация реагентов: Ошибки могут возникать из-за неодинаковой концентрации реагентов в разных образцах. При измерении концентрации с помощью индикаторов необходимо убедиться, что концентрация реагентов одинакова для всех образцов.
- Качество индикатора: Качество индикатора может варьироваться от производителя к производителю и может сильно влиять на точность измерений. Необходимо использовать качественный и проверенный индикатор.
- Методика измерения: Некоторые методы измерения, такие как спектрофотометрия, требуют точной настройки прибора и обученного персонала, чтобы гарантировать точность измерения. Также важно следовать протоколу измерения и не допускать ошибок при подготовке образцов.
- Воздействие окружающей среды: Некоторые условия, такие как температура и освещение, могут влиять на результаты измерений. При использовании индикаторов необходимо контролировать окружающую среду и убедиться, что она не влияет на результаты измерений.
- Другие факторы: Ошибки также могут возникать из-за ошибок при подготовке образцов, изменений в pH и других условиях эксперимента. Необходимо учитывать все возможные факторы, которые могут влиять на результаты измерений, и контролировать их в процессе эксперимента.
Понимание этих факторов и контроль за ними могут помочь уменьшить ошибки измерений при использовании индикаторов.
Концентрация реагентов может оказывать влияние на ошибку индикатора. Например, если концентрация реагента слишком мала, то это может привести к тому, что ошибки измерения будут недостаточно точными. С другой стороны, если концентрация реагента слишком велика, то это может привести к насыщению индикатора и, как следствие, к погрешности измерения.
Качество индикатора также важно для точности измерения. Низкое качество индикатора может привести к погрешности в результате измерения. Качество индикатора может быть оценено на основе его показателя чистоты, свойств и способности к обнаружению изменений в реакции.
Методика измерения также может оказывать влияние на ошибку индикатора. Например, использование различных типов оборудования и методов измерения может привести к различным значениям ошибки. Поэтому важно следовать определенной методике измерения и использовать одинаковые условия для всех измерений. Поэтому необходимо контролировать эти факторы при измерении концентрации вещества с использованием индикаторов.
Заключение
В заключении стоит отметить, что развитие новых методов и технологий в химическом анализе продолжается, и это позволяет использовать все более точные индикаторы и методики измерений. Однако, необходимо учитывать, что важную роль играет не только совершенствование самих инструментов, но и профессиональный подход и опыт химиков, анализирующих данные.
В современном мире, где промышленность, наука и технологии играют ключевую роль, точность и надежность результатов анализа становятся все более важными. Индикаторы, применяемые в окислительно-восстановительном методе, являются важной составляющей в химическом анализе и позволяют достигать высокой точности результатов.
Таким образом, использование индикаторов и правильный расчет их ошибок являются важными составляющими в химическом анализе и играют ключевую роль в достижении точности и надежности результатов. Важно помнить, что индикаторы должны быть выбраны в зависимости от типа реакции и требуемой точности измерения, а расчет ошибок индикатора является необходимой составляющей для получения более точных результатов.
Индикаторы играют важную роль в химическом анализе и, особенно, в окислительно-восстановительном методе. Они позволяют определить момент достижения точки эквивалентности и тем самым установить конечный результат реакции. Однако, при использовании индикаторов возможны ошибки, которые могут привести к неточным результатам.
В данной работе были представлены основные типы индикаторов, применяемых в окислительно-восстановительном методе, и способы расчета ошибок индикатора. Было показано, что ошибки могут возникать по различным причинам, но с помощью правильного подбора индикатора, контроля качества, правильной методики измерения и коррекции ошибок можно достичь более точных результатов. Таким образом, правильный выбор и использование индикаторов в окислительно-восстановительном методе имеет большое значение для получения точных результатов..
Список использованной литературы
- Грушинский, С. В. (2010). Количественный анализ: учебник для вузов. Химия.
- Колесников, Г. А., & Желтоводский, А. А. (2013). Химический анализ. Учебник. Феникс.
- Скочеляс, И. М., Кокозей, В. Н., & Червонная, Т. А. (2010). Аналитическая химия. Кн. 1. Химия.
- Стоянов, А. В., & Горбачева, Т. А. (2014). Аналитическая химия: учебник для вузов. Лань.
- Таланов, В. С. (2010). Аналитическая химия: методические указания для студентов химического факультета. Изд-во СПбГУ.
- Фролов, А. В., & Макаров, А. А. (2007). Аналитическая химия. Учебное пособие для вузов. Высшая школа.
- Шилов, Г. В. (2015). Аналитическая химия: Учебник для студентов вузов по специальности «Химия». КНОРУС.
- Яценко, Л. А. (2014). Аналитическая химия: Учебное пособие. М.: Лаборатория знаний.
- Горбачева, Т. А. (2018). Курс аналитической химии. Часть 1: Аналитическая химия общего назначения. М.: КноРус.
- Копылов, А. С. (2016). Аналитическая химия: Учебное пособие. М.: Издательство Юрайт.
- Максименко, В. Г. (2008). Количественный анализ: учебное пособие для студентов высших учебных заведений. М.: ЮНИТИ-ДАНА.
- Костюк, В. А. (2018). Аналитическая химия. Учебное пособие. М.: Дашков
- Пискарёва С. К. и др. Аналитическая химия. — Издание 2-е. — М.: Высшая школа, 1994. — С. 296—297. — ISBN 5-06-002179-3.
- Аналитическая химия. Химические методы анализа / Под ред. О. М. Петрухина. — М.: Химия, 1992. — С. 289—290. — ISBN 5-7245-0640-8.
- Жаровський Ф. Г., Пилипенко А. Т., П’ятницький І. В. Аналітична хімія. — 2-е. — К.: Вища школа, 1982. — С. 429—431.
- Бишоп, Э. Индикаторы / Пер. с англ. Под ред. И. Н. Марова. — М.: Мир, 1976. — Т. 2. — С. 146—162.
- Васильев В. П. Аналитическая химия. Часть 1. Гравиметрический и титриметрический методы анализа. — М.: Высшая школа, 1989. — 320 с. — 40 000 экз. — ISBN 5-06-000066-4.
- В.В. Болотов, А. Н. Гайдукевич, Е. Н. Свечникова и др. Аналитическая химия. — Харьков: Издательство НФАУ, 2001. — 455 с. — 2500 экз. — ISBN 966-615-079-4.
- Кольтгоф И. М. Объемный анализ / И. М. Кольтгоф. – М.: Госхимиздат, 1961. – Т. 3.
- Крешков А. П. Основы аналитической химии : в 3 кн. /А. П. Крешков. – М. : Химия, 1977.
