Сайт издательства «Медиа Сфера»
содержит материалы, предназначенные исключительно для работников здравоохранения. Закрывая это сообщение, Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
ФГБОУ ВО «Санкт-Петербургский государственный университет»;
СПБ ГБУЗ «Психиатрическая больница №1 им. П.П. Кащенко»
Петрова Н.Н.
ФГБОУ ВО «Санкт-Петербургский государственный университет»
Лиманкин О.В.
СПБ ГБУЗ «Психиатрическая больница №1 им. П.П. Кащенко»;
ФГБУ ДПО «Санкт-Петербургский институт усовершенствования врачей-экспертов» Минтруда России;
ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России
Ашенбреннер Ю.В.
ФГБОУ ВО «Санкт-Петербургский государственный университет»;
СПБ ГБУЗ «Психиатрическая больница №1 им. П.П. Кащенко»

Когнитивные нарушения у пациентов с биполярным аффективным расстройством в ремиссии
Авторы:
Чумаков Е.М., Петрова Н.Н., Лиманкин О.В., Ашенбреннер Ю.В.
Журнал:
Журнал неврологии и психиатрии им. С.С. Корсакова. 2021;121(4): 12‑18
Как цитировать:
Чумаков Е.М., Петрова Н.Н., Лиманкин О.В., Ашенбреннер Ю.В.
Когнитивные нарушения у пациентов с биполярным аффективным расстройством в ремиссии. Журнал неврологии и психиатрии им. С.С. Корсакова.
2021;121(4):12‑18.
Chumakov EM, Petrova NN, Limankin OV, Ashenbrenner YuV. Cognitive impairment in remitted patients with bipolar disorder. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2021;121(4):12‑18. (In Russ.).
https://doi.org/10.17116/jnevro202112104112

?>
Читать метаданные
ЦЕЛЬ ИССЛЕДОВАНИЯ
Определение частоты, структуры и выраженности когнитивных нарушений у пациентов с биполярным аффективным расстройством (БАР) в ремиссии.
МАТЕРИАЛ И МЕТОДЫ
Обследованы 85 пациентов с БАР I типа (n=64) и II типа (n=21) в ремиссии (средний возраст 36,6±5,7 года). Выраженность психопатологической симптоматики оценивалась с помощью шкалы депрессии Гамильтона (HDRS) и шкалы мании Янга (YMRS), когнитивные нарушения — с использованием методики Краткого нейропсихологического обследования когнитивной сферы (КНОКС).
РЕЗУЛЬТАТЫ И ЗАКЛЮЧЕНИЕ
Когнитивные нарушения выявлены у 43,5% обследованных пациентов. Частота и структура когнитивных нарушений при БАР I типа и II типа в ремиссии не различались. Обследованные пациенты с когнитивными нарушениями характеризовались снижением скорости психических процессов, снижением рабочей памяти и нарушениями внимания. Выявлена ассоциированность общего балла КНОКС с возрастом пациентов, длительностью заболевания, общими баллами HDRS и YMRS. Результаты исследования свидетельствуют в пользу аффективной природы когнитивного дефицита у обследованных пациентов. Когнитивные нарушения у пациентов с БАР в ремиссии являются значимой терапевтической мишенью.
Авторы:
Чумаков Е.М.
ФГБОУ ВО «Санкт-Петербургский государственный университет»;
СПБ ГБУЗ «Психиатрическая больница №1 им. П.П. Кащенко»
Петрова Н.Н.
ФГБОУ ВО «Санкт-Петербургский государственный университет»
Лиманкин О.В.
СПБ ГБУЗ «Психиатрическая больница №1 им. П.П. Кащенко»;
ФГБУ ДПО «Санкт-Петербургский институт усовершенствования врачей-экспертов» Минтруда России;
ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России
Ашенбреннер Ю.В.
ФГБОУ ВО «Санкт-Петербургский государственный университет»;
СПБ ГБУЗ «Психиатрическая больница №1 им. П.П. Кащенко»
Дата поступления:
25.06.2020
Дата принятия в печать:
13.07.2020
Список литературы:
- Pini S, de Queiroz V, Pagnin D, et al. Prevalence and burden of bipolar disorders in European countries. Eur Neuropsychopharmacol. 2005;15:425–434. https://doi.org/10.1016/j.euroneuro.2005.04.011
- Weinstock LM, Strong D, Uebelacker LA, Miller IW. DSM-IV depressive symptom expression among individuals with a history of hypomania: a comparison to those with or without a history of mania. J Psychiatr Res. 2010;44(14):979–985. https://doi.org/10.1016/j.jpsychires.2010.03.010
- Gitlin MJ, Miklowitz DJ. The difficult lives of individuals with bipolar disorder: a review of functional outcomes and their implications for treatment. J Affect Disord. 2017;209:147–154. https://doi.org/10.1016/j.jad.2016.11.021
- Rosenblat JD, Simon GE, Sachs GS, et al. Treatment effectiveness and tolerability outcomes that are most important to individuals with bipolar and unipolar depression. J Affect Disord. 2019;243:116–120. https://doi.org/10.1016/j.jad.2018.09.027
- Rocha P, Correa H. The impact of clinical comorbidities and residual depressive symptoms in sleep quality in euthymic/interepisodic bipolar subjects. Psychiatry Res. 2018;268:165–168. https://doi.org/10.1016/j.psychres.2018.07.002
- Martínez-Arán A, Vieta E. Cognition as a target in schizophrenia, bipolar disorder and depression. Eur Neuropsychopharmacol. 2015;25(2):151–157. https://doi.org/10.1016/j.euroneuro.2015.01.007
- Miller S, Dell’Osso B, Ketter TA. The prevalence and burden of bipolar depression. J Affect Disord. 2014;169(Suppl 1):3–11. https://doi.org/10.1016/s0165-0327(14)70003-5
- Петрова Н.Н., Ашенбреннер Ю.В. Биполярное аффективное расстройство первого типа и психосоциальное функционирование больных. Социальная и клиническая психиатрия. 2018;28(1):10–14.
- Fagiolini A, Kupfer DJ, Masalehdan A, et al. Functional impairment in the remission phase of bipolar disorder. Bipolar Disord. 2015;7(3):281–285. https://doi.org/10.1111/j.1399-5618.2005.00207.x
- Volkert J, Schiele MA, Kazmaier J, et al. Cognitive deficits in bipolar disorder: From acute episode to remission. Eur Arch Psychiatry Clin Neurosci. 2016;266(3):225–237. https://doi.org/10.1007/s00406-015-0657-2
- Смулевич А.Б., Андрющенко А.В., Романов Д.В., Захарова Н.В. Ремиссии при аффективных заболеваниях: эпидемиология, психопатология, клинический и социальный прогноз, вторичная профилактика. Журнал неврологии и психиатрии им. С.С. Корсакова. 2014;114(3):4–13.
- Ашенбреннер Ю.В., Чумаков Е.М., Петрова Н.Н. Резидуальные симптомы и социальное функционирование у пациентов с биполярным аффективным расстройством в ремиссии. Неврологический вестник. 2019;51(2):66–71. https://doi.org/10.17816/nb15665
- Конорева А.Е., Мосолов С.Н. Когнитивные нарушения при биполярном аффективном расстройстве. Современная терапия психических расстройств. 2017;(4):11–18. https://doi.org/10.21265/PSYPH.2017.43.8416
- Solé B, Jimenez E, Torrent C, et al. Cognitive Impairment in Bipolar Disorder: Treatment and Prevention Strategies. Int J Neuropsychopharmacol. 2017;20(8):670–680. https://doi.org/10.1093/ijnp/pyx032
- Engel J. Visions for novel biophysical elucidations of extracellular matrix networks. Int J Biochem Cell Biol. 2007;39(2):311–318. https://doi.org/10.1016/j.biocel.2006.08.003
- Rosa AR, Bonnin CM, Vazquez GH, et al. Functional impairment in bipolar II disorder: Is it as disabling as bipolar I? J Affect Disord. 2010;127(1–3):71–6. https://doi.org/10.1016/j.jad.2010.05.014
- Toyoshima K, Kako Y, Toyomaki A, et al. Associations between cognitive impairment and quality of life in euthymic bipolar patients. Psychiatry Res. 2019;271:510–515. https://doi.org/10.1016/j.psychres.2018.11.061
- Veeh J, Kopf J, Kittel-Schneider S, et al. Cognitive re mediation for bipolar patients with objective cognitive impairment: a naturalistic study. Int J Bipolar Disord. 2017;5(1):8. https://doi.org/10.1186/s40345-017-0079-3
- Daglas R, Yucel M, Cotton S, et al. Cognitive impairment in first-episode mania: a systematic review of the evidence in the acute and remission phases of the illness. Int J Bipolar Disord. 2015;3:9. https://doi.org/10.1186/s40345-015-0024-2
- Samalin L, Bellivier F, Giordana B, et al. Patients’ Perspectives on Residual Symptoms in Bipolar Disorder: A Focus Group Study. J Nerv Ment Dis. 2014;202(7):550–555. https://doi.org/10.1097/nmd.0000000000000157
- Roux P, Raust A, Cannavo A-S, et al. Associations between residual depressive symptoms, cognition, and functioning in patients with euthymic bipolar disorder: results from the FACE-BD cohort. Br J Psychiatry. 2017;211(6):381–387. https://doi.org/10.1192/bjp.bp.117.201335
- Post F, Pardeller S, Frajo-Apor B, et al. Quality of life in stabilized outpatients with bipolar I disorder: Associations with resilience, internalized stigma, and residual symptoms. J Affect Disord. 2018;238:399–404. https://doi.org/10.1016/j.jad.2018.05.055
- Cipriani G, Danti S, Carlesi C, et al. Bipolar Disorder and Cognitive Dysfunction: A Complex Link. J Nerv Ment Dis. 2017;205(10):743–756. https://doi.org/10.1097/nmd.0000000000000720
- Martínez-Arán A, Vieta E, Colom F, et al. Cognitive impairment in euthymic bipolar patients: implications for clinical and functional outcome. Bipolar Disord. 2004;6(3):224–232. https://doi.org/10.1111/j.1399-5618.2004.00111.x
- Goodwin GM, Martinez-Aran A, Glahn DC, Vieta E. Cognitive Impairment in Bipolar Disorder: Neurodevelopment or Neurodegeneration? An ECNP expert meeting report. Eur Neuropsychopharmacol. 2008;18(11):787–793. https://doi.org/10.1016/j.euroneuro.2008.07.005
- Riedel P, Smolka MN, Bauer M. Schizophrenia and bipolar disorder: Treatment of cognitive impairments. Nervenarzt. 2018;89(7):784–795. https://doi.org/10.1007/s00115-018-0500-x
- Hamilton M. A rating scale for depression. J Neurol Neurosurg Psychiatry. 1960;23(1):56–62. https://doi.org/10.1136/jnnp.23.1.56
- Young RC, Biggs JT, Ziegler VE, Meyer DA. A rating scale for mania: reliability, validity and sensitivity. Br J Psychiatry. 1978;133(5):429–435. https://doi.org/10.1192/bjp.133.5.429
- Тонконогий И.М.; Микадзе Ю.В., ред. Краткое нейропсихологическое обследование когнитивной сферы (КНОКС). М.; 2010.
- Chumakov EM. Cognitive impairment and mental disorders in HIV-infected patients with early stages of syphilis. Vestnik Sankt-Peterburgskogo universiteta. Seriya 11. Meditsina. 2017;12(3):273–277. https://doi.org/10.21638/11701/spbu11.2017.307
- Нийноя И.В., Романов Д.В., Махмудова Г.Ж., Нодель М.Р. Депрессия при болезни Паркинсона: аспекты психопатологической структуры и нозологической квалификации. Психиатрия. 2019;17(4):38–48. https://doi.org/10.30629/2618-6667-2019-17-4-38-48
- Мосолов С.Н., Ушкалова А.В., Костюкова Е.Г., и др. Валидизация российской версии опросника HCL-32 для выявления пациентов с биполярным аффективным расстройством II типа среди больных, наблюдающихся с диагнозом рекуррентного депрессивного расстройства. Социальная и клиническая психиатрия. 2015;25(1):22–30.
- Szmulewicz AG, Valerio MP, Smith JM, et al. Neuropsychological Profiles of Major Depressive Disorder and Bipolar Disorder During Euthymia. A Systematic Literature Review of Comparative Studies. Psychiatry Res. 2017;248:127–133. https://doi.org/10.1016/j.psychres.2016.12.031
- Xu G, Lin K, Rao D, et al. Neuropsychological performance in bipolar I, bipolar II and unipolar depression patients: a longitudinal, naturalistic study. J Affect Disord. 2012;136(3):328–339. https://doi.org/10.1016/j.jad.2011.11.029
- Kurtz MM, Gerraty RT. A meta-analytic investigation of neurocognitive deficits in bipolar illness: profile and effects of clinical state. Neuropsychology. 2009;23(5):551–562. https://doi.org/10.1037/a0016277
- Вассерман Л.И., Березенцева М.С., Ершов Б.Б., Щелкунова Л.А. Нейропсихологическая оценка когнитивных нарушений у пациентов с эндогенными депрессивными расстройствами. Вестник Южно-Уральского государственного университета. Серия: Психология. 2012;(31):92–96.
- Glahn DC, Almasy L, Barguil M, et al. Neurocognitive endophenotypes for bipolar disorder identified in multiplex multigenerational families. Arch Gen Psychiatry. 2010;67(2):168–177. https://doi.org/10.1001/archgenpsychiatry.2009.184
- Balanza-Martinez V, Rubio C, Selva-Vera G, et al. Neurocognitive endophenotypes (endophenocognitypes) from studies of relatives of bipolar disorder subjects: a systematic review. Neurosci Biobehav Rev. 2008;32(8):1426–1438. https://doi.org/10.1016/j.neubiorev.2008.05.019
- Goldberg JF, Harrow M. Consistency of remission and outcome in bipolar and unipolar mood disorders: a 10-year prospective follow up. J Affect Disord. 2004;81(2):123–131. https://doi.org/10.1016/s0165-0327(03)00161-7
- Bonnin CM, Sanchez-Moreno J, Martinez-Aran A, et al. Subthreshold symptoms in bipolar disorder: Impact on neurocognition, quality of life and disability. J Affect Disord. 2012;136(3):650–659. https://doi.org/10.1016/j.jad.2011.10.012
- Kuppili PP, Menon V, Chandrasekaran V, Navin K. Biological Rhythm Impairment in Bipolar Disorder: A State or Trait Marker? Indian J Psychiatry. 2018;60(4):404–409. https://doi.org/10.4103/psychiatry.indianjpsychiatry_110_18
- Konstantakopoulos G, Ioannidi N, Typaldou M, et al. Clinical and cognitive factors affecting psychosocial functioning in remitted patients with bipolar disorder. Psychiatriki. 2016;27(3):182–191. https://doi.org/10.22365/jpsych.2016.273.182
- Fuentes I, Rizo-Mendez A, Jarne-Esparcia A. Low compliance to pharmacological treatment is linked to cognitive impairment in euthymic phase of bipolar disorder. J Affect Disord. 2016;195:215–220. https://doi.org/10.1016/j.jad.2016.02.005
Биполярное аффективное расстройство (БАР), являясь одним из самых распространенных психических расстройств [1], не только негативно влияет на качество жизни [2] и приводит к снижению социального функционирования пациентов [3—6], но и ассоциируется с большим бременем затрат государства и семьи на лечение и уход [7, 8]. Снижение социального функционирования у пациентов с БАР проявляется не только в период обострения, но и во время стойкой ремиссии [9]. В числе возможных причин ухудшения социального функционирования пациентов с БАР в ремиссии рассматриваются когнитивные нарушения [10] и резидуальные симптомы [11, 12].
В последние десять лет растет интерес исследователей к вопросам диагностики и лечения когнитивных нарушений, связанных с БАР, поскольку они сохраняются в периоды ремиссии и могут значительно влиять на психосоциальное функционирование пациентов [13, 14]. Когнитивные нарушения выявляются уже в дебюте заболевания и связаны преимущественно с общим дефицитом психической активности, а их тяжесть нарастает с увеличением длительности заболевания [15]. Частота когнитивных нарушений у пациентов с БАР в ремиссии достигает 40—50% случаев, а связь когнитивных нарушений с острым эпизодом или аффективными симптомами выявляется не всегда [16]. Показано, что даже легкие когнитивные нарушения у пациентов с БАР в ремиссии могут обусловить снижение качества жизни пациентов [17]. Отмечено, что нарушения познавательных процессов у больных БАР носят неотчетливый и полиморфный характер, это определяет необходимость адекватной нейропсихологической диагностики [15]. Предполагается, что нарушения внимания, рабочей и вербальной памяти являются наиболее распространенными когнитивными нарушениями при биполярном расстройстве [18].
Продолжается дискуссия о сроках развития и характеристиках когнитивных нарушений при БАР, их зависимости от состояния больных [19]. Высказываются противоречивые мнения о том, являются ли когнитивные нарушения у больных БАР в ремиссии одним из проявлений резидуальных симптомов заболевания [20] или самостоятельным психопатологическим доменом БАР [21]. В пользу первого свидетельствуют данные о том, что наличие резидуальных симптомов депрессии негативно влияет на внимание и вербальную память, скорость психических процессов [10, 23]. При этом высказываются предположения об общем патогенезе эмоциональных и когнитивных нарушений, исходя из нейроанатомического, нейропсихологического, электрофизиологического и нейровизуализационного анализов конкретных клинических случаев [24].
С другой стороны, есть указания на то, что когнитивные нарушения при БАР являются независимыми от резидуальных симптомов факторами ухудшения профессионального функционирования пациентов в ремиссии [21, 22]. В пользу самостоятельности когнитивных нарушений свидетельствуют данные о том, что у пациентов с БАР выявляются стабильные когнитивные нарушения на всех этапах БАР, включая ремиссию, особенно в таких сферах, как внимание, память и исполнительные функции [10, 13, 23]. При этом указывается, что нейрокогнитивный дефицит, ассоциированный с БАР, не только сохраняется у пациентов в ремиссии [20, 21], но и может нарастать по мере увеличения количества перенесенных эпизодов [25]. Кроме того сообщается, что улучшение когнитивного функционирования у пациентов с БАР приводит к повышению качества жизни и уровня психосоциального функционирования в большей степени, чем успешное лечение других резидуальных симптомов [26].
Таким образом, на сегодняшний день остается открытым вопрос о месте когнитивных нарушений в структуре БАР у пациентов в ремиссии.
Цель исследования — изучение частоты, структуры и выраженности когнитивных нарушений у больных БАР в ремиссии.
Материал и методы
Исследование проводилось в амбулаторном звене психиатрической службы города Санкт-Петербурга в 2017—2019 гг. Для решения поставленных задач было обследовано 85 пациентов с БАР I типа (75%; 64 пациента) и БАР II типа (25%; 21 пациент) в ремиссии. Все обследованные пациенты получали поддерживающую терапию. Исследуемую выборку составили 29 мужчин и 56 женщин в возрасте 36,6±5,7 года. Пациенты включались в данное исследование, если их состояние соответствовало критериям ремиссии БАР по МКБ-10 (F31.7). Критериями исключения служили: наличие сопутствующего органического поражения головного мозга или другого коморбидного психического расстройства; наличие актуальной соматической патологии.
В исследовании применялся метод клинико-шкальной оценки, а также структурированное интервью. Выраженность психопатологической симптоматики оценивали с помощью шкалы депрессии Гамильтона (HDRS) [27] и шкалы мании Янга (YMRS) [28]. Когнитивные нарушения оценивали с использованием методики Краткого нейропсихологического обследования когнитивной сферы (КНОКС) [29], которая ранее показала свою эффективность для скрининга когнитивных нарушений [30], в том числе при аффективной патологии [31]. Процедура отбора включала заполнение информированного согласия на участие в исследовании.
Статистическая обработка данных проводилась с использованием стандартных методов параметрической и непараметрической статистики. За критический уровень значимости принимался p=0,05. Для описания категориальных переменных использовались абсолютные значения и доли от целого — n (%). Переменные, имеющие непрерывный характер распределения, описывались средним и стандартным отклонением (М±σ), дискретные переменные и упорядоченные данные — медианой, 1—3-м квартилями (Md [Q1; Q3]). Нормальность распределения выборки оценивалась с помощью критерия Шапиро—Уилка и учитывалась при выборе метода. Для сравнения качественных данных использовался критерий χ2 Пирсона. Для сравнения количественных данных использовали критерий Манна—Уитни. Изучение корреляционной связи между показателями проводилось с помощью линейного корреляционного анализа — критерия Пирсона. Коррекция на множественное тестирование гипотез осуществлялась при помощи поправки Беньямини—Хохберга. Статистическая обработка материала выполнялась на ПЭВМ с использованием стандартного пакета программ прикладного статистического анализа — SPSS v 15.0 и MS Excel 2016.
Результаты
Основные социально-демографические характеристики выборки представлены в табл. 1. Статистически значимые различия в характеристиках заболевания БАР, а также профессиональном статусе пациентов с БАР I и II типов выявлены не были. Несмотря на то что большинство обследованных работали, 31,2 и 23,8% пациентов с БАР I типа и БАР II типа соответственно, согласно самооценке, испытывали затруднения в выполнении трудовой нагрузки. Важно отметить, что среди пациентов с БАР I типа лица с инвалидностью (n=18; 28,1% от числа пациентов с БАР I типа) встречались в 3 раза чаще, чем среди пациентов с БАР II типа (n=2; 9,5% от числа пациентов с БАР II типа).
Таблица 1. Основные социально-демографические характеристики пациентов
|
Основные характеристики |
БАР I типа (n=64) |
БАР II типа (n=21) |
Достоверность, р |
|
Возраст, годы (M±σ) |
37,3±6,5 |
34,5±6,8 |
0,195 |
|
Возраст начала заболевания, годы (M±σ) |
27,4±4,6 |
27,1±5,5 |
0,982 |
|
Длительность заболевания, лет (M±σ) |
9,9±5,0 |
7,3±4,3 |
0,171 |
|
Пол, n (%): |
|||
|
мужской |
24 (37,5) |
5 (23,8) |
χ2=0,8, df=1, p=0,377 |
|
женский |
40 (62,5) |
16 (76,2) |
χ2=0,8, df=1, p=0,377 |
|
Образование, n (%): |
|||
|
среднее |
2 (3,1) |
— |
χ2=0,8, df=3, p=0,845 |
|
среднеспециальное |
18 (28,1) |
7 (33,3) |
χ2=0,8, df=3, p=0,845 |
|
неоконченное высшее |
21 (32,8) |
4 (19,0) |
χ2=0,8, df=3, p=0,845 |
|
высшее |
9 (14,1) |
3 (14,3) |
χ2=0,8, df=3, p=0,845 |
|
Профессиональный статус, n (%): |
|||
|
работает по специальности |
18 (28,1) |
10 (47,6) |
χ2=8,8, df=6, p=0,186 |
|
работает не по специальности |
12 (18,8) |
4 (19,0) |
χ2=8,8, df=6, p=0,186 |
|
низкоквалифицированная работа |
10 (15,6) |
— |
χ2=8,8, df=6, p=0,186 |
|
учится |
5 (7,8) |
1 (4,8) |
χ2=8,8, df=6, p=0,186 |
|
не работает и не учится |
11 (17,2) |
1 (4,8) |
χ2=8,8, df=6, p=0,186 |
|
Инвалидность, n (%): |
|||
|
3-я группа |
8 (12,5) |
2 (9,5) |
χ2=4,1, df=2, p=0,128 |
|
2-я группа |
10 (15,6) |
— |
χ2=4,1, df=2, p=0,128 |
Хотя состояние всех пациентов соответствовало критериям ремиссии при БАР (табл. 2), резидуальные симптомы выявлены у 27 (42,2%) пациентов с БАР I типа и у 6 (28,6%) пациентов с БАР II типа (χ2=0,7, df=1, p=0,394).
Таблица 2. Результаты оценки аффективной симптоматики и характеристика резидуальных симптомов в выборке
|
Основные характеристики |
БАР I т. (n=64) |
БАР II т. (n=21) |
Достоверность, р |
|
HDRS, баллы (Md [Q1; Q3]) |
3,0 [2,0; 4,0] |
2,0 [2,0; 4,0] |
U=776,5, p=0,394 |
|
YMRS, баллы (Md [Q1; Q3]) |
2,0 [1,75; 3,0] |
2,0 [2,0; 3,0] |
U=670,5, p=0,992 |
|
Нарушения сна, n (%) |
13 (20,3%) |
2 (9,5%) |
χ²=0,6, df=1, p=0,426 |
|
Транзиторные аффективные колебания, n (%) |
5 (7,8%) |
2 (9,5%) |
χ²=0,6, df=1, p=0,426 |
|
Психологическое переживание ожидания наступления ухудшения, n (%) |
3 (4,7%) |
1 (4,8%) |
χ²=0,6, df=1, p=0,426 |
|
Умственное истощение, n (%) |
5 (7,8%) |
2 (9,5%) |
χ²=0,6, df=1, p=0,426 |
|
Нарушение аппетита, n (%) |
3 (4,7%) |
— |
χ²=0,1, df=1, p=0,742 |
У 45,3% (n=29) пациентов с БАР I типа и у 38,1% (n=8) пациентов с БАР II типа (χ2=0,34, df=1, p=0,56 в сравнении с больными БАР I типа) общий балл методики КНОКС был ниже 28 баллов, что соответствует легкому когнитивному дефициту. При этом средние значения общего балла КНОКС у пациентов с БАР I типа (28 [26,75; 29] баллов) и БАР II типа (29 [26; 29] баллов) соответствовали нормативному показателю и не обнаруживали статистически значимых различий (U=600,5; p=0,46). Профили когнитивных нарушений у пациентов с БАР I и II типов не имели статистически значимых различий (табл. 3).
Таблица 3. Характеристика когнитивных нарушений у пациентов с БАР в ремиссии (по данным КНОКС), баллы (Md [Q1; Q3])
|
Субтесты КНОКС |
БАР I типа (n=64) |
БАР II типа (n=21) |
Достоверность, p |
|
Ориентировка |
3 [3; 3] |
3 [3; 3] |
U=672; p=1,0 |
|
Память на президентов |
3 [2; 3] |
3 [2; 3] |
U=644; p=0,73 |
|
Называние |
3 [3; 3] |
3 [3; 3] |
U=672; p=1,0 |
|
Понимание |
3 [3; 3] |
3 [3; 3] |
U=661,5; p=0,57 |
|
Конструктивный праксис |
3 [3; 3] |
3 [3; 3] |
U=640,5; p=0,32 |
|
Балл 1-й части |
15 [14; 15] |
15 [14; 15] |
U=616; p=0,5 |
|
Набор последовательностей |
2 [2; 3] |
2 [3; 3] |
U=609,5; p=0,47 |
|
Незавершенные изображения |
3 [3; 3] |
3 [3; 3] |
U=630; p=0,24 |
|
Нахождение сходства |
3 [2; 3] |
3 [2; 3] |
U=663; p=0,91 |
|
Внимание |
2 [2; 3] |
3 [2; 3] |
U=552,5; p=0,17 |
|
Рабочая память |
3 [2; 3] |
3 [2; 3] |
U=635,5; p=0,66 |
|
Балл 2-й части |
13 [12; 14] |
14 [11; 14] |
U=608,5, p=0,51 |
С учетом того, что частота развития и структура когнитивных нарушений при БАР I и II типов в ремиссии не различались, был проведен анализ исследуемых факторов, представленных в табл. 1 и 2, на наличие связи с выраженностью когнитивных нарушений в выборке в целом. Выявлена ассоциированность общего балла КНОКС с возрастом пациентов, длительностью заболевания, общими баллами HDRS и YMRS (табл. 4). Частота выявления исследуемых факторов в выборке в зависимости от наличия или отсутствия у пациентов когнитивных нарушений представлена в табл. 5. Пациенты с когнитивными нарушениями (n=37; женщины — 70,3% ) и пациенты без когнитивных нарушений (n=48; женщины — 62,5% ) не различались по полу, однако средний возраст пациентов с когнитивными нарушениями был статистически значимо больше, чем у пациентов без когнитивных нарушений. Средняя длительность заболевания у пациентов с когнитивными нарушениями была также статистически значимо больше, чем у пациентов без когнитивных нарушений. Среднее значение общего балла HDRS у пациентов с когнитивными нарушениями было статистически значимо выше, а среднее значение общего балла YMRS у этих пациентов — ниже, чем у пациентов без когнитивных нарушений. Обследованные пациенты с когнитивными нарушениями характеризовались снижением скорости психических процессов, снижением рабочей памяти (низкие показатели по субтестам «Набор последовательностей», «Рабочая память») и нарушениями внимания (низкие показатели по субтесту «Внимание»). Пациенты с БАР I и II типов хуже справлялись со второй частью КНОКС, что косвенно говорит о поражении высших психических функций.
Таблица 4. Корреляция общего балла по шкале КНОКС и характеристиками БАР
|
Коэффициент |
Возраст пациентов |
Возраст начала заболевания |
Длительность заболевания |
Общий балл HDRS |
Общий балл YMRS |
|
Пирсона |
–0,507* |
–0,145 |
–0,544* |
–0,560* |
0,336* |
|
Статистическая значимость (p) |
0,000 |
0,185 |
0,000 |
0,000 |
0,002 |
Примечание. *Статистическая значимость корреляции на уровне p<0,01 (данные представлены в виде коэффициента Пирсона (r), статистической значимости p).
Таблица 5. Демографическая и клиническая характеристики пациентов в зависимости от наличия когнитивных нарушений
|
Показатель |
Пациенты с когнитивными нарушениями (n=37) |
Пациенты без когнитивных нарушений (n=48) |
Достоверность, p |
|
Общий балл КНОКС, (Md [Q1; Q3]) |
26 [25; 27] |
29 [28; 29] |
U=7,5; p<0,001 |
|
Женский пол, n (%) |
26 (70,3%) |
30 (62,5%) |
χ2=0,56, df=1, p=0,45 |
|
Возраст пациентов, годы (M±σ) |
39,41±6,2 |
34,44±6,21 |
p<0,001 |
|
Возраст начала заболевания, годы (M±σ) |
27,86±5,23 |
26,89±4,52 |
p=0,391 |
|
Длительность заболевания, годы (M±σ) |
11,54±5,16 |
7,54±3,95 |
p<0,001 |
|
Уровень депрессии (баллы по HDRS), (Md [Q1; Q3]) |
4 [2,5; 6] |
3 [1; 4] |
U=504,5; p=0,001 |
|
Уровень мании (баллы по YMRS), (Md [Q1; Q3]) |
2 [1; 2] |
3 [2; 4] |
U=598,5; p=0,008 |
|
Инвалидность, n (%) |
16 (43,2%) |
4 (8,3%) |
χ2=14,15, df=1, p<0,001 |
|
Число пациентов с резидуальными симптомами в ремиссии, n (%) |
23 (62,2%) |
10 (20,8%) |
χ2=15,03, df=1, p<0,001 |
Обсуждение
Настоящее исследование посвящено изучению когнитивных нарушений у пациентов с БАР в ремиссии. Преимуществом данного исследования является то, что в выборку были включены пациенты с БАР I и II типов. К числу ограничений исследования можно отнести относительно небольшой размер выборки, что в совокупности с длительностью набора пациентов в исследование косвенно подтверждает данные литературы о недостаточной выявляемости и диагностике БАР в России [32]. Хотя особенности фармакотерапии БАР в ремиссии рассматриваются как потенциальный причинный фактор когнитивных нарушений [33], мы не анализировали влияние фармакотерапии на наличие когнитивных расстройств в выборке ввиду больших индивидуальных различий в лечении у обследованных пациентов.
В ходе настоящего исследования когнитивные нарушения выявлены у 43,5% пациентов с БАР в ремиссии, что соответствует данным литературы [16]. Хотя тип БАР рассматривается как потенциальный фактор тяжести когнитивных нарушений [33], в нашем исследовании не были выявлены различия в структуре и частоте когнитивных нарушений у пациентов с БАР I и II типов, что подтверждает данные литературы об общем нейропсихологическом профиле когнитивного дефицита у пациентов с аффективными нарушениями [33, 34].
Наиболее значимыми по выраженности проявлениями когнитивных нарушений у обследованных пациентов явились снижение внимания, рабочей памяти и скорости психических процессов. Известно, что нарушения вербальной памяти и исполнительных функций часто встречаются у пациентов с БАР в ремиссии [24]. M. Kurtz и R. Gerraty в своем исследовании приходят к выводу, что дефицит исполнительных функций и вербального научения у пациентов с БАР чаще всего носит хронический характер [35]. Такие же данные приводят и отечественные исследователи. Так, например, в статье Л.И. Вассермана и соавт. [36] сообщается, что для пациентов с аффективными расстройствами более типичны нарушения, указывающие на дефицитарность исполнительных функций, функций планирования и организации познавательной деятельности. Нейропсихологически это проявляется в расстройстве процесса принятия решений [15]. Нарушения исполнительных функций, в том числе рабочей памяти, рассматриваются как важные компоненты эндофенотипа когнитивного функционирования при БАР, так как они сохраняются в ремиссии и имеют признаки наследственных [37, 38]. Рабочая память предложена в качестве еще одного потенциального компонента нейрокогнитивного эндофенотипа у пациентов с БАР в ремиссии [10]. Хотя в процессе скрининга методика КНОКС не позволяет оценить тонкие нарушения исполнительных функций, убедительные данные о нарушениях внимания и рабочей памяти у обследованных, а также различия в общих баллах первой и второй частей методики свидетельствуют в пользу вовлеченности именно этого набора когнитивных способностей и подтверждают данные литературы о превалировании нарушений исполнительных функций у пациентов с БАР в ремиссии [13].
Не вызывает сомнений, что нейропсихологические нарушения при БАР выявляются как во время обострений, так и в периоды эутимии, однако нет единого мнения, являются ли они стабильными во времени или больше связаны с актуальным состоянием [10]. Наши данные подтверждают обоснованность продолжающейся в настоящее время дискуссии о возможном изменении существующих критериев эутимии [39, 40]. Когнитивные нарушения чаще выявлялись у обследованных пациентов с резидуальными симптомами в ремиссии, а выраженность когнитивного дефицита была статистически значимо связана с клиническими характеристиками заболевания, такими как длительность заболевания и выраженность резидуальной симптоматики. Тот факт, что степень когнитивного дефицита обнаруживала прямую связь с выраженностью резидуальной симптоматики депрессивного полюса и обратную связь с выраженностью резидуальной симптоматики маниакального полюса, интерпретируется нами как свидетельство аффективной природы когнитивного дефицита у обследованных пациентов. Результаты исследования подтверждают данные литературы о негативном влиянии резидуальных симптомов на внимание и скорость психических процессов у пациентов с БАР в ремиссии [10, 23]. Наиболее частым резидуальным симптомом у обследованных пациентов были нарушения сна, что косвенно говорит в пользу возможных нарушений биологических ритмов у этих пациентов и, соответственно, подтверждает обоснованность суждений о необходимости терапевтического ведения субсиндромальных аффективных симптомов в период ремиссии [41].
Когнитивные нарушения у пациентов с БАР часто сочетаются с трудностями контроля поведения [42], что хорошо известно и ожидаемо в период обострения болезни, но остается недостаточно изученным в периоде ремиссии. Однако установлена взаимосвязь нарушений вербальной памяти с погрешностями в приеме поддерживающей терапии, в связи с чем когнитивные нарушения у пациентов с БАР в ремиссии представляются значимой терапевтической мишенью [43]. В связи с этим, на наш взгляд, целесообразно проводить скрининг пациентов на предмет когнитивных нарушений на этапе амбулаторного лечения с целью повышения качества медицинской помощи и уровня комплаенса. Для этого, по нашему опыту, может использоваться методика КНОКС, доступная для применения не только клиническими психологами, но и психиатрами.
Заключение
Установлено, что когнитивные нарушения встречаются у пациентов с БАР с высокой частотой (до 43%) вне зависимости от типа расстройства и проявляются преимущественно нарушениями исполнительных функций (это нарушения внимания, рабочей памяти, скорости психических процессов). Выявлена связь когнитивных нарушений и их выраженности с наличием субсиндромальной (резидуальной) симптоматики БАР в ремиссии. Наши данные свидетельствуют в пользу аффективной природы когнитивного дефицита при БАР и подтверждают необходимость разработки рекомендаций по терапевтической коррекции субсиндромальных аффективных симптомов БАР в ремиссии. Необходимо проведение дальнейших исследований, направленных на уточнение нейропсихологического эндофенотипа БАР и определение наиболее оптимальных стратегий терапевтических вмешательств при выявлении когнитивных нарушений у пациентов с БАР в ремиссии.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
ММА имени И.М. Сеченова
Психические расстройства, прежде всего когнитивные и эмоциональные нарушения, являются одним из наиболее частых проявлений органических заболеваний головного мозга. В тех случаях, когда нарушения памяти и других когнитивных функций выражены настолько, что препятствуют осуществлению профессиональной и социальной деятельности в прежнем объеме и качестве, принято говорить о деменции. Особенно часто деменция отмечается в пожилом возрасте. Согласно популяционным исследованиям от 5 до 20% пожилых лиц имеют деменцию. Деменция и преддементные когнитивные расстройства регулярно сочетаются с эмоциональными нарушениями, прежде всего в виде депрессивных и тревожно-депрессивных расстройств [22].
Безусловными лидерами в списке причин деменции у пожилых являются болезнь Альцгеймера и сосудистая мозговая недостаточность. Хронические прогрессирующие формы церебральной недостаточности сосудистой этиологии традиционно обозначаются в отечественной литературе термином дисциркуляторная энцефалопатия (ДЭ) [15]. Патогенез ДЭ является весьма сложным и связан как с хронической гипоперфузией головного мозга, так и с повторными острыми нарушениями мозгового кровообращения, а также, в ряде случаев – с ликвородинамическими нарушениями и вторичным нейродегенеративным процессом [3–5,29,34].
«Феномен разобщения» в патогенезе психических нарушений при ДЭ
Ведущую роль в формировании когнитивной недостаточности при ДЭ играет поражение глубинных отделов белого вещества головного мозга и базальных ганглиев, что приводит к нарушению связи лобных головного мозга и подкорковых структур (феномен разобщения). Механизм формирования разобщения связывается в первую очередь с артериальной гипертензией и представляется следующим. Хроническая неконтролируемая артериальная гипертензия приводит к вторичным изменениям сосудистой стенки – липогиалинозу, который развивается преимущественно в сосудах микроциркуляторного русла. Развивающийся вследствие этого артериолосклероз приводит к изменению физиологической реактивности сосудов. В этих условиях снижение кровяного давления в результате присоединения сердечной недостаточности со снижением сердечного выброса или в результате избыточной гипотензивной терапии, или в результате физиологических циркадных изменений кровяного давления приводит к возникновению гипоперфузии в зонах терминального кровообращения. К последним относятся указанные выше глубинные церебральные структуры [9,23,26,37].
Острые ишемические эпизоды в бассейне глубоких пенетрирующих артерий приводят к возникновению небольших по диаметру лакунарных инфарктов в глубинных отделах головного мозга. При неблагоприятном течении артериальной гипертензии повторные острые эпизоды приводят к возникновению т.н. лакунарного состояния, которое является одним из вариантов мультиинфарктной сосудистой деменции [25,29]. Помимо повторных острых нарушений, предполагается и наличие хронической ишемии в зонах терминального кровообращения. Маркером последней является резрежение перивентрикулярного или субкортикального белого вещества – лейкоареозис, который патоморфологически представляет собой зону демиелинизации, глиоз и расширение периваскулярных пространств [9,23,26,32]. В некоторых случаях неблагоприятного течения артериальной гипертензии возможно подострое развитие диффузного поражения белого вещества головного мозга с клиникой быстро прогрессирующей деменции и других проявлениях разобщения, что иногда обозначается в литературе термином болезнь Бинсвангера [30].
Нейропсихологические проявления «феномена разобщения»
Ведущую роль в формировании когнитивных нарушений при сосудистой мозговой недостаточности играет разобщение лобных долей и подкорковых образований, что приводит к возникновение вторичной дисфункции лобных долей головного мозга. Лобные доли имеют очень существенное значение в когнитивной деятельности. Согласно теории А.Р. Лурия, которая разделяется в настоящее время подавляющим большинством нейропсихологов, лобные доли отвечают за регуляцию произвольной деятельности: формирование мотивации, выбор цели деятельности, построение программы и контроль за ее достижением [10–12]. При этом дорзолатеральная лобная доля коры и ее связи с стриарным комплексом обеспечивают переключаемость внимания, что необходимо для смены алгоритма деятельности. Орбитофронтальные отделы участвуют в подавлении нерелевантных цели побуждений, обеспечивая таким образом устойчивость внимания и адекватность поведенческих реакций. Кроме того, орбитофронтальная лобная кора находится в тесной взаимосвязи с гиппокампом, обеспечивая устойчивость внимания в мнестической деятельности [13,37].
Дисфункция лобных долей головного мозга приводит к формированию дизрегуляторного синдрома. При этом сохраняются операциональные механизмы памяти, восприятия, двигательные и языковые навыки, но нарушается программирование деятельности: развивается патологическая инертность, связанная с недостаточностью переключаемости внимания либо, напротив, избыточная импульсивность вследствие неустойчивости произвольного внимания, либо различные их сочетания [10–12].
Другие патогенетические механизмы когнитивных нарушений
Помимо поражения глубинных церебральных структур и возникновения феномена разобщения со вторичной дисфункцией лобных отделов головного мозга, в патогенезе когнитивных нарушений несомненную роль играют инфаркты мозга корковой локализации. Стратегически важными для когнитивной деятельности являются ассоциативные зоны лобной коры и зоны стыка теменно-височно-затылочной коры, а также структуры гиппокампового круга. В некоторых случаях возможно возникновение постинсультной деменции, связанной с перенесенным единичным крупноочаговым инфарктом мозга стратегической локализации [4, 32, 40].
Не менее важным аспектом патогенеза когнитивных расстройств при ДЭ является присоединение нейродегенеративного процесса. Согласно патоморфологическим данным, сосуществование сосудистых изменений и маркеров нейродегенерации альцгеймеровского характера (сенильные амилоидные бляшки, нейрофибриллярные внутриклеточные сплетения, апоптоз нейронов медибазальных лобых отделов, гиппокампа и височно-теменных долей головного мозга) не является редким. В этих случаях принято говорить о смешанном сосудисто-дегенеративном характере деменции. Частота встречаемости смешанной деменции значительно превосходит ожидаемую при случайном совпадении двух болезней. Этот факт имеет теоретическое объяснение: гипоксия является фактором, ускоряющим нейродегенеративные изменения, причем особенно чувствительны к гипоксии нейроны гиппокампа [27]. Поэтому, сосудистая мозговая недостаточность расценивается в настоящее время как фактор риска и один из патогенетических механизмов развития болезни Альцгеймера. Таким образом, по крайней мере у части больных существенный вклад в развитие когнитивных расстройств вносит сопутствующий дегенеративный процесс [34, 36].
Патогенез эмоциональных нарушений при ДЭ
Достаточно сложным и разнородным представляется патогенез депрессивных симптомов при ДЭ и их взаимосвязь с когнитивными расстройствами. Во–первых, эмоциональные нарушения, как и когнитивные, могут быть результатом вторичной дисфункции лобных отделов головного мозга. Известно, что связи дорзолатеральной лобной коры и стриарного комплекса участвуют в формировании положительного эмоционального подкрепления при достижении цели деятельности. Нарушение этих связей в результате феномена разобщения будет приводить к недостаточности положительного подкрепления и, как следствие, к хронической фрустрации, что является предпосылкой возникновения депрессии [13, 38].
Депрессивные симптомы регулярно описываются при поражении лобных долей головного мозга различной этиологии [13]. Однако следует иметь в виду, что некоторые проявления лобной дисфункции могут имитировать депрессию в отсутствие истинного снижения фона настроения. Речь идет о мотивационных расстройствах вследствие нарушения связей цингулярной извилины и лимбической системы. Хорошо известна также неустойчивость внешнего аффекта, что связанно с избыточной подвижностью произвольного внимания и снижением критики в результате дисфункции орбитофронтальной коры [10–13, 45].
Наряду с биологическими предпосылками депрессии при лобной дисфункции, несомненную роль играют также психогенные факторы. Безусловно, переживание своей нарастающей интеллектуальной и, как правило, двигательной неспособности вносит свой вклад в формирование депрессивных расстройств, по крайней мере, на ранней стадии деменции, в отсутствие выраженного снижения критики.
Наличие эмоциональных нарушений способно усугублять выраженность когнитивных расстройств из–за повышения уровня тревоги и связанных с этим трудностей сосредоточиться, неуверенности и ожидания неудачи. Таким образом, взаимосвязи когнитивных и эмоциональных нарушений достаточно сложны. Оба вида психических расстройств связаны наличием общих патогенетических факторов (феномен разобщения и лобная дисфункция), а также способны непосредственно влиять друг на друга по описанным выше психологическим механизмам [16].
Клинические характеристики когнитивных нарушений при ДЭ
Поскольку патогенез когнитивных расстройств при ДЭ гетерогенен, клинические проявления интеллектуального дефицита также неоднородны. Однако ведущим в большинстве случаев является синдром «подкорковой» деменции или преддементных когнитивных расстройтсв. Патогенез данного вида когнитивных нарушений связан с поражением глубинных отделов белого и серого вещества головного мозга по указанным выше патологическим механизмам.
Термин «подкорковая» деменция был впервые предложен M. Albert и соавт. в 1974 для обозначения когнитивных расстройств при прогрессирующем надъядерном параличе [21]. В дальнейшем, аналогичные когнитивные расстройства описывались и при других неврологических заболеваниях: болезни Паркинсона, сосудистой деменции, рассеянном склерозе и других поражениях глубинных церебральных структур. Сам термин не вполне удачен, поскольку важную роль в патогенезе «подкорковых» когнитивных расстройств играет дисфункция лобной коры. Тем не менее, этот термин состоялся с клинической точки зрения и широко применяется в литературе [26,40,49].
Подкорковая деменция характеризуется прежде всего замедленностью умственной деятельности – брадифренией: больному требуется больше, чем в норме, времени и попыток для того, чтобы решать насущные интеллектуальные задачи. Отмечается недостаточность кратковременной памяти при относительной сохранности долговременной. Такое своебразие мнестических расстройств обусловливает сохранность памяти о событиях жизни при выраженных затруднениях в обучении, при одновременной работе с несколькими источниками информации и при решении многоэтапных задач, требующих сохранности памяти о промежуточном результате деятельности. «Подкорковая» деменция характеризуется также нарушением восприятия и моторного выражения пространственных отношений, что проявляется при конструировании и в рисунке. Интеллектульная сфера характеризуется нарушением обобщений в результате недооценки условий задания и принятия импульсивных решений. В отличие от болезни Альцгеймера и локальных поражений коры головного мозга, для «подкорковых» деменций не характерны амнезия на текущие событий, апраксия, агнозия и афазия [13,21,26,40,49].
Описания когнитивных нарушений при ДЭ и сосудистой деменции в целом соответствуют упомянутой выше модели «подкорковых» деменций. Однако наличие церебральных инфарктов корковой локализации или сопутствующего нейродегенеративного процесса могут весьма модифицировать клиническую картину, добавляя в нее признаки, характерные для первичного поражения височно-теменных отделов головного мозга. Сопутствующий нейродегенеративный процесс, как правило, возникает у лиц более пожилого возраста. Клиническая картина когнитивных расстройств при этом может в большей степени напоминать болезнь Альцгеймера [3,4,13,16,18,41,49].
Клинические особенности эмоциональных нарушений при ДЭ
Наиболее типичным изменением эмоционального состояния при ДЭ является развитие депрессии. Однако, как правило, выраженность депрессивных расстройств не достигает степени большого депрессивного эпизода по критериям DSM–IV. На ранних стадиях заболевания депрессия при ДЭ носит ипохондрические черты. Выраженность ипохондрии, однако, уменьшается по мере прогрессирования сосудистой мозговой недостаточности. Тяжесть депрессивных симптомов при ДЭ зависит от стадии заболевания и выраженности неврологических нарушений. Имеется также связь с выраженностью когнитивных расстройств и наличием деменции: при этом отмечается большая выраженность депрессии [16].
Весьма любопытны данные о клинико-нейровизуализационных сопоставлениях. В работе Т.А. Янакаевой было показано, что наличие и тяжесть симптомов депрессии зависят от выраженности очаговых изменений белого вещества лобных долей головного мозга и нейровизуализационных признаков ишемического повреждения базальных ганглиев. Эти наблюдения свидетельствуют о биологической природе депрессии при ДЭ, вероятно, связанной главным образом с феноменом лобно-подкоркового разобщения [16].
Диагноз и дифференциальный диагноз сосудистой деменции
В дифференциальном диагнозе сосудистой и первично-дегенеративной деменции весьма важную роль играет сочетание когнитивных нарушений и других клинических проявлений феномена разобщения. К последним относятся псевдобульбарный синдром, олигобрадикинезия, апраксия ходьбы, постуральные и тазовые расстройства. В типичных случаях когнитивные расстройства подкоркового характера и симптомы депрессии в сочетании с вышеуказанными неврологическими нарушениями отмечаются у пожилого пациента с историей повоторных инсультов и длительно существующего сосудистого заболевания, например, гипертонической болезни или церебрального атеросклероза [3,17,18,35].
Важную роль в верификации сосудистой природы когнитивных и эмоциональных нарушений играют методы нейровизуализации: КТ и МРТ головного мозга. В настоящее время диагноз сосудистой деменции считается неправомерным без нейровизуализационного подтверждения. Типичными находками для ДЭ являются очаговые и диффузные изменения белого вещества, постишемические кисты и церебральная атрофия. По некоторым данным, выраженность изменений белого вещества коррелирует с выраженностью когнитивных и эмоциональных нарушений при ДЭ [3,9,17,18].
Фармакотерапия психических нарушений при ДЭ
Лечение когнитивных и эмоциональных нарушений при ДЭ должно быть, по возможности, этиотропным или патогенентическим. Поскольку в основе психических нарушений равно как и других симптомов ДЭ лежит сосудистое заболевание головного мозга, первоочередная задача врача – коррекция факторов риска инсульта и устранение или уменьшение выраженности хронической ишемии головного мозга. Лечение артериальной гипертензии, назначение антиагрегантов, хирургическая коррекция атеросклеротического сужения магистральных артерий, несомненно, способствует профилактике нарастания когнитивых расстройств и, по некоторым данным, уменьшению выраженности имеющегося когнитивного дефекта. Важное значение имеет также контроль гиперлипидемии, гипергликемии, лечение других соматических заболеваний [7].
Патогенетически обосновано применение препаратов с вазоактивными, нейропротективными и метаболическими свойствами. Вазоактивные препараты улучшают церебральную микроциркуляцию, воздействуя на тонус артериол и реологические свойства крови. Широко применяются на практике такие препараты, как танакан, винпоцетин, пентоксифиллин, вазобрал, блокаторы кальциевых каналов (нимодипин, циннаризин, флунаризин и др.). Данные препараты обладают способностью уменьшать выраженность когнитивных расстройств при ДЭ. При этом, как правило, наибольший эффект отмечается в наиболее подвижных когнитивных сферах, таких как напряженность внимания и память [7].
Цель применения нейропротективных препаратов – улучшить выживаемость нейронов в условиях хронической ишемии и гипоксии, что способствует вторичной профилактике нарастания выраженности когнитивных и других неврологических расстройств. Учитывая важную патогенетическую роль процессов перекисного окисления липидов в ишемическом повреждении, нейропротективным действием могут обладать препараты с антиоксидантными свойствами. Oбсуждается вероятный антиоксидантный эффект селегелина, токоферола и танакана. Наибольший клинический опыт применения при ДЭ имеется в отношении танакана, который сочетает в себе как вазоактивные, так и нейропротективные свойства. Данный препарат в ряде исследований показал способность уменьшать выраженность когнитивных, эмоциональных и субъективных симптомов ДЭ. Однако способность танакана модифицировать течение заболевания нуждается в дополнительном изучении [8,19,28,31].
Нейропротективным потенциалом обладают также препараты, уменьшающие содержание внутриклеточного кальция в нейронах, такие как нимодипин, поскольку накопление кальция усиливает энергетические процессы и способствует гибели нейронов. Симптоматический ноотропный эффект и потенциальная возможность модифицировать течение заболевания описывается также у блокатора NMDA-рецепторов акатинола мемантина [7,36].
Нейрометаболическая терапия применяется с симптоматической целью для уменьшения выраженности когнитивных и других неврологических нарушений. Кроме того, по некоторым данным, метаболическая терапия обладает возможностью модифицировать течение заболевания. Классом препаратов, специально синтезированных для применения в качестве ноотропных средств, являются ГАМК-ергические препараты: пирацетам и его модификации. Эффективность терапии во многом зависит от режима дозирования. Более целесообразно внутривенное применение в достаточно высоких дозировках [7].
В качестве нейрометаболической терапии хорошо зарекомендовал себя пептидэргический препарат церебролизин. Церебролизин содержит свободные аминокислоты и полипептиды, которые как показывают экспериментальные наблюдения, обладают нейротрофическим эффектом [2,6]. Показано, что церебролизин при внутривенном введении в дозах 15–30 мл оказывает благоприятное действие, главным образом, на когнитивные функции, способствуя улучшению концентрации внимания, мнестических функций и интеллектуальных процессов [1,14,20,35,39].
В качестве ноотропных препаратов используются ацетилхолинергические препараты, учитывая роль ацетилхолинергической медиации в процессах внимания и памяти. В настоящее время доказано, что ингибиторы ацетилхолинэстеразы, такие как ривастигмин и амиридин, улучшают когнитивные функции при деменции альцгеймеровского типа. При ДЭ и сосудистой деменции эти препараты целесообразно назначать при смешанном характере деменции с наличием сопутствующего дегенеративного процесса. Следует отметить, что ингибиторы ацетилхолинэстеразы могут усиливать выраженность депрессии. Поэтому при сочетании когнитивных и эмоциональных расстройств лечение следует начинать с коррекции симптомов депрессии. С целью усиления ацетилхолинергической медиации как при болезни Альцгеймера, так и при сосудистой деменции также используется предшественник ацетилхолина глиатилин [7, 36].
В психофармакотерапии депрессии, связанной с сосудистой мозговой недостаточностью, предпочтительнее назначение препаратов с минимальным холинолитическим эффектом, поскольку последний может способствовать усугублению тяжести когнитивных расстройств. Наиболее целесообразно применение селективных блокаторов обратного захвата серотонина, таких как флуоксетин [36]. Легкий антидепрессивный эффект при сосудистой моговой недостаточности описывается также у танакана, который может применяться при нетяжелой симптоматической депрессии, связанной с ДЭ [31].
Заключение
Таким образом, когнитивные и эмоциональные нарушения являются закономерной составной частью клинической картины дисциркуляторной энцефалопатии. В основе психических расстройств при ДЭ лежит поражение глубинных отделов полушарий головного мозга (базальных ганглиев и глубинных отделов белого вещества), связанное как с хронической гипоперфузией, так и с повторными острыми нарушениями мозгового кровообращения. Поражение глубинных церебральных отделов ведет к разобщению связей лобных отделов и подкорковых структур, что и приводит к возникновению вторичной дисфункции лобных долей головного мозга, проявлением которой являются когнитивные расстройства «подкорково-лобного» характера и симптомы депрессии. Лечение психических расстройств сосудистой этиологии должно включать как лечение основного сосудистого заболевания, так и вазоактивные, нейропротективные и метаболические препараты.
Литература:
1. Верещагин Н.В., Лебедева Н.В. Легкие формы мультиинфарктной деменции: эффективность церебролизина. //Сов.Медицина.-1991.-N.11. –c.6–8.
2. Виндиш М. Церебролизин – новейшие результаты, подтверждающие разностороннее действие лекарства.// В кн.: Третий Международный Симпозиум по Церебролизину. –1991. Москва. –С.81–106.
3. Дамулин И.В. Дисциркуляторная энцефалопатия в пожилом и старческом возрасте. //Автореферат дисс… докт.мед.наук. –М. –1997. –С.32.
4. Дамулин И.В. Сосудистая деменция. //Неврологический Ж. –1999. –Т.3. -№.4. –С.4–11.
5. Дамулин И.В., Орышич Н.А., Иванова Е.А. Нормотензивная гидроцефалия. //Неврол. Ж. –1999. –Т.4. -№.6.-С.51–56.
6. Дамулин И.В., Захаров В.В., Левин О.С., Елкин М.Н. Использование церебролизина в нейрогериатрической практике. //В сб.: Н.Н.Яхно, И.В.Дамулин (ред): Достижения в нейрогериатрии. –Москва, 1995. –Ч.1. –С.100–115.
7. Захаров В.В., Дамулин И.В., Яхно Н.Н. Медикаментозная терапия деменций. Клиническая фармакология и терапия. –1994. –Т.3. -№ 4. –С.69–75.
8. Захаров В.В., Яхно Н.Н. Применение танакана при нарушении мозгового и периферического кровообращения. //Русский Медицинский Журнал. –2001. –Т.9. -№ 15. –С.645–649.
9. Левин О.С., Дамулин И.В. Диффузные изменения белого вещества (лейкоареоз) и проблема сосудистойй деменции. //В кн. под ред. Н.Н.Яхно, И.В.Дамулина: Достижения в нейрогериатрии. –1995. –Ч.2. –С.189–231.
10. Лурия А.Р. Высшие корковые функции человека. Изд.2. –Москва : издательство МГУ, 1969 г.
11. Лурия А.Р. Основы нейропсихологии. –Москва : издательство МГУ, 1973.
12. Лурия.А.Р. Лобные доли и регуляция психических процессов. –М., Изд-во Московского Университета, 1966.
13. Пилипонич А.А., Захаров В.В., Дамулин И.В. Лобная дисфункция при сосудистой деменции. //Клиническая геронтология. –2001. –Т.5. -№ 6. –С.35–41.
14. Соловьев О.И. Нейротропное действие церебролизина по данным компьютеризированной топографии и визуального анализа ЭЭГ. //В кн.: Третий Международный Симпозиум по Церебролизину. –1991. Москва.-с.61–70.
15. Шмидт Е.В. Классификация сосудистых поражений головного испинного мозга. //Ж. Невропатологии и Психиатрии. –1985. –Т.85. –С.192–203.
16. Янакаева Т.А. Эмоционально-аффективные нарушения при дисциркуляторной энцефалопатии и болезни Паркинсона. //Автореферат дисс… канд.мед.наук. –М. –1999.
17. Яхно Н.Н., Левин О.С., Дамулин И.В. Сопоставление клинических и МРТ-данных при дисциркуляторной энцефалопатии. Сообщение 1: двигательные нарушения. //Неврол. Ж. –2001. –Т.6. -№.2. –С.10–16.
18. Яхно Н.Н., Левин О.С., Дамулин И.В. Сопоставление клинических и МРТ-данных при дисциркуляторной энцефалопатии. Сообщение 2: когнитивные нарушения. //Неврол. Ж. –2001. –Т.6. -№.3. –С.10–19.
19. Яхно Н.Н., Дамулин И.В., Захаров В.В., Елкин М.Н., Ерохина Л.Г., Стаховская П.В., Чекнева Н.С., Суслина З.А., Тимербаева С.Л., Федин П.А., Бодарева Э.А., Скоромец А.А., Сорокоумов В.А., Ивашкин В.Т., Григорьев Ю.В., Первозванский Б.Е. Применение танакана при начальных стадиях сосудистой мозговой недостаточности: результаты открытого многоцентрового исследования. //Неврологический журнал. –1998. –Т.3. -№.6. –С.18–22.
20. Яхно Н.Н., Дамулин И.В., Захаров В.В., Левин О.С., Елкин М.Н. Опыт применения высоких доз церебролизина при сосудистой деменции. Тер Архив. –1996. –Т.68. -№ 10. –С.65–69.
21. Albert M.L. Subcortical dementia. In: Alzheimer’s disease : Senile Dementia and Related Disorders. –New York, Raven Press, 1978, V.7, pp 173–180.
22. Amaducci L., Andrea L. The epidemiology of the dementia in Europe. In: A.Culebras, J.Matias Cuiu, G.Roman (eds) : New concepts in vascular dementia . –Barselona : Prous Science Publishers, 1993, pp 19–27.
23. Awad I.A., Masaryk T., Magdinec M. Pathogenesis of subcortical hypertense lesions on MRI of the brain. //Stroke. –1993. –V.24. –P.1339–1346.
24. Cummings J.L., Benson D.F. Subcortical dementia. Review of an emerging concept. //Arch Neurol. –1984. –V.41. –P.874–879.
25. Fisher C.M. Lacunar strokes and infarcts.//Neurology. –1982. –V.32. –P.871–876.
26. Inzitari D., Marinoni M., Ginanneschi A. Pathophysiology of leucoaraiosis. // In: New concepts in vascular dementia. A.Culebras, J.Matias Guiu, G.Roman (eds). Barcelona: Prous Science Publishers. –1993. –P.103–113.
27. Iqbal K., Winblad B., Nishimura T., Takeda M., Wisniewski H.M. (eds) Alzheimer’s Disease: Biology, Diagnosis and Therapeutics John Willey and Sons Ltd, 1997, 830 p.
28. Israel L., Dell’Accio E., Martin G., Hugonot R. Extrait de Ginkgo biloba et expercises d’entrainement de la memoire. Evaluation comparative chez des personnes agees ambulatoires. //Psychol Med. –1987. –V.19. –P.1431–1439.
29. Hachinski V.C., Lassen N.A., Marshall J. Multi–infarct dementia. A case of mental deterioration in the elderly. //Lancet. –1974. –V.2.-P.207–210.
30. Hachinski V.C. Binswanger disease: neither Binswanger’s nor a disease. //J. Neur. Sci. –1991. –V.103. –P.1–13.
31. Halama P. Was leistet der Spezialextrakt (Egb 761) //Therapiewoche. –1990. –V.40. –P.3760–3765.
32. Hershey L.A., Olszewski W.A. Ischemic vascular dementia. //In: Handbook of Demented Illnesses. Ed. by J.C.Morris. –New York etc.: Marcel Dekker, Inc. –1994. –P.335–351
33. Huber S.J., Shuttleworth E.C., Paulson G.W. et al. Cortical vs subcortical dementia: neuropsychological differences. Arch Neurol. –1986. –V.43. –P.392–394.
34. Кalaria R.N., Lewis H., Cookson N.J., Shearman M. The impact of certebrovascular disease on alzheimer’s pathology in elderly. //Neurobiol. aging. –2000. –V.21.-N.1.S.-P.S.66–67.
35. Kofler B., Erhart C., Erhart P. Harrer G. A multi–dimentional approach in testing nootropic drug effects (Cerebrolysin). //Arch. Gerontol. Geriatr. –1990. –V.10. –Р.128–140.
36. Lovenstone S., Gauthier S. Management of dementia. //-Martin Dunitz Ltd. –2000. –P.145.
37. Roman G.V. Vascular dementia: NINDS – AIREN diagnostic criteria. //In: New concepts in vascular dementia. A.Culebras, J.Matias Guiu, G.Roman (eds). Barcelona: Prous Science Publishers. –1993. –P.1–9.
38. Saint–Cyr J.A., Taylor A.E., Nikolson K. Behavior and basal ganglia. //In : W.J.Weiner, A.E.Lang (eds) : «Behavioral Neurology of Movement Disorder». Adv Neurol. –1995. –V.65. –P.1–29.
39. Suchanek–Frohlich H., Wunderlich E. Uber die Wirksamkeit eines Aminosaure– Peptid– Randomisierte Doppelblind– Placebo– Vergleichsstudie. //Neuropsychiatrie. 1986. –V.1. –N.1. –P.45–48.
40. Tien R. The Dementias: Correlation of Clinical Features, Pathophisiology, and Neuroradiology. // A. J. R. –1993. –V.161. –P.245–255.
Около 90% площади коры головного мозга человека участвует в познавательной деятельности. Поэтому большинство неврологических заболеваний с заинтересованностью головного мозга сопровождаются теми или иными когнитивными расстройствами. Обычно они сочетаются с изменениями в эмоционально-поведенческой сфере, будучи объединенными общим патоморфологическим и патофизиологическим субстратом. Практикующему неврологу необходимо оценивать наличие и особенности когнитивных и других нервно-психических нарушений и учитывать эту информацию при синдромальной, топической и нозологической диагностике заболевания нервной системы. Нарушения когнитивных функций имеют не меньшее значение для клиницистов других врачебных специальностей. Органоммишенью многих соматических заболеваний, в частности широко распространенных в пожилом возрасте заболеваний сердечно-сосудистой системы, является головной мозг. Оценка состояния головного мозга в таком случае исключительно важна для оценки эффективности контроля основного заболевания и выбора терапевтической тактики.
Наличие когнитивных нарушений крайне негативно влияет на качество жизни пациента и его ближайших родственников, затрудняет лечение сопутствующих заболеваний и проведение реабилитационных мероприятий. Поэтому очень важным представляются своевременная диагностика и максимально раннее начало терапии имеющихся когнитивных расстройств.
Определение и классификация когнитивных нарушений
Согласно последнему пересмотру международных рекомендаций по диагностике психических расстройств (Diagnostic and statistical manual of mental diseases — DSM-V), к когнитивным расстройствам относится снижение по сравнению с преморбидным уровнем одной или нескольких высших мозговых функций, обеспечивающих процессы восприятия, сохранения, преобразования и передачи информации (табл. 1) [1].
Важно не только установить когнитивное снижение и провести его качественный анализ, но и количественно оценить выраженность имеющихся расстройств. Известно, что некоторые лекарственные препараты, эффективные при выраженных когнитивных расстройствах (деменциях), в значительно меньшей степени влияют на когнитивные нарушения, не достигающие степени деменции. Вероятно, это связано с различными нейрохимическими изменениями, которые отмечаются на ранних и более поздних этапах патологического процесса [2–4].
Деменция (или, согласно DSM-V, выраженное нейрокогнитивное расстройство) характеризуется значительной выраженностью нарушений высших мозговых функций, которые препятствуют нормальному функционированию пациента. При деменциях из-за выраженных когнитивных расстройств пациент хотя бы частично лишен независимости и нуждается в посторонней помощи в самых обычных жизненных ситуациях (например, при ориентировании на местности, совершении покупок в магазине) (табл. 2) [1].
В лечении пациентов с выраженными когнитивными расстройствами приоритет следует отдавать препаратам с симптоматическим эффектом, которые позволяют уменьшить выраженность расстройств и тем самым повысить качество жизни пациентов и их родственников.
Диагноз недементных когнитивных нарушений устанавливается в тех случаях, когда, несмотря на имеющийся интеллектуальный дефект, пациент сохраняет самостоятельность в повседневной жизни. При этом пациент может ощущать некоторые трудности при умственной работе, что отражается в жалобах. Однако пациент преодолевает эти трудности, не прибегая к помощи со стороны (табл. 2) [1]. В лечении пациентов с недементными когнитивными расстройствами следует не только использовать симптоматическую терапию, но и проводить мероприятия по профилактике деменции.
Согласно классификации академика Н.Н. Яхно, недементные когнитивные расстройства разделяются на легкие и умеренные (табл. 3) [5]. При этом пациенты с умеренными нарушениями могут испытывать затруднения в наиболее сложных и непривычных для пациента видах деятельности. В то же время пациенты с легкими нарушениями полностью независимы и самостоятельны во всех видах активности, в том числе и самой сложной.
Последние годы возрастает внимание неврологов, психиатров и представителей других нейронаук к еще более ранней стадии когнитивной недостаточности — так называемым субъективным когнитивным нарушениям. Формулировка «субъективные когнитивные нарушения» (субъективные нарушения памяти, жалобы когнитивного характера) в настоящее время широко используется как в научной литературе, так и в повседневной клинической практике в качестве самостоятельного диагноза. Этот диагноз выставляется, если имеются жалобы когнитивного характера, в то время как результаты объективных когнитивных тестов остаются в пределах возрастной нормы.
Больные могут высказывать жалобы на повышенную забывчивость, снижение концентрации внимания, повышенную утомляемость при умственной работе, иногда — трудности подбора нужного слова в разговоре. Указанные жалобы представляют собой весьма актуальную для пациента проблему, которая может послужить самостоятельным или главным поводом для обращения к врачу. В то же время применение стандартных когнитивных тестов не выявляет какихлибо существенных отклонений от принятых нормативов. Пациенты с субъективными когнитивными расстройствами полностью сохраняют независимость в повседневной жизни. Когнитивные трудности также незаметны со стороны: родственники, сослуживцы и другие лица всегда оценивают когнитивные способности пациента как вполне сохранные.
В настоящее время известны следующие международные диагностические критерии (2014) синдрома субъективных когнитивных нарушений [6]:
— жалобы пациента на стойкое ухудшение по сравнению с прошлым умственной работоспособности, возникшее без видимой причины;
— отсутствие каких-либо отклонений от возрастной нормы по данным когнитивных тестов, используемых для диагностики болезни Альцгеймера и других дементирующих заболеваний;
— когнитивные жалобы не связаны с каким-либо установленным диагнозом неврологического, психиатрического заболевания или интоксикацией.
Таблица 1. Когнитивные функции (по DSM-V)
| Функция | Определение |
|---|---|
| Восприятие (гнозис) | Способность воспринимать и распознавать информацию, поступающую от органов чувств |
| Память | Способность запечатлевать, сохранять и многократно воспроизводить полученную информацию |
| Психомоторная функция (праксис) | Способность составлять, сохранять и выполнять двигательные программы |
| Речь | Способность к вербальной коммуникации, включая понимание обращенной речи, построение собственного речевого высказывания, чтение и письмо |
| Внимание | Способность своевременно реагировать на поступающие от органов чувств сигналы, концентрироваться и сохранять в течение необходимого времени умственную работоспособность, разделять информационные потоки |
| Управляющие функции | Способность к планированию и контролю познавательной деятельности и поведения, включая выбор цели (целеполагание), построение программы (программирование), переход с одного этапа программы на другой (переключаемость, интеллектуальная гибкость) и сопоставление полученного результата с целью (контроль) |
| Социальный интеллект | Способность к пониманию эмоций и логики других людей |
Диссоциация между жалобами пациентов, результатами тестирования и повседневным функционированием пациентов ставит закономерные вопросы об истинной природе жалоб. Эти вопросы пока далеки от своего разрешения и активно изучаются. На современном этапе научных знаний складывается впечатление, что пациенты с субъективными когнитивными нарушениями представляют собой весьма гетерогенную группу, в которую входят как пациенты с наиболее ранними стадиями дементирующего процесса, так и пациенты с расстройствами тревожно-депрессивного и ипохондрического спектра. В некоторых случаях преимущественно субъективный характер нарушений объясняется методологическими трудностями объективизации когнитивного статуса. В настоящее время отсутствуют общепринятые рекомендации по использованию конкретных методик для диагностики деменции или недементных когнитивных нарушений. Поэтому на практике используются тесты различной степени чувствительности, специфичности и воспроизводимости. Использование тестов с низкой чувствительностью будет приводить к недостаточной диагностике легких и умеренных когнитивных нарушений и к избыточной диагностике так называемых субъективных нарушений.
Диагноз «субъективные когнитивные нарушения» часто получают пациенты с высоким преморбидным интеллектуальным уровнем. Сниженные в результате церебрального заболевания когнитивные функции по сравнению с индивидуальной нормой длительное время формально будут находиться в пределах среднестатистического норматива. Следовательно, когнитивное снижение может длительное время оставаться формально неподтвержденным, иначе говоря, «субъективным».
Жалобы когнитивного характера могут быть обусловлены тревожно-депрессивными расстройствами в отсутствие органического церебрального заболевания. Так, пациентов с высоким уровнем тревоги будет чрезмерно беспокоить незначительная ситуационно обусловленная забывчивость. В этом случае причиной обращения к врачу становятся такие широко распространенные, в том числе среди здоровых лиц, жалобы, как «не помню, зачем пришел в комнату», «не помню, что куда положил», «не узнал знакомого человека или не вспомнил его фамилию» и др.
Однако наибольший исследовательский интерес в гетерогенной группе пациентов с субъективными когнитивными нарушениями вызывают пациенты со снижением толерантности к умственным нагрузкам, поскольку указанный патологический феномен может действительно быть наиболее ранним клиническим проявлением дементирующего процесса. Как известно, на самых начальных стадиях нейродегенеративного или цереброваскулярного заболевания клиническая симптоматика может отсутствовать, несмотря на наличие органического поражения мозга, иногда значительного. Это объясняется так называемым церебральным резервом, то есть компенсаторными возможностями головного мозга. Наличие таких возможностей будет приводить к ложноотрицательному результату тестирования. В то же время в повседневной жизни пациент может испытывать затруднения в особых условиях, когда церебральный резерв истощается и не может преодолеть возникающие трудности, например в состоянии утомления или эмоционального стресса. В настоящее время в мире весьма активно ведутся разработки методологии «интеллектуальный тредмилл». Она позволит оценить степень толерантности к повышенным умственным нагрузкам, которая может снижаться до развития клинически очерченных когнитивных расстройств.
Таблица 2. Диагностические критерии умеренного и выраженного нейрокогнитивного расстройства по DSM-V
| Тяжесть нарушений | Критерий |
|---|---|
| Синдром умеренных когнитивных нарушений (умеренное нейрокогнитивное расстройство) | Небольшое снижение по сравнению с прежним уровнем одной или нескольких когнитивных функций (внимание, управляющие функции, память, речь, праксис, гнозис, социальный интеллект), которое подтверждается: — жалобами пациента, информацией от третьих лиц, включая лечащего врача; — нейропсихологическими тестами или независимой клинической оценкой. Когнитивные нарушения не лишают пациента независимости в повседневной деятельности (в том числе в сложных ее видах, например, при осуществлении финансовых операций или приеме лекарств). Пациент остается независимым, однако повседневная деятельность может требовать от него более значительных усилий, чем раньше, или применения специальных стратегий преодоления возникающих трудностей. Когнитивные нарушения присутствуют не только во время делирия. Когнитивные нарушения не связаны с другими психическими расстройствами, например депрессией или шизофренией |
| Выраженное нейрокогнитивное расстройство | Значительное снижение по сравнению с прежним уровнем одной или нескольких когнитивных функций (внимание, управляющие функции, память, речь, праксис, гнозис, социальный интеллект), которое подтверждается: — жалобами пациента, информацией от третьих лиц, включая лечащего врача; — нейропсихологическими тестами или независимой клинической оценкой. Когнитивные нарушения лишают пациента независимости в повседневной жизни (как минимум в сложных ее видах, например, при осуществлении финансовых операций или приеме лекарств). Когнитивные нарушения присутствуют не только во время делирия. Когнитивные нарушения не связаны с другими психическими расстройствами, например депрессией или шизофренией |
Международные исследования свидетельствуют, что риск развития дементирующих заболеваний среди пациентов с субъективными когнитивными нарушениями достоверно выше, чем в среднем в популяции [6]. Поэтому даже изолированные жалобы, не подтвержденные когнитивными тестами, не должны оставаться без внимания лечащих врачей. Они не могут служить основанием для какого-либо определенного клинического диагноза, но их наличие является показанием для активной профилактики, в первую очередь немедикаментозной (умственная и физическая активность, оптимизация питания и образа жизни).
Диагностика умеренных когнитивных нарушений
Как следует из приведенных выше критериев (табл. 2), диагностика синдрома умеренных нейрокогнитивных нарушений базируется, во-первых, на жалобах пациентов и/или их родственников, во-вторых, на объективных результатах тестирования. При этом следует учитывать, что жалобы когнитивного характера далеко не всегда прямолинейны. Обычно на снижение памяти или повышенную забывчивость жалуются пациенты с так называемым амнестическим типом синдрома умеренных нейрокогнитивных нарушений, у которых в когнитивном статусе преобладают прогрессирующие мнестические расстройства. У таких пациентов в будущем чаще всего устанавливается болезнь Альцгеймера. Однако, по данным анализа специализированного амбулаторного приема пациентов с когнитивными нарушениями, самой частой причиной синдрома умеренных когнитивных нарушений является цереброваскулярная патология. Так, опыт первой российской клиники нарушений памяти свидетельствует, что дисциркуляторная энцефалопатия или последствия острых нарушений мозгового кровообращения обусловливают 68% умеренных когнитивных нарушений [7].
Сосудистые когнитивные нарушения в большинстве случаев относятся к так называемому подкорково-лобному типу. При этом память на текущие события и события жизни практически не страдает, а в когнитивном статусе преобладают снижение концентрации внимания и темпа познавательной деятельности (брадифрения), нарушение управляющих лобных функций (планирование и контроль). Характерной особенностью является также частое сочетание когнитивных и эмоционально-поведенческих нарушений: депрессии, апатии или аффективной лабильности. Следует подчеркнуть, что эмоциональноповеденческие расстройства при хронической сосудистой мозговой недостаточности носят органический характер и вызываются тем же поражением головного мозга (дисфункция фронто-стриарных связей), что и когнитивные нарушения. Коморбидность сосудистой депрессии и сосудистых когнитивных нарушений составляет не менее 80% [8–11].
Таблица 3. Классификация когнитивных нарушений по степени тяжести [5]
| Нарушения | Описание |
|---|---|
| Легкие | Снижение когнитивных способностей по сравнению с более высоким преморбидным уровнем индивидуума, снижение формально остается в пределах среднестатистической возрастной нормы или отклоняется от нее незначительно. Обычно отражается в жалобах больного, но не обращает на себя внимания окружающих. Не вызывает затруднений в повседневной жизни, даже при наиболее сложных ее формах |
| Умеренные | Снижение когнитивных способностей по сравнению как с индивидуальной, так и со среднестатистической возрастной нормой. Отражается в жалобах индивидуума и обращает на себя внимание окружающих. Не приводит к существенным затруднениям в повседневной жизни, хотя может препятствовать наиболее сложным видам интеллектуальной активности |
| Тяжелые | Снижение когнитивных способностей, которое приводит к существенным затруднениям в повседневной жизни: профессиональной или социально-бытовой сфере, а при наиболее тяжелых расстройствах — при самообслуживании. Частичная или полная утрата самостоятельности. Зависимость от посторонней помощи |
Пациенты с сосудистыми когнитивными расстройствами редко жалуются на забывчивость, так как память у них относительно сохранна. В структуре жалоб доминируют так называемые субъективные неврологические симптомы: головная боль, несистемное головокружение, шум и тяжесть в голове, повышенная утомляемость, нарушения сна. Указанные симптомы достаточно типичны для начальных стадий дисциркуляторной энцефалопатии и в недалеком прошлом рассматривались как важный признак хронического ишемического поражения головного мозга. В настоящее время очевидно, что головная боль, головокружение и другие неприятные ощущения в голове не могут быть непосредственным результатом церебральной ишемии. Патогенез субъективных неврологических симптомов более сложен и связан в первую очередь с имеющимися когнитивными, эмоциональными и двигательными расстройствами. Так, головная боль чаще всего имеет характер головной боли напряжения, которая, как известно, практически всегда обусловлена тревогой и/или депрессией. Эмоциональную причину также имеют нарушения сна. Повышенная утомляемость может как быть признаком депрессии (табл. 4), так и отражать снижение умственной работоспособности. В последнем случае данная жалоба есть субъективный эквивалент когнитивных расстройств. Головокружение при хронической недостаточности мозгового кровообращения обычно носит несистемный характер и описывается как чувство неустойчивости при ходьбе. За этим ощущением, как правило, стоят реальные нарушения равновесия вследствие поражения фронто-стриарных и фронто-церебеллярных связей.
Субъективные неврологические симптомы почти всегда присутствуют на начальных стадиях хронической сосудистой мозговой недостаточности. Они не могут быть основанием для диагноза, но должны заставить врача заподозрить хроническое цереброваскулярное заболевание. Для подтверждения диагноза необходима тщательная оценка когнитивного и эмоционального статуса с помощью объективных методик. На стадии умеренных (недементных) когнитивных расстройств следует использовать наиболее чувствительные методики, например Монреальскую шкалу оценки когнитивных функций [12].
Патогенетическая и симптоматическая терапия недементных когнитивных нарушений
На сегодняшний день окончательно не выработан единый общепризнанный протокол ведения пациентов с когнитивными нарушениями, не достигающими выраженности деменции. Многие международные исследования не смогли продемонстрировать, что фармакотерапия такими препаратами, как ингибиторы ацетилхолинэстеразы, пирацетам, нестероидные противовоспалительные средства, предотвращает или снижает риск развития деменции [2–4]. В то же время в тех же работах была показана способность некоторых из указанных выше лекарственных препаратов уменьшать выраженность симптоматики у пациентов с синдромом умеренных когнитивных нарушений.
Эмпирически в повседневной клинической практике в настоящее время широко используются вазотропные и нейрометаболические лекарственные средства, дофаминергический и норадренергический препарат пирибедил (Проноран) и блокаторы NMDA-рецепторов.
Результаты ряда крупных исследований и опыт практического применения свидетельствуют о клинической эффективности препарата пирибедил (Проноран). Проноран имеет комплексный механизм действия: он стимулирует постсинаптические D2/D3-рецепторы к дофамину и блокирует пресинаптические альфа-адренорецепторы. При этом блокада пресинаптических адренорецепторов ведет к увеличению церебральной норадренергической активности. Таким образом, на фоне применения данного лекарственного средства увеличивается активность двух церебральных нейротрансмиттерных систем: дофаминергической и норадренергической. Обе эти системы непосредственно вовлечены в познавательную деятельность. При этом считается, что дофаминергическая стимуляция префронтальной коры опосредованно через мезокортикальный дофаминергический путь играет важную роль в процессах внимания и обеспечивает интеллектуальную гибкость, то есть способность менять парадигму поведения. Норадренергическая активация важна для процессов запоминания и воспроизведения информации, поскольку обеспечивает оптимальный для мнестической деятельности уровень концентрации внимания и мотивации. С возрастом снижаются синтез и активность как дофамина, так и норадреналина. Поэтому коррекция указанных нейротрансмиттерных нарушений на фоне применения Пронорана способствует уменьшению выраженности ассоциированных с возрастом нарушений внимания и памяти. Кроме того, благодаря адреноблокирующему и дофаминергическому действию Проноран оказывает также благоприятный вазотропный эффект, что создает дополнительные преимущества при когнитивных нарушениях сосудистой этиологии [13–16].
Таблица 4. Диагностические критерии депрессии по Международной классификации болезней 10-го пересмотра
| Критерий | Симптом |
|---|---|
| А. Основные | Присутствие большую часть времени на протяжении не менее двух последних недель по меньшей мере двух из следующих признаков: — подавленное настроение или тоска; — снижение интересов или утрата чувства удовольствия от той деятельности, которая раньше давала положительные эмоции; — снижение энергии и повышенная утомляемость |
| Б. Дополнительные | Наличие по меньшей мере двух из следующих признаков: — снижение способности к концентрации внимания; — заниженная самооценка и отсутствие уверенности в себе; — идеи вины и самоуничижения; — мрачное, пессимистическое видение будущего; — суицидальные мысли или действия; — нарушения сна; — нарушения аппетита |
В клинической практике Проноран используется для лечения легких и умеренных когнитивных нарушений, не достигающих выраженности деменции, у пациентов старше 50 лет. Препарат может назначаться как при сосудистых когнитивных нарушениях, так и на начальных стадиях нейродегенеративного процесса. По данному показанию было выполнено большое число клинических исследований, в том числе с использованием двойного слепого метода. Так, во Франции в 1980-е гг. проведено 14 клинических исследований, в которых принимало участие более 7 тыс. пациентов с недементными когнитивными нарушениями. Было показано, что Проноран способствует достоверному улучшению показателей памяти, концентрации внимания и интеллектуальной гибкости, то есть способности изменять парадигму поведения в зависимости от внешних условий [17, 18]. В 2001 г. клиническая эффективность Пронорана была вновь продемонстрирована в работе D. Nagaradja и S. Jayashree. Авторы использовали Проноран при синдроме умеренных когнитивных нарушений в соответствии с современными диагностическими критериями. Было показано, что на фоне исследуемого препарата отмечается более чем двукратное увеличение частоты когнитивного улучшения по краткой шкале оценки психического статуса по сравнению с плацебо, что имело статистически и клинически значимый характер [19].
В настоящее время российские специалисты также имеют значительный опыт использования Пронорана у пациентов с когнитивными нарушениями, не достигающими выраженности деменции. Так, в рамках исследования ПРОМЕТЕЙ Проноран получали 574 пациента из 33 городов 30 регионов России, из них 336 женщин и 207 мужчин, в возрасте от 60 до 89 лет (средний возраст 69,5±5,5 года) с легкими или умеренными когнитивными расстройствами. Для лечения отбирались пациенты с жалобами когнитивного характера, которые набирали 25–27 баллов по краткой шкале оценки психического статуса или выполняли с ошибками тест рисования часов, но не соответствовали диагностическим критериям деменции. На фоне терапии было зафиксировано статистически значимое улучшение когнитивных функций, которое отмечалось уже на шестой неделе лечения и в дальнейшем возрастало вплоть до окончания 12-недельного наблюдения. При этом одна часть пациентов получала монотерапию Пронораном, а другая часть — Проноран в комбинации с вазотропными и/или нейрометаболическими препаратами. Достоверной разницы между указанными группами пациентов показано не было, то есть комбинация Пронорана с вазотропной и нейрометаболической терапией не имела преимуществ перед монотерапией исследуемым препаратом [20, 21].
В рамках наиболее крупного российского несравнительного исследования терапию Пронораном получали более 2 тыс. пациентов в возрасте от 50 до 94 лет (средний возраст 64,9±8,3 года) с диагнозом «дисциркуляторная энцефалопатия первой или второй стадии» и с легкими или умеренными когнитивными нарушениями. Все пациенты принимали Проноран в течение трех месяцев. По мнению лечащих врачей, в 2/3 случаев отмечалось значительное или умеренное улучшение когнитивных и других неврологических функций [22]. По некоторым данным, величина терапевтического эффекта дофамин- и норадренергической терапии в отношении недементных когнитивных расстройств может быть больше, чем у других активно используемых в клинической практике вазотропных и нейрометаболических препаратов. В исследовании ФУЭТЕ наблюдались 189 пациентов, из них 139 женщин и 57 мужчин, в возрасте от 42 до 82 лет (средний возраст 63,6 ± 8,5 года) с когнитивными расстройствами, не достигающими выраженности деменции, на фоне артериальной гипертензии и церебрального атеросклероза. Лечение пациентов проводилось различными препаратами, при этом представители терапевтических групп не отличались по возрасту, уровню образования и клиническим особенностям основного заболевания. На фоне проводимой терапии отмечался регресс как субъективных, так и объективных когнитивных расстройств во всех сравниваемых терапевтических группах. При этом выраженность субъективного улучшения и объективная динамика когнитивных тестов на фоне применения Пронорана после двух месяцев терапии были достоверно больше по сравнению с вазотропной и нейрометаболической терапией (рис. 1) [23].
Регресс когнитивных расстройств, по данным специальных тестов, является главным критерием эффективности проводимой терапии. Однако, как уже отмечалось выше, многие пациенты с умеренными когнитивными нарушениями, в первую очередь сосудистой природы, предъявляют также жалобы на головную боль, несистемное головокружение, шум, тяжесть или иные неприятные ощущения в голове, повышенную утомляемость и нарушения сна. Эти жалобы имеют одну природу и связаны как с когнитивной недостаточностью, так и с изменениями в эмоциональном статусе пациентов на начальной стадии хронической сосудистой мозговой недостаточности Они существенно снижают качество жизни пациентов и часто являются основной причиной обращения к неврологу. Поэтому динамика субъективных неврологических симптомов у пациентов с синдромом умеренных нейрокогнитивных нарушений сосудистой этиологии на фоне проводимой терапии крайне важна для оценки значимости клинического эффекта и степени влияния терапии на повседневную жизнь пациентов. Регресс субъективных неврологических симптомов в наибольшей степени способствует приверженности терапии.
В исследовании Н.Н. Яхно и соавт. (2006) 29 пациентов с диагнозом «умеренные когнитивные нарушения» на фоне дисциркуляторной энцефалопатии первой-второй стадии получали Проноран в течение трех месяцев [24]. При этом не использовались какие-либо другие вазотропные или нейрометаболические препараты. На фоне лечения Пронораном достоверно уменьшались частота и выраженность головной боли, головокружения, утомляемости и субъективного ощущения забывчивости (рис. 2). Об ослаблении субъективных неврологических симптомов на фоне применения Пронорана сообщали и другие авторы [17, 18]. Таким образом, дофамин- и норадренергическая терапия способствует значительному улучшению самочувствия пациентов, а следовательно, повышает качество жизни и приверженность проводимым лечебным мероприятиям. Можно резюмировать, что к настоящему времени Проноран зарекомендовал себя как эффективное лекарственное средство, улучшающее когнитивные способности и самочувствие у пациентов с начальными стадиями органических церебральных заболеваний без деменции. В отличие от болезни Паркинсона, при которой используются существенно большие дозы, при недементных когнитивных нарушениях Проноран назначается в дозе 50 мг/сут один раз в день. Рекомендуемая длительность терапии — не менее трех месяцев.
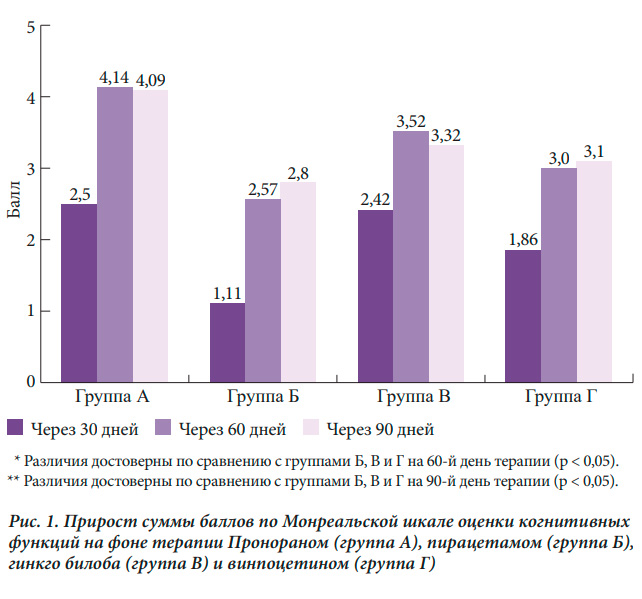
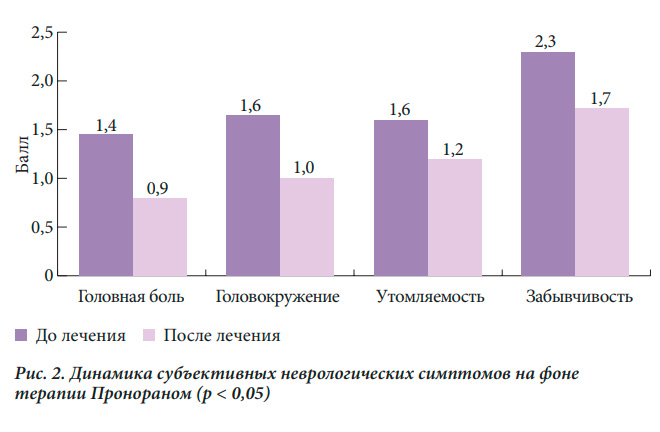
Литература
Diagnostic and statistical manual of mental diseases. V ed. (DSM-V). London: American Psychiatric Association, 2013.
2. Jelic V., Kivipelto M., Winblad B. Clinical trials in mild cognitive impairment: lessons for the future // J. Neurol. Neurosurg. Psychiatry. 2006. Vol. 77. № 4. P. 429–438.
3. Knopman D.S. Current treatment of mild cognitive impairment and Alzheimer’s disease // Curr. Neurol. Nerosci. Rep. 2006. Vol. 6. № 5. P. 365–371.
4. Kurshner H.S. Mild cognitive impairment: to treat or not to treat? // Curr. Neurol. Neurosci. Rep. 2005. Vol. 5. № 6. P. 455–457.
5. Яхно Н.Н. Когнитивные расстройства в неврологической клинике // Неврологический журнал. 2006. Т. 11. Приложение № 1. С. 4–12.
6. Jessen F., Amariglio R.E., van Boxtel M. et al. A conceptual framework for research on subjective cognitive decline in preclinical Alzheimer’s disease // Alzheimer’s Dement. 2014. Vol. 10. № 6. P. 844–852.
7. Яхно Н.Н., Преображенская И.С., Захаров В.В. и др. Распространенность когнитивных нарушений при неврологических заболеваниях (анализ работы специализированного амбулаторного приема) // Неврология, нейропсихиатрия, психосоматика. 2012. № 2. С. 30–34.
8. Яхно Н.Н., Захаров В.В., Локшина А.Б. Синдром умеренных когнитивных нарушений при дисциркуляторной энцефалопатии // Журнал неврологии и психиатрии им. С.С. Корсакова. 2005. Т. 105. № 2. С. 13–17.
9. Яхно Н.Н., Захаров В.В., Локшина А.Б. Нарушения памяти и внимания в пожилом возрасте // Журнал неврологии и психиатрии им. С.С. Корсакова. 2006. Т. 106. № 2. С. 58–62.
10. Яхно Н.Н., Левин О.С., Дамулин И.В. Сопоставление клинических и МРТ-данных при дисциркуляторной энцефалопатии. Сообщение 2: когнитивные нарушения // Неврологический журнал. 2001. Т. 6. № 3. С. 10–19.
11. Вознесенская Т.Г. Некогнитивные нервно-психические расстройства при когнитивных нарушениях в пожилом возрасте // Неврологический журнал. 2010. Т. 15. № 2. С. 4–18.
12. www.mocatest.org.
13. DeKeyser J., Herregodts P., Ebinger G. The mesoneocortical dopamine neuron system // Neurology. 1990. Vol. 40. № 11. Р. 1660–1662.
14. Aston-Jones G., Rajkowsky J., Cohen J. Role of locus coeruleus in attention and behavioral flexibility // Biol. Psychiatry. 1999. Vol. 46. № 9. P. 1309–1320.
15. Bäckman L., Ginovart N., Dixon R. et al. Age-related cognitive deficits mediated by changes in the striatal dopamine system // Am. J. Psychiatry. 2000. Vol. 157. № 4. P. 635–637.
16. Volkow N., Wang G., Fowler J. et al. Parallel loss of presynaptic and postsynaptic dopamine markers in normal aging // Ann. Neurol. 1998. Vol. 44. № 1. P. 143–147.
17. Bille J., Bukiwsky J.V., de Ferron A. et al. Decline cerebral et therapeutique: une etude clinique multicenrique de Trivastal 50 retard en Neuro-Geriatrie // Psych. Med. 1986. Vol. 18. P. 609–626.
18. Scholing W.E. A double-blind study using psychometric tests Trivastal versus a reference compound // Temp. Medical. 1982. P. 114b.
19. Nagaraia D., Jayashree S. Randomized study of the dopamine receptor agonist piribedil in the treatment of mild cognitive impairment // Am. J. Psychiatry. 2001. Vol. 158. № 9. P. 1517— 1519.
20. Захаров В.В. Всероссийская программа исследований эпидемиологии и терапии когнитивных расстройств в пожилом возрасте («Прометей») // Неврологический журнал. 2006. Т. 11. № 2. С. 27–32.
21. Захаров В.В. Распространенность и лечение когнитивных нарушений в неврологической клинике (Результаты Всероссийского исследования «ПРОМЕТЕЙ») // Consilium Medicum. 2008. Т. 10. № 2. С. 114–117.
22. Захаров В.В. Дофаминергическая и норадренергическая терапия когнитивных нарушений // Журнал неврологии и психиатрии им. С.С. Корсакова. 2006. Т. 106. № 9. С. 43–47.
23. Яхно Н.Н., Захаров В.В., Страчунская Е.А. и др. Лечение недементных когнитивных нарушений у пациентов с артериальной гипертензией и церебральным атеросклерозом // Неврологический журнал. 2012. № 4. С. 49–55.
24. Захаров В.В., Локшина А.Б. Применение препарата «Проноран» (пирибедил) при легких когнитивных расстройствах у пожилых больных с дисциркуляторной энцефалопатией // Неврологический журнал. 2004. Т. 9. № 2. С. 30–35
Разработка принципов индивидуализации психотерапии тесно связана с выявлением и конкретизацией релевантных психотерапевтических «мишеней» [1–3]. Особый интерес в этом отношении представляет патологическая тревога, которая является центральным компонентом многих психопатологических состояний. Большинство специалистов сходятся во мнении, что генез тревоги при психических расстройствах различен. В самых общих чертах ее возникновение связывают с тремя основными источниками [4]: с реальной внешней угрозой и психической травмой (реалистическая и стрессовая тревога), с дисбалансом между ситуационными факторами, самооценкой и самоконтролем (ситуационная и невротическая тревога) и, наконец, с несогласованностью психофизиологических стилей реагирования между собой и неконгруэнтностью требованиям социального контроля (личностная, моральная и обсессивная тревога).
В русле когнитивной теории все указанные варианты тревоги могут быть сведены к представлениям о когнитивном диссонансе, возникающем в результате неполного осознания и использования индивидуумом дезадаптивных когнитивных стратегий. Это, в свою очередь, проявляется в так называемых ошибках суждений, или когнитивных искажениях, которые сопряжены с неправильной интерпретацией индивидуумом смысловых контекстов. Устойчивость таких искажений характерна для целого ряда психопатологических состояний, а их коррекция через более или менее полное осознание во многом определяет суть психотерапии как метода лечения. Именно поэтому большинство психотерапевтических подходов адресуется к когнитивно-смысловым процессам [5].
Между тем психологические механизмы возникновения когнитивных искажений, характерных для разных видов тревоги, неодинаковы. Это необходимо учитывать при индивидуализированном подходе к лечению тревожных расстройств, и, соответственно, объективация тревожных переживаний и их когнитивно-смысловых «источников» может оказаться весьма полезной в практическом отношении. Для их выявления нередко используют опросники, нацеленные на обнаружение когнитивных искажений [6, 7]. В литературе описано несколько таких инструментов: Dysfunctional Attitude Scale, DAS, (A. N. Weissman, A. T. Beck, 1978); Automatic Thoughts Questionnaire, ATQ (S. D. Hollon, P. C. Kendall, 1980); Cognitive Errors Questionnaire, CEQ (M. F. Lefebvre, 1981); Cognitive Mistakes Questionnaire, CMQ (A. Freeman, R. DeWolf, 1992); Cognitive Distortion Scale, CDS (J. Briere, 2000); Inventory of Cognitive Distortions, ICD (C. L. Yurica, 2002). Из них только CMQ (Опросник когнитивных ошибок, ОКО) переведен на русский язык [8]. Однако русскоязычная версия указанного теста не валидизирована и ее психометрические характеристики остаются неизученными.
Цель настоящего исследования состояла в апробации и клиническом изучении русскоязычной версии ОКО [8]. Выбор теста для клинического применения был обусловлен его доказанной практической ценностью, а также стабильностью форм патологической тревоги, депрессии и поведенческих расстройств, выделяемых с его помощью в различных культурно-языковых средах [9].
МАТЕРИАЛЫ И МЕТОДЫ
С применением ОКО были обследованы 204 пациента с тревожно-депрессивными расстройствами, обратившихся за амбулаторной психотерапевтической помощью в Московский НИИ психиатрии. Среди этих пациентов, представлявших основную группу, было 125 женщин и 79 мужчин. Возраст испытуемых составлял от 18 до 62 лет (в среднем — 35,5 ± 11,8 года), 78 человек имели среднее и 126 — высшее образование.
В клиническом отношении состояние обследованных больных определяли следующие ведущие диагнозы: депрессивный эпизод легкой степени (n = 32), паническое расстройство (n = 37), агорафобия с паническим расстройством и без него (n = 24), генерализованное тревожное расстройство (n = 39), обсессивно-компульсивное расстройство (n = 22), соматоформное расстройство (n = 12), расстройство адаптации (n = 26), специфические расстройства личности (неустойчивого и тревожно-зависимого вариантов; n = 12).
В исследование включались пациенты с наличием клинически выраженных проявлений патологической психической тревоги в форме панических приступов, фобий, тревожных опасений, стрессовой тревоги, а также тревоги ожидания.
Критериями исключения являлись расстройства шизофренического спектра, депрессивные эпизоды тяжелой степени, алкогольная или наркотическая зависимость, соматические заболевания в стадии декомпенсации.
Обследование с помощью ОКО прошли также 96 психически здоровых испытуемых контрольной группы: 62 женщины и 34 мужчины в возрасте от 18 до 59 лет (в среднем — 32,1 ± 8,8 года).
Все обследованные дали добровольное информированное согласие на участие в исследовании.
Опросник когнитивных ошибок. Оригинальная версия ОКО включает 50 пунктов; каждый из них имеет четыре градации, в соответствии с которыми испытуемый оценивает свойственность ему того или иного утверждения. Пункты образуют 10 субшкал (по 5 пунктов в каждой), характеризующих выделенные с помощью факторного анализа когнитивные «источники» тревоги: «Преувеличение опасности», «Катастрофизация», «Долженствование», «Чтение мыслей», «Персонализация», «Категоричность», «Максимализм», «Доверие критику», «Сравнение с другими», «Самоуверенность» [8]. При проведении настоящего исследования из данного опросника были исключены пункты, составляющие субшкалу «Самоуверенность», которые отражают завышенную самооценку, идеи собственной исключительности и непогрешимости. Таким образом, в апробируемый тест вошли 45 пунктов, а максимальное количество баллов, которое мог набрать испытуемый, равнялось 180.
1. Ретестовую надежность опросника оценивали посредством определения достоверности различий и силы корреляционной связи между пунктами, субшкалами и суммарными баллами по тесту в двух замерах на одной и той же выборке испытуемых (применяли W-критерий Вилкоксона для связанных выборок и коэффициент ранговых корреляций Спирмена). В тестировании участвовали 25 представителей контрольной группы: 17 женщин и 8 мужчин в возрасте 23–39 лет (в среднем — 26,0 ± 3,3 года) с высшим и неоконченным высшим образованием. Период между первичным и повторным опросами составлял от 1 до 2 месяцев.
2. Согласованность пунктов, или гомогенность, ОКО определяли с помощью вычисления коэффициента альфа Кронбаха на смешанной выборке из 300 человек.
3. Диагностическую чувствительность, специфичность и эффективность теста оценивали путем ROC-анализа суммарного балла ОКО у испытуемых основной (n = 204) и контрольной (n = 96) групп. Метод ROC-анализа представляет собой аналог бинарной классификации с применением ROC-кривой (англ. receiver operating characteristic — рабочая характеристика приемника). Отрезная точка была выбрана таким образом, чтобы соблюдался баланс между чувствительностью и специфичностью (определяли минимальную разность между максимальной долей истинно положительных результатов и максимальной долей истинно отрицательных результатов).
4. Изучение внутренней структуры и выделение субшкал ОКО осуществляли на основе факторного анализа с варимакс-вращением, проводившегося по результатам тестирования 204 пациентов с патологической тревогой.
5. Интеркорреляционную (внешнюю) валидность теста изучали посредством анализа корреляций между суммарным баллом, субшкалами ОКО и шкалами теста ММИЛ («Методика многостороннего исследования личности» [10]) на выборке из 115 пациентов основной группы.
РЕЗУЛЬТАТЫ
Ретестовая надежность и внутренняя согласованность
Из 45 пунктов теста по 43 пунктам результаты первичного и повторного тестирования не показали достоверных различий; неустойчивыми оказались два утверждения: «Во мне силен дух соревнования» (пункт 27) и «Я расстраиваюсь, когда слышу об успехах других людей» (пункт 28). Высокая корреляционная связь обнаружена между суммарными баллами первого и второго срезов: коэффициент ранговой корреляции Спирмена равен 0,7635. Таким образом, полученные данные подтвердили ретестовую надежность ОКО.
Коэффициент альфа Кронбаха составил 0,895, что является показателем высокой согласованности утверждений, свидетельствующим в пользу валидности ОКО.
Диагностическая эффективность теста
Результаты ROC-анализа представлены на диаграмме (рис.). Площадь под ROC-кривой (англ. area under curve, AUC) составила 0,886, что указывает на очень хорошее диагностическое качество модели. В основной группе 77,7% пациентов имели истинно положительные результаты (чувствительность теста). В группе контроля у 89,8% здоровых лиц были получены истинно отрицательные результаты (специфичность теста) [11, 12]. Значение отрезной точки по суммарному баллу ОКО составило 93.
Рис. ROC-кривая суммарного балла Опросника когнитивных ошибок у пациентов с тревожно-депрессивными расстройствами (n = 204) и в группе контроля (n = 96)
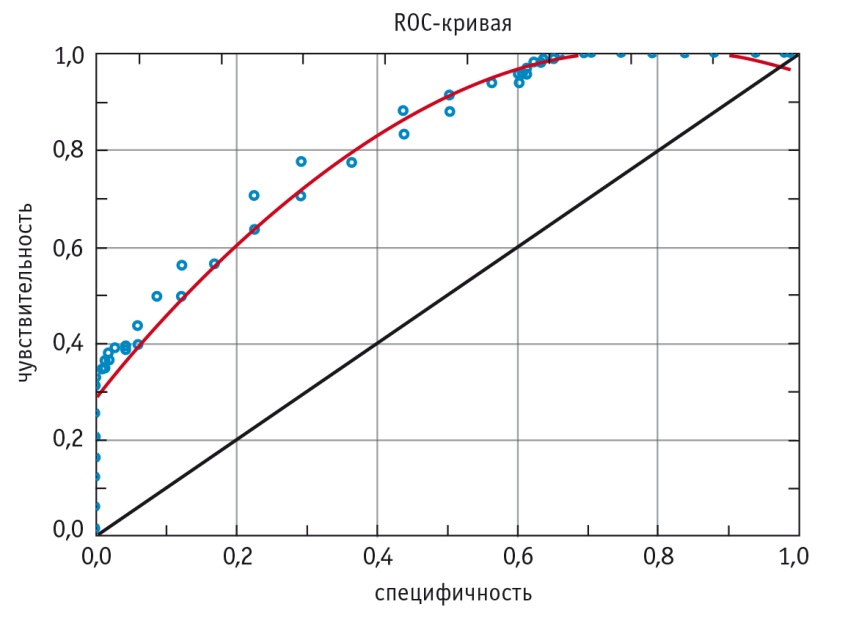
Результаты факторного анализа и интерпретация выделенных факторов
Для изучения когнитивных «источников» тревоги по алгоритмам факторного анализа с варимакс-вращением были обработаны данные тестирования 204 пациентов с расстройствами тревожно-депрессивного спектра. В результате выделены девять факторов, не идентичных субшкалам разработчиков теста по набору утверждений и содержанию (табл. 1).
Таблица 1
Факторная структура Опросника когнитивных ошибок
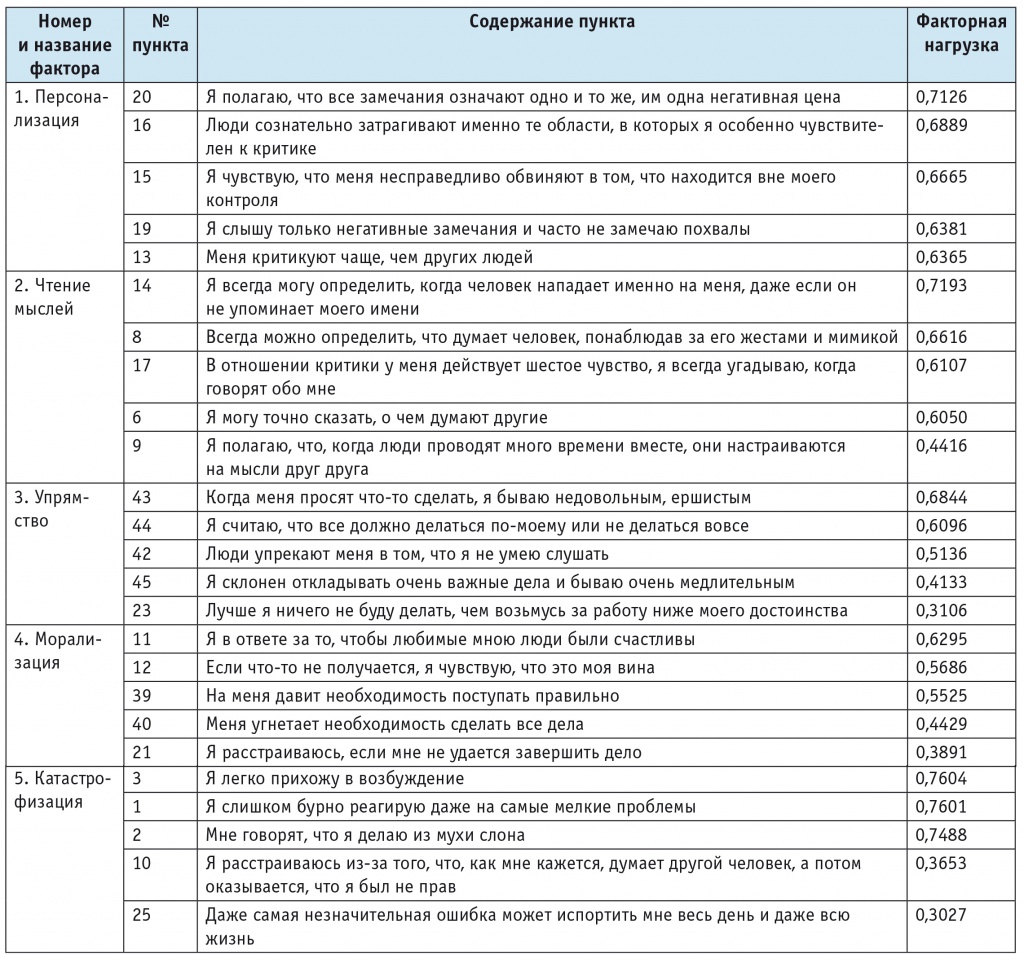
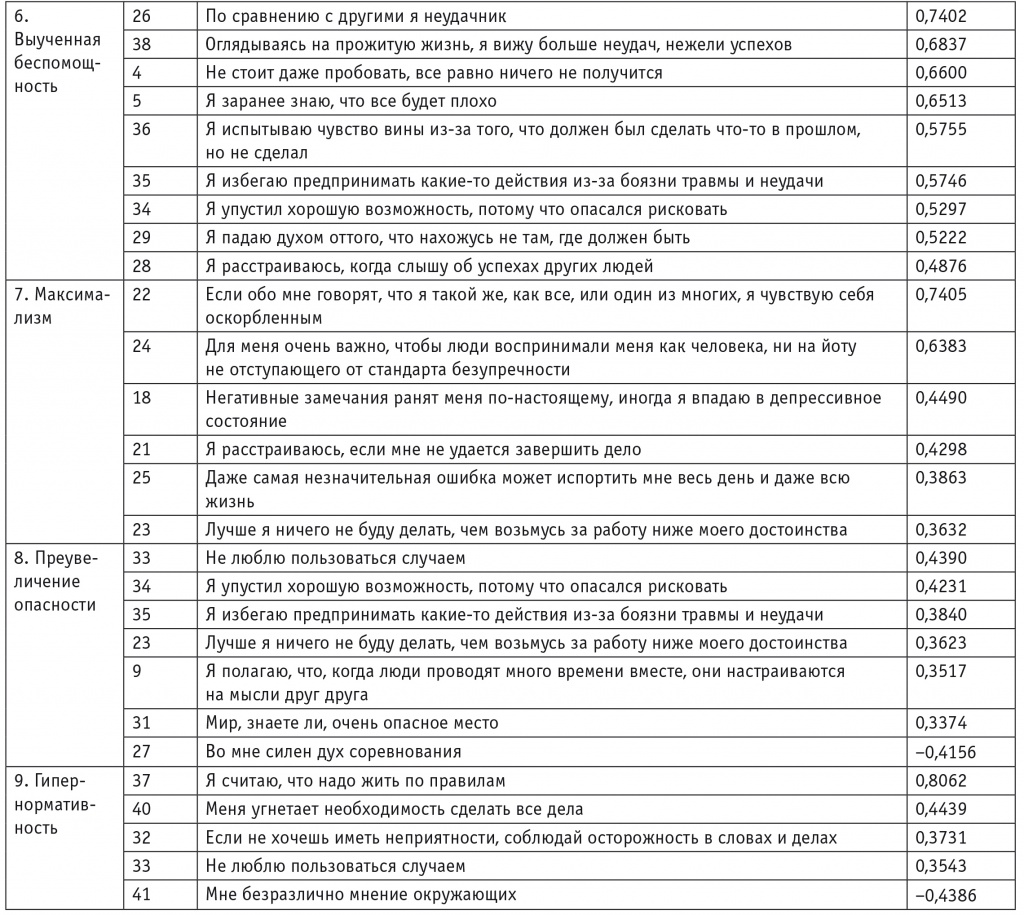
1. Персонализация. Ожидание враждебного и неодобрительного отношения к себе; любое несогласие или замечание воспринимаются как отвержение, подавление или унижение. Пункты: 20, 16, 15, 19, 13. Проявления: фиксация на критических замечаниях и несогласии с другими, обидчивость, недоверие и настороженность, ожидание негативно пристрастного отношения к себе, упреков, обмана, отвержения и унижения со стороны других.
2. Чтение мыслей. Склонность приходить к недостаточно логически обоснованным выводам; тенденция «додумывать» за других людей, опираясь на субъективные ожидания, интуитивные оценки и проекции. Пункты: 14, 8, 17, 6, 9. Проявления: односторонние, как правило, негативные суждения о намерениях, поступках и оценках других людей; неумение логически и с различных сторон рассмотреть причины и обстоятельства поведения окружающих.
3. Упрямство. Настойчивое стремление отстаивать свою самооценку, связанное со страхом ошибиться, эгоцентрическая иерархизация и сужение проблемного поля. Пункты: 43, 44, 42, 45, 23. Проявления: негибкость суждений, преобладание эгоцентрических защитных суждений и бездействия, склонность явно или скрыто оспаривать мнение и предложения других людей «из принципа», отождествляя себя с предметом спора.
4. Морализация. Декларирование повышенной моральной ответственности, стремление к обеспечению безопасности за счет морального контроля над окружающими. Пункты: 11, 12, 39, 40, 21. Проявления: преобладание моральных суждений и оценок в восприятии явлений и людей, представляющих потенциальное неудобство или опасность.
5. Катастрофизация. Склонность преувеличивать значимость проблем и бурно на них реагировать, как правило, вследствие прямого столкновения идеализированных представлений о себе и окружающих с реальностью. Пункты: 3, 1, 2, 10, 25. Проявления: обостренное, негативно преувеличенное реагирование на проблемы, выражающееся в нереалистичном ожидании угрозы жизни, здоровью, благосостоянию, общественному статусу, в потере доверия и в уверенности в обмане со стороны других; склонность к аффективно-шоковым и диссоциативным реакциям.
6. Выученная беспомощность. Обесценивание собственного «я», принижение своих возможностей и способностей, сопряженное со стремлением снять с себя ответственность за жизненные неудачи, и декларирование пессимистической установки. Пункты: 26, 38, 4, 5, 36, 35, 34, 29, 28. Проявления: повторяющееся очевидное обесценивание своих возможностей, положения и достижений, стремление к поиску защиты и покровительства, декларирование своей слабости и беспомощности как оправдание неудач и нежелания активно преодолевать имеющиеся затруднения.
7. Максимализм. Амбициозность и крайность в оценках, потребность в восхищении, выражающаяся через нарциссическую безупречность. Пункты: 22, 24, 18, 21, 25, 23. Проявления: крайность в суждениях, тенденция преувеличивать свои достижения и упрекать окружающих в их недооценке, комплекс Золушки (фрустрация ожиданий восхищения как награды за трудолюбие и безупречность), обесценивание других за лень и необязательность.
8. Преувеличение опасности. Уклонение от непредвиденных обстоятельств, избегание рисков, ответственности и соперничества вследствие преувеличения опасностей. Пункты: 33, 34, 35, 23, 9, 31 и 27 (с отрицательным значением). Проявления: самоограничения и повышенный самоконтроль со ссылками на многочисленные или преувеличенные опасности, неблагоприятные обстоятельства и/или недоброжелательное отношение; избегающая осторожность и пассивность.
9. Гипернормативность. Отождествление себя с социальными нормами, перфекционизм, стремление обезопасить себя за счет тщательного следования нормам и социальным предписаниям. Пункты: 37, 40, 32, 33 и 41 (с отрицательным значением). Проявления: безусловная и не всегда критичная приверженность правилам, нормам поведения и этикету, исполнительность и тщательность, избыточная вежливость и аккуратность во взаимоотношениях, тенденция к вынесению оценок исходя из принятых в данной группе социальных нормативов.
Из таблицы 2 видно, что суммарный балл ОКО коррелировал на среднем уровне с оценочными шкалами F («Достоверность») и K («Конформность»), а также с 6-й («Паранойяльность»), 7-й («Психастения»), 8-й («Аутизация») и в меньшей степени с другими клиническими шкалами ММИЛ. Практически все субшкалы ОКО статистически значимо коррелировали с клиническими шкалами ММИЛ, при этом наиболее выраженную взаимосвязь со шкалами ММИЛ имел показатель «Выученная беспомощность» ОКО. Важно отметить хороший уровень корреляции субшкалы «Персонализация» ОКО со шкалами F, K и 6-й шкалой ММИЛ, субшкалы «Катастрофизация» — со шкалами F, K, 6 и 7, а субшкалы «Максимализм» — со шкалами F, K и 6, 7, 8.
Таблица 2
Корреляция между шкалами теста «Методика многостороннего исследования личности» (ММИЛ) и факторами Опросника когнитивных ошибок на выборке пациентов с расстройствами тревожно-депрессивного спектра (n = 115)
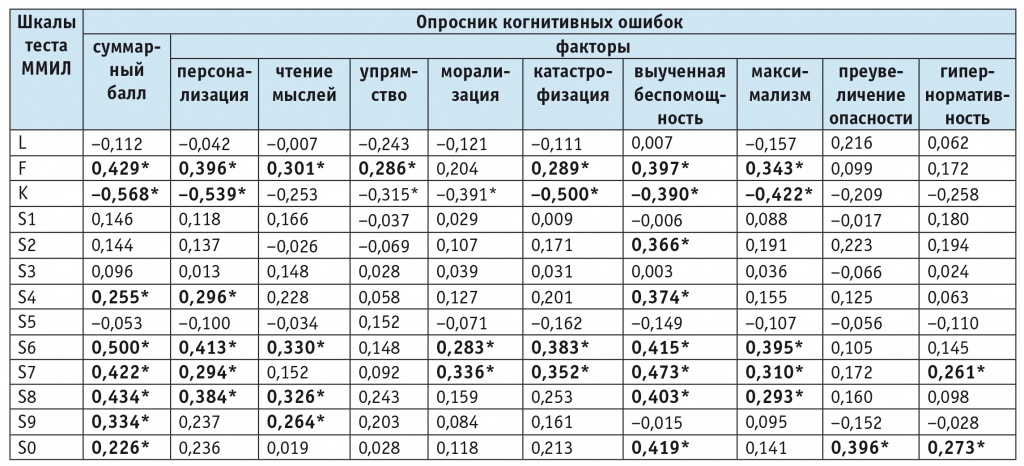
* Уровень значимости коэффициента корреляции р < 0,05 (ранговая корреляция Спирмена).
Примечание. L — шкала лжи; F — «Достоверность»; K — «Конформность»; S1 — «Соматизация»; S2 — «Депрессия»; S3 — «Демонстративность»; S4 — «Протест/Импульсивность»; S5 — «Полоролевые интересы»; S6 — «Паранойяльность»; S7 — «Психастения»; S8 — «Аутизация»; S9 — «Гипомания»; S0 — «Социальная включенность».
Меньший, но статистически значимый уровень корреляций отмечался между субшкалой «Чтение мыслей» ОКО и шкалами F, 6, 8 и 9 («Гипомания») ММИЛ, а также между субшкалой «Упрямство» и шкалами F и К. Следует также обратить внимание на наличие значимой отрицательной корреляции субшкалы «Морализация» ОКО со шкалой К ММИЛ. Что касается субшкал «Преувеличение опасности» и «Гипернормативность», то указанные субшкалы ОКО статистически значимо коррелировали с 0-й («Социальная включенность») шкалой ММИЛ. Субшкала «Гипернормативность» была также связана с 7-й шкалой ММИЛ.
В результате факторного анализа ОКО состав утверждений вновь выделенных факторов-субшкал был изменен. С целью изучения диагностических характеристик каждой из этих субшкал был проведен ROC-анализ на смешанной выборке с определением отрезной точки, разделяющей показатели пациентов с аффективными и поведенческими расстройствами и испытуемых контрольной группы (табл. 3). Общий балл по каждой субшкале вычисляли путем суммирования баллов, присвоенных испытуемым каждому утверждению, вошедшему в шкалу (по алгоритму: никогда — 1 балл; иногда — 2 балла; часто — 3 балла; всегда — 4 балла). Для двух утверждений (27 и 41) применяли обратный алгоритм подсчета (всегда — 1 балл; часто — 2 балла; иногда — 3 балла; никогда — 4 балла), так как они вошли в факторы-субшкалы с отрицательным знаком. Из таблицы 3 видно, что все субшкалы обладают удовлетворительными предсказательными качествами: от средних до отличных.
Таблица 3
Результаты ROC-анализа субшкал Опросника когнитивных ошибок (ОКО) в смешанной выборке из пациентов с аффективными и поведенческими расстройствами (n = 204) и испытуемых группы контроля (n = 96)
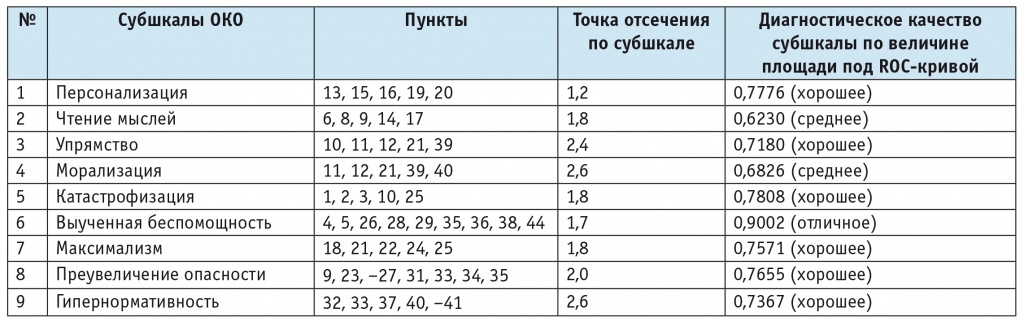
ОБСУЖДЕНИЕ
В ходе исследования установлены ретестовая надежность ОКО (коэффициент ранговой корреляции Спирмена между суммарными баллами первого и второго срезов составил 0,7635), а также внутренняя согласованность этого теста (коэффициент альфа Кронбаха равен 0,895). При сопоставлении ОКО с ММИЛ подтверждена его валидность.
Следует особо остановиться на факторной структуре русскоязычной версии ОКО и содержательной интерпретации входящих в него субшкал. В результате анализа выделены девять факторов-субшкал. Семь из них: «Катастрофизация», «Преувеличение опасности», «Максимализм», «Персонализация», «Чтение мыслей», «Морализация» («Долженствование» в оригинальной версии), «Упрямство» (близкий по набору утверждений к субшкале «Категоричность» в оригинальной версии) — по содержанию и, частично, по набору утверждений были аналогичны субшкалам первоначальной версии теста [8]. Два фактора («Выученная беспомощность» и «Гипернормативность») оказались характерны только для русскоязычной выборки, а два фактора из англоязычной версии («Доверие критику» и «Сравнение с другими») в полученную факторную структуру не вошли. Два пункта не вошли ни в один из факторов: 7 («Мои близкие должны знать, чего я хочу») и 30 («Мне кажется, что если хочешь добиться успеха, то надо постоянно сравнивать себя с другими»).
Хорошая корреляция субшкалы «Выученная беспомощность» с целым рядом шкал теста ММИЛ указывает на то, что данная субшкала отражает типичную для невротических состояний несбалансированность самовосприятия и самооценки. Это сопровождается ограничительным поведением (корреляция с 7-й шкалой ММИЛ), социальной изоляцией (корреляция с 0-й шкалой), настороженностью и параноидными проекциями (корреляция с 6-й шкалой), отчужденностью и деперсонализацией (корреляция с 8-й шкалой). Кроме того, при увеличении общего балла по данной субшкале ОКО отмечаются протест (корреляция с 4-й шкалой ММИЛ), блокада побуждений (корреляция со 2-й шкалой), а также поиск помощи и тенденция преувеличивать тяжесть своего состояния (положительная корреляция со шкалой F и отрицательная — со шкалой K).
Положительная корреляция субшкалы «Персонализация» с 6-й шкалой ММИЛ и ее негативная корреляция со шкалой K свидетельствуют о полном соответствии этой субшкалы содержанию (недоверчивость, настороженность, скептицизм и склонность преувеличивать выраженность межличностных конфликтов). Аналогичная ситуация прослеживается и с субшкалой «Катастрофизация», которая положительно коррелирует с 6-й и 7-й шкалами ММИЛ, а также со шкалой F и негативно — со шкалой K (страх, тревога, повышенная осторожность, поиск помощи и склонность преувеличивать межличностные затруднения). Близкий характер соотношений наблюдается также между субшкалой «Максимализм» и шкалами ММИЛ. Однако эта субшкала, в отличие от субшкалы «Катастрофизация», коррелирует также с 8-й шкалой ММИЛ, что указывает на своеобразие оценок и восприятие реальности, присущее лицам, склонным выносить крайние суждения.
Положительные корреляции субшкалы «Чтение мыслей» с 6-й, 8-й и 9-й шкалами, а также со шкалой F ММИЛ представляются естественными, поскольку эта субшкала отражает тенденцию делать недостаточно обоснованные выводы, опираясь на субъективные ожидания и проекции. То же можно сказать и о субшкале «Преувеличение опасности», которая коррелирует с 0-й шкалой ММИЛ, что свидетельствует о тенденции к социальному избеганию.
Субшкалы ОКО «Морализация» и «Гипернормативность» коррелируют с 7-й шкалой ММИЛ. При этом «Морализация» одновременно дает положительную корреляцию с 6-й шкалой и отрицательную — со шкалой K, что указывает на связанную с ней аффективную ригидность и отрицание конформного поведения, тогда как «Гипернормативность» положительно коррелирует с 0-й шкалой ММИЛ, что свидетельствует об ассоциированных с ней затруднениях в социальных контактах.
Субшкала «Упрямство» — единственный параметр ОКО, который коррелирует только с оценочными шкалами F и K. Это является подтверждением того, что данная субшкала отражает оценочную установку, определяемую как склонность отстаивать правильность своего поведения, игнорируя социальные стереотипы и усугубляя межличностное противостояние.
Выводы
1. Установлены высокая надежность, валидность и гомогенность русскоязычной версии ОКО. В результате ROC-анализа определен оптимальный диагностически значимый уровень суммарного балла (отрезная точка теста).
2. Изучена внутренняя факторная структура этого теста, на основании чего выделены девять субшкал ОКО. Продемонстрированы их хорошая чувствительность и специфичность, определены критерии диагностической значимости для каждой из субшкал.
3. Обнаружены статистически значимые корреляционные связи между выделенными субшкалами ОКО и шкалами теста ММИЛ, что подтверждает внешнюю валидность ОКО и его субшкал.
4. Наиболее сильную связь со шкалами ММИЛ обнаружили субшкалы ОКО, характеризующие когнитивные искажения по типу выученной беспомощности, персонализации, чтения мыслей, катастрофизации и максимализма.
ЗАКЛЮЧЕНИЕ
Опросник когнитивных ошибок (ОКО) апробирован на смешанной русскоязычной выборке испытуемых и показал высокие надежность, валидность и внутреннюю согласованность. Субшкалы и суммарный балл ОКО обнаружили хорошие диагностические качества, эффективность при разграничении между пациентами с патологической тревогой и здоровыми лицами. ОКО может быть рекомендован к дальнейшим исследованиям на клинических выборках, а также как инструмент для изучения динамики состояния в ходе психотерапии и повышения метакогнитивных способностей пациентов.
В статье рассматриваются причины и клинические симптомы когнитивной дисфункции при депрессии. Отмечается, что когнитивные нарушения оказывают неблагоприятное влияние на качество жизни пациентов и их повседневную активность. Подробно обсуждаются методы диагностики и лечения когнитивных нарушений при депрессии. Когнитивные расстройства могут сохраняться после достижения ремиссии и регресса эмоциональных нарушений, поэтому у пациентов с депрессией необходимо тщательно исследовать когнитивную сферу и учитывать ее состояние при выборе терапевтической тактики.
Таблица 1. Диагностические критерии депрессии по Международной классификации болезней 10-го пересмотра
Рисунок. Механизмы формирования когнитивной дисфункции при депрессии
Таблица 2. «Холодные» и «горячие» симптомы депрессии
Таблица 3. Методы исследования когнитивных функций при депрессии
Введение
Депрессия представляет собой одно из наиболее распространенных психических расстройств, которое встречается в практике не только психиатра, но и невролога, терапевта и врачей других специальностей. По данным эпидемиологических исследований, риск развития депрессии в течение жизни составляет до 10% у мужчин и до 20% у женщин [1, 2].
Среди неврологических и терапевтических пациентов распространенность депрессии существенно выше, чем в популяции в целом. Так, согласно Российской эпидемиологической программе КОМПАС (2004), частота депрессивных расстройств в общемедицинской практике варьирует от 24 до 64% [3–5]. При этом приблизительно в половине случаев депрессия достигает значительной выраженности.
В неврологической практике депрессия обычно сопутствует хроническим болевым синдромам (головной боли, боли в спине), сосудистым заболеваниям головного мозга, нейродегенеративным заболеваниям с преимущественным поражением подкорковых базальных ганглиев, рассеянным склерозом, эпилепсией и др. Следует отметить: достигнуть значительного успеха в лечении основного неврологического заболевания практически невозможно без коррекции коморбидных эмоциональных нарушений.
Депрессия оказывает крайне негативное влияние на все стороны жизни пациентов и нередко их ближайших родственников. В наибольшей степени страдает качество жизни, так как любой человек воспринимает повседневную действительность исключительно через призму собственных эмоций. Наличие эмоциональных нарушений неизбежно приводит к утрате или снижению трудоспособности.
Из-за высокой распространенности и негативного влияния на трудоспособность депрессия относится к одним из наиболее дорогостоящих для общества заболеваний. Так, по данным фармакоэкономических исследований, в США ежегодный ущерб от депрессии оценивается приблизительно в 83 млрд долларов [6], а в странах Евросоюза – в 75 млрд евро [7]. Наибольшие экономические потери обусловлены отсутствием пациента на рабочем месте (абсентеизмом) или снижением из-за наличия депрессии производительности труда несмотря на формальное присутствие работника (презентеизмом) [6, 7]. В результате депрессии теряется в среднем 27 рабочих дней на одного работника в год. Из них 18 дней (две трети) обусловлены презентеизмом и только девять дней (треть) – абсентеизмом [6]. Предполагается, что снижение производительности труда на рабочем месте обусловлено главным образом когнитивными проблемами. Об этом говорят сами пациенты, которые указывают на снижение умственных способностей как на главную причину понижения производительности труда. Аналогичные результаты были получены в европейском исследовании на материале 21 000 пациентов из шести стран. По мнению респондентов, снижение внимания и умственной работоспособности обусловливает до 25% общего негативного воздействия депрессии на психосоциальные функции [9].
Распространенность когнитивных нарушений при депрессии
Депрессия – это психическое расстройство, характеризующееся триадой симптомов (триада Крепелина): подавленным настроением или тоской, идеаторной и двигательной заторможенностью [10]. Как видно из данного определения, когнитивный компонент вносит существенный вклад в общую картину депрессии, что находит отражение в описании клинических симптомов и диагностических критериев депрессии (табл. 1).
В последние годы когнитивному аспекту депрессии уделяется особое внимание. Показано, что коррекция когнитивных расстройств имеет первостепенное значение для нормализации повседневного функционирования пациентов при достижении ремиссии, в частности для восстановления нарушенной трудоспособности [8].
По данным опроса пациентов с установленным диагнозом депрессии, трудности концентрации и снижение умственной работоспособности ощущаются ими почти все время. И даже несмотря на нормализацию эмоционального состояния во время ремиссии, пациенты нередко продолжают испытывать когнитивные затруднения, что мешает в работе и повседневной жизни [8]. Эти данные подтверждают автономность когнитивных расстройств, что необходимо учитывать при выборе тактики лечения депрессии. Таким образом, достижение удовлетворительного уровня повседневного функционирования невозможно без восстановления нормального уровня умственной работоспособности пациента, то есть без дополнительного воздействия на когнитивную составляющую.
По данным первой российской лаборатории нарушений памяти на базе Клиники нервных болезней им. А.Я. Кожевникова, тревога и депрессия являются третьей после цереброваскулярной патологии и нейродегенеративного процесса причиной умеренного когнитивного расстройства в российской популяции, отвечая за 5% случаев этого синдрома [11].
Причины когнитивной дисфункции при депрессии
Развитие когнитивной дисфункции при депрессии имеет как психологические, так и биологические (нейрохимические, морфологические, патофизиологические) предпосылки.
Когнитивные трудности у пациентов с депрессией могут быть связаны с негативным влиянием эмоционального состояния на способность к корректному распределению внимания (нарушение избирательности внимания). Так, пациент с депрессией может быть всецело поглощен своим эмоциональным переживанием, которое довлеет над ним, занимая в его мыслях центральное положение, в то время как восприятие, обработка, анализ и запоминание иной информации, не относящейся к содержанию эмоциональных переживаний пациента, закономерно нарушаются. Так и здоровые люди существенно хуже воспринимают и запоминают маловажную для них информацию по сравнению с восприятием и запоминанием значимой и эмоционально окрашенной информации.
Негативное влияние на когнитивные процессы оказывает снижение мотивации, которое закономерно развивается у пациентов с депрессией. Снижение мотивации неизбежно влечет за собой снижение активности познавательной деятельности, что в конечном итоге отрицательно сказывается на общей результативности решения когнитивных задач [12].
Депрессия сопровождается снижением синтеза и активности церебральных нейротрансмиттеров, что считается на сегодняшний день ключевым нейрохимическим механизмом формирования эмоциональных нарушений (моноаминовая гипотеза депрессии) (рисунок). Описывается снижение синтеза и активности в головном мозге таких медиаторов, как серотонин, норадреналин, дофамин. Указанные изменения, безусловно, могут приводить не только к эмоциональной, но и к когнитивной дисфункции. В частности, дофаминергические системы головного мозга (мезокортикальный дофаминергический путь) играют важную роль в распределении и переключении внимания и осуществлении когнитивного контроля за выполнением намеченной программы (так называемые управляющие функции головного мозга). Активация норадренергической системы необходима для более эффективного запоминания информации, поступающей от органов чувств. Серотонинергическая система головного мозга участвует в формировании мотивации для познавательной деятельности. Таким образом, снижение синтеза и активности дофамина, норадреналина и серотонина, наблюдаемое при депрессии, можно рассматривать как нейрохимический субстрат для формирования когнитивного синдрома [13].
Кроме того, депрессия способствует активации гипоталамо-гипофизарно-надпочечниковой системы, что приводит к повышенной активности стероидных гормонов. Последнее негативно влияет на процессы нейрогенеза и нейропластичности головного мозга, способствует активизации связанных с возрастом церебральных атрофических изменений [7, 14]. Действительно, в ряде работ с применением морфометрических методов было показано, что депрессия часто ассоциируется с более выраженными атрофическими изменениями в медиальной височной области и гиппокампе [15]. Указанные изменения могут лежать в основе снижения способности к запоминанию новой информации, что наблюдается у пациентов с депрессией [12–15].
Современные исследования с применением методов функциональной нейровизуализации (позитронно-эмиссионная и функциональная магнитно-резонансная томография) свидетельствуют, что когнитивные симптомы депрессии сопровождаются метаболическими изменениями в структурах, интегрированных в замкнутые лобно-подкорковые функциональные системы (фронто-стриарные круги). Изменения фиксируются в орбитальных и дорзолатеральных отделах лобной коры, полосатых телах, амигдалярных ядрах и др. Приведенные данные сближают патофизиологию когнитивных расстройств при депрессии и так называемых подкорковых деменциях (болезни Паркинсона, сосудистом поражении мозга, связанном с лейкоареозом, и др.). Следует отметить: феноменологически отмечается существенное сходство между когнитивной дисфункцией при депрессии и заболеваниях с преимущественным поражением подкорковых базальных ганглиев или белого вещества головного мозга [16–19].
Особого внимания заслуживает тот факт, что некоторые изменения метаболизма критических церебральных структур (полосатых тел, амигдалярного ядра) отмечались и у клинически здоровых лиц, генетически предрасположенных к развитию рекуррентной депрессии. Это еще раз подчеркивает независимость друг от друга эмоциональных и когнитивных осей депрессии, что должно учитываться при планировании терапии в каждом конкретном случае [20].
Характерное осложнение депрессии – нарушение сна. Вторичная, то есть связанная с эмоциональным расстройством, инсомния также может вносить свой вклад в формирование когнитивной дисфункции при депрессии, поскольку во сне завершается процесс обработки и консолидации в памяти информации, полученной в течение дня. Недостаточность сна приводит к снижению активации коры головного мозга со стороны стволово-подкорковых структур. Клинически это будет проявляться снижением концентрации внимания, активности и темпа познавательной деятельности, что, как уже говорилось выше, весьма характерно для депрессии [21].
Клинические проявления когнитивной дисфункции при депрессии
В настоящее время принято выделять «холодные» и «горячие» когнитивные симптомы депрессии (табл. 2) [22]. К «холодным» симптомам относятся когнитивные расстройства при работе с эмоционально индифферентной информацией. При этом отмечается снижение активности и скорости познавательной деятельности: все когнитивные процессы (восприятие, обработка, анализ, преобразование, передача информации) осуществляются в замедленном темпе [23–27]. Пациенты становятся медлительными, любая мнестическая, интеллектуальная и двигательная активность требует у них больше времени, чем в норме. У них быстрее развивается усталость, что часто находит свое отражение в жалобах на повышенную утомляемость при умственной работе.
Другая характерная жалоба – трудность сосредоточения или трудность поддержания должного уровня внимания в течение необходимого времени. Объективно при нейропсихологическом исследовании отмечается нарушение нейродинамики когнитивных процессов. Согласно А.Р. Лурии, под термином «нейродинамика» понимают степень активации коры головного мозга со стороны стволово-подкорковых структур [28, 29]. Снижение нейродинамики проявляется увеличением времени реакции на внешние стимулы, снижением концентрации внимания и повышенной отвлекаемостью от проводимой интеллектуальной работы. Для диагностики нейродинамических расстройств используются методики, в которых учитывается время выполнения интеллектуальных заданий. Широко применяются исследование литеральных ассоциаций (назвать за минуту как можно больше слов на букву С), проба Шульте, тест связи цифр и букв, часть А [30].
Еще одним типичным «холодным» когнитивным симптомом депрессии является недостаточность управляющих функций лобных долей головного мозга [23–27, 31]. К управляющим функциям относится способность планировать и контролировать познавательную деятельность и собственное поведение (синонимы: регуляторные функции, исполнительные функции, регуляция произвольной деятельности). При депрессии чаще страдает способность к планированию. Нарушается также способность к переключению внимания с текущего этапа когнитивного процесса на следующий этап (снижение подвижности когнитивных процессов, инертность). Из-за этого может снижаться темп когнитивных процессов, однако преимущественно только в тех ситуациях, когда требуется изменить привычную парадигму деятельности. Могут отмечаться персеверации. Считается, что в основе снижения подвижности когнитивных процессов лежит дисфункция дорзолатеральной лобной коры. Одной из наилучших нейропсихологических методик для выявления когнитивной инертности считается тест связи цифр и букв. Сопоставляется время выполнения первой и второй части данного теста (части А и части Б). Пропорциональное увеличение времени выполнения обеих частей теста характерно для снижения нейродинамики когнитивных процессов (дисфункция стволово-подкорковых структур), а диспропорциональное увеличение времени выполнения второй части теста (часть Б) свидетельствует об инертности когнитивных процессов (дисфункция дорзолатеральной лобной коры) [30].
К «холодным» проявлениям когнитивной дисфункции при депрессии относится также нарушение памяти. Пациенты жалуются на повышенную забывчивость, которая может мешать в работе, повседневных бытовых делах, обучении. По данным нейропсихологических методов исследования, в основе нарушений памяти при депрессии лежит недостаточность воспроизведения при относительной сохранности запоминания и хранения информации. Об этом свидетельствует относительная мягкость мнестических расстройств, которые почти никогда не распространяются на текущие или отдаленные события жизни, эффективность подсказок при воспроизведении, сохранная способность к опознанию ранее полученной информации в пробах с предоставлением пациенту множественного выбора [23–27].
Когнитивные расстройства при депрессии могут иметь как объективный, так и преимущественно субъективный характер. Под объективными когнитивными нарушениями понимаются расстройства, которые подтверждаются выходящими за нормы результатами нейропсихологических тестов. О преимущественно субъективных когнитивных расстройствах говорят в тех случаях, когда пациенты предъявляют жалобы когнитивного характера (повышенная забывчивость, трудность сосредоточиться, повышенная утомляемость при умственной работе), но результаты нейропсихологических тестов остаются в пределах нормы для данного возраста и уровня образования. Следует подчеркнуть: преимущественно субъективные когнитивные расстройства имеют не меньшее значение, чем объективные, так как снижают качество жизни пациентов и по меньшей мере в ряде случаев отражаются на эффективности их функционирования на работе и в социально-бытовой сфере. Причиной преимущественно субъективного характера когнитивных нарушений может быть высокий преморбидный интеллектуальный уровень пациента. В этом случае он может осознавать свое когнитивное снижение по сравнению с тем, что было раньше, оставаясь формально в пределах среднестатистической возрастной и образовательной нормы. В других случаях субъективные когнитивные расстройства объясняются повышенной тревогой, которая часто сопровождает депрессию: пациент может испытывать существенное беспокойство по поводу небольшой забывчивости, присущей подавляющему большинству людей (например, «пришел в комнату не помню зачем», «не помню, что куда положил», «забываю фамилии и имена неблизких знакомых») [30, 32, 33].
К «горячим» когнитивным симптомам депрессии относится преимущественное перераспределение внимания пациента на негативную или отрицательно эмоционально окрашенную информацию [22]. Так, если пациенту предложить определить эмоциональное выражение лица на рисунке, он быстрее опознает грустное выражение лица по сравнению с веселым или нейтральным выражением. Кроме того, грустное лицо привлечет внимание пациента на более длительный срок. Аналогичным образом отрицательно окрашенная информация запоминается пациентами с депрессией гораздо лучше, чем положительно окрашенная или нейтральная [34–36]. По некоторым наблюдениям, элементы «горячих» когнитивных расстройств отмечаются у клинически здоровых (то есть без депрессии) лиц, генетически предрасположенных к рекуррентному аффективному расстройству [19]. Эти данные позволяют предположить, что изменения в когнитивной сфере могут быть не только осложнением депрессии или параллельным симптомом, но и причиной возникновения депрессии (пациент замечает и запоминает только негативную информацию, поэтому склонен к формированию депрессивных реакций).
Диагностика и дифференциальная диагностика когнитивных нарушений при депрессии
С учетом значения когнитивных нарушений для повседневного функционирования и качества жизни пациентов наличие депрессии является показанием для объективного исследования когнитивных функций. Вместе с тем речь идет о депрессии не только на момент врачебной консультации, но и в анамнезе, так как изменения в когнитивной сфере могут сохраняться у таких пациентов, несмотря на достижение ремиссии в эмоциональной сфере.
Единственным методом объективной оценки когнитивных функций является нейропсихологическое тестирование. Исходя из клинических особенностей когнитивного синдрома депрессии предпочтительны такие нейропсихологические методики, как тест литеральных ассоциаций, тест «Символы и цифры», тест связи цифр и букв, пробы на запоминание и воспроизведение вербального и зрительного материала (табл. 3) [30].
Когнитивные нарушения у пациента с депрессией могут быть связаны с сопутствующим заболеванием, что особенно вероятно у пациентов пожилого и старческого возраста. Как известно, самая распространенная причина когнитивных расстройств в пожилом возрасте – болезнь Альцгеймера на начальных стадиях в подавляющем большинстве случаев сопровождается тревогой и депрессией. Однако клинические особенности когнитивных расстройств в этом случае будут принципиально иными. Уже на начальных стадиях болезни Альцгеймера на первый план выступают нарушения памяти, обусловленные недостаточностью запоминания. В то же время мнестические расстройства выражены в значительно большей степени, чем при первичной депрессии, характеризуются неэффективностью подсказок при воспроизведении, нарушением опознания информации в пробах с множественным выбором (так называемый гиппокампальный тип нарушений памяти). Память на текущие и недавние события в этих случаях страдает в большей степени, чем память на отдаленные события [37–39].
Гораздо труднее провести дифференциальную диагностику когнитивных расстройств в структуре депрессии и в структуре заболеваний с клиникой «подкорковых» когнитивных расстройств (заболевания с поражением подкорковых базальных ганглиев, дисциркуляторная энцефалопатия, рассеянный склероз). Как уже говорилось выше, феноменологических различий между когнитивным синдромом депрессии и «подкорковыми» когнитивными расстройствами не существует, так как в основе и того и другого лежит общий субстрат – дисфункция фронто-стриарных кругов. При этом заболевания с клиникой «подкорковых» когнитивных нарушений почти облигатно сопровождаются депрессией или апатией [40, 41]. Однако с практической точки зрения дифференциальный диагноз между когнитивными расстройствами в рамках депрессии и заболеваниями с поражением подкорковых структур не имеет принципиального значения: во всех случаях требуется лечение как депрессии, так и когнитивной дисфункции. В то же время устранение депрессии не ведет автоматически к полному регрессу когнитивных расстройств даже у пациентов с первичной депрессией.
Лечение когнитивных нарушений при депрессии
Учитывая результаты последних исследований, следует признать устаревшей традиционную рекомендацию при коморбидных когнитивных и эмоциональных расстройствах «сначала лечить депрессию». Более оправдана тактика одновременной терапии как когнитивных, так и эмоциональных нарушений. Если депрессия не является единственной или основной причиной когнитивных расстройств (например, у пациентов с начинающейся болезнью Альцгеймера или хронической цереброваскулярной патологией), параллельно следует назначать антидепрессанты и ацетилхолинергические и/или глутаматергические препараты. Если же когнитивная дисфункция связана преимущественно с депрессией, то необходимости в одновременном назначении антидепрессанта и препаратов, улучшающих когнитивные функции, нет. Однако при выборе антидепрессанта следует учитывать его влияние на когнитивную сферу.
Трициклические антидепрессанты (амитриптилин, имипрамин, нортриптилин), как известно, обладают выраженным холинолитическим эффектом и поэтому могут вызывать когнитивную дисфункцию или усиливать уже имеющиеся когнитивные нарушения. В этой связи препараты из данной фармакологической группы нежелательно назначать пациентам с депрессией и выраженной когнитивной дисфункцией и пациентам пожилого возраста независимо от наличия и выраженности когнитивных симптомов.
Несколько слабее данный эффект выражен у тетрациклических антидепрессантов (например, у миансерина). Однако у пациентов с депрессией и когнитивными нарушениями более предпочтительным является назначение селективных ингибиторов обратного захвата серотонина или ингибиторов обратного захвата серотонина и норадреналина. Данные препараты не только не усиливают когнитивных расстройств, но, напротив, способствуют уменьшению их выраженности. При этом быстрее и в большей мере откликаются на антидепрессивную терапию так называемые «горячие» когнитивные симптомы депрессии (преимущественная фокусировка внимания на отрицательно эмоционально окрашенной информации). По некоторым наблюдениям, положительная динамика в сфере «горячих» когнитивных симптомов предшествует регрессу собственно эмоциональных расстройств [42]. Этот факт также косвенно свидетельствует о роли когнитивной дисфункции в формировании депрессии в целом.
Наиболее перспективны у пациентов с депрессией и когнитивными расстройствами антидепрессанты с мультимодальным механизмом, которые воздействуют одновременно на несколько фармакологических мишеней. Именно поэтому большие надежды для практического применения в настоящее время связаны с препаратом из новой группы антидепрессантов мультимодального действия вортиоксетином/vortioxetine (Бринтелликс/Brintellix) (получил одобрение в Европе и США, но в России пока не зарегистрирован).
Бринтелликс не только угнетает обратный захват серотонина в структурах головного мозга, но и оказывает непосредственное влияние на постсинаптические рецепторы к серотонину. Это действие разнонаправлено в отношении различных типов рецепторов. Бринтелликс является антагонистом 5-НТ3-, 5-НТ7- и 5-НТ1D-рецепторов, агонистом 5-НТ-1А-рецепторов и частичным антагонистом 5-НТ-1В-рецепторов. С воздействием на постсинаптические рецепторы к серотонину связана способность Бринтелликса модулировать активность других нейротрансмиттерных систем. Показано, что на фоне его применения увеличивается внеклеточное содержание таких нейромедиаторов, как ацетилхолин, норадреналин, дофамин и гистамин [43–46]. Вероятно, этот эффект лежит в основе благоприятного влияния Бринтелликса на когнитивные функции. Кроме того, в эксперименте показана активация на фоне использования Бринтелликса синтеза нейрональной РНК и белков, которые лежат в основе процессов нейропластичности [47]. Применение Бринтелликса способствует также модуляции активности ГАМКергической и глутаматергической активности головного мозга, чем обусловлен анксиолитический эффект препарата [48].
Положительный эффект Бринтелликса в отношении когнитивных функций показан как в экспериментальных [49–52], так и в клинических работах [53–54]. Так, в большом двойном слепом рандомизированном исследовании (n = 301) на фоне назначения Бринтелликса в дозе 5 мг/сут пожилым пациентам с депрессией было зафиксировано достоверное улучшение концентрации внимания и памяти по сравнению с плацебо [53].
В другом крупном исследовании (n = 591), также проведенном согласно всем принципам доказательной медицины, на фоне использования Бринтелликса было продемонстрировано улучшение памяти, концентрации внимания и управляющих лобных функций. В данном исследовании изучались две схемы применения препарата: 10 и 20 мг/сут. Обе дозировки имели преимущество по сравнению с плацебо в отношении когнитивных показателей. При этом положительная динамика в мнестической сфере была более выраженной при использовании меньшей дозы препарата (10 мг/сут) [54].
Еще одна работа была посвящена сопоставлению эффективности Бринтелликса и дулоксетина у пациентов с депрессией и когнитивными жалобами (n = 392). Терапия и тем и другим препаратом имела преимущество перед плацебо в отношении субъективного осознания когнитивных расстройств: выраженность жалоб когнитивного характера на фоне антидепрессивной терапии достоверно регрессировала. Однако объективные показатели когнитивных функций претерпели положительную динамику лишь на фоне использования Бринтелликса (в дозе 10–20 мг/сут) [55].
Важными преимуществами Бринтелликса являются безопасность его применения, в том числе у пожилых пациентов, и хорошая переносимость. Самым частым побочным эффектом терапии была тошнота: она отмечалась у небольшой части пациентов, была легкой или умеренной по выраженности и носила преходящий характер, не требующий приостановки или отмены терапии.
По своему основному (антидепрессивному) эффекту Бринтелликс не уступает другим препаратам из группы селективных ингибиторов обратного захвата серотонина и ингибиторов обратного захвата серотонина и норадреналина, о чем свидетельствуют результаты восьми двойных слепых плацебоконтролируемых рандомизированных исследований, в которых участвовали в общей сложности 4186 пациентов [56].
Заключение
Нарушения когнитивных функций – важная составляющая клинической картины депрессии – оказывают неблагоприятное влияние на качество жизни пациентов и их повседневную активность, в том числе трудовую деятельность. Нет прямых корреляций между выраженностью когнитивных и эмоциональных нарушений. Когнитивные расстройства могут оставаться после достижения ремиссии и регресса собственно эмоциональных нарушений. В этой связи у пациентов с депрессией необходимо тщательно исследовать когнитивную сферу и учитывать ее состояние при выборе терапевтической тактики.
Когнитивные нарушения при аффективных расстройствах. Способы диагностики и возможности коррекции
Янушко М.Г.1, Шаманина М.В1,Киф Р.2, Шипилин М.Ю.2
1ФГБУ «Санкт-Петербургский научно-исследовательский психоневрологический институт имени В.М. Бехтерева»
2 Duke UniversityMedicalCenter, USA
Резюме. Пациенты, страдающие депрессиями в рамках биполярного и рекуррентного аффективных расстройств, часто испытывают когнитивный дефицит как в период обострений, так и в ремиссиях. В обзоре приведен анализ возможностей влияния психофармакотерапии на степень выраженности когнитивных нарушений у данной когорты больных. Рассмотрены подходы к диагностике когнитивных нарушений при аффективных расстройствах, учитывающие особенности депрессивных пациентов с точки зрения доказательной медицины.
ММА имени И.М. Сеченова
Психические расстройства, прежде всего когнитивные и эмоциональные нарушения, являются одним из наиболее частых проявлений органических заболеваний головного мозга. В тех случаях, когда нарушения памяти и других когнитивных функций выражены настолько, что препятствуют осуществлению профессиональной и социальной деятельности в прежнем объеме и качестве, принято говорить о деменции. Особенно часто деменция отмечается в пожилом возрасте. Согласно популяционным исследованиям от 5 до 20% пожилых лиц имеют деменцию. Деменция и преддементные когнитивные расстройства регулярно сочетаются с эмоциональными нарушениями, прежде всего в виде депрессивных и тревожно-депрессивных расстройств [22].
Безусловными лидерами в списке причин деменции у пожилых являются болезнь Альцгеймера и сосудистая мозговая недостаточность. Хронические прогрессирующие формы церебральной недостаточности сосудистой этиологии традиционно обозначаются в отечественной литературе термином дисциркуляторная энцефалопатия (ДЭ) [15]. Патогенез ДЭ является весьма сложным и связан как с хронической гипоперфузией головного мозга, так и с повторными острыми нарушениями мозгового кровообращения, а также, в ряде случаев – с ликвородинамическими нарушениями и вторичным нейродегенеративным процессом [3–5,29,34].
«Феномен разобщения» в патогенезе психических нарушений при ДЭ
Ведущую роль в формировании когнитивной недостаточности при ДЭ играет поражение глубинных отделов белого вещества головного мозга и базальных ганглиев, что приводит к нарушению связи лобных головного мозга и подкорковых структур (феномен разобщения). Механизм формирования разобщения связывается в первую очередь с артериальной гипертензией и представляется следующим. Хроническая неконтролируемая артериальная гипертензия приводит к вторичным изменениям сосудистой стенки – липогиалинозу, который развивается преимущественно в сосудах микроциркуляторного русла. Развивающийся вследствие этого артериолосклероз приводит к изменению физиологической реактивности сосудов. В этих условиях снижение кровяного давления в результате присоединения сердечной недостаточности со снижением сердечного выброса или в результате избыточной гипотензивной терапии, или в результате физиологических циркадных изменений кровяного давления приводит к возникновению гипоперфузии в зонах терминального кровообращения. К последним относятся указанные выше глубинные церебральные структуры [9,23,26,37].
Острые ишемические эпизоды в бассейне глубоких пенетрирующих артерий приводят к возникновению небольших по диаметру лакунарных инфарктов в глубинных отделах головного мозга. При неблагоприятном течении артериальной гипертензии повторные острые эпизоды приводят к возникновению т.н. лакунарного состояния, которое является одним из вариантов мультиинфарктной сосудистой деменции [25,29]. Помимо повторных острых нарушений, предполагается и наличие хронической ишемии в зонах терминального кровообращения. Маркером последней является резрежение перивентрикулярного или субкортикального белого вещества – лейкоареозис, который патоморфологически представляет собой зону демиелинизации, глиоз и расширение периваскулярных пространств [9,23,26,32]. В некоторых случаях неблагоприятного течения артериальной гипертензии возможно подострое развитие диффузного поражения белого вещества головного мозга с клиникой быстро прогрессирующей деменции и других проявлениях разобщения, что иногда обозначается в литературе термином болезнь Бинсвангера [30].
Нейропсихологические проявления «феномена разобщения»
Ведущую роль в формировании когнитивных нарушений при сосудистой мозговой недостаточности играет разобщение лобных долей и подкорковых образований, что приводит к возникновение вторичной дисфункции лобных долей головного мозга. Лобные доли имеют очень существенное значение в когнитивной деятельности. Согласно теории А.Р. Лурия, которая разделяется в настоящее время подавляющим большинством нейропсихологов, лобные доли отвечают за регуляцию произвольной деятельности: формирование мотивации, выбор цели деятельности, построение программы и контроль за ее достижением [10–12]. При этом дорзолатеральная лобная доля коры и ее связи с стриарным комплексом обеспечивают переключаемость внимания, что необходимо для смены алгоритма деятельности. Орбитофронтальные отделы участвуют в подавлении нерелевантных цели побуждений, обеспечивая таким образом устойчивость внимания и адекватность поведенческих реакций. Кроме того, орбитофронтальная лобная кора находится в тесной взаимосвязи с гиппокампом, обеспечивая устойчивость внимания в мнестической деятельности [13,37].
Дисфункция лобных долей головного мозга приводит к формированию дизрегуляторного синдрома. При этом сохраняются операциональные механизмы памяти, восприятия, двигательные и языковые навыки, но нарушается программирование деятельности: развивается патологическая инертность, связанная с недостаточностью переключаемости внимания либо, напротив, избыточная импульсивность вследствие неустойчивости произвольного внимания, либо различные их сочетания [10–12].
Другие патогенетические механизмы когнитивных нарушений
Помимо поражения глубинных церебральных структур и возникновения феномена разобщения со вторичной дисфункцией лобных отделов головного мозга, в патогенезе когнитивных нарушений несомненную роль играют инфаркты мозга корковой локализации. Стратегически важными для когнитивной деятельности являются ассоциативные зоны лобной коры и зоны стыка теменно-височно-затылочной коры, а также структуры гиппокампового круга. В некоторых случаях возможно возникновение постинсультной деменции, связанной с перенесенным единичным крупноочаговым инфарктом мозга стратегической локализации [4, 32, 40].
Не менее важным аспектом патогенеза когнитивных расстройств при ДЭ является присоединение нейродегенеративного процесса. Согласно патоморфологическим данным, сосуществование сосудистых изменений и маркеров нейродегенерации альцгеймеровского характера (сенильные амилоидные бляшки, нейрофибриллярные внутриклеточные сплетения, апоптоз нейронов медибазальных лобых отделов, гиппокампа и височно-теменных долей головного мозга) не является редким. В этих случаях принято говорить о смешанном сосудисто-дегенеративном характере деменции. Частота встречаемости смешанной деменции значительно превосходит ожидаемую при случайном совпадении двух болезней. Этот факт имеет теоретическое объяснение: гипоксия является фактором, ускоряющим нейродегенеративные изменения, причем особенно чувствительны к гипоксии нейроны гиппокампа [27]. Поэтому, сосудистая мозговая недостаточность расценивается в настоящее время как фактор риска и один из патогенетических механизмов развития болезни Альцгеймера. Таким образом, по крайней мере у части больных существенный вклад в развитие когнитивных расстройств вносит сопутствующий дегенеративный процесс [34, 36].
Патогенез эмоциональных нарушений при ДЭ
Достаточно сложным и разнородным представляется патогенез депрессивных симптомов при ДЭ и их взаимосвязь с когнитивными расстройствами. Во–первых, эмоциональные нарушения, как и когнитивные, могут быть результатом вторичной дисфункции лобных отделов головного мозга. Известно, что связи дорзолатеральной лобной коры и стриарного комплекса участвуют в формировании положительного эмоционального подкрепления при достижении цели деятельности. Нарушение этих связей в результате феномена разобщения будет приводить к недостаточности положительного подкрепления и, как следствие, к хронической фрустрации, что является предпосылкой возникновения депрессии [13, 38].
Депрессивные симптомы регулярно описываются при поражении лобных долей головного мозга различной этиологии [13]. Однако следует иметь в виду, что некоторые проявления лобной дисфункции могут имитировать депрессию в отсутствие истинного снижения фона настроения. Речь идет о мотивационных расстройствах вследствие нарушения связей цингулярной извилины и лимбической системы. Хорошо известна также неустойчивость внешнего аффекта, что связанно с избыточной подвижностью произвольного внимания и снижением критики в результате дисфункции орбитофронтальной коры [10–13, 45].
Наряду с биологическими предпосылками депрессии при лобной дисфункции, несомненную роль играют также психогенные факторы. Безусловно, переживание своей нарастающей интеллектуальной и, как правило, двигательной неспособности вносит свой вклад в формирование депрессивных расстройств, по крайней мере, на ранней стадии деменции, в отсутствие выраженного снижения критики.
Наличие эмоциональных нарушений способно усугублять выраженность когнитивных расстройств из–за повышения уровня тревоги и связанных с этим трудностей сосредоточиться, неуверенности и ожидания неудачи. Таким образом, взаимосвязи когнитивных и эмоциональных нарушений достаточно сложны. Оба вида психических расстройств связаны наличием общих патогенетических факторов (феномен разобщения и лобная дисфункция), а также способны непосредственно влиять друг на друга по описанным выше психологическим механизмам [16].
Клинические характеристики когнитивных нарушений при ДЭ
Поскольку патогенез когнитивных расстройств при ДЭ гетерогенен, клинические проявления интеллектуального дефицита также неоднородны. Однако ведущим в большинстве случаев является синдром «подкорковой» деменции или преддементных когнитивных расстройтсв. Патогенез данного вида когнитивных нарушений связан с поражением глубинных отделов белого и серого вещества головного мозга по указанным выше патологическим механизмам.
Термин «подкорковая» деменция был впервые предложен M. Albert и соавт. в 1974 для обозначения когнитивных расстройств при прогрессирующем надъядерном параличе [21]. В дальнейшем, аналогичные когнитивные расстройства описывались и при других неврологических заболеваниях: болезни Паркинсона, сосудистой деменции, рассеянном склерозе и других поражениях глубинных церебральных структур. Сам термин не вполне удачен, поскольку важную роль в патогенезе «подкорковых» когнитивных расстройств играет дисфункция лобной коры. Тем не менее, этот термин состоялся с клинической точки зрения и широко применяется в литературе [26,40,49].
Подкорковая деменция характеризуется прежде всего замедленностью умственной деятельности – брадифренией: больному требуется больше, чем в норме, времени и попыток для того, чтобы решать насущные интеллектуальные задачи. Отмечается недостаточность кратковременной памяти при относительной сохранности долговременной. Такое своебразие мнестических расстройств обусловливает сохранность памяти о событиях жизни при выраженных затруднениях в обучении, при одновременной работе с несколькими источниками информации и при решении многоэтапных задач, требующих сохранности памяти о промежуточном результате деятельности. «Подкорковая» деменция характеризуется также нарушением восприятия и моторного выражения пространственных отношений, что проявляется при конструировании и в рисунке. Интеллектульная сфера характеризуется нарушением обобщений в результате недооценки условий задания и принятия импульсивных решений. В отличие от болезни Альцгеймера и локальных поражений коры головного мозга, для «подкорковых» деменций не характерны амнезия на текущие событий, апраксия, агнозия и афазия [13,21,26,40,49].
Описания когнитивных нарушений при ДЭ и сосудистой деменции в целом соответствуют упомянутой выше модели «подкорковых» деменций. Однако наличие церебральных инфарктов корковой локализации или сопутствующего нейродегенеративного процесса могут весьма модифицировать клиническую картину, добавляя в нее признаки, характерные для первичного поражения височно-теменных отделов головного мозга. Сопутствующий нейродегенеративный процесс, как правило, возникает у лиц более пожилого возраста. Клиническая картина когнитивных расстройств при этом может в большей степени напоминать болезнь Альцгеймера [3,4,13,16,18,41,49].
Клинические особенности эмоциональных нарушений при ДЭ
Наиболее типичным изменением эмоционального состояния при ДЭ является развитие депрессии. Однако, как правило, выраженность депрессивных расстройств не достигает степени большого депрессивного эпизода по критериям DSM–IV. На ранних стадиях заболевания депрессия при ДЭ носит ипохондрические черты. Выраженность ипохондрии, однако, уменьшается по мере прогрессирования сосудистой мозговой недостаточности. Тяжесть депрессивных симптомов при ДЭ зависит от стадии заболевания и выраженности неврологических нарушений. Имеется также связь с выраженностью когнитивных расстройств и наличием деменции: при этом отмечается большая выраженность депрессии [16].
Весьма любопытны данные о клинико-нейровизуализационных сопоставлениях. В работе Т.А. Янакаевой было показано, что наличие и тяжесть симптомов депрессии зависят от выраженности очаговых изменений белого вещества лобных долей головного мозга и нейровизуализационных признаков ишемического повреждения базальных ганглиев. Эти наблюдения свидетельствуют о биологической природе депрессии при ДЭ, вероятно, связанной главным образом с феноменом лобно-подкоркового разобщения [16].
Диагноз и дифференциальный диагноз сосудистой деменции
В дифференциальном диагнозе сосудистой и первично-дегенеративной деменции весьма важную роль играет сочетание когнитивных нарушений и других клинических проявлений феномена разобщения. К последним относятся псевдобульбарный синдром, олигобрадикинезия, апраксия ходьбы, постуральные и тазовые расстройства. В типичных случаях когнитивные расстройства подкоркового характера и симптомы депрессии в сочетании с вышеуказанными неврологическими нарушениями отмечаются у пожилого пациента с историей повоторных инсультов и длительно существующего сосудистого заболевания, например, гипертонической болезни или церебрального атеросклероза [3,17,18,35].
Важную роль в верификации сосудистой природы когнитивных и эмоциональных нарушений играют методы нейровизуализации: КТ и МРТ головного мозга. В настоящее время диагноз сосудистой деменции считается неправомерным без нейровизуализационного подтверждения. Типичными находками для ДЭ являются очаговые и диффузные изменения белого вещества, постишемические кисты и церебральная атрофия. По некоторым данным, выраженность изменений белого вещества коррелирует с выраженностью когнитивных и эмоциональных нарушений при ДЭ [3,9,17,18].
Фармакотерапия психических нарушений при ДЭ
Лечение когнитивных и эмоциональных нарушений при ДЭ должно быть, по возможности, этиотропным или патогенентическим. Поскольку в основе психических нарушений равно как и других симптомов ДЭ лежит сосудистое заболевание головного мозга, первоочередная задача врача – коррекция факторов риска инсульта и устранение или уменьшение выраженности хронической ишемии головного мозга. Лечение артериальной гипертензии, назначение антиагрегантов, хирургическая коррекция атеросклеротического сужения магистральных артерий, несомненно, способствует профилактике нарастания когнитивых расстройств и, по некоторым данным, уменьшению выраженности имеющегося когнитивного дефекта. Важное значение имеет также контроль гиперлипидемии, гипергликемии, лечение других соматических заболеваний [7].
Патогенетически обосновано применение препаратов с вазоактивными, нейропротективными и метаболическими свойствами. Вазоактивные препараты улучшают церебральную микроциркуляцию, воздействуя на тонус артериол и реологические свойства крови. Широко применяются на практике такие препараты, как танакан, винпоцетин, пентоксифиллин, вазобрал, блокаторы кальциевых каналов (нимодипин, циннаризин, флунаризин и др.). Данные препараты обладают способностью уменьшать выраженность когнитивных расстройств при ДЭ. При этом, как правило, наибольший эффект отмечается в наиболее подвижных когнитивных сферах, таких как напряженность внимания и память [7].
Цель применения нейропротективных препаратов – улучшить выживаемость нейронов в условиях хронической ишемии и гипоксии, что способствует вторичной профилактике нарастания выраженности когнитивных и других неврологических расстройств. Учитывая важную патогенетическую роль процессов перекисного окисления липидов в ишемическом повреждении, нейропротективным действием могут обладать препараты с антиоксидантными свойствами. Oбсуждается вероятный антиоксидантный эффект селегелина, токоферола и танакана. Наибольший клинический опыт применения при ДЭ имеется в отношении танакана, который сочетает в себе как вазоактивные, так и нейропротективные свойства. Данный препарат в ряде исследований показал способность уменьшать выраженность когнитивных, эмоциональных и субъективных симптомов ДЭ. Однако способность танакана модифицировать течение заболевания нуждается в дополнительном изучении [8,19,28,31].
Нейропротективным потенциалом обладают также препараты, уменьшающие содержание внутриклеточного кальция в нейронах, такие как нимодипин, поскольку накопление кальция усиливает энергетические процессы и способствует гибели нейронов. Симптоматический ноотропный эффект и потенциальная возможность модифицировать течение заболевания описывается также у блокатора NMDA-рецепторов акатинола мемантина [7,36].
Нейрометаболическая терапия применяется с симптоматической целью для уменьшения выраженности когнитивных и других неврологических нарушений. Кроме того, по некоторым данным, метаболическая терапия обладает возможностью модифицировать течение заболевания. Классом препаратов, специально синтезированных для применения в качестве ноотропных средств, являются ГАМК-ергические препараты: пирацетам и его модификации. Эффективность терапии во многом зависит от режима дозирования. Более целесообразно внутривенное применение в достаточно высоких дозировках [7].
В качестве нейрометаболической терапии хорошо зарекомендовал себя пептидэргический препарат церебролизин. Церебролизин содержит свободные аминокислоты и полипептиды, которые как показывают экспериментальные наблюдения, обладают нейротрофическим эффектом [2,6]. Показано, что церебролизин при внутривенном введении в дозах 15–30 мл оказывает благоприятное действие, главным образом, на когнитивные функции, способствуя улучшению концентрации внимания, мнестических функций и интеллектуальных процессов [1,14,20,35,39].
В качестве ноотропных препаратов используются ацетилхолинергические препараты, учитывая роль ацетилхолинергической медиации в процессах внимания и памяти. В настоящее время доказано, что ингибиторы ацетилхолинэстеразы, такие как ривастигмин и амиридин, улучшают когнитивные функции при деменции альцгеймеровского типа. При ДЭ и сосудистой деменции эти препараты целесообразно назначать при смешанном характере деменции с наличием сопутствующего дегенеративного процесса. Следует отметить, что ингибиторы ацетилхолинэстеразы могут усиливать выраженность депрессии. Поэтому при сочетании когнитивных и эмоциональных расстройств лечение следует начинать с коррекции симптомов депрессии. С целью усиления ацетилхолинергической медиации как при болезни Альцгеймера, так и при сосудистой деменции также используется предшественник ацетилхолина глиатилин [7, 36].
В психофармакотерапии депрессии, связанной с сосудистой мозговой недостаточностью, предпочтительнее назначение препаратов с минимальным холинолитическим эффектом, поскольку последний может способствовать усугублению тяжести когнитивных расстройств. Наиболее целесообразно применение селективных блокаторов обратного захвата серотонина, таких как флуоксетин [36]. Легкий антидепрессивный эффект при сосудистой моговой недостаточности описывается также у танакана, который может применяться при нетяжелой симптоматической депрессии, связанной с ДЭ [31].
Заключение
Таким образом, когнитивные и эмоциональные нарушения являются закономерной составной частью клинической картины дисциркуляторной энцефалопатии. В основе психических расстройств при ДЭ лежит поражение глубинных отделов полушарий головного мозга (базальных ганглиев и глубинных отделов белого вещества), связанное как с хронической гипоперфузией, так и с повторными острыми нарушениями мозгового кровообращения. Поражение глубинных церебральных отделов ведет к разобщению связей лобных отделов и подкорковых структур, что и приводит к возникновению вторичной дисфункции лобных долей головного мозга, проявлением которой являются когнитивные расстройства «подкорково-лобного» характера и симптомы депрессии. Лечение психических расстройств сосудистой этиологии должно включать как лечение основного сосудистого заболевания, так и вазоактивные, нейропротективные и метаболические препараты.
Литература:
1. Верещагин Н.В., Лебедева Н.В. Легкие формы мультиинфарктной деменции: эффективность церебролизина. //Сов.Медицина.-1991.-N.11. –c.6–8.
2. Виндиш М. Церебролизин – новейшие результаты, подтверждающие разностороннее действие лекарства.// В кн.: Третий Международный Симпозиум по Церебролизину. –1991. Москва. –С.81–106.
3. Дамулин И.В. Дисциркуляторная энцефалопатия в пожилом и старческом возрасте. //Автореферат дисс… докт.мед.наук. –М. –1997. –С.32.
4. Дамулин И.В. Сосудистая деменция. //Неврологический Ж. –1999. –Т.3. -№.4. –С.4–11.
5. Дамулин И.В., Орышич Н.А., Иванова Е.А. Нормотензивная гидроцефалия. //Неврол. Ж. –1999. –Т.4. -№.6.-С.51–56.
6. Дамулин И.В., Захаров В.В., Левин О.С., Елкин М.Н. Использование церебролизина в нейрогериатрической практике. //В сб.: Н.Н.Яхно, И.В.Дамулин (ред): Достижения в нейрогериатрии. –Москва, 1995. –Ч.1. –С.100–115.
7. Захаров В.В., Дамулин И.В., Яхно Н.Н. Медикаментозная терапия деменций. Клиническая фармакология и терапия. –1994. –Т.3. -№ 4. –С.69–75.
8. Захаров В.В., Яхно Н.Н. Применение танакана при нарушении мозгового и периферического кровообращения. //Русский Медицинский Журнал. –2001. –Т.9. -№ 15. –С.645–649.
9. Левин О.С., Дамулин И.В. Диффузные изменения белого вещества (лейкоареоз) и проблема сосудистойй деменции. //В кн. под ред. Н.Н.Яхно, И.В.Дамулина: Достижения в нейрогериатрии. –1995. –Ч.2. –С.189–231.
10. Лурия А.Р. Высшие корковые функции человека. Изд.2. –Москва : издательство МГУ, 1969 г.
11. Лурия А.Р. Основы нейропсихологии. –Москва : издательство МГУ, 1973.
12. Лурия.А.Р. Лобные доли и регуляция психических процессов. –М., Изд-во Московского Университета, 1966.
13. Пилипонич А.А., Захаров В.В., Дамулин И.В. Лобная дисфункция при сосудистой деменции. //Клиническая геронтология. –2001. –Т.5. -№ 6. –С.35–41.
14. Соловьев О.И. Нейротропное действие церебролизина по данным компьютеризированной топографии и визуального анализа ЭЭГ. //В кн.: Третий Международный Симпозиум по Церебролизину. –1991. Москва.-с.61–70.
15. Шмидт Е.В. Классификация сосудистых поражений головного испинного мозга. //Ж. Невропатологии и Психиатрии. –1985. –Т.85. –С.192–203.
16. Янакаева Т.А. Эмоционально-аффективные нарушения при дисциркуляторной энцефалопатии и болезни Паркинсона. //Автореферат дисс… канд.мед.наук. –М. –1999.
17. Яхно Н.Н., Левин О.С., Дамулин И.В. Сопоставление клинических и МРТ-данных при дисциркуляторной энцефалопатии. Сообщение 1: двигательные нарушения. //Неврол. Ж. –2001. –Т.6. -№.2. –С.10–16.
18. Яхно Н.Н., Левин О.С., Дамулин И.В. Сопоставление клинических и МРТ-данных при дисциркуляторной энцефалопатии. Сообщение 2: когнитивные нарушения. //Неврол. Ж. –2001. –Т.6. -№.3. –С.10–19.
19. Яхно Н.Н., Дамулин И.В., Захаров В.В., Елкин М.Н., Ерохина Л.Г., Стаховская П.В., Чекнева Н.С., Суслина З.А., Тимербаева С.Л., Федин П.А., Бодарева Э.А., Скоромец А.А., Сорокоумов В.А., Ивашкин В.Т., Григорьев Ю.В., Первозванский Б.Е. Применение танакана при начальных стадиях сосудистой мозговой недостаточности: результаты открытого многоцентрового исследования. //Неврологический журнал. –1998. –Т.3. -№.6. –С.18–22.
20. Яхно Н.Н., Дамулин И.В., Захаров В.В., Левин О.С., Елкин М.Н. Опыт применения высоких доз церебролизина при сосудистой деменции. Тер Архив. –1996. –Т.68. -№ 10. –С.65–69.
21. Albert M.L. Subcortical dementia. In: Alzheimer’s disease : Senile Dementia and Related Disorders. –New York, Raven Press, 1978, V.7, pp 173–180.
22. Amaducci L., Andrea L. The epidemiology of the dementia in Europe. In: A.Culebras, J.Matias Cuiu, G.Roman (eds) : New concepts in vascular dementia . –Barselona : Prous Science Publishers, 1993, pp 19–27.
23. Awad I.A., Masaryk T., Magdinec M. Pathogenesis of subcortical hypertense lesions on MRI of the brain. //Stroke. –1993. –V.24. –P.1339–1346.
24. Cummings J.L., Benson D.F. Subcortical dementia. Review of an emerging concept. //Arch Neurol. –1984. –V.41. –P.874–879.
25. Fisher C.M. Lacunar strokes and infarcts.//Neurology. –1982. –V.32. –P.871–876.
26. Inzitari D., Marinoni M., Ginanneschi A. Pathophysiology of leucoaraiosis. // In: New concepts in vascular dementia. A.Culebras, J.Matias Guiu, G.Roman (eds). Barcelona: Prous Science Publishers. –1993. –P.103–113.
27. Iqbal K., Winblad B., Nishimura T., Takeda M., Wisniewski H.M. (eds) Alzheimer’s Disease: Biology, Diagnosis and Therapeutics John Willey and Sons Ltd, 1997, 830 p.
28. Israel L., Dell’Accio E., Martin G., Hugonot R. Extrait de Ginkgo biloba et expercises d’entrainement de la memoire. Evaluation comparative chez des personnes agees ambulatoires. //Psychol Med. –1987. –V.19. –P.1431–1439.
29. Hachinski V.C., Lassen N.A., Marshall J. Multi–infarct dementia. A case of mental deterioration in the elderly. //Lancet. –1974. –V.2.-P.207–210.
30. Hachinski V.C. Binswanger disease: neither Binswanger’s nor a disease. //J. Neur. Sci. –1991. –V.103. –P.1–13.
31. Halama P. Was leistet der Spezialextrakt (Egb 761) //Therapiewoche. –1990. –V.40. –P.3760–3765.
32. Hershey L.A., Olszewski W.A. Ischemic vascular dementia. //In: Handbook of Demented Illnesses. Ed. by J.C.Morris. –New York etc.: Marcel Dekker, Inc. –1994. –P.335–351
33. Huber S.J., Shuttleworth E.C., Paulson G.W. et al. Cortical vs subcortical dementia: neuropsychological differences. Arch Neurol. –1986. –V.43. –P.392–394.
34. Кalaria R.N., Lewis H., Cookson N.J., Shearman M. The impact of certebrovascular disease on alzheimer’s pathology in elderly. //Neurobiol. aging. –2000. –V.21.-N.1.S.-P.S.66–67.
35. Kofler B., Erhart C., Erhart P. Harrer G. A multi–dimentional approach in testing nootropic drug effects (Cerebrolysin). //Arch. Gerontol. Geriatr. –1990. –V.10. –Р.128–140.
36. Lovenstone S., Gauthier S. Management of dementia. //-Martin Dunitz Ltd. –2000. –P.145.
37. Roman G.V. Vascular dementia: NINDS – AIREN diagnostic criteria. //In: New concepts in vascular dementia. A.Culebras, J.Matias Guiu, G.Roman (eds). Barcelona: Prous Science Publishers. –1993. –P.1–9.
38. Saint–Cyr J.A., Taylor A.E., Nikolson K. Behavior and basal ganglia. //In : W.J.Weiner, A.E.Lang (eds) : «Behavioral Neurology of Movement Disorder». Adv Neurol. –1995. –V.65. –P.1–29.
39. Suchanek–Frohlich H., Wunderlich E. Uber die Wirksamkeit eines Aminosaure– Peptid– Randomisierte Doppelblind– Placebo– Vergleichsstudie. //Neuropsychiatrie. 1986. –V.1. –N.1. –P.45–48.
40. Tien R. The Dementias: Correlation of Clinical Features, Pathophisiology, and Neuroradiology. // A. J. R. –1993. –V.161. –P.245–255.
Дата публикации 7 ноября 2022Обновлено 11 марта 2023
Определение болезни. Причины заболевания
Аффективные расстройства (Аffective disorders) — это группа психических заболеваний, связанных с эмоциональной неустойчивостью и нарушением аффективных реакций.

Аффективными реакциями, или аффектом, называют эмоциональное состояние, усиленное до уровня страсти, смятённых чувств.
К аффектам относятся:
- чувство превосходства и величия (мания величия);
- сильный и длительный изматывающий страх;
- гнев и ярость;
- сильная обида и зависть;
- ревность, любовная страсть или ненависть.
Эти состояния могут быть связаны с необоснованным чувством исключительности и могущества, снижением критики к своим способностям и поведению. Аффекты и их смена доводят человека до эмоционального и иногда физического истощения, так как сопровождаются выраженными вегетативными и соматическими симптомами: колебаниями артериального давления, эпизодическим нарушением тонуса гладкой (во внутренних органах и сосудах) и скелетной мускулатуры, учащённым или иногда замедленным сердцебиением, чувством нехватки воздуха, жаром или ознобом, чувством жжения в некоторых частях тела, периодическим нарушением аппетита, болями в животе, руках, ногах, спине, голове и шее.
В психиатрии аффективные расстройства называют расстройствами настроения. Из-за временных вегетативных симптомов их часто ошибочно считают ситуативными состояниями, которые постепенно пройдут сами. Но на самом деле аффективные расстройства требуют лечения и психологической помощи: иначе у человека нарушается адаптация в семье, школе или на работе, он хуже справляется с обязанностями и проблемами.
Самые яркие и распространённые виды аффективных нарушений — это биполярное аффективное расстройство, мания и депрессия.
Биполярное аффективное расстройство (БАР) — это тяжёлое хроническое расстройство психики с нарушением настроения, которое проявляется в виде эпизодов эйфории или приподнятого настроения, возникающих при мании или гипомании, и эпизодов плохого настроения, наблюдаемых при депрессивном эпизоде [1][2][3]. Раньше это расстройство называли маниакально-депрессивным психозом или маниакальной/биполярной депрессией. Заболевание сопровождается нейропсихологическими дефицитами: неточным распознаванием эмоций и намерений других людей, ошибками и иррациональностью мышления, нарушением концентрации и внимания к деталям. Также при БАР возникает физическое недомогание и проблемы с иммунитетом [10]. Расстройство часто становится причиной инвалидности, так как может серьёзно ухудшить привычный уклад жизни, нарушить мышление и поведение.
Мания — это аффективное расстройство, для которого характерно повышенное настроение, не соответствующее обстоятельствам, увеличение объёма и темпа физической и психической активности. Манию или гипоманию (более лёгкую манию) диагностируют по таким признакам, как эйфория, речевой напор, скачка идей, сниженная потребность во сне и повышенная энергичность с признаками навязчивого поведения, которая приводит к гиперактивности [1][2][3].
Депрессия — это расстройство, которое затрагивает мысли, чувства, поведение, физическое самочувствие. Она отражается на внешнем виде человека и накладывает отпечаток на все сферы жизни: дом, работу, учёбу и другие социальные сферы [1][2][3][5][6]. Депрессия проявляется сниженным настроением — печалью, страданием, упадком духа, неспособностью радоваться, мрачностью, подавленностью, ощущением уныния. Это состояние тяжело переносится, поскольку оно непрерывно, всепроникающе и болезненно. У людей с депрессией может возникать боль в груди, в области живота, спине, суставах, костях, головные боли, может болеть любой участок или всё тело («душа болит»). Часто найти объективные причины этой боли не удаётся.
Распространённость аффективных расстройств
Расстройствами настроения в России, по разным данным, страдают 20–45 % населения, в мире — более 10 % [24][32].
БАР встречается у 2,3–2,6 % населения, у мужчин в 1,2 раза чаще, чем у женщин [7]. В последние годы распространённость заболевания увеличилась (до 2,8–6,5 %), особенно среди подростков (до 18 %). Возможно, это связано с развитием методов диагностики расстройств настроения у детей [8][10]. Чаще всего БАР выявляют в 15–24 лет и 45–54 лет, но точный возраст начала заболевания часто трудно определить из-за позднего обращения к врачу и неправильной диагностики [10][11].
Биполярное расстройство наследуется в 25 % случаев. Дети пациентов с БАР заболевают в 10–15 раз чаще, чем люди без наследственной отягощённости [6][8].
Распространённость мании за последние десятилетия XX века и в наши дни выросла примерно в 10 раз, что, с одной стороны, связано с необоснованным назначением антидепрессантов при некоторых неточно диагностированных расстройствах, с другой — с недооценкой и неправильной диагностикой симптомов мании или гипомании при эпизодах БАР или при других расстройствах [33].
Хотя бы один эпизод депрессии возникает у 8,4 % взрослых. Причём большое депрессивное расстройство (депрессия средней и тяжёлой степени) чаще встречается среди мужчин, чем среди женщин, и в основном в возрасте 18–25 лет. При наличии в прошлом неоднократных эпизодов депрессии (двух и более) в дальнейшем частота больших депрессивных эпизодов повышается до 15,9 % [12].
У детей частота депрессии увеличивается с возрастом: если в 3–11 лет она встречается в 4,4 % случаев, то в 12–17 лет — до 17 % (у девочек — 25,2 %, у мальчиков — 9,2 %) [12]. Частота средней и тяжёлой депрессии у подростков повышается при неоднократных эпизодах — до 29,9 %. Депрессивные и маниакальные/гипоманиакальные состояния у детей раннего возраста (1–3 лет) часто недооцениваются.
Причины аффективных расстройств
На развитие БАР, как и других расстройств настроения, влияют различные факторы. Среди причин выделяют сочетание наследственной предрасположенности и нарушений центральной нервной системы, которые могут возникнуть ещё внутриутробно. В течение жизни к этим причинам присоединяются различные неблагоприятные психосоциальные условия и факторы внешней среды, которые влияют на работу мозга и вызывают проявление симптомов, ранее слабовыраженных. К внешним факторам относятся негативное социально-психологическое влияние, курение, алкоголь, наркотики, инфекции и травмы.
Психосоциальные факторы. Эмоциональное насилие над ребёнком в четыре раза повышает риск развития БАР, а также способствует возникновению более тяжёлых форм — смешанных эпизодов мании и депрессии. Из-за травматических событий в детстве человек может стать эмоционально нестабильным, перестать контролировать настроение, импульсивность и периоды жестокости. Громкие крики, ругань, необдуманные решения в семье могут провоцировать развитие расстройства у ребёнка, так как он невольно будет подражать дезадаптивному поведению родителей.
Психологические стрессоры. В научных исследованиях доказана связь стрессов и последующего развития психического расстройства в ближайшие шесть месяцев. Стрессом для ребёнка может быть разлука с родителями даже на 1–2 недели, когда он остаётся с посторонними людьми (например, с подругой матери). Другими стрессорами могут быть смерть или тяжёлая болезнь близкого родственника, недавний развод или новый брак родителей [11].
А при хронических стрессорах у ребёнка перестраиваются возникающие нейросети, что повышает риск развития расстройства [8][11]. У него нарушается работа гипоталамуса, гипофиза и надпочечников, которые активируются при стрессе, повышается уровень нейротрофического фактора роста (BDNF) и цитокинов, снижается объём серого вещества поясной извилины и гиппокампа [11]. Трудно сказать, в какой степени именно плохое обращение с ребёнком приводит к развитию БАР, так как психические заболевания родителей, как фактор наследственности, также вносит вклад в развитие заболевания.
Злоупотребление психоактивными веществами. БАР часто связано с употреблением алкоголя, каннабиноидов, опиоидов, кокаина и седативных веществ [10][13]. Даже один раз употребив психоактивные вещества, в частности энергетики, подростки с предрасположенностью рискуют спровоцировать появление симптомов БАР. Предрасположенность проявляется проблемами с эмоциями и поведением в детстве, например склонностью к затяжным истерикам и возбуждённому поведению.
На развитие депрессивных расстройств также влияют:
- наследственные факторы (тяжёлая депрессия наследуется в 33–45 % случаях, однако генетический вклад при развитии депрессивных расстройств меньшей степени тяжести может быть ниже);
- различные стрессовые жизненные события (развод, переезд, военные действия, рождение ребёнка, смерть близкого родственника или друга семьи, смена работы или школы, тяжёлое соматическое заболевание и др.);
- хронические мелкие стрессоры (ссоры, эмоциональное или физическое насилие в семье, прессинг в школе, напряжённые отношения на работе);
- индивидуальные различия в реакциях на стрессоры (копинг-стратегии, нейротизм);
- факторы уязвимости: отсутствие или нехватка поддержки со стороны друзей или любимого человека, присутствие в доме более трёх детей, безработица, отсутствие глубоких религиозных убеждений;
- нарушения баланса нейромедиаторов и связей в нейросетях (баланс нарушается при всех расстройствах, где поражаются эмоции и поведение) [6][12].
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы аффективного расстройства
Симптомы БАР
Биполярное аффективное расстройство может включать в себя четыре типа эпизодов: манию, депрессию, гипоманию и смешанные маниакально-депрессивные состояния, которые одновременно включают как депрессивные, так и маниакальные/гипоманиакальные симптомы [1][2][3][5][6].
Это разные эпизоды. От их частоты и интенсивности зависит клиническая картина расстройства, поэтому у каждого человека она разная. Первый эпизод может начаться в любом возрасте, начиная с детства [34].
В периоды мании появляются следующие симптомы:
- чувство лёгкости, приподнятого, эйфорического настроения, раздражительности или обидчивости;
- повышение энергии и активности, особенно вечером и ночью;
- быстрая и напористая речь, ускоренное мышление;
- расторможенность, неугомонность, навязчивость в поведении;
- уменьшение потребности во сне;
- повышенная отвлекаемость и неспособность сосредоточиться;
- полёт и скачка идей (одна незаконченная мысль сменяется другой, мысли «перескакивают» одна с другой);
- разговор стихотворными фразами;
- идеи и планы, связанные с чувством превосходства, могущества и исключительности;
- беспричинный смех и напевание во время той или иной деятельности.
Периоды депрессии сопровождаются:
- пониженным настроением;
- утратой интересов или чувства удовольствия;
- снижением энергии (слабостью, вялостью, утомляемостью, усталостью, сниженной работоспособностью, замедленным мышлением);
- забывчивостью и рассеянностью;
- односложной речью, иногда замедленной;
- болезненностью в теле и мышцах;
- повышенной потребностью во сне.
При биполярной депрессии или смешанном эпизоде БАР часто присутствуют дополнительные симптомы:
- чувство вины или низкая самооценка;
- утомляемость или снижение энергии;
- трудности при сосредоточении;
- периоды снижения и повышения аппетита, тяга к сладкому;
- суицидальные мысли или действия.
Гипомания проявляется так же, как и мания, но менее выраженно. Часто больные воспринимают гипоманию позитивно, как прилив энергии и работоспособности, и перестают лечиться.
При мании и гипомании могут встречаться дополнительные симптомы, такие как страсть к накопительству, припрятывание еды, пристрастие к сладкому и необдуманным тратам денег (взятие кредитов, трата денег и имущества в ущерб интересов семьи), проблемы с законом (воровство, разбои, участие в незаконных действиях и др.), промискуитет (половая распущенность и множественные половые связи).
При быстром чередовании эпизодов мании и депрессии, переходах между ними или обострении заболевания возникают различные нарушения сна: бессонница, беспокойный сон и ранние пробуждения, сонливость днём и бодрствование, активность ночью. Нарушения снамогут свидетельствовать об обострении биполярного расстройства или смене фаз[31].
В течении БАР может преобладать любой тип эпизодов (маниакальный или депрессивный) с различной периодичностью. Эпизоды бывают частыми, практически без перерыва, или могут разделяться периодами нормального настроения.
Помимо нарушений настроения (мании, гипомании и депрессии), при БАР наблюдаются нейропсихологические дефициты: неточность восприятия эмоций и намерений других людей, иррациональное мышление, быстрый поток мыслей при мании или замедление мышления при депрессии, снижение контроля над эмоциями и поведением, нетерпеливость, импульсивность [18][29].
Также могут нарушаться реакции иммунитета и возникать различные соматические симптомы: головные боли разной локализации и интенсивности, потливость, чувство жара, дрожь в руках, ногах или во всём теле, болезненные спазмы и подёргивания мышц лица, шеи, спины, рук и ног, одышка или чувство нехватки воздуха, учащённое сердцебиение, скачки артериального давления, колебания температуры (иногда на два градуса от нормы) при отсутствии соматических заболеваний, спазмы в животе, запоры, нарушение аппетита, тошнота, учащённое мочеиспускание (при отсутствии органических поражений мочеполовой системы).
В целом клиническая картина очень разнообразна и зависит от генетических особенностей, возраста и сопутствующих расстройств.
Симптомы депрессии
Основные симптомы депрессивного расстройства:
- снижение настроения;
- потеря удовольствия и интереса к занятиям, которые раньше нравились, и к жизни в целом;
- повышенная утомляемость и слабость, хроническая усталость, даже после сна.
Эти симптомы называются триадой Бека — по имени Аарона Бека, американского теоретика в области клинической психологии и психотерапии. Также при депрессии могут возникать дополнительные симптомы, перечисленные выше при описании депрессивного эпизода БАР.
Степень тяжести депрессии определяется по количеству основных и дополнительных симптомов. Наличие одного основного симптома депрессии характеризует лёгкую степень тяжести, двух — среднюю степень, трёх — тяжёлую [1][3]. При любой степени тяжести могут наблюдаться соматические симптомы, обычно в виде болей различной локализации, выявить причину которых не удаётся даже при полном обследовании. Боли связаны со снижением уровня серотонина, который вырабатывается нейронами мозга, и повышением чувствительности болевых рецепторов.
Чем тяжелее депрессия, тем больше возникает соматических симптомов. При любой тяжести расстройства они могут быть достаточно выраженными, из-за чего пациенты часто обращаются к терапевтам, кардиологам, урологам, неврологам или хирургам, недооценивая психологические факторы и симптомы (хронические стрессы, тревожность, иррациональные мысли, негативное восприятие себя, своего окружения и будущего, нарушения настроения, энергии и удовольствия).
Для постановки диагноза депрессивного расстройства любой степени основные симптомы должны сохраняться как минимум две недели. При тяжёлых симптомах и очень остром начале диагноз тяжёлой депрессии оправдан даже при эпизоде меньше двух недель [1][3].
Если депрессию не лечить, она может длиться месяцами или годами с различными симптомами и тяжестью. Люди с депрессивным расстройством не могут привести свои чувства в норму самостоятельно, при тяжёлом эпизоде депрессии очень трудно продолжать заниматься привычными делами. Часто окружающие думают, что человек, страдающий депрессией, просто ленив или не хочет общаться, работать или учиться, но это не так. Многие также думают, что для пожилых людей нормально иметь депрессию. Это неправильное и очень опасное заблуждение, снижающее продолжительность жизни от соматических симптомов. Если врач предполагает у пожилого человека депрессивное заболевание, нужно пройти тщательное медицинское обследование и как можно скорее посетить психиатра.
Патогенез аффективного расстройства
Наши эмоции и поведение регулируют биохимические и электрофизиологические процессы в лимбической системе: поясной извилине коры больших полушарий, прозрачной перегородке, миндалевидном ядре, гиппокампе, гипоталамусе, ретикулярной формации ствола мозга [16][18][19][21]. Также в регуляции эмоций, поведения и вегетативных реакций участвуют хвостатое ядро (скопление серого вещества под корой больших полушарий мозга), префронтальная, суборбитальная и височные зоны коры больших полушарий. Эти процессы протекают благодаря нейронам, которые связаны между собой синапсами и обмениваются информацией с помощью нейромедиаторов (молекул, синтезируемыми клетками мозга) и электрических импульсов (гальванического электричества в силу разности потенциалов).
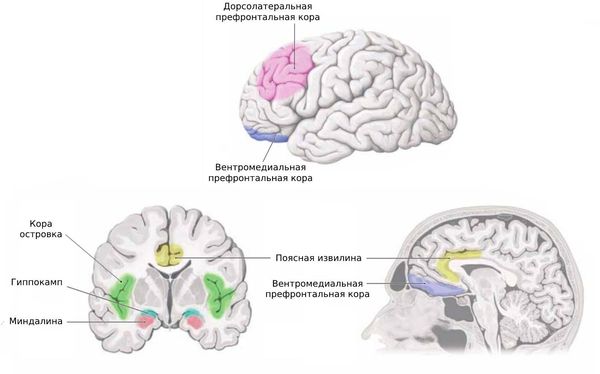
При патологиях эмоций и поведения нарушается уровень нейромедиаторов и синаптических связей. Эти изменения не видны на КТ и МРТ, о нарушениях врач может узнать, наблюдая за поведением и эмоциями пациента и основываясь на знаниях работы мозга.
Механизм развития БАР и других эмоционально-поведенческих расстройств объясняется с помощью разных гипотез. В XX веке было показано, что причиной БАР и других расстройств настроения могут быть аномалии в структуре и/или работе миндалины, префронтальной коры и гиппокампа [4][8].
В течение первого десятилетия XXI века стало известно, что в развитии тревожных, аффективных и психотических расстройств критическую роль играют:
- внутренняя нейронная сеть — сеть автоматической регуляции, с превалирующим участием вегетативной нервной системы в проявлении эмоций; включает вентромедиальную префронтальную кору, переднюю часть поясной извилины, прилежащее ядро прозрачной перегородки, бледный шар и таламус;
- внешняя нейронная сеть — сеть волевой, сознательной регуляции, включающая вентролатеральную префронтальную кору, среднюю и дорсальную часть поясной извилины, вентромедиальное полосатое тело, бледный шар и таламус [17][18].
Также для объяснения периодов мании и моторного возбуждения предложена парадигма киндлинга — зажигания нейронов в областях мозга, отвечающих за эмоции, поведение и вегетативную регуляцию. На ЭЭГ киндлинг проявляется усилением электрических импульсов. На уровне поведения это выражается дрожью, непроизвольными движениями, напоминающими судороги, тики или хорею, а также неподвижным взглядом, замиранием, резким возбуждением вегетативных реакций, вплоть до вегетативных кризов, которые могут быть вызваны перевозбуждением или резким подавлением задней группы ядер гипоталамуса [19][20][21].
![Поражение структур лимбической системы мозга (передней части поясной извилины, ядер прозрачной перегородки, ядер гипоталамуса, гиппокампальной коры), приводящее к эмоциональным и поведенческим расстройствам [16] Поражение структур лимбической системы мозга (передней части поясной извилины, ядер прозрачной перегородки, ядер гипоталамуса, гиппокампальной коры), приводящее к эмоциональным и поведенческим расстройствам [16]](https://probolezny.ru/media/bolezny/rasstroystvo-affektivnoe/porazhenie-struktur-limbicheskoy-sistemy-mozga-perednyay-chasti-poyasnoy-izviliny-yader-prozrachnoy-peregorodki-yader-gipotalamusa-gippokampalnoy-kory-privodyashee-k-emocionalnym-i-povedencheskim-rasstroystvam-16_s.jpeg)
При аффективных расстройствах, особенно при длительном течении без лечения или при врождённых нарушениях развития мозга, на МРТ можно увидеть увеличение боковых желудочков мозга (в среднем на 17 %) , уплотнение белого вещества мозга в 2,5 раза, истончение серого вещества в некоторых отделах мозга, в частности в гиппокампе, изменение размера передней части лимбической коры и миндалины, поражение базальных ядер и мозжечка [17][18][19].
При депрессии нарушается работа в префронтальной коре, лимбической системе (поясной извилине, гиппокампе, миндалевидном ядре, гипоталамусе и гипофизе), структурах полосатого тела, иногда в коре и проводящих путях мозжечка [8].
Также существуют различные психологические теории депрессии [6]. Особого внимания заслуживает когнитивная теория депрессии Бека, согласно которой главным механизмом развития депрессии являются негативные автоматические мысли о себе, своём окружении и будущем. Аарон Бек систематизировал автоматические мысли в депрессивную когнитивную триаду:
- негативные мысли о себе (я ничтожество, неудачник, у меня ничего не получится и т. д.);
- негативные мысли о других (меня никто не любит, все люди плохие, жестоки ко мне);
- негативные мысли о будущем (будущее безнадёжно, потому что ничего не изменится) [6].
Классификация и стадии развития аффективного расстройства
Расстройства настроения могут быть:
- монополярными (мания/гипомания либо депрессия лёгкой, средней или тяжёлой степени);
- биполярными (чередование мании/гипомании и депрессии);
- смешанными (одновременное присутствие мании/гипомании и депрессии).
При монополярной депрессии у человека наблюдаются только симптомы депрессии и не бывает маниакальных/гипоманиакальных эпизодов. Такая депрессия в Международной классификации болезней (МКБ-10) кодируется как F32. При биполярной форме (F31) депрессия чередуется с манией/гипоманией, или в анамнезе имеется хотя бы один эпизод мании/гипомании. Симптомы монополярной и биполярной депрессии одинаковы, но наличие эпизода эйфорического настроения хотя бы раз в жизни говорит о биполярном расстройстве и требует другого подхода к лечению.
Также выделяют два типа БАР:
- I — чередование мании и депрессии;
- II — чередование гипомании и депрессии.
Согласно МКБ-10, кроме БАР и депрессивного расстройства, к аффективным расстройствам относятся:
- Маниакальный эпизод (F30), который включает:
- Манию — приподнятое настроение, эйфорию, преувеличенное ощущение эмоционального и физического благополучия, повышенную физическую и психическую активность. Может сопровождаться чувством превосходства, исключительности и могущества, доходящими до бреда величия. Мышление характеризуется полётом и скачкой идей, повышенной отвлекаемостью и неспособностью сосредоточиться, а также рискованным, нереальным планам, которые человек не в силах реализовать. Во время эпизода мании пациенту может быть достаточно 3–4 часов сна в сутки, иногда ему некоторое время совсем не хочется спать.
- Гипоманию — более лёгкую манию, без бреда, может проявляться избыточной разговорчивостью, ускоренной речью и мышлением, слегка повышенной двигательной активностью и отвлекаемостью, сниженной потребностью во сне (достаточно 5–6 часов в сутки). Гипомания может временно сменять манию. Считается расстройством, только если поведение не соответствует происходящим событиям.
- Рекуррентное депрессивное расстройство (F33) — повторяющиеся эпизоды депрессии разной степени тяжести.
- Устойчивые расстройства настроения (F34):
- Циклотимия — состояние хронической нестабильности настроения, часто с раннего детства. Проявляется многочисленными эпизодами лёгкой депрессии и приподнятого настроения, ни один из которых не является достаточно интенсивным и длительным, чтобы соответствовать диагнозам БАР или рекуррентному депрессивному расстройству.
- Дистимия — хроническое депрессивное настроение в течение нескольких лет, недостаточное для постановки диагноза рекуррентного депрессивного расстройства. Также часто возникает с раннего детства.
- Другие биполярные аффективные расстройства (F31.8) — включают БАР II типа и рекуррентные (рецидивирующие) маниакальные эпизоды.
- Другие единичные аффективные расстройства (F38) — включают смешанный аффективный эпизод, длящийся, по крайней мере, две недели, при котором маниакальные/гипоманиакальные и депрессивные симптомы сочетаются или сменяются в течение нескольких часов.
- Неуточнённые аффективные расстройства (F39) — нарушения, которые имеют признаки БАР, но нуждаются в дальнейшем наблюдении и уточнении длительности симптомов, всестороннем сборе анамнеза для уточнения диагноза. Важно помнить, что у детей и подростков длительность эпизодов короче, чем у взрослых. К неуточнённым аффективным расстройствам относятся аффективный психоз БДУ (без дальнейших указаний), т. е. не классифицированный иначе, и психическое расстройство БДУ [1][2][3].
Осложнения аффективного расстройства
При БАР человек плохо контролирует своё поведение и импульсивность, что повышает риск суицидальных попыток и вспышек ярости или других видов страсти, приводящих к частым арестам полицией из-за драк, убийств, мести, распущенного полового поведения и денежных долгов [5][6][13].
Помимо риска преждевременной смерти из-за суицидов, для БАР характерно злоупотребление алкоголем или психоактивными веществами, в том числе наркотиками, а также поведение, опасное для жизни, например быстрая езда, подъём на высоту без страховки и подготовки, прыжки с высоты, чтобы проверить свои способности к выживанию [6][7][8][9][10].
Когнитивные нарушения в периоды аффективных эпизодов мании (скачка идей и быстрый поток мыслей) и при депрессии (забывчивость или замедление мыслей) мешают сосредоточиться, работать или учиться [4][5][6]. Идеи величия и могущества при мании или гипомании могут приводить к рискованным поступкам, а чувство вины и самоуничижение при депрессии — к недооценке своих способностей, апатии, недостатку мотивации, ненависти к себе и суициду. Суицидальный риск при биполярной депрессии выше в 12–14 раз, чем в общей популяции [7][9][10].
Другими осложнениями могут быть психотические симптомы, включающие бред, галлюцинации и кататонию, при которой человек не может нормально двигаться и говорить [1][2][3][5][6][13][14][22].
Без лечения депрессия и биполярные расстройства могут привести к потере работы и финансовым трудностям, однако более 60 % пациентов справляются со своими обязанностями, особенно при своевременном лечении [6][13][25].
Диагностика аффективного расстройства
При сборе анамнеза врач обратит внимание на следующие факторы:
- наследственность;
- эпизоды мании, депрессии и суицидальные попытки в прошлом;
- раздражительность и вспышки ярости на тривиальные события и замечания при БАР (например, при просьбе отложить телефон и прибрать вещи) или реакции избегания и чрезмерной вины при монополярной депрессии.
Если есть документы о диагностированных заболеваниях и других результатах обследований, можно показать их врачу напрямую или открыть доступ к своей электронной медкарте.
При физикальном обследовании врач наблюдает и описывает симптомы, соответствующие критериям диагностики, изложенным в руководствах по классификации психических расстройств [1][2][3]. К физикальным симптомам депрессии относится триада Протопопова: расширение зрачков, запоры и тахикардия.
При любых выраженных эмоциональных проблемах может усиливаться потливость, возникать чувство жара, учащаться сердцебиение, появляться одышка без физической нагрузки, дрожь в руках, ногах или во всём теле, неустойчивость при ходьбе, головные боли, связанные с эмоциональным напряжением, боли в спине из-за сопутствующей тревожности и напряжения мышц в шейном, грудном и поясничном отделах.
Электроэнцефалография (ЭЭГ) позволяет определить нарушение биоэлектрической активности мозга (повышенный или сниженный вольтаж альфа-, бета-, дельта- и тета-ритмов, очаги возбуждения нервных клеток, нарушенную реакцию на провоцирующие стимулы).

При диагностике БАР и других эмоциональных и поведенческих расстройств не информативно исследовать сосуды мозга, т. е. проводить реоэнцефалографию. Этот метод подходит для диагностики атеросклероза сосудов мозга, инсульта, тяжёлых травм головы и шеи, а также при выборе тактики оперативного вмешательства на мозге.
Общий и биохимический анализ крови помогут выявить сопутствующие соматические болезни: инфекционные заболевания нервной системы, поражение печени, почек и сердца.
Тесты и опросники для диагностики БАР. Существуют разные опросники, но более точные гораздо эффективнее, так как позволяют не только определить степень выраженности симптомов, но и отследить их динамику на фоне лечения.
К таким опросникам относятся:
- шкала депрессии Бека;
- шкала тревоги Бека;
- шкала мании Янга, построенная как частично структурированное интервью, так как сочетает элементы диагностической беседы и количественной оценки выраженности симптомов.
Такие опросники применяют психиатры. Врачи соматического профиля, т. е. терапевты, неврологи, онкологи и другие специалисты, могут предварительно оценить проблему с помощью более простых опросников, которые также подходят для самодиагностики, например:
- шкала депрессии Цунга;
- шкала Монтгомери — Асберга для самооценки депрессии;
- шкала Альтмана для самооценки мании.
Также существует много опросников, которые позволяют собрать дополнительную информацию, например оценить настроение, качество жизни, риск суицида и психопатии.
При обследовании детей врачи могут опираться не только на критерии, описанные в МКБ-10, но и на лист учёта детского поведения Т. Ахенбаха. Для предварительной оценки симптомов БАР можно использовать детский опросник биполярного расстройства [15] и для взрослых — скрининговый опросник расстройства настроения [26].
Для дифференциальной диагностики, чтобы исключить опухоли и органические поражения мозга, используются МРТ и КТ головного мозга. Все обследования, перечисленные выше, также позволяют уточнить диагноз и отличить аффективные расстройства от возможных соматических и неврологических нарушений.
Также БАР нужно отличать:
- от шизофрении;
- острого психотического расстройства;
- шизоаффективного расстройства;
- острых и хронических бредовых расстройств;
- индуцированного бредового расстройства;
- расстройств, связанных с употреблением алкоголя или других психоактивных веществ — состояние отмены с делирием, психотическое расстройство при употреблении психоактивных веществ;
- монополярной депрессии;
- смешанного тревожно-депрессивного расстройства[1][2][5][6].
У детей БАР следует отличать:
- от синдрома гиперактивности и дефицита внимания;
- расстройства поведения;
- смешанных расстройств поведения и эмоций, например депрессивного расстройства поведения и разрушительного, деструктивного расстройства настроения (новый диагноз, появившийся в DSM-V и МКБ-11).
Дифференциальная диагностика депрессии:
- острое психотическое расстройство — есть галлюцинации или бред, например голоса или странные, необычные убеждения;
- биполярное расстройство — в прошлом возникал хотя бы один маниакальный/гипоманиакальный эпизод (двигательное и эмоциональное возбуждение, приподнятое настроение, ускоренная речь);
- расстройства, связанные с употреблением алкоголя или психоактивных веществ — при злоупотреблении алкоголем или наркотиками;
- смешанное тревожно-депрессивное расстройство [1][2][5][6].
Сопутствующие расстройства при БАР:
- у 17–35 % пациентов выявляют генерализованное тревожное расстройство;
- у 19 % — панические атаки;
- 9 % — обсессивно-компульсивное расстройство;
- 20 % — социофобия[10][11].
Из соматических заболеваний наиболее часто сопутствуют БАР:
- синдром раздражённого кишечника;
- бронхиальная астма;
- метаболические и эндокринные заболевания (ожирение, дисфункция щитовидной и поджелудочной железы и др.);
- черепно-мозговые травмы;
- ревматоидный артрит;
- кардио- и цереброваскулярные заболевания (колебания артериального давления, аритмия, мигрень, энцефалопатия);
- множественный склероз;
- эпилепсия [10].
Эти сопутствующие болезни возникают из-за общих для данных заболеваний факторов воспаления в патогенезе и поражения функциональных связей в отделах мозга, которые регулируют эмоции и вегетативные проявления [4][13][17][18].
Депрессия часто сопровождается:
- необъяснимыми соматическими жалобами;
- тревогой;
- алкогольной или лекарственной зависимостями [1][2][3].
Почему важно отличать депрессию от последствий гипомании
Депрессию (F32) следует отличать от истощения после нелеченных эпизодов гипомании или мании (F30). Дело в том, что гипомания многими людьми воспринимается положительно и ошибочно считается нормой, так как она субъективно сопровождается более хорошим настроением, повышенной активностью и работоспособностью, человек меньше хочет спать, иногда возникает бессонница. Такая высокая активность организма через 3–4 месяца может привести к усталости и различным вегетативным нарушениям: головокружению, колебанию артериального давления, учащённому сердцебиению, проблемам с желудочно-кишечным трактом и др. И антидепрессанты, которые обычно назначают при депрессии, в этом случае могут оказать противоположный эффект: вопреки ожиданиям, они будут усиливать усталость, вялость и головокружение.
Поэтому врач должен внимательно оценивать опросники и интервью пациента с симптомами мании, гипомании и депрессии и при необходимости гибко менять тактику лечения.
Если достаточных критериев депрессии не отмечается, то антидепрессанты лучше не назначать, можно ограничиться нормотимиками — средствами, нормализующими настроение. А при первых признаках мании, гипомании и связанного с ними истощения эффективней использовать нейролептики, которые назначают методом титрования, т. е. начинают с небольшой дозы и постепенно увеличивают до более действенной. Причём они показаны и между эпизодами этих нарушений. Нейролептики успокаивают чрезмерно активные нервные клетки, снижают эффект зажигания нейронов, или киндлинга, и нормализуют их активность.
Лечение аффективного расстройства
Манию/гипоманию и депрессию при биполярном или монополярном расстройстве лечат в два этапа:
- Сначала нормализуют острую фазу расстройства, чтобы у пациента исчезли симптомы и нормализовалось настроение.
- Затем в течение 2–5 лет проводят поддерживающую терапию, чтобы предотвратить рецидивы, уменьшить подпороговые симптомы (т. е. остаточные симптомы, которые не достигают порога, необходимого для постановки психиатрического диагноза) и улучшить способности выполнять свои роли в семье и на работе [6].
Медикаментозное лечение аффективных расстройств
Лечить БАР медикаментозно достаточно сложно, так как терапия, облегчающая депрессию, может вызывать манию/гипоманию или быструю цикличность (четыре или более эпизодов за год), а лечение, уменьшающее манию, может вызвать депрессию.
Для лечения биполярной депрессии и мании/гипомании используются разные сочетания нейролептиков, нормотимиков, антидепрессантов и транквилизаторов (выбирать лекарства при БАР желательно в этой последовательности):
- Нейролептики (сильные успокаивающие) при лечении мании/гипомании или биполярной депрессии желательно использовать в средних терапевтических дозах. Начинают с небольших доз, постепенно доводя до терапевтически работающей дозы (т .е. устраняющей симптомы), индивидуальной для каждого больного. При присоединении психотических симптомов (галлюцинаций, бреда, сильного двигательного возбуждения) дозы могут быть увеличены до максимальной суточной дозы, но с учётом переносимости. Психотические симптомы при назначении средних терапевтических доз нейролептиков постепенно ослабевают в течение 1–2 недель. Затем лечение продолжают ещё 4–6 недель или дольше, чтобы полностью устранить психотические симптомы. При назначении высоких доз нейролептиков для быстрого устранения психотических симптомов могут возникать побочные явления и осложнения, которые значительно снижают приверженность пациентов к лечению [6].
- Нормотимики (средства, нормализующие настроение), например противосудорожные средства, соли лития. При лечении солями лития замедляется формирование органических поражений при БАР, снижается избыточная электрическая возбудимость нейронов и, следовательно, преждевременная гибель нервных клеток [27]. При этом улучшается память, скорость обработки информации, самоконтроль, уменьшается количество рецидивов, снижается число и интенсивность маниакальных эпизодов.
- Транквилизаторы (слабые успокаивающие) применяют для устранения симптомов тревоги и кататонии — возможных сопутствующих симптомов БАР.
- Антидепрессанты с разными свойствами (в зависимости от совокупности основных и дополнительных симптомов у конкретного человека) назначают для лечения преимущественно монополярной депрессии или при длительных эпизодах биполярной депрессии (обычно БАР II типа), в последнем случае — в сочетании с нейролептиками или нормотимиками.
- Электросудорожная терапия может потребоваться при кататонии и трудно поддающихся лечению эпизодах большой депрессии или мании [22].
Психотерапия аффективных расстройств
Поддерживающая терапия — это поддержка пациента, доброжелательное и помогающее отношение к нему. Проводится в рамках семейной, индивидуальной или групповой психотерапии, применяется одновременно с лечением препаратами [28].
Семейная терапия нацелена на преодоление критики и враждебности в семье. Включает психологическое образование родителей или ухаживающих людей (21 сеанс). Применяемая совместно с лекарственной терапией, помогает увеличить периоды ремиссий, снизить количество и интенсивность стрессоров, улучшить память, скорость обработки информации, самоконтроль, способности выполнять свои роли в семье или на работе.
Когнитивно-поведенческая терапия (КПТ). Предполагается, что повторные нарушения настроения обусловлены пессимистическим мышлением в ответ на жизненные события и наиболее укоренившимися, устойчивыми негативными убеждениями о себе, окружающем мире и своём будущем (А. Бек) [29]. В рандомизированных клинических испытаниях люди, получившие 12–14 сеансов КПТ, становились менее депрессивными, более уравновешенными и лучше выполняли свои роли в семье или на работе в течение последующих 30 месяцев [30].
Межличностная и нормализующая циркадные ритмы терапия. Нарушения сна и настроения взаимосвязаны. Люди с манией/гипоманией склонны к повышенной активности вечером и ночью. Стабилизировать сон и циркадные ритмы можно с помощью постепенного сдвига времени отхождения ко сну и специальных ритуалов перед засыпанием. Эта терапия эффективна только после стабилизации острой фазы маниакального или депрессивного эпизода с помощью лекарственной терапии. Для нормализации циркадных ритмов при депрессии может применяться светотерапия.

Психообразовательные процедуры в групповом формате. Барселонский подход включает объединение пациентов в терапевтическую группу, информирование их о симптомах, механизмах развития заболевания, вариантах лечения, ранних признаках обострения, важности соблюдения режима сна и бодрствования. Составляется расписание и программа занятий на 21 день. Такой подход позволяет снизить количество рецидивов в течение последующих пяти лет, экономит средства пациентов на лечение и сокращает пропуски работы по болезни.
Функциональное восстановление. Данная терапия помогает восстановить когнитивные функции и включает упражнения на память, внимание, мышление (логику, рассуждения о последствиях и возможностях), разрешение проблем и развитие самоконтроля.
У детей для лечения, профилактики и снижения частоты рецидивов эмоциональных и поведенческих проблем наиболее эффективны тренинги в рамках когнитивно-поведенческого подхода:
- тренинг навыков релаксации (прогрессирующее мышечное расслабление и управляемое дыхание по Шульте),
- тренинг управления гневом;
- управления стрессом;
- самоконтроля;
- разрешения проблем;
- ассертивности (уверенного, но не агрессивного поведения);
- социального взаимодействия (соблюдение социальной дистанции, навыки вежливости и учтивости, взаимодействие с авторитетными лицами, например с учителями и родителями).
Подобные тренинги и отработку навыков поведения у детей с нормальным интеллектом можно проводить в детских садах с 4 лет и/или в школах после предварительного объяснения и демонстрации в виде проигрывания ролей. Тренинги для детей можно сочетать с программами психологического образования для родителей, которые проводятся отдельно.
Прогноз. Профилактика
Неблагоприятный прогноз при БАР может быть:
- при раннем начале болезни (до 17 лет, с пиком в 8–12 лет);
- быстро чередующихся (в тяжёлых случаях — ежедневных) аффективных эпизодах смены настроения и энергии. Раньше это называли «шубообразным течением», оно связано с прогрессивным ухудшением когнитивных и других функций. В крайних случаях приводит к шизофрении.
Также негативно влияют на прогноз сопутствующие нарушения: поведенческие расстройства, синдром гиперактивности и дефицита внимания, злоупотребление алкоголем, никотином и наркотиками, компьютерная зависимость, в том числе азартная увлечённость играми.
У подростков с аффективными расстройствами с 12–13 лет снижается интерес к учёбе, типичны прогулы уроков. С 6–8 лет могут появиться суицидальные мысли, а с 10–11 лет даже у внешне благополучных и успешных в учёбе подростков всё чаще встречаются попытки суицида.
У молодых людей уменьшается интерес к работе, им сложно выполнять свои обязанности из-за невозможности сосредоточиться или закончить начатое. Заметно снижается способность решать проблемы, свойственные возрасту. Из-за нарушения функций ядер гипоталамуса и ствола мозга, регулирующих вегетативные функции (тонус гладкой мускулатуры сосудов, бронхов и кишечника, функции пищеварения и мочеиспускания, деятельность сердца, функцию эндокринных желёз и другое), усугубляются соматические расстройства [23][32].
При плохой приверженности к лечению, частых нелеченных эпизодах болезни и отказе от терапии могут появиться органические поражения мозга, видимые на МРТ. Также у человека могут возникнуть серьёзные трудности в семье и работе, и он может стать инвалидом [7][27]. Попытки суицида, которые часто встречаются при БАР, могут привести к преждевременной смерти [9].
При длительном течении БАР без лечения снижается объём гиппокампа и серого вещества лобной коры. Возможно одновременное утолщение некоторых участков лобной коры как неспецифическое воспалительная реакция, из-за которой человек не может контролировать и планировать своё поведение [4][5][6][8][13].
Чтобы предотвратить рецидивы аффективного расстройства, рекомендуется:
- обращаться к врачу при первых признаках заболевания;
- принимать назначенные лекарства;
- с помощью когнитивно-поведенческой терапии учиться справляться с внешними стрессорами;
- нормализовать режим сна, бодрствования и повседневных дел;
- чаще общаться с родственниками, друзьями, заниматься хобби, учёбой или работой;
- не злоупотреблять алкоголем и отказаться от наркотиков [6].
Сайт издательства «Медиа Сфера»
содержит материалы, предназначенные исключительно для работников здравоохранения. Закрывая это сообщение, Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
ФГБОУ ВО «Санкт-Петербургский государственный университет»;
СПБ ГБУЗ «Психиатрическая больница №1 им. П.П. Кащенко»
Петрова Н.Н.
ФГБОУ ВО «Санкт-Петербургский государственный университет»
Лиманкин О.В.
СПБ ГБУЗ «Психиатрическая больница №1 им. П.П. Кащенко»;
ФГБУ ДПО «Санкт-Петербургский институт усовершенствования врачей-экспертов» Минтруда России;
ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России
Ашенбреннер Ю.В.
ФГБОУ ВО «Санкт-Петербургский государственный университет»;
СПБ ГБУЗ «Психиатрическая больница №1 им. П.П. Кащенко»

Когнитивные нарушения у пациентов с биполярным аффективным расстройством в ремиссии
Авторы:
Чумаков Е.М., Петрова Н.Н., Лиманкин О.В., Ашенбреннер Ю.В.
Как цитировать:
Чумаков Е.М., Петрова Н.Н., Лиманкин О.В., Ашенбреннер Ю.В. Когнитивные нарушения у пациентов с биполярным аффективным расстройством в ремиссии. Журнал неврологии и психиатрии им. С.С. Корсакова.
2021;121(4):12‑18.
Chumakov EM, Petrova NN, Limankin OV, Ashenbrenner YuV. Cognitive impairment in remitted patients with bipolar disorder. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2021;121(4):12‑18. (In Russ.)
https://doi.org/10.17116/jnevro202112104112

Читать метаданные
ЦЕЛЬ ИССЛЕДОВАНИЯ
Определение частоты, структуры и выраженности когнитивных нарушений у пациентов с биполярным аффективным расстройством (БАР) в ремиссии.
МАТЕРИАЛ И МЕТОДЫ
Обследованы 85 пациентов с БАР I типа (n=64) и II типа (n=21) в ремиссии (средний возраст 36,6±5,7 года). Выраженность психопатологической симптоматики оценивалась с помощью шкалы депрессии Гамильтона (HDRS) и шкалы мании Янга (YMRS), когнитивные нарушения — с использованием методики Краткого нейропсихологического обследования когнитивной сферы (КНОКС).
РЕЗУЛЬТАТЫ И ЗАКЛЮЧЕНИЕ
Когнитивные нарушения выявлены у 43,5% обследованных пациентов. Частота и структура когнитивных нарушений при БАР I типа и II типа в ремиссии не различались. Обследованные пациенты с когнитивными нарушениями характеризовались снижением скорости психических процессов, снижением рабочей памяти и нарушениями внимания. Выявлена ассоциированность общего балла КНОКС с возрастом пациентов, длительностью заболевания, общими баллами HDRS и YMRS. Результаты исследования свидетельствуют в пользу аффективной природы когнитивного дефицита у обследованных пациентов. Когнитивные нарушения у пациентов с БАР в ремиссии являются значимой терапевтической мишенью.
Авторы:
Чумаков Е.М.
ФГБОУ ВО «Санкт-Петербургский государственный университет»;
СПБ ГБУЗ «Психиатрическая больница №1 им. П.П. Кащенко»
Петрова Н.Н.
ФГБОУ ВО «Санкт-Петербургский государственный университет»
Лиманкин О.В.
СПБ ГБУЗ «Психиатрическая больница №1 им. П.П. Кащенко»;
ФГБУ ДПО «Санкт-Петербургский институт усовершенствования врачей-экспертов» Минтруда России;
ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России
Ашенбреннер Ю.В.
ФГБОУ ВО «Санкт-Петербургский государственный университет»;
СПБ ГБУЗ «Психиатрическая больница №1 им. П.П. Кащенко»
Дата поступления:
25.06.2020
Дата принятия в печать:
13.07.2020
Список литературы:
- Pini S, de Queiroz V, Pagnin D, et al. Prevalence and burden of bipolar disorders in European countries. Eur Neuropsychopharmacol. 2005;15:425–434. https://doi.org/10.1016/j.euroneuro.2005.04.011
- Weinstock LM, Strong D, Uebelacker LA, Miller IW. DSM-IV depressive symptom expression among individuals with a history of hypomania: a comparison to those with or without a history of mania. J Psychiatr Res. 2010;44(14):979–985. https://doi.org/10.1016/j.jpsychires.2010.03.010
- Gitlin MJ, Miklowitz DJ. The difficult lives of individuals with bipolar disorder: a review of functional outcomes and their implications for treatment. J Affect Disord. 2017;209:147–154. https://doi.org/10.1016/j.jad.2016.11.021
- Rosenblat JD, Simon GE, Sachs GS, et al. Treatment effectiveness and tolerability outcomes that are most important to individuals with bipolar and unipolar depression. J Affect Disord. 2019;243:116–120. https://doi.org/10.1016/j.jad.2018.09.027
- Rocha P, Correa H. The impact of clinical comorbidities and residual depressive symptoms in sleep quality in euthymic/interepisodic bipolar subjects. Psychiatry Res. 2018;268:165–168. https://doi.org/10.1016/j.psychres.2018.07.002
- Martínez-Arán A, Vieta E. Cognition as a target in schizophrenia, bipolar disorder and depression. Eur Neuropsychopharmacol. 2015;25(2):151–157. https://doi.org/10.1016/j.euroneuro.2015.01.007
- Miller S, Dell’Osso B, Ketter TA. The prevalence and burden of bipolar depression. J Affect Disord. 2014;169(Suppl 1):3–11. https://doi.org/10.1016/s0165-0327(14)70003-5
- Петрова Н.Н., Ашенбреннер Ю.В. Биполярное аффективное расстройство первого типа и психосоциальное функционирование больных. Социальная и клиническая психиатрия. 2018;28(1):10–14.
- Fagiolini A, Kupfer DJ, Masalehdan A, et al. Functional impairment in the remission phase of bipolar disorder. Bipolar Disord. 2015;7(3):281–285. https://doi.org/10.1111/j.1399-5618.2005.00207.x
- Volkert J, Schiele MA, Kazmaier J, et al. Cognitive deficits in bipolar disorder: From acute episode to remission. Eur Arch Psychiatry Clin Neurosci. 2016;266(3):225–237. https://doi.org/10.1007/s00406-015-0657-2
- Смулевич А.Б., Андрющенко А.В., Романов Д.В., Захарова Н.В. Ремиссии при аффективных заболеваниях: эпидемиология, психопатология, клинический и социальный прогноз, вторичная профилактика. Журнал неврологии и психиатрии им. С.С. Корсакова. 2014;114(3):4–13.
- Ашенбреннер Ю.В., Чумаков Е.М., Петрова Н.Н. Резидуальные симптомы и социальное функционирование у пациентов с биполярным аффективным расстройством в ремиссии. Неврологический вестник. 2019;51(2):66–71. https://doi.org/10.17816/nb15665
- Конорева А.Е., Мосолов С.Н. Когнитивные нарушения при биполярном аффективном расстройстве. Современная терапия психических расстройств. 2017;(4):11–18. https://doi.org/10.21265/PSYPH.2017.43.8416
- Solé B, Jimenez E, Torrent C, et al. Cognitive Impairment in Bipolar Disorder: Treatment and Prevention Strategies. Int J Neuropsychopharmacol. 2017;20(8):670–680. https://doi.org/10.1093/ijnp/pyx032
- Engel J. Visions for novel biophysical elucidations of extracellular matrix networks. Int J Biochem Cell Biol. 2007;39(2):311–318. https://doi.org/10.1016/j.biocel.2006.08.003
- Rosa AR, Bonnin CM, Vazquez GH, et al. Functional impairment in bipolar II disorder: Is it as disabling as bipolar I? J Affect Disord. 2010;127(1–3):71–6. https://doi.org/10.1016/j.jad.2010.05.014
- Toyoshima K, Kako Y, Toyomaki A, et al. Associations between cognitive impairment and quality of life in euthymic bipolar patients. Psychiatry Res. 2019;271:510–515. https://doi.org/10.1016/j.psychres.2018.11.061
- Veeh J, Kopf J, Kittel-Schneider S, et al. Cognitive re mediation for bipolar patients with objective cognitive impairment: a naturalistic study. Int J Bipolar Disord. 2017;5(1):8. https://doi.org/10.1186/s40345-017-0079-3
- Daglas R, Yucel M, Cotton S, et al. Cognitive impairment in first-episode mania: a systematic review of the evidence in the acute and remission phases of the illness. Int J Bipolar Disord. 2015;3:9. https://doi.org/10.1186/s40345-015-0024-2
- Samalin L, Bellivier F, Giordana B, et al. Patients’ Perspectives on Residual Symptoms in Bipolar Disorder: A Focus Group Study. J Nerv Ment Dis. 2014;202(7):550–555. https://doi.org/10.1097/nmd.0000000000000157
- Roux P, Raust A, Cannavo A-S, et al. Associations between residual depressive symptoms, cognition, and functioning in patients with euthymic bipolar disorder: results from the FACE-BD cohort. Br J Psychiatry. 2017;211(6):381–387. https://doi.org/10.1192/bjp.bp.117.201335
- Post F, Pardeller S, Frajo-Apor B, et al. Quality of life in stabilized outpatients with bipolar I disorder: Associations with resilience, internalized stigma, and residual symptoms. J Affect Disord. 2018;238:399–404. https://doi.org/10.1016/j.jad.2018.05.055
- Cipriani G, Danti S, Carlesi C, et al. Bipolar Disorder and Cognitive Dysfunction: A Complex Link. J Nerv Ment Dis. 2017;205(10):743–756. https://doi.org/10.1097/nmd.0000000000000720
- Martínez-Arán A, Vieta E, Colom F, et al. Cognitive impairment in euthymic bipolar patients: implications for clinical and functional outcome. Bipolar Disord. 2004;6(3):224–232. https://doi.org/10.1111/j.1399-5618.2004.00111.x
- Goodwin GM, Martinez-Aran A, Glahn DC, Vieta E. Cognitive Impairment in Bipolar Disorder: Neurodevelopment or Neurodegeneration? An ECNP expert meeting report. Eur Neuropsychopharmacol. 2008;18(11):787–793. https://doi.org/10.1016/j.euroneuro.2008.07.005
- Riedel P, Smolka MN, Bauer M. Schizophrenia and bipolar disorder: Treatment of cognitive impairments. Nervenarzt. 2018;89(7):784–795. https://doi.org/10.1007/s00115-018-0500-x
- Hamilton M. A rating scale for depression. J Neurol Neurosurg Psychiatry. 1960;23(1):56–62. https://doi.org/10.1136/jnnp.23.1.56
- Young RC, Biggs JT, Ziegler VE, Meyer DA. A rating scale for mania: reliability, validity and sensitivity. Br J Psychiatry. 1978;133(5):429–435. https://doi.org/10.1192/bjp.133.5.429
- Тонконогий И.М.; Микадзе Ю.В., ред. Краткое нейропсихологическое обследование когнитивной сферы (КНОКС). М.; 2010.
- Chumakov EM. Cognitive impairment and mental disorders in HIV-infected patients with early stages of syphilis. Vestnik Sankt-Peterburgskogo universiteta. Seriya 11. Meditsina. 2017;12(3):273–277. https://doi.org/10.21638/11701/spbu11.2017.307
- Нийноя И.В., Романов Д.В., Махмудова Г.Ж., Нодель М.Р. Депрессия при болезни Паркинсона: аспекты психопатологической структуры и нозологической квалификации. Психиатрия. 2019;17(4):38–48. https://doi.org/10.30629/2618-6667-2019-17-4-38-48
- Мосолов С.Н., Ушкалова А.В., Костюкова Е.Г., и др. Валидизация российской версии опросника HCL-32 для выявления пациентов с биполярным аффективным расстройством II типа среди больных, наблюдающихся с диагнозом рекуррентного депрессивного расстройства. Социальная и клиническая психиатрия. 2015;25(1):22–30.
- Szmulewicz AG, Valerio MP, Smith JM, et al. Neuropsychological Profiles of Major Depressive Disorder and Bipolar Disorder During Euthymia. A Systematic Literature Review of Comparative Studies. Psychiatry Res. 2017;248:127–133. https://doi.org/10.1016/j.psychres.2016.12.031
- Xu G, Lin K, Rao D, et al. Neuropsychological performance in bipolar I, bipolar II and unipolar depression patients: a longitudinal, naturalistic study. J Affect Disord. 2012;136(3):328–339. https://doi.org/10.1016/j.jad.2011.11.029
- Kurtz MM, Gerraty RT. A meta-analytic investigation of neurocognitive deficits in bipolar illness: profile and effects of clinical state. Neuropsychology. 2009;23(5):551–562. https://doi.org/10.1037/a0016277
- Вассерман Л.И., Березенцева М.С., Ершов Б.Б., Щелкунова Л.А. Нейропсихологическая оценка когнитивных нарушений у пациентов с эндогенными депрессивными расстройствами. Вестник Южно-Уральского государственного университета. Серия: Психология. 2012;(31):92–96.
- Glahn DC, Almasy L, Barguil M, et al. Neurocognitive endophenotypes for bipolar disorder identified in multiplex multigenerational families. Arch Gen Psychiatry. 2010;67(2):168–177. https://doi.org/10.1001/archgenpsychiatry.2009.184
- Balanza-Martinez V, Rubio C, Selva-Vera G, et al. Neurocognitive endophenotypes (endophenocognitypes) from studies of relatives of bipolar disorder subjects: a systematic review. Neurosci Biobehav Rev. 2008;32(8):1426–1438. https://doi.org/10.1016/j.neubiorev.2008.05.019
- Goldberg JF, Harrow M. Consistency of remission and outcome in bipolar and unipolar mood disorders: a 10-year prospective follow up. J Affect Disord. 2004;81(2):123–131. https://doi.org/10.1016/s0165-0327(03)00161-7
- Bonnin CM, Sanchez-Moreno J, Martinez-Aran A, et al. Subthreshold symptoms in bipolar disorder: Impact on neurocognition, quality of life and disability. J Affect Disord. 2012;136(3):650–659. https://doi.org/10.1016/j.jad.2011.10.012
- Kuppili PP, Menon V, Chandrasekaran V, Navin K. Biological Rhythm Impairment in Bipolar Disorder: A State or Trait Marker? Indian J Psychiatry. 2018;60(4):404–409. https://doi.org/10.4103/psychiatry.indianjpsychiatry_110_18
- Konstantakopoulos G, Ioannidi N, Typaldou M, et al. Clinical and cognitive factors affecting psychosocial functioning in remitted patients with bipolar disorder. Psychiatriki. 2016;27(3):182–191. https://doi.org/10.22365/jpsych.2016.273.182
- Fuentes I, Rizo-Mendez A, Jarne-Esparcia A. Low compliance to pharmacological treatment is linked to cognitive impairment in euthymic phase of bipolar disorder. J Affect Disord. 2016;195:215–220. https://doi.org/10.1016/j.jad.2016.02.005
Биполярное аффективное расстройство (БАР), являясь одним из самых распространенных психических расстройств [1], не только негативно влияет на качество жизни [2] и приводит к снижению социального функционирования пациентов [3—6], но и ассоциируется с большим бременем затрат государства и семьи на лечение и уход [7, 8]. Снижение социального функционирования у пациентов с БАР проявляется не только в период обострения, но и во время стойкой ремиссии [9]. В числе возможных причин ухудшения социального функционирования пациентов с БАР в ремиссии рассматриваются когнитивные нарушения [10] и резидуальные симптомы [11, 12].
В последние десять лет растет интерес исследователей к вопросам диагностики и лечения когнитивных нарушений, связанных с БАР, поскольку они сохраняются в периоды ремиссии и могут значительно влиять на психосоциальное функционирование пациентов [13, 14]. Когнитивные нарушения выявляются уже в дебюте заболевания и связаны преимущественно с общим дефицитом психической активности, а их тяжесть нарастает с увеличением длительности заболевания [15]. Частота когнитивных нарушений у пациентов с БАР в ремиссии достигает 40—50% случаев, а связь когнитивных нарушений с острым эпизодом или аффективными симптомами выявляется не всегда [16]. Показано, что даже легкие когнитивные нарушения у пациентов с БАР в ремиссии могут обусловить снижение качества жизни пациентов [17]. Отмечено, что нарушения познавательных процессов у больных БАР носят неотчетливый и полиморфный характер, это определяет необходимость адекватной нейропсихологической диагностики [15]. Предполагается, что нарушения внимания, рабочей и вербальной памяти являются наиболее распространенными когнитивными нарушениями при биполярном расстройстве [18].
Продолжается дискуссия о сроках развития и характеристиках когнитивных нарушений при БАР, их зависимости от состояния больных [19]. Высказываются противоречивые мнения о том, являются ли когнитивные нарушения у больных БАР в ремиссии одним из проявлений резидуальных симптомов заболевания [20] или самостоятельным психопатологическим доменом БАР [21]. В пользу первого свидетельствуют данные о том, что наличие резидуальных симптомов депрессии негативно влияет на внимание и вербальную память, скорость психических процессов [10, 23]. При этом высказываются предположения об общем патогенезе эмоциональных и когнитивных нарушений, исходя из нейроанатомического, нейропсихологического, электрофизиологического и нейровизуализационного анализов конкретных клинических случаев [24].
С другой стороны, есть указания на то, что когнитивные нарушения при БАР являются независимыми от резидуальных симптомов факторами ухудшения профессионального функционирования пациентов в ремиссии [21, 22]. В пользу самостоятельности когнитивных нарушений свидетельствуют данные о том, что у пациентов с БАР выявляются стабильные когнитивные нарушения на всех этапах БАР, включая ремиссию, особенно в таких сферах, как внимание, память и исполнительные функции [10, 13, 23]. При этом указывается, что нейрокогнитивный дефицит, ассоциированный с БАР, не только сохраняется у пациентов в ремиссии [20, 21], но и может нарастать по мере увеличения количества перенесенных эпизодов [25]. Кроме того сообщается, что улучшение когнитивного функционирования у пациентов с БАР приводит к повышению качества жизни и уровня психосоциального функционирования в большей степени, чем успешное лечение других резидуальных симптомов [26].
Таким образом, на сегодняшний день остается открытым вопрос о месте когнитивных нарушений в структуре БАР у пациентов в ремиссии.
Цель исследования — изучение частоты, структуры и выраженности когнитивных нарушений у больных БАР в ремиссии.
Материал и методы
Исследование проводилось в амбулаторном звене психиатрической службы города Санкт-Петербурга в 2017—2019 гг. Для решения поставленных задач было обследовано 85 пациентов с БАР I типа (75%; 64 пациента) и БАР II типа (25%; 21 пациент) в ремиссии. Все обследованные пациенты получали поддерживающую терапию. Исследуемую выборку составили 29 мужчин и 56 женщин в возрасте 36,6±5,7 года. Пациенты включались в данное исследование, если их состояние соответствовало критериям ремиссии БАР по МКБ-10 (F31.7). Критериями исключения служили: наличие сопутствующего органического поражения головного мозга или другого коморбидного психического расстройства; наличие актуальной соматической патологии.
В исследовании применялся метод клинико-шкальной оценки, а также структурированное интервью. Выраженность психопатологической симптоматики оценивали с помощью шкалы депрессии Гамильтона (HDRS) [27] и шкалы мании Янга (YMRS) [28]. Когнитивные нарушения оценивали с использованием методики Краткого нейропсихологического обследования когнитивной сферы (КНОКС) [29], которая ранее показала свою эффективность для скрининга когнитивных нарушений [30], в том числе при аффективной патологии [31]. Процедура отбора включала заполнение информированного согласия на участие в исследовании.
Статистическая обработка данных проводилась с использованием стандартных методов параметрической и непараметрической статистики. За критический уровень значимости принимался p=0,05. Для описания категориальных переменных использовались абсолютные значения и доли от целого — n (%). Переменные, имеющие непрерывный характер распределения, описывались средним и стандартным отклонением (М±σ), дискретные переменные и упорядоченные данные — медианой, 1—3-м квартилями (Md [Q1; Q3]). Нормальность распределения выборки оценивалась с помощью критерия Шапиро—Уилка и учитывалась при выборе метода. Для сравнения качественных данных использовался критерий χ2 Пирсона. Для сравнения количественных данных использовали критерий Манна—Уитни. Изучение корреляционной связи между показателями проводилось с помощью линейного корреляционного анализа — критерия Пирсона. Коррекция на множественное тестирование гипотез осуществлялась при помощи поправки Беньямини—Хохберга. Статистическая обработка материала выполнялась на ПЭВМ с использованием стандартного пакета программ прикладного статистического анализа — SPSS v 15.0 и MS Excel 2016.
Результаты
Основные социально-демографические характеристики выборки представлены в табл. 1. Статистически значимые различия в характеристиках заболевания БАР, а также профессиональном статусе пациентов с БАР I и II типов выявлены не были. Несмотря на то что большинство обследованных работали, 31,2 и 23,8% пациентов с БАР I типа и БАР II типа соответственно, согласно самооценке, испытывали затруднения в выполнении трудовой нагрузки. Важно отметить, что среди пациентов с БАР I типа лица с инвалидностью (n=18; 28,1% от числа пациентов с БАР I типа) встречались в 3 раза чаще, чем среди пациентов с БАР II типа (n=2; 9,5% от числа пациентов с БАР II типа).
Таблица 1. Основные социально-демографические характеристики пациентов
|
Основные характеристики |
БАР I типа (n=64) |
БАР II типа (n=21) |
Достоверность, р |
|
Возраст, годы (M±σ) |
37,3±6,5 |
34,5±6,8 |
0,195 |
|
Возраст начала заболевания, годы (M±σ) |
27,4±4,6 |
27,1±5,5 |
0,982 |
|
Длительность заболевания, лет (M±σ) |
9,9±5,0 |
7,3±4,3 |
0,171 |
|
Пол, n (%): |
|||
|
мужской |
24 (37,5) |
5 (23,8) |
χ2=0,8, df=1, p=0,377 |
|
женский |
40 (62,5) |
16 (76,2) |
χ2=0,8, df=1, p=0,377 |
|
Образование, n (%): |
|||
|
среднее |
2 (3,1) |
— |
χ2=0,8, df=3, p=0,845 |
|
среднеспециальное |
18 (28,1) |
7 (33,3) |
χ2=0,8, df=3, p=0,845 |
|
неоконченное высшее |
21 (32,8) |
4 (19,0) |
χ2=0,8, df=3, p=0,845 |
|
высшее |
9 (14,1) |
3 (14,3) |
χ2=0,8, df=3, p=0,845 |
|
Профессиональный статус, n (%): |
|||
|
работает по специальности |
18 (28,1) |
10 (47,6) |
χ2=8,8, df=6, p=0,186 |
|
работает не по специальности |
12 (18,8) |
4 (19,0) |
χ2=8,8, df=6, p=0,186 |
|
низкоквалифицированная работа |
10 (15,6) |
— |
χ2=8,8, df=6, p=0,186 |
|
учится |
5 (7,8) |
1 (4,8) |
χ2=8,8, df=6, p=0,186 |
|
не работает и не учится |
11 (17,2) |
1 (4,8) |
χ2=8,8, df=6, p=0,186 |
|
Инвалидность, n (%): |
|||
|
3-я группа |
8 (12,5) |
2 (9,5) |
χ2=4,1, df=2, p=0,128 |
|
2-я группа |
10 (15,6) |
— |
χ2=4,1, df=2, p=0,128 |
Хотя состояние всех пациентов соответствовало критериям ремиссии при БАР (табл. 2), резидуальные симптомы выявлены у 27 (42,2%) пациентов с БАР I типа и у 6 (28,6%) пациентов с БАР II типа (χ2=0,7, df=1, p=0,394).
Таблица 2. Результаты оценки аффективной симптоматики и характеристика резидуальных симптомов в выборке
|
Основные характеристики |
БАР I т. (n=64) |
БАР II т. (n=21) |
Достоверность, р |
|
HDRS, баллы (Md [Q1; Q3]) |
3,0 [2,0; 4,0] |
2,0 [2,0; 4,0] |
U=776,5, p=0,394 |
|
YMRS, баллы (Md [Q1; Q3]) |
2,0 [1,75; 3,0] |
2,0 [2,0; 3,0] |
U=670,5, p=0,992 |
|
Нарушения сна, n (%) |
13 (20,3%) |
2 (9,5%) |
χ²=0,6, df=1, p=0,426 |
|
Транзиторные аффективные колебания, n (%) |
5 (7,8%) |
2 (9,5%) |
χ²=0,6, df=1, p=0,426 |
|
Психологическое переживание ожидания наступления ухудшения, n (%) |
3 (4,7%) |
1 (4,8%) |
χ²=0,6, df=1, p=0,426 |
|
Умственное истощение, n (%) |
5 (7,8%) |
2 (9,5%) |
χ²=0,6, df=1, p=0,426 |
|
Нарушение аппетита, n (%) |
3 (4,7%) |
— |
χ²=0,1, df=1, p=0,742 |
У 45,3% (n=29) пациентов с БАР I типа и у 38,1% (n=8) пациентов с БАР II типа (χ2=0,34, df=1, p=0,56 в сравнении с больными БАР I типа) общий балл методики КНОКС был ниже 28 баллов, что соответствует легкому когнитивному дефициту. При этом средние значения общего балла КНОКС у пациентов с БАР I типа (28 [26,75; 29] баллов) и БАР II типа (29 [26; 29] баллов) соответствовали нормативному показателю и не обнаруживали статистически значимых различий (U=600,5; p=0,46). Профили когнитивных нарушений у пациентов с БАР I и II типов не имели статистически значимых различий (табл. 3).
Таблица 3. Характеристика когнитивных нарушений у пациентов с БАР в ремиссии (по данным КНОКС), баллы (Md [Q1; Q3])
|
Субтесты КНОКС |
БАР I типа (n=64) |
БАР II типа (n=21) |
Достоверность, p |
|
Ориентировка |
3 [3; 3] |
3 [3; 3] |
U=672; p=1,0 |
|
Память на президентов |
3 [2; 3] |
3 [2; 3] |
U=644; p=0,73 |
|
Называние |
3 [3; 3] |
3 [3; 3] |
U=672; p=1,0 |
|
Понимание |
3 [3; 3] |
3 [3; 3] |
U=661,5; p=0,57 |
|
Конструктивный праксис |
3 [3; 3] |
3 [3; 3] |
U=640,5; p=0,32 |
|
Балл 1-й части |
15 [14; 15] |
15 [14; 15] |
U=616; p=0,5 |
|
Набор последовательностей |
2 [2; 3] |
2 [3; 3] |
U=609,5; p=0,47 |
|
Незавершенные изображения |
3 [3; 3] |
3 [3; 3] |
U=630; p=0,24 |
|
Нахождение сходства |
3 [2; 3] |
3 [2; 3] |
U=663; p=0,91 |
|
Внимание |
2 [2; 3] |
3 [2; 3] |
U=552,5; p=0,17 |
|
Рабочая память |
3 [2; 3] |
3 [2; 3] |
U=635,5; p=0,66 |
|
Балл 2-й части |
13 [12; 14] |
14 [11; 14] |
U=608,5, p=0,51 |
С учетом того, что частота развития и структура когнитивных нарушений при БАР I и II типов в ремиссии не различались, был проведен анализ исследуемых факторов, представленных в табл. 1 и 2, на наличие связи с выраженностью когнитивных нарушений в выборке в целом. Выявлена ассоциированность общего балла КНОКС с возрастом пациентов, длительностью заболевания, общими баллами HDRS и YMRS (табл. 4). Частота выявления исследуемых факторов в выборке в зависимости от наличия или отсутствия у пациентов когнитивных нарушений представлена в табл. 5. Пациенты с когнитивными нарушениями (n=37; женщины — 70,3% ) и пациенты без когнитивных нарушений (n=48; женщины — 62,5% ) не различались по полу, однако средний возраст пациентов с когнитивными нарушениями был статистически значимо больше, чем у пациентов без когнитивных нарушений. Средняя длительность заболевания у пациентов с когнитивными нарушениями была также статистически значимо больше, чем у пациентов без когнитивных нарушений. Среднее значение общего балла HDRS у пациентов с когнитивными нарушениями было статистически значимо выше, а среднее значение общего балла YMRS у этих пациентов — ниже, чем у пациентов без когнитивных нарушений. Обследованные пациенты с когнитивными нарушениями характеризовались снижением скорости психических процессов, снижением рабочей памяти (низкие показатели по субтестам «Набор последовательностей», «Рабочая память») и нарушениями внимания (низкие показатели по субтесту «Внимание»). Пациенты с БАР I и II типов хуже справлялись со второй частью КНОКС, что косвенно говорит о поражении высших психических функций.
Таблица 4. Корреляция общего балла по шкале КНОКС и характеристиками БАР
|
Коэффициент |
Возраст пациентов |
Возраст начала заболевания |
Длительность заболевания |
Общий балл HDRS |
Общий балл YMRS |
|
Пирсона |
–0,507* |
–0,145 |
–0,544* |
–0,560* |
0,336* |
|
Статистическая значимость (p) |
0,000 |
0,185 |
0,000 |
0,000 |
0,002 |
Примечание. *Статистическая значимость корреляции на уровне p<0,01 (данные представлены в виде коэффициента Пирсона (r), статистической значимости p).
Таблица 5. Демографическая и клиническая характеристики пациентов в зависимости от наличия когнитивных нарушений
|
Показатель |
Пациенты с когнитивными нарушениями (n=37) |
Пациенты без когнитивных нарушений (n=48) |
Достоверность, p |
|
Общий балл КНОКС, (Md [Q1; Q3]) |
26 [25; 27] |
29 [28; 29] |
U=7,5; p<0,001 |
|
Женский пол, n (%) |
26 (70,3%) |
30 (62,5%) |
χ2=0,56, df=1, p=0,45 |
|
Возраст пациентов, годы (M±σ) |
39,41±6,2 |
34,44±6,21 |
p<0,001 |
|
Возраст начала заболевания, годы (M±σ) |
27,86±5,23 |
26,89±4,52 |
p=0,391 |
|
Длительность заболевания, годы (M±σ) |
11,54±5,16 |
7,54±3,95 |
p<0,001 |
|
Уровень депрессии (баллы по HDRS), (Md [Q1; Q3]) |
4 [2,5; 6] |
3 [1; 4] |
U=504,5; p=0,001 |
|
Уровень мании (баллы по YMRS), (Md [Q1; Q3]) |
2 [1; 2] |
3 [2; 4] |
U=598,5; p=0,008 |
|
Инвалидность, n (%) |
16 (43,2%) |
4 (8,3%) |
χ2=14,15, df=1, p<0,001 |
|
Число пациентов с резидуальными симптомами в ремиссии, n (%) |
23 (62,2%) |
10 (20,8%) |
χ2=15,03, df=1, p<0,001 |
Обсуждение
Настоящее исследование посвящено изучению когнитивных нарушений у пациентов с БАР в ремиссии. Преимуществом данного исследования является то, что в выборку были включены пациенты с БАР I и II типов. К числу ограничений исследования можно отнести относительно небольшой размер выборки, что в совокупности с длительностью набора пациентов в исследование косвенно подтверждает данные литературы о недостаточной выявляемости и диагностике БАР в России [32]. Хотя особенности фармакотерапии БАР в ремиссии рассматриваются как потенциальный причинный фактор когнитивных нарушений [33], мы не анализировали влияние фармакотерапии на наличие когнитивных расстройств в выборке ввиду больших индивидуальных различий в лечении у обследованных пациентов.
В ходе настоящего исследования когнитивные нарушения выявлены у 43,5% пациентов с БАР в ремиссии, что соответствует данным литературы [16]. Хотя тип БАР рассматривается как потенциальный фактор тяжести когнитивных нарушений [33], в нашем исследовании не были выявлены различия в структуре и частоте когнитивных нарушений у пациентов с БАР I и II типов, что подтверждает данные литературы об общем нейропсихологическом профиле когнитивного дефицита у пациентов с аффективными нарушениями [33, 34].
Наиболее значимыми по выраженности проявлениями когнитивных нарушений у обследованных пациентов явились снижение внимания, рабочей памяти и скорости психических процессов. Известно, что нарушения вербальной памяти и исполнительных функций часто встречаются у пациентов с БАР в ремиссии [24]. M. Kurtz и R. Gerraty в своем исследовании приходят к выводу, что дефицит исполнительных функций и вербального научения у пациентов с БАР чаще всего носит хронический характер [35]. Такие же данные приводят и отечественные исследователи. Так, например, в статье Л.И. Вассермана и соавт. [36] сообщается, что для пациентов с аффективными расстройствами более типичны нарушения, указывающие на дефицитарность исполнительных функций, функций планирования и организации познавательной деятельности. Нейропсихологически это проявляется в расстройстве процесса принятия решений [15]. Нарушения исполнительных функций, в том числе рабочей памяти, рассматриваются как важные компоненты эндофенотипа когнитивного функционирования при БАР, так как они сохраняются в ремиссии и имеют признаки наследственных [37, 38]. Рабочая память предложена в качестве еще одного потенциального компонента нейрокогнитивного эндофенотипа у пациентов с БАР в ремиссии [10]. Хотя в процессе скрининга методика КНОКС не позволяет оценить тонкие нарушения исполнительных функций, убедительные данные о нарушениях внимания и рабочей памяти у обследованных, а также различия в общих баллах первой и второй частей методики свидетельствуют в пользу вовлеченности именно этого набора когнитивных способностей и подтверждают данные литературы о превалировании нарушений исполнительных функций у пациентов с БАР в ремиссии [13].
Не вызывает сомнений, что нейропсихологические нарушения при БАР выявляются как во время обострений, так и в периоды эутимии, однако нет единого мнения, являются ли они стабильными во времени или больше связаны с актуальным состоянием [10]. Наши данные подтверждают обоснованность продолжающейся в настоящее время дискуссии о возможном изменении существующих критериев эутимии [39, 40]. Когнитивные нарушения чаще выявлялись у обследованных пациентов с резидуальными симптомами в ремиссии, а выраженность когнитивного дефицита была статистически значимо связана с клиническими характеристиками заболевания, такими как длительность заболевания и выраженность резидуальной симптоматики. Тот факт, что степень когнитивного дефицита обнаруживала прямую связь с выраженностью резидуальной симптоматики депрессивного полюса и обратную связь с выраженностью резидуальной симптоматики маниакального полюса, интерпретируется нами как свидетельство аффективной природы когнитивного дефицита у обследованных пациентов. Результаты исследования подтверждают данные литературы о негативном влиянии резидуальных симптомов на внимание и скорость психических процессов у пациентов с БАР в ремиссии [10, 23]. Наиболее частым резидуальным симптомом у обследованных пациентов были нарушения сна, что косвенно говорит в пользу возможных нарушений биологических ритмов у этих пациентов и, соответственно, подтверждает обоснованность суждений о необходимости терапевтического ведения субсиндромальных аффективных симптомов в период ремиссии [41].
Когнитивные нарушения у пациентов с БАР часто сочетаются с трудностями контроля поведения [42], что хорошо известно и ожидаемо в период обострения болезни, но остается недостаточно изученным в периоде ремиссии. Однако установлена взаимосвязь нарушений вербальной памяти с погрешностями в приеме поддерживающей терапии, в связи с чем когнитивные нарушения у пациентов с БАР в ремиссии представляются значимой терапевтической мишенью [43]. В связи с этим, на наш взгляд, целесообразно проводить скрининг пациентов на предмет когнитивных нарушений на этапе амбулаторного лечения с целью повышения качества медицинской помощи и уровня комплаенса. Для этого, по нашему опыту, может использоваться методика КНОКС, доступная для применения не только клиническими психологами, но и психиатрами.
Заключение
Установлено, что когнитивные нарушения встречаются у пациентов с БАР с высокой частотой (до 43%) вне зависимости от типа расстройства и проявляются преимущественно нарушениями исполнительных функций (это нарушения внимания, рабочей памяти, скорости психических процессов). Выявлена связь когнитивных нарушений и их выраженности с наличием субсиндромальной (резидуальной) симптоматики БАР в ремиссии. Наши данные свидетельствуют в пользу аффективной природы когнитивного дефицита при БАР и подтверждают необходимость разработки рекомендаций по терапевтической коррекции субсиндромальных аффективных симптомов БАР в ремиссии. Необходимо проведение дальнейших исследований, направленных на уточнение нейропсихологического эндофенотипа БАР и определение наиболее оптимальных стратегий терапевтических вмешательств при выявлении когнитивных нарушений у пациентов с БАР в ремиссии.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Мы используем файлы cооkies для улучшения работы сайта. Оставаясь на нашем сайте, вы соглашаетесь с условиями
использования файлов cооkies. Чтобы ознакомиться с нашими Положениями о конфиденциальности и об использовании
файлов cookie, нажмите здесь.
