Государственное бюджетное профессиональное образовательное учреждение Департамента здравоохранения города Москвы
«Медицинский колледж №5» филиал №4
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
Практического занятия
ПМ .04 «Проведение профилактических мероприятий»
МДК 01.03 « Технология оказания медицинских услуг»
Тема : «Взятие крови из вены на биохимическое исследование»
Для специальности 34.02.01 сестринское дело
Базовая подготовка
Рассмотрено
На заседании Методического совета
ГБПОУ ДЗМ «МК №5» филиала 4
Протокол №_____от ______2016г
2016
Автор: Абрамова И.В.
- Тема занятия
- Время, отведенное на изучение темы
- Вид занятия
- Методика проведения занятия
- Цели занятия (общая и конкретная)
- Хронологическая карта
- Оснащение
Тема занятия: «Взятие крови из вены для биохимического исследования»
Время, отведенное на изучение темы – 90 минут
Место проведения: кабинет доклинической практики
Вид занятия: доклиническое практическое
Методика проведения занятия: традиционный урок с элементами работы в «малых группах».
Общая цель: обучить студентов взятию крови из вены для биохимического исследования
Конкретные цели:
После изучения темы студент должен уметь:
- выбрать назначения на лабораторные исследования из листа назначений;
- подготовить посуду и оформить направления;
- объяснить пациенту сущность исследования и правила подготовки к нему;
- взять кровь из вены для биохимического исследования применять универсальные меры предосторожности для профилактики внутрибольничной инфекции, ВИЧ – инфекции и гепатита В.
Хронологическая карта
|
№ п/п |
Этап занятия |
Содержание занятия |
Время |
|
1. |
Организационный момент. |
Проверка присутствующих, их внешнего вида, готовности к занятию. |
2 мин. |
|
2. |
Актуализация темы. |
Определение целей занятия. |
3 мин. |
|
3. |
Проверка и коррекция исходного уровня знаний студентов. |
Метод фронтального опроса. |
15 мин. |
|
4. |
Изучение нового материала с демонстрацией на фантоме. |
Преподаватель объясняет тему: «Взятие крови из вены для биохимического исследования, на реакцию Вассермана и для выявления антител к ВИЧ – инфекции». Демонстрирует выборку назначений на диагностические исследования из листа назначений. |
30 мин. |
|
5. |
Самостоятельная работа студентов с последующей коррекцией. |
Отработка практических навыков, с использованием методического материала для студентов. Студенты работают малыми группами. |
20 мин. |
|
6. |
Тестовый контроль знаний. |
Решение тестов. Анализ тестового контроля. |
10 мин. |
|
7. |
Подведение итогов занятия. |
Преподаватель выставляет оценку студентам за работу на занятии и итогам тестового контроля. |
5 мин. |
|
8. |
Задание на дом. |
Объяснение домашнего задания. |
5 мин. |
|
Итого: |
90 мин. |
Оснащение занятия:
1. Методическое обеспечение :
- Методическая разработка для преподавателя – 1 шт.
- Методическая разработка для студентов – 10 шт.
2. Материальное обеспечение:
( из расчета на одну бригаду)
- Стерильные иглы для забора крови – 10шт.
- Одноразовые держатели – 10шт.
- Стерильные вакуумные сухие пробирки с резиновыми пробками – 20 шт.
- Штатив – 10 шт.
- Стерильные ватные тампоны
- Стерильные перчатки – 10 пар
- Маска, защитные очки
- 70% раствор этилового спирта
- Контейнер с ячейками для транспортировки пробирок в лабораторию – 1 шт.
- Аварийная аптечка
Тема: «Техника выполнения взятия крови на исследование»
- Глоссарий
- Введение (мотивация темы)
- Опорная лекция – конспект по теме: «Взятие крови из вены на исследование»
- Алгоритмы действий
|
Термин |
Определение |
|
Реакция Вассермана |
серологический метод диагностики сифилиса (в ряде случаев может давать ложноположительные результаты). |
|
Общеклиническое исследование крови |
количественное и качественное изучение форменных элементов крови (эритроцитов, лейкоцитов, тромбоцитов), определение количества гемоглобина, СОЭ. |
|
СОЭ |
скорость оседания эритроцитов |
|
Биохимическое исследование крови |
определение содержания в крови некоторых веществ (глюкозы крови, билирубина, холестерина, белка, креатинина и др.). |
|
ИФА |
иммуноферментативный анализ на ВИЧ-инфекцию. |
|
Гемопоэз |
процесс воспроизводства клеток в костном мозге. |
|
Гемолиз |
Процесс выхода клеток крови в плазму/сыворотку крови. |
Введение
Гематологические анализы более 100 лет используются в клинической практике. Однако, несмотря на такой длительный срок, многие из них не утратили своего значения и в настоящее время. Гематологические исследования представляют информацию о количестве клеток крови и их характеристиках. Оснащение КДЛ современными гематологическими автоанализаторами, которые могут предоставлять информацию о более чем 30 параметрах и характеристиках клеток крови, позволило значительно повысить клиническую информативность и точность результатов гематологических исследований.
Из всех лабораторных исследований наиболее часто в клинической практике назначается общий анализ крови, биохимическое исследование крови. Их результаты отражают как часто встречающихся, так и менее распространенные нарушения здоровья человека, которые могут проявляться отклонениями многих параметров крови от нормы. Часто общий анализ крови играет большую роль в постановке диагноза, а при заболеваниях системы кроветворения ему отводится ведущая роль.
Исследование крови
Различают общеклинические, биохимические, серологические и иммунологические исследования крови.
Цель общеклинического исследования крови – количественное и качественное изучение форменных элементов крови (эритроцитов, лейкоцитов, тромбоцитов), определение количества гемоглобина (Нв), скорости оседания эритроцитов (СОЭ).
Клеточный состав крови здорового человека достаточно постоянен, поэтому его изменения указывают на различные патологические процессы в организме.
Однако даже у здорового человека могут наблюдаться некоторые колебания состава крови в течение суток под влиянием пищи, физической нагрузки, количества принятой жидкости и т. д. Для устранения влияния этих факторов кровь для исследования следует брать при одинаковых условиях в одно и то же время (утром натощак) из пальца (возьмет лаборант).
Биохимическое исследование крови заключается в определении содержания в крови некоторых веществ (глюкозы крови, билирубина, холестерина, белка, креатина и др.) Их содержание изменяется при тех или иных заболеваниях (увеличивается или уменьшается), что позволяет использовать эти данные для постановки диагноза, а также контроля за проводимым лечением.
Серологические методы исследования дают возможность выявлять в крови больных или антитела, специфичные для определенного возбудителя инфекционного заболевания, или антигены (в большинстве случаев белки) самих микроорганизмов. В любом случае в основе всех серологических реакций лежит взаимодействие антигена и антитела.
Кровь для биохимического, серологического исследования берет медицинская сестра в процедурном кабинете. Для получения крови для лабораторных исследований используются три процедуры:
- Венепункция;
- Взятие капиллярной крови (из пальца);
- Пункция артерии.
Наиболее удобным местом взятия крови на анализы является локтевая вена. Венозная кровь – лучший материал не только для определения биохимических, гормональных, серологических, иммунологических показателей, но и для общеклинического исследования крови.
При взятии крови из пальца возможен ряд методических особенностей, которые стандартизировать очень трудно (холодные, цианотичные, отечные пальцы, необходимость в разведении исследуемой крови др.), что приводит к значительным разбросам получаемых результатов и как следствие к необходимости повторных исследований. Для общеклинического исследования кровь из пальца рекомендуется брать в следующих случаях:
- при ожогах, занимающих большую площадь поверхности тела пациента;
- при наличии у пациента очень мелких вен или когда они труднодоступны;
- при выраженном ожирении пациента;
- при установленной склонности к венозному тромбозу;
- у новорожденных.
Пункция артерии для взятия крови на лабораторные исследования используется редко, в основном для исследования газов крови.
Специалист, осуществляющий забор крови, должен строго выполнять меры безопасности на рабочем месте!
Медицинская сестра обязана:
- Кровь и другие биологические жидкости всех больных изначально рассматривать как инфицированные.
- Соблюдать уровни мытья рук.
- Надевать перчатки при контакте с биологическими жидкостями, в том числе и с кровью.
- Дезинфицировать перчатки переходя от одного больного к другому, или сменять их, если они одноразовые. Все другие предметы (приспособления), используемые при заборе крови, необходимо проверять (исправность, срок годности, достаточное количество) и располагать на рабочем месте так, чтобы их при необходимости можно было легко взять.
- Мыть руки сразу после снятия перчаток.
- Немедленно убирать пролитый или просыпанный инфицированный материал.
- Дезинфицировать использованный инструментарий, и перевязочный материал сразу после использования.
Положение пациента при взятии крови!
Лучше брать кровь в положении пациента лежа на кушетке или сидя, откинувшись на наклонную спинку кресла; следует учитывать опасность потери сознания больным. Всегда нужно проверять удобно ли ему.
Положение сидя. Пациент удобно сидит в кресле, положа руку на подлокотник (или на стол) так, чтобы она была почти прямой от запястья до плеча и имела хорошую опору. Ее чуть- чуть сгибают в локте. Процедурная сестра должна находиться перед пациентом, чтобы в случае обморока поддержать его и не дать ему упасть.
Положение лежа. Пациент удобно располагается на спине. Если нужна дополнительная опора для руки, под нее подкладывают подушку. Рука должна быть почти прямой (чуть согнутой в локте). Пациент не должен испытывать никакого физического напряжения при удержании руки в нужном положении.
Специалист, осуществляющий венепункцию или взятие крови из пальца, должен подготовить необходимые принадлежности: перчатки, пробирки, шприцы, иглы, жгут, 70% этиловый спирт, марлевые тампоны, бинты, ватные шарики. Их располагают так, чтобы они были легко доступны специалисту, не мешали пациенту и он не мог случайно их задеть, уронить, повредить.
Факторы, влияющие на лабораторные показатели:
1. Режим питания, состав принимаемой пищи, перерывы в ее приеме оказывают существенное влияние на ряд показателей лабораторных исследований. Например, после 48 ч голодания может увеличиваться концентрация билирубина в крови. Голодание в течение 72 ч снижает уровень глюкозы в крови у здоровых людей до 2,5 ммоль/л (45%), увеличивает концентрацию триглециридов, свободных жирных кислот без значительных изменений концентрации холестерина.
2. Физические упражнения. Физическая нагрузка может оказывать преходящее влияние или иметь длительное воздействие на различные параметры гомеостаза. Физические упражнения влияют на показатели гемостаза: активируют свертываемость крови и функциональную активность тромбоцитов. Длительная физическая нагрузка увеличивает в крови уровень половых гормонов.
3. Эмоциональный стресс. Степень влияния психического стресса (страх перед взятием крови, предоперационный стресс и т. д.) на результаты лабораторных тестов часто медицинскими сестрами недооценивается. Между тем под его влиянием в крови может наблюдаться преходящее повышение количества лейкоцитов в крови (лейкоцитоз), снижение уровня железа, увеличение уровня катехоламинов, альдестерона, глюкозы, холестерина и др.
4. Суточные ритмы гомеостаза. При назначении лабораторных исследований необходимо учитывать и суточные ритмы колебаний некоторых показателей гомеостаза. Уровень некоторых гормонов в крови в послеобеденные часы снижается, в то время как число эозинофилов и уровень железа повышаются. Достоверно значимые изменения ряда показателей могут быть вызваны колебаниями уровня гормонов при менструации.
5. Влияние лекарственных средств. Некоторые лекарственные средства могут оказывать существенное влияние на результаты лабораторных исследований. Например, прием аспириносодержащих препаратов при определении времени длительности кровотечения по Дуке должен быть отменен за 7-10 дней до проведения исследований. Если принимаемый пациентом лекарственный препарат может повлиять на результат анализа, то при невозможности его отмены врач лаборатории должен об этом знать.
6. Другие факторы. Среди других факторов, влияющих на результаты исследований, имеют значение возраст, пол, беременность, географическое положение местности, высота над уровнем моря, температура окружающей среды, курение табака. В связи с этим лабораториям рекомендуется устанавливать индивидуальные локальные референтные (нормальные) величины для своей популяции.
Памятка для пациентов, у которых будет взята кровь на лабораторные исследования:
(общие положения)
Вам необходимо:
- Не принимать пищу после ужина.
- Лечь спать накануне в обычное для Вас время и встать не позднее чем за 1 час до взятия крови.
- Утром после подъема воздержаться от курения.
- Если Вы испытываете трудности с отменой лекарств, то обязательно сообщите об этом лечащему врачу. Кровь на анализы сдают утром до приема лекарственных средств.
- Кровь следует сдавать до проведения рентгенологического, эндоскопического или ректального исследования или физиотерапевтических процедур.
- Непосредственно перед взятием крови на анализы необходимо исключит физическое напряжение (бег, подъем по лестнице), эмоциональное возбуждение. Поэтому непосредственно перед процедурой следует отдохнуть 10-15 мин и успокоиться.
- Очень важно, чтобы Вы точно следовали указанным рекомендациям, так только в этом случае будут получены правильные результаты исследования.
Осложнения и возможные затруднения при взятии крови.
- Обморок. Чтобы избежать это осложнения и его последствий, лучше брать кровь, когда пациент находиться в положении лежа.
- Гематома. Если начинает появляться гематома, необходимо сразу снять жгут и вынуть иглу из вены, после чего наложить давящую повязку на место пункции.
- Отек. Лучше не брать кровь там, где имеются отек, иначе межтканевая жидкость попадет в кровь и результаты исследования будут искажены.
- Ожирение. У людей с ожирением трудно найти вену и произвести ее пункцию. При заборе крови в нее может попасть много межтканевой жидкости и активаторов свертывания крови.
- Поврежденные и склерозированные вены бывают у пациентов после многократных венепункций (внутривенное введение лекарств). При заборе крови на исследование нужно избегать таких вен.
- Гемолиз. Причиной гемолиза может быть слишком тонкая игла для венепункции, очень быстрые движения поршня шприца, неаккуратное (быстрое) переливание крови из одной емкости в другую, очень интенсивное перемешивание (встряхивание), длительное положение жгута (более 2 мин). Необходимо помнить, что причиной гемолиза может быть физиологическая «ненормальность» эритроцитов, о чем необходимо предупредить лабораторию.
- Гемоконцентрация. Причинами этого осложнения являются длительное наложение жгута, массаж и сжимание места взятия крови, склерозированные или окклюзированные вены.
- Спавшиеся вены – обычно небольшие вены, из которых хотят слишком быстро забрать («выкачать») кровь шприцем.
- Тромбоз вен после пункции обычно возникает у пациентов со склонностью к гиперкоагуляции, он также может появится при повторных пункциях в одно и том же месте.
- Инфекционные осложнения возникают при нарушении правил асептики и антисептики.
Типичные ошибки при взятии проб крови.
Наиболее часто встречающиеся ошибки при взятии проб крови можно разделить на три типа:
1 тип — ошибки на этапе подготовки к взятию крови — ошибки первого типа могут быть обусловлены факторами, связанные с пациентом (несоблюдение правил подготовки) и действиями медицинской сестры. Типичные ошибки, которые допускают медицинские сестра, связаны с неправильной идентификацией пациента и неверным выбором приспособлений (пробирок) для взятия проб крови.
2 тип – ошибки при проведении процедуры взятия крови — ошибки при проведении процедуры взятия крови состоит в том, что медицинские сестры после наложения жгута нередко просят пациента поработать кистью рук. Это грубая ошибка, которая может привести к искажению ряда биохимических показателей у больного. Переливание крови из шприца в пробирку под давлением поршня тоже является типичной ошибкой, результатом которой бывает гемолизированная проба. Превышение времени наложения жгута при заборе проб крови – еще одна типичная ошибка. Частой ошибкой этого типа является несоблюдение правильного соотношения кровь/антикоагулянтом.
3 тип – ошибки при подготовке отобранных проб к отправке в лабораторию, нарушение температурного, светового режима хранения, условий и времени транспортировки. Типичные ошибки третьего типа наиболее часто включают превышение установленного времени доставки проб крови в лабораторию.
Приспособления, используемые для взятия проб крови.
Одним из важных моментов при взятии проб крови на лабораторные исследования является выбор приспособлений для выполнения этой процедуры.
Широко используемые в настоящее время у нас в стране способы взятия проб венозной крови являются основной и традиционной причиной их низкого качества, результатов лабораторных анализов и даже лабораторных ошибок. Они не могут быть стандартизированы и не обеспечивают безопасность пациента и медицинского персонала.
Использование медицинского шприца с иглой для взятия крови следует избегать:
- из – за недостаточной безопасности для медицинского персонала;
- из – за возможного гемолиза крови при переносе пробы под давлением из шприца в пробирку;
- из – за высокой вероятности попадания крови пациента на руки медицинского персонала. В этом случае руки медицинской сестры могут стать источником передачи и распространения возбудителей гемоконтактных инфекций другому пациенту путем контаминации кровью инъекционной ранки.
Поэтому для взятия проб крови предпочтительнее использовать одноразовые фирменные приспособления, например, вакуум – содержащие системы.
Этот способ имеет ряд преимуществ:
- кровь попадает непосредственно в закрытую пробирку, предотвращающую любой контакт медицинского персонала с кровью пациента;
- повышает качество результатов лабораторных исследований;
- имеют цветную маркировку для различных видов исследования;
- содержат антикоагулянт или другие наполнители, что позволяет соблюдать правильное соотношение между объемами крови и антикоагулянтов;
- позволяет максимально стандартизировать процедуру взятия крови, контролировать качество приспособлений (срок годности, условия хранения) ;
- при заборе крови в обычные пробирки взятый объем крови у пациента в среднем в 45 раз превышает необходимый для анализов, при взятии крови в вакуум–содержащие пробирки только в 7 раз;
- возможность прямого использования в качестве первичной пробирки;
- герметичная упаковка проб крови и небьющиеся пробирки, что упрощает и делает безопасным процесс транспортировки и центрифугирования;
- простая методика обучения персонала.
Для взятия крови наиболее часто используют приспособления фирм « BECTON DICKINSON» (вакутейнеры) и «САРШТЕДТ» (моноветты). Все они предназначены для разового использования.
- Приспособления фирмы «САРШТЕДТ» представляют собой шприцы-пробирки (моноветты) для венозной крови с антикоагулянтами (гепарин, цитрат натрия и др.) или наполнителями для ускорения свертываемости крови и микроветты для взятия капиллярной крови (из пальца). Изготовлены из пластмассы.
- Вакуумная система для взятия крови вакутейнер состоит из трех основных элементов: соединяющихся между собой в процессе взятия крови: стерильной одноразовой пробирки с крышкой и дозированным содержанием вакуума без наполнителей, с антикоагулянтами (гепарин, цитрат натрия, ЭДТА), наполнителями для ускорения свертываемости крови или ингибиторами гликолиза, стерильной одноразовой двусторонней иглы, закрытой с обеих сторон защитными колпачками, и одно- или многоразового иглодержателя. Изготовлена из пластмассы.
Забор крови из вены на биохимическое исследование крови.
Цель: диагностическая.
Техника выполнения алгоритма действий при взятии крови из вены на биохимическое исследование вакуумной системой
Примечание: при невыполнении этапа, отмеченного знаком*, дальнейшие действия не оцениваются (выполнение манипуляции прекращается), выставляется «0» баллов за всю манипуляцию.
|
№п/п |
Этапы |
Исходный балл |
Полученный балл |
|
I. Подготовка к процедуре |
|||
|
|
Идентифицировать пациента, представиться, объяснить ход и цель процедуры. Убедиться в наличии у пациента информированного согласия на предстоящую процедуру взятия крови. В случае отсутствия такового уточнить дальнейшие действия у врача. |
1 |
|
|
|
Предложить пациенту или помочь ему занять удобное положение: сидя или лежа |
1 |
|
|
|
Промаркировать пробирки, указав ФИО пациента, отделение» (с целью исключения ошибки при идентификации пробы биоматериала). |
1 |
|
|
|
Обработать руки гигиеническим способом, осушить. |
1* |
|
|
|
Обработать руки антисептиком. Не сушить, дождаться полного высыхания антисептика. |
1 |
|
|
|
Надеть нестерильные перчатки. |
1* |
|
|
|
Выбрать пробирки, соответствующие заявленным тестам или необходимым пациенту лабораторным исследованиям, приготовить иглу, держатель, спиртовые салфетки, пластырь. |
1 |
|
|
|
Наложить жгут на рубашку или пеленку на 7-10 см выше места венепункции. Жгут нужно накладывать не более, чем на одну минуту. Большее время сдавливания вены может повлиять на результаты анализов вследствие изменения концентраций в крови некоторых показателей. |
1 |
|
|
|
Попросить пациента сжать кулак. Нельзя задавать для руки физическую нагрузку (энергичное «сжимание и разжимание кулака»), так как это может привести к изменениям концентрации в крови некоторых показателей. Выбрать место венепункции. Наиболее часто используются средняя локтевая и подкожные вены, однако можно пунктировать и менее крупные и полнокровные вены тыльной поверхности запястья и кисти. |
1 |
|
|
II. Выполнение процедуры |
|||
|
|
Взять иглу и снять защитный колпачок с нее. Если используется двусторонняя игла – снять защитный колпачок серого или белого цвета. |
1 |
|
|
|
Вставить иглу в иглодержатель и завинтить до упора. |
1 |
|
|
|
Продезинфицировать место венепункции марлевой салфеткой или тампоном, смоченным антисептическим раствором, круговыми движениями, от центра к периферии. |
1 |
|
|
|
Подождать до полного высыхания антисептического раствора (30-60 секунд). Нельзя вытирать и обдувать место прокола, чтобы не занести на него микроорганизмы. Нельзя также пальпировать вену после дезинфекции. Если во время венепункции возникли сложности, и вена пальпировалась повторно, эту область нужно продезинфицировать снова. |
1 |
|
|
|
Снять колпачок с другой стороны иглы. |
1 |
|
|
|
Обхватить левой рукой предплечье пациента так, чтобы большой палец находился на 3-5 см. ниже места венепункции, натянуть кожу. |
1 |
|
|
|
Расположить иглу по одной линии с веной, скосом вверх, и пунктировать вену под углом 15 – 30 градусов к коже. |
1 |
|
|
|
Вставить заранее приготовленную пробирку в иглодержатель до упора и удерживать ее, пока кровь не перестанет поступать в пробирку. Жгут необходимо снять сразу же после начала поступления крови в пробирку. Убедиться, что пациент разжал кулак. Кровь проходит в пробирку, пока полностью не компенсирует созданный в ней вакуум. Если кровь не идет, это значит, что игла прошла вену насквозь — в этом случае нужно немного вытянуть иглу, но не вынимать, пока кровь не пойдет в пробирку. Точность заполнения пробирки составляет ±10 % от номинального объема. |
1 |
|
|
|
Извлечь пробирку из держателя. |
1 |
|
|
|
Сразу же после заполнения пробирку нужно аккуратно перевернуть для смешивания пробы с наполнителем: пробирку без антикоагулянтов – 5-6 раз; пробирку с цитратом – 3-4 раза, пробирку с гепарином, ЭДТА и другими добавками – 8-10 раз. Пробирки нельзя встряхивать — это может вызвать пенообразование и гемолиз, а также привести к механическому лизису эритроцитов. |
1 |
|
|
|
Если это необходимо, в иглодержатель вставляется ряд других пробирок для получения нужного объема крови для различных исследований. Повторно вводить иглу в вену для этого не нужно. |
1 |
|
|
|
После того как все необходимые пробирки будут наполнены, приложить сухую стерильную салфетку к месту венепункции и извлечь иглу. |
1 |
|
|
III. Окончание процедуры |
|||
|
|
Использованную иглу вместе с одноразовым держателем поместить в контейнер для острых предметов. Многоразовые держатели отсоединяются путем помещения иглы в специальное отверстие в крышке контейнера. Игла откручивается от держателя, оставаясь в контейнере. В целях предотвращения контакта с кровью запрещается разбирать иглу и держатель в руках! |
1* |
|
|
|
Убедиться, что наружного кровотечения у пациента в области венепункции нет. |
1 |
|
|
|
Наложить давящую повязку на руку или бактерицидный пластырь. |
1 |
|
|
|
Обработать руки в перчатках дезинфицирующим средством. |
1 |
|
|
|
Подвергнуть дезинфекции весь использованный материал. Снять перчатки, поместить в емкость для дезинфекции или непромокаемый пакет/контейнер для утилизации отходов класса Б. |
1* |
|
|
|
Обработать руки гигиеническим способом, осушить. |
1 |
|
|
|
Уточнить у пациента о его самочувствии. |
1 |
|
|
|
Сделать соответствующую запись о результатах выполнения услуги в медицинскую документацию или оформить направление |
1 |
|
|
|
Организовать доставку пробирок с полученным лабораторным материалом в лабораторию. |
1 |
|
|
ИТОГО |
30 |
Критерии оценки 100-60% вид деятельности освоен
59% и менее вид деятельности не освоен
|
Отметка |
«2»59% и менее |
«3»69-60% |
«4» 89-70% |
«5»100-90% |
|
Баллы |
Менее 18 |
20 — 18 |
26 — 21 |
30 — 27 |
- Вопросы для самоподготовки
- Материалы для контроля исходного уровня знаний:
- вопросы для фронтального опроса
- эталоны ответов к фронтальному опросу
- Материалы для контроля знаний в виде заданий в тестовой форме.
- Эталоны ответов к терминологическому диктанту
Вопросы для самоподготовки
- Основы кроветворения.
- Техника забора крови из вены.
- Подготовка пациента к лабораторным исследованиям.
- Определение понятия «Дезинфекция».
- Дезинфекция отработанного материала, использованных шприцев, игл, перчаток.
- Определение понятия «Стерилизация».
- Общие меры безопасности медицинской сестры на рабочем месте.
- Правила выписки направления для лабораторного исследования.
- Использование аварийной аптечки
Вопросы для фронтального опроса
- Дать определение понятию «Гемопоэз».
- В чем заключается общеклиническое исследование крови?
- В чем заключается биохимическое исследование крови?
- Дать определение «Реакция Вассермана»?
- Какие процедуры используются для получения крови для лабораторных исследований?
- Перечислите общие меры безопасности медицинской сестры на рабочем месте.
- Назовите ошибки, которые могут возникнуть при взятии проб крови.
- Какие осложнения и возможные затруднения могут возникнуть при взятии крови?
- Дать определение понятию «Гемолиз».
Эталоны ответов к фронтальному опросу.
1. Гемопоэз – процесс воспроизводства клеток крови, который происходит в костном мозге.
2. Общеклиническое исследование крови заключается в количественном и качественном изучении форменных элементов крови (эритроцитов, лейкоцитов, тромбоцитов), определение количества гемоглобина, СОЭ.
3. Биохимическое исследование крови заключается в определении содержания в крови некоторых веществ (глюкозы крови, билирубина, холестерина, белка, креатинина и др.).
4. Реакция Вассермана — серологический метод диагностики сифилиса (в ряде случаев может давать ложноположительные результаты).
5. Для получения крови для клинических лабораторных исследований используются три процедуры:
- венепункция;
- взятие капиллярной крови;
- пункция артерии.
Наиболее удобным местом для взятия крови на анализы является локтевая вена. Венозная кровь — лучший материал не только для биохимических, гормональных, серологических, иммунологических показателей, но и для общеклинического исследования.
6. Общие меры безопасности медицинской сестры на рабочем месте.
Медицинская сестра обязана:
- Кровь и другие биологические жидкости всех больных изначально рассматривать как инфицированные.
- Соблюдать уровни мытья рук.
- Надевать перчатки при контакте с биологическими жидкостями, в том числе и с кровью.
- МЕНЯТЬ перчатки переходя от одного больного к другому.
- Все другие предметы (приспособления), используемые при заборе крови, необходимо проверять (исправность, срок годности, достаточное количество) и располагать на рабочем месте так, чтобы их при необходимости можно было легко взять.
- Мыть руки сразу после снятия перчаток.
- Немедленно убирать пролитый или просыпанный инфицированный материал.
- Дезинфицировать использованный инструментарий, и перевязочный материал сразу после использования.
7. Осложнения и возможные затруднения при взятии крови:
- Обморок. Чтобы избежать это осложнения и его последствий, лучше брать кровь, когда пациент находиться в положении лежа.
- Гематома. Если начинает появляться гематома, необходимо сразу снять жгут и вынуть иглу из вены, после чего наложить давящую повязку на место пункции.
- Отек. Лучше не брать кровь там, где имеются отек, иначе межтканевая жидкость попадет в кровь и результаты исследования будут искажены.
- Ожирение. У людей с ожирением трудно найти вену и произвести ее пункцию. При заборе крови в нее может попасть много межтканевой жидкости и активаторов свертывания крови.
- Поврежденные и склерозированные вены бывают у пациентов после многократных венепункций (внутривенное введение лекарств). При заборе крови на исследование нужно избегать таких вен.
- Гемолиз. Причиной гемолиза может быть слишком тонкая игла для венепункции, очень быстрые движения поршня шприца, неаккуратное (быстрое) переливание крови из одной емкости в другую, очень интенсивное перемешивание (встряхивание), длительное положение жгута (более 2 мин). Необходимо помнить, что причиной гемолиза может быть физиологическая «ненормальность» эритроцитов, о чем необходимо предупредить лабораторию.
- Гемоконцентрация. Причинами этого осложнения являются длительное наложение жгута, массаж и сжимание места взятия крови, склерозированные или окклюзированные вены.
- Спавшиеся вены – обычно небольшие вены, из которых хотят слишком быстро забрать(«выкачать») кровь шприцем.
- Тромбоз вен после пункции обычно возникает у пациентов со склонностью к гиперкоагуляции, он также может появится при повторных пункциях в одно и том же месте.
- Инфекционные осложнения возникают при нарушении правил асептики и антисептики.
8. Типичные ошибки при взятии проб крови
Наиболее часто встречающиеся ошибки при взятии проб крови можно разделить на три типа:
1 тип — ошибки на этапе подготовки к взятию крови — ошибки первого типа могут быть обусловлены факторами, связанные с пациентом (несоблюдение правил подготовки) и действиями медицинской сестры. Типичные ошибки, которые допускают медицинские сестра, связаны с неправильной идентификацией пациента и неверным выбором приспособлений (пробирок) для взятия проб крови.
2 тип – ошибки при проведении процедуры взятия крови — ошибки при проведении процедуры взятия крови состоит в том, что медицинские сестры после наложения жгута нередко просят пациента поработать кистью рук. Это грубая ошибка, которая может привести к искажению ряда биохимических показателей у больного. Переливание крови из шприца в пробирку под давлением поршня тоже является типичной ошибкой, результатом которой бывает гемолизированная проба. Превышение времени наложения жгута при заборе проб крови – еще одна типичная ошибка. Частой ошибкой этого типа является несоблюдение правильного соотношения кровь/антикоагулянтом.
3 тип – ошибки при подготовке отобранных проб к отправке в лабораторию, нарушение температурного, светового режима хранения, условий и времени транспортировки. Типичные ошибки третьего типа наиболее часто включают превышение установленного времени доставки проб крови в лабораторию.
9. Гемолиз — процесс выхода клеток крови в плазму/сыворотку крови.
Инструкция
для самостоятельной работы студентов.
Студенты разделяются на малые группы по два человека.
Распределить группу: один медработник, второй – пациент. Затем меняются ролями.
Задание: отработать алгоритмы манипуляций с использованием методического материала для студентов.
На выполнение отводится 15 минут.
Работу малых групп контролирует преподаватель.
Задания в тестовой форме
по теме: «Взятие крови из вены на исследование»»
Выберите все правильные ответы:
1. Наиболее часто встречающиеся ошибки при проведении забора крови для лабораторного исследования:
- ошибки, связанные с неправильной идентификацией пациента;
- медицинские сестры после наложения жгута нередко просят пациента поработать кистью рук;
- длительное положение жгута (более 2 мин).
- транспортировка проб крови доставляется в лабораторию как можно быстрее.
2. Лучшим местом для венепункции является:
- сгиб локтевого сустава (серединная) вена;
- вены на кисти;
- вены на предплечье;
- вены на стопе.
3. При попадании крови пациента на кожу медицинской сестры необходимо:
- обработать кожу раствором борной кислоты;
- вымыть кожу с мылом. Обработать данный участок кожи антисептическим раствором.
- вымыть кожу с мылом под проточной водой.
- обработать кожу ДЕЗСРЕДСТВОМ.
4. Медицинская сестра на рабочем месте должна соблюдать следующие меры безопасности:
- Кровь всех больных изначально рассматривать как инфицированную.
- соблюдать уровни мытья рук;
- Проводить забор крови в перчатках, маске.
- Дезинфицировать использованный инструментарий, и перевязочный материал сразу после использования.
5. Реакция Вассермана это:
- определение содержания в крови некоторых веществ (глюкозы, холестерина);
- определение количественного и качественного изучения форменных элементов крови (эритроцитов, лейкоцитов, тромбоцитов);
- гормональный метод исследования крови;
- серологический метод диагностики сифилиса.
6. Биохимическое исследование крови это:
- определение количественного и качественного изучения форменных элементов крови (эритроцитов, лейкоцитов, тромбоцитов);
- иммунологический метод исследования крови;
- определение содержания в крови некоторых веществ (глюкозы, холестерина, билирубина, АСТ, АЛТ и др.).
- определение содержания гемоглобина в крови.
7. Осложнения и возможные затруднения при взятии крови:
- гемолиз;
- острая игла;
- отек;
- склерозированные вены.
8. Причиной гемолиза может быть:
- слишком тонкая игла, выбранная для венепункции
- очень быстрые движения поршня шприца;
- неаккуратное (быстрое) переливание крови из одной емкости в другую;
- длительное положение жгута (более 2 мин).
9. Кровь для исследования берут:
- утром натощак;
- утром после завтрака;
- независимо от приема пищи;
- пациент не должен принимать пищу после ужина, утром натощак.
10. Общим правилом для пациента, у которого будет взята кровь на лабораторные исследования, является все нижеперечисленное, кроме:
- забор крови проводится независимо от проведения рентгенологического, эндоскопического исследований;
- непосредственно перед процедурой необходимо отдохнуть 10-15 мин. (исключить бег, подъем по лестнице, эмоциональное возбуждение);
- кровь на анализы сдают утром до приема лекарственных средств;
- утром после подъема воздержаться от курения;
11. Оптимальное время для взятия проб крови на анализы:
- между 6 и 9 ч утра;
- между 7 и 9 ч;
- между 8 и 9 ч;
- между 7 и 8 ч.
12. Для исследования крови из вены необходимо взять:
- 5 – 7 мл крови;
- 3 – 4 мл крови;
- 1 – 2 мл крови;
- 4 мл крови.
Эталон ответов к тестовым заданиям
по теме: «Взятие крови из вены для исследования»
1. 1, 2, 3;
2. 1;
3. 2;
4. 1, 2, 3, 4;
5. 4;
6. 3;
7. 1, 2, 3;
8. 1, 2, 3, 4;
9. 4;
10. 1;
11. 2;
12. 1;
Критерии оценки:
1. 0-1 ошибки (100% — 90%) — «5» баллов
2. 2 ошибки (89%-80%) — «4» балла
3. 3 ошибки (79%-70%) — «3» балла
4. более 3 (69% и менее) – «2» балла
Задание на дом
Тема: «Взятие крови из вены для исследования».
1. Техника взятия крови из вены на ВИЧ-инфекцию.
2. Осложнения и возможные затруднения при взятии крови.
3. Типичные ошибки при взятии проб крови.
4. Меры безопасности, которые должны соблюдать медицинские работники на рабочем месте.
5. Общие правила для пациентов, у которых будет взята кровь на лабораторные исследования.
6. Дезинфекция использованного материала, шприцев, игл, перчаток.
7. Подготовка пациента к исследованию мокроты.
Литература
1.Мухина С.А., Тарновская И.И.- Практическое руководство к предмету: «Основы сестринского дела», учебник – М. Родник, 2014 г. Стр.248-250, стр.302-303.
2.Сан Пин 2010 г
Лабораторная практика традиционно делится на три этапа: преаналитический, аналитический и постаналитический.
Преаналитическая фаза включает в себя правильный отбор образцов, предоставление информации о пациенте, сбор и маркировку образцов, обработку образцов, сортировку, титрование и центрифугирование. Любой из этих шагов может быть пропущен, что приведет к неточным результатам, которые приписываются преаналитической фазе.
Преаналитические ошибки при исследовани общего анализа крови чаще всего вызваны неверным пониманием запроса на анализ, неправильной маркировкой, контаминацией места отбора, гемолизом, сгустками, недостаточным количеством образцов, проблемами хранения и несоответствующей пропорцией крови к антикоагулянту или неправильным выбором антикоагулянта.
Общая частота неточностей в лабораторных работах, согласно G. Lippi et.al. (2010), варьируется от 0,1% до 3,0%. Считается, что преаналитические ошибки составляют от 46% до 68,2% ошибочных диагнозов, в то время как аналитические ошибки, которые были в центре внимания более ранних исследований, составляют лишь около 10% всех ошибочных диагнозов (Hammerling J., 2013). Кроме того, преаналитические ошибки составляют от 18,5% до 47% всех лабораторных ошибок.
Наиболее распространенными преаналитическими ошибками являются отсутствие медицинской информации, неподходящие контейнеры и потерянные образцы.
Несмотря на то, что существуют международные стандарты отбора проб крови и стандартизации процесса тестирования, соблюдение руководящих принципов здесь крайне низкое, особенно тогда, когда лабораторный персонал не привлекается, а медсестры или врачи выполняют забор крови, частота преаналитических ошибок становится очень высокой.
Кроме того, критерии отбраковки образцов различаются в разных лабораториях. Не хватает профессиональных данных по отчетности, анализу первопричин и стратегиям предотвращения лабораторных ошибок (Lima-Oliveira G, et.al., 2012).
Наиболее распространенной преаналитической ошибкой являются изменения условий хранения из-за задержки при транспортировке, на которые приходится 19,45%, за которыми следуют пробы, забракованные из-за неверных медицинских записей- 19,16%. Общее количество забракованных разбавленных проб составляет 16,35%, а количество забракованных проб из-за неправильных пробирок составляет 16,01%). Отклоняется гемолизированных образцов — 15,13%. Немеченые образцы отклоняются в количестве 10,01%, а образцы со сгустками составляют 3,88% от общего числа забракованных образцов (Toor N., et. al., 2023)
Низкая удовлетворенность пациентов напрямую связана с лабораторными ошибками и высокими затратами как для пациентов, так и для системы лабораторных услуг.
Негативное влияние лабораторных ошибок на лечение пациентов не ограничивается тем фактом, что они увеличивают время обработки, требуют дополнительных заборов крови и приводят к неточным диагнозам и неподходящим лекарствам; они также наносят ущерб репутации лаборатории и подрывают доверие пациентов к диагностическим услугам. Было подсчитано, что лабораторная ошибка оказывает негативное влияние на результаты лечения пациентов до 24,4% (Lippi G., et.al., 2006).
Этот процесс приводит к увеличению финансовой нагрузки на систему здравоохранения. Согласно исследованию S. Green (2013), расходы на преаналитические ошибки составляют от 0,23% до 1,2% всего операционного бюджета больниц.
Сбор крови
Количество и концентрация дикалийэтилендиаминтетрауксусной кислоты (EDTA) в пробирке для сбора крови требуют, чтобы кровь собиралась до определенной отметки на пробирке. Если собрано слишком мало крови, разбавление образца может привести и к изменению параметров. Относительный избыток EDTA в таких случаях также влияет на морфологию клеток крови.
Транспортировка крови
Транспортировка образца должна исключать высокую температуру. Фрагментация эритроцитов при этом является признаком избыточного тепла. Ложно высокое количество лейкоцитов (WBC) при высокой температуре встречается чаще, чем ложно низкое. Известно, что в определенных ситуациях гематологические анализаторы обеспечивают ложное PLT, когда истинное количество тромбоцитов является адекватным.
Физиологические и физические факторы, влияющие на показатели общего анализа крови
Несколько физиологических и физических факторов могут повлиять на результаты CBC и затруднить установление референтных значений. Физиологические факторы включают возраст, этническую принадлежность, пол, сезон, время суток, питание, болезни, стресс, травмы др.
К важным физическим факторам относятся место забора крови, наличие и тип антикоагулянта, а также обработка и подготовка образцов (Dyer D.Cervasio S.,2008). Любая интерпретация результатов должна учитывать эти факторы.
Преаналитические ошибки результатов общего анализа крови
Потеря образца
Отсутствие полноценного запроса на анализ
Неправильная маркировка (19,16% преаналитических ошибок)
Сбор крови
Контаминация места, в котором производится забор крови
Недостаточное количество образца крови
Неправильный выбор антикоагулянта, относительный избыток или дефицит EDTA (16,45% преаналитических ошибок)
Неправильные пробирки (16,01%)
Гемолиз in vitro (15,13% преаналитических ошибок)
Наличие сгустков крови (3,88% преаналитических ошибок)
Транспортировка
Задержка транспортировки (19, 45% преаналитических ошибок)
Неподходящие контейнеры
Высокая температура окружающей среды при транспортировке
<RBC (фрагментация эритроцитов)
WBC >
Неправильное хранение
Высокая температура окружающей среды при хранении
<RBC (фрагментация эритроцитов)
WBC >
Первоначальное замораживание с последующим охлаждением
Нарушение срока хранения образца крови при определенной температуре
Хранение крови
Отложенный анализ проб по организационным, техническим причинам или проверке сомнительных результатов, которые необходимо уточнить — не редкость в клинической практике. Кроме того, реорганизация лабораторных служб по всему миру влечет за собой объединение небольших лабораторий в более крупные, что особенно важно в эпоху новых инициатив в области общественного здравоохранения. Большое количество образцов отправляется из периферийных центров в централизованную лабораторию на большие расстояния, тем самым происходит задержка на 12-24 часа или даже более. Более того, в выходные дни этот интервал может превышать 36 часов. Это важно уситывать в связи с тем, что CBC является наиболее часто проводимым лабораторным тестом, дающим основную и ценную информацию не только для облегчения диагностики и направления дальнейшего тестирования, но и для мониторинга состояния пациента, включая оценку эффективности терапии.
В большинстве случаев мы не можем сразу провести анализ, поэтому информацией о том, как долго мы можем хранить образцы для получения надежных результатов, должны владеть как сотрудники лаборатории, так и врачи.
В литературе большинства производителей автоматических анализаторов часто упоминается, что образцы крови, хранящиеся либо при комнатной температуре, либо при 4 ± 2°C (в холодильнике) до 24 часов, как правило, дают надежные результаты для общего анализа крови и автоматизированного дифференциального подсчета лейкоцитов. Однако, хранение при комнатной температуре может вызвать изменения этилендиаминтетраацетата (EDTA) и количественное влияние хранения на кровь, поскольку известно, что клеточные элементы обладают ограниченной стабильностью в EDTA. В то же время, было отмечено, что хранение в холодильнике крови с антикоагулянтом EDTA улучшает стабильность общего анализа крови (Gulati G., et.al., 2002).
В соответствии с рекомендациями Международного комитета по гематологической стандартизации, максимальные интервалы хранения для общего и лейкоцитарного подсчета с автоматическим дифференциальным подсчетом стабильны при 4°C в течение как минимум 24 ч или даже до 72 ч, при этом существенные различия зависят от типа автоматизированного анализатора клеток крови.
Для CBC образцы можно надежно хранить в течение 24 часов. Для более длительного хранения лучшим выбором будет охлаждение (при 4 °C). Интересно, что в некоторые моменты времени (1, 2 и 4 часа) PLT немного ниже. Хранение при 4 °C показало гораздо большую стабильность. За исключением 8 часов, до 3 дней статистических изменений не было. Преимущества холодильной камеры (4 ° C) очевидны для длительного хранения. Стоит отметить, что хранение образцов более 12 часов для метаболической панели может привести к ненадежным результатам. Разные авторы сообщают, что некоторые анализы крови стабильны до 72 часов после сбора, если хранить их при 4 ° C в холодильнике.
Повреждение эритроцитов при хранении тесно связано с их внутренним энергетическим метаболизмом. Поскольку в эритроцитах нет митохондрий, полностью зависящих от гликолиза для получения энергии, молочная кислота, образующаяся в процессе гликолиза, будет снижать внутреннее значение рН клеток, тем самым снижая уровень метаболизма клеток и уменьшая производство АТP, что приводит к снижению уровня фосфорилирования фосфопротеинов и утрате деформируемости клеточной мембраны. Снижение уровня АТP в свою очередь уменьшает синтез 2,3-дифосфоглицериновой кислоты, а уменьшение значения рН и концентрации 2-магне3-дифосфоглицериновой кислоты сдвигает кривую кислородной диссоциации гемоглобина влево. АТP также является агонистом NO-синтазы. NO и гемоглобин в эритроцитах объединяются с образованием SNOHb и Hb(Fe~II) NO, которые участвуют в транспорте и метаболизме NO. Уменьшение АТP также влияет на ионный насос на клеточной мембране, что приводит к увеличению уровня К + в депонированной крови (Li L., et.al., 2022).
Некоторые параметры, связанные с эритроцитами, такие как RBC, HB и MCHC менее стабильны при хранении при 4 °C, на что может повлиять первоначальное замораживание с последующим охлаждением (Lombardi G., et al., 2011). RDW значительно увеличивается после 24-часового хранения при комнатной температуре. Возможной причиной этого изменения может быть повышенный MCV (de Baca M., et.al., 2006).
По данным D. Gunawardena et.al. (2017) среди параметров CBC лейкоциты (WBC), эритроциты (RBC), HB, MCH, нейтрофилы и лимфоциты стабильны при всех температурах (4 ± 2°С, 23 ± 2°С и 31 ± 2°С.) до 48 часов. Моноциты, эозинофилы, MCH, HCT и SV-RDW показали статистически значимые изменения при 23 ± 2°C и 31 ± 2°C. Значительное снижение количества тромбоцитов (PLT) и увеличение MPV и количества базофилов наблюдались при всех исследуемых температурах вплоть до 48 часов.
Увеличение MPV наблюдается при всех температурах, причем этот показатель не считается очень стабильным для образцов крови, хранящихся в течение длительного времени. Его значения изменяются в первый период времени (1 час) и не имеют различий для температуры хранения (Wu D-W., et.al., 2017). Четыре дня при 4 °C изменяют морфологию, движение и агрегацию тромбоцитов (Mahmoodi M., et al., 2006). MPV может иметь отношение к изменениям формы тромбоцитов, связанным со временем и формой, от дисковидной до сферической и набухания. Возможно, что тробмоциты, которые показывают повышение MPV, не будут подсчитаны машиной как тромбоциты, а будут помечены отдельно, что приведет к снижению PLT. Это говорит о том, что лучше всего оценивать PLT в течение 6 часов после забора крови.
Во всех случаях результаты CBC обычно более стабильны, чем различные биохимические, например, метаболические панели и предоставляют надежные результаты даже через 24 часов хранения.
Эритроциты, хранящиеся с добавлением прогестерона, имеют более высокие уровни АТP, меньший спонтанный лизис, более высокую осмотическую резистентность и более высокое поглощение метиленового синего в течение времени хранения, чем клетки, хранение которых происходит без добавления прогестерона. Этот гормон, по-видимому, находится в устойчивом равновесии между плазмой и эритроцитами в течении 42 дней хранения, и его количество в плазме почти вдвое больше, чем в клетках. После повторных промываний солевым раствором около 10% прогестерона остается прикрепленным к эритроцитам. Специфическая связь прогестерона с популяциями эритроцитов различной плотности показывает, что высокая удельная активность достигается в популяциях клеток низкой плотности (молодые клетки) в течение всего времени хранения (DeVenuto F., S M Wilson S.,1976).
.
Трансфузиология
Во время хранения компонентов крови ex vivo биореактивные вещества, накопленные в среде хранения и вызвавшие изменения в эритроцитах, предоставили постоянные доказательства непрерывных изменений, приводящих к дисфункции эритроцитов и способны оказывать неблагоприятное воздействие на переливаемого хозяина (Gacko M., et.al., 2004). Удаление лейкоцитов и тромбоцитов как источника свободных радикалов в компонентах эритроцитов влияет на защиту оксидоредуктивного баланса в компонентах эритроцитов во время хранения.
Лейкоредуцирование или лейко-истощение относится к снижению количества лейкоцитов менее чем 5 × 10 6 остаточных донорских лейкоцитов в конечном продукте крови при сохранении 85% жизнеспособного исходного RBC. Наличие лейкоцитов в компонентах крови является причиной нескольких осложнений.
Лейкоредуцирование предотвращает фебрильные реакции, накопление цитокинов / хемокинов, избегая фебрильной негемолитической реакции трансфузии (FNHTR), уменьшая передачу цитомегаловируса и невосприимчивость к переливанию тромбоцитов (в концентратах тромбоцитов).
Несмотря на использование аддитивных растворов, изменения морфологии и метаболизма эритроцитов ожидаются при хранении пакетов с кровью с лейко-редукцией и без нее. Хранение эритроцитов вызывает некоторые сложные структурные и биохимические изменения, которые называются поражением хранения эритроцитов (RCSL)
Биохимические изменения включают снижение активности фермента глюкозо-6-фосфатдегидрогеназы (G6PD) в качестве антиоксидантного фермента, увеличение везикуляции эритроцитов, потеря мембран эритроцитов, лизис мембран эритроцитов, снижение уровня 2,3-дифосфоглицерата (2,3- DPG), аденозинтрифосфат (АТФ) и снижение уровня глутатионредуктазы (GSH). Эти процессы сопровождаются снижением рН, увеличением активности фермента ЛДГ и концентрацией лактата.
Эти изменения приводят к снижению функции и выживаемости эритроцитов после переливания. G6PD является важным ферментом в метаболизме эритроцитов и ключевым ферментом окислительного пентозофосфатного пути (PPP). В PPP никотинамид-аденин-динуклеотид-фосфат (NADP) превращается в его восстановленную форму, NADPH, которая необходима для GSH-опосредованной защиты от окислительного стресса поддерживая целостность эритроцитов.
Также наблюдаются некоторые биохимические изменения концентратов эритроцитов при анаэробном гликолизе. В частности, наблюдается увеличение уровней калия (K +) и лактата и одновременное снижение уровней pH, глюкозы и натрия (Na +). Время хранения не влияет на уровни кальция (Ca ++) в концентратах RBC.
Активность ферментов лактатдегидрогеназы и К + в эритроцитах значительно выше (в 20-160 раз), чем в плазме, и можно ожидать, что гемолиз приведет к увеличению этих аналитов.
Cтатистически значимое увеличение активности лактат дегидрогеназы было показано в течение периода хранения в нефильтрованных эритроцитах. Активность фермента LDH в нефильтрованном эритроците по сравнению с LR-RBC увеличилась с 14-го дня хранения и была статистически признана значимой. Такие показатели, как MCV, MCH и MCHC, меньше всего влияли на хранение. Другие авторы обнаружили, что MCV увеличился, а MCHC значительно снизился в течение периода хранения, которые оценивались каждую неделю. (Grezelbash B., et.al., 2018).
J. Latham et al. (1982) наблюдали увеличение концентрации не только лактата, лактатдегидрогеназы, но и гемоглобина во время хранения. Консистенция свободного Hb и скорость гемолиза также были выше в нефильтрованном RBC по сравнению с LR-RBC во время хранения. Эти наблюдения указывают на возможное вовлечение лейкоцитов в большее повреждение эритроцитарной мембраны и благоприятное влияние лейкоредуцирования на качество сохраняемых единиц эритроцитов. Эти различия могут быть связаны с биологически активными веществами, такими как цитокины и гистамин, которые высвобождаются из лейкоцитов во время хранения, что оказывает непосредственное воздействие на мембрану эритроцитов и приводит к некоторым структурным и биохимическим изменениям.
Согласно предложению Castro O., et.al. (2003), общая концентрация гемоглобина, лактатдегидрогеназа и концентрация лактата являются маркерами гемолиза.
Sonker А. et.al. (2014) также сообщили, что лейко-фильтрованный RBC показывает меньшее повышение K +, LDH и гемолиза к концу периода хранения по сравнению с их нефильтрованными единицами. Присутствие лейкоцитов может быть причиной усиленного окислительного стресса. Эти авторы отметили, что активность ферментов LDH, гемолиз и повреждение клеточных мембран (калий, LDH, свободный гемоглобин) усиливаются в компонентах крови с высоким содержанием лимфоцитов.
Дельта – проверки
Преаналитические ошибки, которые могут повлиять на результаты CBC, включают смешивание образцов, неправильное получение образца и нарушение целостности образца между моментом, когда образец был получен и когда он был доставлен в лаборатории.
Дельта-проверки — процесс маркировки различий в конкретных аналитах между последовательными анализами, являются одним из способов выявления таких проблем. Такие проверки эффективны при обнаружении некоторых вариантов преаналитических ошибок.
Среди обычно оцениваемых показателей CBC средний объем клеток, или MCV, и средняя концентрация клеточного гемоглобина, или MCHC, пригодны для дельта -проверок лучше всего. И тот, и другой показатель чрезвычайно стабильны в течении короткого срока — 24 часа. Например, суточный биологический коэффициент вариации MCV у здоровых людей составляет всего 0,5%. Даже в ситуациях быстрого изменения других параметров эритроцитов, таких как острое кровоизлияние, MCV и MCHC не будут значительно изменяться в течение суток, поскольку ответ ретикулоцитов на острую кровопотерю не начинается в течение первых двух-трех дней. За исключением переливания эритроцитов и редко острого внутрисосудистого гемолиза, нет неотложных ситуаций в состоянии пациента, которые бы значительно изменили эти показатели в краткосрочной перспективе. В случае острого гемолиза с гемоглобинемией, MCHC может быть изменен, в отличие от MCV, который будет оставаться стабильным.
Из других проблем, связанных с анализом образца, гемолиз образца также поддается обнаружению с помощью дельта-проверок на основе MCHC. В этом сценарии RBC уменьшается, без изменений в HB и MCV, что приводит к увеличению MCHC.
Загрязнение образцов внутривенной жидкостью и изменения количества клеток из-за свертывания образцов теоретически могут быть обнаружены дельта-проверками HB и HCT, а также изменениями значений RBC, WBC и PLT. Однако нецелесообразно использовать дельта-проверки любого из этих показателей для обнаружения такого образца, поскольку быстрые изменения любого из них являются обычными у госпитализированных пациентов, причем, частота ложноположительных результатов будет здесь неприемлемо высокой. Тем не менее, внутривенное загрязнение приводит к пропорциональному снижению всех этих показателей.
Следует также отметить, что выполнение дельта-проверок на MCHC имеет дополнительное преимущество для обнаружения неисправности анализатора, поскольку MCHC рассчитывается на основе трех параметров эритроцитов RBC, HB и MCV, которые измеряются непосредственно на большинстве гематологических анализаторов. Следовательно, проблемы в любом из этих измерений будут влиять на MCHC. Выбор пределов достоверности для дельта-проверок зависит от ряда факторов, в том числе от желаемого баланса чувствительности и специфичности и оцениваемой популяции пациентов. Статистический подход к дельта-проверкам может быть достигнут путем получения пар точек данных пациентов из репрезентативной популяции. Пределы, охватывающие желаемую долю населения (например, 95% или 99%), могут быть легко выбраны (Savage R., 2006).
Температура хранения
Гемоглобин, количество эритроцитов, количество лейкоцитов, средний корпускулярный гемоглобин остаются стабильными в течение по меньшей мере 24 часов при температуре 33 ° C. Гематокрит, средний корпускулярный объем и количество тромбоцитов стабильны в течение менее четырех часов при 33 ° C. Все вышеперечисленные параметры стабильны при 22 ° С и 4 ° С. Дифференциальная оценка HCT, MCV, PLT показала нестабильность в течение четырех часов при температуре 33 ° C.
Некоторые параметры, связанные с эритроцитами, такие как RBC, HB и MCHC, менее стабильны при хранении при 4 ° C, поскольку на них может повлиять первоначальное замораживание с последующим охлаждением Изменение HCT и MCHC, несомненно, является следствием изменения MCV, поскольку эти параметры частично получены из последнего показателя.
Гемолиз in vitro
Термин «гемолиз» происходит от латинского слова hemo (кровь) и лизиса (взломать) и означает разрушение клеток крови. Лаборанты обычно ограничивают значение понятия «гемолиз» эритроцитами (процесс, называемый эритролизом), которые составляют наибольший процент эритроцитов крови и игнорируют состояние других клеток крови. В связи с этим подходом методы оценки гемолиза зависят «исключительно» от измеренного количества свободного гемоглобина (fHB), выделившегося из разрушенных эритроцитов. Напротив, небольшое количество авторов описывают «гемолиз» как разрушение всех типов клеток крови, а именно панцитолиз и заявляют, что лейкоциты и тромбоциты также могут поддвергаться гемолизу. Стоит отметить, что лейкоциты могут способствовать повышению уровня калия в состоянии лизиса.
Гемолиз может происходить in vivo, при патологических состояниях или in vitro в связи с преаналитическими ошибками.
Гемолиз in vitro в преаналитической фазе является основной проблемой, с которой сталкиваются клинические лаборатории. Определяемый как разрыв мембраны эритроцита с экстравазацией гемоглобина и других внутриклеточных компонентов в окружающую плазму, гемолиз можно обнаружить визуально во время лабораторной оценки из-за изменения окраски плазмы от розового до красного после центрифугирования образца.
Гемолиз in vitro обычно возникает в результате неадекватного забора крови, включая такие факторы, как использование игл малого диаметра, попадание остатков спирта с кожи в образец, трудности с поиском венозного доступа, маленькие и хрупкие вены, которые легко травмируются, и попытки неудовлетворительной пункции. Кроме того, неправильное обращение с образцами, такое как недостаточное заполнение пробирки для сбора, приводящее к избытку антикоагулянта, сильное встряхивание образца, воздействие чрезмерно высоких или низких температур и центрифугирование на очень высокой скорости в течение длительного периода времени, также являются факторами, которые могут нарушить структурная целостность клеток крови (Lippi G., et.al., 2008).
Факторы, способствующие гемолизу in vitro вследствие неадекватного забора крови
Использование игл малого размера
Попадание остатков спирта с кожи в образец
Трудности с поиском венозного доступа
Маленькие и хрупкие вены, которые легко травмируются
Неоднократные попытки плохой пункции
Было показано, что с течением времени количество эритроцитов значительно снижается из-за гемолиза. Повышенная проницаемость клеток будет определяться увеличением MCV — индекса, отражающего набухание эритроцитов. Изменение HCT и MCHC явно является следствием изменения MCV, поскольку эти параметры частично получены из MCV (Buoro S., et al., 2016).
В работе G. de Longe et.al. (2018) образцы с высокой степенью гемолиза превышали спецификации качества для желаемой систематической ошибки, демонстрируя снижение эритроцитов (4,7%), гематокрита (6,6%), MCV (0,6%) и увеличение параметров: RDW (1,3%), MCH (1,5%), MCHC (2,5%) и количество тромбоцитов (36,7%). В то время как образцы с легкой степенью гемолиза имели умеренное увеличение MCH (0,6%), MCHC (0,7%) и количества тромбоцитов (1,4%). Авторами было замечено, что RCB имел погрешность -6,4% (от -22,8% до 10,0%), а HCT — погрешность -8,3% (от -25,7% до 9,2%), превышающую допустимые нормы ±1,7% для проб с высокой степенью гемолиза. Так, эти показатели могут быть занижены до 22,8% для эритроцитов и до 25,7% для HCT или завышены до 10,0% и 9,2% соответственно.
Стоит отметить, что принцип измерения MCV сильно различается в зависимости от используемого гематологического анализатора. с помощью метода импеданса образцы с высокой степенью гемолиза могут демонстрировать умеренное изменение MCV (увеличение на 0,6%) с последующим увеличением RDW на 1,3%, что представляет собой широкий разброс примерно в 12%, оценивая пределы согласия и их доверительные интервалы.
Гемолиз образца крови, взятого для CBC
Высокая степень гемолиза
Снижение RBC (4,7%), HCT (6,6%), MCV (0,6%)
Увеличение RDW (1,3%), MCH (1,5%), MCHC (2,5%)
Отсутствии изменений HB
Увеличение PLT (36,7%)
Низкая степень гемолиза
Увеличение MCH (0,6%), MCHC (0,7%), PLT (1,4%)
Сравнение образцов с разной степенью гемолиза показало снижение количества эритроцитов и гематокрита и увеличение средней концентрации корпускулярного гемоглобина и количества тромбоцитов в образцах с высокой степенью гемолиза. Согласно принятой клинической точке зрения, образцы с высокой степенью гемолиза превышают желаемую погрешность, демонстрируя снижение RBC, HCT и MCV, а также увеличение RDW, MCH, MCHC, PLT. Однако образцы с легкой степенью гемолиза показали лишь незначительное увеличение среднего корпускулярного гемоглобина, средней концентрации корпускулярного гемоглобина и количества тромбоцитов. (de Jonge G., et.al.,2018).
Выяснение интерференционных механизмов гемолиза необходимо для более точного решения проблемы гемолиза in vitro. Гемолизированные образцы влияют на результаты испытаний по нескольким механизмам, таким как: композиционные помехи (из-за разницы между внутриклеточной и внеклеточной концентрацией аналитов), помехи сигнала в инструментальных измерениях и химической помехи в аналитических реакциях. Эти интерференционные механизмы могут сосуществовать в различных сочетаниях. Отказ от результатов анализа гемолизированных образцов может привести к задержке в диагностике, что угрожает безопасности пациента, а запрос дополнительного образца увеличивает рабочую нагрузку лаборанта и стоимость исследования.
Вполне возможно, что клеточный дебрис и строма, образующиеся в результате распада эритроцитов, могут вызывать существенные аналитические помехи в подсчете тромбоцитов
В практике клинициста бывают неординарные ситуации, связанные с лабораторными исследованиями. Врач назначает анализы и получает результаты, совершенно не укладывающиеся в клиническую картину. Например, пациент тяжелый, и логично, что должны быть изменения, но их нет. Или наоборот, здоровый человек проходит медосмотр, а у него показатели общего анализа крови за пределами нормы. Как правило, основной причиной подобных казусов являются дефекты преаналитического этапа.
О наиболее распространенных ошибках при заборе венозной крови для диагностических исследований рассказала заведующая клинико-диагностической лабораторией Городской гинекологической больницы Минска Дина Жуковская.
Лабораторная диагностика
 Почти 80 % ошибок при лабораторных исследованиях происходит на преаналитическом этапе, т. е. до того момента, как образцы биологического материала поступают в лабораторию. Их можно разделить на 3 группы:
Почти 80 % ошибок при лабораторных исследованиях происходит на преаналитическом этапе, т. е. до того момента, как образцы биологического материала поступают в лабораторию. Их можно разделить на 3 группы:
- неправильная предварительная подготовка пациента к сдаче анализа,
- несоблюдение инструкций и технических требований в момент забора крови,
- нарушение условий при транспортировке образцов в лабораторию.
Основным регламентирующим документом, в котором подробно прописаны преаналитический этап и все требования к нему, является «Инструкция о порядке организации преаналитического этапа лабораторных исследований», утвержденная приказом Минздрава № 1123 от 10.11.2015.
Дина Жуковская:
При соблюдении врачами и средним медперсоналом всех рекомендаций, прописанных в этом документе, количество ошибок можно минимизировать.
В Инструкции изложена подготовка пациента с учетом особенностей каждого исследования, указано, какие одноразовые системы для каких видов исследований предназначены, описаны техники забора крови, в частности венозной, при которой чаще всего совершаются ошибки.
Кровь из вены или из пальца?
Дина Жуковская:
Венозная кровь является лучшим биологическим материалом для гематологических, биохимических, гормональных, серологических и иммунологических показателей. В настоящее время практически все исследования выполняются из венозной крови, это стандарт.
Исследование капиллярной крови из пальца у взрослых и детей, пяточки у новорожденных допускается только в случаях, когда технически затруднена возможность венопункции:
- при ожогах большой площади,
- склонности пациента к венозному тромбозу,
- выраженном ожирении,
- острых состояниях, связанных с гипотонией, и др.
В зависимости от цели может проводиться анализ цельной крови, сыворотки или плазмы крови. В пробирках или системах, предназначенных для каждого вида, находятся коагулянты/антикоагулянты.
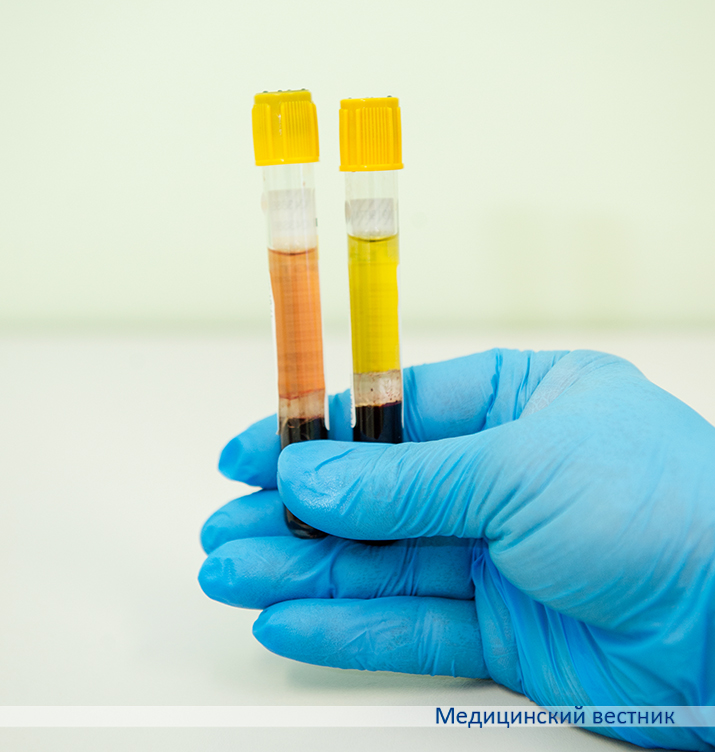
Маркировка и антикоагулянты
Согласно приказу Минздрава № 1123, к применению разрешены два типа стандартных одноразовых систем:
- шприц-пробирка с поршневым или вакуумным способом забора крови,
- вакуумная система.
Каждая из них имеет несколько вариантов:
- по виду исследования,
- реагенту-наполнителю,
- размеру,
- объему пробы.
Вакуумные системы исключают контакт персонала с кровью пациента. Они подлежат процедуре государственной регистрации для применения в учреждениях здравоохранения (как государственных, так и коммерческих).
Дина Жуковская:
По международным стандартам сейчас все одноразовые вакуумные системы промаркированы крышками по цвету, чтобы средний медперсонал не мог случайно перепутать. При заборе сразу нескольких видов анализов наполнение пробирок должно быть строго последовательным. Вначале берется кровь в пробирки без антикоагулянтов, затем — с антикоагулянтами во избежание загрязнения ими иглы.
Желтый. Перед доставкой в лабораторию эти пробирки необходимо отцентрифугировать и получить сыворотку — идеальный биологический материал для определения биохимических показателей, гормонов, онкомаркеров. Современные системы для транспортировки сыворотки содержат специальный гель, который отделяет чистую сыворотку от сгустков эритроцитов и предотвращает смешивание. Если в учреждении систем с гелем нет, то перед транспортировкой полученную сыворотку нужно переместить во вторичную пробирку.
Голубой. В системе содержится антикоагулянт — цитрат натрия. Забор крови на коагулограмму проводится только в эту пробирку. Исследуются плазма крови, факторы свертывания, антикоагулянтный потенциал и т. д.
Зеленый. В системе находится антикоагулянт гепарин. При смешивании с гепарином цельной крови полученный образец исследуется на газы крови, так называемый анализ КОС (кислотно-основное состояние), и другие биохимические показатели.
Фиолетовый. В системе находится консервант ЭДТА. Используется цельная кровь при самом распространенном, простом и в то же время информативном ОАК, иммунологическом определении группы крови. Также может использоваться плазма при некоторых клинико-химических исследованиях.
Помимо систем важен грамотный выбор диаметра иглы, которой берется кровь. Какие вены какими иглами пунктировать? Этот навык возможно приобрести только постоянной практикой и накоплением опыта. Существуют современные системы с камерой визуализации, что позволяет в момент пункции видеть, попала ли игла в вену.
Некоторые медсестры с большим опытом применения обычных пробирок для забора крови и техники перетягивания вен жгутом испытывают неуверенность при использовании одноразовых вакуумных систем. По мнению Дины Жуковской, следует уделять больше внимания обучению этим навыкам и закреплению их на курсах повышения квалификации.
Важный момент — перемешивание
При заборе венозной крови нужно не только наполнить нужную пробирку, но и правильно перемешать, чтобы произошел контакт крови с антикоагулянтом, напыленным на стенках.
Техника перемешивания крови с антикоагулянтом тоже имеет значение. Не нужно пробирку трясти, взбалтывать, необходимо сделать около 10 ротирующих движений, затем перейти к наполнению следующей пробирки.
Дина Жуковская:
Иногда медсестра не придает этому значения, поэтому тщательного перемешивания не происходит. В таком случае общий анализ крови обязательно будет с погрешностями из-за агрегации тромбоцитов.
Бывает, что эти микросгустки даже видны невооруженным глазом, но чаще не видны. И только на конечном этапе, когда мы потратили время, реагенты, врач ждет результат, а мы видим аномалию с запредельной тромбоцитопенией. Наша лаборатория оснащена современными анализаторами, которые в таких случаях сразу выдают звуковой сигнал и текстовое сообщение: «Внимание! Агрегация тромбоцитов!»
Сколько крови брать?
Вакуумные одноразовые системы облегчают задачу: нужный объем четко обеспечивается вакуумом. Но есть нюансы: при соблюдении техники забора скорость наполнения пробирки будет такой, что она заполнится ровно до метки. Только в этом случае достигается правильное соотношение кровь/антикоагулянт.
Если в момент пункции вены и забора крови возникают препятствия (медсестра долго не может попасть в вену, начинает искать другую вену, кровь идет плохо из-за неадекватно подобранного диаметра иглы), то правильное соотношение кровь/антикоагулянт не будет достигнуто. Такой образец не следует отправлять в лабораторию!
Дина Жуковская:
Исследование этой пробы не имеет смысла, потому что результат будет заведомо недостоверным. Несоблюдение техники сразу видно по метке на пробирке. И если мы получаем некачественный образец, то даже не берем его для исследования, чтобы не терять время, а связываемся с отделением для решения вопроса о повторном заборе крови у данного пациента.
Поэтому если медсестра понимает, что не соблюла технику забора крови, система не наполнилась до метки, будет лучше, если она сама примет решение и не станет направлять такой образец на исследование.

Что делать, если медсестра не может попасть в вену?
Помогают более опытные сестры, обычно это медсестры-анестезисты.
Если пациенту назначен только ОАК, а у него очень плохие вены, то допускается забор капиллярной крови.
В случае тяжелого состояниях пациента, срочной необходимости анализа и невозможности обеспечить венозный доступ к периферическим венам выполняется катетеризация центральных вен. Это делается врачом, чаще всего в отделениях реанимации.
Дина Жуковская:
Из отделения звонят нам, и наш фельдшер-лаборант берет кровь из пальца. Но, повторюсь, такой вариант подходит лишь для общего анализа крови. Для всех остальных исследований нужна только венозная кровь. Если возможно перенести анализ на следующий день, то лучше так и поступить, особенно если пациент нервничает.
За рубежом пациентам в стационарах, как правило, ставят периферические катетеры, которые используются для внутривенных инфузий лекарственных средств. Это удобно и для персонала, и для пациента, особенно если назначений много. У нас такой подход пока не получил повсеместного распространения, хотя тоже применяется, особенно в педиатрической практике.
Особенности взятия образца крови из катетера
Взятие образцов крови для исследований из установленного ранее катетера для внутривенной инфузии лекарственных средств допускается, но только при строгом соблюдении определенных условий.
Запрещен забор крови для исследования системы гемостаза (коагулограмма) из катетера, обработка которого проводилась гепарином. Необходимо обеспечить другой венозный доступ.
В катетере есть так называемая гепариновая заглушка, когда для предотвращения тромбирования вводится гепариновый раствор с физраствором в соотношении 100:1. Поэтому перед взятием крови на исследование из катетера его следует промыть физраствором в объеме, равном объему катетера, и обязательно утилизировать первые 5 мл взятой из катетера крови. Нужно, чтобы даже следов гепарина не оказалось в образце!
Дина Жуковская:
Иначе мы получим неадекватный результат, в частности, нехарактерное удлинение АЧТВ. Иногда мы вообще не можем определить этот показатель, потому что кровь совсем не сворачивается, и понятно, что у живого человека такого не может быть. В таком случае звоним в отделение или пишем в примечании: «Повторите коагулограмму. Вероятно попадание гепарина в образец».
У тяжелых пациентов в ОРИТ: при крайней необходимости срочного взятия образца крови на общий анализ у пациента, который в это время находится на инфузии через венозный или артериальный катетер, кровь берется из другого доступа. Медсестра обязательно должна указать в сопроводительном бланке факт того, что кровь бралась в момент инфузии, а также лекарственное средство. В лаборатории при выдаче результата будет учтен момент делюции (разведения) пробы.
Транспортировка образцов
Доставка образцов с биоматериалом в лабораторию осуществляется в наиболее возможный короткий промежуток времени.
В учреждении со своей лабораторией герметично закрытые пробирки, установленные вертикально в штативы, относятся в лабораторию.
При транспортировке в централизованную лабораторию штативы с образцами крови помещаются в специальные промаркированные термоконтейнеры, оборудованные хладагентами для поддержания температуры 2–8 °С.
Основные требования при транспортировке: избегать перепадов температур, резких колебаний, воздействий прямых солнечных лучей, нахождения рядом с нагревательными приборами или оборудованием.
Дина Жуковская:
Недочеты, которые встречаются на данном этапе, обычно происходят в момент сбора образцов в отделении. Так, приходилось наблюдать ситуации, когда штативы стояли на подоконнике над батареей отопления или на столе у окна под яркими солнечными лучами. Конечно, клетки, ферменты в пробирках разрушаются — и качество таких образцов резко снижается.

Самое главное — достоверный результат
Дина Жуковская:
Согласно данным ВОЗ, более 70 % врачебных решений принимается на основании результатов лабораторных исследований. Они помогают поставить верный диагноз, назначить эффективное лечение, а в экстренной ситуации — коренным образом повлиять на тактику оказания помощи и спасти пациенту жизнь. Но самое главное в данном процессе — получить достоверные результаты. Они зависят от совместных усилий врачей, среднего медперсонала, специалистов лаборатории. В нашем учреждении этот процесс хорошо отлажен.
