100 БАЛЛЛОВ!!!!!!!!!!!!!
Укажите ошибки, допущенные учеником при выполнении практической работы «Приготовление раствора соли с заданной массовой долей растворённого вещества».
Укажите один или несколько правильных вариантов ответа:
1)Смешал соль с водой, постепенно добавляя воду.
2)Перед началом работы уравновесил чаши весов.
3)Насыпал отмеряемую соль непосредственно на чашу весов.
4)Разновесы брал пинцетом.
5)Отмеряя необходимый объём жидкости, смотрел на цилиндр сверху.
Урок №___ 8 класс « » _______. _____ г.
ТЕМА: Практическая работа №3. Приготовление растворов солей с определённой
массовой долей растворённого вещества.
Цель урока: сформировать умение осуществлять расчеты по формуле определения массовой доли растворённого вещества; сформировать практические навыки приготовления растворов с заданной концентрацией с использованием лабораторной посуды и химических веществ.
Планируемые результаты обучения
Предметные. Уметь готовить раствор с определённой массовой долей растворённого вещества.
Метапредметные. Формировать умения самостоятельно планировать пути достижения целей, осознанно выбирать наиболее эффективные способы решения учебных и познавательных задач.
Личностные. Формировать ответственное отношение к учению, готовность и способность к саморазвитию и самообразованию.
Основные виды деятельности учащихся. Осуществление расчётов для приготовления. Работа с техническими весами и мерной посудой. Приготовление раствор с определённой массовой долей растворённого вещества.
Основные определения: раствор, растворитель, растворенное вещество, массовая доля растворенного вещества, насыщенный и ненасыщенный раствор, концентрированный, разбавленный раствор, кристаллогидрат.
Оборудование: лабораторная посуда, правила Т.Б., кухонная поваренная соль (сахар, сода), вода, весы с разновесами.
Тип урока: урок закрепления знаний.
Метод обучения: проблемно-поисковый, практическая работа.
Организационные формы: беседа, практическая работа.
Структура урока
I. Организационный этап 2 мин
II. Актуализация и мотивация знаний ……………………5 мин
-
Инструктажи: по технике безопасности
по проведению практической работы ..5-6 мин
-
Проведение практической работы …. 25 мин
-
Домашнее задание …1- 2 мин
-
. Подведение итогов урока …3 мин
-
Рефлексия урока ………………………………………… 2 мин
ХОД УРОКА
-
ОРГАНИЗАЦИОННЫЙ ЭТАП (Учет отсутствующих учащихся)
-
АКТУАЛИЗАЦИЯ И МОТИВАЦИЯ ЗНАНИЙ
Проводится опрос, учащиеся вспоминают основные формулы необходимые для приготовления растворов солей с определённой массовой долей растворённого вещества.
Беседа по вопросам
-
Какие компоненты входят в состав раствора?
m (раствора) = m (вещества) + m (растворителя).
-
Как определить состав раствора?
Состав раствора количественно выражается концентрацией, соотношением количества растворенного вещества и растворителя. Чаще всего используется массовая доля растворенного вещества (процентная концентрация), которую можно вычислить по формуле:
![]()
Массовая доля растворенного вещества — безразмерная величина, выражается в долях от единицы или в процентах.
Используя эту формулу, можно вычислить массу вещества и раствора:
m (раствора) = m (растворенного в-ва) *100% / w (растворенного в-ва)
m (растворенного в-ва) = m (раствора) *w (растворенного в-ва) /100%
![]()
-
Вода жидкость как мы отмеряем ее массу?
Вычисляем объем воды, так как взвешивать воду на весах нельзя. Плотность воды при температуре +25°С равна 1 г/мл.
ρ= m/ v V=m / х; ![]()
Жизнь на Земле зародилась в растворе с массовой долей солей около 1%. Раствор, содержащийся в живом организме и составляющий основу крови, имеет массовую долю соли 0,9%. Все сложные обменные процессы на клеточном уровне протекают в растворах. В повседневной жизни мы с вами используем растворы: поваренной соли, соды и тд..
Сегодня на уроке мы с вами проведем практическую работу по приготовлению раствора с определённой массовой долей растворённого вещества.
-
Какова цель нашего урока? (учащиеся самостоятельно формулируют цель практической работы).
Научиться готовить растворы с заданной массовой долей растворенного вещества, уметь использовать следующие операции: взвешивание, отмеривание определенного объема жидкости, растворять вещества; производить необходимые расчеты.
-
ИНСТРУКТАЖИ ПО ТЕХНИКЕ БЕЗОПАСНОСТИ И ПО ПРОВЕДЕНИЮ П.Р. (Подготовка учащимися рабочего места к практическому занятию).
Учащиеся называют Правила по ТБ.
-
Для насыпания твердых веществ следует пользоваться шпателем.
-
Нельзя брать реактивы не защищенными руками.
-
Перемешивать жидкость в стеклянном стакане следует перемешивать стеклянной палочкой.
-
Во время работы со стеклом необходимо быть осторожными, особенно необходимо беречь глаза.
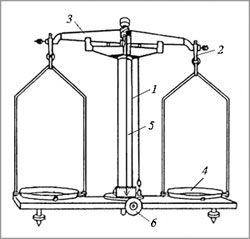
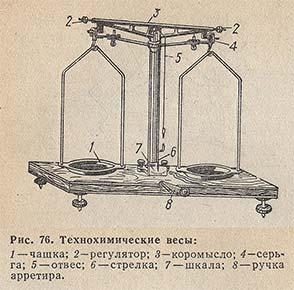
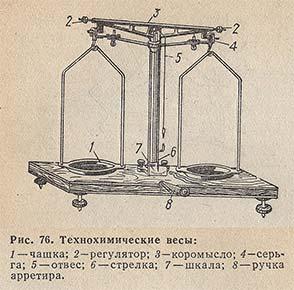
Для работы вам необходимы весы с разновесами. Вспомним строение технохимических весов и правила работы с ними. Приложение №2.
Учащиеся знакомятся с инструкцией по проведению и выполнению практической работы (с.118 учебника).
Каждый учащийся получает свое задание. Приложение №1.
-
ПРОВЕДЕНИЕ ПРАКТИЧЕСКОЙ РАБОТЫ (Оформление в тетради)
Практическая работа №3
Тема: Приготовление раствора с определенной массовой долей растворенного вещества (соли).
Цель: научиться приготовлять растворы с заданной массовой долей растворенного вещества, уметь производить необходимые расчеты.
Оборудование: технические весы с разновесами, химический стакан, мерный цилиндр, ложечка для сыпучих веществ, стеклянная палочка, склянка под приготовленный раствор.
Реактивы: дистиллированная (кипяченая) вода, сухая поваренная соль, сухая питьевая сода.
Правила техники безопасности: работа с сыпучими веществами; правила взвешивания.
Ход работы
Задание № 1. Проведите расчеты.
Рассчитайте массу вещества и объём воды необходимые, для приготовления раствора ___г. с массовой долей вещества ___%.
Результаты расчетов занесите в таблицу:
|
№ |
Масса раствора mр (г) |
Массовая доля раств. вещества w (%) |
Масса вещества mв (г) |
Масса воды m (г) |
Объем воды V (мл) |
Задание № 2. Взвешивание.
Перед взвешиванием проверьте техническое состояние весов. На чаши весов положите одинаковые кусочки фильтровальной бумаги (на неё будет насыпаться вещество при взвешивании и размещаться разновес) и уравновесьте весы при помощи маленьких кусочков бумаги.
Отвесьте на весах рассчитанную вами навеску соли. На правую чашку весов при помощи пинцета поместите разновес (в соответствии с тем, какую массу должна иметь навеска соли), а на фильтровальную бумагу, лежащую на левой чашке, насыпьте соль. Снова уравновесьте весы, добавляя или убирая небольшие порции соли.
Задание № 3. Приготовление раствора.
Навеску соли перенесите в колбу. При помощи мерного цилиндра отмерьте объём воды, необходимый для приготовления раствора. При отмеривании жидкости глаз наблюдателя должен находиться в одной плоскости с уровнем жидкости, а черта деления — напротив нижнего мениска уровня жидкости. Примерно половину отмеренного объёма воды вылейте в колбу с веществом. Энергичным взбалтыванием добейтесь полного растворения соли. Затем в полученный раствор вылейте остальную воду, после чего раствор взболтайте вновь.
Задание № 4. В отчете опишите последовательность ваших действий. Сделайте вывод.
-
ДОМАШНЕЕ ЗАДАНИЕ
Повторить темы «Кислород», «Водород» и «Вода. Растворы».
-
ПОДВЕДЕНИЕ ИТОГОВ УРОКА
Учитель подводит итоги урока, оценивает технику работы учащихся, проводит обсуждение выполненной работы.
Наш урок хочу закончить словами М.В.Ломоносова: «Химии никоим образом научиться невозможно, не видав самой практики и не принимаясь за химические операции».
-
РЕФЛЕКСИЯ УРОКА
Самостоятельно проанализировать, чему научились, а над чем еще надо поработать.
Список использованной литературы:
-
Рудзитис Г.Е. Химия. 8 класс: учеб. для общеобразоват. организаций / Г.Е. Рудзитис, Ф.Е. Фельдман. – 4-е изд. – М.: Просвещение, 2016. – 207 с.: ил.
-
Гара Н. Н. Г20 Химия: уроки в 8 классе: пособие для учителя / Н. Н. Гара. — 2-е изд., перераб. — М. : Просвещение, 2014. — 127 с. — ISBN 978-5-09-018248-5.
Ответы:
|
№ |
m(H20) |
m (вещества) |
№ |
m (Н20) |
m (вещества) |
|
1. |
380 г |
20 г |
16. |
45 г |
15 г |
|
2. |
260 г |
60 г |
17. |
280 г |
40 г |
|
3. |
140 г |
60 г |
18. |
170 г |
30 г |
|
4. |
68 г |
2 г |
19. |
58 г |
2 г |
|
5. |
124 г |
4 г |
20. |
114г |
6 г |
|
6. |
150 г |
30 г |
21. |
220 г |
30 г |
|
7. |
124 г |
8 г |
22. |
85 г |
15 г |
|
8. |
68 г |
12 г |
23. |
75 г |
5 г |
|
9. |
90 г |
30 г |
24. |
80 г |
20 г |
|
10. |
175г |
25 г |
25. |
150 г |
50 г |
|
11. |
88 г |
12 г |
26. |
126 г |
14 г |
|
12. |
240 г |
60 г |
27. |
250 г |
50 г |
|
13. |
144 г |
56 г |
28. |
300 г |
6г |
|
14. |
96 г |
24 г |
29. |
200 г |
40 г |
|
15. |
165 г |
35 г |
30. |
70 г |
10г |
Приложение №1.
|
1. |
m (раствора) 400 г |
w (вещества) 5% |
16. |
m (раствора) 60 г |
w (вещества) 25% |
|
2. |
m (раствора) 320 г |
w (вещества) 18,75% |
17. |
m (раствора) 320 г |
w (вещества) 12,5% |
|
3. |
m (раствора) 200г |
w (вещества) 30% |
18. |
m (раствора) 200 г |
w (вещества) 15% |
|
4. |
m (раствора) 70 г |
w (вещества) 2,86% |
19. |
m (раствора) 60 г |
w (вещества) 3,33% |
|
5. |
m (раствора) 128 г |
w (вещества) 3,125% |
20. |
m (раствора) 120 г |
w (вещества) 5% |
|
6. |
m (раствора) 180 г |
w (вещества) 16,7% |
21. |
m (раствора) 250 г |
w (вещества) 12% |
|
7. |
m (раствора) 132 г |
w (вещества) 6,06% |
22. |
m (раствора) 100 г |
w (вещества) 15% |
|
8. |
m (раствора) 80 г |
w (вещества) 15% |
23. |
m (раствора) 80 г |
w (вещества) 6,25% |
|
9. |
m (раствора) 110 г |
w (вещества) 25% |
24. |
m (раствора) 100 г |
w (вещества) 20% |
|
10. |
m (раствора) 200 г |
w (вещества) 12,5% |
25. |
m (раствора) 200 г |
w (вещества) 25% |
|
11. |
m (раствора) 100 г |
w (вещества) 12% |
26. |
m (раствора) 140 г |
w (вещества) 10% |
|
12. |
m (раствора) 300 г |
w (вещества) 20% |
27. |
m (раствора) 300 г |
w (вещества) 16,7% |
|
13. |
m (раствора) 200 г |
w (вещества) 28% |
28. |
m (раствора) 306 г |
w (вещества) 2% |
|
14. |
m (раствора) 130 г |
w (вещества) 20% |
29. |
m (раствора) 240 г |
w (вещества) 16,7% |
|
15. |
m (раствора) 200 г |
w (вещества) 17,5% |
30. |
m (раствора) 80 г |
w (вещества) 12,5% |
Приложение №2.
Цель: научиться готовить раствор соли с определенной массовой долей растворенного вещества, усовершенствовать навыки работы с лабораторным оборудованием.
Реактивы: кристаллические соли, калий хлорид, натрий нитрат, натрий хлорид, дистиллированная вода.
Оборудование: технохимические весы с гирьками, химический стакан, стеклянная палочка, шпатель.
Правила техники безопасности во время выполнения практической работы
Для насыпания твердых веществ следует пользоваться шпателем. Брать реактивы не защищенными руками брать нельзя. Перемешивать жидкость в стеклянном стакане следует перемешивать стеклянной палочкой. Во время работы со стеклом необходимо быть осторожными, особенно необходимо беречь глаза.
Порядок выполнения работы
1.Вычислить массы соли и воды, которые необходимо взять для приготовления определенного раствора. Массовая доля w – это отношение массы растворенного вещества к массе раствора. Выражается в процентах.
Просмотр содержимого документа
«Практическая работа «Приготовление раствора соли с определенной массовой долей растворенного вещества»»
Я ИДУ НА УРОК
Приготовление растворов солей
с определенной массовой долей
растворенного вещества
Практическая работа (1 ч)  8 класс
8 класс
Практическая работа выполняется по
инструкции и содержит несколько вариантов.
Каждый ученик выбирает один из пяти предложенных
вариантов задач. Задания, обозначенные
звездочкой (*), предназначены для учащихся,
успешно выполнивших предыдущие задания.
Цели. Уметь готовить растворы с
определенной массовой долей растворенного
вещества, используя следующие операции:
взвешивание, отмеривание определенного объема
жидкости, растворение; производить необходимые
расчеты; знать расчетную формулу для определения
массовой доли растворенного вещества, правила
пользования химической посудой и реактивами.
Оборудование. Технические весы с
разновесами, химический стакан, мерный цилиндр,
ложечка для сыпучих веществ, стеклянная палочка,
склянка под приготовленный раствор.
Реактивы. NaCl, Н3ВO3, СuSO4,
NaHCO3 – все кристаллические, 30%-й раствор NaOH,
дистиллированная (кипяченая) вода.
Подготовить для приготовляемых растворов
склянки с этикетками, на которых формула
изображена в цвете: для кислот – красным, для
солей – черным, для щелочей – синим.
Правила техники безопасности
Осторожно обращайтесь с химическим
оборудованием!
Пользуйтесь чистой и пригодной для работы
посудой.
|
|
Запрещается пробовать вещества на
|
Предварительно учащиеся получают
домашнее задание, связанное с изучением
содержания предстоящей работы по инструкции,
используя материал учебников 8-го класса авторов
О.С.Габриеляна (§ 34) или Г.Е.Рудзитиса,
Ф.Г.Фельдмана (§ 30).
ХОД УРОКА
В письменном отчете записываются название
темы, цели, оборудование, реактивы (4–5 мин).
Предлагается несколько вариантов расчетных
задач для приготовления растворов и пример
решения задачи.
Вариант № 1
Определите массы воды и борной кислоты,
необходимые для приготовления 50 г раствора с
массовой долей кислоты 0,02. Где применяют данный
раствор?
Вариант № 2
Какие массы гидрокарбоната натрия и воды надо
взять, чтобы приготовить раствор массой 50 г с
массовой долей соли 10%? Где используют данный
раствор?
Вариант № 3
В 45 г воды растворено 5 г NaCl. Вычислите массовую
долю растворенного вещества в растворе. Для чего
необходим этот раствор в быту и лаборатории?
Вариант № 4*
Рассчитайте массы воды и безводного сульфата
меди, необходимые для приготовления 100 мл
раствора, содержащего 8% соли. плотность раствора
– 1,084 г/мл. Где применяют полученный раствор?
Вариант № 5*
Какую массу воды нужно добавить к 100 мл 30%-го
раствора гидроксида натрия (![]() = 1,33 г/мл) для получения 10%-го раствора
= 1,33 г/мл) для получения 10%-го раствора
щелочи, используемого в лаборатории?
Пример решения задачи
Вычислите массы соли и воды, которые
потребуются для приготовления 50 г раствора
хлорида натрия, содержащего 0,1 массовой доли
соли.

Этапы выполнения работы
1. После произведенных расчетов по
одному из вариантов оформите их в тетради (6–7
мин).
2. Отвесьте рассчитанное количество
вещества и поместите его в стакан объемом 100 мл
или колбу на 200 мл.
Помните! К соли приливают воду! Кислоту
добавляют в воду при постоянном перемешивании!
Взвешивание
(6–7 мин)
|
|
Технохимические весы:
|
· Отрегулируйте арретиром
весы.
· Взвешиваемое вещество кладите на
левую чашку весов, разновесы на правую. (Для
левшей – на правую чашку кладут вещество, на
левую – разновесы.)
· Разновесы брать только пинцетом и при
снятии с весов класть сразу в те гнезда футляра,
из которых они были взяты.
· После взвешивания чашка весов должна
оставаться чистой.
· По окончании работы проверьте
разновесы. Весы арретировать (привести в
нерабочее состояние).
Жидкости на весах
не взвешивают!
3. Отмерьте мерным цилиндром
рассчитанный объем жидкости и вылейте в стакан с
солью или водой (1–2 мин).
4. Перемешайте стеклянной палочкой
смесь до полного растворения вещества. Раствор
готов!
5. В отчете опишите последовательность
ваших действий. Сделайте рисунок сосуда, в
котором вы приготовили раствор (10 мин).
 Склянку с
Склянку с
раствором сдайте учителю или лаборанту.
Пример. 0,9%-й раствор NaCl называется
физиологическим. Применяется для инъекций.
6. Сделайте письменный вывод о
проделанной работе (5–6 мин).
7. Приведите рабочее место в порядок (1–2
мин).
Сдайте тетради на проверку.
Домашнее задание
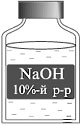
Задача. Определите массу воды,
которую нужно добавить к 50 г раствора с массовой
долей соли 5%, чтобы получить раствор с массовой
долей соли 2%.
Учитель следит за выполнением работы учащимися
и отмечает свои наблюдения в карточке учета
умений.
Карточка учета умений
| Операции практической работы |
Фамилии учащихся | |||||
|---|---|---|---|---|---|---|
| А | Б | В | Г |
… |
Я | |
| Приготовление склянки для раствора |
||||||
| Знание правил техники безопасности |
||||||
| Взвешивание вещества | ||||||
| Работа с мерным цилиндром | ||||||
| Приготовление раствора | ||||||
| Kультура выполнения опыта | ||||||
| Оформление отчета |
Образцы отчета о проделанной
практической работе
Вариант № 1
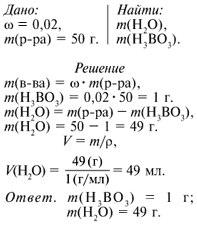
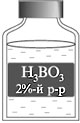
Взвешиваю 1 г борной кислоты, помещаю его в
стакан и добавляю к веществу воды до метки 50 мл.
Вещество растворяется в воде. Для его лучшего
растворения перемешиваю раствор стеклянной
палочкой. Переливаю раствор в приготовленную
склянку с этикеткой.
Раствор борной кислоты используют в медицине как
дезинфицирующее средство.
В лаборатории он хранится в аптечке для
промывания глаз в случае попадания в них щелочи.
Вариант № 2

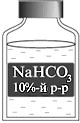
Взвешиваю 5 г гидрокарбоната натрия и помещаю в
химический стакан вместимостью 50 мл (или 100 мл).
Добавляю воды до метки 50 мл. Вещество
растворяется. для его полного растворения
перемешиваю раствор стеклянной палочкой.
Получила 10%-й раствор NaHCO3. Переливаю
раствор в склянку с этикеткой.
Полученный раствор используют для обработки
кожного покрова в случае попадания на него
кислоты.
Вариант № 3
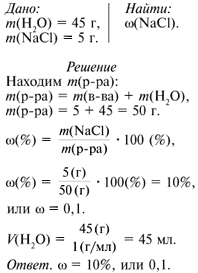

Взвешиваю на весах 5 г хлорида натрия и помещаю
соль в химический стакан. Мерным цилиндром
отмериваю 45 мл воды и добавляю к соли. Для лучшего
растворения соли перемешиваю раствор стеклянной
палочкой. Переливаю раствор в приготовленную
склянку.
Раствор используют в быту для засолки огурцов и
квашения капусты. В лаборатории раствор NaCl
используют как реактив для проведения химическиx
реакций.
Вариант № 4*
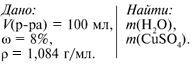

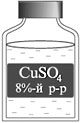
Взвешиваю на весах 8,7 г соли CuSO4. Отмериваю
мерным цилиндром 100 мл воды и переливаю в стакан с
солью. Перемешиваю раствор стеклянной палочкой.
Приготовленный раствор переношу в склянку с
этикеткой.
Раствор используют для борьбы с вредителями
сельскохозяйственных культур.
Вариант № 5*

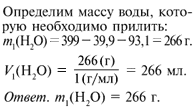
Добавим к выданному 30%-му раствору щелочи 266 мл
воды. Получили 10%-й раствор NаОН.
Внимание! Если для приготовления растворов
берут щелочь в кристаллическом виде, тогда
щелочь добавляют в воду.
Раствор используют в химической лаборатории для
проведения химических реакций.
Вывод. Рассчитав массу вещества и объем воды,
приготовили раствор с заданной концентрацией
растворенного вещества, используя операции:
взвешивание, отмеривание объема жидкости,
растворение. Растворы широко применяются в быту
и народном хозяйстве.
Домашнее задание

О.М.БЫКОВА,
учитель химии
Красноярской средней школы № 2
(с. Красный Яр, Астраханская обл.)
Практическая работа №4 «Приготовление растворов солей с определенной массовой долей растворенного вещества»
Цель работы: приготовить раствор хлорида натрия с заданной массовой долей растворенного вещества.
Реактивы и оборудование: весы, мерный цилиндр, химический стакан, ложка, стеклянная палочка, кристаллический хлорид натрия NaCl, вода.
Оформление работы
Результаты выполнения работы записывают в виде решения задач.
Ход работы
Вариант 1
Задача №1. Рассчитайте массу воды и массу соли, которые необходимо взять для приготовления 150 г раствора хлорида натрия NaCl с концентрацией 1%.
Задача №2. Определите процентную концентрацию раствора, полученного растворением 10 г хлорида натрия в 250 мл воды.
Вариант 2
Задача №1. Рассчитайте массу воды и массу соли, которые необходимо взять для приготовления 150 г раствора хлорида натрия NaCl с концентрацией 5%.
Задача №2. Определите процентную концентрацию раствора, полученного растворением 20 г хлорида натрия в 250 мл воды.
Вариант 3
Задача №1. Рассчитайте массу воды и массу соли, которые необходимо взять для приготовления 150 г раствора хлорида натрия NaCl с концентрацией 10%.
Задача №2. Определите процентную концентрацию раствора, полученного растворением 30 г хлорида натрия в 250 мл воды.
Вывод: для приготовления раствора хлорида натрия с массовой долей ___% нужно взять ___ г NaCl и ___ г воды.

![]()
На практической работе «Приготовление раствора соли с заданной массовой долей растворённого вещества» ученик взвесил 8 г поваренной соли и отмерил 32 мл воды. Заполните пропуски в задании, которое ученик получил к практической работе:
Приготовьте _ г _ %-ного раствора натрия.
Ваританты:
|25| |32| |64| |16| |20| |40|
Остались вопросы?
Новые вопросы по предмету Химия

100 БАЛЛЛОВ!!!!!!!!!!!!!
Укажите ошибки, допущенные учеником при выполнении практической работы «Приготовление раствора соли с заданной массовой долей растворённого вещества».
Укажите один или несколько правильных вариантов ответа:
1)Смешал соль с водой, постепенно добавляя воду.
2)Перед началом работы уравновесил чаши весов.
3)Насыпал отмеряемую соль непосредственно на чашу весов.
4)Разновесы брал пинцетом.
5)Отмеряя необходимый объём жидкости, смотрел на цилиндр сверху.
Тема
урока: Приготовление раствора соли с определенной массовой долей растворенного
вещества
Цель: приготовить
раствор с заданной массовой долей растворенного вещества путем растворения
рассчитанной массы твердого вещества в определенном объеме воды.
Задачи:
1. образовательные: закрепить и проверить умения решать задачи прикладного
характера на вычисление массы растворенного вещества и объема воды;—
научить учащихся приготавливать растворы веществ, имеющих практическое
значение в повседневной жизни.—
2.воспитательные: воспитывать ответственное отношение к выполнению своей
работы, наблюдательность, настойчивость— воспитывать культуру поведения в мире
веществ.—
3. развивающие: развивать умения переносить знания о растворах в новые условия;—
развивать коммуникативные качества учащихся: способность к сотрудничеству,
взаимопомощи, делового общения.
Тип урока:
практическая работа
Оборудование: химический стакан, мерный
цилиндр, ложечка для сыпучих веществ, стеклянная палочка, склянка под
приготовленный раствор.
Реактивы. NaCl, Н3ВO3, СuSO4, NaHCO3
– все кристаллические, 30%-й раствор NaOH, дистиллированная (кипяченая) вода.
Подготовить
для приготовляемых растворов склянки с этикетками, на которых формула
изображена в цвете: для кислот – красным, для солей – черным, для щелочей –
синим.
Правила
техники безопасности
Осторожно
обращайтесь с химическим оборудованием!
Пользуйтесь чистой и пригодной для работы посудой.
|
|
|
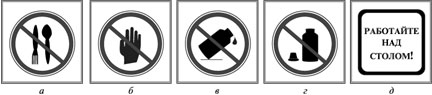
Запрещается пробовать вещества на вкус (а), |
ХОД УРОКА
В
письменном отчете записываются название темы, цели, оборудование, реактивы (4–5
мин).
Предлагается несколько вариантов расчетных задач для приготовления растворов и
пример решения задачи.
Вариант
№ 1 Определите массы воды и борной кислоты, необходимые для
приготовления 50 г раствора с массовой долей кислоты 0,02. Где применяют данный
раствор?
Вариант
№ 2 Какие массы гидрокарбоната натрия и воды надо взять, чтобы
приготовить раствор массой 50 г с массовой долей соли 10%? Где используют
данный раствор?
Вариант
№ 3 В 45 г воды растворено 5 г NaCl. Вычислите массовую долю
растворенного вещества в растворе. Для чего необходим этот раствор в быту и
лаборатории?
Вариант
№ 4*
Рассчитайте
массы воды и безводного сульфата меди, необходимые для приготовления 100 мл
раствора, содержащего 8% соли. плотность раствора – 1,084 г/мл. Где применяют
полученный раствор?
Вариант
№ 5*
Какую
массу воды нужно добавить к 100 мл 30%-го раствора гидроксида натрия (![]() =
=
1,33 г/мл) для получения 10%-го раствора щелочи, используемого в лаборатории?
Пример
решения задачи
Вычислите
массы соли и воды, которые потребуются для приготовления 50 г раствора хлорида
натрия, содержащего 0,1 массовой доли соли.

Этапы
выполнения работы
1.
После произведенных расчетов по одному из вариантов оформите их в тетради (6–7
мин).
2. Отвесьте рассчитанное количество вещества и поместите его в стакан
объемом 100 мл или колбу на 200 мл.
Помните! К соли приливают воду! Кислоту добавляют в воду при постоянном
перемешивании!
Пример.
0,9%-й раствор NaCl называется физиологическим. Применяется для инъекций.
Домашнее
задание
Задача.
Определите массу воды, которую нужно добавить к 50 г раствора с массовой долей
соли 5%, чтобы получить раствор с массовой долей соли 2%.
Образцы
отчета о проделанной
практической работе
Вариант
№ 1


Взвешиваю
1 г борной кислоты, помещаю его в стакан и добавляю к веществу воды до метки 50
мл. Вещество растворяется в воде. Для его лучшего растворения перемешиваю
раствор стеклянной палочкой. Переливаю раствор в приготовленную склянку с
этикеткой.
Раствор борной кислоты используют в медицине как дезинфицирующее средство.
В лаборатории он хранится в аптечке для промывания глаз в случае попадания в
них щелочи.
Вариант
№ 2


Взвешиваю
5 г гидрокарбоната натрия и помещаю в химический стакан вместимостью 50 мл (или
100 мл). Добавляю воды до метки 50 мл. Вещество растворяется. для его полного
растворения перемешиваю раствор стеклянной палочкой. Получила 10%-й раствор
NaHCO3. Переливаю раствор в склянку с этикеткой.
Полученный раствор используют для обработки кожного покрова в случае попадания
на него кислоты.
Вариант
№ 3


Взвешиваю
на весах 5 г хлорида натрия и помещаю соль в химический стакан. Мерным
цилиндром отмериваю 45 мл воды и добавляю к соли. Для лучшего растворения соли
перемешиваю раствор стеклянной палочкой. Переливаю раствор в приготовленную
склянку.
Раствор используют в быту для засолки огурцов и квашения капусты. В лаборатории
раствор NaCl используют как реактив для проведения химическиx реакций.
Вариант
№ 4*



Взвешиваю
на весах 8,7 г соли CuSO4. Отмериваю мерным цилиндром 100 мл воды и
переливаю в стакан с солью. Перемешиваю раствор стеклянной палочкой.
Приготовленный раствор переношу в склянку с этикеткой.
Раствор используют для борьбы с вредителями сельскохозяйственных культур.
Вариант
№ 5*


 Добавим
Добавим
к выданному 30%-му раствору щелочи 266 мл воды. Получили 10%-й раствор NаОН.
Внимание! Если для приготовления растворов берут щелочь в
кристаллическом виде, тогда щелочь добавляют в воду.
Раствор используют в химической лаборатории для проведения химических реакций.
Вывод. Рассчитав массу вещества и объем воды, приготовили раствор с
заданной концентрацией растворенного вещества, используя операции: взвешивание,
отмеривание объема жидкости, растворение. Растворы широко применяются в быту и
народном хозяйстве.
Домашнее
задание


Практическая работа №1
«Приготовление раствора соли с определенной массовой долей растворенного вещества»
Цель: научиться готовить раствор соли с определенной массовой долей растворенного вещества, усовершенствовать навыки работы с лабораторным оборудованием.
Реактивы: поваренная соль, сахар, вода.
Оборудование: стакан, ложка.
Правила техники безопасности во время выполнения практической работы
Для насыпания твердых веществ следует пользоваться шпателем. Брать реактивы не защищенными руками брать нельзя. Перемешивать жидкость в стеклянном стакане следует перемешивать стеклянной палочкой. Во время работы со стеклом необходимо быть осторожными, особенно необходимо беречь глаза.
Порядок выполнения работы
1.Вычислить массы соли и воды, которые необходимо взять для приготовления определенного раствора. Массовая доля w – это отношение массы растворенного вещества к массе раствора. Выражается в процентах.
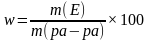
Определяем массу растворенного вещества (соли), которая необходима для приготовления раствора по формуле:
m (рас. в-ва)= w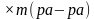
Находим массу воды. Посколько масса раствора состоит из массы растворенного вещества и массы воды, то масса воды равна разницы между массой растворенного вещества и массой раствора.
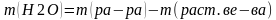
Вычисляем объем воды, так как взвешивать воду на весах нельзя. Плотность воды при температуре +25°С равна 1 г/см3.
V=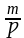 ;
; 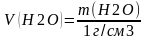
После вычисления массы соли и объема воды необходимо взвесить на весах необходимую массу соли. Для этого используют технохимические весы, которые дают результаты с точностью до 0,01 г.
2.Отмеряем с помощью мерного цилиндра необходимый объем дистиллированной воды. Наливаем в мерный цилиндр дистиллированную воду так, чтобы нижний уровень вещества касался выбранной отметки. Во время измерения цилиндр должен находиться в вертикальном положении, а глаза наблюдающего и значение объема на одном расстоянии.
3.Вливаем отмеренный объем воды в химический стакан с солью. Аккуратно перемешиваем содержимое стеклянной палочкой до полного растворения соли.
Составляем отчет в такой форме:
-
Вычисляем массу соли и объем воды, необходимый для приготовления раствора.
-
Взвешиваем на весах соль определенной массы и высыпаем ее в химический стакан.
-
Отмеряем с помощью мерного цилиндра воду необходимого объема и выливаем ее в химический стакан.
-
Перемешиваем содержимое химического стакана стеклянной палочкой для полного растворения.
Задания
А) приготовить 20 г раствора с массовой долей калий хлорида 0,05;
Б) приготовить 25 г раствора с массовой долей натрий нитрата 4%;
В) приготовить 10 г раствора с массовой долей натрий хлорида 10%;
Наблюдения: соль растворилась.
Выводы: взята соль с растворенным веществом. В данном растворе соль является растворенным веществом, вода – растворитель.
Общий вывод работы: во время выполнения практической работы научились готовить раствор соли с определенной массовой долей растворенного вещества, усовершенствовали навыки работы с лабораторным оборудованием.
Цель: научиться готовить раствор соли с определенной массовой долей растворенного вещества, усовершенствовать навыки работы с лабораторным оборудованием.
Реактивы: кристаллические соли, калий хлорид, натрий нитрат, натрий хлорид, дистиллированная вода.
Оборудование: технохимические весы с гирьками, химический стакан, стеклянная палочка, шпатель.
Правила техники безопасности во время выполнения практической работы
Для насыпания твердых веществ следует пользоваться шпателем. Брать реактивы не защищенными руками брать нельзя. Перемешивать жидкость в стеклянном стакане следует перемешивать стеклянной палочкой. Во время работы со стеклом необходимо быть осторожными, особенно необходимо беречь глаза.
Порядок выполнения работы
1.Вычислить массы соли и воды, которые необходимо взять для приготовления определенного раствора. Массовая доля w – это отношение массы растворенного вещества к массе раствора. Выражается в процентах.
Просмотр содержимого документа
«Практическая работа «Приготовление раствора соли с определенной массовой долей растворенного вещества»»

![]()
На практической работе «Приготовление раствора соли с заданной массовой долей растворённого вещества» ученик взвесил 8 г поваренной соли и отмерил 32 мл воды. Заполните пропуски в задании, которое ученик получил к практической работе:
Приготовьте _ г _ %-ного раствора натрия.
Ваританты:
|25| |32| |64| |16| |20| |40|
Остались вопросы?
Новые вопросы по предмету Химия
Практическая работа №1
«Приготовление раствора соли с определенной массовой долей растворенного вещества»
Цель: научиться готовить раствор соли с определенной массовой долей растворенного вещества, усовершенствовать навыки работы с лабораторным оборудованием.
Реактивы: поваренная соль, сахар, вода.
Оборудование: стакан, ложка.
Правила техники безопасности во время выполнения практической работы
Для насыпания твердых веществ следует пользоваться шпателем. Брать реактивы не защищенными руками брать нельзя. Перемешивать жидкость в стеклянном стакане следует перемешивать стеклянной палочкой. Во время работы со стеклом необходимо быть осторожными, особенно необходимо беречь глаза.
Порядок выполнения работы
1.Вычислить массы соли и воды, которые необходимо взять для приготовления определенного раствора. Массовая доля w – это отношение массы растворенного вещества к массе раствора. Выражается в процентах.
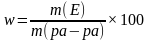
Определяем массу растворенного вещества (соли), которая необходима для приготовления раствора по формуле:
m (рас. в-ва)= w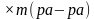
Находим массу воды. Посколько масса раствора состоит из массы растворенного вещества и массы воды, то масса воды равна разницы между массой растворенного вещества и массой раствора.
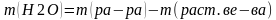
Вычисляем объем воды, так как взвешивать воду на весах нельзя. Плотность воды при температуре +25°С равна 1 г/см3.
V=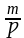 ;
; 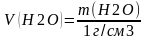
После вычисления массы соли и объема воды необходимо взвесить на весах необходимую массу соли. Для этого используют технохимические весы, которые дают результаты с точностью до 0,01 г.

2.Отмеряем с помощью мерного цилиндра необходимый объем дистиллированной воды. Наливаем в мерный цилиндр дистиллированную воду так, чтобы нижний уровень вещества касался выбранной отметки. Во время измерения цилиндр должен находиться в вертикальном положении, а глаза наблюдающего и значение объема на одном расстоянии.
3.Вливаем отмеренный объем воды в химический стакан с солью. Аккуратно перемешиваем содержимое стеклянной палочкой до полного растворения соли.
Составляем отчет в такой форме:
-
Вычисляем массу соли и объем воды, необходимый для приготовления раствора.
-
Взвешиваем на весах соль определенной массы и высыпаем ее в химический стакан.
-
Отмеряем с помощью мерного цилиндра воду необходимого объема и выливаем ее в химический стакан.
-
Перемешиваем содержимое химического стакана стеклянной палочкой для полного растворения.
Задания
А) приготовить 20 г раствора с массовой долей калий хлорида 0,05;
Б) приготовить 25 г раствора с массовой долей натрий нитрата 4%;
В) приготовить 10 г раствора с массовой долей натрий хлорида 10%;
Наблюдения: соль растворилась.
Выводы: взята соль с растворенным веществом. В данном растворе соль является растворенным веществом, вода – растворитель.
Общий вывод работы: во время выполнения практической работы научились готовить раствор соли с определенной массовой долей растворенного вещества, усовершенствовали навыки работы с лабораторным оборудованием.