Репаративная,
или восстановительная регенерация —
это восстановление клеток и тканей
взамен погибших из-за различных
патологических процессов.
Она чрезвычайно разнообразна по факторам,
вызывающим повреждения, по объемам
повреждения, а также по способам восста-

Рис.
126. Регенерация
комплекса органов у гидры (А);
кольчатого
червя (Б); морской звезды (В)
новления.
Повреждающими факторами, например,
могут быть механическая травма,
оперативное вмешательство, действие
ядовитых веществ, ожоги, обморожения,
лучевые воздействия, голодание и другие
болезнетворные агенты. Наиболее широко
изучена репаративная регенерация после
механической травмы. Способность
некоторых животных (гидра, планария,
некоторые кольчатые черви, морские
звезды, асцидия и др.) восстанавливать
утраченные органы и части организма
издавна изумляла ученых. Ещё Ч.Дарвин
удивлялся способности улитки воспроизводить
голову и способности саламандры
восстанавливать отрезанные глаза, хвост
и конечности.
Известны примеры
восстановления больших участков
организма
(рис. 126), состоящих из
комплекса органов (регенерация ротового
конца у гидры, головного конца у кольчатого
червя, восстановление морской звезды
из одного луча).
Репаративная
регенерация может быть полной и неполной.
Полная
регенерация, или
реституция, характеризуется возмещением
дефекта тканью, которая идентична
погибшей.
Она развивается преимущественно в
тканях, где преобладает клеточная
регенерация. При
неполной
регенерации,
или
субституции, дефект замещается
соединительной тканью, рубцом. Субституция
характерна для органов и тканей, в
которых преобладает внутриклеточная
форма регенерации, либо она сочетается
с клеточной регенерацией. Функция органа
возмещается в таких случаях путем
гипертрофии или гиперплазии окружающих
дефект клеток.

Рис.
127. Схема
гиперрегенерации


Рис.
128. Схема
гипорегенерации
9.5.3. Патологическая регенерация
Патологическая
регенерация — это извращение регенерационного
процесса, нарушение смены фаз пролиферации
и дифференцировки.
Патологическая
регенерация (рис.
127, 128) проявляется
в избыточном или недостаточном образовании
регенерирующей ткани
(гипер- или гипорегенерация). Примерами
ее могут служить образование келоидных
рубцов, избыточная регенерация
периферических нервов (травматические
невромы), избыточное образование костной
мозоли при срастании перелома, вялое
заживление ран (хронические трофические
язвы голени в результате венозного
застоя) и др.
9.5.4. Способы репаративной регенерации
Механизмы
репаративной и физиологической
регенерации едины: репаративная
регенерация – это, по сути, усиленная
физиологическая регенерация. Однако
из-за влияния патологических процессов
репаративная регенерация имеет некоторые
качественные морфологические отличия
от физиологической.
Существует
несколько способов (разновидностей)
репаративной регенерации. К ним относят
эпиморфоз, морфаллаксис, регенерационную
и компенсаторную гипертрофию. Гипертрофию
и гиперплазию клеток органов и тканей,
а также возникновение и рост опухолей
относят к гипербиотическим
процессам
— процессам избыточного роста и размножения
клеток, тканей и органов.
Гипертрофия —
увеличение размеров органа или ткани
за счет увеличения размера каждой
клетки.
Выделяют рабочую (компенсаторную),
викарную (заместительную) и гормональную
(коррелятивную) гипертрофии.
Самым частым видом
гипертрофии является рабочая
гипертрофия,
которая встречается как в нормальных
физиологических условиях, так и при
некоторых патологических состояниях.
Причиной ее является усиленная нагрузка,
предъявляемая к органу или ткани.
Примером рабочей гипертрофии в
физиологических условиях может служить
гипертрофия скелетной мускулатуры и
сердца у спортсменов, а также лиц, занятых
тяжелым физическим трудом. Рабочая
гипертрофия наблюдается в тканях,
состоящих из стабильных, неделящихся
клеток, в которых адаптация к повышенной
нагрузке не может быть реализована
путем увеличения количества клеток.
Викарная, или
заместительная гипертрофия
развивается в парных органах (почки)
или при удалении части органа, например,
в печени, в легких. Примером физиологической
гормональной
(коррелятивной) гипертрофии
может служить гипертрофия матки при
беременности.
Развивающаяся в
органе гипертрофия,
несомненно, имеет положительное значение,
поскольку позволяет сохранить функцию
органа в резко изменившихся условиях
(заболевание, утрата части органа и
т.п.). Этот период называется стадией
компенсации. В дальнейшем, когда в органе
возникают дистрофические изменения,
происходит ослабление функции, и в
конечном счете, когда адаптационные
механизмы исчерпаны, наступает
декомпенсация органа.
Исходя из частей
органа (клеток), вовлечённых в процесс
гипертрофии, её подразделяют на истинную
и ложную. Истинная
гипертрофия
— увеличение объема ткани или органа и
повышение их функциональной способности
вследствие разрастания основных
(ответственных за функцию) клеток, а
также других элементов. Примером являются
гипертрофия гладких мышц матки у
беременных животных, а также гипертрофия
сердца при физической работе. Ложная
гипертрофия
— увеличение объема органа при разрастании
соединительной или жировой ткани.
Количество основных клеток при этом
остается без изменений или даже
уменьшается, а функциональная способность
органа снижается (например, гипертрофия
молочной железы за счет жировой ткани).
У животных
различают два основных способа
регенерации: эпиморфоз и морфаллаксис.
Эпиморфоз
заключается в отрастании нового органа
от ампутационной поверхности.
При
эпиморфической регенерации утраченная
часть тела восстанавливается за счет
активности недифференцированных клеток,
похожих на эмбриональные. Они накапливаются
под пораненным эпидермисом у поверхности
разреза, где образуют зачаток, или
бластему
(рис. 129).
Клетки бластемы постепенно размножаются
и превращаются в ткани нового органа
или части тела. Регенерация путем
образования бластемы широко распространена
у беспозвоночных, а также играет важную
роль в регенерации органов амфибий.
Существует две
теории происхождения бластемных клеток:
1) клетки бластемы происходят из
«резервных клеток», т.е.
клеток, оставшихся неиспользованными
в процессе эмбрионального развития и
распределившихся по разным органам
тела; 2) ткани,
целостность которых была нарушена в
области разреза (травмы), «дедифференцируются»
(утрачивают специализацию) и превращаются
в отдельные бластемные клетки. Таким
образом, согласно теории «резервных
клеток», бластема образуется из клеток,
остававшихся эмбриональными, которые
мигрируют из разных участков тела и
скапливаются у поверхности разреза, а
согласно теории «дедифференцированной
ткани», бластемные клетки происходят
из клеток поврежденных тканей.
Морфаллаксис
— это регенерация путем перестройки
регенерирующего участка.
При морфаллаксисе другие ткани тела
или органа преобразуются в структуры
недостающей части.
У гидроидных полипов регенерация
происходит главным образом путем
морфаллаксиса, а у планарий в ней
одновременно имеют место как эпиморфоз,
так и морфаллаксис.
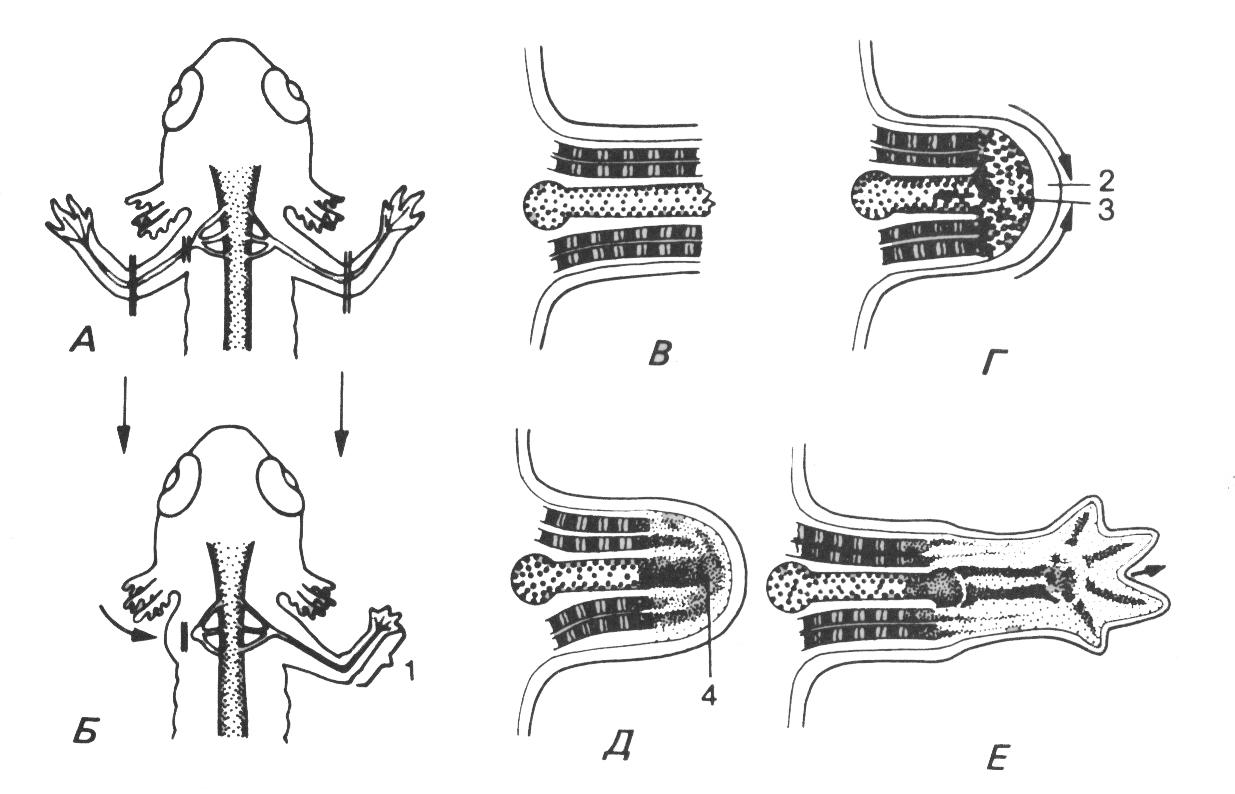
Рис.
129. Регенерация
конечностей путём эпиморфоза у личинки
амфибий.
А – схема операции;
Б – регенерирует только иннервированная
(правая) культя (1), левая культя
рассасывается; В – после ампутации; Г
– затягивание раны эпидермисом (2) и
распад тканей (3) под ним за счёт
дедифференцировки; Д – редифференцировка
в бластеме (4); Е – дальнейшее развитие
регенерата
Соседние файлы в папке Часть 2
- #
- #
- #
- #
- #
- #
- #
- #
Статья на конкурс «Био/Мол/Текст»: Почти у всех нас есть конечности. Мы настолько к ним привыкли, что воспринимаем как нечто само собой разумеющееся. Часто ли мы задумываемся об их важности? Вспоминается грустная пословица «Что имеем не храним, потерявши плачем». Авторы статьи искренне желают читателю никогда не познать ее в жизни. Во всяком случае, в таком контексте. Но все же — обязательно ли «плакать» в случае потери конечности, и нет ли способа вернуть ее в случае несчастья? А может, такой способ появится в будущем? Большие вещи начинаются с малого. Понимание регенерации целой руки и ноги кроется в осознании процессов, происходящих на самых кончиках пальцев. О них и пойдет речь дальше.

Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Важность конечностей неоспорима. Недаром даже есть поговорки: «С руками нигде не пропадешь», «Волка ноги кормят». Потеря или необратимые повреждения конечностей могут оставить человека инвалидом на всю жизнь. С помощью современных медицинских подходов можно, конечно, поставить человека «на ноги». Возможны реплантация ампутированной конечности (ее обратное приживление) или закрытие раны участками кожи для формирования культи с последующим применением протезирующих устройств. Несмотря на стремительно развивающееся протезирование и появление киберпротезов, которые (как пророчат книги, игры и фильмы) уже в недалеком будущем будут почти идентичны утраченной части тела и легко и дешево заменимы, уж очень привлекательна перспектива полного структурного и функционального восстановления ампутированной конечности собственными силами организма (или с помощью небольшой дополнительной стимуляции — рис. 1).

Рисунок 1. В настоящем 2077 протезы уже не будут нужны
рисунок Анастасии Кисловой
Известно, что многие рыбы и амфибии способны к регенерации утраченных конечностей. Но способен ли на это человеческий организм? Оказывается, и да, и нет. Все зависит от правильного взаимодействия различных факторов: от активности генов и иммунной системы до морфологического строения поврежденной конечности и концентрации кислорода в ране. Попытаемся подробнее изучить основные эволюционные изменения процессов регенерации, рассмотреть все тонкости регенерации конечностей, а также порассуждать, насколько хорошо проходит регенерация у млекопитающих.
Регенерация — от прошлого к настоящему
Еще в древних мифах описывалось необычное свойство некоторых существ восстанавливать любую отрубленную часть тела. Так, Лернейская гидра в битве с Гераклом могла отращивать новые головы на месте отрубленной. При этом для победы Геракл использовал вполне оригинальный и логичный способ: он прижег горящими головнями места, где вырастали новые головы, что воспрепятствовало бесконечной регенерации. Можно вспомнить и другой пример из древнегреческой мифологии — каждый день печень Прометея, который похитил для людей божественный огонь, склевывал орел, а каждую ночь она отрастала заново. Однако древние греки едва ли могли объяснить описываемые явления с биологической точки зрения. Так чем же обусловлены эти процессы у существующих организмов?
Наши передние и задние конечности состоят из различных типов клеток: остеоцитов (образуют скелет), миоцитов (мышцы), адипоцитов (жировая ткань), нейронов (нервная ткань), кератиноцитов (эпидермиса). Каждая клетка имеет свой генетический профиль и историю его реализации, называемую дифференцировкой. Клетки специализируются и сохраняют приобретенные особенности, так как хранят запись биохимических сигналов своих клеточных предков, полученных еще на эмбриональной стадии. По сути, регенерация конечности — это прохождение клеточной специализации заново. И пройти ее должны все названные выше типы клеток. Восстановить группу клеток одного типа — уже непростая задача, что уж говорить о регенерации более сложноорганизованных структур. В организме для этого формируется бластема — неоднородная популяция клеток, которая временно образуется на раневой поверхности после ампутации как результат миграции и компенсаторной пролиферации клеток, а затем подвергается морфогенезу и замещает поврежденную часть органа (рис. 2). Бластема становится источником стволовых клеток — недифференцированных (незрелых) клеток, из которых впоследствии формируются ткани. Именно они затем специализируются и восстанавливают первоначальный размер и форму утраченной конечности.
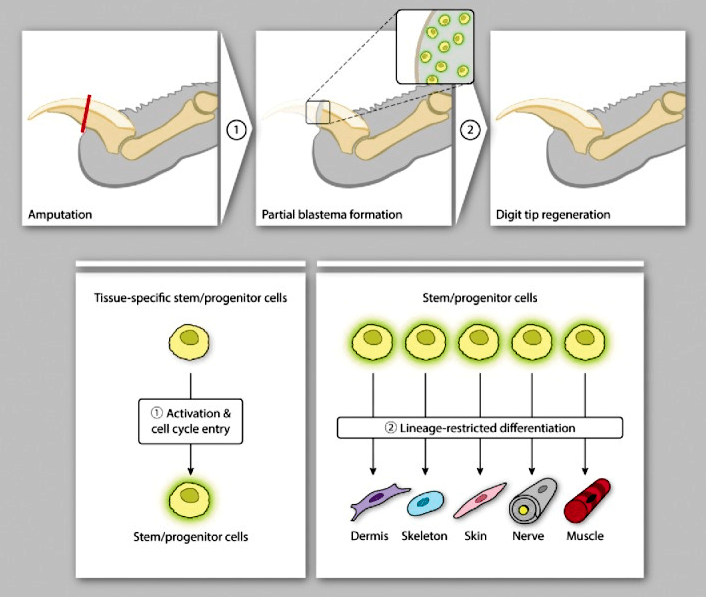
Рисунок 2. Регенерация пальца у мышей. В ход идут клеточные механизмы, единые для всех позвоночных: прежде всего активируются стволовые клетки, которые формируют бластему. Затем стволовые клетки на основе своей уникальной программы, заложенной в геноме, дифференцируются в соответствующий тип клеток (кожи, мышц, костей и др.) и восстанавливают исходный размер и форму кончика пальца.
Ослабление способности к регенерации с течением эволюции
Среди млекопитающих не найти столь впечатляющих примеров регенерации, как среди хвостатых амфибий. Но сравнение эпиморфной регенерации у классических моделей (земноводных и рыб) и млекопитающих приближает нас к пониманию того, что мешает нам (млекопитающим) регенерировать так же эффективно, и как это можно преодолеть. Сложно поверить, но механизмы регенерации, как и механизмы развития, схожи не только у всех позвоночных, но также и среди основных типов беспозвоночных.
Информацию о механизмах регенерации содержит геном, практически идентичный во всех клетках организма. Клетки разных тканей отличаются друг от друга потому, что экспрессируют разные наборы генов (а не потому, что содержат разные гены). Избирательная экспрессия генов обусловливает и разные стадии регенерации:
- пролиферацию, дающую множество клеток из одной;
- специализацию, создающую клетки с разной пространственной ориентацией и биологическими характеристиками;
- связь клеток между собой, определяющую поведение одной клетки по отношению к соседям;
- перемещение (миграцию), при которой клетки группируются, чтобы сформировать ткани и органы заданной структуры.
Во всех этих процессах клетка постепенно переходит из недифференцированного (столового) состояния в последующие, более специализированные. Возможен и альтернативный путь: клетка может уже пройти частично путь специализации, но перейти на другой под воздействием особых сигналов среды. Это как раз случай бластемы.
Но почему же примитивные беспозвоночные и низшие позвоночные (анамнии) способны к регенерации, а высшие (амниоты) утратили эту суперспособность?
С течением эволюции у всех животных — от низших до высших, вплоть до человека, — набор генов менялся не слишком сильно. Для согласованного построения многоклеточной структуры разные организмы используют всего несколько довольно консервативных путей передачи межклеточных сигналов. Однако по мере усложнения организмов дар регенерации постепенно угасал. В результате амниоты (рептилии, птицы, млекопитающие) почти утратили способность формировать бластему. Почему? Различия в общем плане строения организма возникают во многом из-за различий в генах регуляторных и сигнальных белков, которые отвечают за то, когда и где другие гены, кодирующие структурные белки, должны быть активированы или ингибированы.
Ученые из лаборатории молекулярных основ эмбриогенеза ИБХ РАН выдвинули гипотезу, что изменения в регуляторных участках и некоторых генах коррелируют с потерей регенерации. Чтобы ее проверить, они поочередно ингибировали и активировали гены, которые могли быть причастны к формированию раневого эпителия и бластемы. Выяснилось, что гены транскрипционных факторов Ag1 и сигнальных белков Ras-dva встречаются только в геномах низших позвоночных, рыб и амфибий, но отсутствуют у высших — рептилий, птиц и млекопитающих (рис. 4) [2]. При этом эти гены одновременно и стимулируют регенерацию конечностей, и подавляют развитие конечного мозга. Именно с их потерей у высших позвоночных в эмбриогенезе зародился конечный мозг.

Рисунок 4. Регенерация, которую мы потеряли. Видно, что с усложнением организации высших позвоночных происходила потеря генов семейства Ras-dva, а вместе с этим и способности к регенерации.
Оказывается, где-то на развилках эволюции самым драматическим образом произошел обмен регенерации конечностей на мощный мозг. Видимо, раз мы смогли написать для вас эту статью, то он оказался полезным. Однако почему же нельзя было оставить нам и регенерацию?
На данный момент регенерацию изучают больше всего на амфибиях (саламандры и тритоны) и рыбах данио рерио (зебрафиш) [3]. Например, хвостатые амфибии способны восстанавливать конечность, хвост, хрусталик глаза и часть нижней челюсти. Исследования проводят и на млекопитающих, хотя их потенциал далеко не так впечатляет. Ампутированные кончики пальцев у грызунов, повреждения ушной раковины у иглистых мышей и кроликов — вот, по сути, всё, что можно изучать из области эпиморфной регенерации у млекопитающих. Эти исследования позволяют связать регенеративную биологию и регенеративную медицину. В статье мы будем использовать информацию, полученную из исследований как на амниотах, так и анамниях, ибо, несмотря на потерю транскрипционных факторов Ag1 и сигнальных белков Ras-dva, консервативные пути передачи регенеративного сигнала в клетках в течение эволюции сохранились, и общий план строения конечностей у анамний и амниот схож.
Разбираем бластему: этап за этапом, клетка за клеткой, ген за геном
Сначала необходимо понять, какие внешние воздействия могут способствовать или мешать формированию бластемы. Для этого лучше изучить регенерацию «на практике». Вот мы ампутировали конечность. А дальше? Что мы можем сделать для стимуляции регенеративных процессов? Оказывается, не так много. Конечно, можно использовать разные шовные материалы и медицинские клеи для остановки кровотечения. Однако может получиться так, что регенерация остановится уже на первых этапах и не успеет достигнуть стадии бластемы. В исследовании, проведенном на мышах, ученые пробовали покрывать рану медицинским клеем (рис. 5) [4]. Это привело к следующему результату — раневая поверхность покрылась беспорядочной богатой коллагеном соединительной тканью, называемой фиброзной, которая составила основу культи и мало чем напоминала нормальную конечность.
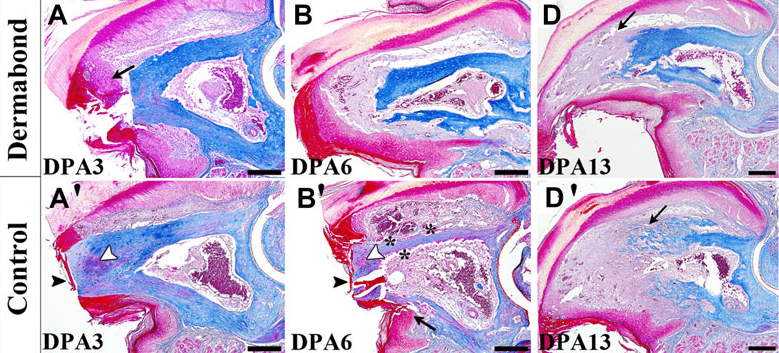
Рисунок 5. Хронология регенерации ампутированного кончика пальца при обработке медицинским клеем (фирма Dermabond; A, B и D) и без обработки (Control; A’, B’ и D’) в течение 13 дней после ампутации (DPA — days post-amputation). Можно заметить, что закрытие раны эпидермисом у пальца, обработанного клеем, на третий день после ампутации (A) началось преждевременно (черная стрелка) по сравнению с контрольной группой (A’), где наблюдалось лишь образование сгустка крови в полости костного мозга (белая стрелка). Впоследствии структурные изменения становились все более заметными, в результате чего на 13-й день после ампутации у пальца, не обработанного клеем, бластема была больше по объему и числу клеток (черная стрелка на срезе D’ указывает на клетки разрушенной костной ткани, которые впоследствии будут вовлечены в процесс регенерации), чем у пальца, обработанного клеем (срез D).
Оказалось, что важнейшую роль на разных этапах восстановления конечности играет локальное изменение концентрации кислорода [5]. Примечательно, что в норме на начальных этапах регенерации концентрация кислорода должна быть повышена (а при использовании медицинского клея выходит наоборот), а впоследствии падать из-за образования раневого эпидермиса на поверхности раны и активировать сигнальные пути регенерации. Если же изначально закрыть рану, то образования стабильного микроокружения из клеток и сигнальных молекул для формирования бластемы не происходит.
Цикл регенерации можно разбить на шесть этапов (рис. 6). Рассмотрим каждый из них подробнее и опишем процессы, которые при этом происходят.
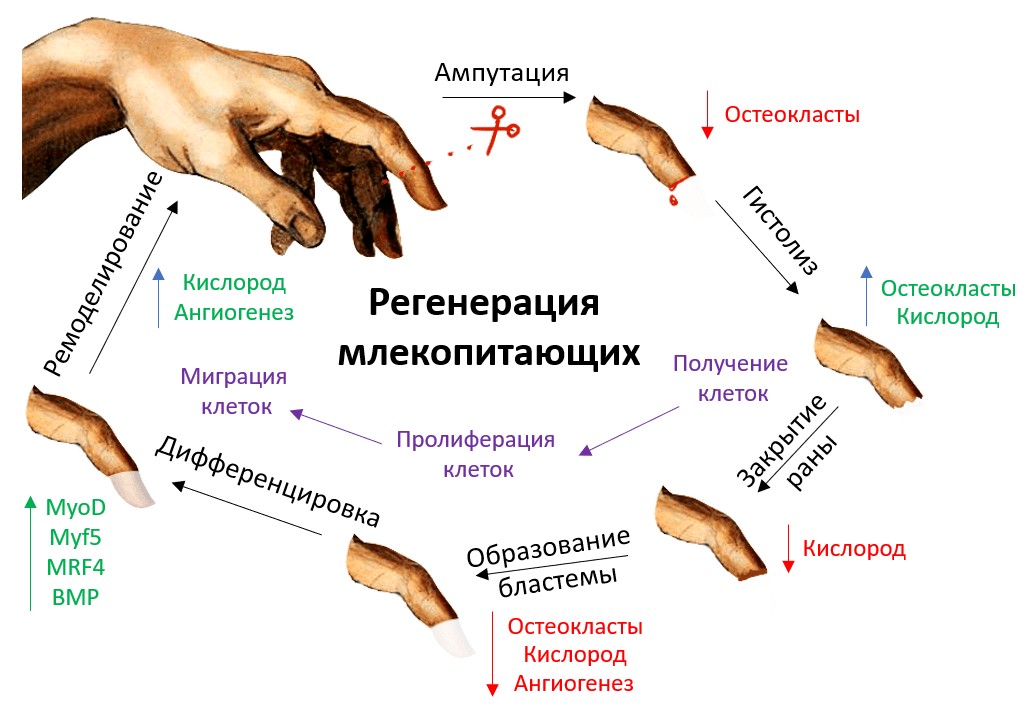
Рисунок 6. Цикл регенерации кончика пальца у млекопитающих: ампутация, гистолиз, закрытие раны, образование бластемы, дифференцировка, ремоделирование. Для каждого этапа характерны свои особенности и нюансы, о которых речь пойдет дальше.
рисунок авторов статьи
1. Ампутация
После столь ужасной травмы организму первым делом необходимо остановить кровопотерю и создать условия для образования бластемы. Сразу после травмы включается иммунная реакция, останавливается кровотечение, происходит вазоконстрикция (сужение сосудов) и коагуляция тромбоцитов. Они формируют сгусток фибрина, который составляет основу тромба [6], [7]. Вместе с этим в рану мигрируют воспалительные клетки — нейтрофилы и моноциты. Последние на месте повреждения превращаются в макрофаги, ну а нейтрофилы «пожирают» патогенные микроорганизмы, после чего «кончают с собой» путем апоптоза. Эти клетки входят в систему врожденного иммунитета, и в числе первых запускают защитную реакцию и воспаление. Этот этап длится первые несколько часов после травмы.
Как упоминалось ранее, у заживления после ампутации возможны два исхода: образование рубца из фиброзной ткани или эпиморфная регенерация. А что именно произойдет — решится в следующей фазе.
2. Гистолиз
Это разрушение тканей путем их «растворения» протеолитическими ферментами перед заживлением раны. Можно сказать, что организм действует по принципу «вред во благо». Это одна из ключевых стадий эпиморфной регенерации, так как именно в результате гистолиза формируется микроокружение, стимулирующее дедифференцировку клеток в стволовые, благодаря чему и формируется бластема. Происходит необходимое разрушение кости и уменьшение ее в объеме (до 60–75%) для того, чтобы ее компоненты (в том числе мезенхимальные и гемопоэтические, или кроветворные, стволовые клетки) могли принять участие в регенерации (рис. 7). Параллельно этому синтезируются протеазы (ферменты, расщепляющие белки) клетками иммунной системы, реорганизуются фрагменты внеклеточного матрикса и образуются факторы роста — специальные белки, контролирующие рост клеток и их вступление в клеточный цикл и усиливающие или ингибирующие регенеративные процессы.

Рисунок 7. Гистолизу подвергается преимущественно костная ткань, а разрушают ее предназначенные для этого клетки — остеокласты. Данный процесс может длиться вплоть до образования бластемы (12–14 дней после ампутации).
[34], рисунок адаптирован
Активная роль в разрушении тканей принадлежит ферментам матриксным металлопротеиназам (ММП). Они расщепляют белки внеклеточного матрикса, которые вовлечены в процесс заживления ран и контролируют процесс ремоделирования тканей.
- Внеклеточный матрикс
- многокомпонентная субстанция, которая объединяет разрозненные клетки в единый многоклеточный организм, и в которую погружены все клетки организма [8]. Внеклеточный матрикс, который формируется при воздействии иммунных клеток, содержит гиалуроновую кислоту и специфические белки (гликопротеины и протеогликаны), а затем дополняется другими белками (коллагены типа I и III, эластин, фибронектин, тенасцин-C и др.), что делает матрикс более организованным и структурированным [9]. Примечательно, элементы внеклеточного матрикса легко окрашиваются, поэтому по их градиенту концентрации легко визуализировать и отслеживать, с каким успехом проходят восстановительные процессы. Все перечисленные соединения синтезируются преимущественно фибробластами — клетками соединительной ткани, которые вносят основной вклад в образование бластемы и ремоделирование конечностей [10].
Раневые участки содержат множество типов ММП, которые поддерживают различные реакции, связанные с миграцией фибробластов, ангиогенезом (восстановлением сосудистой сети) и предотвращением синтеза базальной мембраны между тканями конечности и раневым эпидермисом, что и подавляет рубцевание. Ингибирование ММП приводит к замедлению заживления ран и нарушению миграции и дифференцировки стволовых клеток. Например, мыши с мутацией коллагена типа I, который устойчив к расщеплению ММП-1, демонстрируют нарушение ремоделирования и замедленное заживление тканей. Однако в ряде исследований многие ММП-дефицитные мутанты не демонстрируют таких аномалий, что может быть связано со сложной специфической ролью каждой ММП [9], [11]. При этом активность ММП не может продолжаться долго, она подавляется тканевыми ингибиторами металлопротеиназ, когда приходит время создавать новый каркас для клеток из внеклеточного матрикса на стадии ремоделирования.
3. Закрытие раны
На 7–10 день после ампутации происходит эпителизация поврежденного участка, что связано с ростом количества кератиноцитов. При этом продолжают работу иммунные клетки: макрофаги и нейтрофилы синтезируют активные формы кислорода, чтобы нейтрализовать инородные микроорганизмы и подвергнуть фагоцитозу поврежденную ткань [9]. Макрофаги — важный источник как воспалительных, так и противовоспалительных сигналов, поступающих в поврежденную область после травмы, где они участвуют в обмене компонентов внеклеточного матрикса, очищают ткани от инородных частиц и подвергают фагоцитозу апоптотические клетки (останки клеток после программируемой гибели). Эти процессы опосредованы специальными белками, контролирующими рост клеток — цитокинами. Благодаря провоспалительным цитокинам, которые запускают механизм специфического иммунитета и действуют через свои рецепторы на клетки мишени на ранней стадии воспаления (интерлейкины IL-1, IL-6, IL-8; фактор некроза опухоли-α TNF-α), фибробласты выделяют факторы роста кератиноцитов KGF-1, KGF-2, сигнализирующие кератиноцитам мигрировать и пролиферировать. Также клетками иммунной системы синтезируются хемокины (семейство цитокинов), необходимые для миграции фибробластов, а впоследствии и противовоспалительные цитокины (IL-4, IL-10, трансформирующий фактор роста TGF-β), которые ослабляют воспаление и стимулируют ангиогенез [12]. К примеру, сигнальная молекула TGF-β подавляет пролиферацию кератиноцитов, что способствует регенеративным процессам благодаря замедлению рубцевания. А у мышей с мутациями, нарушающими синтез TGF-β, наблюдалось более быстрое заживление ран и рубцевание. Поэтому неудивительно, что в исследованиях на мышах недостаток макрофагов и нейтрофилов или нарушение их регуляции после ампутации приводит к неполному восстановлению мышц и образованию рубцов [13].
Таким образом, уменьшение количества иммунных клеток вызывает снижение миграции фибробластов и кератиноцитов, так как снижается концентрация сигнализирующих белков. Однако и нормальное содержание макрофагов и нейтрофилов приводит к воспалению, а затем к образованию рубцовой ткани, что преимущественно и наблюдается у млекопитающих. Поэтому нельзя однозначно ответить, положительно или отрицательно клетки иммунной системы влияют на процессы регенерации. Стоит помнить, что иммунная система примитивных животных и низших позвоночных не так сложна, как у высших, что также может объяснять их лучшую способность к регенерации. Примечательно, что в ряде исследований, мутантные модели мышей, испытывающие дефицит макрофагов и нейтрофилов, все еще были способны заживлять небольшие раны без образования рубцовой ткани [13].
4. Образование бластемы
После заживления раны на 10–14 день после ампутации организму необходимо накопить достаточное число стволовых клеток для формирования бластемы. Обычно полученных на стадии гистолиза стволовых клеток взрослому организму бывает недостаточно, так как регенерация сложных структур конечности требует большого количества клеток-предшественников. Решение данной проблемы — дедифференцировка и трансдифференцировка уже детерминированных клеток соседних тканей. При этом анамнии справляются с дефицитом стволовых клеток путем свободного формирования клеток-предшественников из дифференцированных клеток в бластеме, а у амниот дедифференцировка совмещена с трансдифференцировкой [1]. Переход к более недифференцированному состоянию или смена клеткой своей специализации сопровождается реорганизацией цитоскелета (клеточного каркаса), перегруппировкой клеток, изменением взаимодействия между молекулами клеточной адгезии (преимущественно кадгерином и интегрином).
- Кадгерины и интегрины
- кальций-зависимые и кальций-независимые соединения соответственно, которые управляют перемещениями клеток, взаимодействуют с элементами внеклеточного матрикса и контролируют избирательное связывание клеток друг с другом в пункте назначения.
Синтез цитокинов, факторов роста, сигнальных молекул и молекул клеточной адгезии, от которых зависит потеря или смена клеточной специализации и пролиферация клеток в бластеме, коррелирует с кислородным голоданием — гипоксией. Если обратить внимание на хронологическую последовательность регенерации конечности у мыши, то можно заметить, что гипоксия наблюдается как раз к 12-му дню после ампутации конечности (рис. [5].
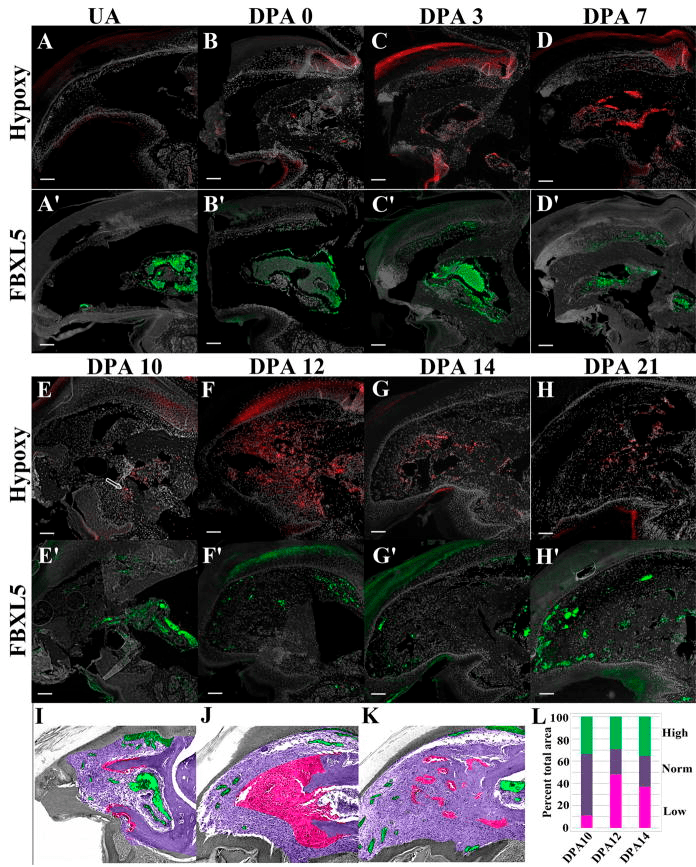
Рисунок 8. Кислород на месте ампутированной конечности. На кончике пальца мыши после ампутации можно заметить области гипоксии (A–H; красный цвет) и нормальной концентрации кислорода (A’-H’; зеленый цвет). Примечательно, в первые 7 дней после ампутации (DPA — days post-amputation) концентрация кислорода была по большей части повышена в тканях пальца, что связано с беспрепятственным проникновением кислорода через незакрытую эпидермисом рану, однако после ее закрытия можно наблюдать обширные области сниженной концентрации кислорода в тканях, что впоследствии приводит к формированию бластемы на 12-й день после ампутации (F, J, L).
На основе работ по изучению гипоксии во время регенерации можно предположить, что кислородное голодание является своеобразным стимулятором регенеративных процессов на стадии формирования бластемы. Однако как клеткам, которым обычно необходим кислород для нормального функционирования, приспособиться к таким непростым условиям? В это время в них синтезируются молекулы, призванные поддерживать их жизнеспособность — фактор, индуцируемый гипоксией, или HIF-1α [14]. Он побуждает клетки синтезировать те гены, которые адаптируют метаболизм под условия недостатка кислорода и участвуют в пролиферации и выживаемости клеток. Однако работа HIF-1α на данном этапе не закончена. Впоследствии он будет необходим уже для восстановления сосудистой сети.
Клетки бластемы обладают сложным генетическим профилем. Какие же гены отвечают за перепрограммирование зрелых клеток в стволовые? Общий фон экспрессии генов бластемы схож с таковым у эмбриональных стволовых клеток уже после формирования зародышевых листков. Кажется, многие слышали о возможности превратить окончательно дифференцированные клетки в стволовые, которые называются индуцированными плюрипотентными стволовыми клетками: ученые Джон Гардон и Шинья Яманака на опыте продемонстрировали, как вектор из четырех генов (Myc, Oct3/4, Sox2 и Klf4; данный список продолжает пополняться), внедренный в клетки, может обратить вспять биологические часы [15]. По сути, такие же гены активны в стволовых клетках бластемы.
К сожалению, было доказано, что клетки бластемы находятся не в плюрипотентном состоянии даже у анамний. Только четыре из шести ключевых генов транскрипционных факторов (Klf4, Sox2, Lin28, c‐Myc; без Nanog и Oct4), используемых для перепрограммирования взрослых специализированных клеток, активно экспрессируются [16]. Именно поэтому стволовые клетки бластемы относят к мультипотентным — клеткам, которые могут дифференцироваться только в клетки определенного типа ткани. Наряду с обязательными генами в общий профиль бластемы может входить до 50 генов, в разной степени вовлеченных в процесс формирования и поддержания бластемы. Однако необходимо еще распределить такое разнообразие клеток в пространстве для последующих дифференцировки и ремоделирования.
Для этого существуют так называемые направляющие воздействия. Активность небольшой группы соединений координирует миграцию большой популяции клеток, не только стволовых. Среди них помимо градиента кислорода важное место занимает комплекс из сигнальной молекулы и рецептора SDF1/CXCR4 [17]. Во время регенерации сигнальные молекулы SDF1 синтезируются преимущественно в фибробластах, которые, как говорилось ранее, необходимы для организации внеклеточного матрикса в бластеме. SDF1/CXCR4 примечателен тем, что его синтез повышается в ответ на повышение концентрации HIF-1α и механические повреждения, что приводит к усиленной миграции стволовых клеток посредством хемотаксиса в область ампутации (рис. 9) [14], [17]. Таким образом, к концу стадии образования бластемы у организма уже есть резерв стволовых клеток и место для их дислокации для последующей дифференцировки.
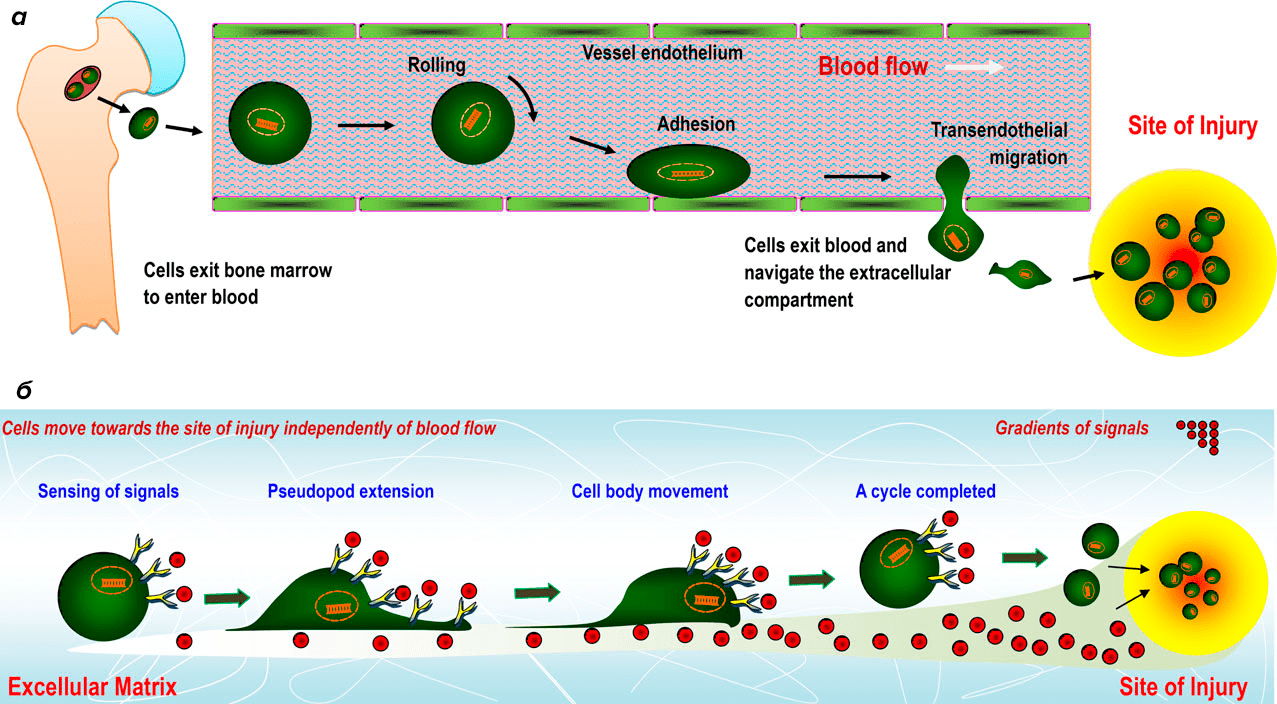
Рисунок 9. Миграция стволовых клеток по градиенту сигнальных молекул (например, факторов роста и хемокинов), которые высвобождаются тканью в ответ на повреждение. Стволовые клетки мобилизуются из костной ткани и мигрируют по кровеносным сосудам (а) или непосредственно по внеклеточному матриксу (б) с помощью белков клеточной адгезии, достигая места повреждения.
5. Дифференцировка
После образования бластемы необходимо направить дифференцировку стволовых клеток в нужное русло для последующего ремоделирования поврежденной конечности. У каждой более специализированной группы клеток активны определенные гены, которые кодируют сигнальные молекулы, молекулы клеточной адгезии, структурные белки и другие соединения. Чтобы восстановить ткань, нужно направить стволовые клетки по пути переспециализации, которая, в свою очередь, достигается за счет смены экспрессируемых генов.
Рассмотрим в качестве примера активацию сателлитных стволовых клеток — предшественников миоцитов. Направление миогенной дифференцировки осуществляется при помощи различных факторов роста, к которым относятся фактор роста гепатоцитов (HGF), фактор роста фибробластов (FGF), трансформирующий фактор роста β (TGF-β). Взаимодействуя со своими рецепторами, они активируют внутриклеточные сигнальные пути, что приводит к экспрессии специфических миогенных регуляторов. Среди них можно выделить белки и их семейства — Pax (Pax3, Pax7), MyoD, Myf5, MRF4, миогенин [18]. Они заставляют клетки дифференцироваться и производить специфические для мышц актин и миозин, цитоскелетные, метаболические и мембранные белки, характерные именно для мышечной клетки. При регенерации происходит активация не всех регуляторов сразу, процесс последователен: сначала в клетках-предшественниках активен белок Pax7, затем начинает синтезироваться MyoD, потом Myf5 и MRF4, а миогенин вырабатывается позднее, одновременно с началом производства тяжелых цепей миозина (рис. 10). При этом порядок их синтеза отличается от картины, характерной для миогенеза в ходе эмбрионального развития.
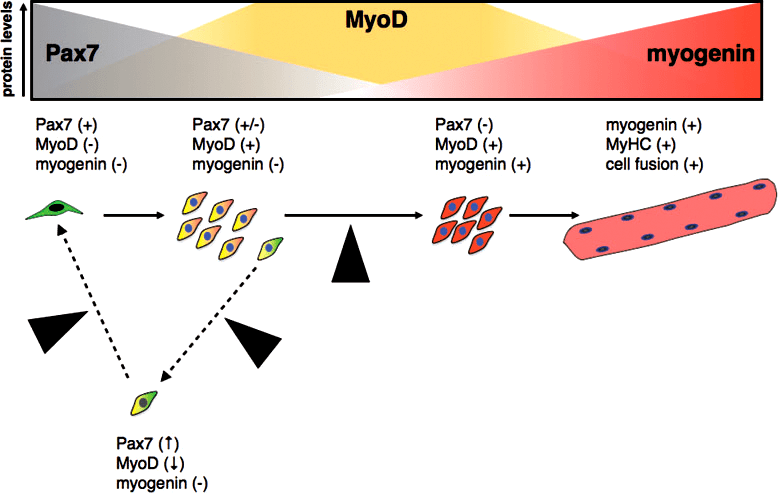
Рисунок 10. При пролиферации и самообновлении сателлитных клеток повышена выработка Pax7, затем под воздействием внешних стимулов происходит постепенная дифференцировка, за которую отвечает регулятор MyoD, в конце дифференцировки к общему фону экспрессии подключается ген транскрипционного фактора миогенина, который стимулирует синтез основных сократительных белков мышц (актин и миозин) и белков клеточной адгезии.
Особенное место при восстановлении конечности занимает дифференцировка клеток соединительной ткани. В основе этого процесса лежит активность преобладающих в бластеме фибробластов. В плане регенерации фибробласты являются уникальной группой клеток: после повреждения они мигрируют по градиенту сигнальных молекул, помогая восстанавливать как внеклеточный матрикс, так и почти все клетки соединительной ткани — костные клетки (остеобласты, остеоциты), хрящевые клетки (хондроциты), жировые клетки (адипоциты) и клетки гладких мышц (входят в состав сосудов) [19], [20]. Фибробласты в разных частях организма могут сильно отличаться друг от друга, даже в одной конечности между ними есть различия. Так, «зрелые» фибробласты, почти дифференцированные клетки с меньшей способностью к преобразованиям, могут существовать рядом с «незрелыми» фибробластами (часто называемыми мезенхимальными стволовыми клетками), которые способны развиваться в любой тип клеток соединительной ткани (рис. 11).
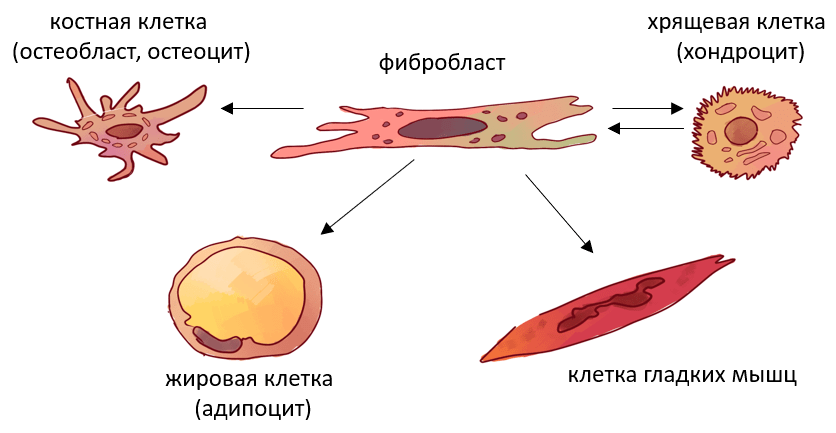
Рисунок 11. Универсальные фибробласты. Стрелками показаны взаимные превращения, происходящие между представителями семейства соединительной ткани.
[19], рисунок адаптирован
Поэтому грань между стволовыми клетками и фибробластами может быть довольно тонкой. Механизм этих взаимных превращений изучен не до конца, но можно выделить несколько наиболее важных участников сигнальных путей фибробластов: костные морфогенетические белки (BMP) и трансформирующий фактор роста β (TGF-β) [21]. Они регулируют рост, дифференцировку клеток соединительной ткани, а также контролируют синтез внеклеточного матрикса.
Параллельно с процессами дифференцировки происходит развитие сосудистой сети. Под влиянием ряда факторов роста — фибробластов (FGF), тромбоцитарного (PDGF), эпидермального (EGF), трансформирующего (TGF-β), фактора некроза опухоли-альфа (TNF-α), IL-6, IL-1 — происходит повышение уровня синтеза фактора роста эндотелия сосудов (VEGF). Он же является мощным стимулятором эндотелиоцитов, выстилающих кровеносные сосуды [13], [22]. VEGF связывается с рецепторами на поверхности эндотелиоцитов, побуждая их разрастаться и проникать в испытывающую кислородное голодание ткань после образование бластемы, чтобы обеспечить ее новыми кровеносными сосудами. Чтобы эндотелиальные клетки бесконтрольно не разрастались, они взаимодействуют между собой и с краевыми клетками для своевременной приостановки ангиогенеза. Таким образом, если запустить нужную комбинацию работы генов, можно преобразовать стволовые клетки в определенный тип дифференцированных клеток.
Наиболее простой способ — обратиться к внешним стимулам, которые в норме поступают от соседних клеток. Общая схема дифференцировки основана на том, что сигнальные белки от окружающих бластему клеток направляют развитие группы клеток по определенному пути. Можно выделить шесть групп сигнальных путей, необходимых как для самообновления стволовых клеток в бластеме, так и для их дифференцировки: FGF, TGFβ, BMP, Hedgehog (Hh), Notch, Wnt. Все ранее упомянутые молекулы в той или иной степени являются их участниками. Пути могут пересекаться и иметь общие сигнальные молекулы (рис. 12).
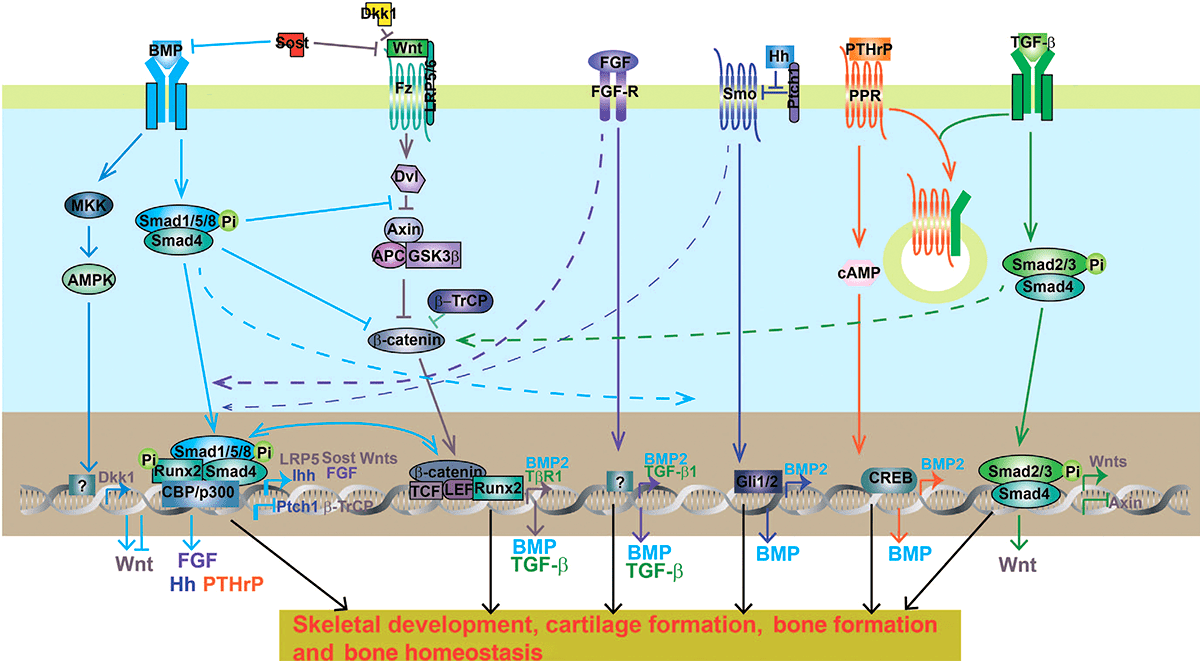
Рисунок 12. Общая схема и перекрестное взаимодействие некоторых сигнальных путей. Их активация связана со сложным каскадом взаимодействий между комплексами белков и ДНК, что в итоге приводит к синтезу белков, необходимых для регенерации поврежденных тканей.
Наиболее изученными в плане регенерации являются белки семейства Wnt. Они способны активировать Wnt/β-катениноный путь (канонический Wnt-путь), который основан на протеолизе (расщеплении) β-катенина — белка-регулятора генов, что приводит к окончательному определению судьбы клеток и морфогенезу; и неканонические (β-катенин-независимые) пути, которые регулируют реорганизацию цитоскелета и метаболизм кальция в клетках [23]. При этом дифференцировка клеток не обязательно должна быть однородной.
Существует механизм, обусловливающий чередование обычных эпидермальных клеток с сенсорными. За него преимущественно отвечает путь Notch. В основе лежит связывание сигнального белка Delta с рецептором Notch. Этот путь направляет сигнал клеткам вблизи предшественника сенсорной клетки не становиться на такой же путь дифференцировки. В результате они становятся эпидермальными.
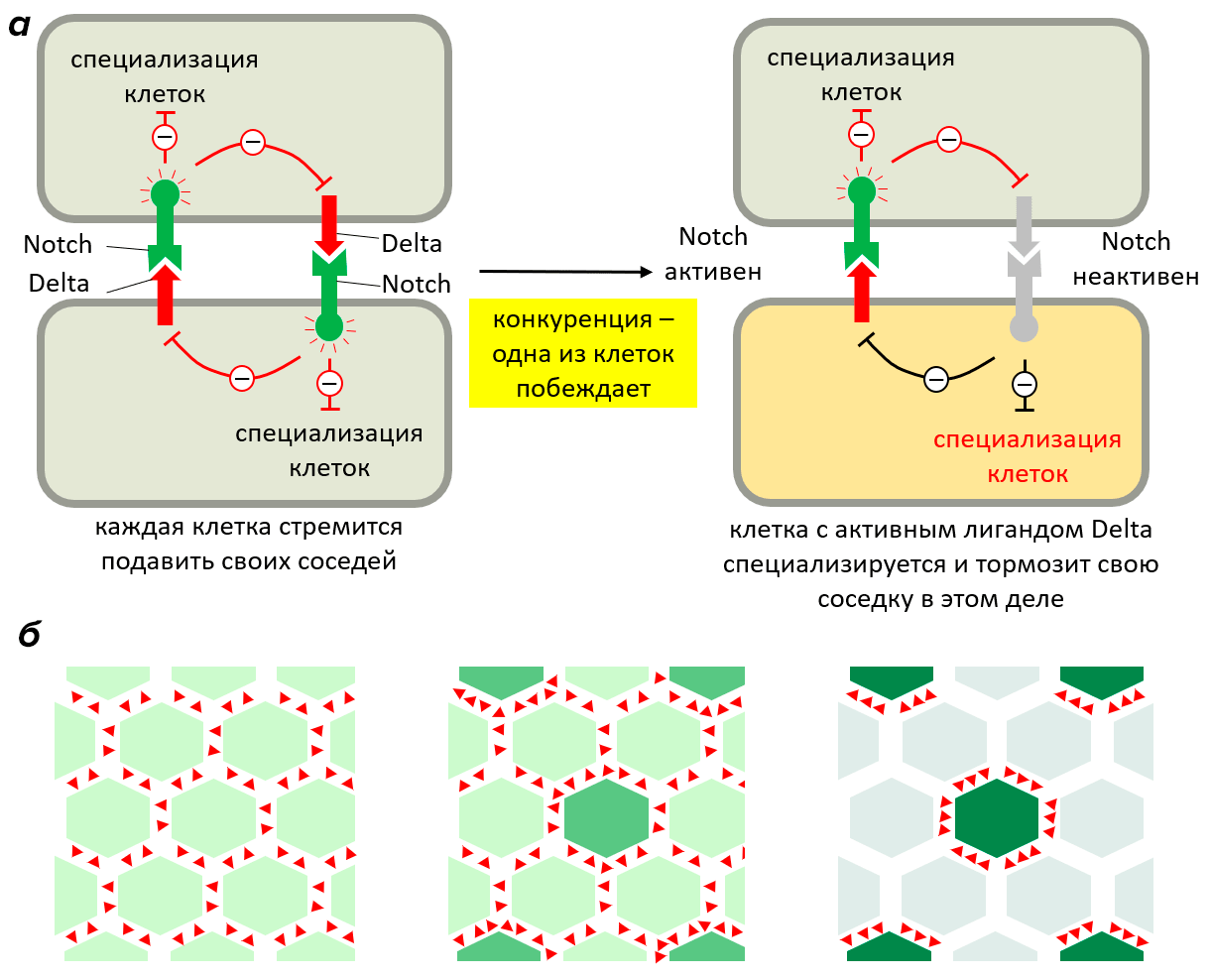
Рисунок 13. а — Механизм конкурентного ингибирования соседствующих клеток. Сначала все клетки в группе эквивалентны и синтезируют и трансмембранный рецептор Notch, и его сигнальную молекулу Delta, что препятствует специализации (серый цвет клеток). Когда одна из клеток дифференцируется (оранжевый цвет клеток), она пытается предотвратить дифференцировку в том же направлении соседних клеток за счет более сильной выработки Delta (у неспециализированной клетки производство Delta подавляется). б — Исход того же процесса в более многочисленной группе клеток. Выигрывающая клетка по мере того, как становится все более и более дифференцированной, тормозит своих соседей все сильнее.
[35], рисунок адаптирован
Таким образом, результатом активации или ингибирования перечисленных сигнальных путей является изменение транскрипции ДНК в отвечающей на сигнал клетке. Одни гены включаются, а другие выключаются. Разные сигнальные молекулы (факторы роста, гормоны, цитокины) активируют разные виды регулирующих гены белков, поэтому одни и те же клетки по-разному реагируют на один и тот же сигнал, посылаемый в разное время, а клетки разного типа по-разному реагируют на одинаковый сигнал. При этом молекулы сигнальных путей образуют группу сигнальных молекул — морфогенов, изменение концентрации которых приводит к изменению градиента концентрации сигнала, что побуждает клетки ступать на различные пути развития (высокая концентрация — один путь развития, низкая концентрация — другой). Когда клетка делает свой окончательный выбор в дифференцировке, она обязуется следовать сложной программе, предполагающей экспрессию строго определенного набора генов. В конечном счете это приводит к ремоделированию конечности, где каждая специализированная клетка занимает свое место.

Рисунок 14. Иногда выбор пути клеточной специализации навевает воспоминания о дорожном камне из русских былин
рисунок Анастасии Кисловой
6. Ремоделирование
Вместе с процессами дифференцировки происходит ремоделирование — восстановление исходного размера и формы конечности. Эти процессы могут быть растянуты во времени и занимать от 14 до 40 дней после ампутации. Необходимо учесть факт, что к концу дифференцировки каждая клетка обладает своей пространственной ориентацией благодаря молекулам клеточной адгезии и запоминает положение по биохимическим реакциям соседей — возникает подобие позиционной памяти. Передние и задние конечности обладают одним и тем же набором дифференцированных тканей (кости, кожа, мышцы). Однако именно различие в пространственном положении тканей друг относительно друга отличает руку от ноги. И клеточная память хранит информацию об этом. Если перенести элемент бластемы с дистальной (дальше от туловища) части конечности к более проксимально (ближе к туловищу) расположенной бластеме той же конечности, то клетки будут формировать нормальную конечность [16]. Если же взять часть клеток бластемы, которая в норме должна образовывать заднюю конечность, и интегрировать в область бластемы передних конечностей, то нас ждет весьма интересный результат: из-за позиционной памяти часть клеток передних конечностей будет содержать морфологические признаки задних конечностей (рис. 15).
Рисунок 15. Такие маленькие мелочи, как происхождение бластемы, могут иметь большое значение
рисунок Анастасии Кисловой
Как происходит регуляция положения клеток, приводящая к формированию нужной? Она осуществляется с помощью так называемых гомеозисных генов (консервативных генов, отвечающих за регуляцию развития и формирование органов и тканей). Различают несколько комплексов гомеозисных генов, которые объединены в кластеры на нескольких хромосомах. Общее число таких генов в течение эволюции достигло 48 у млекопитающих. При этом к наиболее важным семействам генов относится Hox-группа, которая участвует в определении формы конечностей и экспрессируется неоднородно в проксимальном и дистальном положениях в бластеме. Так, в конечности позвоночных гены из пары комплексов Hох (НохА и НоxD) экспрессируются в виде регулярной системы, подчиняющейся обычным правилам последовательной экспрессии генов в этих комплексах (всего их четыре: НохА, HoxB, HoxC и НоxD). Они помогают в сочетании с другими факторами регулировать различия в поведения клеток по проксимально-дистальной оси конечности. В результате клетка запоминает свой «адрес» по оси конечности в пределах своего сегмента [24].
Но не все регуляторы относятся к группе гомеозисных белков. Например, группа морфогенов — Wnt, Bmp, Sox9 [25]. Это трио лежит в основе реакционно-диффузионный механизма, открытого Аланом Тьюрингом в 1979 году. Благодаря взаимной активации и ингибированию при участии описанных выше факторов роста и гомеозисных белков происходит формирование в бластеме градиентного сигнала и паттерна из полос Sox9, в результате чего образуется необходимое число и приобретается правильная форма пальцев [26]. При этом любое нарушение одного из компонентов может нарушить нормальное строение конечности.
Нервная иннервация и бластема — «два сапога пара»
Следует учитывать, что на всех этапах регенерации, особенно на ранних стадиях, важную роль играет нервная иннервация места повреждения, которая является своеобразным связующим звеном в процессах регенерации. Можно сказать, что нейроны способствуют миграции и создают дополнительный стимул к дифференцировке стволовых клеток [9]. Еще в 2003 году было доказано, что факторы роста, среди которых можно выделить нейротрофический фактор мозга (BDNF) и глиальный нейротрофический фактор (GDNF), необходимые для нормального развития бластемы и дополнительного привлечения нервов к месту ампутации, образуются как раз при взаимодействии микроокружения бластемы с нервами [27]. К примеру, ампутированные конечности тритона без иннервации не регенерируют, а раны просто зарубцовываются. Даже была сформулирована нейротрофическая теория Маркуса Сингера на основе его работ 1942–1978 годов, согласно которой существует некий порог числа нервных волокон для успешного формирования бластемы в зависимости от места повреждения. Причем тип нервных волокон (чувствительные или двигательные), согласно ей, не влияет существенно на ход регенерации. Результаты исследований, проведенных на тритонах, подтверждают, что чем больше площадь поперечного сечения у конечности, тем большее число нервных волокон необходимо для регенерации (количество нервных волокон на единицу площади при этом оставалось постоянным) [28]. Эта теория работает и на млекопитающих, хотя роль иннервации в регенерации у них изучена не до конца: у мышей при удалении нервов задней конечности в области кончиков пальцев наблюдалось утолщение кожи и нарушение роста костей, однако стволовые клетки все же не утрачивали способность к дифференцировке [29].
«Через неделю пациент пришел со старым отрубленным пальцем в сумке и новым на руке» — Каковы реальные возможности регенеративной медицины настоящего и будущего?
Мы постарались объяснить процессы, за счет которых происходит регенерация конечностей, но пока оставили без должного внимания самый важный вопрос — до какой степени возможна регенерация? Анамнии способны отращивать всю конечность заново, но у амниот все иначе. По названию статьи и примерам, приведенным по ходу, читатель уже мог догадаться, что у амниот, особенно у млекопитающих, регенерация возможна не для плеча, не для предплечья, даже не для кисти, а только лишь для фаланг пальцев (и то не всех)! В исследовании на мышах ученые ампутировали различные фаланги пальцев, а затем наблюдали за формированием бластемы. На 10-й день после ампутации образование бластемы на уровне второй фаланги наблюдалось лишь в некоторых случаях. При этом даже попытка приживления бластемы из первой фаланги ко второй не увенчалась успехом (наблюдалось менее 10% случаев успешного формирования бластемы) [30]. На успех регенерации может влиять ногтевая пластина, вокруг которой обнаружено скопление стволовых клеток, способных влиять на другие мультипотентные стволовые клетки. После ампутации кончика пальца в пределах ногтевой пластины стволовые клетки за счет активности уже известных генов группы Bmp и Wnt и перечисленных ранее в статье цитокинов, факторов роста, транскрипционных факторов и молекул клеточной адгезии оказались способны восстановить утраченный кончик пальца. Мыши после ампутации выше ногтевой пластины в пределах второй фаланги были почти лишены способности к регенерации [31].
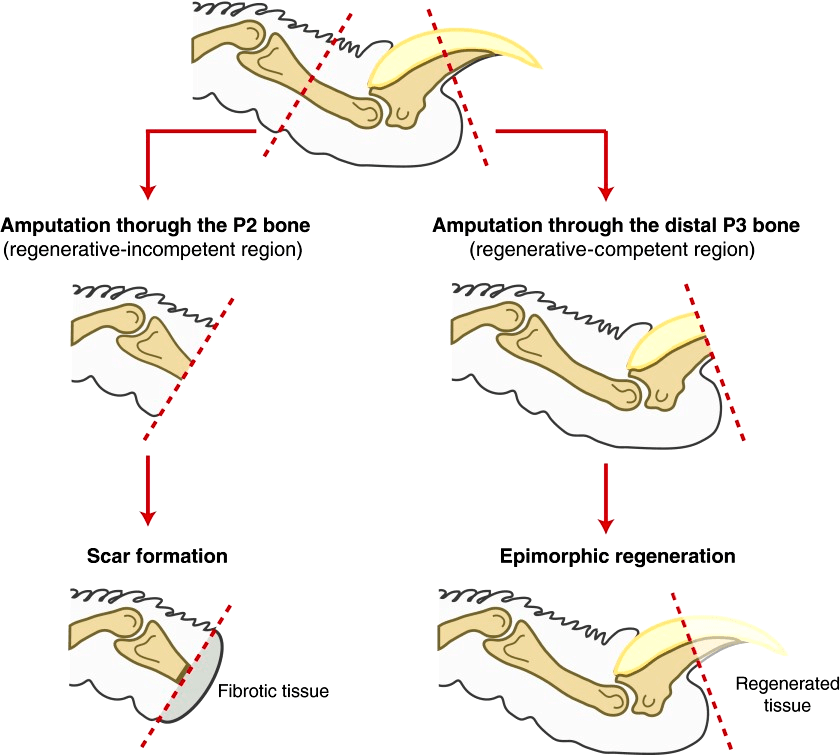
Рисунок 16. Когда регенерация невозможна. Если произвести срез в пределах первой фаланги (правый путь), то регенерация утраченной части конечности возможна. Если же ампутация произошла дальше, в пределах второй фаланги (левый путь), то образуется преимущественно фиброзная ткань.
У людей наблюдается похожая картина: пострадавший после несчастного случая может регенерировать первую фалангу пальца, на которой осталась нетронутая ногтевая пластина. Может ли врач поспособствовать более эффективному процессу регенерации? В силу сложности хирургической работы с мелкими сосудами проводить операции по реплантации нецелесообразно. Лучший вариант — наложить окклюзионную повязку на место ампутации, тем самым предотвращая возможное заражение и предоставить организму самому справиться с проблемой, как это было ранее упомянуто в исследовании с медицинским клеем.
В журнале International Journal of Molecular Sciences ученые впервые описывают изменения, происходившие на раневой поверхности в течение недели после ампутации у людей. Выяснилось, что в экссудате, полученном с окклюзионных повязок, была повышена концентрация упомянутых ранее факторов роста — VEGF, EGF, FGF, BDNF, — а также воспалительных цитокинов на первой неделе после ампутации. На второй — противовоспалительных цитокинов [32]. При этом неясной оставалась роль иммунитета, результаты действия которого связывали с образованием фиброзной ткани. Успешная регенерация в основном наблюдалась у детей. Примечательно, что после регенерации отпечаток пальца не восстанавливался. Тем не менее в интернете можно найти немало сопровождающихся фотографиями рассказов о случаях успешной регенерации у взрослых. Вот еще один повод беречь свои ногти!
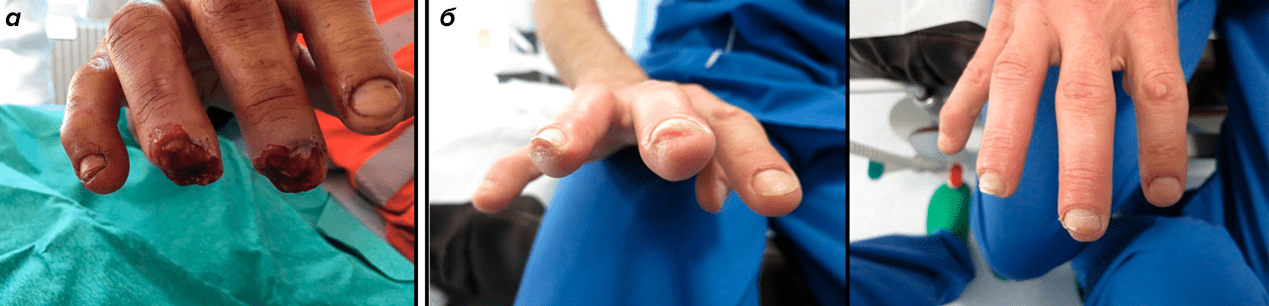
Рисунок 17. Клинический случай регенерации: а — перед наложением окклюзионной повязки; б — через три месяца после травмы. Регенерированные пальцы по морфологическим и функциональным характеристикам аналогичны пальцам на другой руке.
Может показаться, что в регенерации кончиков пальцев нет ничего важного. Слишком уж мелки они, что в физических размерах, что в значимости для организма по сравнению с другими органами. Однако ее изучение впоследствии позволит расширить знания о созревании стволовых клеток, и в будущем станет возможным спроецировать модель восстановления кончиков пальцев на более сложные структуры. Надеемся, развитие технологий регенеративной медицины позволит создать будущее, в котором протезы уже не будут нужны.
- Elizabeth R. Zielins, Ryan C. Ransom, Tripp E. Leavitt, Michael T. Longaker, Derrick C. Wan. (2016). The role of stem cells in limb regeneration. Organogenesis. 12, 16-27;
- Лаборатория молекулярных основ эмбриогенеза: от гена к признаку;
- Туберкулез: роковая история коварной болезни;
- Jennifer Simkin, Mimi C. Sammarco, Lindsay A. Dawson, Catherine Tucker, Louis J. Taylor, et. al.. (2015). Epidermal closure regulates histolysis during mammalian (Mus) digit regeneration. Regeneration. 2, 106-119;
- Mimi C Sammarco, Jennifer Simkin, Danielle Fassler, Alex J Cammack, Aaron Wilson, et. al.. (2014). Endogenous Bone Regeneration Is Dependent Upon a Dynamic Oxygen Event. J Bone Miner Res. 29, 2336-2345;
- Как работает свертывание крови?;
- Последний путь тромбоцита;
- Что такое внеклеточный матрикс и почему его все изучают;
- Yohan Choi, Fanwei Meng, Charles S. Cox, Kevin P. Lally, Johnny Huard, Yong Li. (2017). Regeneration and Regrowth Potentials of Digit Tips in Amphibians and Mammals. International Journal of Cell Biology. 2017, 1-13;
- Sarah Calve, Shannon J. Odelberg, Hans-Georg Simon. (2010). A transitional extracellular matrix instructs cell behavior during muscle regeneration. Developmental Biology. 344, 259-271;
- Bellayr I., Holden K., Mu X., Pan H., Li Y. (2013). Matrix metalloproteinase inhibition negatively affects muscle stem cell behavior. Int. J. Clin. Exp. Pathol. 2, 124–141;
- James W. Godwin, Alexander R. Pinto, Nadia A. Rosenthal. (2013). Macrophages are required for adult salamander limb regeneration. Proc Natl Acad Sci USA. 110, 9415-9420;
- Jennifer Simkin, Mimi C. Sammarco, Lindsay A. Dawson, Paula P. Schanes, Ling Yu, Ken Muneoka. (2015). The mammalian blastema: regeneration at our fingertips. Regeneration. 2, 93-105;
- Lizhen Liu, Qin Yu, Jie Lin, Xiaoyu Lai, Weijie Cao, et. al.. (2011). Hypoxia-Inducible Factor-1α Is Essential for Hypoxia-Induced Mesenchymal Stem Cell Mobilization into the Peripheral Blood. Stem Cells and Development. 20, 1961-1971;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- David L. Stocum. (2017). Mechanisms of urodele limb regeneration. Regeneration. 4, 159-200;
- Xuan Li, Xiao-Tao He, Yuan Yin, Rui-Xin Wu, Bei-Min Tian, Fa-Ming Chen. (2017). Administration of signalling molecules dictates stem cell homing forin situregeneration. J. Cell. Mol. Med.. 21, 3162-3177;
- Hugo C. Olguín, Addolorata Pisconti. (2012). Marking the tempo for myogenesis: Pax7 and the regulation of muscle stem cell fate decisions. J. Cell. Mol. Med.. 16, 1013-1025;
- Fibroblasts and their transformations: the connective-tissue cell family. In: Molecular Biology of the Cell (4th Edition) / ed. by Alberts B., Johnson A., Lewis J., Raff M., Roberts K., Walter P. NY: Garland Science, 2002. — 712 p.;
- Такие разные стволовые клетки;
- Mengrui Wu, Guiqian Chen, Yi-Ping Li. (2016). TGF-β and BMP signaling in osteoblast, skeletal development, and bone formation, homeostasis and disease. Bone Res. 4;
- Ling Yu, Mingquan Yan, Jennifer Simkin, Paulina D. Ketcham, Eric Leininger, et. al.. (2014). Angiogenesis is inhibitory for mammalian digit regeneration. Regeneration. 1, 33-46;
- Важнейшие стрелочники клеток организма: белки Wnt;
- Гены, от которых вырастают крылья. И ноги. И всё остальное;
- Ashley W. Seifert, Ken Muneoka. (2018). The blastema and epimorphic regeneration in mammals. Developmental Biology. 433, 190-199;
- Дай пять: как математика управляет развитием пальцев;
- J Boyd. (2003). Glial cell line-derived neurotrophic factor and brain-derived neurotrophic factor sustain the axonal regeneration of chronically axotomized motoneurons in vivo. Experimental Neurology. 183, 610-619;
- Marcus Singer. (1947). The nervous system and regeneration of the forelimb of adult triturus. VII. The relation between number of nerve fibers and surface area of amputation. J. Exp. Zool.. 104, 251-265;
- Yuval Rinkevich, Daniel T. Montoro, Ethan Muhonen, Graham G. Walmsley, David Lo, et. al.. (2014). Clonal analysis reveals nerve-dependent and independent roles on mammalian hind limb tissue maintenance and regeneration. Proc Natl Acad Sci USA. 111, 9846-9851;
- Yuanyuan Wu, Karen Wang, Adrine Karapetyan, Warnakulusuriya Akash Fernando, Jennifer Simkin, et. al.. (2013). Connective Tissue Fibroblast Properties Are Position-Dependent during Mouse Digit Tip Regeneration. PLoS ONE. 8, e54764;
- Makoto Takeo, Wei Chin Chou, Qi Sun, Wendy Lee, Piul Rabbani, et. al.. (2013). Wnt activation in nail epithelium couples nail growth to digit regeneration. Nature. 499, 228-232;
- Paris Jafari, Camillo Muller, Anthony Grognuz, Lee Applegate, Wassim Raffoul, et. al.. (2017). First Insights into Human Fingertip Regeneration by Echo-Doppler Imaging and Wound Microenvironment Assessment. IJMS. 18, 1054;
- Гончарук С. (2018). Ras-dva и готово. ИБХ РАН;
- Lina M. Quijano, Kristen M. Lynch, Christopher H. Allan, Stephen F. Badylak, Tabassum Ahsan. (2016). Looking Ahead to Engineering Epimorphic Regeneration of a Human Digit or Limb. Tissue Engineering Part B: Reviews. 22, 251-262;
- Альбертс Б., Джонсон А., Льюис Д. и др. Молекулярная биология клетки: в 3-х томах. М.: «Мир», 1994. — 1560 с..
В настоящее время травматизм входит в пятерку ведущих смертности в мире, угрожая экономическому и социальному развитию. Переломы длинных костей занимают ведущее место в структуре травматизма последних десятилетий и составляют, по данным различных авторов, составляют до 80% всех повреждений костей скелета.
Поэтому проблема лечения переломов костей последние годы сохраняет актуальность, хотя прогресс в области травматологии является несомненным. Остается нерешенным ряд вопросов, связанных с так называемой остеогенной недостаточностью.
Несмотря на применение современных медицинских технологий, процент осложнений, возникающих в результате лечения переломов длинных костей, остается высоким.
К ним относятся замедленная консолидация, формирование ложных суставов, несращение костных отломков и другие проблемы.
Так, нарушение консолидации костных отломков при переломах длинных костей составляет от 15 до 50%, а частота ложных суставов варьирует от 4 до 33%.
Согласно данным Американской ассоциации ортопедии, из двух миллионов переломов длинных костей в США ежегодно около 100 тысяч завершаются несращением.
По информации отечественных исследователей, нарушения консолидации костных отломков при переломах костей конечностей составляют около 25% в структуре инвалидности пострадавших от механической травмы.
Процент неудач в процессе лечении подобных нарушений классическими методами достигает 33%, что почти в два раза превышает число неудовлетворительных анатомо-функциональных результатов лечения переломов.
За последние годы отмечается и скрытый рост инвалидности вследствие травм и увеличения срока консолидации в каждом третьем случае.
Проблема лечения нарушений репаративной регенерации костной ткани, возникающих после диафизарных переломов костей, остается актуальной для современной ортопедии и травматологии. Случаи развития такой патологии составляют от 2,5 до 18%.
В структуре последствий травм длинных костей псевдоартрозы бедренной кости составляют 10-30%, костей голени — 15-50%, плечевой кости — 1-10%.
Обращает на себя внимание, что среди контингента с нарушениями репаративной регенерации костей преобладают лица трудоспособного возраста.
Данная патология отмечается стойкой утратой трудоспособности у 5 человек на 10000 населения, а образованные при этом анатомо-функциональные нарушения конечности являются причиной стойкой инвалидности в 12-45% больных.
Длительное лечение больных с большими материальными затратами, низкая эффективность, высокий уровень инвалидности позволяют считать осложнения при переломах длинных костей важнейшей социальной проблемой, с которой многим пострадавшим сложно справиться без социальной помощи.
Из этого следует, что лечение переломов длинных костей, осложненных репаративными нарушениями, является актуальной экономической и медико-социальной проблемой.
Основная задача современной травматологии заключается в совершенствовании существующих и разработке новых, экономичных и эффективных методов лечения.
Что такое регенерация костной ткани?
Кость представляет собой сложный орган, который выполняет механические и биологические функции в организме и имеет сложную иерархическую структуру.
Кости участвуют в обменных процессах благодаря содержанию значительного процента минеральных веществ организма, а также создают специфическое микроокружение для предшественников крови красного костного мозга.
Костная ткань являет собой динамическую систему, в которой в течение жизни организма происходят два взаимосвязанных противоположных процесса, составляющих природный цикл ремоделирования – резорбция (разрушение) и остеогенез (синтез).
Поэтому условия репаративного остеогенеза постоянно находятся в поле зрения практикующих врачей – травматологов и ортопедов.
Давно известно, что переломы в области компактной (кортикальной) и губчатой (трабекулярной) костной ткани отличаются сроками консолидации, что связано с особенностями ее структурной организации.
Перспектива заживления переломов губчатой кости более благоприятные, поскольку в структуре ее находятся элементы, необходимые для формирования регенерата. В свою очередь, компактная костная ткань характеризуется низкой плотностью сосудов по сравнению с губчатой, а также имеет особенности кровоснабжения.
Репаративная регенерация определяется как процесс восстановления ткани после травмы. Механизмы репаративной и физиологической регенерации одинаковые и основываются на единых биологических закономерностях.
Репаративная регенерация рассматривается как в той или иной степени усиленная физиологическая. Репаративная регенерации костной ткани – она же репаративный остеогенез – важная теоретическая и практическая проблема травматологии.
Действительно, в идеале консолидация перелома должна привести к образованию обновленной костной ткани, идентичной старой, существовавшей до травмы. Однако сращение перелома на практике является достаточно сложным, длительным многостадийным процессом, на который влияет множество факторов.
Кость имеет очень высокий репаративный потенциал.
Проблема состоит в том, что процессы репаративного остеогенеза возможно ускорить за счет активации обмена лишь в очень незначительной степени (порядка недель). С другой стороны, замедлить процесс нарушением физиологических условий очень легко, что нередко происходит из-за недостаточного понимания физиологии кости.
Согласно определению Руцкого и Ткаченко, репаративная регенерация – это сложный процесс, вызванный разрушением костных структур, который количественно превышает допустимые пределы физиологической регенерации и направлен на полное восстановление анатомической целостности и функции кости.
По мнению исследователя А. Корж, процессы регенерации кости являются сложным переплетением общих воздействий на системном уровне и локальных изменений тканевых обменных процессов, включая изменения на молекулярном уровне.
Д. Саркисов и соавторы представляют репаративный остеогенез как физиологическую регенерацию, которая протекает в условиях экстремальных воздействий на организм и отличается большей интенсивностью проявлений.
Другие же исследователи утверждают, что, в отличие от физиологической регенерации, которая фактически является адаптацией, репаративный остеогенез – компенсаторный процесс, восстанавливающий строение после гибели части или всего органа.
Репаративная регенерация каждого типа тканей имеет уникальные особенности, но всегда включает следующие процессы:
-
Разрушение поврежденных клеток и структур
-
Пролиферация жизнеспособных клеток в области дефекта
-
Дифференцировка жизнеспособных клеток регенерата
-
Формирование межклеточных связей и перестройка регенерата.
Репаративная регенерация костной ткани бывает неполной или полной.
Полная регенерация характеризуется замещением дефекта тканью, которая соответствует старой ткани. О неполной принято говорить в случаях, когда костный дефект замещается соединительной тканью или рубцом.
Репаративный остеогенез – это многокомпонентный процесс, основными этапами которого являются дифференцировка клеток, пролиферация, резорбция погибшей ткани и образование кости с ее ремоделированием, формирование органического внеклеточного матрикса и его минерализация.
Описанные процессы протекают параллельно, но один из них может стать доминирующим на тех или иных стадиях репаративного остеогенеза.
Практика подтверждает, что костная ткань действительно является уникальной, поскольку способна восстанавливать полностью даже большие по длине дефекты.
Причины нарушений репаративной регенерации кости
Известно, что репаративная регенерация костной ткани является сложным, генетически запрограммированным процессом. Стадийно-временные характеристики этого процесса зависят от действия ряда эндогенных и экзогенных факторов.
Течение остеорепаративного процесса связывают с такими факторами:
-
Особенности и интенсивность травмы
-
Характер повреждения кости и мягких тканей
-
Степень посттравматических расстройств периферического кровоснабжения
-
Качество оказания первичной и квалифицированной медицинской помощи
-
Особенности восстановительного лечения
-
Наличием сопутствующей патологии.
Одно из первых мест среди причин, способствующих развитию нарушения репаративного остеогенеза, занимает несвоевременность и неадекватность оказания квалифицированной медицинской помощи.
Экспериментально доказано, что в случаях отсроченной иммобилизации отломков при переломе костей предплечья уже на 3 сутки проявляются признаки нарушения процесса костной репарации с увеличением срока консолидации в 1,5 раза.
Отсроченное сопоставление отломков костей голени за 14 суток приводит к образованию ложного сустава, а при отсутствии стабильной фиксации отломков сроки формирования периостального костного сращения увеличиваются не менее чем в 4 раза.
Дальнейшие экспериментальные исследования показали, что нарушение условий репаративной регенерации в виде отсроченного до 14 суток сопоставления костных отломков приводят к формированию ложного сустава на 50-е сутки.
При медленном заживлении перелома восстановление кости в обычные сроки не происходит, тормозится ремоделирования и созревания костной мозоли.
Как правило, заживление в подобных ситуациях наступает через год и более.
Перелом расценивают как несросшийся, если по истечении 6 месяцев отсутствуют рентгенологические признаки заживления, или когда отсутствует положительная динамика в течение трех месяцев наблюдения.
При несращении перелома наблюдается торможение репаративных процессов и остановка его заживления. Понятие «замедленная консолидация» принято считать относительным, поскольку сроки сращения переломов у каждого больного индивидуальны и зависят от многих факторов.
Условно эти факторы можно разделить на общие и местные.
Общие факторы связаны с общим состоянием организма, сопутствующей соматической патологией, медикаментозной терапией, наличием вредных привычек и тому подобное.
К факторам второй группы относят отсутствие надежной иммобилизации сегмента, недостаточную репозицию, фиксацию и нарушение кровоснабжения костных отломков, травматичность оперативного вмешательства, нарушения тактики лечения, использование массивных металлических имплантатов.
Важным звеном репаративной регенерации является состояние костной ткани на момент травмы, а также эндемическое состояние региона, где проживает травмированное лицо.
В последнее время увеличивается количество исследований относительно влияния неблагоприятных экологических факторов на репаративный остеогенез костной ткани. Отечественными и зарубежными авторами изучалось влияние экологического окружения человека на структуру и метаболизм костной ткани, от которых зависит ход репаративной регенерации.
Клинические исследования демонстрируют, что повышенное потребление фтора сопровождается ломкостью костей, при этом замедляется процесс репаративного остеогенеза и чаще формируются ложные суставы.
После проведения нескольких экспериментов in vitro ученые пришли к выводу о разрушительном действии радиации на костную ткань, которая также замедляет процессы регенерации и увеличивает количество осложнений.
Поэтому при лечении переломов костей необходимо учитывать воздействие неблагоприятных факторов окружающей среды на регенерацию костной ткани.
В настоящее время темой научных дискуссий является вопрос зависимости частоты нарушений остеорепаративных процессов от механизма травмы. Согласно клиническим исследованиям, этиологический фактор травмы влияет на процессы заживления раны.
На течение репаративного процесса влияет как разновидность травмирующего агента, так и характер повреждения костной ткани. По данным ряда авторов, у 55% пациентов с нарушением репаративного остеогенеза травма получена в результате действия высокоэнергетического травмирующего агента.
Проведенные экспериментальные исследования выявили, что при воздействии травмирующей силы высокой интенсивности происходит гибель значительного числа клеточных источников остеорепарации, а сохранившиеся клетки претерпевают настолько значительные морфологических изменения, что не в состоянии поддерживать нормальное функционирование ткани.
Е. Побел и соавторы приводят целый ряд причин, которые приводят к нарушению процессов посттравматической остеорегенерации:
-
Возраст пациента
-
Характер травматического повреждения
-
Патологическое состояние костной ткани (остеопороз)
-
Отягощенный анамнез (хронические болезни печени и почек, ожирение)
-
Снижение остеорепаративного потенциала (дефицит факторов роста, остеокальцитонина, активной формы гормона витамина D3)
-
Травматичность процедуры металлоостеосинтеза.
Эти изменения приводят к нарушению процессов консолидации костных отломков и требуют проведения мероприятий по оптимизации репаративного остеогенеза.
Кость является высокоспециализированной тканью, которая существует в тесном взаимодействии связи с кровеносной системой. Взаимосвязь путей гемоциркуляции в костной ткани проявляется как в местных нутритивных процессах, поддержке общего минерального равновесия внутренней среды организма, так и непосредственно в физиологической и репаративной регенерации костной ткани.
Поэтому весомым фактором, обусловливающим расстройства репаративного остеогенеза, является нарушение кровообращения в участке повреждения.
Недостаточная степень кровоснабжения зоны перелома вследствие массивного повреждения мягких тканей, кости, отслоение и травматизация надкостницы, нарушение медуллярного кровообращения приводят к активизации хондрогенеза и неполноценности процесса срастания костных отломков.
Проведенные исследования выявили особенности структурно-функционального состояния сосудов при нарушениях репаративного остеогенеза. Эти расстройства могут быть обусловлены структурно-функциональнимы изменениями сосудов поврежденной конечности, которые определяют особенности его течения.
Большой интерес вызывает концептуальная модель механизма компенсации нарушений регионарного кровоснабжения при переломах костей, которую разработали исследователь Г.В. Гайко и его коллеги.
Проводя экспериментальные и клинические исследования периферического кровоснабжения при переломах, авторы пришли к выводу, что в основе восстановления регионарного кровоснабжения после перелома костей лежит перераспределение циркуляции крови и реваскуляризация тканей.
Компенсация регионарного и местного кровоснабжения, как правило, наступает в течение нескольких часов после травмы при переломах без смещения костных отломков, без обширного повреждения мягких тканей и магистральных сосудов.
Неполная компенсация сопровождается гипоксией, способствует развитию фиброзной соединительной ткани и стимулирует фиброзное сращение костных отломков.
На участке декомпенсации возникает некроз костной и мягких тканей, который и является причиной продления сроков лечения, формирования ложных суставов и возникновения гнойных осложнений.
Стадии репаративной регенерации костной ткани
Разработаны стадии репаративного остеогенеза в их взаимосвязи, при которых каждая стадия характеризуется определенным морфологическим клеточно-тканевой составом.
Изучение морфологических изменений при лечении перелома кости с использованием различных методических подходов позволило выделить в регенерации два этапа:
-
Построение соединительнотканной мозоли и замещение ее незрелой.
-
Перестройка в сформированную зрелой костью предшественницу костной мозоли.
Согласно результатом проведенных патоморфологических анализов заживления костных переломов выделяют следующие стадии восстановления дефекта кости:
-
I – дестабилизация клеточных элементов
-
II – интенсивная клеточная пролиферация
-
III – дифференциация различных тканей (хрящевой, фибробластической, остеобластической, недифференцированной ткани, похожей на мезенхиму, фибробластической соединительной ткани)
-
IV – эпигенез остеогенной ткани, при котором наблюдаются процессы прямой метаплазии, атипичной энхондральной оссификации и остеоидной модификации
-
V — спонгизация остеоидной ткани и образование остеонов
-
VI – образование пластинчатой кости.
В другом варианте выделяются 4 стадии: пролиферацию остеобластных клеток, образование коллагеновых волокон, образование аморфного углеводно-белкового вещества и импрегнация межклеточного вещества минеральными солями.
Используя новые данные молекулярной биологии, биохимии, морфологии, иммуноморфологии и генетики Н. Корж и соавторы выделили 5 стадий репаративного процесса: воспаление, дифференцировку клеток и формирование тканеспецифических структур в области травмы, реорганизация тканевых структур и их минерализация, ремоделирование и завершения восстановительного процесса.
Такого же мнения придерживаются многие известные зарубежные авторы.
Вообще, восстановление кости – сложный биологический процесс, требующий изменений в экспрессии нескольких тысяч генов.
Чаще консолидация переломов происходит путем косвенного восстановления кости, состоит из нескольких последовательных этапов – воспаление, образование мягкой мозоли, образование твердой мозоли и ремоделирование.
Фаза воспаления начинается непосредственно после травмы и длится до 5 дней.
Эта стадия включает образование воспалительной гематомы вследствие разрыва кровеносных капилляров в зоне перелома, миграцию в зону воспаления мезенхимальных клеток, нейтрофилов и макрофагов для удаления фрагментов поврежденной ткани, которые дифференцируются в фибробласты, остеобласты иил хондробласты с последующим образованием хрящевого матрикса.
В течение второй стадии, которая продолжается до 40 дней, происходит замещение гематомы фиброзно-хрящевой тканью путем дифференцирования мезенхимальных клеток в хондроциты, а также синтеза матрикса из коллагена второго типа.
Далее матрикс постепенно кальцинируется и замещается костной тканью, синтезированной остеобластами.
В течение третьей стадии процесса происходит оссификация, образуются костные мостики между фрагментами переломанной кости.
Процесс репаративной регенерации заканчивается стадией ремоделирования, когда восстанавливаются ее исходная форма, структура и механическая прочность.
Нарушение течения любой из этих стадий могут привести к замедлению процесса остеорепарации в целом или даже несращению фрагментов кости.
Гистологически различают два варианта сращения костных отломков – первичное (прямое) и вторичное. Первичное заживление происходит благодаря активной пролиферации остеогенных клеток в фоне гиперваскуляризация тканей на участке перелома. Вторичное заживление протекает в несколько стадий.
На сегодняшний день было разработано несколько классификаций, подробно описывающих стадии заживления перелома.
Известны данные и о стадийности заживления переломов, которые основаны на конкретных морфологических преобразованиях в зоне дефекта кости:
-
Тромбирование гематомы
-
Организация кровяного сгустка
-
Образование фиброзного предкистозного регенерата
-
Формирование полноценного регенерата костной ткани
-
Образование вторичного регенерата кости
-
Функциональная реконструкция регенерата.
Ряд авторов по совокупности структурно-морфологических и биохимических изменений, происходящих в костном регенерате, выделяют следующие фазы регенерации кости:
-
I – катаболическая, с дезинтеграцией и деградацией окружающих структур
-
II – прогрессирующая пролиферация клеток и дифференцировка клеточных элементов с секрецией органической основы костного регенерата
-
III – сложные биохимические, биофизические и физиологические процессы, приводящие к появлению первичной костной структуры
-
IV — образование пластинчатой костной структуры, обеспечивающей восстановление формы и функции кости.
При сопоставлении с приведенными выше исследованиями оригинально выглядит вариант классификации стадий заживления перелома кости (воспаление, фагоцитоз, фиброзная мозоль, первичная и вторичная костные мозоли), в котором авторы недостаточно обоснованно отделили фагоцитоз от воспаления.
На основании системных представлений и оценки результатов многочисленных клинических и экспериментальных наблюдений динамики сращения костных отломков А.Т. Бруско и соавторы предложили свою стадийность репаративного остеогенеза. Здесь он рассматривается как однонаправленный процесс, протекающий с закономерной последовательностью морфологических изменений регенерата.
Авторы выделили следующие стадии заживления переломов костей:
-
I – репаративная реакция
-
II – формирование сращения костных отломков
-
III – сращение отломков, при котором возможны варианты: а) первичное костное сращение, b) фиброзно-хрящевое сращение, c) вторичное костное сращение
-
IV – функциональная перестройка костной мозоли и консолидированных отломков с формированием органной структуры кости.
Как мы видим, проблема
регенерации костной ткани занимает особое место в биологических и медицинских
знаниях. На данный момент определены ключевые особенности регенерации костной
ткани и достигнуты определенные успехи в выяснении биологических механизмов,
лежащих в основе репаративного остеогенеза, сформулированы основные тенденции
развития науки.
Есть два вида регенерации – физиологическая и репаративная. Под физиологической регенерацией понимают восстановление тканевых структур здорового организма по мере их старения и отмирания. Наглядным примером этого является кожа — постоянное отслоение и отшелушивание эпидермиса. Физиологическая регенерация — это постоянный и очень медленный процесс, который не вызывает стрессовой ситуации в организме.
- Регенерация костей: основные сведения
- Источники регенерации
- Стадии репаративного остеогенеза
- Средства стимуляции остеорепарации
Регенерация костей: основные сведения
Репаративная регенерация — это восстановление поврежденной или потерянной ткани. Степень и качество регенеративного процесса в различных тканей различна. Чем выше дифференцировки ткани (нервная, мышечная), тем меньше у нее способность к восстановлению своей структуры. Поэтому анатомическое восстановление поврежденного участка происходит за счет замещения дефекта соединительной тканью — рубцом. Поврежденая костная ткань способна пройти ряд стадий репаративного процесса и восстановить свою анатомическую форму, гистологическую структуру и функциональную пригодность.
Перелом кости сопровождается повреждением прилежащих мягких тканей и вызывает стрессовую ситуацию, которая сопровождается местной и общей реакциями организма. В процессе восстановления костной ткани происходят сложные общие и местные биологические и биохимические изменения, которые зависят от кровоснабжения кости, возраста больного, общего состояния организма, а также качества лечения.

Источники регенерации
Восстановление целостности кости происходит путем пролиферации клеток остеогенного слоя надкостницы, эндоста, недостаточно дифференцированных плюрипотентных клеток костного мозга, а также вследствие метаплазии гиараосальних тканей.
Современные представления о процессах регенерации костной ткани сочетают концепции неопластической и метапластическая теорий. Преостеогенными клетками считают остеобласты, фибробласты, остеоциты, перициты, гистиоциты, лимфоидные, жировые и эндотелиальные клетки, клетки миелоидного и эритроцитного рядов.
При сращения сломанных костей установлена стадийность репаративного остеогенеза, которая имеет условный характер. Деление на стадии не имеет принципиального значения, поскольку они в динамике перекрываются.
Даже при идеальной репозиции и фиксации отломков дифференцировки различных клеток происходит одновременно, и поэтому стадийность репаративного процесса трудно разграничить. Но для выбора оптимальной тактики лечения больных нужно иметь представление о закономерностях репаративного остеогенеза.
Стадии репаративного остеогенеза
Стадия катаболизма тканевых структур и клеточной инфильтрации. По сравнению с воспалением это стадия альтерации (разрушение). После травмы возникают омертвения поврежденных тканей и распад клеточных элементов гематомы.
Организм человека немедленно реагирует на травму местной фагоцитарной реакцией. Наряду с этим продукты распада, которые являются генетическими индукторами, вместе с гормонами обусловливают репродукцию и пролиферацию различных специализированных клеток (остеоциты, гистиоциты, фиброциты, лимфоидные, жировые и эндотелиальные клетки), то есть мелкоклеточная инфильтрацию, которая длится 6—10 дней.
Стадия дифференцировки клеток длится 10—15 дней. В основном ДНК и РНК, а также анаболические гормоны направляют дифференцировку клеток прогрессирующего мелкоклеточного инфильтрата. Одновременно происходит три типа дифференцировки клеток: фибробластические, хондроидные и остеогенные. Это зависит от условий, при которых происходит репаративный процесс.
При идеальных репозиции и фиксации отломков и достаточном кровоснабжении (применение аппаратного остеосинтеза т.д.) сращение происходит по типу первичного остеогенеза. Дифференцировка большинства клеток сразу направлена на образование остеоидной ткани. Когда фиксация ненадежна или недостаточное кровоснабжение отломков вследствие тяжелых повреждений, дифференцировки клеток происходит путем фиброгенеза с последующей метаплией в хрящевую и костную ткани.
Стадия формирования первичного остеона — образование ангиогенной костной структуры — происходит в течение 16—21 дней. Характеризуется она тем, что возникает полная реваскуляризадия первичной мозоли. Регенерат прорастает капиллярами и начинается минерализация его белковой основы. Появляется мелкопетличная, хаотично ориентирована сетка костных трабекул, которые постепенно сливаются с образованием первичного остеона и гаверсовых канальцев.
Стадия перестройки первичного регенерата или спонгиозации мозоли, — это та стадия, на которой формируется пластинчатая костная ткань. Во время перестройки первичного регенерата костный пластинчатый остеон набирает ориентации над силовыми линиями нагрузки, появляется корковое вещество кости, надкостницы и восстанавливается костно-мозговая полость. Части регенерата, которые за нагрузкой, рассасываются. Все это приводит к полному восстановлению структуры и функции переломанной кости. В зависимости от локализации перелома процесс перестройки и восстановления может длиться от нескольких месяцев до 2—3 лет.
Итак, из закономерностей репаративной регенерации костной ткани вытекают следующие практические выводы:
1) идеальной репозиции и фиксации костных отломков следует добиваться быстрее, к тому же не позднее, чем начнется стадия дифференцировки клеток;
2) поздняя репозиция, любое вмешательство с целью коррекции отломков ведут к повторному разрушению капилляров регенерата и нарушению репаративного остеогенеза;
3) стимулятором образования пластинчатой кости в процессе перестройки первичного регенерата является функциональная нагрузкп, о которой следует помнить при лечении больных.
Теоретически различают три вида репаративной регенерации костной ткани — первичная, первично-замедленная и вторичное сращение. Первичное сращение костей происходит в течение короткого времени первичным остеогенезом за счет образования интермедиарной мозоли. Но для этого следует создать все условия. Прежде всего это наблюдается при забойных и компрессионных переломах костей, часто после идеальной репозиции (диастаз между отломками 50—100 мкм) и надежной фиксации отломков.
Первично-замедленное сращение бывает тогда, когда между неподвижными отломками нет щелей, сращения проходит только по сосудистым каналам (интраканаликулярный остеогенез), т.е. возникает частичное сращение, а полному межкостному сращиванию предшествует резорбция концов отломков. Но с практической точки зрения этот вид репарации следует расценивать как положительный, и поэтому клиницисты придерживаются разделения на два вида восстановления кости — первичное и вторичное.
Вторичное сращение переломанных костей происходит за счет образования менее полноценных видов мозоли — периостальной, эндостальной и параосальной (гематома, мягкие ткани).
Образованием избыточной периостальной и параосальной мозоли организм пытается компенсировать фиксацию отломков, которой не сделал врач. Это природный саногенез организма. В этом случае срок сращения кости значительно увеличивается. По характеру мозоли на рентгенограмме можно сразу оценить качество лечения больного. Чем больше мозоль, тем хуже была фиксация отломков.
Вторичное сращение кости сравнивают с заживлением ран мягких тканей. Но в заживлении поражения двух тканей принципиальная разница. Заживление раны мягких тканей, происходит вторичным натяжением, заканчивается образованием рубца, в то время как при переломе кости в процессе репарации все костные клетки проходят стадию метаплазии, что заканчивается образованием полноценной кости. Однако для того чтобы кость срослась вторично, необходима также надежная фиксация отломков. Если ее не будет, то клетки пройдут стадии фибро- и хондрогенеза, перелом заживет, но кость не срастется.
Вопрос о стимуляции репаративного остеогенеза в теоретическом плане остается нерешенным. Попытки ускорить регенерацию костной ткани уже были давно, и сейчас не уменьшается количество поисков.
Средства стимуляции остеорепарации
1) механические (раздражение периоста постукиванием молоточком по месту перелома, локальный массаж, дозированная нагрузка конечности, управляемое динамическая нагрузка сегмента конечности аппаратом Пустовойта т.п.);
2) физические (ИК, УВЧ—излучения, диатермия, электрофорез лекарств, ультразвуковая, лазерная, магнитная терапия, оксибаротерапия, электростимуляция и т.д.);
3) медикаментозные (метионин, цистеин, карбоксилин, витамины, нуклеиновые кислоты, ретаболил, тиреокальцитонин, кальцитрин, экзогенная гомологична РНК, мумие и т.д.);
4) биологические (локальные инъекции аутокрови, некрогормонотерапия, экстракты органов и тканей по И. Л. Зайченко, использование переходного эпителия мочевых путей, декальцинованого матрикса и молотой кости, костного трансплантата и т.д.).
Следует отметить, что некоторые средства стимуляции (лазерная, магнитная терапия и др.) И ныне еще не имеют полного теоретического обоснования, хотя эмпирически доказано их положительное влияние на срастание костей. Применение стимулирующих средств в зависимости от их целенаправленного действия следует связывать со стадией репаративного процесса в кости. Например, сначала назначают такие средства, которые способствуют обменным процессам, клеточной инфильтрации и дифференцировке клеток. На стадии формирования пластинчатой кости важен выбор оптимальной нагрузки костного сегмента.
Следует помнить, что сращиванию перелома кости помогает комплекс благоприятных факторов, но в условиях идеальной репозиции отломков, надежной их фиксации, полноценного питания и нормального обмена веществ. Если этого не будет, то репаративный процесс нарушается, и кость может не срастись независимо от вида стимулирования.
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Сухова Д.С.
1
Большакова О.В.
1
1 Медицинская академия им. С.И. Георгиевского (структурное подразделение) ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского»
Проблема регенерации эпителия является актуальной на сегодняшний день. Были изучены и проанализированы новейшие исследования в данной области за последние годы. Рассмотрена регенерация кожи без последующего образования соединительнотканного рубца, вызванная функционированием миофибробластов. Отмечено несколько закономерностей, которые участвуют в процессе при котором не образуется рубцовой ткани на месте повреждения. Установлено, что жировые клетки непосредственно связаны с волосяными фолликулами, а именно, при появлении фолликула увеличивается число адипоцитов. Именно благодаря появлению волос на поврежденной ткани обеспечивается ее регенерация. Вместе с этим рассматривалась регенерация волосяного фолликула. Для подтверждения теории ученые использовали технологию Cell-in-a-box, а также перепрограммированные iPS-клетки. Вклад в этот раздел внесли ученые университета биологии развития RIKEN, отдела Пластической и эстетической хирургии экспериментального центра южного медицинского университета, лаборатории развития и регенеративной биологии Пликуса. Регенерация ткани обусловлена ее перепрограммированием, которое вызывает сначала появление волосяных фолликулов, а они, в свою очередь, отвечают за регенерацию жировой ткани. Тканевая нанотрансфекция позволяет в клетки кожи вводить генетический код, который изменяет их на другие типы клеток, необходимые для излечения.
ips-клетки
регенерация
адипоциты
миофибробласты
морфология
1. Алексеева Н.Т., Никитюк Д.Б., Клочкова С.В. Аналитическая морфология репаративной регенерации в коже под действием различных региональных факторов // Журнал анатомии и гистопатологии. – 2015. – Т. 4, № 1. – С. 26-37.
2. Еськова А.Ю., Большакова О.В., Голубинская Е.П., Бессалова Е.Ю., Фомочкина И.И. Регенерация ожогов кожи в условиях местной терапии микробной трансглютаминазой со вспомогательной субстанцией авторской фитомази // Крымский журнал экспериментальной и клинической медицины. – 2017. – Т. 7, № 4. – С. 20-28.
3. Asakawa K, Toyoshima KE, Ishibashi N, Tobe H, Iwadate A, Kanayama T, et al. Hair organ regeneration via the bioengineered hair follicular unit transplantation. Sci Rep. 2012;2: 424.
4. Bolton EM, Bradley JA. Avoiding immunological rejection in regenerative medicine. Regen Med. 2015;10: 287–304.
5. Huang C, Du Y, Nabzdyk CS, Ogawa R, Koyama T, Orgill D, et al. Regeneration of hair and other skin appendages: A microenvironment-centric view. Wound Repair Regen. 2016;24: 759–766.
6. Mao AS, Mooney DJ. Regenerative medicine: current therapies and future directions. Proc Natl Acad Sci U S A. 2015;112: 14452–14459.
7. Su YS, Miao Y, Jiang JD, Liu H, Hu J, Hu ZQ. A simple and rapid model for hair-follicle regeneration in the nude mouse. Clin Exp Dermatol. 2015;40: 653–658.
8. Toyoshima KE, Asakawa K, Ishibashi N, Toki H, Ogawa M, Hasegawa T, et al. Fully functional hair follicle regeneration through the rearrangement of stem cells and their niches. Nat Commun. 2012;3:784.
9. Wang X, Tredget EE, Wu Y. Dynamic signals for hair follicle development and regeneration. Stem Cells Dev. 2012;21(1):7–18.
10. Xiao S, Hu Z, Jiang J, Miao Y, Feng C. Neonatal murine skin-derived cells transplanted using a mini-chamber model produce robust and normal hair. J Tissue Eng Regen Med. 2016;10: 286–293.
Несмотря на достижения молекулярной биологии, возможности лабораторного синтеза факторов роста клеток, современного уровня развития тканевой инженерии, проблема восстановления утраченного кожного покрова при повреждениях различной этиологии до сих пор по-прежнему актуальна [1-3]. После тяжелых ранений и операций на теле остается чаще всего некрасивый и огромный шрам. Регенерация органов становится многообещающим выбором для многих пациентов, однако многие подробности о механизмах восстановления остаются неизвестными.
Цель работы: провести анализ современных исследований в сфере открытий и решений проблем регенерации кожи.
Миофибробласты рыхлой волокнистой соединительной ткани являются превалирующим типом клеток, который присутствует в грануляционной ткани стягивающихся ран, а также находятся в некоторых развивающихся или нормальных взрослых тканях. Было выявлено, что миофибробласты можно превратить в жировые клетки, перепрограммируя их. Предполагаемая функция миофибробластов заключается в изменении натяжения ткани, а жировые клетки или адипоциты находятся в коже до тех пор, пока не образуется рубцовая ткань. Логично предположить, что каким-то образом необходимо заменить миофибробласты адипоцитами, чтобы не произошло образование рубца. Рубцовая ткань отличается от эпителия отсутствием волосяных фолликулов. Ученые пришли к выводу, что волосяные фолликулы и адипоциты связаны, и если восстановить волосяные фолликулы, они индуцируют увеличение жировых клеток в ответ на сигналы от фолликула. Как регенеративные образования, волосяные фолликулы предлагают хорошую модель для изучения механизмов, связанных с регенеративной медициной. В соответствующих исследованиях основное внимание уделялось донорским клеткам, и нет данных, связанных с влиянием факторов хозяина на реконструкцию волосяного фолликула [5].
Для начала, рассмотрим восстановление волосяных фолликулов при помощи изоляции трансплантированных клеток, проверив влияние факторов клетки-хозяина, то есть понять будет ли возможно развитие волосяного фолликула без клеток хозяина. Ученые отдела Пластической и эстетической хирургии Экспериментального центра Южного медицинского университета (Китай) провели целое исследование, посвященное образованию волосяного фолликула. Для эксперимента использовали шестнадцать новорожденных мышей, меченных красным флуоресцентным белком и двадцать четыре взрослых мыши с зеленым флуоресцентным белком. Все эксперименты над животными были проведены по согласованию с Комитетом по уходу и использованию животных Южного медицинского университета. Затем последовала подготовка клеток для трансплантации. Эпидермис и дерму разделили путем инкубации в течение ночи при температуре в 4 градуса по Цельсию. Потом кожу три раза промыли фосфатно-буферным физиологическим раствором, окончательно отделяя дерму от эпидермиса. Из каждой части получили «фарш» путем измельчения дермы и эпидермиса [8].
Технология Cell-in-a-Box позволила инкапсулировать клетки в защитный, полупроницаемый шарик на основе целлюлозы. Небольшие поры в бусинах позволяют проходить обмену питательных веществ, но клетки внутри бусинок сохраняются. Бусины способны выдерживать до 6 месяцев в имплантате, иммунного ответа хозяина нет. Эти характеристики позволяют встроенным клеткам расти в течение более длительного времени, чем традиционная двумерная клеточная культура. Эта технология была выбрана, как метод исследования и анализа взаимодействия между средами-хозяина и трансплантированными клетками. Капсулы, содержащие дермальные клетки с зеленым флуоресцентным белком, которые получили от новорожденных мышат с красным флуоресцентным белком, были подкожно пересажены мышам без шерсти. Пустые капсулы пересадили как контрольную группу. Каждая группа состояла из 6 мышей, которым в целом было пересажено по 10 капсул. Клетки смесей с красным флуоресцентным белком вводили под поверхностный слой подкожных тканей мышам с зеленым флуоресцентным белком. Никаких побочных эффектов не наблюдалось после трансплантации капсулы. Это указывает на то, что трансплантированные клетки могли принимать все питание от хозяина, но при этом были изолированы от клеток-хозяев. Рана зажила без осложнений. Ученые пришли к выводу, что если инкапсулированные клетки получают достаточное количество питательных веществ от хозяина, то они могут образовывать зрелые фолликулы волос при изоляции от клеток-хозяев [4].
Волосяные фолликулы представляют собой весьма информативную модель для изучения механизмов в области регенерации. Различные исследования подтвердили, что волосяные фолликулы могут быть восстановлены путем пересадки соответствующих клеток, но механизм этого процесса не совсем ясен. Хорошо известно лишь то, что микроокружение играет важную роль в клеточной пролиферации и дифференцировке (рис. 1). Микросреда обычно состоит из следующих групп: клетки (лейкоциты, фибробласты и адипоциты), факторы роста (трансформирующий фактор роста, фактор роста эндотелия сосудов и фактор роста фибробластов), внеклеточный матрикс (ламинин, фибронектин, протеогликан), и сигнальные молекулы (например, костный морфогенетический белок).
Рис. 1. Восстановление волосяных фолликулов и появление новых адипоцитов.
Ученые из Центра биологии развития RIKEN (Япония) успешно смогли создать ткань кожи, которая содержит волосяные фолликулы и сальные железы. Затем эту кожу имплантировали живым мышам, ткани образовывали связи с другими системами органов, такими как нервы и мышцы. Ученые использовали стволовые клетки для создания слоев кожи. Техническим термином для стволовых клеток, которые они использовали, являются перепрограммированные iPS-клетки. Команда доктора Цудзи взяла клетки из десен мышей и использовала химические вещества, чтобы превратить их в iPS-клетки. Затем они культивировали клетки, трансплантировав их на мышей, где они превращались в функционирующую ткань кожи. Как только клетки кожи дифференцировались, их пересаживали на разных мышей, где они начали естественным образом расти с фолликулами и железами и развивали связи с нервами и мышцами. Таким образом, биоинженерная кожа способна расти так же естественно, как и нормальная кожа без трансплантации [7].
До сих пор искусственное развитие кожи было затруднено тем фактом, что на коже не хватало волосяных фолликулов и экзокринных желез, которые играют важную роль в регуляции. Мы все ближе приближаемся к мечте о возможности воссоздания реальных органов в лаборатории для трансплантации, а также считаем, что ткань, выращенная этим методом, может быть использована в качестве альтернативы тестированию на животных химических веществ.
После того как стал понятен принцип регенерации волосяного фолликула возвратимся к начальной теме. Данное открытие было сделано при совместной работе ученых из Медицинской школы Перельмана в университете Пенсильвании и Лабораторией развития и регенеративной биологии Пликуса в Калифорнийском университете в Ирвине. Кристиан Ф. Герреро-Хуарес тесно сотрудничавший с проектом, комментировал открытие: «Как правило, миофибробласты, первичный тип клеток, обнаруженный в ранах, считались неспособными стать другими типами клеток. Однако наша команда обнаружила, что миофибробласты ран могут эффективно и стабильно превращаться в новые различные типы клеток, в частности новые адипоциты, необходимыми для здоровой кожи. В нашем исследовании установлено, что раны с волосяными фолликулами имеют факторы, которые могут перепрограммировать миофибробласты в адипоциты».
Раневым заживлением можно манипулировать, поэтому оно приводит к регенерации кожи, а не к образованию рубцов. Цель состоит в том, чтобы регенерировать волосяные фолликулы раньше. Как только это произойдет, жир будет регенерировать в ответ на сигналы, исходящие от этих фолликулов (рис. 2). Исследование также показало, что волосы и адипоциты могут развиваться отдельно, но зависимо. Сначала формируются волосяные фолликулы. Регенерирующим волосяным фолликулом образуются дополнительные факторы, которые служат для преобразования окружающих миофибробластов в жировые клетки, чтобы избежать образование шрама. Жировая ткань не образуется при отсутствии новых волос, но когда происходит восстановление волосяных фолликулов, новые клетки нельзя отличить от ранее существовавших жировых клеток. Исследователи определили, что костный морфогенетический белок инструктирует миофибробласты стать жировыми клетками [6, 9].
Рис. 2. Влияние волосяных фолликулов на преобразование адипоцитов.
Ученые разработали устройство, которое способно переключать функцию клетки только лишь одним касанием. Эта технология больше известна как тканевая нанотрансфекция, позволяющая в клетки кожи вводить генетический код, который изменяет их на другие типы клеток, необходимые для излечения. Перепрограммирование занимает несколько секунд: нужно коснуться чипом определенного места, а затем удалить его. В серии лабораторных тестов исследователи применили чип к конечностям мышей, которые практически не кровоснабжались из-за поврежденных сосудов. Исследователи перепрограммировали клетки кожи, чтобы они стали сосудистыми клетками. Через неделю начали появляться первые трансформации. Ко второй неделе образованы активные кровеносные сосуды, а к третьей неделе конечности мышей были спасены, при этом другой формы лечения не проводили [10].
Разница технологий заключается в том, как доставляется ДНК в клетки. Чип, нагруженный определенным генетическим кодом или определенными белками, помещается на кожу, а при помощи небольшого электрического тока создаются каналы в ткани. ДНК или РНК вводятся в полученные каналы и начинают перепрограммировать клетки. Этот метод эффективно работает до 98% не только на коже, но и на любом типе ткани. Ученые смогли вырастить клетки мозга на поверхности кожи мыши, собрать их, а потом перенести их в поврежденный мозг мыши. Всего через несколько недель после инсульта мозговая функция была восстановлена.
Заключение. Таким образом, регенерация эпителия без последующего образования соединительнотканного рубца вызвана функционированием миофибробластов. Регенерация ткани обусловлена ее перепрограммированием, которое вызывает сначала появление волосяных фолликулов, а они, в свою очередь, отвечают за регенерацию жировой ткани. Благодаря появлению волос на поврежденной ткани обеспечивается ее регенерация.
Библиографическая ссылка
Сухова Д.С., Большакова О.В. РЕГЕНЕРАТИВНЫЕ ВОЗМОЖНОСТИ КОЖИ // Международный студенческий научный вестник. – 2018. – № 5.
;
URL: https://eduherald.ru/ru/article/view?id=18950 (дата обращения: 31.01.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)

Стадийность регенерации кости и основы фармакологической коррекции репаративного остеогенеза нижней челюсти
Журнал:
Стоматология. 2012;91(1): 9‑12
Как цитировать:
Швырков М.Б.
Стадийность регенерации кости и основы фармакологической коррекции репаративного остеогенеза нижней челюсти. Стоматология.
2012;91(1):9‑12.
Shvyrkov MB. Stages of bone regeneration and foundation of pharmacоlogical correction of the mandible reparative osteogenesis. Stomatologiya. 2012;91(1):9‑12. (In Russ.).

?>
Снижение частоты осложнений у больных с переломами нижней челюсти и сокращение сроков их нетрудоспособности — серьезная медико-социальная задача, решение которой теснейшим образом связано с репаративной регенерацией кости. Этот процесс зависит от генетического и эпигенетического факторов.
Известно, что скорость регенерации тканей генетически очень жестко лимитирована в небольших пределах, измеряемых часами и даже минутами. Так, для синтеза молекулы коллагена требуется от 4 до 11 ч. Если сборка молекулы длится <4 ч, она будет неполноценной. Такая молекула либо не выйдет из клетки и будет в ней демонтирована, либо будет сейчас же разрушена, как только появится во внеклеточном пространстве, тканевыми протеазами. На современном уровне развития науки невозможно выйти за пределы, разрешенные генотипом. Следовательно, не стоит и ставить заведомо невыполнимую задачу влияния на него с целью ускорения регенерации.
Другое дело, если мы будем воздействовать на эпигенетический компонент, стремясь создать идеальные условия для метаболических процессов в клетке. Это позволит клетке синтезировать необходимые вещества в максимально короткие сроки, заложенные в генотипе. Эпигенетический фактор слагается из многих составляющих: гормональный фон, обеспеченность клеток строительным материалом, витаминами, кислородом, интенсивность резорбции кости, прочность иммобилизации отломков и пр. Эпигенетический компонент весьма вариабелен и вполне доступен для воздействия. Следовательно, можно считать оправданной и реальной задачу создания такого эпигенетического компонента, который способствовал бы максимальной реализации генетических потенций.
В сущности, это — задача, которую мы пытаемся решить на протяжении многих поколений. Сложность ее решения связана с тем, что отсутствуют знания по целому ряду ключевых моментов: 1) до сих пор неизвестны все составляющие эпигенетического фактора; 2) сама генетическая программа не идентична у разных индивидов; 3) разные ткани обладают разной генетической программой; 4) неизвестен оптимум эпигенетического компонента на протяжении всего периода консолидации отломков.
Формирование костной мозоли представляет собой совокупность процессов роста и развития, которые, как известно, исключают друг друга [4]. В костной мозоли одновременно протекают оба процесса, но в разных клеточных популяциях, причем в каждый определенный момент преобладает тот или иной процесс и каждому из них соответствует свой эпигенетический компонент, составляющие которого призваны оптимизировать каждую стадию процесса регенерации.
Идеально оптимизировать все стадии регенерации невозможно. Можно лишь пытаться создать оптимум для той стадии регенерации, в которой находится максимум структур в данное конкретное время. На наш взгляд, от существующей практики назначения 1—2 стимуляторов остеогенеза (гормон, витамин, метилурацил — МУ и пр.) на весь период сращения сломанной кости следует отказаться как от нецелесообразной, а то и просто вредной.
Положительные результаты, полученные отдельными исследователями от применения того или иного препарата, объясняются тем, что в какой-то момент применение этого препарата совпадает с соответствующей фазой регенерации. Самые лучшие результаты ограничиваются сомнительным сокращением срока нетрудоспособности — максимум, на 1 нед.
Таким образом, от нестадийного лечения следует отказаться как от неоправдавшего себя. Необходима целенаправленная разработка стадийных схем лечения, успех которой зависит от знания протяженности и очередности стадий репаративной регенерации кости.
Данные литературы и наш опыт позволяют выделить 5 стадий репаративной регенерации кости [1, 3, 7]: I стадия — 1—2 дня после перелома — деструктивно-резорбтивная; II стадия — 3—8 дней — сочетание дегенеративно-воспалительной и пролиферативной стадий; III стадия — 9—14 дней — синтетическая стадия; IV стадия — 15—21 день — стадия ремоделирования; V стадия — 22—28 дней — стадия созревания костной мозоли.
Исследованиями последних лет показана прямая зависимость интенсивности регенерации от I, пусковой стадии — деструктивно-резорбтивной [2, 6]. Постоянная, точно дозированная микродеструкция кости, лежащая, в частности, в основе компрессионно-дистракционного остеогенеза, позволяет пролонгировать эту стадию сколь угодно долго, поддерживать длительное время процесс репаративной регенерации на очень высоком уровне и бескровно замещать большие дефекты костной ткани [10].
При переломе кости возникает воспалительная реакция, первыми участниками которой являются нейтрофильные лейкоциты. Уже в конце 2-х суток при распаде этих клеток выделяются холин и другие медиаторы, которые приводят к трансформации моноцитов в макрофаги. Эти клетки не только занимаются очищением раны от некротических тканей, распадающихся нейтрофилов, продуктов бактериального распада, но и синтезируют большое количество цитокинов (трансформирующий фактор роста-β, морфогенетический белок кости, инсулиноподобный фактор роста, фактор роста фибробластов, эндотелиальный фактор роста сосудов и др.). Общепризнанным считается, что источником, предшественником остеокластов, являются макрофаги, «сливающиеся» в 1 гигантскую многоядерную клетку [13]. И это кажется логичным, так как для очистки костной раны нужен свой специфический «чистильщик», которым как раз и является остеокласт. Несмотря на обилие цитокинов, до сих пор неясно, под влиянием какого медиатора макрофаги превращаются в остеокласт. Особенностью цитокинов является то, что они действуют на очень коротком расстоянии и на строго определенные клетки-мишени. Остеокласт представляет собой гигантскую клетку, возникшую от слияния несколько десятков макрофагов, что хорошо укладывается в философскую категорию перехода количества в качество. Остеокласт может резорбировать кость, что невозможно для макрофага. Фактически остеокласт является костным макрофагом — «чистильщиком» костной раны.
Существует тесная связь между скоростью резорбции и образования кости. В этом процессе участвуют остеобласты, скелетогенные стволовые и клетки-предшественники, которые могут дифференцироваться по остеогенному либо по хондрогенному пути [8]. Эта дифференцировка зависит от степени восстановления микроциркуляторной сети в месте повреждения и степени оксигенации тканей [9, 11]. Мезенхимальные клетки, т.е. эмбриональные, способны активно делиться и дифференцироваться в разные клетки. Дифференцировка всех этих клеток контролируется и направляется фактором роста фибробластов, инсулиноподобным фактором роста и др. [12].
Наше предположение, что длительное поддержание репаративной регенерации в зоне растяжения молодой костной мозоли (дистракция) на высоком уровне обусловлено не только активностью остеобластов, но и качеством санации костной раны остеокластами, нуждается в проверке. С этой целью были проведены опыты на крысах, в которых исследовали влияние стимуляции и торможения I деструктивно-резорбтивной фазы на репаративную регенерацию нижней челюсти.
Материал и методы
В 1-й эксперимент включили 90 белых беспородных крыс массой 180—200 г, которым под эфирным наркозом рассекали мягкие ткани в правой подчелюстной области, скелетировали нижнюю челюсть, и между первым и вторым молярами маникюрными кусачками производили перелом тела нижней челюсти. Стремясь создать открытый перелом, перфорировали слизистую оболочку, обеспечивая сообщение полости рта с местом перелома челюсти. Наружную рану зашивали. Иммобилизации не производили, но крысы получали мягкую измельченную полноценную пищу. Важную роль в осуществлении физиологического контроля резорбции костной ткани играет гормон паращитовидной железы, чем и определялся дизайн опытов.
Крыс разделили на 3 группы. Животным 1-й группы (контроль) инъецировали физиологический раствор, во 2-й группе — деструктивно-резорбтивную фазу стимулировали путем внутримышечного введения паратиреоидного гормона (ПТГ) в дозе 0,1 ЕД на 100 г массы тела животного в первые 3 дня после перелома; в 3-й группе деструктивно-резорбтивную фазу в те же сроки тормозили интраоральным введением МУ в дозе 2 мг на 100 г массы тела [5].
Во 2-й эксперимент включили 180 таких же животных с аналогичными переломами нижней челюсти. Животных распределили на 9 групп по 20 в группе в зависимости от используемых препаратов. Им в первые 5 сут после перелома нижней челюсти вводили ретаболил, индометацин, дексаметазон, тестостерон, витамин Е, витамин D3, витамин А, ПТГ и кальцитонин (КТ). ПТГ (0,1 ЕД/100 г) и КТ (0,1 ЕД/100 г) вводили внутримышечно ежедневно. Дексаметазон (0,004 мг/100 г) и тестостерон (0,01 мг/100 г) ежедневно инъецировали под кожу. Ретаболил (0,5 мг/100 г) вводили под кожу на 1-й и 5-й дни после перелома. Витамин Е (0,125 мг/100 г), витамин D3 (100 нг/100 г), витамин А (6 ЕД/100 г) и индометацин (0,03 мг/100 г) вводили в полость рта из шприца ежедневно. Чтобы меньше травмировать животных, часть препаратов давали в 1-ю, а часть — во 2-ю половину дня. Результаты оценивали через 1 мес по количеству осложнений и прочности сращения отломков нижней челюсти. Прочность сращения отломков оценивали с помощью машины Instron 1122. Для анализа брали нижние челюсти только с нормальной консолидацией отломков.
Результаты и обсуждение
Как мы и предполагали, использование ПТГ уменьшило количество осложнений на 36%, а применение МУ почти на столько же увеличило (табл. 1).

Необходимо отметить, что длительное применение МУ (в течение 2 нед) привело к тому, что осложнений стало недостоверно меньше, чем в контрольной группе, животные которой получали плацебо. Это объясняется тем, что МУ, отрицательно повлияв на I, резорбтивную, стадию, оказал в более поздние сроки положительное влияние на одну из последующих синтетических стадий.
Статистическая обработка результатов показала, что прочность сращения отломков у животных, получавших ПТГ, была достоверно значительно выше, чем у животных, получавших МУ (см. рисунок).

Таким образом, стимулирование I, резорбтивной стадии репаративной регенерации, не только уменьшило число осложнений, но и создало оптимальные условия для остеогенеза, что обеспечило более прочное сращение отломков.
Основываясь на информации о ведущей роли остеоиндукции в репаративном остеогенезе и на результатах нашей работы по стимуляции резорбтивной фазы остеогенеза, обусловленной выделением из травмированной кости белков остеоиндукторов, мы изучали влияние на остеоиндуктивный механизм ряда препаратов, являющихся остеотропными и применяющихся в клинической практике.
После обработки материалов 2-го эксперимента было установлено, что ретаболил, дексаметазон, тестостерон и витамин Е ухудшают остеоиндуктивный потенциал кости, способствуют возникновению травматического остеомиелита, замедляют сращение отломков и, следовательно, их применение в первые дни после травмы нежелательно. Целесообразность применения в ранние сроки после перелома витамина А и КТ сомнительна, так как их действие, по-видимому, опосредовано через синтез остеоиндуктивного фактора, а это требует времени. Поэтому они показаны со второй трети регенераторного периода, т.е. в синтетической стадии. Но их применение, как и индометацина, по крайней мере, безвредно. Хорошие результаты дали ПТГ и активный витамин D3 — кальцитриол (табл. 2).

Исследование показало, что необходима разработка критериев, позволяющих выявлять тип регенерации у конкретного индивида, т.е. устанавливать генетический потенциал его регенераторной способности. Следует объединить силы клиницистов и экспериментаторов с целью определения границ стадий репаративного остеогенеза и разработки методов создания оптимальных условий на каждой из них. Решение этих задач не под силу 1—2 группам; необходима общая координация усилий для разработки принципиально новой тактики и стратегии лечения больных с переломами костей.
Репаративная,
или восстановительная регенерация —
это восстановление клеток и тканей
взамен погибших из-за различных
патологических процессов.
Она чрезвычайно разнообразна по факторам,
вызывающим повреждения, по объемам
повреждения, а также по способам восста-

Рис.
126. Регенерация
комплекса органов у гидры (А);
кольчатого
червя (Б); морской звезды (В)
новления.
Повреждающими факторами, например,
могут быть механическая травма,
оперативное вмешательство, действие
ядовитых веществ, ожоги, обморожения,
лучевые воздействия, голодание и другие
болезнетворные агенты. Наиболее широко
изучена репаративная регенерация после
механической травмы. Способность
некоторых животных (гидра, планария,
некоторые кольчатые черви, морские
звезды, асцидия и др.) восстанавливать
утраченные органы и части организма
издавна изумляла ученых. Ещё Ч.Дарвин
удивлялся способности улитки воспроизводить
голову и способности саламандры
восстанавливать отрезанные глаза, хвост
и конечности.
Известны примеры
восстановления больших участков
организма
(рис. 126), состоящих из
комплекса органов (регенерация ротового
конца у гидры, головного конца у кольчатого
червя, восстановление морской звезды
из одного луча).
Репаративная
регенерация может быть полной и неполной.
Полная
регенерация, или
реституция, характеризуется возмещением
дефекта тканью, которая идентична
погибшей.
Она развивается преимущественно в
тканях, где преобладает клеточная
регенерация. При
неполной
регенерации,
или
субституции, дефект замещается
соединительной тканью, рубцом. Субституция
характерна для органов и тканей, в
которых преобладает внутриклеточная
форма регенерации, либо она сочетается
с клеточной регенерацией. Функция органа
возмещается в таких случаях путем
гипертрофии или гиперплазии окружающих
дефект клеток.

Рис.
127. Схема
гиперрегенерации


Рис.
128. Схема
гипорегенерации
9.5.3. Патологическая регенерация
Патологическая
регенерация — это извращение регенерационного
процесса, нарушение смены фаз пролиферации
и дифференцировки.
Патологическая
регенерация (рис.
127, 128) проявляется
в избыточном или недостаточном образовании
регенерирующей ткани
(гипер- или гипорегенерация). Примерами
ее могут служить образование келоидных
рубцов, избыточная регенерация
периферических нервов (травматические
невромы), избыточное образование костной
мозоли при срастании перелома, вялое
заживление ран (хронические трофические
язвы голени в результате венозного
застоя) и др.
9.5.4. Способы репаративной регенерации
Механизмы
репаративной и физиологической
регенерации едины: репаративная
регенерация – это, по сути, усиленная
физиологическая регенерация. Однако
из-за влияния патологических процессов
репаративная регенерация имеет некоторые
качественные морфологические отличия
от физиологической.
Существует
несколько способов (разновидностей)
репаративной регенерации. К ним относят
эпиморфоз, морфаллаксис, регенерационную
и компенсаторную гипертрофию. Гипертрофию
и гиперплазию клеток органов и тканей,
а также возникновение и рост опухолей
относят к гипербиотическим
процессам
— процессам избыточного роста и размножения
клеток, тканей и органов.
Гипертрофия —
увеличение размеров органа или ткани
за счет увеличения размера каждой
клетки.
Выделяют рабочую (компенсаторную),
викарную (заместительную) и гормональную
(коррелятивную) гипертрофии.
Самым частым видом
гипертрофии является рабочая
гипертрофия,
которая встречается как в нормальных
физиологических условиях, так и при
некоторых патологических состояниях.
Причиной ее является усиленная нагрузка,
предъявляемая к органу или ткани.
Примером рабочей гипертрофии в
физиологических условиях может служить
гипертрофия скелетной мускулатуры и
сердца у спортсменов, а также лиц, занятых
тяжелым физическим трудом. Рабочая
гипертрофия наблюдается в тканях,
состоящих из стабильных, неделящихся
клеток, в которых адаптация к повышенной
нагрузке не может быть реализована
путем увеличения количества клеток.
Викарная, или
заместительная гипертрофия
развивается в парных органах (почки)
или при удалении части органа, например,
в печени, в легких. Примером физиологической
гормональной
(коррелятивной) гипертрофии
может служить гипертрофия матки при
беременности.
Развивающаяся в
органе гипертрофия,
несомненно, имеет положительное значение,
поскольку позволяет сохранить функцию
органа в резко изменившихся условиях
(заболевание, утрата части органа и
т.п.). Этот период называется стадией
компенсации. В дальнейшем, когда в органе
возникают дистрофические изменения,
происходит ослабление функции, и в
конечном счете, когда адаптационные
механизмы исчерпаны, наступает
декомпенсация органа.
Исходя из частей
органа (клеток), вовлечённых в процесс
гипертрофии, её подразделяют на истинную
и ложную. Истинная
гипертрофия
— увеличение объема ткани или органа и
повышение их функциональной способности
вследствие разрастания основных
(ответственных за функцию) клеток, а
также других элементов. Примером являются
гипертрофия гладких мышц матки у
беременных животных, а также гипертрофия
сердца при физической работе. Ложная
гипертрофия
— увеличение объема органа при разрастании
соединительной или жировой ткани.
Количество основных клеток при этом
остается без изменений или даже
уменьшается, а функциональная способность
органа снижается (например, гипертрофия
молочной железы за счет жировой ткани).
У животных
различают два основных способа
регенерации: эпиморфоз и морфаллаксис.
Эпиморфоз
заключается в отрастании нового органа
от ампутационной поверхности.
При
эпиморфической регенерации утраченная
часть тела восстанавливается за счет
активности недифференцированных клеток,
похожих на эмбриональные. Они накапливаются
под пораненным эпидермисом у поверхности
разреза, где образуют зачаток, или
бластему
(рис. 129).
Клетки бластемы постепенно размножаются
и превращаются в ткани нового органа
или части тела. Регенерация путем
образования бластемы широко распространена
у беспозвоночных, а также играет важную
роль в регенерации органов амфибий.
Существует две
теории происхождения бластемных клеток:
1) клетки бластемы происходят из
«резервных клеток», т.е.
клеток, оставшихся неиспользованными
в процессе эмбрионального развития и
распределившихся по разным органам
тела; 2) ткани,
целостность которых была нарушена в
области разреза (травмы), «дедифференцируются»
(утрачивают специализацию) и превращаются
в отдельные бластемные клетки. Таким
образом, согласно теории «резервных
клеток», бластема образуется из клеток,
остававшихся эмбриональными, которые
мигрируют из разных участков тела и
скапливаются у поверхности разреза, а
согласно теории «дедифференцированной
ткани», бластемные клетки происходят
из клеток поврежденных тканей.
Морфаллаксис
— это регенерация путем перестройки
регенерирующего участка.
При морфаллаксисе другие ткани тела
или органа преобразуются в структуры
недостающей части.
У гидроидных полипов регенерация
происходит главным образом путем
морфаллаксиса, а у планарий в ней
одновременно имеют место как эпиморфоз,
так и морфаллаксис.

Рис.
129. Регенерация
конечностей путём эпиморфоза у личинки
амфибий.
А – схема операции;
Б – регенерирует только иннервированная
(правая) культя (1), левая культя
рассасывается; В – после ампутации; Г
– затягивание раны эпидермисом (2) и
распад тканей (3) под ним за счёт
дедифференцировки; Д – редифференцировка
в бластеме (4); Е – дальнейшее развитие
регенерата
Соседние файлы в папке Часть 2
- #
- #
- #
- #
- #
- #
- #
- #

В настоящее время травматизм входит в пятерку ведущих смертности в мире, угрожая экономическому и социальному развитию. Переломы длинных костей занимают ведущее место в структуре травматизма последних десятилетий и составляют, по данным различных авторов, составляют до 80% всех повреждений костей скелета.
Поэтому проблема лечения переломов костей последние годы сохраняет актуальность, хотя прогресс в области травматологии является несомненным. Остается нерешенным ряд вопросов, связанных с так называемой остеогенной недостаточностью.
Несмотря на применение современных медицинских технологий, процент осложнений, возникающих в результате лечения переломов длинных костей, остается высоким.
К ним относятся замедленная консолидация, формирование ложных суставов, несращение костных отломков и другие проблемы.
Так, нарушение консолидации костных отломков при переломах длинных костей составляет от 15 до 50%, а частота ложных суставов варьирует от 4 до 33%.
Согласно данным Американской ассоциации ортопедии, из двух миллионов переломов длинных костей в США ежегодно около 100 тысяч завершаются несращением.
По информации отечественных исследователей, нарушения консолидации костных отломков при переломах костей конечностей составляют около 25% в структуре инвалидности пострадавших от механической травмы.
Процент неудач в процессе лечении подобных нарушений классическими методами достигает 33%, что почти в два раза превышает число неудовлетворительных анатомо-функциональных результатов лечения переломов.
За последние годы отмечается и скрытый рост инвалидности вследствие травм и увеличения срока консолидации в каждом третьем случае.
Проблема лечения нарушений репаративной регенерации костной ткани, возникающих после диафизарных переломов костей, остается актуальной для современной ортопедии и травматологии. Случаи развития такой патологии составляют от 2,5 до 18%.
В структуре последствий травм длинных костей псевдоартрозы бедренной кости составляют 10-30%, костей голени — 15-50%, плечевой кости — 1-10%.
Обращает на себя внимание, что среди контингента с нарушениями репаративной регенерации костей преобладают лица трудоспособного возраста.
Данная патология отмечается стойкой утратой трудоспособности у 5 человек на 10000 населения, а образованные при этом анатомо-функциональные нарушения конечности являются причиной стойкой инвалидности в 12-45% больных.
Длительное лечение больных с большими материальными затратами, низкая эффективность, высокий уровень инвалидности позволяют считать осложнения при переломах длинных костей важнейшей социальной проблемой, с которой многим пострадавшим сложно справиться без социальной помощи.
Из этого следует, что лечение переломов длинных костей, осложненных репаративными нарушениями, является актуальной экономической и медико-социальной проблемой.
Основная задача современной травматологии заключается в совершенствовании существующих и разработке новых, экономичных и эффективных методов лечения.
Что такое регенерация костной ткани?
Кость представляет собой сложный орган, который выполняет механические и биологические функции в организме и имеет сложную иерархическую структуру.
Кости участвуют в обменных процессах благодаря содержанию значительного процента минеральных веществ организма, а также создают специфическое микроокружение для предшественников крови красного костного мозга.
Костная ткань являет собой динамическую систему, в которой в течение жизни организма происходят два взаимосвязанных противоположных процесса, составляющих природный цикл ремоделирования – резорбция (разрушение) и остеогенез (синтез).
Поэтому условия репаративного остеогенеза постоянно находятся в поле зрения практикующих врачей – травматологов и ортопедов.
Давно известно, что переломы в области компактной (кортикальной) и губчатой (трабекулярной) костной ткани отличаются сроками консолидации, что связано с особенностями ее структурной организации.
Перспектива заживления переломов губчатой кости более благоприятные, поскольку в структуре ее находятся элементы, необходимые для формирования регенерата. В свою очередь, компактная костная ткань характеризуется низкой плотностью сосудов по сравнению с губчатой, а также имеет особенности кровоснабжения.
Репаративная регенерация определяется как процесс восстановления ткани после травмы. Механизмы репаративной и физиологической регенерации одинаковые и основываются на единых биологических закономерностях.
Репаративная регенерация рассматривается как в той или иной степени усиленная физиологическая. Репаративная регенерации костной ткани – она же репаративный остеогенез – важная теоретическая и практическая проблема травматологии.
Действительно, в идеале консолидация перелома должна привести к образованию обновленной костной ткани, идентичной старой, существовавшей до травмы. Однако сращение перелома на практике является достаточно сложным, длительным многостадийным процессом, на который влияет множество факторов.
Кость имеет очень высокий репаративный потенциал.
Проблема состоит в том, что процессы репаративного остеогенеза возможно ускорить за счет активации обмена лишь в очень незначительной степени (порядка недель). С другой стороны, замедлить процесс нарушением физиологических условий очень легко, что нередко происходит из-за недостаточного понимания физиологии кости.
Согласно определению Руцкого и Ткаченко, репаративная регенерация – это сложный процесс, вызванный разрушением костных структур, который количественно превышает допустимые пределы физиологической регенерации и направлен на полное восстановление анатомической целостности и функции кости.
По мнению исследователя А. Корж, процессы регенерации кости являются сложным переплетением общих воздействий на системном уровне и локальных изменений тканевых обменных процессов, включая изменения на молекулярном уровне.
Д. Саркисов и соавторы представляют репаративный остеогенез как физиологическую регенерацию, которая протекает в условиях экстремальных воздействий на организм и отличается большей интенсивностью проявлений.
Другие же исследователи утверждают, что, в отличие от физиологической регенерации, которая фактически является адаптацией, репаративный остеогенез – компенсаторный процесс, восстанавливающий строение после гибели части или всего органа.
Репаративная регенерация каждого типа тканей имеет уникальные особенности, но всегда включает следующие процессы:
-
Разрушение поврежденных клеток и структур
-
Пролиферация жизнеспособных клеток в области дефекта
-
Дифференцировка жизнеспособных клеток регенерата
-
Формирование межклеточных связей и перестройка регенерата.
Репаративная регенерация костной ткани бывает неполной или полной.
Полная регенерация характеризуется замещением дефекта тканью, которая соответствует старой ткани. О неполной принято говорить в случаях, когда костный дефект замещается соединительной тканью или рубцом.
Репаративный остеогенез – это многокомпонентный процесс, основными этапами которого являются дифференцировка клеток, пролиферация, резорбция погибшей ткани и образование кости с ее ремоделированием, формирование органического внеклеточного матрикса и его минерализация.
Описанные процессы протекают параллельно, но один из них может стать доминирующим на тех или иных стадиях репаративного остеогенеза.
Практика подтверждает, что костная ткань действительно является уникальной, поскольку способна восстанавливать полностью даже большие по длине дефекты.
Причины нарушений репаративной регенерации кости
Известно, что репаративная регенерация костной ткани является сложным, генетически запрограммированным процессом. Стадийно-временные характеристики этого процесса зависят от действия ряда эндогенных и экзогенных факторов.
Течение остеорепаративного процесса связывают с такими факторами:
-
Особенности и интенсивность травмы
-
Характер повреждения кости и мягких тканей
-
Степень посттравматических расстройств периферического кровоснабжения
-
Качество оказания первичной и квалифицированной медицинской помощи
-
Особенности восстановительного лечения
-
Наличием сопутствующей патологии.
Одно из первых мест среди причин, способствующих развитию нарушения репаративного остеогенеза, занимает несвоевременность и неадекватность оказания квалифицированной медицинской помощи.
Экспериментально доказано, что в случаях отсроченной иммобилизации отломков при переломе костей предплечья уже на 3 сутки проявляются признаки нарушения процесса костной репарации с увеличением срока консолидации в 1,5 раза.
Отсроченное сопоставление отломков костей голени за 14 суток приводит к образованию ложного сустава, а при отсутствии стабильной фиксации отломков сроки формирования периостального костного сращения увеличиваются не менее чем в 4 раза.
Дальнейшие экспериментальные исследования показали, что нарушение условий репаративной регенерации в виде отсроченного до 14 суток сопоставления костных отломков приводят к формированию ложного сустава на 50-е сутки.
При медленном заживлении перелома восстановление кости в обычные сроки не происходит, тормозится ремоделирования и созревания костной мозоли.
Как правило, заживление в подобных ситуациях наступает через год и более.
Перелом расценивают как несросшийся, если по истечении 6 месяцев отсутствуют рентгенологические признаки заживления, или когда отсутствует положительная динамика в течение трех месяцев наблюдения.
При несращении перелома наблюдается торможение репаративных процессов и остановка его заживления. Понятие «замедленная консолидация» принято считать относительным, поскольку сроки сращения переломов у каждого больного индивидуальны и зависят от многих факторов.
Условно эти факторы можно разделить на общие и местные.
Общие факторы связаны с общим состоянием организма, сопутствующей соматической патологией, медикаментозной терапией, наличием вредных привычек и тому подобное.
К факторам второй группы относят отсутствие надежной иммобилизации сегмента, недостаточную репозицию, фиксацию и нарушение кровоснабжения костных отломков, травматичность оперативного вмешательства, нарушения тактики лечения, использование массивных металлических имплантатов.
Важным звеном репаративной регенерации является состояние костной ткани на момент травмы, а также эндемическое состояние региона, где проживает травмированное лицо.
В последнее время увеличивается количество исследований относительно влияния неблагоприятных экологических факторов на репаративный остеогенез костной ткани. Отечественными и зарубежными авторами изучалось влияние экологического окружения человека на структуру и метаболизм костной ткани, от которых зависит ход репаративной регенерации.
Клинические исследования демонстрируют, что повышенное потребление фтора сопровождается ломкостью костей, при этом замедляется процесс репаративного остеогенеза и чаще формируются ложные суставы.
После проведения нескольких экспериментов in vitro ученые пришли к выводу о разрушительном действии радиации на костную ткань, которая также замедляет процессы регенерации и увеличивает количество осложнений.
Поэтому при лечении переломов костей необходимо учитывать воздействие неблагоприятных факторов окружающей среды на регенерацию костной ткани.
В настоящее время темой научных дискуссий является вопрос зависимости частоты нарушений остеорепаративных процессов от механизма травмы. Согласно клиническим исследованиям, этиологический фактор травмы влияет на процессы заживления раны.
На течение репаративного процесса влияет как разновидность травмирующего агента, так и характер повреждения костной ткани. По данным ряда авторов, у 55% пациентов с нарушением репаративного остеогенеза травма получена в результате действия высокоэнергетического травмирующего агента.
Проведенные экспериментальные исследования выявили, что при воздействии травмирующей силы высокой интенсивности происходит гибель значительного числа клеточных источников остеорепарации, а сохранившиеся клетки претерпевают настолько значительные морфологических изменения, что не в состоянии поддерживать нормальное функционирование ткани.
Е. Побел и соавторы приводят целый ряд причин, которые приводят к нарушению процессов посттравматической остеорегенерации:
-
Возраст пациента
-
Характер травматического повреждения
-
Патологическое состояние костной ткани (остеопороз)
-
Отягощенный анамнез (хронические болезни печени и почек, ожирение)
-
Снижение остеорепаративного потенциала (дефицит факторов роста, остеокальцитонина, активной формы гормона витамина D3)
-
Травматичность процедуры металлоостеосинтеза.
Эти изменения приводят к нарушению процессов консолидации костных отломков и требуют проведения мероприятий по оптимизации репаративного остеогенеза.
Кость является высокоспециализированной тканью, которая существует в тесном взаимодействии связи с кровеносной системой. Взаимосвязь путей гемоциркуляции в костной ткани проявляется как в местных нутритивных процессах, поддержке общего минерального равновесия внутренней среды организма, так и непосредственно в физиологической и репаративной регенерации костной ткани.
Поэтому весомым фактором, обусловливающим расстройства репаративного остеогенеза, является нарушение кровообращения в участке повреждения.
Недостаточная степень кровоснабжения зоны перелома вследствие массивного повреждения мягких тканей, кости, отслоение и травматизация надкостницы, нарушение медуллярного кровообращения приводят к активизации хондрогенеза и неполноценности процесса срастания костных отломков.
Проведенные исследования выявили особенности структурно-функционального состояния сосудов при нарушениях репаративного остеогенеза. Эти расстройства могут быть обусловлены структурно-функциональнимы изменениями сосудов поврежденной конечности, которые определяют особенности его течения.
Большой интерес вызывает концептуальная модель механизма компенсации нарушений регионарного кровоснабжения при переломах костей, которую разработали исследователь Г.В. Гайко и его коллеги.
Проводя экспериментальные и клинические исследования периферического кровоснабжения при переломах, авторы пришли к выводу, что в основе восстановления регионарного кровоснабжения после перелома костей лежит перераспределение циркуляции крови и реваскуляризация тканей.
Компенсация регионарного и местного кровоснабжения, как правило, наступает в течение нескольких часов после травмы при переломах без смещения костных отломков, без обширного повреждения мягких тканей и магистральных сосудов.
Неполная компенсация сопровождается гипоксией, способствует развитию фиброзной соединительной ткани и стимулирует фиброзное сращение костных отломков.
На участке декомпенсации возникает некроз костной и мягких тканей, который и является причиной продления сроков лечения, формирования ложных суставов и возникновения гнойных осложнений.
Стадии репаративной регенерации костной ткани
Разработаны стадии репаративного остеогенеза в их взаимосвязи, при которых каждая стадия характеризуется определенным морфологическим клеточно-тканевой составом.
Изучение морфологических изменений при лечении перелома кости с использованием различных методических подходов позволило выделить в регенерации два этапа:
-
Построение соединительнотканной мозоли и замещение ее незрелой.
-
Перестройка в сформированную зрелой костью предшественницу костной мозоли.
Согласно результатом проведенных патоморфологических анализов заживления костных переломов выделяют следующие стадии восстановления дефекта кости:
-
I – дестабилизация клеточных элементов
-
II – интенсивная клеточная пролиферация
-
III – дифференциация различных тканей (хрящевой, фибробластической, остеобластической, недифференцированной ткани, похожей на мезенхиму, фибробластической соединительной ткани)
-
IV – эпигенез остеогенной ткани, при котором наблюдаются процессы прямой метаплазии, атипичной энхондральной оссификации и остеоидной модификации
-
V — спонгизация остеоидной ткани и образование остеонов
-
VI – образование пластинчатой кости.
В другом варианте выделяются 4 стадии: пролиферацию остеобластных клеток, образование коллагеновых волокон, образование аморфного углеводно-белкового вещества и импрегнация межклеточного вещества минеральными солями.
Используя новые данные молекулярной биологии, биохимии, морфологии, иммуноморфологии и генетики Н. Корж и соавторы выделили 5 стадий репаративного процесса: воспаление, дифференцировку клеток и формирование тканеспецифических структур в области травмы, реорганизация тканевых структур и их минерализация, ремоделирование и завершения восстановительного процесса.
Такого же мнения придерживаются многие известные зарубежные авторы.
Вообще, восстановление кости – сложный биологический процесс, требующий изменений в экспрессии нескольких тысяч генов.
Чаще консолидация переломов происходит путем косвенного восстановления кости, состоит из нескольких последовательных этапов – воспаление, образование мягкой мозоли, образование твердой мозоли и ремоделирование.
Фаза воспаления начинается непосредственно после травмы и длится до 5 дней.
Эта стадия включает образование воспалительной гематомы вследствие разрыва кровеносных капилляров в зоне перелома, миграцию в зону воспаления мезенхимальных клеток, нейтрофилов и макрофагов для удаления фрагментов поврежденной ткани, которые дифференцируются в фибробласты, остеобласты иил хондробласты с последующим образованием хрящевого матрикса.
В течение второй стадии, которая продолжается до 40 дней, происходит замещение гематомы фиброзно-хрящевой тканью путем дифференцирования мезенхимальных клеток в хондроциты, а также синтеза матрикса из коллагена второго типа.
Далее матрикс постепенно кальцинируется и замещается костной тканью, синтезированной остеобластами.
В течение третьей стадии процесса происходит оссификация, образуются костные мостики между фрагментами переломанной кости.
Процесс репаративной регенерации заканчивается стадией ремоделирования, когда восстанавливаются ее исходная форма, структура и механическая прочность.
Нарушение течения любой из этих стадий могут привести к замедлению процесса остеорепарации в целом или даже несращению фрагментов кости.
Гистологически различают два варианта сращения костных отломков – первичное (прямое) и вторичное. Первичное заживление происходит благодаря активной пролиферации остеогенных клеток в фоне гиперваскуляризация тканей на участке перелома. Вторичное заживление протекает в несколько стадий.
На сегодняшний день было разработано несколько классификаций, подробно описывающих стадии заживления перелома.
Известны данные и о стадийности заживления переломов, которые основаны на конкретных морфологических преобразованиях в зоне дефекта кости:
-
Тромбирование гематомы
-
Организация кровяного сгустка
-
Образование фиброзного предкистозного регенерата
-
Формирование полноценного регенерата костной ткани
-
Образование вторичного регенерата кости
-
Функциональная реконструкция регенерата.
Ряд авторов по совокупности структурно-морфологических и биохимических изменений, происходящих в костном регенерате, выделяют следующие фазы регенерации кости:
-
I – катаболическая, с дезинтеграцией и деградацией окружающих структур
-
II – прогрессирующая пролиферация клеток и дифференцировка клеточных элементов с секрецией органической основы костного регенерата
-
III – сложные биохимические, биофизические и физиологические процессы, приводящие к появлению первичной костной структуры
-
IV — образование пластинчатой костной структуры, обеспечивающей восстановление формы и функции кости.
При сопоставлении с приведенными выше исследованиями оригинально выглядит вариант классификации стадий заживления перелома кости (воспаление, фагоцитоз, фиброзная мозоль, первичная и вторичная костные мозоли), в котором авторы недостаточно обоснованно отделили фагоцитоз от воспаления.
На основании системных представлений и оценки результатов многочисленных клинических и экспериментальных наблюдений динамики сращения костных отломков А.Т. Бруско и соавторы предложили свою стадийность репаративного остеогенеза. Здесь он рассматривается как однонаправленный процесс, протекающий с закономерной последовательностью морфологических изменений регенерата.
Авторы выделили следующие стадии заживления переломов костей:
-
I – репаративная реакция
-
II – формирование сращения костных отломков
-
III – сращение отломков, при котором возможны варианты: а) первичное костное сращение, b) фиброзно-хрящевое сращение, c) вторичное костное сращение
-
IV – функциональная перестройка костной мозоли и консолидированных отломков с формированием органной структуры кости.
Как мы видим, проблема
регенерации костной ткани занимает особое место в биологических и медицинских
знаниях. На данный момент определены ключевые особенности регенерации костной
ткани и достигнуты определенные успехи в выяснении биологических механизмов,
лежащих в основе репаративного остеогенеза, сформулированы основные тенденции
развития науки.
Статья на конкурс «Био/Мол/Текст»: Почти у всех нас есть конечности. Мы настолько к ним привыкли, что воспринимаем как нечто само собой разумеющееся. Часто ли мы задумываемся об их важности? Вспоминается грустная пословица «Что имеем не храним, потерявши плачем». Авторы статьи искренне желают читателю никогда не познать ее в жизни. Во всяком случае, в таком контексте. Но все же — обязательно ли «плакать» в случае потери конечности, и нет ли способа вернуть ее в случае несчастья? А может, такой способ появится в будущем? Большие вещи начинаются с малого. Понимание регенерации целой руки и ноги кроется в осознании процессов, происходящих на самых кончиках пальцев. О них и пойдет речь дальше.

Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Важность конечностей неоспорима. Недаром даже есть поговорки: «С руками нигде не пропадешь», «Волка ноги кормят». Потеря или необратимые повреждения конечностей могут оставить человека инвалидом на всю жизнь. С помощью современных медицинских подходов можно, конечно, поставить человека «на ноги». Возможны реплантация ампутированной конечности (ее обратное приживление) или закрытие раны участками кожи для формирования культи с последующим применением протезирующих устройств. Несмотря на стремительно развивающееся протезирование и появление киберпротезов, которые (как пророчат книги, игры и фильмы) уже в недалеком будущем будут почти идентичны утраченной части тела и легко и дешево заменимы, уж очень привлекательна перспектива полного структурного и функционального восстановления ампутированной конечности собственными силами организма (или с помощью небольшой дополнительной стимуляции — рис. 1).

Рисунок 1. В настоящем 2077 протезы уже не будут нужны
рисунок Анастасии Кисловой
Известно, что многие рыбы и амфибии способны к регенерации утраченных конечностей. Но способен ли на это человеческий организм? Оказывается, и да, и нет. Все зависит от правильного взаимодействия различных факторов: от активности генов и иммунной системы до морфологического строения поврежденной конечности и концентрации кислорода в ране. Попытаемся подробнее изучить основные эволюционные изменения процессов регенерации, рассмотреть все тонкости регенерации конечностей, а также порассуждать, насколько хорошо проходит регенерация у млекопитающих.
Регенерация — от прошлого к настоящему
Еще в древних мифах описывалось необычное свойство некоторых существ восстанавливать любую отрубленную часть тела. Так, Лернейская гидра в битве с Гераклом могла отращивать новые головы на месте отрубленной. При этом для победы Геракл использовал вполне оригинальный и логичный способ: он прижег горящими головнями места, где вырастали новые головы, что воспрепятствовало бесконечной регенерации. Можно вспомнить и другой пример из древнегреческой мифологии — каждый день печень Прометея, который похитил для людей божественный огонь, склевывал орел, а каждую ночь она отрастала заново. Однако древние греки едва ли могли объяснить описываемые явления с биологической точки зрения. Так чем же обусловлены эти процессы у существующих организмов?
Наши передние и задние конечности состоят из различных типов клеток: остеоцитов (образуют скелет), миоцитов (мышцы), адипоцитов (жировая ткань), нейронов (нервная ткань), кератиноцитов (эпидермиса). Каждая клетка имеет свой генетический профиль и историю его реализации, называемую дифференцировкой. Клетки специализируются и сохраняют приобретенные особенности, так как хранят запись биохимических сигналов своих клеточных предков, полученных еще на эмбриональной стадии. По сути, регенерация конечности — это прохождение клеточной специализации заново. И пройти ее должны все названные выше типы клеток. Восстановить группу клеток одного типа — уже непростая задача, что уж говорить о регенерации более сложноорганизованных структур. В организме для этого формируется бластема — неоднородная популяция клеток, которая временно образуется на раневой поверхности после ампутации как результат миграции и компенсаторной пролиферации клеток, а затем подвергается морфогенезу и замещает поврежденную часть органа (рис. 2). Бластема становится источником стволовых клеток — недифференцированных (незрелых) клеток, из которых впоследствии формируются ткани. Именно они затем специализируются и восстанавливают первоначальный размер и форму утраченной конечности.

Рисунок 2. Регенерация пальца у мышей. В ход идут клеточные механизмы, единые для всех позвоночных: прежде всего активируются стволовые клетки, которые формируют бластему. Затем стволовые клетки на основе своей уникальной программы, заложенной в геноме, дифференцируются в соответствующий тип клеток (кожи, мышц, костей и др.) и восстанавливают исходный размер и форму кончика пальца.
Ослабление способности к регенерации с течением эволюции
Среди млекопитающих не найти столь впечатляющих примеров регенерации, как среди хвостатых амфибий. Но сравнение эпиморфной регенерации у классических моделей (земноводных и рыб) и млекопитающих приближает нас к пониманию того, что мешает нам (млекопитающим) регенерировать так же эффективно, и как это можно преодолеть. Сложно поверить, но механизмы регенерации, как и механизмы развития, схожи не только у всех позвоночных, но также и среди основных типов беспозвоночных.
Информацию о механизмах регенерации содержит геном, практически идентичный во всех клетках организма. Клетки разных тканей отличаются друг от друга потому, что экспрессируют разные наборы генов (а не потому, что содержат разные гены). Избирательная экспрессия генов обусловливает и разные стадии регенерации:
- пролиферацию, дающую множество клеток из одной;
- специализацию, создающую клетки с разной пространственной ориентацией и биологическими характеристиками;
- связь клеток между собой, определяющую поведение одной клетки по отношению к соседям;
- перемещение (миграцию), при которой клетки группируются, чтобы сформировать ткани и органы заданной структуры.
Во всех этих процессах клетка постепенно переходит из недифференцированного (столового) состояния в последующие, более специализированные. Возможен и альтернативный путь: клетка может уже пройти частично путь специализации, но перейти на другой под воздействием особых сигналов среды. Это как раз случай бластемы.
Но почему же примитивные беспозвоночные и низшие позвоночные (анамнии) способны к регенерации, а высшие (амниоты) утратили эту суперспособность?
С течением эволюции у всех животных — от низших до высших, вплоть до человека, — набор генов менялся не слишком сильно. Для согласованного построения многоклеточной структуры разные организмы используют всего несколько довольно консервативных путей передачи межклеточных сигналов. Однако по мере усложнения организмов дар регенерации постепенно угасал. В результате амниоты (рептилии, птицы, млекопитающие) почти утратили способность формировать бластему. Почему? Различия в общем плане строения организма возникают во многом из-за различий в генах регуляторных и сигнальных белков, которые отвечают за то, когда и где другие гены, кодирующие структурные белки, должны быть активированы или ингибированы.
Ученые из лаборатории молекулярных основ эмбриогенеза ИБХ РАН выдвинули гипотезу, что изменения в регуляторных участках и некоторых генах коррелируют с потерей регенерации. Чтобы ее проверить, они поочередно ингибировали и активировали гены, которые могли быть причастны к формированию раневого эпителия и бластемы. Выяснилось, что гены транскрипционных факторов Ag1 и сигнальных белков Ras-dva встречаются только в геномах низших позвоночных, рыб и амфибий, но отсутствуют у высших — рептилий, птиц и млекопитающих (рис. 4) [2]. При этом эти гены одновременно и стимулируют регенерацию конечностей, и подавляют развитие конечного мозга. Именно с их потерей у высших позвоночных в эмбриогенезе зародился конечный мозг.

Рисунок 4. Регенерация, которую мы потеряли. Видно, что с усложнением организации высших позвоночных происходила потеря генов семейства Ras-dva, а вместе с этим и способности к регенерации.
Оказывается, где-то на развилках эволюции самым драматическим образом произошел обмен регенерации конечностей на мощный мозг. Видимо, раз мы смогли написать для вас эту статью, то он оказался полезным. Однако почему же нельзя было оставить нам и регенерацию?
На данный момент регенерацию изучают больше всего на амфибиях (саламандры и тритоны) и рыбах данио рерио (зебрафиш) [3]. Например, хвостатые амфибии способны восстанавливать конечность, хвост, хрусталик глаза и часть нижней челюсти. Исследования проводят и на млекопитающих, хотя их потенциал далеко не так впечатляет. Ампутированные кончики пальцев у грызунов, повреждения ушной раковины у иглистых мышей и кроликов — вот, по сути, всё, что можно изучать из области эпиморфной регенерации у млекопитающих. Эти исследования позволяют связать регенеративную биологию и регенеративную медицину. В статье мы будем использовать информацию, полученную из исследований как на амниотах, так и анамниях, ибо, несмотря на потерю транскрипционных факторов Ag1 и сигнальных белков Ras-dva, консервативные пути передачи регенеративного сигнала в клетках в течение эволюции сохранились, и общий план строения конечностей у анамний и амниот схож.
Разбираем бластему: этап за этапом, клетка за клеткой, ген за геном
Сначала необходимо понять, какие внешние воздействия могут способствовать или мешать формированию бластемы. Для этого лучше изучить регенерацию «на практике». Вот мы ампутировали конечность. А дальше? Что мы можем сделать для стимуляции регенеративных процессов? Оказывается, не так много. Конечно, можно использовать разные шовные материалы и медицинские клеи для остановки кровотечения. Однако может получиться так, что регенерация остановится уже на первых этапах и не успеет достигнуть стадии бластемы. В исследовании, проведенном на мышах, ученые пробовали покрывать рану медицинским клеем (рис. 5) [4]. Это привело к следующему результату — раневая поверхность покрылась беспорядочной богатой коллагеном соединительной тканью, называемой фиброзной, которая составила основу культи и мало чем напоминала нормальную конечность.

Рисунок 5. Хронология регенерации ампутированного кончика пальца при обработке медицинским клеем (фирма Dermabond; A, B и D) и без обработки (Control; A’, B’ и D’) в течение 13 дней после ампутации (DPA — days post-amputation). Можно заметить, что закрытие раны эпидермисом у пальца, обработанного клеем, на третий день после ампутации (A) началось преждевременно (черная стрелка) по сравнению с контрольной группой (A’), где наблюдалось лишь образование сгустка крови в полости костного мозга (белая стрелка). Впоследствии структурные изменения становились все более заметными, в результате чего на 13-й день после ампутации у пальца, не обработанного клеем, бластема была больше по объему и числу клеток (черная стрелка на срезе D’ указывает на клетки разрушенной костной ткани, которые впоследствии будут вовлечены в процесс регенерации), чем у пальца, обработанного клеем (срез D).
Оказалось, что важнейшую роль на разных этапах восстановления конечности играет локальное изменение концентрации кислорода [5]. Примечательно, что в норме на начальных этапах регенерации концентрация кислорода должна быть повышена (а при использовании медицинского клея выходит наоборот), а впоследствии падать из-за образования раневого эпидермиса на поверхности раны и активировать сигнальные пути регенерации. Если же изначально закрыть рану, то образования стабильного микроокружения из клеток и сигнальных молекул для формирования бластемы не происходит.
Цикл регенерации можно разбить на шесть этапов (рис. 6). Рассмотрим каждый из них подробнее и опишем процессы, которые при этом происходят.

Рисунок 6. Цикл регенерации кончика пальца у млекопитающих: ампутация, гистолиз, закрытие раны, образование бластемы, дифференцировка, ремоделирование. Для каждого этапа характерны свои особенности и нюансы, о которых речь пойдет дальше.
рисунок авторов статьи
1. Ампутация
После столь ужасной травмы организму первым делом необходимо остановить кровопотерю и создать условия для образования бластемы. Сразу после травмы включается иммунная реакция, останавливается кровотечение, происходит вазоконстрикция (сужение сосудов) и коагуляция тромбоцитов. Они формируют сгусток фибрина, который составляет основу тромба [6], [7]. Вместе с этим в рану мигрируют воспалительные клетки — нейтрофилы и моноциты. Последние на месте повреждения превращаются в макрофаги, ну а нейтрофилы «пожирают» патогенные микроорганизмы, после чего «кончают с собой» путем апоптоза. Эти клетки входят в систему врожденного иммунитета, и в числе первых запускают защитную реакцию и воспаление. Этот этап длится первые несколько часов после травмы.
Как упоминалось ранее, у заживления после ампутации возможны два исхода: образование рубца из фиброзной ткани или эпиморфная регенерация. А что именно произойдет — решится в следующей фазе.
2. Гистолиз
Это разрушение тканей путем их «растворения» протеолитическими ферментами перед заживлением раны. Можно сказать, что организм действует по принципу «вред во благо». Это одна из ключевых стадий эпиморфной регенерации, так как именно в результате гистолиза формируется микроокружение, стимулирующее дедифференцировку клеток в стволовые, благодаря чему и формируется бластема. Происходит необходимое разрушение кости и уменьшение ее в объеме (до 60–75%) для того, чтобы ее компоненты (в том числе мезенхимальные и гемопоэтические, или кроветворные, стволовые клетки) могли принять участие в регенерации (рис. 7). Параллельно этому синтезируются протеазы (ферменты, расщепляющие белки) клетками иммунной системы, реорганизуются фрагменты внеклеточного матрикса и образуются факторы роста — специальные белки, контролирующие рост клеток и их вступление в клеточный цикл и усиливающие или ингибирующие регенеративные процессы.

Рисунок 7. Гистолизу подвергается преимущественно костная ткань, а разрушают ее предназначенные для этого клетки — остеокласты. Данный процесс может длиться вплоть до образования бластемы (12–14 дней после ампутации).
[34], рисунок адаптирован
Активная роль в разрушении тканей принадлежит ферментам матриксным металлопротеиназам (ММП). Они расщепляют белки внеклеточного матрикса, которые вовлечены в процесс заживления ран и контролируют процесс ремоделирования тканей.
- Внеклеточный матрикс
- многокомпонентная субстанция, которая объединяет разрозненные клетки в единый многоклеточный организм, и в которую погружены все клетки организма [8]. Внеклеточный матрикс, который формируется при воздействии иммунных клеток, содержит гиалуроновую кислоту и специфические белки (гликопротеины и протеогликаны), а затем дополняется другими белками (коллагены типа I и III, эластин, фибронектин, тенасцин-C и др.), что делает матрикс более организованным и структурированным [9]. Примечательно, элементы внеклеточного матрикса легко окрашиваются, поэтому по их градиенту концентрации легко визуализировать и отслеживать, с каким успехом проходят восстановительные процессы. Все перечисленные соединения синтезируются преимущественно фибробластами — клетками соединительной ткани, которые вносят основной вклад в образование бластемы и ремоделирование конечностей [10].
Раневые участки содержат множество типов ММП, которые поддерживают различные реакции, связанные с миграцией фибробластов, ангиогенезом (восстановлением сосудистой сети) и предотвращением синтеза базальной мембраны между тканями конечности и раневым эпидермисом, что и подавляет рубцевание. Ингибирование ММП приводит к замедлению заживления ран и нарушению миграции и дифференцировки стволовых клеток. Например, мыши с мутацией коллагена типа I, который устойчив к расщеплению ММП-1, демонстрируют нарушение ремоделирования и замедленное заживление тканей. Однако в ряде исследований многие ММП-дефицитные мутанты не демонстрируют таких аномалий, что может быть связано со сложной специфической ролью каждой ММП [9], [11]. При этом активность ММП не может продолжаться долго, она подавляется тканевыми ингибиторами металлопротеиназ, когда приходит время создавать новый каркас для клеток из внеклеточного матрикса на стадии ремоделирования.
3. Закрытие раны
На 7–10 день после ампутации происходит эпителизация поврежденного участка, что связано с ростом количества кератиноцитов. При этом продолжают работу иммунные клетки: макрофаги и нейтрофилы синтезируют активные формы кислорода, чтобы нейтрализовать инородные микроорганизмы и подвергнуть фагоцитозу поврежденную ткань [9]. Макрофаги — важный источник как воспалительных, так и противовоспалительных сигналов, поступающих в поврежденную область после травмы, где они участвуют в обмене компонентов внеклеточного матрикса, очищают ткани от инородных частиц и подвергают фагоцитозу апоптотические клетки (останки клеток после программируемой гибели). Эти процессы опосредованы специальными белками, контролирующими рост клеток — цитокинами. Благодаря провоспалительным цитокинам, которые запускают механизм специфического иммунитета и действуют через свои рецепторы на клетки мишени на ранней стадии воспаления (интерлейкины IL-1, IL-6, IL-8; фактор некроза опухоли-α TNF-α), фибробласты выделяют факторы роста кератиноцитов KGF-1, KGF-2, сигнализирующие кератиноцитам мигрировать и пролиферировать. Также клетками иммунной системы синтезируются хемокины (семейство цитокинов), необходимые для миграции фибробластов, а впоследствии и противовоспалительные цитокины (IL-4, IL-10, трансформирующий фактор роста TGF-β), которые ослабляют воспаление и стимулируют ангиогенез [12]. К примеру, сигнальная молекула TGF-β подавляет пролиферацию кератиноцитов, что способствует регенеративным процессам благодаря замедлению рубцевания. А у мышей с мутациями, нарушающими синтез TGF-β, наблюдалось более быстрое заживление ран и рубцевание. Поэтому неудивительно, что в исследованиях на мышах недостаток макрофагов и нейтрофилов или нарушение их регуляции после ампутации приводит к неполному восстановлению мышц и образованию рубцов [13].
Таким образом, уменьшение количества иммунных клеток вызывает снижение миграции фибробластов и кератиноцитов, так как снижается концентрация сигнализирующих белков. Однако и нормальное содержание макрофагов и нейтрофилов приводит к воспалению, а затем к образованию рубцовой ткани, что преимущественно и наблюдается у млекопитающих. Поэтому нельзя однозначно ответить, положительно или отрицательно клетки иммунной системы влияют на процессы регенерации. Стоит помнить, что иммунная система примитивных животных и низших позвоночных не так сложна, как у высших, что также может объяснять их лучшую способность к регенерации. Примечательно, что в ряде исследований, мутантные модели мышей, испытывающие дефицит макрофагов и нейтрофилов, все еще были способны заживлять небольшие раны без образования рубцовой ткани [13].
4. Образование бластемы
После заживления раны на 10–14 день после ампутации организму необходимо накопить достаточное число стволовых клеток для формирования бластемы. Обычно полученных на стадии гистолиза стволовых клеток взрослому организму бывает недостаточно, так как регенерация сложных структур конечности требует большого количества клеток-предшественников. Решение данной проблемы — дедифференцировка и трансдифференцировка уже детерминированных клеток соседних тканей. При этом анамнии справляются с дефицитом стволовых клеток путем свободного формирования клеток-предшественников из дифференцированных клеток в бластеме, а у амниот дедифференцировка совмещена с трансдифференцировкой [1]. Переход к более недифференцированному состоянию или смена клеткой своей специализации сопровождается реорганизацией цитоскелета (клеточного каркаса), перегруппировкой клеток, изменением взаимодействия между молекулами клеточной адгезии (преимущественно кадгерином и интегрином).
- Кадгерины и интегрины
- кальций-зависимые и кальций-независимые соединения соответственно, которые управляют перемещениями клеток, взаимодействуют с элементами внеклеточного матрикса и контролируют избирательное связывание клеток друг с другом в пункте назначения.
Синтез цитокинов, факторов роста, сигнальных молекул и молекул клеточной адгезии, от которых зависит потеря или смена клеточной специализации и пролиферация клеток в бластеме, коррелирует с кислородным голоданием — гипоксией. Если обратить внимание на хронологическую последовательность регенерации конечности у мыши, то можно заметить, что гипоксия наблюдается как раз к 12-му дню после ампутации конечности (рис.  [5].
[5].

Рисунок 8. Кислород на месте ампутированной конечности. На кончике пальца мыши после ампутации можно заметить области гипоксии (A–H; красный цвет) и нормальной концентрации кислорода (A’-H’; зеленый цвет). Примечательно, в первые 7 дней после ампутации (DPA — days post-amputation) концентрация кислорода была по большей части повышена в тканях пальца, что связано с беспрепятственным проникновением кислорода через незакрытую эпидермисом рану, однако после ее закрытия можно наблюдать обширные области сниженной концентрации кислорода в тканях, что впоследствии приводит к формированию бластемы на 12-й день после ампутации (F, J, L).
На основе работ по изучению гипоксии во время регенерации можно предположить, что кислородное голодание является своеобразным стимулятором регенеративных процессов на стадии формирования бластемы. Однако как клеткам, которым обычно необходим кислород для нормального функционирования, приспособиться к таким непростым условиям? В это время в них синтезируются молекулы, призванные поддерживать их жизнеспособность — фактор, индуцируемый гипоксией, или HIF-1α [14]. Он побуждает клетки синтезировать те гены, которые адаптируют метаболизм под условия недостатка кислорода и участвуют в пролиферации и выживаемости клеток. Однако работа HIF-1α на данном этапе не закончена. Впоследствии он будет необходим уже для восстановления сосудистой сети.
Клетки бластемы обладают сложным генетическим профилем. Какие же гены отвечают за перепрограммирование зрелых клеток в стволовые? Общий фон экспрессии генов бластемы схож с таковым у эмбриональных стволовых клеток уже после формирования зародышевых листков. Кажется, многие слышали о возможности превратить окончательно дифференцированные клетки в стволовые, которые называются индуцированными плюрипотентными стволовыми клетками: ученые Джон Гардон и Шинья Яманака на опыте продемонстрировали, как вектор из четырех генов (Myc, Oct3/4, Sox2 и Klf4; данный список продолжает пополняться), внедренный в клетки, может обратить вспять биологические часы [15]. По сути, такие же гены активны в стволовых клетках бластемы.
К сожалению, было доказано, что клетки бластемы находятся не в плюрипотентном состоянии даже у анамний. Только четыре из шести ключевых генов транскрипционных факторов (Klf4, Sox2, Lin28, c‐Myc; без Nanog и Oct4), используемых для перепрограммирования взрослых специализированных клеток, активно экспрессируются [16]. Именно поэтому стволовые клетки бластемы относят к мультипотентным — клеткам, которые могут дифференцироваться только в клетки определенного типа ткани. Наряду с обязательными генами в общий профиль бластемы может входить до 50 генов, в разной степени вовлеченных в процесс формирования и поддержания бластемы. Однако необходимо еще распределить такое разнообразие клеток в пространстве для последующих дифференцировки и ремоделирования.
Для этого существуют так называемые направляющие воздействия. Активность небольшой группы соединений координирует миграцию большой популяции клеток, не только стволовых. Среди них помимо градиента кислорода важное место занимает комплекс из сигнальной молекулы и рецептора SDF1/CXCR4 [17]. Во время регенерации сигнальные молекулы SDF1 синтезируются преимущественно в фибробластах, которые, как говорилось ранее, необходимы для организации внеклеточного матрикса в бластеме. SDF1/CXCR4 примечателен тем, что его синтез повышается в ответ на повышение концентрации HIF-1α и механические повреждения, что приводит к усиленной миграции стволовых клеток посредством хемотаксиса в область ампутации (рис. 9) [14], [17]. Таким образом, к концу стадии образования бластемы у организма уже есть резерв стволовых клеток и место для их дислокации для последующей дифференцировки.

Рисунок 9. Миграция стволовых клеток по градиенту сигнальных молекул (например, факторов роста и хемокинов), которые высвобождаются тканью в ответ на повреждение. Стволовые клетки мобилизуются из костной ткани и мигрируют по кровеносным сосудам (а) или непосредственно по внеклеточному матриксу (б) с помощью белков клеточной адгезии, достигая места повреждения.
5. Дифференцировка
После образования бластемы необходимо направить дифференцировку стволовых клеток в нужное русло для последующего ремоделирования поврежденной конечности. У каждой более специализированной группы клеток активны определенные гены, которые кодируют сигнальные молекулы, молекулы клеточной адгезии, структурные белки и другие соединения. Чтобы восстановить ткань, нужно направить стволовые клетки по пути переспециализации, которая, в свою очередь, достигается за счет смены экспрессируемых генов.
Рассмотрим в качестве примера активацию сателлитных стволовых клеток — предшественников миоцитов. Направление миогенной дифференцировки осуществляется при помощи различных факторов роста, к которым относятся фактор роста гепатоцитов (HGF), фактор роста фибробластов (FGF), трансформирующий фактор роста β (TGF-β). Взаимодействуя со своими рецепторами, они активируют внутриклеточные сигнальные пути, что приводит к экспрессии специфических миогенных регуляторов. Среди них можно выделить белки и их семейства — Pax (Pax3, Pax7), MyoD, Myf5, MRF4, миогенин [18]. Они заставляют клетки дифференцироваться и производить специфические для мышц актин и миозин, цитоскелетные, метаболические и мембранные белки, характерные именно для мышечной клетки. При регенерации происходит активация не всех регуляторов сразу, процесс последователен: сначала в клетках-предшественниках активен белок Pax7, затем начинает синтезироваться MyoD, потом Myf5 и MRF4, а миогенин вырабатывается позднее, одновременно с началом производства тяжелых цепей миозина (рис. 10). При этом порядок их синтеза отличается от картины, характерной для миогенеза в ходе эмбрионального развития.

Рисунок 10. При пролиферации и самообновлении сателлитных клеток повышена выработка Pax7, затем под воздействием внешних стимулов происходит постепенная дифференцировка, за которую отвечает регулятор MyoD, в конце дифференцировки к общему фону экспрессии подключается ген транскрипционного фактора миогенина, который стимулирует синтез основных сократительных белков мышц (актин и миозин) и белков клеточной адгезии.
Особенное место при восстановлении конечности занимает дифференцировка клеток соединительной ткани. В основе этого процесса лежит активность преобладающих в бластеме фибробластов. В плане регенерации фибробласты являются уникальной группой клеток: после повреждения они мигрируют по градиенту сигнальных молекул, помогая восстанавливать как внеклеточный матрикс, так и почти все клетки соединительной ткани — костные клетки (остеобласты, остеоциты), хрящевые клетки (хондроциты), жировые клетки (адипоциты) и клетки гладких мышц (входят в состав сосудов) [19], [20]. Фибробласты в разных частях организма могут сильно отличаться друг от друга, даже в одной конечности между ними есть различия. Так, «зрелые» фибробласты, почти дифференцированные клетки с меньшей способностью к преобразованиям, могут существовать рядом с «незрелыми» фибробластами (часто называемыми мезенхимальными стволовыми клетками), которые способны развиваться в любой тип клеток соединительной ткани (рис. 11).

Рисунок 11. Универсальные фибробласты. Стрелками показаны взаимные превращения, происходящие между представителями семейства соединительной ткани.
[19], рисунок адаптирован
Поэтому грань между стволовыми клетками и фибробластами может быть довольно тонкой. Механизм этих взаимных превращений изучен не до конца, но можно выделить несколько наиболее важных участников сигнальных путей фибробластов: костные морфогенетические белки (BMP) и трансформирующий фактор роста β (TGF-β) [21]. Они регулируют рост, дифференцировку клеток соединительной ткани, а также контролируют синтез внеклеточного матрикса.
Параллельно с процессами дифференцировки происходит развитие сосудистой сети. Под влиянием ряда факторов роста — фибробластов (FGF), тромбоцитарного (PDGF), эпидермального (EGF), трансформирующего (TGF-β), фактора некроза опухоли-альфа (TNF-α), IL-6, IL-1 — происходит повышение уровня синтеза фактора роста эндотелия сосудов (VEGF). Он же является мощным стимулятором эндотелиоцитов, выстилающих кровеносные сосуды [13], [22]. VEGF связывается с рецепторами на поверхности эндотелиоцитов, побуждая их разрастаться и проникать в испытывающую кислородное голодание ткань после образование бластемы, чтобы обеспечить ее новыми кровеносными сосудами. Чтобы эндотелиальные клетки бесконтрольно не разрастались, они взаимодействуют между собой и с краевыми клетками для своевременной приостановки ангиогенеза. Таким образом, если запустить нужную комбинацию работы генов, можно преобразовать стволовые клетки в определенный тип дифференцированных клеток.
Наиболее простой способ — обратиться к внешним стимулам, которые в норме поступают от соседних клеток. Общая схема дифференцировки основана на том, что сигнальные белки от окружающих бластему клеток направляют развитие группы клеток по определенному пути. Можно выделить шесть групп сигнальных путей, необходимых как для самообновления стволовых клеток в бластеме, так и для их дифференцировки: FGF, TGFβ, BMP, Hedgehog (Hh), Notch, Wnt. Все ранее упомянутые молекулы в той или иной степени являются их участниками. Пути могут пересекаться и иметь общие сигнальные молекулы (рис. 12).

Рисунок 12. Общая схема и перекрестное взаимодействие некоторых сигнальных путей. Их активация связана со сложным каскадом взаимодействий между комплексами белков и ДНК, что в итоге приводит к синтезу белков, необходимых для регенерации поврежденных тканей.
Наиболее изученными в плане регенерации являются белки семейства Wnt. Они способны активировать Wnt/β-катениноный путь (канонический Wnt-путь), который основан на протеолизе (расщеплении) β-катенина — белка-регулятора генов, что приводит к окончательному определению судьбы клеток и морфогенезу; и неканонические (β-катенин-независимые) пути, которые регулируют реорганизацию цитоскелета и метаболизм кальция в клетках [23]. При этом дифференцировка клеток не обязательно должна быть однородной.
Существует механизм, обусловливающий чередование обычных эпидермальных клеток с сенсорными. За него преимущественно отвечает путь Notch. В основе лежит связывание сигнального белка Delta с рецептором Notch. Этот путь направляет сигнал клеткам вблизи предшественника сенсорной клетки не становиться на такой же путь дифференцировки. В результате они становятся эпидермальными.

Рисунок 13. а — Механизм конкурентного ингибирования соседствующих клеток. Сначала все клетки в группе эквивалентны и синтезируют и трансмембранный рецептор Notch, и его сигнальную молекулу Delta, что препятствует специализации (серый цвет клеток). Когда одна из клеток дифференцируется (оранжевый цвет клеток), она пытается предотвратить дифференцировку в том же направлении соседних клеток за счет более сильной выработки Delta (у неспециализированной клетки производство Delta подавляется). б — Исход того же процесса в более многочисленной группе клеток. Выигрывающая клетка по мере того, как становится все более и более дифференцированной, тормозит своих соседей все сильнее.
[35], рисунок адаптирован
Таким образом, результатом активации или ингибирования перечисленных сигнальных путей является изменение транскрипции ДНК в отвечающей на сигнал клетке. Одни гены включаются, а другие выключаются. Разные сигнальные молекулы (факторы роста, гормоны, цитокины) активируют разные виды регулирующих гены белков, поэтому одни и те же клетки по-разному реагируют на один и тот же сигнал, посылаемый в разное время, а клетки разного типа по-разному реагируют на одинаковый сигнал. При этом молекулы сигнальных путей образуют группу сигнальных молекул — морфогенов, изменение концентрации которых приводит к изменению градиента концентрации сигнала, что побуждает клетки ступать на различные пути развития (высокая концентрация — один путь развития, низкая концентрация — другой). Когда клетка делает свой окончательный выбор в дифференцировке, она обязуется следовать сложной программе, предполагающей экспрессию строго определенного набора генов. В конечном счете это приводит к ремоделированию конечности, где каждая специализированная клетка занимает свое место.

Рисунок 14. Иногда выбор пути клеточной специализации навевает воспоминания о дорожном камне из русских былин
рисунок Анастасии Кисловой
6. Ремоделирование
Вместе с процессами дифференцировки происходит ремоделирование — восстановление исходного размера и формы конечности. Эти процессы могут быть растянуты во времени и занимать от 14 до 40 дней после ампутации. Необходимо учесть факт, что к концу дифференцировки каждая клетка обладает своей пространственной ориентацией благодаря молекулам клеточной адгезии и запоминает положение по биохимическим реакциям соседей — возникает подобие позиционной памяти. Передние и задние конечности обладают одним и тем же набором дифференцированных тканей (кости, кожа, мышцы). Однако именно различие в пространственном положении тканей друг относительно друга отличает руку от ноги. И клеточная память хранит информацию об этом. Если перенести элемент бластемы с дистальной (дальше от туловища) части конечности к более проксимально (ближе к туловищу) расположенной бластеме той же конечности, то клетки будут формировать нормальную конечность [16]. Если же взять часть клеток бластемы, которая в норме должна образовывать заднюю конечность, и интегрировать в область бластемы передних конечностей, то нас ждет весьма интересный результат: из-за позиционной памяти часть клеток передних конечностей будет содержать морфологические признаки задних конечностей (рис. 15).

Рисунок 15. Такие маленькие мелочи, как происхождение бластемы, могут иметь большое значение
рисунок Анастасии Кисловой
Как происходит регуляция положения клеток, приводящая к формированию нужной? Она осуществляется с помощью так называемых гомеозисных генов (консервативных генов, отвечающих за регуляцию развития и формирование органов и тканей). Различают несколько комплексов гомеозисных генов, которые объединены в кластеры на нескольких хромосомах. Общее число таких генов в течение эволюции достигло 48 у млекопитающих. При этом к наиболее важным семействам генов относится Hox-группа, которая участвует в определении формы конечностей и экспрессируется неоднородно в проксимальном и дистальном положениях в бластеме. Так, в конечности позвоночных гены из пары комплексов Hох (НохА и НоxD) экспрессируются в виде регулярной системы, подчиняющейся обычным правилам последовательной экспрессии генов в этих комплексах (всего их четыре: НохА, HoxB, HoxC и НоxD). Они помогают в сочетании с другими факторами регулировать различия в поведения клеток по проксимально-дистальной оси конечности. В результате клетка запоминает свой «адрес» по оси конечности в пределах своего сегмента [24].
Но не все регуляторы относятся к группе гомеозисных белков. Например, группа морфогенов — Wnt, Bmp, Sox9 [25]. Это трио лежит в основе реакционно-диффузионный механизма, открытого Аланом Тьюрингом в 1979 году. Благодаря взаимной активации и ингибированию при участии описанных выше факторов роста и гомеозисных белков происходит формирование в бластеме градиентного сигнала и паттерна из полос Sox9, в результате чего образуется необходимое число и приобретается правильная форма пальцев [26]. При этом любое нарушение одного из компонентов может нарушить нормальное строение конечности.
Нервная иннервация и бластема — «два сапога пара»
Следует учитывать, что на всех этапах регенерации, особенно на ранних стадиях, важную роль играет нервная иннервация места повреждения, которая является своеобразным связующим звеном в процессах регенерации. Можно сказать, что нейроны способствуют миграции и создают дополнительный стимул к дифференцировке стволовых клеток [9]. Еще в 2003 году было доказано, что факторы роста, среди которых можно выделить нейротрофический фактор мозга (BDNF) и глиальный нейротрофический фактор (GDNF), необходимые для нормального развития бластемы и дополнительного привлечения нервов к месту ампутации, образуются как раз при взаимодействии микроокружения бластемы с нервами [27]. К примеру, ампутированные конечности тритона без иннервации не регенерируют, а раны просто зарубцовываются. Даже была сформулирована нейротрофическая теория Маркуса Сингера на основе его работ 1942–1978 годов, согласно которой существует некий порог числа нервных волокон для успешного формирования бластемы в зависимости от места повреждения. Причем тип нервных волокон (чувствительные или двигательные), согласно ей, не влияет существенно на ход регенерации. Результаты исследований, проведенных на тритонах, подтверждают, что чем больше площадь поперечного сечения у конечности, тем большее число нервных волокон необходимо для регенерации (количество нервных волокон на единицу площади при этом оставалось постоянным) [28]. Эта теория работает и на млекопитающих, хотя роль иннервации в регенерации у них изучена не до конца: у мышей при удалении нервов задней конечности в области кончиков пальцев наблюдалось утолщение кожи и нарушение роста костей, однако стволовые клетки все же не утрачивали способность к дифференцировке [29].
«Через неделю пациент пришел со старым отрубленным пальцем в сумке и новым на руке» — Каковы реальные возможности регенеративной медицины настоящего и будущего?
Мы постарались объяснить процессы, за счет которых происходит регенерация конечностей, но пока оставили без должного внимания самый важный вопрос — до какой степени возможна регенерация? Анамнии способны отращивать всю конечность заново, но у амниот все иначе. По названию статьи и примерам, приведенным по ходу, читатель уже мог догадаться, что у амниот, особенно у млекопитающих, регенерация возможна не для плеча, не для предплечья, даже не для кисти, а только лишь для фаланг пальцев (и то не всех)! В исследовании на мышах ученые ампутировали различные фаланги пальцев, а затем наблюдали за формированием бластемы. На 10-й день после ампутации образование бластемы на уровне второй фаланги наблюдалось лишь в некоторых случаях. При этом даже попытка приживления бластемы из первой фаланги ко второй не увенчалась успехом (наблюдалось менее 10% случаев успешного формирования бластемы) [30]. На успех регенерации может влиять ногтевая пластина, вокруг которой обнаружено скопление стволовых клеток, способных влиять на другие мультипотентные стволовые клетки. После ампутации кончика пальца в пределах ногтевой пластины стволовые клетки за счет активности уже известных генов группы Bmp и Wnt и перечисленных ранее в статье цитокинов, факторов роста, транскрипционных факторов и молекул клеточной адгезии оказались способны восстановить утраченный кончик пальца. Мыши после ампутации выше ногтевой пластины в пределах второй фаланги были почти лишены способности к регенерации [31].

Рисунок 16. Когда регенерация невозможна. Если произвести срез в пределах первой фаланги (правый путь), то регенерация утраченной части конечности возможна. Если же ампутация произошла дальше, в пределах второй фаланги (левый путь), то образуется преимущественно фиброзная ткань.
У людей наблюдается похожая картина: пострадавший после несчастного случая может регенерировать первую фалангу пальца, на которой осталась нетронутая ногтевая пластина. Может ли врач поспособствовать более эффективному процессу регенерации? В силу сложности хирургической работы с мелкими сосудами проводить операции по реплантации нецелесообразно. Лучший вариант — наложить окклюзионную повязку на место ампутации, тем самым предотвращая возможное заражение и предоставить организму самому справиться с проблемой, как это было ранее упомянуто в исследовании с медицинским клеем.
В журнале International Journal of Molecular Sciences ученые впервые описывают изменения, происходившие на раневой поверхности в течение недели после ампутации у людей. Выяснилось, что в экссудате, полученном с окклюзионных повязок, была повышена концентрация упомянутых ранее факторов роста — VEGF, EGF, FGF, BDNF, — а также воспалительных цитокинов на первой неделе после ампутации. На второй — противовоспалительных цитокинов [32]. При этом неясной оставалась роль иммунитета, результаты действия которого связывали с образованием фиброзной ткани. Успешная регенерация в основном наблюдалась у детей. Примечательно, что после регенерации отпечаток пальца не восстанавливался. Тем не менее в интернете можно найти немало сопровождающихся фотографиями рассказов о случаях успешной регенерации у взрослых. Вот еще один повод беречь свои ногти!

Рисунок 17. Клинический случай регенерации: а — перед наложением окклюзионной повязки; б — через три месяца после травмы. Регенерированные пальцы по морфологическим и функциональным характеристикам аналогичны пальцам на другой руке.
Может показаться, что в регенерации кончиков пальцев нет ничего важного. Слишком уж мелки они, что в физических размерах, что в значимости для организма по сравнению с другими органами. Однако ее изучение впоследствии позволит расширить знания о созревании стволовых клеток, и в будущем станет возможным спроецировать модель восстановления кончиков пальцев на более сложные структуры. Надеемся, развитие технологий регенеративной медицины позволит создать будущее, в котором протезы уже не будут нужны.
- Elizabeth R. Zielins, Ryan C. Ransom, Tripp E. Leavitt, Michael T. Longaker, Derrick C. Wan. (2016). The role of stem cells in limb regeneration. Organogenesis. 12, 16-27;
- Лаборатория молекулярных основ эмбриогенеза: от гена к признаку;
- Туберкулез: роковая история коварной болезни;
- Jennifer Simkin, Mimi C. Sammarco, Lindsay A. Dawson, Catherine Tucker, Louis J. Taylor, et. al.. (2015). Epidermal closure regulates histolysis during mammalian (Mus) digit regeneration. Regeneration. 2, 106-119;
- Mimi C Sammarco, Jennifer Simkin, Danielle Fassler, Alex J Cammack, Aaron Wilson, et. al.. (2014). Endogenous Bone Regeneration Is Dependent Upon a Dynamic Oxygen Event. J Bone Miner Res. 29, 2336-2345;
- Как работает свертывание крови?;
- Последний путь тромбоцита;
- Что такое внеклеточный матрикс и почему его все изучают;
- Yohan Choi, Fanwei Meng, Charles S. Cox, Kevin P. Lally, Johnny Huard, Yong Li. (2017). Regeneration and Regrowth Potentials of Digit Tips in Amphibians and Mammals. International Journal of Cell Biology. 2017, 1-13;
- Sarah Calve, Shannon J. Odelberg, Hans-Georg Simon. (2010). A transitional extracellular matrix instructs cell behavior during muscle regeneration. Developmental Biology. 344, 259-271;
- Bellayr I., Holden K., Mu X., Pan H., Li Y. (2013). Matrix metalloproteinase inhibition negatively affects muscle stem cell behavior. Int. J. Clin. Exp. Pathol. 2, 124–141;
- James W. Godwin, Alexander R. Pinto, Nadia A. Rosenthal. (2013). Macrophages are required for adult salamander limb regeneration. Proc Natl Acad Sci USA. 110, 9415-9420;
- Jennifer Simkin, Mimi C. Sammarco, Lindsay A. Dawson, Paula P. Schanes, Ling Yu, Ken Muneoka. (2015). The mammalian blastema: regeneration at our fingertips. Regeneration. 2, 93-105;
- Lizhen Liu, Qin Yu, Jie Lin, Xiaoyu Lai, Weijie Cao, et. al.. (2011). Hypoxia-Inducible Factor-1α Is Essential for Hypoxia-Induced Mesenchymal Stem Cell Mobilization into the Peripheral Blood. Stem Cells and Development. 20, 1961-1971;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- David L. Stocum. (2017). Mechanisms of urodele limb regeneration. Regeneration. 4, 159-200;
- Xuan Li, Xiao-Tao He, Yuan Yin, Rui-Xin Wu, Bei-Min Tian, Fa-Ming Chen. (2017). Administration of signalling molecules dictates stem cell homing forin situregeneration. J. Cell. Mol. Med.. 21, 3162-3177;
- Hugo C. Olguín, Addolorata Pisconti. (2012). Marking the tempo for myogenesis: Pax7 and the regulation of muscle stem cell fate decisions. J. Cell. Mol. Med.. 16, 1013-1025;
- Fibroblasts and their transformations: the connective-tissue cell family. In: Molecular Biology of the Cell (4th Edition) / ed. by Alberts B., Johnson A., Lewis J., Raff M., Roberts K., Walter P. NY: Garland Science, 2002. — 712 p.;
- Такие разные стволовые клетки;
- Mengrui Wu, Guiqian Chen, Yi-Ping Li. (2016). TGF-β and BMP signaling in osteoblast, skeletal development, and bone formation, homeostasis and disease. Bone Res. 4;
- Ling Yu, Mingquan Yan, Jennifer Simkin, Paulina D. Ketcham, Eric Leininger, et. al.. (2014). Angiogenesis is inhibitory for mammalian digit regeneration. Regeneration. 1, 33-46;
- Важнейшие стрелочники клеток организма: белки Wnt;
- Гены, от которых вырастают крылья. И ноги. И всё остальное;
- Ashley W. Seifert, Ken Muneoka. (2018). The blastema and epimorphic regeneration in mammals. Developmental Biology. 433, 190-199;
- Дай пять: как математика управляет развитием пальцев;
- J Boyd. (2003). Glial cell line-derived neurotrophic factor and brain-derived neurotrophic factor sustain the axonal regeneration of chronically axotomized motoneurons in vivo. Experimental Neurology. 183, 610-619;
- Marcus Singer. (1947). The nervous system and regeneration of the forelimb of adult triturus. VII. The relation between number of nerve fibers and surface area of amputation. J. Exp. Zool.. 104, 251-265;
- Yuval Rinkevich, Daniel T. Montoro, Ethan Muhonen, Graham G. Walmsley, David Lo, et. al.. (2014). Clonal analysis reveals nerve-dependent and independent roles on mammalian hind limb tissue maintenance and regeneration. Proc Natl Acad Sci USA. 111, 9846-9851;
- Yuanyuan Wu, Karen Wang, Adrine Karapetyan, Warnakulusuriya Akash Fernando, Jennifer Simkin, et. al.. (2013). Connective Tissue Fibroblast Properties Are Position-Dependent during Mouse Digit Tip Regeneration. PLoS ONE. 8, e54764;
- Makoto Takeo, Wei Chin Chou, Qi Sun, Wendy Lee, Piul Rabbani, et. al.. (2013). Wnt activation in nail epithelium couples nail growth to digit regeneration. Nature. 499, 228-232;
- Paris Jafari, Camillo Muller, Anthony Grognuz, Lee Applegate, Wassim Raffoul, et. al.. (2017). First Insights into Human Fingertip Regeneration by Echo-Doppler Imaging and Wound Microenvironment Assessment. IJMS. 18, 1054;
- Гончарук С. (2018). Ras-dva и готово. ИБХ РАН;
- Lina M. Quijano, Kristen M. Lynch, Christopher H. Allan, Stephen F. Badylak, Tabassum Ahsan. (2016). Looking Ahead to Engineering Epimorphic Regeneration of a Human Digit or Limb. Tissue Engineering Part B: Reviews. 22, 251-262;
- Альбертс Б., Джонсон А., Льюис Д. и др. Молекулярная биология клетки: в 3-х томах. М.: «Мир», 1994. — 1560 с..
